Спосіб одержання гетерологічного секретованого білка з клітин яєчника китайського хом’ячка, що вирощуються на мікроносіях
Формула / Реферат
1. Спосіб одержання гетерологічного секретованого білка з клітин СНО, що вирощуються на мікроносіях, що передбачає стадії:
інокуляції клітинного біореактора, що містить мікроносії як тверду підкладку для росту прикріплених клітин і безсироваткове середовище для культивування клітин, доповнене мікроелементами, інокулятом клітин-хазяїнів СНО, трансформованих для експресії гетерологічного секретованого білка, де інокулят одержують шляхом вирощування трансформованих клітин-хазяїнів СНО в клітинному культуральному середовищі, що містить сироватку;
культивування інокульованих клітин-хазяїнів СНО в культурі прикріплених клітин без перфузії середовища для культури клітин;
ініціації живлення безсироваткового середовища для культури клітин, доповненого інсуліном, цитратом заліза (III), селеном і мікроелементами, в клітинний біореактор шляхом безперервної перфузії;
збільшення швидкості живильного потоку безсироваткового середовища для культури клітин, доповненого мікроелементами, в стадіях протягом приблизно шести-десятиденного періоду, поки не буде досягнута кінцева швидкість живильного потоку в діапазоні приблизно 1-3,5 об./об./день, для одержання і секреції гетерологічного білка з клітин-хазяї СНО в безсироваткове середовище для культури клітин; і
культивування клітин-хазяїв СНО в культурі прикріплених клітин при кінцевій швидкості живильного потоку.
2. Спосіб за п. 1, який відрізняється тим, що інокульовані клітини-хазяїни у вказаній стадії культивування інокульованих клітин-хазяїнів СНО культивують в культурі прикріплених клітин на мікроносіях протягом періоду в межах приблизно одного-трьох днів.
3. Спосіб за п. 2, який відрізняється тим, що вказаний період складає приблизно 2 дні.
4. Спосіб за п. 1, який відрізняється тим, що стадія ініціації живлення починається з живлення при швидкості потоку в діапазоні приблизно 0,1-0,4 об./об./день безсироваткового середовища для культури клітин, доповненого інсуліном, цитратом заліза (III), селеном і мікроелементами.
5. Спосіб за п. 4, який відрізняється тим, що живлення починають при швидкості живильного потоку в діапазоні приблизно 0,2-0,3 об./об./день.
6. Спосіб за п. 4, який відрізняється тим, що живлення починають при швидкості живильного потоку приблизно 0,2 об./об./день.
7. Спосіб за п. 1, який відрізняється тим, що швидкість живильного потоку збільшують від стадії до стадії протягом приблизно семи-дев’ятиденного періоду.
8. Спосіб за п. 1, який відрізняється тим, що швидкість живильного потоку збільшують від стадії до стадії протягом приблизно восьмиденного періоду.
9. Спосіб за п. 1, який відрізняється тим, що кінцева швидкість живильного потоку знаходиться в діапазоні приблизно 1,5-2,5об./об./день.
10. Спосіб за п. 1, який відрізняється тим, що кінцева швидкість живильного потоку становить приблизно 2 об./об./день.
11. Спосіб за п. 1, який відрізняється тим, що додатково передбачає стадію вилучення гетерологічного білка з безсироваткового середовища для культури клітин.
12. Спосіб за п. 1, який відрізняється тим, що гетерологічний білок є розчинним рецептором інтерферону ![]() (sIFNAR2).
(sIFNAR2).
13. Спосіб за п. 1, який відрізняється тим, що мікроносії являють собою Cytopore 2.
14. Спосіб за п. 1, який відрізняється тим, що безсироватковим середовищем для культури клітин є DMEM/F12.
Текст
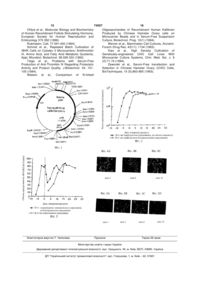
1. Спосіб одержання гетерологічного секретованого білка з клітин СНО, що вирощуються на мікроносіях, що передбачає стадії: інокуляції клітинного біореактора, що містить мікроносії як тверду підкладку для росту прикріплених клітин і безсироваткове середовище для культивування клітин, доповнене мікроелементами, інокулятом клітин-хазяїнів СНО, трансформованих для експресії гетерологічного секретованого білка, де інокулят одержують шляхом вирощування трансформованих клітин-хазяїнів СНО в клітинному культуральному середовищі, що містить сироватку; культивування інокульованих клітин-хазяїнів СНО в культурі прикріплених клітин без перфузії середовища для культури клітин; ініціації живлення безсироваткового середовища для культури клітин, доповненого інсуліном, цитратом заліза (III), селеном і мікроелементами, в клітинний біореактор шляхом безперервної перфузії; 2 (19) 1 3 74557 4 10. Спосіб за п.1, який відрізняється тим, що кін12. Спосіб за п.1, який відрізняється тим, що цева швидкість живильного потоку становить пригетерологічний білок є розчинним рецептором інблизно 2 об./об./день. терферону / (sIFNAR2). 11. Спосіб за п.1, який відрізняється тим, що до13. Спосіб за п.1, який відрізняється тим, що мікдатково передбачає стадію вилучення гетерологіроносії являють собою Cytopore 2. чного білка з безсироваткового середовища для 14. Спосіб за п.1, який відрізняється тим, що безкультури клітин. сироватковим середовищем для культури клітин є DMEM/F12. Даний винахід відноситься до способу одержання секретованого білка в культурі прикріплених клітин ссавця. Більшість промислових виробничим процесів, які використовують як клітини-хазяїни клітини яєчника китайського хом'ячка (СНО), застосовують клітинні лінії, адаптовані до зростання в суспензії, наприклад, t-PA [Werner et al., 1993 і Lubiniecki et al., 1994], для яких безсироваткові середовища були доступні протягом останніх 10 років [Gorfien et al., 1991]. Однак альтернативною стратегією для культури клітин СНО є підтримка зростання прикріплених до субстрату клітин, де клітини прикріпляються до матрикса, наприклад, до мікроносія [Kadouri, 1994]. Клітини СНО можуть рости успішно на таких носіях, і були розроблені промислові процеси, що використовують культури мікроносіїв СНО, наприклад, Pmeguna [Olijve et al., 1996]. Зростання прикріплених клітин СНО на мікроносіях звичайно виконують подачею сироватки в культуру, в формі фетальної телячої сироватки (ФТС) [Xiao et аl., 1994; Clark et fl., 1981; Nikolai et al., 1992; Asselbergs et al., 1982; Levin et al., 1992; Watson et al., 1994 і Ohlson et al., 1994]. Ця комплексна добавка до культурального середовища містить необхідні фактори прикріплення і зростання, необхідні для стимуляції прикріпленого фенотипу, наприклад, фібронектин, ламінін [Zaworski et al., 1993 і Nilsson, 1989]. Повідомлялося, що у відсутності сироватки деякі клітинні лінії не будуть рости на мікроносіях [Schmid et al., 1992] або що відсутність сироватки є шкідливим для утворення продукту [Teige et al., 1994]. Хоча безсироваткове прикріплене зростання клітин СНО досягалося з використанням базального середовища, доповненого інсуліном, трансферином і селеном [Gasser et al., 1985], це зростання одержували в умовах дуже пасивного середовища в Т-колбі, умовах середовища, які, як відомо, істотно відрізняються від умов середовища у разі прикріпленого зростання на мікроносіях в біореакторі [Cherry et al., 1985]. У промислових процесах на основі мікроносіїв клітини звичайно підживлюють (за допомогою безперервної перфузії) культуральним середовищем, доповненим сироваткою, поки ці клітини не заповнять доступну площу поверхні, що забезпечується мікроносієм (фаза зростання). Потім середовище, яке перфузується, перемикають на інше середовище, звичайно безсироваткове, оскільки клітини в цій точці не діляться і можуть задовольнятися існуючим позаклітинним матриксом для підтримки їх прикріплення. Саме під час цієї другої фази (фази утворення продукту) кондиціоновану фазу збирають для витягання і очищення рекомбінантного білка. Однак в такій двофазній системі перемикан ня від зростання до утворення продукту може призводити до драматичної клітинної відповіді, такої як втрата клітин і зменшена об'ємна продуктивність рекомбінантного білка [Cosgrove et al., 1995]. Альтернативно, може мати місце лаг-фаза, коли клітини реагують на це драматичне перемикання в середовищі, яке потім призводить до періоду низької продуктивності рекомбінантного білка, поки ці клітини не відновляться до нормального стану. Цитування тут будь-якого документа не є визнанням того, що такий документ є документом попереднього рівня техніки, що відноситься до даного питання або матеріалом, що враховується відносно патентоспроможності якого-небудь пункту формули винаходу даної заявки. Будь-яке твердження, наприклад, відносно змісту або дати будьякого документа засновується на інформації, доступній для заявника під час подання, і не є визнанням, наприклад, відносно коректності такого твердження. Метою даного винаходу є усунення проблем і труднощів, що зустрічаються в попередньому рівні техніки, що обговорювались вище. Даний винахід забезпечує спосіб одержання гетерологічного секретованого білка з трансформованих клітин СНО, що вирощуються на мікроносіях в безсироватковому середовищі для культури клітин. Цей спосіб має перевагу, що полягає в подоланні проблеми лаг-фази в утворенні продукту, що спостерігається при перемиканні від середовища, що містить сироватку, до без сироваткового оточення. На Фіг.1 показане схематичне представлення рецептора р40 IFN-α/β в pCMV.PA4. На Фіг.2 показане зростання клітин клону СНО 1-1-31 на мікроносіях Cytopore 2, які підживлюються або середовищем, що містить сироватку (режим №4 біореактора, підживлення середовищем DMEM/F12, доповненим 5% фетальною телячою сироваткою), або безсироватковим середовищем (режим №12 біореактора, підживлення середовищем DMEM/F12, доповненим IFCSTE). На Фіг.3 показана кінетика утворення розчинного рецептора інтерферону α/β (sIFNAR2) в двофазній системі, де має місце перемикання від середовища, що містить сироватку, до безсироваткового середовища, і в системі з єдиним поживним середовищем і без перемикання в середовищі. Експлуатацію (режим) №4 реактора проводили у вигляді двофазної системи з фазою зростання DMEM/F12, доповненого 5% ФТС, і перемиканням на фазу утворення продукту DMEM/F12, доповненого IFCSTE. Перемикання представлене вертикальною пунктирною лінією під час 0. В режимі експлуатації №12 біореактора ви 5 74557 6 користали єдине поживне середовище DMEM/F12, Утворення і секреція бажаного гетерологічного доповнене IFCSTE. секретованого білка підтримується, після того як Fla Фіг.4А-4С показані клітини СНО (клон 1-1досягається кінцева швидкість подачі середовища, 31), зростаючі на мікроносіях Cytopore 2 в день 4 за допомогою безперервної перфузії безсироват(Фіг.4А), день 6 (Фіг.4В) і день 10 (Фіг.4С) після кового культурального середовища, доповненого фідингу (підживлення) сироватковою композицією IFCSTE. Бажаний гетерологічний білок, продукоDMEM/F12, доповненого 5% ФТС. Життєздатні ваний і секретований у безсироваткове культураклітини, що зросли на мікроносії, забарвлюються льне середовище, може бути легко витягнутий і флуоресцентним барвником. Дні, вказані на очищений з використанням загальноприйнятих Фіг.4А-4С, є днями експлуатації реактора, тобто способів витягання і очищення, добре відомих фаднями після інокуляції біореактора, але не днями хівцям в даній області. утворення продукту. Таблиця 1 На Фіг.5A-5D показані клітини СНО (клон 1-131), зростаючі на мікроносіях Cytopore 2 в день 1 Робоча концентрація добавки IFCSTE в середовищі для (Фіг.5А), день 3 (Фіг.5В), день 6 (Фіг.5С) і день 10 культури клітин (Фіг.5D) після фідингу безсироватковою композицією DMEM/F12, доповненого IFCSTE. Життєздатні 1)Інсулін 1мг/л клітини, що зросли на мікроносії, забарвлюються 2) Цитрат заліза(lll) 12,24мг/л флуоресцентним барвником. Дні, вказані на 3) Натрій/селен 68мкг/л 16 Фіг.5A-5D, є днями експлуатації реактора, тобто 4) Мікроелементи А , 1000 (номер №99днями після інокуляції біореактора, але не днями 182 за каталогом Gibco BRL), розведені утворення продукту. 1:1000 для робочої концентрації в мікрограмах на літр Даний винахід заснований на розробці стратеCuSO4·5Н2О 1,60 гії безсироваткового фідингу (підживлення) для ZnSO4·7Н2О 863,00 вирощування клітин СНО на мікроносіях, яка дає Селеніт·2Na 17,30 можливість уникнути потреби в сироватці для стиЦитрат заліза(lll) 1155,10 муляції прикріпленого клітинного фенотипу. Ця 16 5) Мікроелементи В , 1000 (номер №99стратегія безсироваткового фідингу відповідно до 175 за каталогом Gibco BRL), розведені способу даного винаходу значно поліпшує витя1:1000 для робочої концентрації в мікроггання бажаного секретованого білкового продукту рамах на літр за допомогою елімінації лаг-фази, пов'язаної з MnSO4·Н2О 0,17 NaSiO4·9Н2О 140,00 видаленням сироватки, тобто перемиканням від Молібденова кислота сіль амонію 1,24 середовища, що містить сироватку (сироватковоNH4VO3 0,65 го), до безсироваткового середовища. NiSO4·6Н2О 0,13 Спосіб одержання гетерологічного секретоваSnCl2 (безводний) 0,12 ного білка з клітин СНО, що вирощуються на мік16 6) Мікроелементи С , 1000 (номер роносіях, відповідно до даного винаходу включає в №99-176 за каталогом Gibco BRL), розсебе інокуляцію клітинного біореактора, що місведені 1:1000 для робочої концентрації в тить мікроносії як тверду підкладку для зростання мікрограмах на літр прикріплених клітин, інокулятом живительних кліАlСl3·6Н2О 1,20 AgNO3 0,17 тин СНО, трансформованих для експресії гетероВа(С2Н3О2)2 2,55 логічного секретованого білка. Хоча це і не є абсоKВr 0,12 лютно необхідним, інокульовані клітини СоСl2 2,28 вирощують переважно без перфузії в сироваткоСоСl2·6Н2О 2,38 вому середовищі для культури клітин, такому як CrCl3 (безводний) 0,32 DMEM/F12, доповненому 5% фетальною телячою NaF 4,20 сироваткою (ФТС), протягом періоду приблизно GeO2 0,53 одного-трьох днів, переважно приблизно двох KL 0,17 RbCl 1,21 днів. Приблизно через два дні, тобто 48 годин, ці ZrOCl2·8H2O 3,22 клітини потім підживлюють шляхом перфузії безсироваткового середовища для культури клітин, Фахівцям в даній області буде зрозуміло, що яка є переважно середовищем DMEM/F12 [номер початкова швидкість потоку фідингу і період часу за каталогом 1330-032, Gibco BRL, Gaithersburg, для збільшення швидкості потоку фідингу від стаMD], доповненим IFCSTE (акроним для композиції дії до стадії до кінцевої швидкості потоку фідингу інсуліну, цитрату заліза(lll), селену і мікроелеменможе варіюватися в залежності від розміру інокутів, склад якої показаний в таблиці 1 нижче), при ляту. У переважному варіанті, інокулят приблизно початковій швидкості потоку фідингу в діапазоні 2 105клітин/мл використовують для біореактора на приблизно від 0,1 до 0,4 об'єм/об'єм/день 4,8 літри, і клітини культивують протягом приблиз(об./об./д.) перед збільшенням швидкості фідингу но двох днів перед перфузією з початковим фідинбезсироваткового середовища для культури клітин гом безсироваткового культурального середовища в стадіях протягом приблизно шестипри початковій швидкості потоку фідингу близько десятиденного періоду, переважно семи-дев'яти 0,2об./об./д. Швидкість потоку фідингу для безпеднів, поки не досягається швидкість подачі фідингу рервної перфузії культури прикріплених клітин в приблизно 1-3,5об/об/д для утворення і секреції переважному варіанті збільшують в день 3 приббажаного гетерологічного секретованого білка з лизно до 0,3об./об./д., в день 4 - приблизно до культури клітин СНО в культуральне середовище. 7 74557 8 0,5об./об./д., в день 5 - приблизно до 0,8об./об./д., лікаря Рубінштейна, використали як матрицю для в день 6 - приблизно до 1,2об./об./д., в день 7 ПЛР-ампліфікації. Пару ПЛР-праймерів викорисприблизно до 1,5об./об./д. поки кінцева швидкість тали для ампліфікації кДНК рецептора IFNα/β люпотоку 2,0об./об./д. не досягається в день 8. Як дини від стартового кодона АТС сигнального пепбуде зрозуміло фахівцям з кваліфікацією в даній тиду до стоп-кодона TAG. Сайт Xbal був області, що мають керівництво, забезпечене цим включений в обидва праймери. ПЛР проводили переважним варіантом даного винаходу, якщо при стандартних умовах протягом 25 циклів. Після розмір інокуляту є великим, то може бути потрібна очищення від гелю і розщеплення Xbal, ПЛРбільш висока початкова швидкість потоку фідингу, продукт в 730п.н лігували в розщеплений Xbal, і може бути потрібна відповідна зміна періоду часу оброблений СІР експресуючий вектор pCMV.PA4. для збільшення швидкості потоку. Кінцева швидРозщеплення Xbal і Ndel використали для скринінкість потоку фідингу може бути між 1 і 3,5об./об./д., гу МС1061-трансформантів. Клон 11 pCMV.PAале переважно вона складає близько 2об./об./д., hlFN α/β рецептор підтверджували розщепленням наприклад, знаходиться в діапазоні приблизно від рестриктазами і аналізом послідовності ДНК. У 1,5 до 2,5об./об./д. районі сигнального пептиду був виявлений феніХоча спосіб згідно з винаходом може бути звилаланін замість валіну в положенні амінокислоти чайно застосовний для утворення і секреції гете10, що відрізняється від опублікованої послідовнорологічних секретованих білків в клітинах СНО, де сті (Rubinstein, 1994). Та ж сама заміна була виявтермін "гетерологічний секретований білок" озналена д-ром Рубінштейном в його вихідній клонуючає секретований білок, що не є ендогенним для чій конструкції розчинної форми. клітин СНО, переважним варіантом, приведеним Трансфекція і відбір в клітинах СНО як приклад в прикладах, є розчинний рецептор Клітини CHO-DUKX котрансфікували конструінтерферону α/β (sIFNAR2). Розчинний IFNAR2 кцією hIFNα/βR-CMV.PA4 (50мкг) і конструкцією Dα людини є глікозильованим білком, який зв'язує як (10мкг) у співвідношенні 5:1 рутинним способом інтерферон а, так і інтерферон β, і його існування у СаРО4-преципітації. Експресуючий вектор Dα місвигляді розчинної форми рецептора IFNα/β надає тить ген дигідрофолатредуктази (DHFR), що роможливість використання цього рецептора терабить можливими відбір і ампліфікацію з викориспевтично як антагоніст IFN. танням лікарського засобу метотрексату (МТХ). Ця Твердою підкладкою, на якій вирощують приктрансфекція була названа IFNR1. Середовище ріплені клітини СНО, є переважно мікроносії для вирощування, що використовується до і відраCytopore 2 (Amersham Pharmacia Biotech, зу ж після трансфекції, складалось з середовища Piscataway, NJ), які с мікроносіями зі структуроваальфа-МЕМ (+) (з дезокси- і рибонуклеозидами ним матриксом з целюлози бавовнику, гідрофільGibco BRL), доповненого 10% сертифікованою нім покриттям ДЕАЕ, щільністю заряду 1,8мекв/г і фетальною телячою сироваткою (ФТС, Gibco BRL) середнім діаметром пор 30мкм. Однак інші відпоі 1% L-глутаміном (Gibco BRL). Через сорок вісім відні мікроносії, відомі в даній області для застосугодин після трансфекції кожну чашку промивали вання в культурі прикріплених клітин, можуть тазабуференим фосфатом сольовим розчином кож служити як альтернативна тверда підкладка (ЗФР), при pH7,0, і обробляли 2мл розчину 0,05% для прикріпленого зростання клітин СНО. трипсин - 0,53мМ ЕДТА (Gibco BRL) протягом чоПереважним безсироватковим середовищем тирьох хвилин при 37°С. Трипсин гасили додавандля культури клітин є DMEM/F12, доповнене ням 8мл селективного середовища, що складаєтьIFCSTE. ся з середовища альфа-МЕМ (-) (без дезокси- і Після опису даного винаходу в загальному вирибонуклеозидів, Gibco BRL), доповненого 10% гляді все описане буде більш легко зрозуміле з діалізованою фетальною телячою сироваткою посиланням на наступні приклади, які приведені як (дФТС, Gibco BRL), 1% L-глутаміном (Gibco BRL) і ілюстрація і не призначені для обмеження даного 0,02мкМ МТХ (Sigma). Дисоційовані клітини ресусвинаходу яким-небудь чином. пендували, розподіляли у відношенні 1:10 і висіваПриклад 1 ли в десять культуральних чашок Р100. У чашки Виділяли і характеризували клональні лінії кліподавали свіже селективне середовище кожні 3-4 тин СНО, що експресують рекомбінантний розчиндні. ний рецептор IFNα/β людини (IFNAR2). Два потенЗвичайно після 10-14 днів під час відбору ційних клони були відібрані для подальшої оцінки утворюються великі колонії. Потім чашки трипсинів дослідженні подвоєння стабільності на 100 попузували для перерозподілу цих клітин у вигляді ляціях. На основі рівнів експресії IFNAR2 і аналізу пулів, так, щоб могла утворитися багатошарова мРНК, з панелі клонів були вибрані наступні клони. культура без надмірного зростання локалізованих CHO-IFNAR1-1-50 мав найвищу питому продуктизон. Як тільки чашки досягали 80% конфлюентносвність з pcd 34,48. CHO-IFNAR.1-1-31 (клон СНО 1ті, їм подавали свіже селективне середовище. Че1-31) мав найвищу об'ємну продуктивність, ексрез двадцять чотири години брали пробу супернапресуючи 18,71мкг/мл в колбі Т75 протягом періотанту для аналізу експресії, клітини ду 24 год. Обидва клони виявляли єдиний основтрипсинізували і рахували за допомогою гемоциний тип мРНК при випробуванні за допомогою тометра. Два флакони, що містять 1-3 мільйони Нозерн-блот-аналізу. клітин, кріоконсервували в селективному середоСпособи вищі, що містить 10% диметилсульфоксид (ДМСО, Конструювання вектора Sigma), для кожного з десяти пулів. Проби в сереДНК плазміди pCEV9-QM27, що містить кДНК довищі зберігали при -20°С. розчинного рецептора IFNα/β людини, одержану у Ампліфікація клітин CHO-IFNR1 9 74557 10 Оскільки вектор Dα містив ген DHFR, можна IFNAR2 розводили 1:5000 в ЗФР/Т. 100мкл на ямку було спробувати ампліфікувати експресію клітин використали протягом однієї години при кімнатній CHO-IFNAR1. Після відбору при 0,02мкМ МТХ температурі. Планшети промивали три рази з витрансфіковані клітини ампліфікували в "пулах" користанням ЗФР/Т. відповідно до стандартної схеми ампліфікації Біотинільоване антикроляче антитіло (Вектор ВА-1000) розводили 1:10000 в ЗФР/Т. 100мкл на 0,1мкМ 0,5мкМ 1,0мкМ 5,0мкМ МТХ. Після ямку використали протягом однієї години при кімдвадцяти чотирьох годин експресії брали проби натній температурі. Планшети промивали три рази при рівні 0,02мкМ МТХ, інші клітини використали ЗФР/Т. для ампліфікації. На кожній стадії ампліфікації одABC-реагент (Vector ABC Elite kit) готували тану чашку Ρ100 для кожного пулу засівали при ким чином: 1 краплю реагенту А додавали до 10мл 7 105 клітин в середовищі альфа-МЕМ (-), доповЗФР/Т і змішували перевертанням. До цього доданеному 10% діалізованою фетальною телячою вали 1 краплю реагенту В і змішували переверсироваткою (дФТС, Gibco BRL), 1% L-глутаміном танням. Цю суміш інкубували як мінімум 30 хвилин (Gibco BRL) і відповідною концентрацією МТХ при кімнатній температурі, потім розводили до (Sigma). Клітини підтримували на кожній з послікінцевого об'єму не більше 50мл безпосередньо довних стадій ампліфікації щонайменше протягом перед використанням. 100мкл на ямку розведеносеми-десяти днів. го ABC давали інкубуватись тридцять хвилин при Визначення 24-годинної експресії, де рівні екскімнатній температурі. Планшети промивали три пресії розраховували на клітину, проводили на рази в ЗФР/Т. кожній стадії ампліфікації таким чином. Коли кліти100мкл на ямку субстрату пероксидази ТМВ ни досягали приблизно 70-80% конфлюентності, в Microwell (Kirkegaard & Perry Lab, Gaithersburg, чашки подавали свіже культуральне середовище MD) давали інкубуватись в темряві протягом п'яти (що містить відповідну концентрацію МТХ). Через хвилин, потім додавали 50мкл на ямку 0,3Μ сірчадвадцять чотири години брали проби супернатанної кислоти для зупинення розвитку забарвлення. тів, клітини трипсинізували і визначали загальне Планшети зчитували при 450 нм з використанчисло клітин. Після проведення визначень експреням пристрою для зчитування мікропланшет UV сії, на кожній стадії ампліфікации, 7 105 клітин виmax kinetic microplate reader з Molecular Devices. користали для засіву Ρ100 в середовищі, що місКлонування CHO-IFNRl-1 тить рівень МТХ для наступної стадії ампліфікації, З використанням IFNAR2-ELISA рівні SIFNAR2 а інші клітини кріоконсервували в середовищі, що людини, що детектуються, були виявлені тільки містить відповідну концентрацію лікарського засопри 0,5, 1,0 і 5,0мкМ МТХ для невеликої частини бу для даної стадії ампліфікації і 10% ДМСО. Всі пулів TFNR1. На основі цих результатів IFNR1-1 кількісні визначення IFNAR2 виконували з викорипри рівні 1мкМ був відібраний для клонування. станням ELISA для розчинного IFNAR2 людини. Один флакон пулу IFNR1-1 відтавали в колбу Т75, Протокол ELISA для розчинного рецептора що містить середовище з 1мкМ МТХ. Клітини паIFN людини сували в колби Т75 в DMEM/F12, що містить 5% Планшети Immulon IV з Dynatech покривали ФТС, і проводили клонування з використанням асцитами з моноклональним антитілом aнтилімітуючою розведення. П'ять 96-ямкових планшеIFNAR2 34.1, розведеними 1:5000 в 0,1% Твині 20 тів інокулювали 0,25, 0,5 і 1клітин/ямку. Клонуванв ЗФР, pH7,4 (ЗФР/Т) при 100мкл на ямку, протяня виконували у відсутності лікарського засобу. Всі гом 2 годин при 37°С. Планшети промивали двічі ямки обстежували під мікроскопом для гарантії ЗФР/Т. Всі промивки проводили при кімнатній темоднієї клітини на ямку Будь-які ямки, які містили пературі (RT) з використанням автоматичного асчисленні клітини, виключали. Опісля щонайменше піратора/промивача Ultrawash Plus з Dynatech. 11 днів вирощування колонії з 82 ямок переносили Планшети блокували протягом ночі при 4°С в 24-ямкові планшети. Як тільки клітини досягали 200мкл на ямку 1,0% БСА в ЗФР/Т. Планшети мо50-70% конфлюентності, визначали об'ємну прожуть зберігатися в холодному вигляді в блоках аж дуктивність з використанням IFNAR2-LL1SA. Тільдо семи днів. їх промивали три рази ЗФР/Т перед ки клони з високими рівнями експресії (~50% від подальшим використанням. всіх клонів) переносили в колби Т25, де проводили Стандарт і проби розводили в ЗФР/Т. Стандавизначення 24-годинної об'ємної експресії. Два ртом був афінно очищений рецептор rhIFN α/β, що флакони кожного клону кріоконсервували в зберігається при -20°С або відталий і що зберігаDMEM/F12, що містить 5% ФТС, 1% L-глутамін і ється при 0°С протягом періоду, що не перевищує 10% ДМСО. один тиждень. Цей рецептор був нестабільним при Підтвердження експресії клонів після відтанизьких концентраціях, так що його розбавляли до вання робочої концентрації безпосередньо перед викоОдин флакон кожної з п'ятнадцяти найвищих ристанням. Стандарт використали при 200, 100, експресій відтавали і використовували для іноку50, 25, 12,5 і 6,25нг/мл і при 100мкл на ямку, приляції колби Т25. Потім клітини ділили на дві колби чому кожну концентрацію використали в трьох Т75, де проводили 24-годинні експресії в двох поповторюваностях. Розведені проби також викорисвторюваностях, а додаткові десять флаконів кріотали при 100мкл на ямку в двох повторюваностях консервували. (або трьох повторюваностях, якщо дозволяв просНозерн-аналіз клонів тір на планшеті). Стандарти і проби інкубували Тотальну РНК виділяли безпосередньо з кліпротягом однієї години при кімнатній температурі. тин, що вирощуються в колбах Т-75, з використанПланшети промивали три рази в ЗФР/Т. ням реагенту TRlzol (Gibco BRL) згідно з процедуПоліклональну кролячу сироватку проти 11 74557 12 рою, що рекомендується виготовлювачем. Тота(IFNAR), який являє собою гетеромультимерний льну РНК, 5мкг на доріжку, фракціонували за розрецепторний комплекс, що складається щонаймеміром в агарозних гелях, які містили формальдегід нше з двох різних поліпептидних ланцюгів, назваяк денатуруючий агент. Потім РНК переносили них альфа і бета. Як і бета-субодиниця, альфакапілярним блотом на найлонові мембрани GENE субодиниця була перейменована і відома також як 32 SCREEN PLUS і гібридизували з Р-міченим зонIFNAR1. sIFNAR2 є розчинним і не мембранозв'ядом hIFNAR2 з ПЛР-фрагмента кДНК. Сигнали заним, оскільки він позбавлений щонайменше смуг визначали кількісно на моделі 603 Бетаскопа; трансмембранного домена IFNAR2. Два режими розміри оцінювали з радіоавтографів цих блотів. біореактора з клітинами СНО, здатними продукуРезультати вати і секретувати SIFNAR2, як представлено ниАмпліфікація жче, демонструють звичайний "класичний" підхід Проби аналізували за допомогою ELISA на (режим №4 біореактора) і нову стратегію фідингу всіх стадіях ампліфікації. Тільки два пули, IFNR1-1 сироватки відповідно до даного винаходу (режим і: IFNR1-6 були детектованими при рівнях 0,5-5,0 і №12 біореактора), використовуючу культуру прик1,0 і 5,0мкМ МТХ, відповідно. Всі інші рівні експреріплених клітин. сії були дуже низькими для детектування. Режим №4 біореактора (стратегія фідингу, що містить сироватку) Таблиця 2 Клон СНО 1-1-31 (експресу є sIFNAR2) вирощували в DMEM/F12, доповненому 5% ФТС, в ТПідсумовуванні результати продуктивності (мкг/мл) колбах і ролерних флаконах доти, поки не утвориоб'ємного продукування під час ампліфікації лося досить клітин для інокуляції біореактора на Ампліфікація CHO-IFNR1 4,8л. Потім клітини трипсинізували з ролерних флаконів і використовували для інокуляції реактоПул Рівень МТХ (мкМ) мкг/мл ра, що містить 2г/л мікроносіїв Cytopore 2 в 4,8л IFNR1-1 0,5 5,58 DMEM/F12, доповненого 5% ФТС. Після 24IFNR1-1 1,0 9,40 годинного періоду починали фідинг DMEM/F12, IFNR1-1 5,0 8,94 доповненого 5% ФТС, при швидкості потоку 0,3 IFNR1-6 1,0 7,39 IFNR1-6 5,0 4,87 об'єму середовища фідингу/об'єм реактора/день (об./об./д.). Цю швидкість фідингу збільшували Пул IFNR1-1 при рівні 1мкМ МТХ мав найвищу постадійно протягом 8-денного періоду, поки не досягалася швидкість потоку 2 об./об./д. (тобто об'ємну продуктивність, 9,40мкг/мл, і був вибраний для клонування. Питома продуктивність цього пу9,6л/день). У день 0 утворення продукту (день 9 роботи реактора) середовище фідингу перемикали лу відповідала 5,99pcd. Підтвердження експресії клонів після відтана DMEM/F12, доповнене 1мг/л рекомбінантного інсуліну, приблизно 12мг/л цитрату заліза(ІІІ), вання 0,0068мг/л селену і 1Х розчину мікроелементів Таблиця 3 (IFCSTE). Швидкість потоку фідингу близько 2об./об./д. підтримували протягом всього періоду Підтвердження експресії клонів IFNR1-1 утворення продукту. Зростання клітин на мікроносіях і утворення sIFNAR2 піддавали моніторингу. Клон мкг/мл pcd Режим №12 біореактора (стратегія фідингу, 50 14,42 34,48 що не містить сироватку) 44 9,77 25,22 Клон СНО 1-1-31 (експресує sIFNAR2) виро31 18,71 19,33 щували в DMEM/F12, доповненому 5% ФТС, в Т4 10,60 19,12 колбах і ролерних флаконах доти, поки не утвори45 5,87 17,61 лося досить клітин для інокуляції біореактора на 61 10,17 16,53 4,8л. Потім клітини трипсинізували з ролерних 60 15,75 16,35 флаконів і використовували для інокуляції реакто37 5,03 16,22 70 11,85 14,32 ра, що містить 2г/л мікроносіїв Cytopore 2 в 4,8л 13 6,83 10,19 DMEM/F12, доповненого 5% ФТС. Після 4838 4,06 8,59 часового періоду починали фідинг DMEM/F12, що 36 4,39 5,99 не містить сироватки, доповненого IFCSTE, при 24 6,02 5,01 швидкості потоку 0,2 об'єму середовища фідин8 3,41 4,48 гу/об'єм реактора/день (об./об./д.). Цю швидкість 56 5,14 3,25 фідингу збільшували постадійно протягом 8денного періоду, поки не досягалася швидкість Клоном з найвищою експресією був IFNR1-1потоку 2об./об./д. "День утворення продукту" в цій 50 з питомою продуктивністю 34,48pcd. Продуценсистемі пов'язували з початком фідингу (день 2 том з найвищою експресією з розрахунку на об'ємроботи біореактора), оскільки цей режим не був ну експресію був клон IFNR1-1-31 (клон СНО 1-1"класичним" двофазним протоколом. Зростання 31) з рівнем експресії 18,71мкг/мл. клітин на мікроносіях і утворення SIFNAR2 піддаПриклад 2 вали моніторингу. У цьому прикладі sIFNAR2 є гетерологічно сеРезультати кретованим білком, який продукується і секретуЯк показано на Фіг.2, швидкість клітинного роється в культурі прикріплених клітин СНО. IFNRA2 зподілу і щільність насичення в обох режимах №4 і є бета-субодиницею рецептора інтерферону типу І №12 біореактора були порівнянними. Клітини, 13 74557 14 одержуючі підживлення (фідинг) композицією, що винаходу описується, затверджується або передмістить сироватку (режим №4), збільшувались в бачається в релевантній області. Попередній опис характерних варіантів повніскількості з 1,4 105клітин/мл до 6,7 106клітин/мл тю розкриває загальний характер даного винахо(5,5 генерацій клітин), а клітини, одержуючі піджиду, який інші дослідники можуть, з використанням влення (фідинг) безсироватковою композицією, 5 знань в межах кваліфікації в даній області (в тому збільшувалися в кількості з 2,5 10 клітин/мл до числі змісту посилань, що цитуються тут), легко 5,1 106клітин/мл (4,4 генерацій клітин). модифікувати і/або пристосувати для різноманітФігура 3 ілюструє кінетику утворення продукту них застосувань таких характерних варіантів, без sIFNAR2 в режимах №4 і №12 біореактора. Клітинадмірного експериментування, без відхилення від ни з фідингом DMEM/F12, доповненим 5% ФТС, загальної концепції даного винаходу. Таким чином, спочатку демонстрували об'ємну продуктивність передбачається, що така адаптація і модифікації приблизно 80мг/л/день. Однак при перемиканні на знаходяться в межах задуму і діапазону еквівалебезсироваткову композицію DMEM/F12, доповнентів описаних варіантів здійснення і засновані на ного IFCSTE, спостерігали лаг-фазу, в якій продукпоясненні і керівництві, представленому тут. Потивність падала менше, ніж до 40мг/л/д, повертавинне бути зрозуміло, що фразеологія або терміючись зворотно до 80мг/л/д після 10-денного нологія в описі служить меті опису і не є обмеженперіоду (день 20 роботи біореактора). У протиленям, так що термінологія або фразеологія даного жність цьому, клітини, одержуючі з самого початку опису повинна інтерпретуватися кваліфікованим фідинг середовища DMEM/F12, доповненого фахівцем в світлі приведених тут вказівок і керівIFCSTE, не виявляли лаг-фази і досягали 80мг/л/д ництва, в поєднанні зі знаннями фахівця із звичайв день 14 роботи біореактора. ною кваліфікацією в даній області. Зростання клону СНО 1-1-31 на мікроносіях Посилання Cytopore 2, з фідингом або середовищем, що місAsselbergs et al., Scaled-up Production of тить сироватку, або безсироватковою композицією Recombinant Human Renin in CHO Cells for середовища, піддавали моніторингу, як показано Enzymatic and X-ray Structure Analysis, J.Biotechnol на Фіг.4А-4С і фігурах SA-SD, відповідно, де спо32:191-202 (1992). стерігали життєздатні клітини, забарвлені зеленим Cherry et al., Physical Mechanisms of Cell флуоресцентним барвником. Фіг.4А-4С і Фіг.5A-5D Damage in Microcarrier Cell Culture Bioreactors, разом ілюструють, що обидві стратегії фідингу Biotechnology and Bioengineering 32:1001-1014 режимів №4 і №12 біореактора підтримують зрос(1988). тання клітин на мікроносіях із збільшеннями флуоClark et al., Optimizing Culture Conditions for the ресценції, що спостерігається протягом часу. Production of Animal Cells in Microcarrier Culture, Тепер, після повного опису даного винаходу, Annals Mew York Academy of Sciences 33-46 фахівцям з кваліфікацією в даній області буде (1981). зрозуміло, що те ж саме можна здійснювати в шиCosgrove et al., "Purification and Properties of рокому діапазоні еквівалентних параметрів, конInsulin Receptor Ectodomain from Large-Scale центрацій і умов, не відхиляючись від ідеї і не виMammalian Cell Culture, Protein expression and ходячи за рамки даного винаходу, і без надмірного Purification 6:789-798 (1995). експериментування. Gasser et al., Long-Term Multiplication of the Хоча даний винахід був описаний в зв'язку з Chinese Hamster Ovary (CHO) Cell Line in a Serumйого характерними варіантами, повинне бути зроFree Medium, In Vitro Cellular and Developmental зуміле, що його можна додатково модифікувати. Biology 21(10): 588-592(1985). Передбачається, що дана заявка охоплює будь-які Gorfien et al., Growth and rDNA Protein варіації, застосування або адаптацію даного винаProduction in an Improved Serum-free Medium ходу відповідно до, в загальних рисах, принципів Formulation, J.Cell Biol. 115(3) Part 2, 358a (1991). даного винаходу і включає в себе такі відхилення Kadouri, Cultivation of Anchorage-dependent від даного опису, які знаходяться в межах відомої Mammalian Cells and Production of Various або загальноприйнятої практики в області, до якої Metabolites. Colloids and Surfaces B, Biointerfaces відноситься даний винахід, і які можуть бути за2:265-272 (1994). стосовані до істотних ознак, викладених тут вище, Levin et al., Purification of Recombinant Human згідно з об'ємом прикладеної формули винаходу. Secretary Phospholipase A2 (Group II) Produced in Всі посилання, що цитуються тут, в тому числі Long-term Immobilized cell Culture, Protein Expr. і опубліковані журнальні статті або реферати або Purif. 3(1) 27-35 (1992). відповідні заявки США або інших країн, патенти Lubiniecki et al., Purified Protein Products of США або іноземні патенти, або інші посилання, rDNA Technology Expressed in Animal Cell Culture, включені посиланнями, що приводяться тут в повBiologicals 22:161-169 (1994). ному вигляді, в тому числі з всіма результатами, Nikolai et al., Cultivation of Mammalian Cells on таблицями, фігурами і текстом, представленими в Macroporous Microcarriers, Enzyme Microb. Technol. посиланнях, що цитуються. Крім того, повний зміст 14:203-208 (1992). посилань, що цитуються в посиланнях, що привоNilsson, Microcarrier Cell Culture, Biotechnology дяться тут, також в повному вигляді включено як and Genetic Engineering Reviews 6 (11): 403-439 посилання. (1989). Посилання на відомі стадії способів, загальноOhlson et al., Bead-to-Bead Transfer of Chinese прийняті стадії способів, відомі способи або загаHamster Ovary Cells Using Macroporous льноприйняті способи ні в якій мірі не є визнанням Microcarriers, Cytotechnology 14:57-80 (1994). того, що будь-який аспект, опис або варіант даного 15 74557 16 OHjve et al., Molecular Biology and Biochemistry Oligosaccharides of Recombinant Human Kallikrein of Human Recombinant Follicle Stimulating Hormone, Produced by Chinese Hamster Ovary cells on European Society for Human Reproduction and Microcarrier Beads and in Serum-Free Suspension Embryology 372-382 (1996). Culture, Biotechnol. Prog. 10(1) (1994). Rubinstein, Сеll, 77:391-400 (1994). Werner et al., Mammalian Cell Cultures, Arzneim. Schmid et al., Repeated Batch Cultivation of Forsch./Drug Res. 43(11); 1134 (1993). rBHK Cells on Cytodex 3 Microcarriers; Antithrombin Xiao et al., High Density Cultivation of III, Amino Acid, and Fatty Acid Metabolic Quotients, Genetically-engineered CHO Cell Lines With Appl. Microbiol. Biotechnol. 38:328-333 (1992). Microcarrier Culture Systems, Chin. Med. Sei. J. 9 Teige et al., Problems with Serum-Free (2):71-74 (1994). Production of Anti-Thrombin III Regarding Proteolytic Zaworski et al., Serum-Free transfection and Activity and Product Quality, J.Biotechnol. 34: 101Selection in Chinese Hamster Ovary (CHO) Cells, 105 (1994). BioTechniques. 15 (5);863-865 (1993). Watson et al., Comparison of N-linked Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for producing a heterologous secreted protein from chinese hamster ovaries cells grown on microcarriers
Назва патенту російськоюСпособ получения гетерологического секретированного белка изклеток яичника китайского хомячка, которые выращиваются на микроносителях
Автори російськоюCunningham, Mark
МПК / Мітки
МПК: C12N 5/10, C12P 21/02, C12N 15/09, C07K 14/715, C12N 15/12
Мітки: мікроносіях, гетерологічного, білка, секретованого, китайського, спосіб, клітин, яєчника, одержання, хом'ячка, вирощуються
Код посилання
<a href="https://ua.patents.su/8-74557-sposib-oderzhannya-geterologichnogo-sekretovanogo-bilka-z-klitin-yaehchnika-kitajjskogo-khomyachka-shho-viroshhuyutsya-na-mikronosiyakh.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання гетерологічного секретованого білка з клітин яєчника китайського хом’ячка, що вирощуються на мікроносіях</a>
Попередній патент: Спосіб стабілізації білих столових виноматеріалів до необоротних колоїдних помутнінь
Наступний патент: Спосіб одержання вугільної золи виносу, що містить германій
Випадковий патент: Порошковий інгалятор