Спосіб верифікації цитотоксичних ефектів металовмісних наноматеріалів на пухлинні клітини
Номер патенту: 75163
Опубліковано: 26.11.2012
Автори: Чехун Василь Федорович, Налєскіна Леся Анатоліївна, Демаш Дмитро Віталійович, Лук'янова Наталія Юріївна, Кунська Любов Миколаївна, Тодор Ігор Миколайович
Формула / Реферат
Спосіб верифікації цитотоксичних ефектів металовмісних наноматеріалів на пухлинні клітини, який відрізняється тим, що для визначення ступеню цитотоксичного впливу металовмісного наноагента на цитоархітектоніку клітин в залежності від його концентрації та тривалості контактної дії використовуються комплекси простих, не трудомістких цитоморфологічних показників змін в цитоплазмі пухлинних клітин - зміна конфігурації цитоплазми, явища блебінгу цитоплазматичної мембрани, вакуольно-гідропічної дистрофії, і в ядрах - передчасна конденсація хромосом, перерозподіл хроматину, фрагментація ядер, утворення протрузій та мікроядер.
Текст
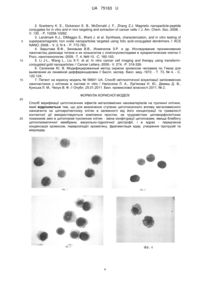
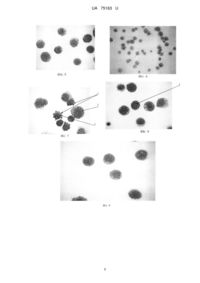
Реферат: Спосіб верифікації цитотоксичних ефектів металовмісних наноматеріалів на пухлинні клітини, при якому для визначення ступеню цитотоксичного впливу металовмісного наноагента на цитоархітектоніку клітин в залежності від його концентрації та тривалості контактної дії використовуються комплекси простих, не трудомістких цитоморфологічних показників змін в цитоплазмі пухлинних клітин - зміна конфігурації цитоплазми, явища блебінгу цитоплазматичної мембрани, вакуольно-гідропічної дистрофії, і в ядрах - передчасна конденсація хромосом, перерозподіл хроматину, фрагментація ядер, утворення протрузій та мікроядер. UA 75163 U (12) UA 75163 U UA 75163 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель, що заявляється, належить до медико-біологічних наук, а саме до експериментальної онкології, та може бути використана для тестування цитотоксичної дії металовмісних наноматеріалів в системі in vitro. Створення технологій таргетної доставки цитостатиків безпосередньо у пухлину є першочерговим завданням експериментальної та клінічної онкології, оскільки феномен резистентності пухлин до протипухлинних засобів перешкоджає ефективному лікуванню хворих на рак. Застосування при створенні лікарських засобів сучасних нанотехнологій, зокрема, використання наночастинок металовмісних матеріалів - наноферомагнетиків, магнітної рідини, колоїдного золота, є одним з напрямків вирішення проблеми резистентності. На сьогодні розроблені різні способи отримання та удосконалення речовин, які мають векторні властивості, тому кожна отримана нанорозробка підлягає біологічній перевірці на цитотоксичні властивості і потребує застосування адекватних методів об'єктивізації та інформативних критеріїв змін, що відбуваються під їх впливом. Найбільш поширеними серед існуючих способів дослідження металовмісних наноматеріалів у біологічних об'єктах є методи електронної мікроскопії, конфокальної мікроскопії, проточної флуориметрії, які мають ряд суттєвих недоліків, зокрема, коштовність застосованого оптикотехнічного обладнання і тому обмежена його доступність, а також трудомісткість підготовки біологічного матеріалу для досліджень. Крім того, ці методи не дають чітких об'єктивних уявлень про цитоморфологічні прояви дії різних за походженням наночастинок на архітектоніку клітинних структур. Відомими методичними підходами щодо тестування створених наноматеріалів різного походження, вибраних як показників рівня техніки і водночас можливих прототипів корисної моделі, що заявляється, є спосіб синтезу та ліпідзв'язаної доставки у пухлинні клітини людини в системі in vitro вуглецевих нанотрубок, виповнених частинками наноферомагнетику [1], та спосіб отримання нанокомпозиту із супермагнітних кобальт-феритних наночастинок, кон'югованих із специфічними лігандами, для таргетної експресії ЕрhА2-рецепторів у пухлинних клітинах яєчників і вивільнення у пухлинах [2]. У обох розробках основну увагу зосереджено на матеріалах, що застосовуються, умовах та технології створення зазначених композитів. Позитивним у обох розробках є можливість констатації надходження у пухлинні клітини створених композитів за допомогою декількох методів, у тому числі найсучасніших методів мікроскопічного дослідження: скануючої та трансмісійної мікроскопії, а також розсіюючого рентгенаналізатора - у першій; експериментів in vitro та in vivo із застосуванням інвертованої та лазерної скануючої конфокальної мікроскопії - у другій. У інших двох прототипах - спосіб синтезу та тестування наночастинок оксиду заліза з супермагнітними властивостями [3] та спосіб отримання кон'югатів наночастинок диоксиду титану з олігонуклеотидами та візуалізації проникнення в еокаріотичні клітини [4], як і у двох попередніх, не висвітлено питання цитотоксичної дії наночастинок, а йдеться лише про об'єктивізацію надходження отриманих композитів у клітини з використанням малодоступних для повсякденного дослідження методів: конфокальної, лазерної скануючої та електронної мікроскопії, які через високу коштовність обладнання не можуть бути застосовані у переважній більшості науково-дослідних установ медико-біологічного профілю. Найбільш близьким за рівнем техніки можна вважати прототип, в якому запропоновано спосіб визначення цитотоксичної дії наночастинок золота, кон'югованих із трансферином у модельній системі in vitro [5]. Позитивною стороною цього способу є те, що на двох культурах клітин раку молочної залози людини у порівнянні з контролем за допомогою гемоаналізатора встановлена залежність між цитотоксичним ефектом і концентрацією наночастинок, кон'югованих з трансферином, а також показана вирішальна роль у інтерналізації досліджених наночастинок зв'язку - трансферин-трансфериновий рецептор. Недоліком, притаманним і попередньо проаналізованим розробкам, є відсутність даних щодо цитоморфологічних проявів цитотоксичної дії цих кон'югатів у пухлинних клітинах та використання мало доступного обладнання для визначення наночастинок золота - конфокальної, лазерної скануючої мікроскопії. В основу корисної моделі, що заявляється, поставлено задачу: розробити доступний, легко відтворюваний, незатратний спосіб світлооптичної візуалізації цитотоксичних ефектів, що відбуваються у пухлинних клітинах в системі in vitro, клітинах, отриманих із асцитної рідини тварин з перещеплюваними пухлинами, під впливом різних за походженням металовмісних наноматеріалів для розмежування ступеню цитотоксичного впливу кожного металовмісного наноагенту на цитоархітектоніку клітин в залежності від тривалості дії та концентрації його у розчині. 1 UA 75163 U 5 10 15 20 25 30 35 40 45 50 55 Поставлена задача вирішується шляхом верифікації цитотоксичних ефектів металовмісних агентів у клітинах в системі in vitro та у клітинах з асцитичної рідини. Спосіб, що пропонується здійснюється за наступним алгоритмом. Дослідження проводилось на клітинах 3-х груп тварин з асцитною карциномою Ерліха через 7 діб після внутрішньочеревного введення тваринам кожної з цих груп наночастинок одного з металовмісних матеріалів різного походження: наноферомагнетиків у ліпосомній формі (розмірами 60-70 нм та концентрацією 3 та 6 мг/кг ваги тварини), магнітної рідини (розмірами наночастинок заліза 10-12 нм, концентрацією 3 та 6 мг/кг ваги тварини) та колоїдного золота (розміром 5 нм та концентрацією 30 та 60 мг/кг ваги тварини). Цитотоксичні ефекти оцінювали через різні часові інтервали дії введених наноматеріалів (24 та 48 год.). Кожна з досліджених груп мала свій контроль, тобто тварин, яким не вводились наночастинки металовмісних матеріалів. Цитоархітектоніка клітин контрольних тварин з асцитною карциномою Ерліха через 24 та 48 год. була однотипною для всіх трьох досліджених груп (фіг. 1 та фіг. 2). Вилучена із черевної порожнини асцитична рідина із пухлинними клітинами піддавалась центрифугуванню та дворазовому відмиванню клітинного осаду фізіологічним розчином. Після цього розведені у фізіологічному розчині клітини у концентрації 1 млн на 1 мл розчину наносились на предметні скельця, підсушувались на повітрі, фіксувались у парах параформальдегіду протягом 3 хв. та зафарбовувались за методом Романовського-Гімза [6]. Отримані цитологічні препарати досліджувались за допомогою світлового мікроскопу МРІ-1 при збільшеннях об'єктивів 10, 20, 40, 100 (масл. імерсія). На підставі світлооптичних досліджень популяцій клітин асцитної карциноми Ерліха, що зазнали впливу різних металовмісних наноматеріалів, було встановлено, що не всі вони викликають однотипний цитотоксичний вплив на досліджені клітини. Найбільш виражені зміни визначались у популяції клітин асцитної карциноми Ерліха після дії ліпосомної форми наноферамагнетику. Зазначено залежність ступеню цитотоксичного впливу як від концентрації, так і від часу впливу цього чинника. При концентрації наноферомагнетику 3 мг/кг ваги тварини і тривалості дії 24 год. спостерігається незначний ступінь змін цитоархітектоніки клітин. Зміни стосуються лише стану цитоплазми - змінюється її конфігурація і клітини набувають фестончатого вигляду. Поряд з цим в цитоплазмі визначаються окремі вакуолі. Через 48 год. впливу цієї дози спостерігаються більш виражені зміни з боку цитоплазми: явища блебінгу цитоплазматичної мембрани як наслідку дестабілізації поверхневого натягу мембрани через порушення співвідношення між білками цитоскелету актино-мієлінового ряду, явища вакуольно-гідропічної дистрофії за рахунок порушення водно-білкового метаболізму. Після дії наноферомагнетику у концентрації 6 мг/кг ваги тварини протягом 48 год. спостерігаються суттєві цитотоксичні зміни у досліджених клітинах, які окрім виражених змін з боку цитоплазми стосуються пошкоджень ядерних структур. Відбувається передчасна конденсація хромосом, перерозподіл хроматину, фрагментація ядер, утворюються протрузії, мікроядра. На відміну від зазначених порушень внаслідок дії наноферомагнетику вплив магнітної рідини у тих же дозах і термінах застосування не викликає змін цитоархітектоніки клітин асцитної карциноми Ерліха за виключенням появи поодиноких вакуолей у цитоплазмі. Колоїдне золото також не призводить до суттєвих токсичних змін у застосованій дозі 30 мг/кг ваги тварини і часі дії 24 та 48 год., окрім дози 60 мг/кг ваги тварини і інтервалу впливу 48 год., при яких спостерігається деякий поліморфізм клітин, явища вакуольно-гідропічної дистрофії та незначні зміни конфігурації клітин. В ядрах суттєві зміни не відбувались. Приклади практичного застосування корисної моделі Прикладами щодо практичного застосування корисної моделі можуть бути порівняльні дані цитоархітектоніки клітин асцитної карциноми Ерліха після застосування різних концентрацій наноферомагнетиків та магнітної рідини (3 та 6 мг/кг ваги тварини), а також колоїдного золота (30 та 60 мг/кг ваги тварини) протягом 24 та 48 год. Приклад 1. Слабко (фіг.3) та помірно (фіг.4 та фіг.5) виражені зміни цитоархітектоніки клітин асцитної карциноми Ерліха при дії наноферомагнетику у концентрації 3 мг/кг ваги тварини протягом 24 та 48 годин. Приклад 2. Виражені зміни цитоархітектоніки клітин асцитної карциноми Ерліха під впливом наноферомагнетика у ліпосомній формі в концентрації 6 мг/кг ваги тварини через 48 год. (фіг.6, фіг.7 та фіг.8). Приклад 3. Відсутність цитотоксичної дії магнітної рідини у концентрації 6 мг/кг ваги тварини на клітини асцитної карциноми Ерліха через 48 год. (фіг.9, фіг.10 та фіг.11). 2 UA 75163 U 5 10 15 20 25 30 35 40 45 50 55 Приклад 4. Наслідок цитотоксичної дії колоїдного золота у концентрації 60 мг/кг ваги тварини на цитоархітектоніку клітин асцитної карциноми Ерліха через 24 та 48 год. (фіг. 12 та фіг. 13). Таким чином, спосіб верифікації цитотоксичних ефектів металовмісних нонаматеріалів на пухлинні клітини дозволяє визначити ступінь цитотоксичних ефектів щодо впливу різних концентрацій металовмісних наноматеріалів на пухлинні клітини при різних термінах їх контактної взаємодії у культуральному середовищі. Перелік фігур Фіг. 1. Контроль - клітини асцитної карциноми Ерліха (24 години культивування), що не піддавались цитотоксичній дії наночастинок металовмісних матеріалів. Пухлинні клітини правильної округлої форми з чітко окресленим ядром з рівномірною петлисто-зернистою текстурою хроматину. Фіг. 2 Контроль - клітини асцитної карциноми Ерліха (48 години культивування), що не піддавались цитотоксичній дії наночастинок металовмісних матеріалів. Цитоархітектоніка пухлинних клітин не змінена порівняно із цитоархітектонікою клітин, що культивувались 24 години. Фіг. 3 Цитотоксична дія наноферомагнетику у концентрації 3 мг/кг ваги тварини на клітини асцитної карциноми Ерліха через 24 години. Слабкий прояв дії наноферомагнетику: поліморфізм клітин асцитної карциноми Ерліха, незначні зміни конфігурації та вакуолізація цитоплазми. Фіг. 4 Помірно виражений цитотоксичний ефект наноферомагнетику у концентрації 3 мг/кг ваги тварини у цитоплазмі клітин асцитної карциноми Ерліха через 48 годин. Зміна конфігурації клітин та виражена вакуолізація цитоплазми. Фіг. 5 Помірно виражений цитотоксичний ефект наноферомагнетику у концентрації 3 мг/кг ваги тварини у ядрах клітин асцитної карциноми Ерліха через 48 годин. Втрата чіткості ядерної мембрани, "набухання", розрихлення хроматину. Фіг. 6 Вплив наноферомагнетику в дозі 6 мг/кг ваги тварини на пухлинні клітини через 48 годин. Цитоархітектоніка пухлинних клітин характеризується вираженими ознаками змін в цитоплазмі: поліморфізм розмірів та зміна конфігурації. Фіг. 7 Поряд із суттєвими змінами у цитоплазмі пухлинних клітин (явища блебінгу цитоплазматичної мембрани, множинна вакуолізація цитоплазми) через 48 годин дії нанокомпозиту в дозі 6 мг/кг ваги тварини спостерігаються значні зміни в ядрах - передчасна конденсація хромосом, фрагментація ядер, утворення протрузій та мікроядер. Позначення: 1 блебінг; 2 - передчасна конденсація хромосом; 3 - фрагментація ядра. Фіг. 8 Окрім змін, зазначених на фіг. 6 та фіг. 7, у пухлинних клітинах асцитної карциноми Ерліха, що зазнали дії наноферомагнетику у дозі 6 мг/кг ваги тварини, через 48 годин спостерігається утворення мікроядер. Позначення: 1 - утворення мікроядер. Фіг. 9 Клітини асцитної карциноми Ерліха через 48 годин дії магнітної рідини у дозі 6 мг/кг ваги тварини характеризуються звичайною цитоархітектонікою, за виключенням наявності окремих вакуолей. Фіг. 10. Пухлинні клітини після дії магнітної рідини у дозі 6 мг/кг ваги тварини через 48 годин зберігають звичайну форму і добре окреслені контури цитоплазматичної мембрани при наявності поодиноких гранул заліза, візуалізованих за допомогою модифікованої реакції Лілі [7]. Фіг. 11 Пухлинні клітини після дії магнітної рідини у дозі 6 мг/кг ваги тварини через 48 годин мають звичайну форму і добре окреслені контури цитоплазматичної мембрани при наявності поодиноких фанул заліза, візуалізованих за допомогою модифікованої реакції Лілі [7] навіть при множинному накопиченні магнітної рідини. Фіг. 12 Пухлинні клітини через 24 години після дії колоїдного золота у концентрації 60 мг/кг ваги тварин мають звичайну цитоархітектоніку. Фіг. 13 Пухлинні клітини через 48 годин після дії колоїдного золота у концентрації 60 мг/кг ваги тварини характеризуються незначно вираженими ознаками поліморфізму, у тому числі ядер, та вакуолізацією цитоплазми. Всі цитологічні препарати пофарбовано за методом Романовського-Гімза і досліджені за допомогою світлооптичної мікроскопії при збільшенні 1200, ім. масло. Джерела інформації: 1. Mönch I., Meye A., Leonhardt A. et al. Ferromagnetic filled carbon nanotubes and nanoparticles: synthesis and lipid-mediated delivery into human tumor cells // J. Magnetism & Magnetic Materials.-2005. - V. 290-291. - P. 276-278. 3 UA 75163 U 5 10 15 2. Scarberry K. E., Dickerson E. B., McDonald J. F., Zhang Z.J. Magnetic nanoparticle-peptide conjugates for in vitro and in vivo targeting and extraction of cancer cells // J. Am. Chem. Soc.-2008. V. 130. - P. 10258-10262. 3. Landmark K.J., DiMaggio S., Ward J. et al. Synthesis, characterization, and in vitro testing of superparamagnetic iron oxide nanoparticles targeted using folic acid-conjugated dendrimers // ACS NANO.-2008. - V. 2, N 4. - P. 773-783. 4. Зарытова В.Ф., Зиновьев В.В., Исмагилов З.Р. и др. Исследование проникновения наночастиц диоксида титана и их коньюгатов с олигонуклеотидами в эукариотические клетки // Росс, нанотехнологии.-2009. -Т. 4, №9-10. -С. 160-163. 5. Li J-L., Wang L., Liu X-Y. et al. In vitro cancer cell imaging and therapy using transferrinconjugated gold nanoparticles // Cancer Letters.-2009.- V. 274. -P. 319-326. 6. Селезнев Ю. В. Модифицированный метод окраски хромосом человека по Гимза для выявления их линейной дифференцировки // Бюлл. экспер. биол. мед.-1972. - Т. 73, № 4. - С. 122-124. 7. Патент на корисну модель № 56641 UA. Спосіб світлооптичної візуалізації залізовмісних наночастинок у клітинах в системі in vitro / Налєскіна Л. А., Лук'янова Н. Ю., Демаш Д. В., Кунська Л. М., Чехун В. Ф. // Опубл. 25.01.2011. Бюл. промислової власності 2011, № 2. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 20 25 Спосіб верифікації цитотоксичних ефектів металовмісних наноматеріалів на пухлинні клітини, який відрізняється тим, що для визначення ступеню цитотоксичного впливу металовмісного наноагента на цитоархітектоніку клітин в залежності від його концентрації та тривалості контактної дії використовуються комплекси простих, не трудомістких цитоморфологічних показників змін в цитоплазмі пухлинних клітин - зміна конфігурації цитоплазми, явища блебінгу цитоплазматичної мембрани, вакуольно-гідропічної дистрофії, і в ядрах - передчасна конденсація хромосом, перерозподіл хроматину, фрагментація ядер, утворення протрузій та мікроядер. 4 UA 75163 U 5 UA 75163 U Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for verification of cyto-toxic effects of metal-containing nano-materials on tumor cells
Автори англійськоюChekhun Vasyl Fedorovych, Nalieskina Lesia Anatoliivna, Lukianova Nataliia Yuriivna, Todor Ihor Mykolaiovych, Kunska Liubov Mykolaivna, Demash Dmytro Valeriiovych
Назва патенту російськоюСпособ верификации цитотоксических эффектов металлосодержащих наноматериалов на опухолевые клетки
Автори російськоюЧехун Василий Федорович, Налескина Леся Анатольевна, Лукьянова Наталья Юрьевна, Тодор Игорь Николаевич, Кунская Любовь Николаевна, Демаш Дмитрий Валерьевич
МПК / Мітки
МПК: G01N 21/00
Мітки: металовмісних, спосіб, клітині, наноматеріалів, ефектів, пухлинні, верифікації, цитотоксичних
Код посилання
<a href="https://ua.patents.su/8-75163-sposib-verifikaci-citotoksichnikh-efektiv-metalovmisnikh-nanomaterialiv-na-pukhlinni-klitini.html" target="_blank" rel="follow" title="База патентів України">Спосіб верифікації цитотоксичних ефектів металовмісних наноматеріалів на пухлинні клітини</a>
Попередній патент: Спосіб визначення локального значення коефіцієнта монохроматичної випромінювальної здатності в різних точках поверхні тіла, розжареного до світіння
Наступний патент: Спосіб визначення спектра ізоформ лактатдегідрогенази при діагностиці диспепсії неонатальних телят
Випадковий патент: Пристрій для гідроструминної обробки поверхонь