Фосфатні проліки фтороксіндолів
Номер патенту: 77296
Опубліковано: 15.11.2006
Автори: Старретт Джон Е., Шміц Уільям Д., Лопез Омар Д., Гевавасам Піясена, Гіллман Кевін В., Провенкал Девід П.
Формула / Реферат
1. Сполука за формулою
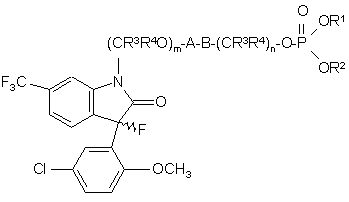 , I
, I
де хвилеподібний зв'язок ![]() означає рацемат, (R)-енантіомер або (S)-енантіомер;
означає рацемат, (R)-енантіомер або (S)-енантіомер;
А являє собою прямий зв'язок або (С=O);
В являє собою прямий зв'язок, кисень або азот;
m приймає значення 0 або 1;
n приймає значення 1, 2, 3;
R1 i R2 кожний незалежно являє собою водень або естерну групу, здатну гідролізуватися; і коли R1 являє собою водень, R2 може бути також –P(O)OR5OR6 або гетероарилом;
R3 i R4 кожний незалежно являє собою водень або С1-4 алкіл; і
R5 i R6 кожний незалежно являє собою водень або естерну групу, здатну гідролізуватися;
або її нетоксична фармацевтичнo прийнятна сіль чи сольват.
2. Сполука за п. 1, де хвилеподібним зв'язком ![]() є рацемат, (R)-енантіомер або (S)-енантіомер;
є рацемат, (R)-енантіомер або (S)-енантіомер;
А являє собою прямий зв'язок або (С=O);
В являє собою прямий зв'язок або кисень;
m приймає значення 0 або 1;
n приймає значення 1, 2 або 3;
R1 і R2 кожний незалежно являє собою водень або естерну групу, здатну гідролізуватися; і коли R1 являє собою водень, R2 може бути також –P(O)OR5OR6;
R3 і R4 кожний незалежно являє собою водень або С1-4 алкіл; і
R5 i R6 кожний незалежно являє собою водень або естерну групу, здатну гідролізуватися;
або її нетоксична фармацевтичнo прийнятна сіль чи сольват.
3. Сполука за п. 2, вибрана із групи, що складається із:
моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового] естеру (S)-фосфорної кислоти;
моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового] естеру (R)-фосфорної кислоти;
2-фосфоноксипропілового естеру (S)-3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-карбонової кислоти;
2-фосфоноксіетилового естеру (S)-3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-карбонової кислоти;
3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового естеру (S)-(2-фосфоноксіетил)карбамінової кислоти;
3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового естеру (S)-фосфоноксіоцтової кислоти;
фосфоноксиметилового естеру (S)-3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-карбонової кислоти;
3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового естеру (S)-3-фосфоноксипропіонової кислоти;
[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметилового естеру (S)-пірофосфорної кислоти;
[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметиловий естер]метилового естеру (S)-фосфорної кислоти і
[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметиловий естер]етилового естеру (S)-фосфорної кислоти;
або її нетоксична фармацевтичнo прийнятна сіль чи сольват.
4. Сполука за п. 3, що є моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметиловим] естером (S)-фосфорної кислоти,
або її нетоксична фармацевтичнo прийнятна сіль чи сольват.
5. Сполука за п. 4, що є моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1-ілметиловим] естером (S)-фосфорної кислоти,
її біс-[трис(гідроксиметил)амонійметанова] сіль чи сольват.
6. Фармацевтична композиція для лікування розладів, чутливих до відкривання високопровідних калієвих каналів, що активуються кальцієм, яка містить терапевтично ефективну кількість сполуки за п. 1 і фармацевтично прийнятний носій або розріджувач.
7. Спосіб лікування розладів, чутливих до відкривання високопровідних калієвих каналів, що активуються кальцієм, у ссавця, що потребує такого лікування, який передбачає введення зазначеному ссавцю терапевтично ефективної кількості сполуки за п. 1.
8. Спосіб за п. 7, який відрізняється тим, що зазначеним розладом є ішемія, інсульт, конвульсії, астма, епілепсія, синдром подразненої товстої кишки, мігрень, травматичне ушкодження мозку, підвищений внутрішньочерепний тиск, ушкодження спинного мозку, статева дисфункція, отруєння монооксидом вуглецю і нетримання сечі.
9. Спосіб за п. 8, який відрізняється тим, що зазначеним розладом є інсульт.
10. Спосіб за п. 8, який відрізняється тим, що зазначеним розладом є травматичне ушкодження мозку.
11. Спосіб за п. 8, який відрізняється тим, що зазначеним розладом є підвищений внутрішньочерепний тиск.
Текст
1. Сполука за формулою O OR1 3R4O) -A-B-(CR3R4) -O-P (CR m n C2 2 (19) 1 3 77296 4 [3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6за п. 1 і фармацевтично прийнятний носій або ротрифторметил-2,3-дигідроіндол-1-ілметиловий зріджувач. естер]метилового естеру (S)-фосфорної кислоти і 7. Спосіб лікування розладів, чутливих до відкри[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6вання високопровідних калієвих каналів, що актитрифторметил-2,3-дигідроіндол-1-ілметиловий вуються кальцієм, у ссавця, що потребує такого естер]етилового естеру (S)-фосфорної кислоти; лікування, який передбачає введення зазначеному або її нетоксична фармацевтичнo прийнятна сіль ссавцю терапевтично ефективної кількості сполуки чи сольват. за п. 1. 8. Спосіб за п. 7, який відрізняється тим, що за4. Сполука за п. 3, що є моно[3-(5-хлор-2метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3значеним розладом є ішемія, інсульт, конвульсії, дигідроіндол-1-ілметиловим] естером (S)астма, епілепсія, синдром подразненої товстої фосфорної кислоти, кишки, мігрень, травматичне ушкодження мозку, або її нетоксична фармацевтичнo прийнятна сіль підвищений внутрішньочерепний тиск, ушкодженчи сольват. ня спинного мозку, статева дисфункція, отруєння 5. Сполука за п. 4, що є моно[3-(5-хлор-2монооксидом вуглецю і нетримання сечі. 9. Спосіб за п. 8, який відрізняється тим, що заметоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3дигідроіндол-1-ілметиловим] естером (S)значеним розладом є інсульт. 10. Спосіб за п. 8, який відрізняється тим, що фосфорної кислоти, її біс-[трис(гідроксиметил)амонійметанова] сіль чи зазначеним розладом є травматичне ушкодження сольват. мозку. 11. Спосіб за п. 8, який відрізняється тим, що 6. Фармацевтична композиція для лікування розладів, чутливих до відкривання високопровідних зазначеним розладом є підвищений внутрішньокалієвих каналів, що активуються кальцієм, яка черепний тиск. містить терапевтично ефективну кількість сполуки Даний винахід стосується нових фосфатних похідних фтороксіндолу - сполуки, котра є модулятором високопровідних калієвих каналів, що активуються кальцієм, (ВК), і отже може застосовуватися для захисту нейронних клітин і лікування розладів, що виникають внаслідок дисфункції поляризації і провідності клітинної мембрани. Крім того, об'єктами винаходу є також процес лікування за допомогою нових заміщених похідних фтороксіндолу і фармацевтичні композиції, що їх містять. Сьогодні інсульт визнаний третьою серед головних причин недієздатності і смертності дорослого населення в США і Європі. У минуле десятиріччя досліджувалось декілька терапевтичних підходів щодо мінімізації зв'язаного з інсультом ушкодження мозку, в тому числі, за допомогою інгібіторів АМРА/каїнату, N-метил-D-аспартату (NMDA) та інгібіторів повторного поглинання аденозину. Метою даного винаходу є створення нових сполук, здатних модулювати калієві канали і, зокрема, калієві канали високої провідності, що активуються кальцієм, (ВК), які можуть застосовуватися для зменшення нейронного ушкодження під час ішемічних станів в інсультні періоди. Калієві канали відіграють ключову роль у регулюванні клітинного мембранного потенціалу і в модуляції збудженості клітини. Калієві канали саморегулюються напругою, клітинним метаболізмом, кальцій-іоном і рецептор-опосередкованими процесами. [Cook, N.S., Trends in Pharmacol. Sciences., 9, pp.21-28 (1988); and Quast, U. і Cook, N.S., Trends in Pharmacol. Sciences., 10, pp.431-435 (1989)]. Калієві канали, що активуються кальцієм, (KСа), являють собою групу різноманітних іонних каналів, активність яких залежить від внутрішньоклітинних іонів кальцію. Активність KСа-каналів регулюється внутрішньоклітинним іоном [Са2+], мем бранним потенціалом і фосфорилюванням. За своєю одноканальною провідністю в симетричних K+-розчинах KСа-канали поділяються на три підкласи, а саме на канали високої провідності (ВК) >150пСм, канали проміжної провідності 50-150пСм і канали низької провідності 150пСм) і високий [3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6ступінь специфічності до іонів K+ у ВK-каналів світрифторметил-2,3-дигідроіндол-1-ілметиловий дчать про те, що невелика кількість цих каналів естер]етиловий естер (S)-фосфорної кислоти; може відчутно впливати на мембранну провідність та їхні нетоксичні, фармацевтично прийнятні і збуджуваність клітин. Крім того, збільшення імосолі і сольвати. вірності відмикання каналів зі збільшенням внутВ іншому кращому варіанті здійснення даного рішньоклітинних Са2+ вказує на залучення ВKвинаходу пропонуються фармацевтичні композиканалів до модуляції Са2+-залежних функцій, таких ції, що містять, принаймні, одну сполуку за форяк секреції і м'язового скорочення [Asano, Μ. et al., мулою І в комбінації з ад'ювантом, носієм або розJ. Pharmacol. Exp Ther. 267. pp.1277-1285 (1993)]. чинником. Дія на клітини з боку засобів відмикання ВKВ іншому кращому варіанті здійснення даного каналів проявляється у збільшенні імовірності відвинаходу пропонується процес лікування або микання цих каналів [McKay, М.С. et al., J. профілактики захворювань, чутливих до відкриття Neurophvsiol. 71. pp.1873-1882 (1994); Olesen, S.калієвих каналів у ссавця, що потребує терапевтиP., Exp., Qpin. Invest. Drugs 3, pp.1181-1188 (1994)]. чного втручання, яке передбачає введення зазнаКолективне збільшення кількості відкритих індивіченому ссавцю терапевтично ефективної кількості дуальних Вk-каналів приводить до гіперполяризасполуки за формулою І або її нетоксичної, фармації клітинних мембран, особливо в деполяризовацевтично прийнятної солі, сольвату чи гідрату. них клітинах, внаслідок суттєвого підвищення ВkВ іншому кращому варіанті здійснення даного опосередкованої провідності всієї клітини. винаходу пропонується процес лікування ішемії, Здатність сполуки за формулою II відмикати конвульсії, епілепсії, астми, синдрому подразненої Вk-канали і збільшувати спрямовані назовні (K+) товстої кишки, мігрені, травматичного ушкодження Вk-опосередковані струми всієї клітини оцінювали мозку, підвищеного внутрішньочерепного тиску, в умовах фіксації потенціалу шляхом визначення травми спинного мозку, отруєння монооксидом їхньої здатності збільшувати клонований ссавцевуглецю, порушення статевої функції у чоловіків і вий (mSlo або hSIo) Вk-опосередкований струм жінок, нетримання сечі, і особливо інсульту у ссаназовні, гетерологічно експресований в ооцитах вця, що потребує терапевтичного втручання, яке Xenopus [Butler, A. et al., Science. 261. pp.221-224 передбачає введення зазначеному ссавцю тера(1993); Dworetzky, S.I., et al., Моl. Brain Res., 27, певтично ефективної кількості сполуки за формуpp.189-193 (1994)]. Дві зазначені ВK-конструкції лою І або її нетоксичної, фармацевтично прийнятявляють собою майже ідентичні у структурному ної солі, сольвату чи гідрату. відношенні, гомологічні білки, що підтвердили Біологічна активність свою фармакологічну ідентичність у даних досліКалієві (K+) канали являють собою різні в струдах. Для виділення ВK-струму із нативного (фон, ктурному і функціональному відношенні сімейства не-ВK) струму використовували специфічний, поK+-селективних канальних білків, повсюдно наявтужний токсин іберіотоксин (ІВТХ), що блокує ВK 17 77296 18 канали [Galvez, A. et al., J. Biol. Chem. 265. нтами [К. Osborne, et at., J. Neurol Neurosurg. pp.11083-11090 (1990)] при надмаксимальній конPsychiatry. 50, pp.402-410 (1987) і S. Menzies, et at., центрації (50нМ). Відносний внесок ВK-канального Neurosurgerv. 31, pp.100-107, (1992)]. струму в загальний струм назовні визначали шляЕфективність сполуки за формулою II оцінюхом віднімання струму, що залишається при наяввали на моделі центрального паралічу, що передності ІВТХ (не-ВK струм) із профілів струму, отрибачає перманентне перекривання лівої МСА маних в усіх інших умовах експерименту (МСАО) і ССА (ССАО) і тимчасове перекривання (контроль, лікарський засіб і промивання). Було правої ССА у щурів Wistar [Gribkoff, et al., Nature визначено, що при випробуваній концентрації дана Меd. 7, pp.471-477 (2001)]. Ця процедура має нассполука не впливає на не-ВK нативні струми в оолідком стійкий неокортикальний інфаркт великого цитах. Було показано, що сполука за формулою II об'єму, який виміряють шляхом виключення вітапри концентрації 10мкМ збільшує, принаймні, в 5 льного барвника у послідовних зрізах мозку через ооцитах ВK-струм до 170% відносно контрольного 24 години після МСАО. У даному тесті сполуки ІВТХ-чутливого струму. Запис проводили за доповводилися внутрішньовенним і внутрішньочеревмогою стандартної двоелектродної методики фікним шляхом за дві години після перекривання. сації потенціалу [Stuhmer, W. et al., Methods in Наприклад, у цій моделі сполука за формулою II Enzymoloav. 207. pp.319-339 (1992)]; протоколи зменшувала об'єм кортикального інфаркту, прибфіксації потенціалу складалися зі стадій деполялизно, на 28% при її внутрішньовенному введенні ризації тривалістю 500-750мс від потенціалу замиокремим болюсом (0,3мг/кг) через дві години після кання -60мВ до +140мВ з шагом 20мВ. Експеримеперекривання середньої артерії мозку у порівнянні нтальне середовище (модифікований розчин з контрольним введенням носія. Барта) з рН 7,5 складалося із (мМ) NaCI (88), Для визначення здатності сполук згідно з даNaHCO3 (2,4), КСI (1,0), HEPES (10), MgSO4 (0,82), ним винаходом зменшувати кількість ушкоджених Ca(NO3)2 (0,33), CaCI2 (0,41). нейронів після одержання травми голови викорисСполука за формулою (S)-ll або проліки за товували стандартну модель травматичного формулою І вводилися внутрішньовенно, болюсаушкодження головного мозку. Модель травматичми, самцям щурів Sprague-Dawley (n=3 твариного ушкодження головного мозку щура (ТВІ) вини/відтинок часу) з цільовою дозою, еквівалентною користовували для оцінки сполук на ефективність 1мг/кг сполуки за формулою (S)-ll. У кінцевих точлікування або відвертання руйнівних наслідків ках Τ=0,25, 1 і 2 години відтинків часу після вветравм, подібних струсу мозку. Піддослідних щурів дення дози відбирали й екстрагували ацетонітрицієї моделі піддавали анестезії, проводили краніолом зразки загальної крові. Екстракти крові томію (хірургічне розтинання черепа), і в отримааналізували за допомогою LC/MS/MS на рівні споний отвір уводили соляний розчин для створення луки за формулою (S)-ll. У Табл. дано порівняння точного імпульсу збільшеного внутрішньочерепнозрізаних 0,25-2год. AUC-концентрацій сполуки за го тиску (що звичайно зветься рідинно-перкусійним формулою (S)-ll після введення в одному випадку ушкодженням). Через 15 хвилин після травмувансполуки за формулою II, а в іншому випадку - проня тваринам уводили випробувану сполуку в заліків за формулою І. Наприклад, як показано в значених дозах. Через 48 годин після ТВІ тварин Табл., сполуку за формулою (S)-ll виявляли в крові умертвляли. піддослідної тварини після введення проліків за За допомогою рідинно-перкусійного приладу у формулою І. тварин викликали помірне дифузійне ушкодження головного мозку (за визначенням Макінтоша Таблиця [Mclntosh, et al. Neuroscience. 28:233-44, 1989]). Даний прилад дозволяє викликати контузію швидРівні сполуки (S)-ll ким уведенням потоку фізіологічного розчину (під у крові щурів після введення проліків тиском від 2,1 до 2,7 атмосфер] при постійній тривалості (21-23 мілісекунди) у закриту черепну порожнину. Імпульсний приплив фізіологічного розЗрізані AUC-концентрації (0,25чину призводить до короткочасного зсуву і Приклад 2гoд.) (нг·год./мл) сполуки за фордеформування основної кори головного мозку. мулою (S)-ll у крові Вважається, що ця модель імітує клінічну ситуаСполука за фо261 цію, в котрій пацієнт зазнає подібного струсу мозрмулою (S)-ll ку, що характеризується короткочасними невроло5 106 гічними і системними фізіологічними змінами без 2 188 серйозного структурного ушкодження. Рідинно10 135 перкусійний пристрій вчиняє мозкову травму, не впливаючи безпосередньо на мозок. Дифузійне Для визначення здатності сполук згідно з датравмування мозку створювали шляхом відпусним винаходом зменшувати загибель клітин, зумокання з відповідної висоти зваженого (4,8кг) метавлену нейронною ішемією, у щурів Wistar викликалевого маятника [Mclntosh, et al., 1989], котрий бив ли стандартну фокальну церебральну ішемію по закритому пробкою поршню на кінці циліндричшляхом перманентного перекривання лівої середної ємності з оргстекла, заповненої ізотонічним ньої артерії мозку (МСА) і загальної сонної артерії фізіологічним розчином. У закриту черепну порож(ССА) при одночасному перекриванні правої ССА. нину вводили різні об'єми фізіологічного розчину, Операції виконували, користуючись методом Тастворюючи імпульсне збільшення внутрішньочемури [A. Tamura, et al., J. Cereb. Blood Flow Metab.. репного тиску (ІСР). Ступінь травмування регулю1, pp.53-60, (1981)] та його модифікованими варіа 19 77296 20 вали шляхом варіювання висоти відпускання маянадмірною дозою пентабарбіталу натрію (130мг/кг, тника. внутрішньочеревно). У цьому експерименті імпульси тиску вимірюПіддослідні тварини в цих експериментах були вали ззовні черепа за допомогою датчика, розтаподілені на такі групи: групу симуляції (SV), ще шованого у травмувальному приладі. Після анесотримувала тільки носій; групи (TV), що піддаватезії до рідинно-перкусійного приладу щільно лися ТВІ-травмуванню й отримували носій без приєднували травмувальний гвинт і піддослідну ліків; групи симуляції (SD), що отримували тільки тварину травмували у помірному ступеню тяжкості ліки з дозою 0,08мг/кг сполуки згідно з Прикладом (від -2,1 до 2,7атм) по шкалі, розробленій Макін14 (еквівалент дози 0,05мг/кг сполуки за формутошем [Mclntosh, et al., 1989]. Створювані імпульси лою (S)-II); і групи (TD), що піддавалися ТВІреєстрували на осцилографі, який включався за травмуванню й отримували ліки з дозою 0,08мг/кг допомогою фотоелектричного контактора синхсполуки згідно з Прикладом 14). Усі групи симуляронно з відпусканням маятника. Після гідравлічноції служили контрольними зразками для відповідго удару ковпачок, створений травмувальним гвиних ТВІ-груп. Усіх тварин піддавали анастезії й нтом, стальний гвинт і краніопластичний цемент оперуванню. Тварин ТВІ-груп піддавали травмувидаляли, і рану зашивали нерозсмоктуваним ванню головного мозку в моделі бічного гідроудашвом (3-0). Тварин, що перебували під анестезією ру. Ліки починали вводити тваринам через 15 хвипротягом більш ніж 60 секунд після травмування, лин після ТВІ або симуляції травмування. Сполука негайно умертвляли. Щурів витримували на водявважалася ефективною, якщо вона значно зменній рециркуляційній грілці доти, поки у них не норшувала ІСР порівняно з відповідною групою симумалізувалося дихання і вони не приймали амбулаляції травмування в даній точці часу (значущість торний стан. Після цього тварин умертвляли, а їх за ANOVA порівняно з відповідною групою симумозок препарували для оцінки набряку через 48 ляції; значущість за t-тестом). Через п'ять хвилин годин шляхом вимірювання вмісту води згідно з після травмування абсолютний ІСР-тиск (необрометодикою, описаною в [Mclntosh, et at., 1989]. блені дані) зростав на 6,8мм рт.ст. у тварин групи Раніше було показано, що сполука за формуTV порівняно з тваринами групи SV (SV-5,55 порілою (S)-ll дає суттєве зменшення набряку на деківняно з TV-12,35). Протягом наступних 30 хвилин лькох ділянках, суміжних із зоною ударного траввеличина ІСР після ТВІ падала і, кінець кінцем, мування [Cheney, et al. J. Сеr. Blood Flow & Metab. стабілізувалася на рівні 8,55мм рт.ст. (TV) і на рів21:396-403 (2001)]. Сполуки за формулою Іа згідно ні 5мм рт.ст. (SV). Результати групи TD значно з даним винаходом значно зменшують набряк у відрізнялися від результатів групи TV через 45 прилеглій корі головного мозку порівняно з ефекхвилин, 60 хвилин, 2 години, 3 години, 4 години і том, що дає сполука за формулою (S)-ll, коли ту й 24 години після ТВІ, причому найбільш суттєве іншу вводять в еквівалентних молярних дозах в тій падіння тиску (3,1мм рт.ст.) спостерігалося через самій тваринній моделі травмування головного 60 хвилин після травмування (або через 45 хвилин мозку. після введення препарату (TV-8.15 порівняно з TDАльтернативна методика оцінки тяжкості 5,05мм рт.ст.). Середнє зниження ІСР у тварини ушкодження головного мозку полягала у вимірюбуло значно суттєвішим у TD-тварин, ніж у тварин ваннях внутрішньочерепного тиску (ІСР) на різних груп TV через 30 хвилин (-2,85 проти -1,15мм відтинках часу через 24 години після гідравлічного рт.ст.), через 45 хвилин (-3,95 проти -1,35), через удару. При цьому перед тим, як завдавати гідрав60 хвилин (-4,5 проти -1,55), через 2 години {-4,3 лічний удар, свердлили отвір на відстані 1мм від проти -1,95), через 3 години (-4,3 проти 1,8), через стрілоподібного шва з центром у правій тім'яній 4 години (-4,15 проти -1,3) і через 24 години (-3,05 корі головного мозку в 5мм від лямбди і 5мм від проти -0,9) після травмування. При цьому максибрегми. Після рідинно-перкусійного травмування мальне зниження тиску спостерігалося через 60 ковпачок над травмою і краніопластичний цемент хвилин після травмування (і через 45 хвилин після видаляли. Для досягнення адекватних величин введення препарату). Відповідні величини у SDІСР при перебуванні тварини все ще під анастезітварин не відрізнялися суттєво від таких у SVєю краніотомічний ковпачок після гідравлічного тварин протягом часу до 4 годин після симуляції удару повертали в його первинне положення. Зветравмування (-1,5мм рт.ст. у SV проти -2,1мм рху краніотомічного ковпачка поміщали також порт.ст. у SD). Але через 24 години після введення передньо розрізану стерильну фольгу. Зверху фопрепарату зниження ІСР у цих груп слабшало. льги, для ущільнення мозкової порожнини Результати вищеописаних випробувань поканакладали краніопластичний цемент. Для здійсзують, що нові сполуки оксіндолу за даним винанення безперервних вимірювань у висвердлений ходом можуть застосовуватися в лікуванні людини отвір уводили ІСР-зонд, який фіксували краніоплавід розладів, що є наслідком дисфункції поляризастичним цементом. Після цього тварині накладали ції і провідності клітинної мембрани, і в кращому шви (використовуючи 3-0) і поміщали в хоперваріанті є показаними для лікування ішемії, параклітину, щоб надати їй свободу руху під час експелічу, конвульсій, епілепсії, астми, синдрому подрарименту. Потім ІСР-датчик підключали до монітора зненої товстої кишки, мігрені, травм головного моІСР Кодмана (Codman) і проводили безперервні зку, підвищення внутрішньочерепного тиску, травм вимірювання ІСР через 24 години після травмуспинного мозку, отруєння монооксидом вуглецю, вання (ТВІ) i симуляції травмування головного мостатевої дисфункції і нетримання сечі, а також зку. У цей період часу тварина мала регулярний інших захворювань, чутливих до активації ВKдоступ до води та їжі. Через 24 години після ТВІ каналІв. У найкращому варіанті здійснення винаексперимент завершували, і тварин умертвляли ходу сполуки за формулою І є корисними в ліку 21 77296 22 ванні мозкової ішемії й інсульту, травм головного не тільки від таких факторів, як вік, маса, стать мозку і підвищеного внутрішньочерепного тиску. пацієнта і спосіб уведення, але також від бажаного Сполуки за формулою І та їх фармацевтичні ступеню активації калієвих каналів і активності композиції є корисними в лікуванні, полегшенні й конкретної сполуки, що використовується для лікуусуненні різноманітних розладів, пов'язаних з ВKвання конкретного розладу. Передбачається таканалами. До числа таких розладів належать ішекож, що конкретна сполука може вводиться в лімія, інсульт, конвульсії, епілепсія, астма, синдром карській формі з одинарною дозою, яка може бути подразненої товстої кишки, мігрень, травми головвідрегульована фахівцем відповідним чином з ного мозку, підвищений внутрішньочерепний тиск, урахуванням відносного рівня активності. Питання травми спинного мозку, отруєння монооксидом про призначення конкретної дози (i кількості разів вуглецю, статева дисфункція і нетримання сечі, а її введення за день) лежить у компетенції лікаря і також інші розлади, чутливі до засобів відмикання вирішується з урахуванням конкретних обставин, калієвих каналів. що стосуються створення бажаного терапевтичноЗастосовувані в терапії фармакологічно актиго ефекту згідно з даним винаходом. вні сполуки за формулою І передбачається вводиПідхожа доза сполуки за формулою І або фати у формі фармацевтичної композиції, що містить рмацевтичної композиції, що її містить, для ссавця як головний активний компонент, принаймні, одну і, в тому числі, людини, що страждає або імовірно таку сполуку разом із твердим або рідким фармастраждає на той чи Інший серед перелічених тут цевтично прийнятним носієм і, в разі потреби, з розладів, містить активний компонент у кількості, фармацевтично прийнятними ад'ювантами й експриблизно, від 0,1нг/кг до 10мг/кг маси тіла. Для ципієнтами, за допомогою стандартних і звичайних парентерального і, зокрема, внутрішньовенного методів. введення доза може складати від 0,1нг/кг до Фармацевтичними композиціями можуть бути 10мг/кг маси тіла. Активний компонент у кращому підходящі лікарські форми для орального, паренваріанті може вводитися шляхом однієї лише ботерального (включаючи подшкірне, внутрішньом'ялюсної ін'єкції або болюсної ін'єкції з наступним зове, інтрадермальне і внутрішньовенне), бронхіабезперервним вливанням, як безперервно, так і льне і назальне введення. Таким чином, у разі однаковими дозами від одного до чотирьох разів використання твердого носія склад може бути за день. таблетований, поміщений у формі порошку або Проте цілком зрозуміло, що частота прийому гранул у тверду желатинову капсулу, або ж готусполуки визначається лікарем на грунті конкретних ватися у формі пастилки чи таблетки. Твердий обставин, включаючи стан, що піддається лікуванносій може містити звичайні ексципієнти, такі як ню, вибрану для введення сполуку, шлях уведензв'язуючі речовини, наповнювачі, мастила для ня, вік, масу і реакцію пацієнта, а також тяжкість таблетування, дезінтегратори, зволожувачі і т.п. симптомів його хвороби. Таблетка, в разі потреби, може бути покрита плівНижче з метою ілюстрації винаходу розглянукою за допомогою звичайних процесів. Якщо викото приклади його практичного здійснення, які жодристовується рідкий носій, то препарат може готуним чином не обмежують його об'єму та інших ватися у формі сиропу, емульсії, м'якої можливих варіантів його втілення на практиці. желатинової капсули, стерильного носія для ін'єкУ наведених нижче прикладах температура цій, водної або неводної рідкої суспензії, або ж виражена в градусах Цельсія. Величини темпераможе являти собою сухий продукт для розбавлентури плавлення реєструвалися на капілярному ня водою або іншим підхожим носієм перед вжиприладі визначення температур плавлення ванням. Рідкі препарати можуть містити звичайні Gallenkamp; визначені температури не коректувадобавки, такі, як суспендувальні агенти, емульсилися. Магнітний протонний резонанс (1Н ЯМР) фікатори, зволожувачі, неводні носії (включаючи записували на спектрометрі Bruker AC 300. Усі харчові масла), консерванти, а також коригенти спектри знімали в зазначених розчинниках. Хімічні смаку й запаху і барвники. Для парентерального зсуви виражені в одиницях при зниженні поля від введення носій звичайно містить стерильну воду, внутрішнього тетраметилсиланового (TMS) еталопринаймні, значною мірою, хоча як носій можуть ну, а константи міжпротонного зв'язку виражені в використовуватися фізіологічний розчин, розчини Герцах (Гц). Фігури розщеплення позначені таким глюкози, тощо. Можуть використовуватися також чином: с - синглет; д - дублет; т - триплет; кв. суспензії для ін'єкцій, у випадку чого можуть застоквартет; м - мультиплет; уш. - уширений пік; дд совуватися звичайні суспендувальні агенти. До дублет дублету; бд - уширений дублет; дт - дублет лікарських форм для парентерального введення триплету; бс - уширений синглет; д.кв. - дублет можуть добавлятися звичайні консерванти, буфеквартету. Інфрачервоні (IR) спектри визначали, рні засоби і т.п. Особливо ефективним є введення використовуючи бромістий калій (KВr), на спектсполуки за формулою І безпосередньо в парентерометрі Perkin Elmer 781 в межах від 4000см-1 до ральних препаратах. Фармацевтичні композиції 400см-1, відкаліброваному на поглинанні 1601см-1 одержують за допомогою звичайних процесів, що полістирольною плівкою, і виражали у зворотних -1 відповідають бажаному складу, до якого входить сантиметрах (см ). Мас-спектр низького розрізвідповідна кількість активного компонента, тобто няння (MS) і середню молекулярну масу (МН+) або сполуки за формулою І, див., наприклад, (М-Н)+ визначали на приладі Finnigen TSQ 7000. [Remington's Pharmaceutical Sciences. Mack Мас-спектр високого розрізняння визначали на Publishing Company, Easton, PA, 17th edition, 1985]. приладі Krатоs MS50 у режимі FAB, використовуДозування сполук за формулою І для одерючи як внутрішній еталон йодид цезію/гліцерин. жання бажаного терапевтичного ефекту залежить Елементний склад виражений у масових відсотках. 23 77296 24 Нижче описані процеси одержання проміжних фтор-1-оксиметил-6-трифторметил-1,3продуктів і кінцевих сполук згідно з даним винаходигідроіндол-2-он ((S)-IV) дом. Цілком очевидно, що розглянутими в цих До суміші (S)-3-(5-хлор-2-метоксифеніл)-3прикладах варіантами вибору матеріалів і методів фтор-6-трифторметил-1,3-дигідроіндол-2-ону ((S)не обмежуються інші варіанти вибору підходящих ll) (60,0г, 0,167моль) і К2СО3 (27,7г, 0,00моль) у матеріалів і методів, які можуть бути зроблені фаТГФ (600мл) добавили формальдегід (37% розчин хівцем у даній галузі в рамках даного винаходу. в Н2О, 240мл, 3,0моль), і потім Н2О (300мл). Трохи Приклад 1 замутнену суміш перемішували при кімнатній темБіс-трет-бутиламонієва сіль моно[3-(5-хлор-2пературі протягом 3 годин і розбавили діетиловим метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3етером (1000мл). Органічний шар відділили. Воддигідроіндол-1-ілметилового естеру (S)-фосфорної ний шар промили етером {200мл 2). Об'єднаний кислоти; (S)-la органічний шар промили розсолом і висушили над Стадія А. Ди-трет-бутиловий естер-3-(5-хлорNa2SO4. Після випарювання розчинників отримали 2-метоксифеніл)-3-фтор-2-оксо-6-трифторметилзазначену в заголовку сполуку у вигляді сухої піни 2,3-дигідроіндол-1-ілметиловий естер фосфорної білого кольору (64,5г, 99% вихід). LC/MS m/e: 390 кислоти ((S)-lll) (МН+), 96% чистота. 1Н ЯМР (CDCI3): 3,50 (С, У колбу об'ємом 250мл, у котру був поміщений 3Н), 5,08 (м, 1Н), 5,45 (м, 1Н), 6,75 (дд, J=1,5, (3S)-3-{5-хлор-2-метоксифеніл)-3-фтор-66,5Гц, 1Н), 7,04 (м, 1Н), 7,34 (м, (м, 3Η), 7,79 (дд, трифторметил-1,3-дигідроіндол-2-он ((S)-ll) (отриJ=1,0, 3,0Гц, 1Η). маний згідно з U.S. 5,808,095) (2,00г, 5,57ммоль), Стадія В. (S)-3-(5-Хлор-2-метоксифеніл)-1добавили 20мл безводного ацетонітрилу, карбохлорметил-3-фтор-6-трифторметил-1,3нат цезію (2,35г, 7,04ммоль) і хлорметил-ди-третдигідроіндол-2-он ((S)-V) бутилфосфат (2,16г, 8,36ммоль). Реакційну суміш До розчину (S)-3-(5-хлор-2-метоксифеніл)-3перемішували протягом 24 годин при кімнатній фтор-1-оксиметил-6-трифторметил-1,3температурі, після чого розчинник випарили у вадигідроіндол-2-ону ((S)-IV) (64,5г, 0,166моль) в куумі. Сирий залишок, що утворився, очистили за СН2СІ2 (700мл) по краплях добавили РСІ3 (2,0Μ в допомогою флеш-хроматографії (силікагель; 4:1 СН2СІ2, 255,0мл, 0,510моль) при температурі 0°С в гексан:EtOAc), отримавши зазначену в заголовку атмосфері Ν2 протягом 50 хвилин. Отриману сусполуку (2,12г, 65%) у вигляді твердої речовини міш нагріли до кімнатної температури і перемішу1 білого кольору. Н ЯМР (CDCI3 400Мгц): = 7,78 вання продовжували протягом ночі (16 годин). Су(с, 1Н), 7,47 (с, 1Н), 7,34-7,31 (м, 2Н), 7,05 (д, 1Н, міш погасили льодом при температурі 0°С й J=7Гц), 6,74 (д, 1Н, J=7Гц), 5,71 (дд, 1Н, J=12,0, інтенсивно перемішували протягом 30 хвилин. 6,8Гц), 5,59 (дд, 1Н, J=12,0, 6,8Гц), 3,53 (с, 3Н), Органічний шар відділили, а водний шар промили 1,52 (с, 9Н), 1,51 (с, 9Н). СН2СІ2. Об'єднаний органічний шар промили розСтадія В. Біс-трет-бутиламонієва сіль моно[3солом і висушили над Na2SO4. Після хроматогра(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6фії (силікагель, EtOAc/гексан) отримали зазначену трифторметил-2,3-дигідроіндол-1-ілметилового в заголовку сполуку у вигляді сухої піни білого коестеру (S)-фосфорної кислоти; (S)-Іа. льору (42,0г, 62% вихід). 1Н ЯМР (CDCI3): 3,55 (с, У колбу об'ємом 100мл, в яку був поміщений 3H), 5,39 (д, J=10,5Гц, 1Н), 5,95 (д, J=11,0Гц, 1Н), ди-трет-бутиловий естер-3-(5-хлор-26,76 (дд, J=1,5, 9,0Гц, 1Н), 7,08 (м, 2Н), 7,35 (дд, метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3J=1,5, 9,0Гц, 1Н), 7,40 (д, J=8,0Гц, 1Н), 7,78 (дд, дигідроіндол-1-ілметиловий естер фосфорної кисJ=1,0, 2,5Гц, 1Н). лоти ((S)-lll) (0,500г, 0,860ммоль), добавили 10мл Стадія С. Монотетрабутиламонієва сіль Мобезводного дихлорметану і трифтороцтову кислоно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6ту (0,196г, 1,72ммоль). Реакційну суміш поставили трифторметил-2,3-дигідроіндол-1-ілметилового на перемішування при кімнатній температурі проестеру (S)-фосфорної кислоти; (S)-la1 тягом 24 годин. Дихлорметан випарили у вакуумі, Із продажного дигідрофосфату тетрабутилаа утворену сиру піну очистили за допомогою хромонію (Aldrich, 1,0Μ, 1000мл, 1,0моль) видалили матографії з оберненою фазою (С18 Н2О шляхом випарювання при температурі 28°С і 2:1CH3CN:H2O), після чого вільний фосфат, що висушили протягом ночі під високим вакуумом. виділився, розчинили в етилацетаті, і до розчину Залишок повторно розчинили у висушеному ацедобавили mpem-бутиловий амін (0,051г, тонітрилі (4Å, 2500мл). До утвореного розчину по 3,44ммоль). Далі розчинник випарили у вакуумі, краплях добавили розчин (S)-3-(5-xnop-2отримавши зазначену в заголовку сполуку (0,100г, метоксифеніл)-1-хлорметил-3-фтор-619%) у вигляді порошку білого кольору. 1Н ЯМР трифторметил-1,3-дигідроіндол-2-ону ((S)-V) (D2O 500Мгц): = 7,89 (с, 1Н), 7,78 (с, 1Н), 7,50 (м, (42,0г, 0,103моль) в CH3CN (200мл) при темпера2Н), 7,41 (д, 1Н, J=6,4Гц), 7,03 (д, 1Н, J=6,4Гц), турі 0°С в атмосфері Ν2 протягом ЗО хвилин. Реа5,63 (дд, 1Н, J=12,0, 6,8Гц), 5,56 (дд, 1Н, J=12,0, кційну суміш перемішували при температурі 0°С 6,8Гц), 3,56 (с, ЗН), 1,36 (с, 18Н); 31Р ЯМР (D2O протягом ще 30 хвилин. Перемішування продов202Мгц) = 1,68; LRMS [М-Н] 467,9. жували при кімнатній температурі протягом 2,5 Приклад 2 годин, і розчинник видалили. Залишок розчинили в Монотетрабутиламонієва сіль моно[3-(5-хлорСН2СІ2 (1200мл), промили Н2О (4 X 200мл) і вису2-метоксифеніл)-3-фтор-2~оксо-6-трифторметилшили над Na2SO4. Після хроматографії (силіка2,3-дигідроіндол-1-ілметилового естеру (S)гель, МеОН/СН2СІ2) отримали зазначену в заголофосфорної кислоти; (S)-la1 вку сполуку у вигляді твердої речовини білого Стадія А. (S)-3-(5-Хлор-2-метоксифеніл)-3кольору (28,0г, 38% вихід). LC/MS m/е: 470 (МН+), 25 77296 26 2-Фосфоноксипропіловий естер (S)-3-(5-хлор99% чистота. Н ЯМР (D2O): 0,89 (т, J=7,4Гц, 2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил12Н), 1,09 (м, 8Н), 1,58 (м, 8Н), 3,11 (т, J=7,3Гц, 2,3-дигідроіндол-1-карбонової кислоти; ((S)lb, n=2) 8Н), 3,44 (с, 3Н), 5,48 (м, 1Н), 5,59 (м, 1Н), 6,80 (д, Стадія А. 2-(ди-третJ=9,0Гц, 1Н), 6,98 (д, J=7,0Гц, 1Н), 7,16 (д, J=7,5Гц, Бутоксифосфорилокси)пропіловий естер (S)-3-(51Н), 7,06 (д, J=8,5Гц, 1Н), 7,66 (с, 1Н), 7,71 (с, 1Н). хлор-2-метоксифеніл)-3-фтор-2-оксо-6Приклад 3 трифторметил-2,3-дигідроіндол-1-карбонової кисМононатрієва сіль моно[3-(5-хлор-2лоти ((S)-VII. n=2). метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3До розчину (S)-3-(5-хлор-2-метоксифеніл)-3дигідроіндол-1-ілметилового естеру (S)-фосфорної фтор-6-трифторметил-1,3-дигідроіндол-2-ону ((S)кислоти; (S)la2 ll) (720мг, 2ммоль) в дихлорметані по краплях доСмолу Dowex-50wx8-100 (1350г) промили Н2О, бавили фосген (2,2мл, 20% розчин у толуолі, МеОН, Н2О і після цього підлужили до рН>10 роз4ммоль) і піридин (0,6мл). Отриманий (S)-3-(5чином гідроксиду натрію (1,0М). Далі її промили хлор-2-метоксифеніл)-3-фтор-2-оксо-6Н2О до рН ~7, і отриману смолу розділили на три трифторметил-2,3-дигідроіндол-1-карбонілхлоридчастини (~450г кожна). До розчину моно[3-(5-хлорхлорформіат ((S)-VI) перемішували при кімнатній 2-метоксифеніл)-3-фтор-2-оксо-6-трифторметилтемпературі в атмосфері N2 протягом ночі. У при2,3-дигідроіндол-1-ілметилового] естеру (S)готовану реакційну суміш по краплях добавили ще фосфорної кислоти, монотетрабутиламонієвої 0,6мл піридину, після цього добавили ди-третсолі, (S)-la1: (27г, 0,038моль) в 500мл Н2О, добабутиловий естер-3-оксипропіловий естер фосфорвили одну частину смоли (~450г). Суміш переміної кислоти (1,55г, -5,78ммоль), процес приготушували протягом 10 хвилин, відфільтрували і провання якого описаний нижче. Утворену суміш пемили Н2О. В об'єднаний фільтрат добавили ще ремішували при кімнатній температурі ще одну частину смоли. Суміш перемішували протяпротягом години, розбавили дихлорметаном і гом 10 хвилин, відфільтрували і промили Н2О. До промили водою. Органічний шар висушили над цього фільтрату добавили останню частину смоли. Na2SO4 і сконденсували шляхом випарювання. Суміш перемішували протягом 10 хвилин, відфільЗалишок піддали хроматографії на флеш-колонці трували і промили Н2О. Об'єднані фільтрати відіз силікагелем, заповненій сумішшю етилацетатгефільтрували через невеликий шар (1см) С-18 силіксан (4:1 об./об.), і елюювали сумішшю етилацекагелю з оберненою фазою, і промили Н2О. тат:гексан (4:1 ~ 2:1 об./об.), одержавши зазначену Розчинники об'єднаних фільтратів випарили. Зав заголовку сполуку (818мг, 63%). 1Н ЯМР (CDCI3, лишок розчинили в ацетонітрилі і відфільтрували. Ацетонітрил випарили, залишок повторно розчи500Мгц) 10,06 (с, 1Н), 8,31 (с, 1Н), 7,78 (т, 1Н), нили в СН2СІ2, і до розчину добавили гексан. Після 7,43 (д, 1Н), 7,35 (дд, 1Н), 7,07 (д, 1Н), 6,76 (дд, випарювання розчинників отримали зазначену в 1Н), 4,59 (м, 2Н), 4,16 (м, 2Н), 3,52 (с, ЗН), 2,18 (м, заголовку сполуку у вигляді порошку яскраво2Н), 1,48 (с, 18Н); LC-MS, 654,1 (МН+). білого кольору (15,4г, 87% вихід). MS m/e: 468,0 Одержання ди-трет-бутиловий естер-3(М-Н-). LC/MS m/e: 470 (МН+), чистота 98%. Розраоксипропілового естеру фосфорної кислоти хунок для C17H12CIF4NO6PN·1,05Na·0,18H2O: С У колбу об'ємом 100мл добавили ди-трет41,15; Η - 2,51; Ν - 2,82, Na - 4,89. Вимірювання: С бутиловий естер тетра-n-бутиламонійфосфорної - 41,54; Η - 2,50; Ν - 2,70; Na - 4,97. 1Η ЯМР (D2O): кислоти (3,08г, 6,8ммоль), диметилетиленгліколь (10мл) і 3-бром-1-пропанол (свіжодистильований із 3,52 (с, 3Н), 5,56 (м, 1Н), 5,65 (м, 1Н), 6,94 (д, карбонату калію). Реакційну суміш нагріли і кип'яJ=9,0Гц, 1Н), 7,01 (д, J=7,5Гц, 1Н), 7,36 (д, J=7,5Гц, тили зі зворотним холодильником протягом 2,5 1Н), 7,43 (дд, J=1,5, 9,0Гц, 1Н), 7,72 (с, 1Н), 7,79 (с, годин. Після охолодження до кімнатної температу1Н). 13С ЯМР (D2O): 58,79, 67,99 94,03 110,52 ри реакційну суміш розбавили етиловим етером 116,42 124,01 126,38, 128,04, 128,35, 128,49, (60мл) і витримували в холодильнику, аж поки в 128,74, 131,48, 133,52, 135,98, 145,96, 156,38, осад не випала тверда речовина білого кольору. 175,98. 19F ЯМР (D2O): -63,0, -164. 31Ρ ЯМР Тверду речовину відфільтрували через целіт, а (D2O): 0,12. 0,12. IR (KBr, см-1): 3433, 1756, 1319, 20 фільтрат випарили у вакуумі, отримавши зазначе1131, 1026. [ ] (Η2Ο) +131,95. Хіральний аналіз ну в заголовку сполуку у вигляді прозорого масла методом капілярного електрофорезу (СЕ) показав (1,85г, -100%). 1Н ЯМР (CDCI3, 500Мгц) 4,10 (м, 99+% (S)-ізомер. 2Н),3,73(м, 2Н), 1,84 (м,2Н), 1,46 (с, 18Н). Приклад 4 Стадія В. 2-Фосфоноксипропіловий естер (S)Мононатрієва сіль моно[3-(5-хлор-23-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3трифторметил-2,3-дигідроіндол-1-карбонової кисдигідроіндол-1-ілметилового естеру (R)2 лоти; ((S)-lb. n=2). фосфорної кислоти; (R)-la Розчин 2-(ди-третБеручи за вихідний матеріал (R)-3-(5-хлор-2бутоксифосфорилокси)пропілового естеру (S)-3метоксифеніл)-3-фтор-6-трифторметил-1,3(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6дигідроіндол-2-он ((R)-H) (отриманий у відповіднотрифторметил-2,3-дигідроіндол-1-карбонової киссті з U.S. 5,602,169), зазначену в заголовку сполулоти ((S)-VII, n=2) (540мг, 0,82ммоль) у дихлормеку отримують за допомогою загальних процесів, тані (30мл) перемішували з трифтороцтовою кисописаних у Прикладах 2 і 3. [ ]20 (Н2О) -104,42. лотою (0,6мл) при кімнатній температурі протягом Хіральний аналіз методом капілярного електро3 годин. Час завершення реакції визначали за дофорезу (СЕ) показав 89% (R)-ізомep і 10% (S)помогою LC-MS (рідинної хроматографії високої ізомep з 1% неідентифікованої речовини. розрізнювальної спроможності + масПриклад 5 1 27 77296 28 спектрометрії). Після видалення розчинника залиілметиловий естер (S)-(2-оксіетилкарбамІнової шок розчинили в метанолі, і сирий продукт очискислоти ((S)-IX. n=1). тили за допомогою препаративної HPLC, отримаУ круглодонну колбу об'ємом 25мл, у котру був вши зазначену в заголовку сполуку в кількості поміщений (S)-3-(5-хлор-2-метоксифеніл)-3-фтор255мг (вихід 57 %) у вигляді твердої речовини бі1-оксиметил-6-трифторметил-1,3-дигідроіндол-21 лого кольору після ліофілізації. Н ЯМР (CDCl3, он ((S)-IV) (0,397г, 1,02ммоль), добавили 5мл безводного дихлорметану, триетиламін (0,004г, 500Мгц) 8,07 (с, 1Н), 7,73 (д, 1Н), 7,42 (д, 1Н), 2,04ммоль) і 4-нітрофенілхлорформіат (0,046г, 7,32 (д, 1Н), 7,07 (д, 1Н), 6,75 (д, 1Н), 4,50 (уш., 6Н, 1,02ммоль). Реакційну суміш поставили на перещо містив деяку кількість Н2О як сольват), 4,54 (м, мішування протягом ночі при кімнатній температу2Н), 4,17 (уш., 2Н), 3,49 (с, 3Н), 2,1 (м, 2Н); MS рі, в результаті чого отримали 3-(5-хлор-2(m/e) 539,92 (М+-1); LC-MS, 542 (МН+, 98,5%); 31Р метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3ЯМР (CDCI3, 500Мгц) 2,03; 19F ЯМР (CDCI3, дигідроіндол-1-ілметиловий естер-4500Мгц) -63,4,153,8; Розрахунок для нітрофеніловий естер вугільної кислоти (VIII). ПісC20H17CIF4NO8P: С - 44,34%, Η - 3,16%, Ν - 2,58%; ля цього добавили 2-аміноетанол (0,186г, Вимірювання: С - 44,01%, Η - 3,11%, Ν - 2,45%. 3,05ммоль), і реакційну суміш поставили на переПриклад 6 мішування протягом ще 24 годин. Розчинник вида2-Фосфоноксіетиловий естер (S)-3-(5-хлор-2лили у вакуумі, а сирий залишок очистили за дометоксифеніл-3-фтор-2-оксо-6-трифторметил-2,3помогою колонної хроматографії (силікагель; від дигідроіндол-1-карбонової кислоти: (S)-lb. n=1) 1:1 гексан:ЕtOАс до 4:1 ЕtOАс:гексан), одержавши Стадія А. 2-(ди-трет0,050г (51%) зазначеної в заголовку сполуки. 1H Бутоксифосфорилоксі)етиловий естер (S)-3-{5ЯМР (CDCI3 400Мгц): = 7,78 (с, 1Н), 7,51 (с, 1Н), хлор-2-метоксифеніл)-3-фтор-2-оксо-67,33 (д, 2Н, J=7Гц), 7,02 (д, 1Н, J=7Гц), 6,74 (д, 1Н, трифторметил-2,3-дигідроіндол-1-карбонової кисJ=7Гц), 5,88 (д, 1Н, J=12Гц), 5,83 (д, 1Н, J=12Гц), лоти ((S)-VII. n=1). 3,75 (м, 2Н), 3,50 (с, 3Н), 3,39 (м, 2Н, J=7Гц). Зазначену в заголовку сполуку готували так Стадія В. 3-{5-Хлор-2-метоксифеніл)-3-фтор-2само, як 2-(ди-третоксо-6-трифторметил-2,3-дигідроіндол-1бутоксифосфорилокси)пропіловий естер (S)-3-(5ілметиловий естер (S)-[2-(ди-третхлор-2-метоксифеніл)-3-фтор-2-оксо-6бутоксифосфорилоксі)етилкарбамінової кислоти; трифторметил-2,3-дигідроіндол-1-карбонової кис((S)-X, n=1). лоти ((S)-VII, n=2), використовуючи ди-третУ грушоподібну колбу об'ємом 25мл, у котру бутиловий естер-2-оксіетиловий естер фосфорної був поміщений 3-(5-хлор-2-метоксифеніл)-3-фторкислоти й отримуючи продукт з 52% виходом. 1Н 2-оксо-6-трифторметил-2,3-дигідроіндол-1ЯМР (CDCI3, 500Мгц) 8,09 (с, 1Н), 7,77 (д, 1Н), ілметиловий естер (S)-(2-оксіетил)карбамінової 7,43 (д, 1Н), 7,35 (д, 1Н), 7,07 (д, 1Н), 6,75 (д, 1Н), кислоти ((S)-IX, n=1) (0,050г, 0,526ммоль), добави4,67 {м, 2Н), 4,31 {м, 2Н), 3,53 (с, ЗН), 1,47 (с, 18Н); ли 3мл безводного дихлорметану, 1Н-тетразол LC-MS, 640,15 (МН+, 96); 31Р ЯМР (CDCI3, 500Мгц) (0,110г 1,58ммоль), 4-ДМФА (0,026г, 0,01ммоль) і -8,71; 19F ЯМР (CDCI3, 500Мгц) -63,3, 153,6. ди-трет-бутилдіізопропілфосфорамідит (0,091г, Стадія В. Фосфоноксіетиловий естер (S)-3-(51,05ммоль). Реакційну суміш перемішували протяхлор-2-метоксифеніл)-3-фтор-2-оксо-6гом 2 годин при кімнатній температурі, після чого її трифторметил-2,3-дигідроіндол-1-карбонової кисохолодили до температури 0°С, добавили 30% лоти 2-: (S)-lb. n=1) водний розчин пероксиду водню (0,7мл), і реакційВикористовуючи як вихідний матеріал 2-(дину суміш перемішували ще протягом години. Ортрет-бутоксифосфорилоксі)етиловий естер (S)-3ганічний шар відділили, висушили (Na2SO4) і випа(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6рили у вакуумі. Утворене сире масло очистили за трифторметил-2,3-дигідроіндол-1-карбонової кисдопомогою флеш-хроматографії (силікагель, від лоти ((S)-VII, n=1) і процес, аналогічний тому, що 1:1 ЕtOАс:гексан до 2:1 ЕtOАс:гексан), одержавши використовувався для одержання 20,080г (80%) зазначеної в заголовку сполуки. 1Н фосфоноксипропілового естеру (S)-3-(5-хлор-2ЯМР (CDCI3 400Мгц): = 7,78 (с, 1Н), 7,49 (с, 1Н), метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,37,32 (д, 2Н, J=7Гц), 7,05 (д, 1Н, J=7Гц), 6,74 (д, 1Н, дигідроіндол-1-карбонової кислоти, ((S)-lb, n=2), J=7Гц), 5,84 (дд, 2Н, 12Гц), 4,05 (м, 2Н), 3,51 (с, була одержана зазначена в заголовку сполука з 3Н), 3,48 (м, 2Н), 1,46 (с, 9Н), 1,45 (с, 9Н). виходом 83%. 1Н ЯМР (CDCI3, 500Мгц) 8,03 (с, Стадія С. 3-(5-Хлор-2-метоксифеніл)-3-фтор-21Н), 7,73 (д, 1Н), 7,45 (д, 1Н), 7,30 (д, 1Н), 7,08 (д, оксо-6-трифторметил-2,3-дигідроіндол-11Н), 6,75 (д, 1Н), 4,59 (м, 2Н), 4,33 (м, 2Н), 3,51 (с, ілметиловий естер (S)-[23Н); MS (m/e) 525,95 (М+-1); 31Р ЯМР (CDCI3, 19 фосфоноксіетил)карбамінової кислоти; (S)-lc. n=1). 500Мгц) 1,87; F ЯМР (CDCI3, 500Мгц) -63,05, У грушоподібну колбу об'ємом 25мл, у котру 153,8. Розрахунок для C19H15CIF4NO8P·1,159H2O: був поміщений 3-(5-хлор-2-метоксифеніл)-3-фторС - 41,60%, Η - 3,18%, Ν - 2,55%. Вимірювання: С 2-оксо-6-трифторметил-2,3-дигідроіндол-141,57%, Η - 2,92%, Ν - 2,51%. ілметиловий естер естер-(S)-[2-(ди-третПриклад 7 бутоксифосфорилоксі)етил]карбамінової кислоти 3-(5-Хлор-2-метоксифеніл)-3-фтор-2-оксо-6((S)-X, n=1) (0,080г, 0,419ммоль), добавили 5мл трифторметил-2,3-дигідроіндол-1-ілметиловий безводного дихлорметану і трифтороцтову кислоестер (S)-(2-фосфоноксіетил)карбамінової кислоту (0,143г, 1,06ммоль). Реакційну суміш перемішути; ((S)-lc, n=1) вали протягом 3 годин при кімнатній температурі, Стадія А. 3-(5-Хлор-2-метоксифеніл-3-фтор-2органічний шар випарили у вакуумі, і утворену оксо-6-трифторметил-2,3-дигідроіндол-1 29 77296 30 сиру піну витримали під високим вакуумом протяоксо-6-трифторметил-2,3-дигідроіндол-1гом ночі. Одержаний у результаті порошок білого ілметиловий естер (S)-фосфоноксіоцтової кислокольору очистили за допомогою хроматографії з ти; (S)-ld. n=1) оберненою фазою (С18; 1:1CH3CN:H2O), отримавУ колбу об'ємом 25мл, у котру був поміщений ши зазначену в заголовку сполуку (0,134г, 58%) у 3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-61 вигляді порошку білого кольору. Н ЯМР (D2O трифторметил-2,3-дигідроіндол-1-ілметиловий естер (S)-гідроксіоцтової кислоти ((S)-XI) (0,144г, 400Мгц): = 7,88 (Si 1Н), 7,74 (с, 1Н), 7,50 (м, 2Н), 0,025ммоль) добавили 4мл безводного дихлорме7,40 (д, 1Н, J=7Гц), 7,00 (д, 1Н, J=7Гц), 5,99 (д, 1Н, тану і трифтороцтову кислоту (0,077г, J=12Гц), 5,77 (д, 1Н, J=12Гц), 3,90 (м, 2Н), 3,48 (с, 0,675ммоль). Реакційну суміш поставили на пере3Н), 3,39 (м, 2Н); LRMS [М-Н]- 554,91, [Μ+ΝΗ4]+ мішування при кімнатній температурі протягом 3 574,0. годин. Дихлорметан випарили у вакуумі, а сиру Приклад 8 піну, що утворилася, очистили за допомогою хро3-(5-Хлор-2-метоксифеніл)-3-фтор-2-оксо-6матографії з оберненою фазою (С18СН3СN:Н2О трифторметил-2,3-дигідроіндол-1-ілметиловий 1:1), отримавши зазначену в заголовку сполуку естер (S)-фосфоноксіоцтової кислоти; ((S)-ld, n=1) (0,075г, 63%) у вигляді порошку білого кольору. 1Н Стадія А. 3-(5-хлор-2-метоксифеніл)-3-фтор-2ЯМР (CD3OD 400Мгц): = 7,73 (с, 1Н), 7,74 (с, оксо-6-трифторметил-2,3-дигідроіндол-1ілмегиловий естер (S)-гідроксіоцтової кислоти 1Н), 7,62 (с, 1Н), 7,43-7,40 (м, 2Н), 7,33 (д, 1Н, ((S)-XI) J=7Гц), 6,95 (д, 1Н, J=7Гц), 6,05 (д, 1Н, J=11,0Гц), У колбу об'ємом 10мл, у котру був поміщений 5,96 (д, 1Н, J=11,0Гц), 4,62 (д, 2Н, J=9,6Гц), 3,52 (с, (S)-3-(5-хлор-2-метоксифеніл)-1-хлорметил-33Н); 31Р ЯМР (CD3OD 162Мгц) = 0,89; 19F ЯМР фтор-6-трифторметил-1,3-дигідроіндол-2-он ((S)(CD3OD 376Мгц) = -64,7, -160,9; LRMS [M-H]+ V) (0,000г, 0,489ммоль), добавили 3мл безводного 525,84, [Μ+ΝΗ4] 545,0. ацетонітрилу, гліколеву кислоту (0,045г, Приклад 9 0,588ммоль) і карбонат цезію (0,079г, 0,045ммоль). Фосфоноксиметиловий естер (S)-3-(5-хлор-2Реакційну суміш перемішували протягом 36 годин метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3при кімнатній температурі, після чого органічний дигідроіндол-1-карбонової кислоти; (S)-le) шар розбавили 5мл діетилового етеру, і органічСтадія A. Хлорметиловий естер (S)-3-(5-хлорний розчин декантували від твердого хлориду це2-метоксифеніл)-3-фтор-2-оксо-6-трифторметилзію. Розчинник випарили у вакуумі, а утворену піну 2,3-дигідроіндол-1-карбонової кислоти, ((S)-XII). білого кольору очистили за допомогою флешУ колбу об'ємом 10мл, у котру був поміщений хроматографії (силікагель, гексан:ацетон 4:1), (S)-3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-Єотримавши зазначену в заголовку сполуку (0,126г, трифторметил-1,3-дигідроіндол-2-он(S)-ІІ (0,400г, 58%) у вигляді порошку білого кольору. 1Н ЯМР 1,1ммоль), добавили 6мл безводного дихлормета(CDCI3 400Мгц): = 7,79 (с, 1Н), 7,38-7,33 (м, 3Н), ну, триетиламін (0,167г, 1,67ммоль) і хлорметилх7,06 (д, 1Н, J=7Гц), 6,75 (д, 1Н, J=7Гц), 5,99 (д, 1Н, лорформіат (0,171г, 1,33ммоль). Реакційну суміш J=12Гц), 5,91 (д, 1Н, J=12Гц), 4,06 (с, 2Н), 3,49 (с, перемішували протягом 24 годин при кімнатній 3Н). температурі, після чого органічний шар розбавили Стадія В. 3-(5-Хлор-2-метоксифеніл)-3-фтор-275мл діетилового етеру, і твердий триетиламінгідоксо-6-трифторметил-2,3-дигідроіндол-1рохлорид відфільтрували через целіт. Розчинник ілметиловий естер (ди-третвипарили у вакуумі, а зазначену в заголовку спобутоксифосфорилоксі)оцтової кислоти ((S)-XII). луку (0,414г, 83%) використовували в наступних за У колбу об'ємом 25мл, у котру був поміщений цим реакціях без очистки. 1Н ЯМР (CDCI3 400Мгц): 3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6= 8,36 (с, 1Н), 7,79 (с, 1Н), 7,49 (д, 1Н, J=7Гц), трифторметил-2,3-дигідроіндол-1-ілметиловий 7,36 (д, 1Н, J=7Гц), 7,34 (д, 1Н, J=7Гц), 6,77 (д, 1Н, естер (S)-гідроксіоцтової кислоти ((S)-XI) (0,126г, J=7Гц), 6,10 (д, 1Н, J=6,4Гц), 5,96 (д, 1Н, J=6,4Гц), 0,082ммоль) добавили 3мл безводного дихлорме3,56 (с, 3Н). тану, 1Н-тетразол (0,059г, 0,846ммоль), 4Стадія В. Йодметиловий естер 3-(5-хлор-2диметиламінопіридин (0,0138г, 0,113ммоль) і диметоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3трет-бутил-діізопропілфосфорамідит (0,156г, дигідроіндол-1-карбонової кислоти; ((S)-XIV). 0,560ммоль). Реакційну суміш поставили на переУ колбу об'ємом 25мл, у котру був поміщений мішування при кімнатній температурі протягом 2 хлорметиловий естер (S)-3-(5-хлор-2годин, після чого її охолодили до температури 0°С, метоксифенІл)-3-фтор-2-оксо-6-трифторметил-2,3добавили 30% пероксиду водню (0,8мл), і реакційдигідроіндол-1-карбонової кислоти ((S)-XII) (0,633г, ну суміш інтенсивно перемішували ще протягом 2 1,40ммоль), добавили 6мл безводного ацетону і годин. Органічний шар відділили, промили дистийодистий натрій (0,314г, 2,10ммоль). Реакційну льованою водою, висушили (Na2SO4) і випарили у суміш нагріли і кип'ятили зі зворотним холодильвакуумі. Сиру піну очистили за допомогою флешником при перемішуванні протягом 4 годин. Після хроматографії (силікагель, гексан:ЕtOАс 4:1), цього суміш охолодили до кімнатної температури, і отримавши зазначену в заголовку сполуку (0,144г, розчинник випарили у вакуумі. Сире масло, що 80%) у вигляді порошку білого кольору. 1Н ЯМР утворилося, розчинили в дихлорметані і промили (CDCI3 400Мгц): = 7,78 (с, 1Н), 7,36-7,33 (м, 3Н), 1% водним розчином тіосульфату натрію. Органіч7,06 (д, 1Н, J=7Гц), 6,75 (д, 1Н, J=7Гц), 5,99 (д, 1Н, ний шар відділили, висушили (Na2SO4) і випарили J=12Гц), 5,89 (д, 1Н, J=12Гц), 4,58 (д, 2Н, J=8,6Гц), у вакуумі, отримавши зазначену в заголовку спо3,52 (с, 3Н), 1,47 (с, 18Н). луку (0,640г, 84%), котру використовували в подаСтадіяС. 3-(5-Хлор-2-метоксифеніл)-3-фтор-2льших реакціях без очистки. 1Н ЯМР (CDCI3 31 77296 32 ник випарили у вакуумі, а створену піну білого ко400Мгц): = 8,38 (с, 1Н), 7,78 (с, 1Н), 7,48 (д, 1Н, льору очистили за допомогою флешJ=7Гц), 7,36 (д, 1Н, J=7Гц), 7,31 (д, 1Н, J=7Гц), хроматографії (силікагель, гексан:ацетон 3:1), 6,77 (д, 1Н, J=7Гц), 6,08 (д, 1Н, J=6,4Гц), 6,18 (д, отримавши зазначену в заголовку сполуку (0,115г, 1Н, J=6,4Гц), 3,56 (с, 3Н). 46%) у вигляді порошку білого кольору. 1Н ЯМР Стадія С. ди-третБутоксифосфорилоксиметиловий естер (S)-3-(5(CDCI3 400Мгц): = 7,79 (с, 1Н), 7,37-7,32 (м, 3Н), хлор-2-метоксифеніл)-3-фтор-2-оксо-67,05 (д, 1Н, J=7Гц), 6,75 (д, 1Н, J=7Гц), 5,93 (д, 1Н, трифторметил-2,3-дигідроіндол-1-карбонової кисJ=12Гц), 5,85 (д, 1Н, J=12Гц), 3,92 (т, 2Н, J=7Гц), лоти ((S)-XV). 3,51 (с, 3Н), 2,66 (т, 2Н, J=7Гц). У колбу об'ємом 25мл, у котру був поміщений Стадія В. 3-(5-Хлор-2-метоксифеніл)-3-фтор-2йодметиловий естер 3-(5-хлор-2-метоксифеніл)-3оксо-6-трифторметил-2,3-дигідроїндол-1фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1ілметиловий естер (S)-3-(ди-треткарбонової кислоти ((S)-XIV) (0,000г, 0,368ммоль), бутоксифосфорилокси)пропіонової кислоти ((S)добавили 5мл безводного тетрагідрофурану і диXVII. n=1) трет-бутилфосфат тетрабутиламонію (0,199г, У колбу об'ємом 25мл, у котру був поміщений 0,441ммоль). Реакційну суміш нагріли і кип'ятили зі 3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6зворотним холодильником при перемішуванні протрифторметил-2,3-дигідроіндол-1-ілметиловий тягом 1 години. Після цього суміш охолодили до естер (S)-S-оксипропіонової кислоти ((S)-XVI, n=1) кімнатної температури, і розчинник випарили у (0,115г, 0,049ммоль), добавили 4мл безводного вакуумі. Сиру піну очистили за допомогою флешдихлорметану, 1Н-тетразол (0,052г, 0,747ммоль), хроматографії (силікагель, гексан:ЕtOАс 4:1), 4-диметиламінопіридин (0,012г, 0,099ммоль) і диотримавши зазначену в заголовку сполуку (0,110г, трет-бутил-діізопропілфосфорамідит (0,138г, 48%) у вигляді прозорого безколірного масла. 1Н 0,498ммоль). Реакційну суміш поставили на перемішування при кімнатній температурі протягом 2 ЯМР (CDCI3 400Мгц): = 8,35 (с, 1Н), 7,78 (с, 1Н), годин. Після цього реакційну суміш охолодили до 7,48 (д, 1Н, J=7Гц), 7,34 (д, 1Н, J=7Гц), 7,30 (д, 1Н, температури 0°С, добавили до неї 30% пероксиду J=7Гц), 6,76 (д, 1Н, J=7Гц), 5,90 (д, 1Н, J=12,4Гц), водню (0,8мл) і реакційну суміш інтенсивно пере3,53 (с, 3Н), 1,50 (с, 18Н). мішували ще протягом 2 годин. Органічний шар Стадія D. Фосфоноксиметиловий естер (S)-3відділили, промили дистильованою водою, вису(5-Хлор-2-метоксифеніл)-3-фтор-2-оксо-6шили (Na2SO4) і випарили у вакуумі. Сиру піну трифторметил-2,3-дигідроіндол-1-карбонової кисочистили за допомогою флеш-хроматографії (силоти; (S)-le) лікагель, гексан:ЕtOАс 4:1), отримавши зазначену У колбу об'ємом 25мл, у котру був поміщений в заголовку сполуку (0,144г, 88%) у вигляді порошди-трет-бутоксифосфорилоксиметиловий естер (S)-3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6ку білого кольору. 1Н ЯМР (CDCI3 400Мгц): = 7,78 трифторметил-2,3-дигідроіндол-1-карбонової кис(с, 1Н), 7,36-7,32 (м, 3Н), 7,06 (д, 1Н, J=7Гц), 6,75 лоти ((S)-XV) (0,110г, 0,176ммоль), добавили 2мл (д, 1Н, J=7Гц), 5,90 (д, 1Н, J=12Гц), 5,84 (д, 1Н, безводного дихлорметану і трифтороцтову кислоJ=12Гц), 4,05 (кв, 2Н, J=7,6, 6,4Гц), 3,51 (с, 3Н), ту (0,060г, 0,527ммоль). Реакційну суміш постави2,77 (т, 2Η, J=6,4Гц), 1,46 (с, 18Н). ли на перемішування при кімнатній температурі Стадія С. 3-(5-Хлор-2-метоксифеніл)-3-фтор-2протягом 4 годин. Дихлорметан випарили у вакууоксо-6-трифторметил-2,3-дигідроіндол-1мі, а сиру піну, що утворилася, очистили за допоілметиловий естер (S)-3-фосфоноксипропіонової могою хроматографії з оберненою фазою кислоти; (S)-lf, n=1). (С18CH3CN:H2O 2:1), отримавши зазначену в загоУ колбу об'ємом 25мл, у котру був поміщений ловку сполуку (0,070г, 78%) у вигляді порошку бі3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6трифторметил-2,3-дигідроіндол-1-ілметиловий лого кольору. 1Н ЯМР (CDCI3 400Мгц): = 8,06 (с, естер (S)-3-(ди-трет-бутоксифосфорилокси)1Н), 7,68 (с, 1Н), 7,45 (д, 1Н, J=7Гц), 7,08-7,04 (м, пропіонової кислоти ((S)-XVII, n=1) (0,144г, 2Н), 6,72 (д, 1Н, J=7Гц), 5,90-5,81 (м, 2Н), 3,48 (с, 0,02ммоль), добавили 2мл безводного дихлорме3Н); 31Р ЯМР (CDCI3 162Мгц) = -0,033; 19F ЯМР тану і трифтороцтову кислоту (0,075г, 0,66ммоль). (CDCI3 376Мгц) = -63,3, -153,8; LRMS [M-H]Реакційну суміш поставили на перемішування при 511,4, [M+NH4]+ 530,9. кімнатній температурі протягом 4 годин. ДихлорПриклад 10 метан випарили у вакуумі, а сиру піну, що зали3-(5-Хлор-2-метоксифеніл)-3-фтор-2-оксо-6шилася, очистили за допомогою хроматографії з трифторметил-2,3-дигідроіндол-1-ілметиловий оберненою фазою (С18CH3CN:H2O 2:1), отримавши естер (S)-3-фосфоноксипропіонової кислоти; ((S)зазначену в заголовку сполуку (0,070г, 59%) у виlf, n=1) гляді порошку білого кольору. 1Н ЯМР (CDCI3 Стадія А. 3-(5-Хлор-2-метоксифеніл)-3-фтор-2400Мгц): = 7,70 (с, 1Н), 7,36 (с, 1Н), 7,32-7,07 (м, оксо-6-трифторметил-2,3-дигідроіндол-13Н), 7,00 (д, 1Н, J=6Гц), 6,73 (д, 1Н, J=8Гц), 5,91 (д, ілметиловий естер (S)-3-гідроксипропіонової кис1Н, J=11,0Гц), 5,73 (д, 1Н, J=11,0Гц), 4,07 (м, 2Н), лоти, ((S)-XVI, n=1) 31 3,44 (с, 3Н), 2,75 (м, 2Н); Р ЯМР (CDCI3 162Мгц) У колбу об'ємом 10мл, у котру був поміщений (S)-3-(5-хлор-2-метоксифеніл)-1-хлорметил-3= 1,15; 19F ЯМР (CDCI3 376Мгц) = -63,0, -159,4; фтор-6-трифторметил-1,3-дигідроіндол-2-он ((S)LRMS [Μ-Η]- 539,89, [M+NH4]+ 564,1. V) (0,023г, 0,546ммоль), добавили 3мл безводного Приклад 11 ацетонітрилу і пропаноат цезію (0,182г, Тринатрієва сіль3-(5-хлор-2-метоксифеніл)-30,819ммоль). Реакційну суміш перемішували профтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1тягом 24 годин при кімнатній температурі. Розчинілметилового естеру (S)-пірофосфорної кислоти; 33 77296 34 ((S)-lg2, M+ = Na+) жавши зазначену в заголовку сполуку у вигляді Стадія А. 3-(5-Хлор-2-метоксифеніл)-3-фтор-2склоподібного масла, котре застосовували безпооксо-6-трифторметил-2,3-дигідроіндол-1середньо у наступній за цим іонообмінній реакції. ілметиловий естер (3S)-пірофосфорної кислоти, Стадія В. Мононатрієва сіль [3-(5-хлор-2трис(тетрабутиламонієва) сіль; ((S)-lg1, R=n-бутил) метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3Розчин (S)-3-(5-хлор-2-метоксифеніл)-1дигідроіндол-1-ілметиловий естер]метилового есхлорметил-3-фтор-6-трифторметил-1,3теру (S)-фосфорної кислоти; ((S)-lh2, М+ = Na+, R1 дигідроіндол-2-ону ((S)-V) (0,45г, 1,15ммоль) і = СН3) трис-(тетрабутиламоній)гідропірофосфат (1,04г, Описану вище амонієву сіль, тобто монотет1,15ммоль) змішали в CH3CN (25мл) і перемішурабутиламонієву сіль [3-(5-хлор-2-метоксифеніл)вали при кімнатній температурі протягом, прибли3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1зно, 45 хвилин. Розчинник видалили під зниженим ілметиловий естер]метилового естеру (S)тиском, а маслянистий залишок відфільтрували фосфорної кислоти ((S)-lh1, R=nBu, R1 = СН3)) розчерез подушку С-18 силікагелю з оберненою фачинили в деіонізованій Н2О і помістили на колонку зою при елююванні сумішшю CH3CN/H2O (1:1). з іонообмінною смолою (DOWEX 50WX8-200, тип Розчинники видалили у вакуумі, а залишок очисNa4+). Фракції, що містили зазначену в назві сполутили за допомогою флеш-хроматографії (SiO2) з ку, ліофілізували, одержавши тверду речовину елююванням сумішшю iPrOH/NH4OH (70:30), одебілого кольору (1,02г, 72% за дві стадії). Спектр ржавши в результаті зазначену в заголовку сполупротонного ЯМР залежав від концентрації. 1Н ЯМР ку у вигляді склоподібного масла, яке використо(500Мгц, D2O, 95%. Розрахунок для 1Н) 7,89 (с, 1Н). Р ЯМР (200Мгц, D2O) 0,03 (муC17H12CIF4NO6PN·1,6C4H12N·0,8H2O: С - 46,7; Η льтиплет). 19F ЯМР (470Мгц, D2O) -63,1 (с), -161,1 5,50; Ν - 6,05. Вимірювання: С - 47,03; Η - 5,84; Ν (с) LRMS: 496 (М-Н). Приклади 14-24 5,74. 1Η ЯМР (D2O): 3,14 (с, 19,0Н), 3,52 (с, 3Н), Загальний процес одержання солей 5,50 (м, 1Н), 5,53 (м, 1Н), 6,96 (д, J=9,0Гц, 1Н), 7,40 Смолу Dowex-50wx8-100 промили Н2О, МеОН, (м, 1Н), 7,45 (м, 2Н), 7,75 (с, 1Н), 7,84 (с, 1Н). IR знову Н2О згідно з рекомендаціями виробника (KBr1 см-1): 3429, 1752, 1319, 1129. (Aldrich), підлужили її до рН>10 розчином гідроокПриклад 16 сиду натрію (або тетраметиламонію) (або ж оброГліцинова сіль моно[3-(5-хлор-2-метоксибляли амінокислотою чи органічними амінами), феніл)-3-фтор-2-оксо-6-трифторметил-2,3після чого промили Н2О. Приготовану до застосудигідроіндол-1-ілметилового естеру (s)-фосфорної вання смолу спочатку розділили на три однакові кислоти; (S)-la2 порції. У розчин монотетрабутиламонієвої солі Дотримуючись описаного вище загального моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-6процесу і використовуючи 20г смоли Dowexтрифторметил-2,3-дигідроіндол-1-ілметилового] 50wx8-100 і гліцину (7,5г), одержали 0,156г гліциестеру (S)-фосфорної кислоти в Н2О додали одну нової солі (порошок білого кольору) (94% вихід) із порцію смоли. Суміш перемішували протягом 10 монотетрабутиламонійної солі моно[3-(5-хлор-2хвилин, відфільтрували і промили Н2О. В об'єднаметоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3ний фільтрат додали ще одну порцію смоли. Судигідроіндол-1-iлметилового] естеру (S)міш перемішували протягом 10 хвилин, відфільтфосфорної кислоти, (0,20г, 0,28ммоль). MS m/е: рували і промили Н2О. В одержаний фільтрат 468,0 (М-Н-). Розрахунок для додали останню порцію смоли. Суміш перемішуC17H12CIF4NO6PN·1,42C2H6NO2·0,80H2O: С - 40,31; вали протягом 10 хвилин, відфільтрували і промиΗ - 3,77; Ν - 5,73. Вимірювання; С - 40,57; Η - 3,59; ли Н2О. Розчинники об'єднаних фільтратів випаΝ - 5,41. 1Η ЯМР (D2O): 3,58 (с, 3Н), 3,65 (с, 2,8 рили. Залишок розчинили в ацетонітрилі і Η), 5,63 (м, 1Н), 5,71 (м, 1Н), 7,03 (д, J=9,0Гц, 1Н), відфільтрували для видалення слідів нерозчинно7,42 (д, J=7,0, 1Н), 7,52 (м, 2Н), 7,75 (с, 1Н), 7,92 го продукту. Ацетонітрил випарили. Залишок по(с, 1Н). IR (КВr, см-1): 3431, 1759, 1319, 1131, 1023. вторно розчинили в СН2СІ2. Після цього добавили Приклад 17 гексан. Після випарювання розчинників був одерПролінова сіль моно[3-(5-хлор-2жаний цільовий продукт у вигляді порошку яскраметоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3во-білого кольору. дигідроіндол-1-ілметилового] естеру (s)Приклад 14 фосфорної кислоти; (S)-la2 Калійна сіль моно[3-(5-хлор-2-метоксифенІл-3Дотримуючись описаного вище загального фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1процесу і використовуючи 20г смоли Dowexілметилового естеру (S)-фосфорної кислоти; (S)50wx8-100 і проліну (11,3г), одержали 0,160г проla2 лінової солі (порошок білого кольору) (97% вихід) Дотримуючись описаного вище загального із монотетрабутиламонійної солі моно[3-(5-хлор-2процесу і використовуючи 40г смоли Dowexметоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,350wx8-100, одержали 0,07г калійної солі (порошок дигідроіндол-1-ілметилового] естеру (S)білого кольору) (95% вихід) із монотетрабутилафосфорної кислоти (0,20г, 0,28ммоль). MS m/e: монієвої солі моно[3-(5-хлор-2-метоксифеніл)-3468,1 (М-Н-). LC/MS m/e; 470,0 (МН+), 1,35хв. чисфтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1тота >95%. Розрахунок для ілметилового] естеру (S)-фосфорної кислоти C17H12CIF4NO6PN·1,0C5H10NO2: С - 45,10; Η - 3,95; (0,40г, 0,56ммоль). MS m/e: 468,0 (М-H ). LC/MS Ν - 4,78. Вимірювання: С - 45,19; Η - 3,96; Ν - 4,56. 1 m/e: 469,9 (МН+), 1,52хв. чистота >95%. РозрахуΗ ЯМР (D2O): 1,95 (м, 2Η), 2,03 (м, 1Н), 2,35 (м, нок для C17H12CIF4NO6PN·1,10K·0,45H2O: С - 39,07; 1Н), 3,08 (м, 1Н), 3,35 (м, 1Н), 3,58 (с, 3Н),4,11 (м, Η - 2,50; Ν - 2,69, K - 8,31. Вимірювання: С - 39,41; 1Н), 5,55 (м, 1Н), 5,61 (м, 1Н), 6,94 (д, J=9,0Гц, 1Н), Η - 2,62; Ν - 2,51; Κ - 8,43. 1Η ЯМР (D2O): 3,56 (с, 7,34 (дд, J=2,0, 8,0, 1Н), 7,44 (м, 2Н), 7,66 (с, 1Н), 3Η), 5,55 (м, 1Η), 5,61 (м, 1Η), 7,00 (д, J=8,5Гц, 1Н), 7,82 (с, 1Н). IR (KBr, см-1); 3431, 1757, 1319, 1131, 7,40 (д, J=7,0Гц, 1Н), 7,49 (м, 2Н), 7,77 (с, 1Н), 7,88 1026. (с, 1Н). 19F ЯМР (D2O): -63,1, -161,7. 31Р ЯМР Приклад 18 Магнієва сіль моно[3-(5-хлор-2-метоксифеніл)(D2O): 1,07. 3-фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1Приклад 15 ілметилового] естеру (S)-фосфорної кислоти; (S)Тетраметиламонійна сіль моно[3-(5-хлор-2la2 метоксифеніл-3-фтор-2-оксо-6-трифторметил-2,3Магнієву сіль було отримано шляхом простої дигідроіндол-1-ілметилового естеру (S)-фосфорної заміни Na+ на Мg++. Одержаний продукт був мінікислоти; (S)-la2 мально розчинний у воді, але більш розчинний в Дотримуючись описаного вище загального 37 77296 38 органічних розчинниках. До розчину Mg2SO4 Дотримуючись описаного вище загального (0,130г, 1,1ммоль) в Н2О (5мл) добавили розчин процесу і використовуючи смолу (15г) Dowexмононатриєвої солі (натрієвої солі) моно[3-(5-хлор50wx8-100, одержали 0,15г метанамонійної солі 2-метоксифеніл)-3-фтор-2-оксо-6-трифторметил(порошок білого кольору) (71,1% вихід) із монотет2,3-дигідроіндол-1-ілметилового] естеру (S)рабутиламонійної солі моно[3-(5-хлор-2фосфорної кислоти (0,050г, 0,070ммоль) в Н2О метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3(2мл). Суміш перемішували при кімнатній темпедигідроіндол-1-ілметилового] естеру (S)ратурі протягом 10 хвилин. Осад відфільтрували, фосфорної кислоти (0,3г, 0,42ммоль). MS m/e: промили Н2О і після цього розчинили в EtOAc. За468,11 (М-Н)-, LC/MS m/e: 468,11 (М-Н)-, 4,55хв. лишок після випарювання розчинника повторно чистота >95%. Розрахунок для розчинили в СН2СІ2 і гексані. Після випарювання C17H12CIF4NO6PN·1,0CH6N·0,09H2O: С - 42,74; Η розчинника був одержаний цільовий продукт у 3,68; Ν - 5,54. Вимірювання: С - 42, 38; Η - 3,65; Ν вигляді порошку білого кольору (0,035г, 72% ви5,49. 1Η ЯМР (D2O): 2,57 (с, 3Н), 3,47 (с, 3Н), 5,53 + + хід). MS m/e: 468,0 (М-Н ). LC/MS m/e: 469,9 (МН ), (м, 1Н), 5,56 (м, 1Н), 6,88 (д, J=8,8Гц, 1Н), 7,17 (д, 1,52хв. чистота >95%. Розрахунок для J=6,4Гц, 1Н), 7,31 (д, J=7,0Гц, 1Н), 7,37 (д, J=8,0Гц, C17H12CIF4NO6PN·0,49Mg·1,0H2O: С - 40,95; Η 1Н), 7,67 (с, 1Н), 7,74 (с, 1Н). 2,83; Ν - 2,81; Mg - 2,39. Вимірювання: С - 40,87; Η Приклад 22 Циклогексиламонійна сіль моно[3-(5-хлор-2- 3,04; Ν - 2,44; Mg - 2,42. 1Η ЯМР (D2O): 3,54 (с, метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,33Н), 5,50 (д, J=5,0Гц, 1Н), 5,52 (д, J=5,0Гц, 1Н), дигідроіндол-1-ілметилового естеру (S)-фосфорної 6,99 (д, J=7,5Гц, 1Н), 7,34 (д, J=7,0Гц, 1Н), 7,47 (м, кислоти; (S)-la2 2Н), 7,78 (с, 1Н), 7,86 (с, 1Н). IR (KВr, см-1): 3433, Дотримуючись описаного вище загального 1757, 1319, 1132, 1025. процесу і використовуючи смолу (25г) DowexПриклад 19 50wx8-100, одержали 0,36г циклогексиламонійної Амонійна сіль моно[3-(5-хлор-2солі (порошок білого кольору) (91,6% вихід) із мометоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3нотетрабутиламонійної солі моно[3-(5-хлор-2дигідроіндол-1-ілметилового естеру (S)-фосфорної метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3кислоти; (S)-la2 дигідроіндол-1-ілметилового] естеру (S)Дотримуючись описаного вище загального фосфорної кислоти (0,5г, 0,70ммоль). MS m/e: процесу і використовуючи 50г смоли Dowex487,1 для [(M-)+NH4]+. LC/MS m/e: 467,99 (М-Н)-, 50wx8-100, одержали 0,6г солі амонію (порошок 3,82 хв. чистота >95%. Розрахунок для білого кольору) (87,8% вихід) із монотетрабутилаC17H12CIF4NO6PN·1,0C6H14N: С - 48,56; Η - 4,60; Ν монійної солі моно[3-(5-хлор-2-метоксифеніл)-31 4,92. Вимірювання: С - 48,80; Η - 4,80; Ν - 4,90; Н фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1ЯМР (D2О): 1,14 (м, 1Н), 1,31 (м, 4Н), 1,62 (м, 1Н), ілметилового] естеру (S)-фосфорної кислоти (1,0г, 1,77 (м, 2Н), 1,96 (м, 2Н), 3,12 (м, 1Н), 3,54 (с, 3Н), 1,4ммоль). MS m/e: 468,1 (М-Н)-. LC/MS m/e: 486,8 5,52 (м, 1Н), 5,57 (м, 1Н), 6,95 (д, J=9,0Гц, 1Н), 7,36 (ΜΗ+), 4,54хв. чистота >95%. Розрахунок для (м, 1Н), 7,47 (м, 2Н), 7,75 (с, 1Н), 7,85 (с, 1Н). C17H12CIF4NO6PN·1,0NH4·0,35H2O: С - 41,43; Η Приклад 23 3,39; Ν - 5,69. Вимірювання: С - 41,41; Η - 3,32; Ν Піперидинієва сіль моно[3-(5-хлор-25,71. 1Η ЯМР (CD3CN): 3,47 (с, 3Н), 5,61 (д, метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3J=6,5Гц, 2Н), 5,95 (уш., 2Н), 6,83 (д, J=8,8Гц, 1Н), дигідроіндол-1-ілметилового естеру (S)-фосфорної 7,31 (д, J=7,8Гц, 1Н), 7,36 (м, 2Н), 7,64 (с, 1Н), 7,72 кислоти; (S)-la2 (с, 1Н), 8,1 (уш., 2Н). Дотримуючись описаного вище загального Приклад 20 процесу і використовуючи смолу (20г) DowexЛітієва сіль моно[3-(5-хлор-2-метоксифеніл-350wx8-100 смоли, одержали 0,05г піперидинієву фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1сіль (порошок білого кольору) (78,0% вихід) із моілметилового естеру (S)-фосфорної кислоти; (S)la2 нотетрабутиламонійної солі моно[3-(5-хлор-2Дотримуючись описаного вище загального метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3процесу і використовуючи 50г смоли Dowexдигідроіндол-1-ілметилового] естеру (S)50wx8-100, одержали 0,2г літієвої солі (порошок фосфорної кислоти, (0,4г, 0,56ммоль). MS m/e: білого кольору) (78,8% вихід) із монотетрабутила487,1 для [(M-)+NH4]+. LC/MS m/e: 467,99 (М-Н)-, монійної солі моно[3-(5-хлор-2-метоксифеніл)-33,65хв. чистота >95%. Розрахунок для фтор-2-оксо-6-трифторметил-2,3-дигідроіндол-1C17H12CIF4NO6PN·1,0C5H12N·0,55CH3CI·0,45H2O: С ілметилового] естеру (S)-фосфорної кислоти (0,3г, - 43,16; Η - 3,93; Ν - 4,46. Вимірювання: С - 42,99; 0,42ммоль). MS m/e: 468,1 (М-Н)-. LC/MS m/e: Η - 4,18; Ν - 4,53; 1Η ЯМР (D2O): 1 ,64 (м, 2Н), 1,76 486,8 для [(M-)+NH4]+, 4,48хв. чистота >95%. Роз(м, 4Н), 3,13 (м, 2Н), 3,53 (с, 3Н), 5,55 (м, 1Н), 5,61 рахунок для C17H12CIF4NO6PN·1,1Li·1,0H2O: С (м, 1Н), 6,98 (д, J=9,0Гц, 1Н), 7,35 (Д, J=7,5Гц, 1Н), 40,93; Η - 2,93; Ν - 2,81; Li - 1,40. Вимірювання: С 7,47 (д, J= 7,5Гц, 2Н), 7,73 (с, 1Н), 7,85 (с, 1Н). 41,01; Η - 2,94; Ν - 2,81; Li - 1,54. 1Н ЯМР (D2О): Приклад 24 3,52 (с, 3Н), 5,55 (м, 1Н), 5,62 (м, 1Н), 6,96 (д, Диметиламонійна сіль моно[3-(5-хлор-2J=9,0Гц, 1Н), 7,30 (д, J=7,5Гц, 1Н), 7,44 (м, 2Н), метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,37,73 (с, 1Н), 7,82 (с, 1Н). дигідроіндол-1-ілметилового естеру (S)-фосфорної Приклад 21 кислоти; (S)-la2 Метанамонійна сіль моно[3-(5-хлор-2Дотримуючись описаного вище загального метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3процесу і використовуючи смолу (15г) Dowexдигідроіндол-1-ілметилового естеру (S)-фосфорної 50wx8-100, одержали 0,20г диметиламонійної солі кислоти; (S)-la2 39 77296 40 (порошок білого кольору) (78,9% вихід) із монотетдихлорметан (500мл). Розчин охолодили до 0°С і рабутиламонійної солі моно[3-(5-хлор-2барботували газоподібним хлором з витратою метоксифеніл)-3-фтор-2-оксо-6-трифторметил-2,3приблизно 50 л/хв., підтримуючи температуру реадигідроіндол-1-ілметилового] естеру (S)кційної суміші в межах 0-3°С. Барботування трифосфорної кислоти, (0,3г, 0,42ммоль). MS m/e: вало приблизно 90хв. (приблизно 1 еквівалент + 487,1 для [(M )+NH4] . LC/MS m/e: 468,01 (M-H) , хлору). Моніторинг розвитку реакції проводили за 3,66хв. чистота >95%. Розрахунок для С17Н12СІ раманівським спектром комбінаційного розсіюванF4NO6PN·1,0C2H8N·0,52CH3CI·0,06H2O: С - 40,58; Η ня, HPLC-хроматографією і показаннями масового - 3,67; Ν - 5,03; . Вимірювання: С - 40,30; Η - 3,75; витратоміру газу. По завершенню реакції суміш Ν - 5,50; 1Η ЯМР (D2O): 2,69 (с, 6Н), 3,49 (с, 3Н), нагріли до кімнатної температури і без додаткової 5,52 (м, 1Н), 5,60 (м, 1Н), 6,91 (д, J=8,5Гц, 1Н), 7,05 обробки використовували на стадії С. 1Н ЯМР: (м, 1Н), 7,36 (м, 2Н), 7,70 (с,1Н), 7,76 (с, 1Н). (300Мгц, ДMCO-d6) 7,88 (с, 1Н), 7,69 (д, J=2,3, Приклад 25 1Н), 7,49 (дд, J=2,6, 8,8, 1Н), 7,41 (с, 1Н), 7,04 ((дд, Біс-[трис(гідроксиметил)амоній метанова]сіль J=1,2, 8,9, 1Н), 5,40 (д, J=5,9, 2H), 5,25 (уш., 12Н), моно[3-(5-хлор-2-метоксифеніл)-3-фтор-2-оксо-63,52 (с, 3Н), 3,35 (с, 12Н), 2,15 (с, 4,4Н, пік ацетотрифторметил-2,3-дигідроіндол-1-ілметилового] ну). естеру фосфорної кислоти Альтернативний процес. У круглодонну колбу Стадія А. 3-(5-хлор-2-метоксифеніл)-3-фтор-1зі штуцером для постачання азоту і магнітною міметилсульфанілметил-6-трифторметил-1,3шалкою до розчину 3-(5-хлор-2-метоксифеніл)-3дигідроіндол-2-он фтор-1-метилсульфанілметил-6-трифторметилУ тригорлу круглодонну колбу об'ємом 1л, об1,3-дигідроіндол-2-ону (420мг, 1ммоль) в дихлорладнану ділильною лійкою, додали 3-(5-хлор-2метані (10мл) при кімнатній температурі добавили метоксифеніл)-3-фтор-6-трифторметил-1,3сульфурилхлорид (135мг, 80,2мкл, 1ммоль). Після дигідроіндол-2-он (25г, 69,8ммоль) і безводний перемішування реакційної суміші при кімнатній ТГФ (150мл). Розчин охолодили до температури температурі протягом 20 хвилин сирий розчин 0°С і добавили калій-біс(триметилсиліл)амід (0,5М концентрували у вакуумі, отримавши 3-(5-хлор-2у толуолі (153,6мл, 76,8ммоль) протягом близько метоксифеніл)-1-хлорметил-3-фтор-625 хвилин для того, щоб підтримати температуру трифторметил-1,3-дигідроіндол-2-он (425мг, 100% реакції на рівні між 0°С і 5°С. Реакційна суміш одвихід сирого продукту) у формі розчину світлоразу змінювала колір від чорного на жовтогарячий. жовтого кольору. Розчин поставили нагрітися до кімнатної темпераСтадія С. Бістури, після чого до нього добавили хлорметилме[трис(гідроксиметил)амонійметанова] сіль моно[3тилсульфід {6,39мл, 76,8ммоль). Реакційну суміш, (5-хлор-2-метоксифеніл)-3-фтор-2-)оксо-6що набула темно-коричневого кольору, після цього трифторметил-2,3-дигідроіндол-1-ілметилового кип'ятили зі зворотним холодильником при переестеру фосфорної кислоти. мішуванні. Через 3 години реакційна суміш містиРозчин, одержаний на стадії В, що містив 3-(5ла 84% (АР) цільового продукту. Реакційну суміш хлор-2-метокси-феніл)-1-хлорметил-3-фтор-6кип'ятили зі зворотним холодильником протягом трифторметил-1,3-дигідроіндол-2-он, добавили до ночі. При цьому реакція більше не відбувалася перемішуваного розчину тетра-н-бутиламонію ди(82% АР продукту після перемішування протягом гідрофосфату (801г) в дихлорметані (1500мл) при ночі). Далі суміш залишили охолонути і до неї потемпературі 40°С протягом близько 90 хвилин. вільно добавили 1N. НСІ (100мл) для того, щоб Для завершення реакції прозорий розчин, що внапідтримати температуру реакції на рівні нижче слідок цього утворився, перемішували при темпе30°С. Після перемішування протягом 5 хвилин, ратурі 40°С протягом 10 хвилин. добавили гептан (200мл), і шари, що утворилися, Порцію зазначеного вище розчину (160мл, розділили. Органічний шар промили насиченим 10,1ммоль, 0,063Μ за результатами HPLCрозчином NaCI (200мл), висушили над безводним калібровки) помістили в круглодонну колбу об'єсульфатом натрію і концентрували, отримавши мом 250мл, обладнану в її верхній частині зворотсирий продукт (29,3г). Далі цей продукт піддали ним холодильником. Розчин нагріли на масляній рекристалізації із суміші гептан:ТГФ (15:1), одербані (70°С), і з нього був видалений дихлорметан жавши в результаті 3-(5-хлор-2-метоксифеніл)-3шляхом дистиляції, аж поки внутрішня температуфтор-1-метилсульфанілметил-6-трифторметилра не досягла 60°С (температура дистиляту ста1,3-дигідроіндол-2-он у вигляді порошку світлоновила 34-40°С). Після охолодження до кімнатної 1 жовтого кольору (19,5г, 67%). Н ЯМР (CDCI3, температури добавили НСІ (1Ν, 140мл, 140ммоль) 400Мгц): = 7,78 (дд, 1Н, J=2,7, 0,9Гц), 7,32 (м, і трет-бутилметиловий етер (80мл), і утворену су2Н), 7,21 (м, 2Н), 6,73 {дд, 1Н, J=8,9, 1,2Гц), 4,95 міш перемішували протягом 10 хвилин, поки всі (д, 1Н, J=14,6Гц), 4,79 (д, 1Н, J=14,6Гц), 3,48 (с, тверді речовини повністю не розчинилися. Фази 3Н), 2,23 (с, 3Н). розділили, а водний шар знов екстрагували третСтадія В. 3-(5-Хпор-2-метокси-феніл)-1бутилметиловим етером (40мл). Об'єднаний шар хлорметил-3-фтор-6-трифторметил-1,3трет-бутилметилового етеру промили НСІ (1N, дигідроіндол-2-он 2 140мл) і водою (5 100мл, рН водних промивок У круглодонну колбу з мішалкою і штуцером становив 0, 2, 4, 5, 6 відповідно). Після цього шар для постачання азоту помістили 82г (0,195моль) 3трет-бутилметилового етеру екстрагували розчи(5-хлор-2-метоксифеніл)-3-фтор-1ном трис(гідроксиметил)амінометану (2,58г, метилсульфанілметил-6-трифторметил-1,321,3ммоль) у воді (20мл). До водного шару, збагадигідроіндол-2-ону, приготованого на стадії А, і ченого на продукт (70мл), добавили ацетон, аж 41 77296 42 поки розчин не став замутненим, після чого його протягом 21 годин, одержавши кристалічний проперемішували при кімнатній температурі протягом дукт, біс-[трис(гідроксиметил)амонійметанову] сіль 1,75 годин. Потім знову добавили ацетон (20мл) і (5,08г) у формі сольвату з ацетоном (0,7 еквівалеперемішували при кімнатній температурі протягом нта). 1Н ЯМР: (300Мгц, ДМСО-d6) 7,88 (с, 1Н), 16,5 годин, після чого ще раз добавляли ацетон 7,69 (д, J=2,3, 1Н), 7,49 (дд, J=2,6, 8,8, 1Н), 7,41 (с, (100мл) протягом 30 хвилин. Утворену суспензію 1Н), 7,04 (дд, J=1,2, 8,9, 1Н), 5,40 (д, J=5,9, 2Н), охолодили до температури 0°С і перемішували 5,25 (уш., 12Н), 3,52 (с, 3Н), 3,35 (с, 12Н), 2,15 (с, протягом 2,5 годин. Тверду речовину зібрали шля4,4Н, пік ацетону). 31Р ЯМР: (300Мгц, ДМСО-dб) S хом фільтрування і промили ацетоном (2 20мл). 0,11. 19F ЯМР: (500Мгц, ДMCO-d6) -67,9, -166,0. Отриманий в результаті мокрий корж висушили у вакуумі (25мм рт. ст.) при кімнатній температурі Комп’ютерна верстка О. Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPhosphate prodrugs of fluoro-oxindols
Назва патенту російськоюФосфатные пролекарства фтороксиндолов
МПК / Мітки
МПК: A61K 31/40
Мітки: проліки, фосфатні, фтороксіндолів
Код посилання
<a href="https://ua.patents.su/21-77296-fosfatni-proliki-ftoroksindoliv.html" target="_blank" rel="follow" title="База патентів України">Фосфатні проліки фтороксіндолів</a>
Попередній патент: Рідкий препарат, що містить похідне камптотецину, та фармацевтична композиція, яку можна одержати шляхом ліофілізації цього препарату
Наступний патент: Застосування твердих розчинів на основі йодидпентатіофосфату міді як матеріалу для оптичного реле температур
Випадковий патент: Опалубний щит для монолітного бетонування