Спосіб визначення біологічної активності дефібротиду
Формула / Реферат
1. Спосіб визначення біологічної активності дефібротиду, що містить стадії:
a) приведення в контакт дефібротиду, плазміну й субстрату, специфічного для плазміну, який, за рахунок реакції з плазміном, забезпечує вимірюваний продукт, і
b) виміру кількості продукту, що утворився, у послідовних часових точках,
у якому субстратом, специфічним для плазміну, є сполука формули А1-А2-А3-Х, де A1 і А2 - це неполярні амінокислоти, А3 - лізин чи аргінін і Х - вимірюваний продукт, і у якому концентрація субстрату для плазміну дорівнює від 0,3 до 4 мМ, переважно від 2,5 до 3,5 мМ, більш переважно 3 мМ.
2. Спосіб за п. 1, у якому плазмін є плазміном ссавця, переважно плазміном людини.
3. Спосіб за п. 1, у якому вимірюваний продукт Х вибраний з пара-нітроаніліну і 2-нафтиламіну.
4. Спосіб за п. 1, у якому субстратом для плазміну є Н-D-валіл-L-лейцил-L-лізин-п-нітроанілін.
5. Спосіб за п. 1, у якому плазмін має концентрацію від 0,0064 до 0,050 МО/мл, а субстрат для плазміну має концентрацію від 2,6 до 3,5 мМ.
6. Спосіб за п. 5, у якому концентрація плазміну дорівнює 0,0125 МО/мл, а концентрація субстрату для плазміну дорівнює 3 мМ.
7. Спосіб за п. 1, у якому вимірюваний продукт Х вимірюють за допомогою спектрофотометрії.
8. Спосіб за п. 1, у якому реакційним середовищем є водний розчин, буферизований до рН від 7 до 8, переважно до рН 7,4.
9. Спосіб за п. 1, у якому температуру цієї системи підтримують при 35-39 °С, переважно при 37 °С.
10. Спосіб за п. 1, який містить стадії:
a) визначення швидкості вивільнення вимірюваного продукту Х у ході ферментативної реакції для кожного зразка дефібротиду, як стандарту, так і того, що тестують,
b) установлення кореляції, математично та/або графічно, вищевказаних швидкостей вивільнення з відповідними концентраціями дефібротиду,
c) одержання біологічних активностей аналізованих зразків дефібротиду.
Текст
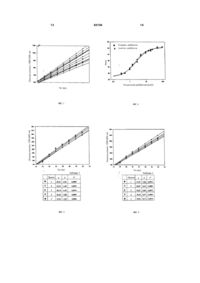
1. Спосіб визначення біологічної активності дефібротиду, що містить стадії: a) приведення в контакт дефібротиду, плазміну й субстрату, специфічного для плазміну, який, за рахунок реакції з плазміном, забезпечує вимірюваний продукт, і b) виміру кількості продукту, що утворився, у послідовних часових точках, у якому субстратом, специфічним для плазміну, є сполука формули А1-А2-А3-Х, де A1 і А2 - це неполярні амінокислоти, А3 - лізин чи аргінін і Х - вимірюваний продукт, і у якому концентрація субстрату для плазміну дорівнює від 0,3 до 4мМ, переважно від 2,5 до 3,5мМ, більш переважно 3мМ. C2 2 (11) 1 3 80104 Дефібротид був предметом численних фармакологічних досліджень, які дозволили припустити, що він може застосовуватися в терапії у якості антитромботичного агента [Патент США 3829567]. Крім того, дефібротид також успішно використовувався в лікуванні периферичних артеріопатій, при гострій нирковій недостатності [Патент США 4694134[ чи при гострій ішемії міокарда [Патент США 4693995]. Подібно іншим біологічним речовинам, що одержують екстракцією, дефібротид є також предметом обмеженої варіабельності складу, яка є типовою для для природних біополімерів. Класичним прикладом цієї ситуації є гепарин, варіабельність якого від партії до партії у відношенні довжини ланцюга, молекулярної маси, складу, ступеня сульфатування і т.д. добре відома. Наслідком цього є те, що ті самі кількості по масі дефібротиду можуть бути фактично нееквівалентними з точки зору специфічної біологічної активності. 15 Процес екстракції, виділення й очищення не може per se гарантувати абсолютн у відтворюваність цього продукту саме унаслідок властивої йому біополімерної структури. Однак при доброму контролі можна зменшити цю варіабельність: для цієї мети проводилися дослідження стандартизованих промислових процесів для виділення дефібротиду екстракцією з органів, такі як, наприклад, дослідження, описані в [US 4985552]. Продукт, одержаний відповідно до вищезгаданого процесу, характеризується шляхом визначення деяких специфічних фізико-хімічних параметрів, таких як, наприклад, електрофоретична рухливість, коефіцієнт екстинкції, здатність до оптичного обертання й оборотна гіперхромність. Однак, ці параметри залежать в основному від структури дефібротиду і не можуть забезпечити інформацію про його біологічну активність. Наскільки відомо авторам даного винаходу, єдиними способами, що, як повідомлялося дотепер, використовувалися для оцінки біологічної активності дефібротиду, є чашковий тест визначення лізису фібрину і тромбоеластографічна реєстрація часу лізису еуглобуліну [Prino G., Mantovani М, Niada R., Coccheri S., Butti A., Indagini preliminari sull'attivita fibrinolitica, nell'animale e neU'uomo, di una nuova sostanza presente in diversi organi animali, Simposio Internazionale: La ricerca scientifica nell'industria farmaceutica in Italia, Rome, 2-4 October 1975 - II Farmaco, Ed. Prat.) (1969), 24, 552-561)]. Однак вищезгадані способи відрізняються значною експериментальною складністю, незадовільною відтворюваністю й точністю та, у конкретному випадку тромбоеластографічної реєстрації, лінійністю відповіді, обмеженою дуже вузькими діапазонами концентрацій. Таким чином, дотепер не були відомі достовірні, точні і відтворювані способи визначення біологічної активності дефібротиду. Перелік фігур-креслень Фіг.1 демонструє кінетику вивільнення pNA із субстрату S-2251 під дією плазміну, який активо 4 ваний і не активований дефібротидом (концентрація 0-100 мкг/мл, 0-20 хвилин). Фіг.2 демонструє залежність нахилу прямих ліній, що відповідають стандарту й аналізованому зразку дефібротиду, від концентрації дефібротиду. Фіг.3 демонструє кінетику вивільнення pNA із хромогенного субстрату S-2251 під дією плазміну в присутності дефібротиду (концентрація 0,5мкг/мл, 5 повторів). Фіг.4 демонструє кінетику вивільнення pNA із субстрату S-2251 під дією плазміну в присутності дефібротиду (концентрація 2,0мкг/мл, 5 повторів). Фіг.5 демонструє кінетику вивільнення pNA із субстрату S-2251 під дією плазміну в присутності дефібротиду (концентрація 8,0мкг/мл, 5 повторів). Автори даного винаходу розробили простий і надійний спосіб визначення біологічної активності дефібротиду, який дозволяє контролювати зразки, одержувані екстракцією, і, отже, дозволяє стандартизувати медичні препарати на основі дефібротиду. Спосіб, до якого відноситься даний винахід, дозволяє визначати специфічну біологічну активність дефібротиду в порівнянні зі стандартним еталоном із високою точністю, великою швидкістю й відтворюваністю. Таким чином, даний винахід відноситься до способу визначення специфічної біологічної активності зразків дефібротиду, який передбачає стадії: а) приведення в контакт дефібротиду, плазміну й субстрату, специфічного для плазміну, що, за допомогою реакції із плазміном, забезпечує вимірюваний продукт, і b) виміру кількості утвореного продукту в послідовних часових точках. Спосіб даного винаходу є непрямим in vitro способом для визначення активності дефібротиду, який заснований на функціональних взаємодіях між дефібротидом і плазміном. З літератури відомо, що плазмін є протеолітичним ферментом у каскаді зсідання/фібринолізу, здатним розщеплювати фібрин, фібриноген і інші білки плазми. Ферментативну активність плазміну звичайно визначають різними стандартними тестами in vitro. Одним із найбільш часто використовуваних способів є визначення за допомогою спектрофотометрії чи флуориметрії хромогенних чи флуорогенних сполук, які вивільняються за допомогою дії плазміну на різні субстрати [Haemostasis, (1978), 7, 138145]. Звичайно використовують пептидні субстрати, що мають формулу А1-А2-А3-Х, у якій Аі і Аг є амінокислотами, які є переважно неполярними, Аз є лізином чи аргініном і X представляє вимірювану сполуку, що вивільняється, наприклад, паранітроанілін (pNa) чи 2-нафтиламін (NA) [Haemostasis, (1978), 7, 146-149]. Крім вищезгаданих пептидних субстратів, успіх був досягнутий з використанням інших, більш простих, сполук, таких як, наприклад, п-нітробензил-п-толуолсульфонілL-аргінін [Haemostasis, (1978), 7,105-108)]. У цих тестах швидкість, з якою сполука X вивільняється в інкубаційне середовище, пропорційна 5 80104 активності (у Міжнародних Одиницях) плазміну, який є у пробі. Тепер було виявлено, і це є принципом, на якому ґрунтується даний винахід, що в описаних вище тестах, заснованих на оцінці плазміну, дефібротид збільшує швидкість вивільнення сполуки X пропорційно його концентрації. Спосіб, до якого відноситься даний винахід, передбачає, насамперед, приведення зразка дефібротиду, плазміну й субстрату плазміну в контакт один з одним. Зразок дефібротиду, використовуваний для визначення відповідно до даного винаходу, звичайно одержують екстракцією з органів відповідно до відомих процедур, таким як, наприклад, процедури, описані в [US 4985552], що вже згадувався. Партію звичайного виготовленого промисловим шляхом дефібротиду вибирали як еталонний зразок (стандарт) і використовували для побудови каліброваних кривих у відповідності зі способом даного винаходу. Звичайно, даний спосіб забезпечує точні й правильні виміри дефібротиду навіть у присутності домішок, таких як, наприклад, РНК, гепарин, деградований дефібротид (дефібротид, із якого був вилучений пурин чи піримідин) чи етанол, за умови, що вони знаходяться в концентраціях звичайно менших, ніж 10% по масі, таких, щоб не порушити систему. Крім можливості визначення дефібротиду, цей спосіб дозволяє також визначати інші біологічно еквівалентні речовини, що утворюються з дефібротиду, такі як, наприклад, деамінований дефібротид чи, більш просто, дефібротид, денатурований нагріванням. Даний спосіб є досить чуттєвим для виявлення концентрацій дефібротиду, рівних чи менших, ніж 0,1мкг/мл (кінцева концентрація в цій системі визначення), і, звичайно, дає добру кореляцію до максимальних величин концентрацій, рівних чи більш високих, ніж 100мкг/мл. Використовуваний плазмін є звичайно плазміном будь-якого ссавця, таким як, наприклад, бичачий, свинячий чи людський плазмін, причому кращим є плазмін людини. Однак, хоча плазмін є кращим ферментом, використання інших еквівалентних ферментних систем, таких як, наприклад, попередники плазміну, такі як плазміноген, чи ферменти-аналоги плазміну, що є хімічно родинними й мають подібну функціональність, знаходиться також у рамках даного винаходу. У способі даного винаходу під субстратом для плазміну може розумітися будь-який субстрат, специфічний для плазміну, який, в умовах даного способу, вивільняє продукт гідролізу X, який детектують . У залежності від природи групи X, яку детектують, можуть використовува тися так само успішно альтернативні системи детектування, звичайно відомі фахівцю в даній області. Спектрофотометричні чи флуорометричні системи детектування є кращими, особливо спектрофотометричні системи. 6 Звичайно використовуваними субстратами є субстрати, що є специфічними для плазміну. Переважно використовувати пептиди формули А1-А2А3-Х, у якій А1 і А2 є амінокислотами, які є переважно неполярними, А3 є лізином чи аргініном і X є групою, яку детектують. Прикладами таких субстратів є Val-Leu-Lys-pNa, Val-Phe-Lys-pNa чи пipoGlu-Phe-Lys-pNa, у яких група X, яку детектують за допомогою спектрофотометрії, є паранітроаніліном (pNa). Інші придатні субстрати, наприклад, Val-Gly-Arg-2NA, містять 2-нафтиламін, який вимірюють флуорометрією. Особливо кращим субстратом є сполука Н-D-валіл-L-лейцил-Lлізин-п-нітроанілін (H-D-Val-Leu-Lys-pNa). Плазміни і специфічні субстрати, використовувані для визначення дефібротиду, є звичайно комерційно доступними. Спосіб визначення за даним винаходом проводять приміщенням цих реагентів і зразка дефібротиду у водяний розчин при специфічних рН і молярності. Зокрема, концентрація плазміну може варіювати, звичайно, від 0,0016 до 0,20М.О./мл, переважно від 0,0064 до 0,050 М.О./мл і ще більш переважно дорівнює приблизно 0,0125М.О./мл. Однак, що стосується субстрату для плазміну, концентрації від 0,3 до 4мМ, переважно від 2,5 до 3,5мМ і найбільш переважно 3мМ використовують звичайно у випадку хромогенного субстрату, тоді як концентрації від 0,05 до 0,15мМ використовують у випадку флуорогенного субстрату. Спосіб визначення даного винаходу, подібно іншим ферментативним способам, є чуттєвим до рН середовища. Фактично він не може застосовуватися при екстремальних значеннях рН, при яких ферментативна система була б інактивована. Переважно також, щоб рН середовища не піддавався зміні в будь-якій часовій точці під час періоду проьедення вимірів, і, отже, розчин звичайно буферизують із використанням буферних систем, обраних із систем, звичайно використовуваних у тестах визначення плазміну. Наприклад, придатними буферними системами можуть бути фосфатний буфер, цитратний буфер чи тріс(гідроксиметил)амінометан-гідрохлоридний (ТРІС) буфер. Операцію проводять переважно в присутності ТРІС у. У даному способі звичайно переважно підтримувати рН середовища в діапазоні приблизно від 7 до 8, більш переважно при приблизно 7,4. Крім того, переважно підтримувати концентрацію буферної системи в діапазоні від 10 до 200мМ, переважно при приблизно 50мМ. Спосіб даного винаходу для визначення дефібротиду передбачає, що плазмін, субстрат для плазміну і дефібротид змішують. Зокрема, для забезпечення правильного проведення вимірів, передбачених даним способом, переважно додавати плазмін чи специфічний субстрат, чи обох, до буферного розчину, що містить зразок дефібротиду, перед початком цієї стадії виміру. Субстрат для плазміну переважно додають в останню чергу. Важливим параметром даного способу визначення є температура. Переважно підтримувати ту 7 80104 саму температуру протягом усієї тривалості вимірів і для усіх вимірюваних зразків, як при побудові каліброваних кривих, так і під час стадії вимірів. Для цієї мети переважно використовувати прилад із контрольованою температурою, а також, коли необхідно, можна проводити кілька серій вимірів, змінюючи положення зразків придатним чином щоб гарантува ти, що дана система має максимальну температурну гомогенність. Звичайно цей спосіб визначення використовують у діапазоні температур, наприклад, від 25 до 40°С, переважно від 35 до 39°С та ще більш переважно при 37°С Відповідно до даного винаходу, вимір концентрації сполуки X, яка вивільняється в середовище під дією плазміну, починають тоді, коли всі реагенти були додані, і продовжують протягом заздалегідь заданого часу і при заздалегідь заданій частоті в залежності від хімічної природи X і системи детектування. Подібно іншим способам біологічного визначення, спосіб даного винаходу також передбачає стадію калібрування та стадію виміру, які переважно виконують паралельно для зменшення, наскільки це можливо, зустрічальності експериментальної мінливості варіабельності. Стадія калібрування містить у собі одержання даних оптичної густини, які відносяться до проб із відомими концентраціями дефібротиду (стандарту), що збільшуються, статистичну обробку цих даних і екстраполяцію каліброваних кривих, які виражають кореляцію між збільшенням швидкості ферментативної реакції даного винаходу та концентрацією дефібротиду, який є присутнім у середовищі. На стадії виміру, завдяки кореляції, отриманої на стадії калібрування, можна визначити невідомі біологічні активності зразків дефібротиду на основі величин оптичної густини, виміряних і оброблених при тих самих умовах. Більш докладно, експериментальний протокол звичайно передбачає підготовку декількох зразків, як стандартних, так і невідомих, при різних відомих концентраціях дефібротиду. Зразки дефібротиду готують послідовним розведенням вихідних розчинів відповідно до заданого заздалегідь фактора розведення. У даному способі переважно готувати щонайменше 5 концентрацій стандарту і 5 концентрацій тестуємого зразка з одержанням 5 повторів, чи більш переважно 10 повторів, для кожної концентрації стандарту і, подібним чином, для кожної концентрації аналізованого зразка, звичайно при послідовному розведенні 1:2 вихідних розчинів. Концентрації як стандарту, так і аналізованого зразка дефібротиду звичайно складають від 0,1 до 100мкг/мл, переважно від 0,3 до 50мкг/мл, більш переважно від 0,5 до8 мкг/мл. Концентрації аналізованого зразка мають переважно той самий порядок величин, що й концентрації стандарту. Відповідно до наведеної вище ілюстрації, виміри для кожної концентрації переважно проводять на двох мікропланшетах, де розміщення кожного зразка, стандарту й аналізованого зразка, відповідно, при відповідній концентрації на одному 8 планшеті є переважно зворотним розміщенню на іншому планшеті. Відповідно до цієї схеми для розташування зразків, яка пояснюється більш докладно в експериментальній частині, для кожної концентрації як стандарту дефібротиду, так і аналізованого зразка дефібротиду вимірюють щонайменше 5 чи, переважно, 10 величин оптичної густини для кожної часової точки. Серію вимірів/ описаних вище, проводять у заданих заздалегідь часових точках, тобто, насамперед, під час t0, тобто, коли всі компоненти були додані, перед початком ферментативної реакції винаходу, і потім через точні інтервали й протягом часу, доста тнього для одержання необхідних даних. Переважно, виміри оптичної густини продовжуються максимально до 90 хвилин, із зняттями показань, що виконуються кожні 1-10 хвилин. Більш переважно, зняття показань роблять під час t0 і потім протягом від 20 до 50 хвилин, кожні 5 хвилин. Фотометричні зняття показань оптичної густини проводять при довжині хвилі, яка залежить від характеру групи X, яку детектують і яка вивільняється в ході ферментативної гідролітичної реакції. У конкретному випадку, коли X є pNA, оптичну густину вимірюють при 405нм. Показання оптичної щільності стандартних і невідомих зразків дефібротиду, відомі як вихідні дані, звичайно прямо походять з одного приладу, який забезпечує операцію зняття показань; їх зводять у таблицю таким чином, що значення оптичної густини дається для кожної часової точки і для кожної лунки. Потім ці вихідні дані піддають обробці з використанням, наприклад, програми Microsoft Excel®. Ця перша операція обробки даних приводить до розрахунку середньої оптичної густини та зв'язаного з нею стандартного відхилення в кожній часовій точці і для кожної серії показань, причому кожна серія показань містить, щонайменше, 5 і переважно 10 повторів для кожної концентрації як стандарту, так і аналізованого зразка дефібротиду. Подальшу ста тистичну обробку даних проводять із використанням програми типу Sigma Plot Computer Program® (SPSS, Chicago, USA), яка перетворює математичну залежність, що існує між значеннями оптичної густини ци х проб і часом, для кожної серії концентрацій дефібротиду, для одержання прямих ліній, нахил яких пропорційний концентрації дефібротиду. Більш точно, в інтервалі, у якому існує лінійність відповіді, переважно від 20 до 50 хвилин, і для кожного з 5 чи, переважно, 10 повторів однієї і тієї ж концентрації, ця програма розраховує лінію регресії, яка характеризується коефіцієнтом лінійної регресії "b", коефіцієнтом кореляції "г2" і відрізком "а", що відтинається на координатній осі. Прямі лінії, одержані за даною процедурою, звичайно мають добру кореляцію, яка виражається високими значеннями r2, звичайно не менш 0,97, переважно г2 ³ 0,99, Дані, одержані за допомогою цієї програми, можуть бути відтворені у вигляді табличних цифрових даних чи можуть бути представлені графічно для кожної серії концентрацій. 9 80104 Як показано на фіг.1, за допомогою відкладання часу по абсцисі, а оптичної густини по ординаті, одержують прямі лінії, нахил яких "b" буде пропорційний швидкості ферментативної реакції: при збільшенні концентрації дефібротиду буде збільшуватися швидкість гідролізу і, пропорційно, буде збільшуватися величина "b". Нарешті, величини нахилу, розраховані, як описано вище, для кожної серії повторів стандарту дефібротиду та дефібротиду аналізованого зразка, корелюють із десятковим логарифмом концентрації дефібротиду, до якої вони відносяться. Графічно, ця кореляція дає сигмоїдальну криву для стандарту й сигмоїдальну криву для аналізованого зразка (фіг.2); центральні частини цих сигмоїдальних кривих дають дві прямі лінії, які звичайно є рівнобіжними і відстань між якими є функцією різниці між біологічними активностями аналізованого зразка та стандарту. У цьому інтервалі лінійності визначають активність невідомого зразка дефібротиду в порівнянні з активністю стандарту відповідно до методології біологічного визначення з використанням рівнобіжних ліній, яка описана Finney DJ, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London. Ця методологія може застосовуватися, коли, як у даному винаході, біологічна відповідь є лінійною функцією логарифма концентрації речовини, яку детектують, і коли існує паралелізм і лінійність між прямими лініями, зв'язаними зі стандартними і, відповідно, невідомими концентраціями. Переважно, статистичну обробку цих даних, розрахунок відносини цих активностей і, отже, визначення невідомої активності дефібротиду проводять за допомогою спеціалізованих програм, створених на основі вищезгаданої методології. Однак статистична обробка даних, яка у хімічному аналізі взагалі й у даному способі більш конкретно дозволяє мінімізувати частоту помилок і експериментальну варіабельність, не є обов'язковою для способу даного винаходу, а просто представляє спосіб оцінки результатів, який добре відомий фахівцям у даній області і який звичайно використовується в даній області. Даний винахід відноситься також до наборів для визначення біологічної активності дефібротиду відповідно до способу даного винаходу, що містять щонайменше: a) виміряну кількість субстрату для плазміну, як визначено вище, і b) виміряну кількість плазміну. Кращі набори вмістять 20-30мг субстрату, специфічного для плазміну, на одиницю плазміну і навіть більш переважно 25мг субстрату на одиницю плазміну. Відповідно до даного винаходу, набори, що містять H-D-Val-Leu-Lys-pNA як субстрат, специфічний для плазміну, і плазмін людини, є найкращими. Набори даного винаходу можуть також містити буферизований водяний розчин, переважно розчин, буферизований 50мМ ТРІС-НС1 при рН 7,4. При необхідності набори даного винаходу містять також виміряну кількість дефібротиду (стан 10 дарту) для забезпечення можливості контрольних вимірів. У кращому втіленні даного винаходу стандартні розчини і розчини зразків дефібротиду, що підлягають визначенню, вводять у відповідні лунки мікропланшетів. Розчин плазміну готують у момент використання і розподіляють по лунках, що містять дефібротид, і, нарешті, додають розчин, що містить субстрат для плазміну. Потім цей мікропланшет поміщають у термостатований планшет-ридер і, після швидкого перемішування, знімають показання оптичної густини цієї системи через попередньо задані інтервали і протягом попередньо заданого періоду часу. Потім отримані вихідні дані обробляють, визначаючи, таким чином, невідомі активності зразків дефібротиду. Ці й інші аспекти даного винаходу будуть проілюстровані більш докладно в наступних прикладах, які, однак, не повинні розглядатися як такі, що обмежують даний винахід. Приклади У наведених прикладах використовували такі матеріали. Устаткування - Детектор для мікрошіаншета, що має 96 лунок, MRX ТСП (Dyne x Technologies, Chantilly, VA, USA), термостатований і обладнаний програмою ферментативної кінетики. - Мікропланшети, що мають 96 лунок із плоскою основою (Greiner L., Rremtmster, Austria, cat. 655101). - Піпетки з безупинно регульованим об'ємом Pipetman P200 (30-200мкл) і 8x200 (20-200мкл) і наконечники для піпеток на 200мкл сертифікованої якості (Gilson, Milan, Italy). - рН-метр РНМ85 Radiometer (Analitica De Mori, Milan, Italy). Програми - Microsoft Excel® (Microsoft Corporation, Redmond, WA, USA). - Sigma Plot Computer Program® (SPSS, Chicago, USA). Речовини - Дефібротид (Gentium). - Плазмін людини, 1 одиниця, Р-4895 (Sigma Aldrich, Milan, Ital y). - Хромогенний субстрат S-2251, 820332-39 (Chromogenix Instrumentation Laboratory S.p.A., Milan, Italy). Тріс(гідроксиметил)амінометан (ТРІС), 255285-9 (Sigma-Aldrich, Milan, Italy). -1 hHCI 1090571000 (Merck). -1 HNaOH 1091411000 (Merck). Розчини ТРІС-НСІ-буфер 2,42г ТРІСу розчиняють у дистильованій воді й розбавляють до об'єму 100мл. 16мл 1 н НСl додають до цього розчину з наступним додаванням додаткової кількості води з одержанням кінцевого об'єму 400мл. рН цього останнього розчину дорівнює 7,40. Якщо ці величини є іншими, рН коректують з одержанням бажаної величини додаванням 1 н НСl чи 1 н NaOH. Розчин плазміну Одну одиницю (1М.О.) плазміну людини розчиняють у 4мл ТРІС-НС1-буфера при 0°С. Потім, 11 80104 працюючи завжди на льоді, цей розчин поділяють на аліквоти по 200мкл, які зберігають при -20°С в пластикових пробірках на 10мл. Розчин хромогенного субстрату S-2251 25мг S-2251 розчиняють у 15,15мл дистильованої води і зберігають при +4/+8°С. Стандартні розчини дефібротиду Готування стандартних розчинів - (Кінцеві) концентрації від 0,1 до 100мкг/мл 60мг дефібротиду розчиняють у 3мл ТРІСНС1-буфера і розбавляють 1:15 ТРІС-НС1буферним розчином. Одержаний у такий спосіб розчин, що має концентрацію 1,333мг/мл, піддають послідовним розведенням 1:2 з одержанням розчинів дефібротиду, що мають концентрацію 666мкг/мл, 333мкг/мл і 166мкг/мл. Цей останній розчин, що використовували як вихідний розчин, додатково розводять з одержанням розчинів, що мають концентрації 83,33мкг/мл, 41,67мкг/мл, 33,33мкг/мл, 25мкг/мл, 16,66мкг/мл, 8,33мкг/мл, 5мкг/мл, 2,5мкг/мл, 1,66 мкг/мл, 0,83мкг/мл, 0,5мкг/мл і, нарешті, 0,16мкг/мл. - (Кінцеві) концентрації від 0,5 до 8мкг/мл 60мг дефібротиду розчиняють у 3мл ТРІСНС1-буфера і розбавляють 1:1500 ТРІС-НС1буферним розчином. Одержаний у такий спосіб розчин, що має концентрацію 13,33мг/мл, піддають послідовним розведенням 1:2 з одержанням розчинів дефібротиду, що мають концентрацію 6,66мкг/мл, 3,33мкг/мл і 1,66мкг/мл і 0,83мкг/мл, відповідно. Процедура Беруть 150мкл кожного з описаних вище стандартних розчинів дефібротиду і вносять у лунки мікропланшетів. Потім швидко готують розчин плазміну додаванням при 0°С 3,8мл ТРІС-НСl-буфера в пробірку, що містить 0,2мл розчину плазміну людини. Усе обережно перемішують, поки не відбудеться розчинення, беруть 50мкл і вносять у лунки мікропланшета з наступним додаванням 50мкл S-2251 для кожної лунки. Мікропланшет, поміщений у MRX ТСП-ридер, установлений на 37°С, перемішують протягом приблизно 10 секунд; зняття показань оптичної густини проводять при 405нм, у початковий момент часу t0 і потім кожні дві хвилини в інтервалі від 10 до 20 хвилин, відповідно до програми ферментативної кінетики. Потім експериментальні дані, виміряні для концентрацій дефібротиду від 0,1 до 100мкг/мл, обробляють (програми Excel і Sigma Plot) і представляють на графіку (лінії регресії), як показано як приклад на наступних фігурах 1 і 2. Величини кутови х коефіцієнтів b (нахил) ци х прямих ліній, що відповідають стандарту й аналізованому зразку дефібротиду (фігура 1), відкладають щодо концентрацій дефібротиду (логарифмічна шкала) (фігура 2). Як можна бачити з цього графіка, лінійну відповідь, що дозволяє ідентифікувати пряму лінію, спостерігають у центральній частині цієї кривої. У цьому інтервалі лінійності визначають активність 12 невідомої проби дефібротиду в порівнянні зі стандартом, відповідно до згаданої методології біологічного визначення з використанням рівнобіжних ліній, яка описана [Finney DJ, Statistical Method in Biological Assay, 2nd ed. Ch. Griffin, London]. Для того щоб ця методологія була застосовною, важливо, щоб був, крім лінійності, паралелізм між прямими лініями, що відносяться до стандарту і, відповідно, до дефібротиду, що підлягає тестуванню. Тест для визначення біологічної активності невідомого зразка дефібротиду у порівнянні зі стандартним дефібротидом проводять переважно з використанням концентрацій, що дають прямолінійну частину сигмоїдальної кривої, визначеної вище Зокрема, кращими є концентрації стандартного і невідомого дефібротиду в діапазоні від 0,5 до 8мкг/мл. Розміщення в лунках планшета повторів різних концентрацій дефібротиду для стандарту і для випробуваного зразка наводиться далі. Стандартний дефібротид 1 2 3 4 5 6 А - В - 0.5 8.0 4.0 2.0 1.0 С - 1.0 0.5 8.0 4.0 2.0 D - 2.0 1.0 0.5 8.0 4.0 Е - 4.0 2.0 1.0 0.5 8.0 F - 8.0 4.0 2.0 1.0 0.5 G - Н - Аналізований зразок 7 8 9 10 11 12 2.0 4.0 8.0 0.5 2.0 4.0 8.0 0.5 1.0 4.0 8.0 0.5 1.0 2.0 8.0 0.5 1.0 2.0 4.0 0.5 1.0 2.0 4.0 8.0 Стандартні розчини дефібротиду поміщають у стовпці 2-6, тоді як зразки дефібротиду, що повинні бути визначені, поміщають у стовпці 7-11, у зазначених концентраціях. На другому планшеті положення цих проб переважно є зворотними. Зовнішні стовпці та рядки мікропланшета не використовують для процесу визначення, але заповнюють водою для гарантії максимальної температурної гомогенності у всій цій системі Мікропланшет, поміщений у MRX ТСП-ридер, установлений на 37°С, перемішують протягом приблизно 10 секунд; зняття показань оптичної густини проводять при 405нм у початковий момент часу t0 і потім кожні 5 хвилин протягом періоду з 20-ої до 50-ої хвилини, відповідно до програми ферментативної кінетики. Потім величини оптичної густини обробляють (програми Excel і Sigma Plot), зводять у таблицю і представляють на графіку (лінії регресії). Потім можна розрахувати відношення активності і визначити активність невідомого зразка дефібротиду в порівнянні зі стандартом, із використанням тієї самої системи розрахунку, що описана вище. Як приклад, далі наведені таблиці (1, 2 і 3) і графіки (фігура 3, 4 і 5), що відносяться до зразків дефібротиду, випробуваним при концентрації 0,5мкг/мл, 2,0мкг/мл і 8,0мкг/мл, відповідно. 13 80104 14 15 Комп’ютерна в ерстка В. Клюкін 80104 Підписне 16 Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for determination of defibrotide biological activity
Назва патенту російськоюСпособ определения биологической активности дефибротида
МПК / Мітки
МПК: G01N 33/68, G01N 33/50, G01N 33/48, C12Q 1/68, C12Q 1/56, C12Q 1/37
Мітки: визначення, дефібротиду, спосіб, активності, біологічно
Код посилання
<a href="https://ua.patents.su/8-80104-sposib-viznachennya-biologichno-aktivnosti-defibrotidu.html" target="_blank" rel="follow" title="База патентів України">Спосіб визначення біологічної активності дефібротиду</a>
Попередній патент: Спосіб одержання золи винесення, що містить германій, галій і їх сполуки
Наступний патент: Білково-жирова емульсія з кров’ю
Випадковий патент: Електрошпатель і підставка для нього