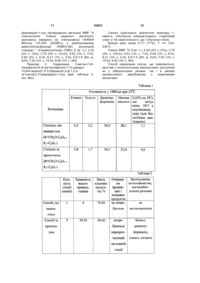
Похідні 3-метил-6,7-діарил-7,12-дигідро-1н,6н-пірано-[3′,4′:5,6]пірано[4,3-d]-1,2,4-триазоло[1,5-a]піримідин-1-онів і спосіб їх одержання
Номер патенту: 82621
Опубліковано: 25.04.2008
Автори: Руденко Роман Володимирович, Афанасіаді Людмила Михайлівна, Комихов Сергій Олександрович, Десенко Сергій Михайлович
Формула / Реферат
1. Похідні 3-метил-6,7-діарил-7,12-дигідро-1Н,6Н-пірано[3',4':5,6]пірано[4,3-d]-1,2,4-триазоло[1,5-а]піримідин-1-онів загальної формули
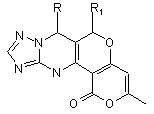 ,
,
де R - C6H5-, 4-OH-C6H4-, 4-Cl-C6H4-, 4-CH3O-C6H4-, 2,4,5-(CH3O)3-C6H2-,
R1 - H, C6H5-, 4-CH3O-C6H4-, 4-Br-C6H4-, 4-OH-C6H4-, 3-CH3O-4-OH-C6H3-, 4-CH3COO-C6H4-, 4-NO2-C6H4-.
2. Спосіб одержання похідних 3-метил-6,7-діарил-7,12-дигідро-1Н,6Н-пірано[3',4':5,6]пірано[4,3-d]-1,2,4-триазоло[1,5-а]піримідин-1-онів загальної формули
 ,
,
де R - C6H5-, 4-OH-C6H4-, 4-Cl-C6H4-, 4-CH3O-C6H4-, 2,4,5-(CH3O)3-C6H2-,
R1 - H, C6H5-, 4-CH3O-C6H4-, 4-Br-C6H4-, 4-OH-C6H4-, 3-CH3O-4-OH-C6H3-, 4-CH3COO-C6H4-, 4-NO2-C6H4-,
що включає взаємодію 3-аміно-1,2,4-триазолу з α,β-ненасиченим кетоном і альдегідами в органічному розчиннику у рівномолярному співвідношенні, який відрізняється тим, що як органічний розчинник використовують н-бутанол або н-аміловий, або ізоаміловий спирт, як α,β-ненасичений кетон використовують 1-(4-гідрокси-6-метил-2-оксо-2Н-3-піраніл)-3-арил-2-пропен-1-он.
Текст
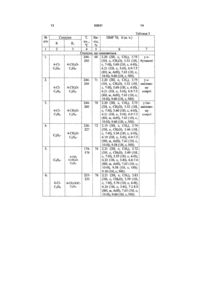
1. Похідні 3-метил-6,7-діарил-7,12-дигідро1Н,6Н-пірано[3',4':5,6]пірано[4,3-d]-1,2,4триазоло[1,5-а]піримідин-1-онів загальної формули 2 3 Винахід відноситься до області органічної хімії, а саме до складних азотовмісних гетероциклічних сполук. Ці сполуки вже достатньо тривалий час привертають увагу хіміків-синтетиків. Обумовлено це декількома причинами, одна із яких - це можливість тонко маніпулювати їх структурою для досягнення необхідних фізичних, хімічних та фармакологічних властивостей. Іншим, не менш важливим фактором є їх широке розповсюдження у природі і першорядна важливість для живих систем. Особливий інтерес представляють сполуки, що вміщують у своєму складі піримідиновий фрагмент. Це викликано тим унікальним значенням, яке мають представники цього класу в біологічних процесах живих організмів. З іншого боку, такі азотовмісні гетероциклічні сполуки являються зручними моделями при вирішенні багатьох питань теоретичної органічної хімії, а саме таких як реакційна здатність, конформаційний аналіз, Похідні піримідинів входять до складу нуклеїнових таутомерія. кислот, тому відправною логічною точкою пошуку лікарських форм, активних у відношенні до вірусів і ефективних для боротьби з онкологічними захворюваннями, може бути дослідження аналогів азагетероциклів, що входять до складу ДНК. Такі сполуки втручаються у реплікативний цикл вірусу і займають місце природного нуклеозіду. Тому зараз є дуже актуальним синтез нових похідних піримідину з різними фармакофорними угрупуваннями, які можуть відігравати важливу роль у різноманітних біопроцесах людини. Відомо, що похідні піримідинів є основною субстанцією лікарських препаратів, які успішно використовують для лікування захворювань, викликаних вірусами герпесу та ВІЛ [Иванский В.И. Химия гетероциклических соединений, М.: Высшая школа, 1978, 560с], проявляють високу гіпнотичну активність, мають високу ефективність при лікуванні захворювань серцево-судинної і ендокринної систем [заявка ЕР №203721, CO7D473/06]; [заявка ЕР №267607, CO7D473/06], виявляють антиалергічну активність [Baziard-Mongsset G., Rached A. et al. Eur. J. Med. Chem., 1995, 30 №3, p.253], діуретичний ефект та антидепресивні властивості [Patent US 5290782 CO7D473/02]. у сполуках 4-гідрокси-2Н-піронового Наявність фрагмента, який також входить до складу великої кількості як природних, так і синтетичних сполук, передбачає виявлення таких видів фізіологічної активності, як антибіотична, цитотоксична, протипухлинна та антиоксидантна [Daylight Chemical Information System, WDI 001 and WDA Database Version 4.73, 2000, Los Altos, CA, USA]. Використання складних азотовмісних гетероциклічних сполук як біологічно активних речовин потребує підвищення ступеня доступності цих класів і безперервного розвитку й удосконалення методів їх синтезу. Дуже важлива для фізіологічно активних речовин стійкість у кислих середовищах, що імітують кислотність шлункового соку; висока розчинність їх у органічних розчинниках і воді розширює їх можливості використання для біологічних 82621 4 досліджень і медичної діагностики, в якості барвників, хімічних засобів захисту рослин у сільському господарстві і таке інше. Відомий структурний аналог сполук, що заявляються, 1-(2-хлорфенил)-1,2,4,10тетрагідро-9-оксо-2,4-діазофенантрен-3-он формули І: і спосіб його одержання [Wang Zong-Ting, Xu Li-Wen et al. Tetrahedron Lett., 45, №2, 7951(2004)]. Сполуки формули І безколірні кристали, що не розчиняються у спиртах і воді, погано розчиняються у неполярних органічних розчинниках (бензол, толуол), розчиняються у сильно полярних розчинниках (диметилформамід, диметилсульфоксид). Сполуки І можуть алкілуватися різними алкілуючими агентами, легко ацилюються за вторинною аміногрупою у положенні 3 дигідропіримідинового циклу у середовищі оцтового ангідриду при нагріванні. Сполуки І завдяки своїм фармакологічним і терапевтичним властивостям, таким як антибактеріальна та антигіпертензивна активності, в останній час притягують особливу увагу не тільки хіміків-синтетиків, але і медиків, біологів, фармацевтів [Y. Ma, C.Qian, L. Wang et al., J. Med. , Chem.,38, 119(1995)]. Недоліком відомої структури І є недостатня стійкість до дії окислювачів (брому, бромсукциніміду і таке інші). Спосіб одержання відомої сполуки складається з 3-ох стадій і реалізується за схемою: На першій стадії фенол сплавляють з 3хлорпропіоновою кислотою у присутності лужного агента КОН з утворенням 3-феноксипропіонової кислоти, яку після нейтралізації НСI виділяють екстракцією діетиловим ефіром і концентрованим розчином Na2CO3. Час протікання реакції на першій стадії складає приблизно 6 годин, вихід 3феноксипропіонової кислоти становить 36%. 3-Феноксипропіонову кислоту, що утворилася, на другій стадії змішують з РСl5 у бензолі, суміш охолоджують до 5°С і при постійному охолодженні у реакційну масу вносять безводний АІСІ 3. 5 Одержану суміш витримують 2 години, після чого комплекс розкладають льодом і відділяють бензольний шар, який промивають NaOH, водою і сушать над СаСl2. Бензол видаляють відгонкою, продукт перекристалізовують із петролейного ефіру при охолодженні рідким азотом. Вихід хроман-4-она складає 30%. На третій стадії конденсують хроман-4-он (1М), 2-хлорбензальдегід (1М), сечовину (1,5М) і триметилхлорсилан (1М) в ацетонітрилі у присутності каталітичних кількостей хлориду заліза (III) з одержанням сполуки формули І. Реакційну суміш нагрівають впродовж 12 годин. На думку авторів, триметилхлорсилан (ТМХС) виконує функцію активатора карбонільної групи кетона. Сечовину використовують у півторакратному надлишку у порівнянні із хроман4-оном і альдегідом. Сумарний вихід технічного продукту складає ~10% з урахуванням всіх технологічних стадій процесу. одержання сполуки Одним із недоліків способу формули І є те, що в таких умовах проведення реакції внаслідок низької температури кипіння розчинника - ацетонітрилу (т. кип. 81,6°С) не можна перейти до одержання більш складних азотовмісних гетероциклів. У зв'язку з вказаним метод також не може бути застосований до циклічних 1,3-азотвмістних бінуклеофілів, що мають амідиновий фрагмент. Все це робить спосіб одержання сполуки формули І виборчим і не дозволяє розширювати асортимент фізіологічно важливих речовин. Крім того, вказаний спосіб є трьохстадійним тривалим процесом з використанням легко займистих, горючих і отруйних речовин (діетиловий ефір, ацетонітрил, бензол, триметилхлорсилан). Триметилхлорсилан - легколетучий, отруйний реагент, що викликає подразнення слизової оболонки очей, верхніх дихальних шляхів, шкіри. При попаданні на шкіру викликає опіки. Хлоровмісні реагенти АlСl3 і РСІ 5 виявляють подразнювальну дію на слизову оболонку очей, органів дихання, при взаємодії з водою виділяють велику кількість тепла, спричиняючи опіки шкіряних покровів. Мають задушливий і сльозоточивий характер. Очистка проміжних продуктів шляхом екстракцій і відгонки легкозаймистих розчинників збільшує не тільки час проведення синтезу, але і вогненебезпечність способу одержання сполуки формули І. У зв'язку з викладеним технічне рішення має обмежене використання. Відомий аналог сполук, що заявляються, за хімічною структурою і способом одержання - 3,7дигідро-2Н-1,2,4-тріазоло[1',5'-а]піримідо[4,5d]бензо[b]пірани структурної формули II 82621 6 наведений в [С.М. Десенко, В.Д. Орлов и др. Химия гетероциклических v соединений, №2, 240 (1996)]. Сполуки формули II являють собою безколірні кристали, що не розчиняються у неполярних розчинниках (бензол, толуол), слабо розчинні у спиртах (~1 - 1,5г/л), розчиняються у сильно полярних розчинних (диметилформамід, диметилсульфоксид, піридин), причому при збільшенні полярності розчинника збільшується і розчинність сполук формули II; мають високу температуру плавлення (>200°С), нестійкі у кислих і лужних середовищах. Так, при нагріванні сполук формули II у диметилсульфоксиді у присутності лужного агента КОН пірановий цикл розкривається. Спосіб одержання сполук формули II складається із 3-ох стадій і здійснюється за схемою: На першій стадії проводять реакцію взаємодії R2-заміщених 2-гідроксиацетофенону з ароматичними альдегідами в етиловому спирті у присутності 50% розчину NaOH при кімнатній температурі та інтенсивному перемішуванні впродовж 6 годин до випадання натрієвої солі халкону в осад. Реакційну масу залишають на 12 годин, після чого нейтралізують 10% розчином НСl.На другій стадії халкон, одержаний на першій стадії, конденсують з 3-аміно-1,2,4-тріазолом у середовищі диметилформаміду при кипінні протягом 30 хвилин, після чого висаджують бензолом; суміш залишають на 5 годин для одержання 7-арил-5-(2-гідроксифеніл)-6,7-дигідро1,2,4-тріазоло[1,5-а]піримідину, який потім перекристалізовують із метанолу. Наявність у дигідропіримідиновому циклі одержаної на другій стадії сполуки двох потенційних реакційних центрів припускає можливість формування як бензопіранового, так бензоксазінового циклів. Однак, як стверджують автори, в умовах реакції з ароматичними альдегідами спостерігається утворення виключно бензопіранових систем. Тому на третій стадії при взаємодії 7-арил-5(2-гідроксифеніл)-6,7-дигідро-1,2,4-тріазоло[1,5а]піримідинів (1М) з ароматичними альдегідами (1М) у диметилформаміді одержують індивідуальні продукти 3,7-дигідро-2Н-1,2,4-тріазоло[1',5'а]піримідо[4,5-d]бензо[b]пірани. Реакція проходить при нагріванні протягом 30 хвилин, в реакційну масу додають бензол, охолоджують. Осад, що випав, відфільтровують і перекристалізовують із суміші диметилформамід - бензол для одержання чистого продукту. 7 Загальний час проведення реакції ~30 - 33 години. До недоліків способу одержання сполук формули II слід віднести багато стадійність і тривалість синтезу, що приводить до додаткових витрат реактивів, робочого часу і енерговитрат. Проміжні продукти, одержані на кожній стадії, і кінцевий продукт потребують обов'язкової очистки - перекристалізацій із легкозаймистих, горючих і отруйних розчинників (бензол, метанол, диметилформамід); невисокі виходи кінцевих продуктів (24 - 62%). Диметилформамід, що використовують для перекристалізації і як середовище для проведення реакцій, має місцеву подразнювальну (на слизові оболонки верхніх дихальних шляхів, очей і шкіру) і загальнотоксичну дію. Викликає порушення дихання і кровообігу. У якості прототипу за хімічною будовою і способом одержання до сполук, що заявляються, вибрано останній із наведених аналогів. В основу винаходу поставлено задачу пошуку нових сполук у низці пірано[4,3-d]піримідинів, що мають більш високу розчинність в органічних розчинниках і більшу стійкість до дії кислих реагентів (окислювачей), а також у розробці простого, доступного способу одержання таких сполук, що дозволяє скоротити тривалість процесу, зменшити кількість технологічних стадій, підвищити вихід основних продуктів реакції і їх якість, виключити із синтезу шкідливі, легкозаймисті і вогненебезпечні речовини. Рішення поставленої задачі забезпечується розробкою нових похідних 3-метил-6,7-діарил7,12-дигідро-1Н,6Н-пірано[3',4':5,6]пірано[4,3-d]1,2,4-тріазоло[1,5-а]піримідин-1-онів формули Рішення поставленої задачі вирішується також тим, що у спосіб одержання сполук, що заявляються, який включає взаємодію 3-аміно1,2,4-тріазолу з α,β-ненасиченим кетоном і альдегідами в органічному розчиннику у рівномолярному співвідношенні, згідно винаходу, в якості органічного розчинника використовують нбутанол, або н-аміловий, або ізоаміловий спирт, в якості α,β-ненасиченого кетона використовують 1(4-гідрокси-6-метил-2-оксо-2Н-3-піраніл)-3-арил-2пропен-1-он. Експериментальним шляхом було установлено, що використання в якості розчинника висококиплячих спиртів - н-бутилового, намілового або ізоамілового - у процесі синтезу сполук, що заявляються, дозволяє одержувати кінцеві сполуки без домішок смолистих побічних продуктів, що дає можливість виділяти чисті сполуки без додаткових перекристалізацій. Це, в свою чергу, дозволяє підвищити вихід і якість готових продуктів, скоротити тривалість всього процесу до 5 годин, а також знизити витрати робочого часу і енерговитрати. Використання указаних розчинників у способі одержаних сполук, що заявляються, суттєво 82621 8 сказалося на чистоті кінцевих продуктів. Якщо у способі за прототипом сполуки формули II потребують очищення шляхом перекристалізації із суміші диметилформамід-бензол, то за способом, що заявляється, сполуки одержують достатньо чистими, що не потребують таких перекристалізацій. До такого позитивного ефекту привела вдала заміна розчинника для проведення реакції: у способі за прототипом диметилформамід, у способі, що заявляється, висококиплячі спирти -н-бутиловий, н-аміловий або ізоаміловий. Виявилося, що висококиплячі спирти (нбутиловий т. кип. 118°С; н-аміловий - 138°С; ізоаміловий 132°С) на відміну від диметилформаміду (т. кип. 153°С), у процесі реакції не сприяють утворенню смолистих побічних продуктів, що забруднюють кінцеві цільові сполуки. Це дає можливість одержувати чисті сполуки відразу у процесі синтезу без додаткових перекристалізацій. Вибір розчинника для реакції також забезпечує необхідну пожежо- і вибухонебезпечність проведення синтезу. Спосіб, що заявляється, є одностадійним, проходить у колбі-реакторі шляхом хімічної взаємодії всіх реагентів відразу у визначених умовах реакції, що дає можливість не тільки скоротити час реакції, поліпшити якість продуктів, але і підвищити вихід, скоротити кількість технологічних стоків, знизити витрати робочого часу і енерговитрати. Сполуки, що заявляються, являють собою високо плавкі (Т. пл. > 180°С), кристалічні складні азотовмісні гетероциклічні речовини, що інтенсивно забарвлені в кольори від жовтого до жовто-оранжевого. Сполуки, що заявляються, стійкі до дії кислих реагентів і до окислювально-відновних процесів при кімнатній температурі і нагріванні; добре розчиняються у полярних розчинниках (піридин, диметилформамід, диметилсульфоксид), спиртах, оцтовій кислот; мало розчинні у неполярних розчинниках (бензол, толуол); не розчиняються у воді. Введення у молекули сполук, що заявляються, додаткового, на відміну від молекул прототипу та аналогу, циклічного 2-оксо-2Н-піранового фрагмента забезпечує кращі сольватаційні властивості і є причиною підвищення розчинності цих речовин у полярних розчинниках (див. таблицю 1). Видозмінення структури сполук, що заявляються, у порівнянні з прототипом привело до появи нових властивостей. Так, наявність метальної групи у пірановому циклі підвищує розчинність сполук в органічних розчинниках, а гідроксигрупа у лужних середовищах приводить до появи водорозчинних сполук, що для таких складних структур виявилося зовсім несподіваним. Наявність карбонільної групи лактонного характеру у молекулах сполук, що заявляються, обумовлює появу внутрішньомолекулярного водневого зв'язку, що є причиною стабільності частково гідрованої форми даних сполук в умовах дії кислих реагентів і до окислювально-відновних процесів (у сполуках II за прототипом карбонільна -С=О група відсутня, вони гетероароматизуються у 9 суперлужних середовищах). Спосіб, заявляється, здійснюється за схемою: 82621 що Експериментальним шляхом виявлено, що рівномолярні кількості 3-аміно-1,2,4-тріазолу і відповідного ненасиченого кетону кип'ятять 1 годину у н-бутиловому (або н-аміловому або ізоаміловому) спирті, після чого до реакційної маси додають рівномолярну кількість відповідного альдегіду і кип'ятять ще 2 години. Продукт, що випадає при охолодженні реакційної маси до кімнатної температури, відфільтровують, промивають етанолом і сушать. із компонентів Використання будь-якого реакції у більшому або меншому співвідношенні приводить до утворення суміші продуктів, що не прореагували, вихідних і кінцевих речовин. Виходи сполук, що замовляються, складають 60-85%. У процесі синтезу одержують достатньо чисті речовини, що не потребують додаткової очистки. Це виключає додаткові витрати органічних розчинників, енерговитрати, знижує вартість кінцевих продуктів, зменшує час їх одержання та мінімізує технологічні шкідливі стоки виробництва. 1 приведено порівняльні дані з У таблиці розчинності сполуки, що заявляється, і сполуки за прототипом. У таблиці 2 представлено порівняльні дані способу одержання сполук, що заявляються, і сполук за прототипом. Характеристики сполук, що заявляються, і сполук за прототипом наведено у таблиці 3. Слід також сказати, що структура сполук, що заявляються, представляє інтерес як з точки зору використання їх у якості потенційних життєво важливих біологічно активних речовин, так і для практичного використання у якості барвників, водорозчинних препаратів у біологічних дослідженнях і медичній діагностиці. Інтенсивне забарвлення сполук, що заявляються, є наслідком наявності двох фрагментів різної електронної природи, розділених крос-супряженням - p-акцепторного тріазольного і p-донорного піранового фрагментів, що забезпечує можливість використання сполук в якості барвників. Так, розчинність сполук, що заявляються, в оцтовій кислоті та їх інтенсивне глибоке забарвлення припускає використання речовин для забарвлення бавовняних тканин. Якісне фарбування бавовни, що проведено сполуками 1, 7, 9, 10, 13, 14 (див. таблицю 3) в 50% оцтовій кислоті при кип’ятінні впродовж 10 хвилин, показало можливість використання сполук, що заявляються, в якості барвників для бавовни. Барвники №№1, 7, 14 забарвлюють бавовну у жовтий, №№9, 10 - у світло-жовтий, а №13 - у оранжевий кольори. Для проведення 10 іспитів 0,01г барвника розчиняють при нагріванні у 2мл 50% оцтової кислоти; у кубовий розчин опускають бавовну розміром 2*2см2 і кип'ятять 10 хвилин. Об'єкт, що забарвлюється, виймають із кубового розчину, промивають водою, 20% NaCl і сушать. У лужних середовищах сполуки, що заявляються і вміщують гідроксигрупу, розчиняються при нагріванні з утворенням солей лужних металів, які розчиняються у воді. Це передбачує їх використання в якості водорозчинних барвників у біологічних дослідженнях. Такі барвники, проникаючи до біологічних об'єктів, що досліджуються, змінюють свої оптичні характеристики (наприклад, знебарвлюються), і це дає можливість вивчати різніМожливість біомолекул. хімічної структури властивості модифікації сполук, що заявляються, шляхом варіювання ароматичних радикалів R і R1 дозволяє одержувати широкий асортимент нових речовин і потенційних фізіологічно активних сполук у низці похідних пірано[4,3-d]піримідинів, що мають важливе значення для життєдіяльності живих організмів (лікарські препарати різного призначення, біохімічні препарати і таке інше). Як видно із опису матеріалів винаходу і даних таблиць 1-3, структура сполук, що заявляються, забезпечує одержання широкого асортименту похідних тріазолопіранопіримідинів з покращеними характеристиками - підвищеною розчинністю, високим ступенем чистоти, стійкістю у кислих середовищах; завдяки стійкості сполук, що заявляються, у розчинах з різним рН, вони мають постійний склад. Підвищена розчинність у полярних розчинниках дозволяє створювати високу концентрацію речовин у розчинах, що, в свою чергу, відіграє важливу роль при проведенні біологічних досліджень (забезпечує широкі концентраційні інтервали для біологічних тестів). Підвищена розчинність цих сполук у 0,52% НСl, що імітує концентрацію НСI у шлунковому соку, у порівнянні із сполуками за прототипом, також сприяє позитивному проведенню цих тестів. Спосіб одержання сполук, що заявляються, ілюструється наступними прикладами. Приклад 1. Одержання 3-метил-7-(4хлорфеніл)-6-(4-метоксифеніл)-7,12-дигідро1Н,6Н-пірано[3',4':5,6]пірано[4,3-d]-1,2,4тріазоло[1,5-а]піримідин-1-ону (див. таблиця 3, поз. №1) У круглодонну колбу, що обладнана зворотним холодильником, завантажують суміш 0,17г (0,002М) 3-аміно-1,2,4-тріазолу і 0,58 (0,002М) 1-(4-гідрокси-6-метил-2-оксо-2Н-3піраніл)-3-(4-хлорфеніл)-2-пропен-1-ону у 3мл нбутилового спирту. Реакційну масу кип'ятять впродовж 1 години, а потім додають 0,28г (0,002М) 4-метоксибензальдегіду і продовжують нагрівання ще 2 години. Осад, що випадає після охолодження реакційної маси, відфільтровують, промивають 10мл етилового спирту і сушать. Вихідні дані: вихід 0,7г (68%). Т. пл. 244-245°С. Структуру 3-метил-7-(4-хлорфеніл)-6-(4метоксифеніл)-7,12-дигідро-1Н,6Нпірано[3',4':5,6]пірано[4,3-d]-1,2,4-тріазоло[1,5 11 а]піримідин-1-ону підтверджено методом ЯМР 1H спектроскопії. Спектр ядерного магнітного резонансу виміряно на спектрометрі VARIAN Mercury VX-200 (200МГц) у дейтерованому диметилсульфоксиді (DMSO-d6), внутрішній стандарт - тетраметилсилан (TMS); δ (м. ч.): 2.20 (3Н, с, СН3), 3.75 (3Н, с, СН3О), 5.52 (1Н, с, 7-Н), 5.60 (1Н, с, 6-Н), 6.21 (1Н, с, 3-Н), 6.9-7.5 (8Н, м, АrН), 7.63 (1Н, с, 10-Н), 9.60 (1Н, с, ΝΗ). Приклад 2. Одержання 3-метил-7-(4хлорфеніл)-6-(4-метоксифеніл)-7,12-дигідро1Н,6Н-пірано[3',4':5,6]пірано[4,3-а]-1,2,4тр1азоло[1,5-а]піримідин-1-ону (див. таблиця 3, поз. №2). 82621 12 Синтез здійснюють аналогічно прикладу 1, замість н-бутанолу використовують н-аміловий спирт у тій самій кількості, що і н-бутанол (3мл). Вихідні дані: вихід 0,71г (71%). Т. пл. 244245°С. Спектр ЯМР 1 Н, δ (м. ч.): 2.20 (3Н, с, СН3), 3.75 (3Н, с, СН3О), 5.52 (1Н, с, 7-Н), 5.60 (1Н, с, 6-Н), 6.21 (1Н, с, 3-Н), 6.9-7.5 (8Н, м, АrН), 7.63 (1Н, с, 10-Н), 9.60 (1H, с, ΝΗ). Спосіб одержання сполук, що заявляються, простий у технологічному використанні, доступний як у лабораторних умовах, так і в умовах промислового виробництва з невеликими витратами. 13 82621 14 15 Комп’ютерна верстка Т. Чепелева 82621 Підписне 16 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською3-methyl-6,7-diaryl-7,12-dihydro-1н,6н-pyrano[3',4':5,6]pyrano[4,3-d]-1,2,4-triazolo[1,5-a]pyrimidine-1-ones derivatives and process for the preparation thereof
Автори англійськоюRudenko Roman Volodymyrovych, Komikhov Serhii Oleksandrovych, Desenko Serhii Mykhailovych, Afanasiadi Liudmyla Mykhailivna
Назва патенту російськоюПроизводной 3-метил-6,7-диарил-7,12- дигидро-1н,6н-пирано-[3',4':5,6]пирано[4,3-d]-1,2,4-триазоло[1,5-a]пиримидин-1-онов и способ их получения
Автори російськоюРуденко Роман Владимирович, Комихов Сергей Александрович, Дэсэнко Сергей Михайлович, Десенко Сергей Михайлович, Афанасиади Людмила Михайловна
МПК / Мітки
МПК: A61K 31/519, C07D 311/00, C07D 249/16, C07D 239/70
Мітки: одержання, 3-метил-6,7-діарил-7,12-дигідро-1н,6н-пірано-[3',4':5,6]пірано[4,3-d]-1,2,4-триазоло[1,5-a]піримідин-1-онів, похідні, спосіб
Код посилання
<a href="https://ua.patents.su/8-82621-pokhidni-3-metil-67-diaril-712-digidro-1n6n-pirano-3456pirano43-d-124-triazolo15-apirimidin-1-oniv-i-sposib-kh-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-метил-6,7-діарил-7,12-дигідро-1н,6н-пірано-[3′,4′:5,6]пірано[4,3-d]-1,2,4-триазоло[1,5-a]піримідин-1-онів і спосіб їх одержання</a>
Попередній патент: Мастило для вузлів тертя промислового обладнання і транспортних засобів
Наступний патент: Електродоутримувач сухотіна
Випадковий патент: Спосіб покращення твердого матеріалу і пристрій для його здійснення