Пероральна дозована форма похідних гемцитабіну
Номер патенту: 90893
Опубліковано: 10.06.2010
Автори: Мірен Фінн, Еріксен Олє Хенрік, Сандвольд Маріт Ліланд
Формула / Реферат
1. Застосування похідного гемцитабіну формули І:
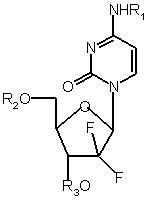 , (I)
, (I)
де R1, R2 і R3 незалежно вибрані з водню і C18- і С20-насичених і мононенасичених ацильних груп, за умови, що всі R1, R2 і R3 не можуть являти собою водень, або його фармацевтично прийнятної солі для приготування пероральної дозованої форми, що містить приблизно від 0,1 мг до 20 грамів на день похідного гемцитабіну формули (І) або його фармацевтично прийнятної солі, при лікуванні раку.
2. Застосування за п. 1, в якому пероральна дозована форма містить приблизно від 100 мг до 2 грамів на день похідного гемцитабіну формули (І) або його фармацевтично прийнятної солі.
3. Застосування за п. 1 або 2, в якому похідне гемцитабіну формули (І) являє собою складний ефір елаїдинової кислоти (5')-гемцитабіну.
4. Застосування за п. 1, в якому пероральна дозована форма додатково містить фармацевтично прийнятні наповнювачі, розріджувачі і/або носії.
5. Пероральна дозована форма, придатна для лікування раку, що містить приблизно від 0,1 мг до 20 грамів на день похідного гемцитабіну формули (І), як визначено в п. 1, або його фармацевтично прийнятної солі.
6. Пероральна дозована форма за п. 5, в якій вказана дозована форма містить приблизно від 100 мг до 2 грамів на день похідного гемцитабіну формули (І), як визначено в п. 1, або його фармацевтично прийнятної солі.
7. Пероральна дозована форма за п. 5 або 6, в якій похідне гемцитабіну формули (І) являє собою складний ефір елаїдинової кислоти (5')-гемцитабіну.
8. Пероральна дозована форма за п. 5, в якій вказана дозована форма додатково містить фармацевтично прийнятні наповнювачі, розріджувачі і/або носії.
9. Спосіб поліпшення комплаєнтності при лікуванні раку у суб'єкта, потребуючого такого лікування, який включає в себе пероральне введення такому суб'єкту терапевтично ефективної кількості похідного гемцитабіну формули (І), як визначено в п. 1, або його фармацевтично прийнятної солі.
Текст
1. Застосування похідного гемцитабіну формули І: NHR1 2 UA 1 Даний винахід стосується пероральних дозованих форм певних похідних довголанцюжкових насичених і мононенасичених жирних кислот і 2',2'дифтордеоксицитидину (гемцитабіну). Зокрема, даний винахід стосується застосування вказаних похідних гемцитабіну або їх фармацевтично прийнятної солі для приготування пероральної дозованої форми для поліпшення комплаентності при лікуванні раку. Гемцитабін має формулу: 3 Похідні згідно з даним винаходом можуть бути представлені формулою І: де R1, R2 і R3 незалежно вибираються з водню і C18- і С20-насичених і мононенасичених ацильних груп, за умови, що всі R1, R2 і R3 не можуть являти собою водень. З WO 98/32762 відомо, що сполуки формули (І) є придатними для використання при лікуванні раку. Крім того, гемцитабін являє собою добре відому цитостатичну сполуку, представлене на ринку під торговим найменуванням Gemzar, від Eli Lilly & Co. Gemzar вводиться внутрішньовенно (В.В.). Причина для вибору парентерального способу введення пов'язана з токсичністю гемцитабіну. Подібно до множини лікарських засобів, очевидно, було б бажаним мати можливість для перорального введення гемцитабіну. Для пацієнта пероральне введення звичайно є набагато більш приємним, ніж внутрішньовенне введення. Як правило, доза в термінах мг/кг повинна збільшуватися, при ентеральному введенні (пероральному), в порівнянні з парентеральним, через біологічну доступність, меншу ніж 100%. З цієї причини, лікарські засоби, що мають високу міру токсичності, не є придатними для перорального введення. Це застосовно і у випадку гемцитабіну. Експерименти показали, що токсичність гемцитабіну сильно збільшується після перорального введення. Тобто, токсичність гемцитабіну сильно збіль 90893 4 шується після перорального введення, в порівнянні з токсичністю після внутрішньочеревинного (парентерального) введення. Автори несподівано виявили, що токсичність після перорального введення похідних формули (І) порівнянна з токсичністю внутрішньочеревинного (парентерального) дозування вказаної сполуки. Головною задачею даного винаходу є знаходження шляхів до отримання можливості перорального введення похідних гемцитабіну, що є настільки ж ефективними або більш ефективними, ніж сам гемцитабін, при лікуванні раку. Ця і інші задачі даного винаходу досягаються згідно з прикладеною формулою винаходу. Відповідно до одного з варіантів здійснення даного винаходу, передбачається застосування похідного гемцитабіну формули (І): де R1, R2 і R3 незалежно вибрані з водню і C18і С20-насичених і мононенасичених ацильних груп, за умови, що всі з R1, R2 і R3 не можуть являти собою водень або його фармацевтично прийнятної солі, для приготування пероральної дозованої форми для поліпшення комплаентності при лікуванні раку. Гемцитабін має три дериватизованих функціональних групи, а саме, 5'- і 3'-гідроксильні групи і N4-аміно групу. Кожна група може селективно перетворюватися в складноефірне або амідне похідне, але також можуть формуватися діаддукти (складні діефіри або складні ефіри - аміди) і триаддукти. У випадку ди- і триаддуктів ацильні групи - замісники не повинні бути обов'язково однаковими. У цей час є переважними моноацильні похідні згідно з даним винаходом, тобто похідні, в яких два з R1, R2 і R3 являють собою водень. Є особливо переважним, щоб монозаміщення за допомогою ацильної групи здійснювалося в 3'-О і 5'-O положенні залишку цукру, при цьому 5'-O заміщення є найбільш переважним. Подвійний зв'язок мононенасичених ацильних груп може знаходитися або в цис, або в транс конфігурації, хоча терапевтичний вплив може змінюватися в залежності від того, яка конфігурація використовується. Положення подвійного зв'язку в мононенаси 5 чених ацильних групах також, очевидно, впливає на активність. У цей час, автори віддають перевагу використанню складних ефірів або амідів, що мають ненасиченість в їх положенні -9. У -системі номенклатури, положення подвійного зв'язку мононенасиченої жирної кислоти відлічується від кінцевої метальної групи, так що, наприклад, ейкозенова кислота (С20:1 -9) має 20 атомів вуглецю в ланцюгу і єдиний подвійний зв'язок утворюється між 9 і 10 атомами вуглецю, відлічуючи від метального кінця ланцюга. Автори віддають перевагу використанню складних ефірів, складних ефірів амідів і амідів, отриманих з олеїнової кислоти (C18:1 -9, цис), елаїдинової кислоти (C18:1 -9, транс), ейкозенової кислоти (кислот) (C20:1 -9, цис) і (C20:1 -9, транс), і аміди і 5'-складні ефіри в цей час є найбільш переважними похідними згідно з даним винаходом. У деяких випадках переважно використовуються складні ефіри, складні ефіри - аміди і аміди гемцитабіну, отримані з стеаринової кислоти (С18:0) і ейкозанової кислоти (С20:0). Амід елаїдинової кислоти (N4)-гемцитабіну, складний ефір елаїдинової кислоти (5')гемцитабіну і складний ефір елаїдинової кислоти (3')-гемцитабіну знаходяться серед найбільш переважних похідних згідно з даним винаходом. У переважному варіанті здійснення даного винаходу передбачається застосування складного ефіру елаїдинової кислоти (5')-гемцитабіну для приготування пероральної дозованої форми для поліпшення комплаентності при лікуванні раку. Відповідно до іншого варіанту здійснення, даний винахід стосується пероральної дозованої форми, придатної для поліпшення комплаентності при лікуванні раку, яка містить похідне гемцитабіну формули (І) або його фармацевтично прийнятну сіль. Даний винахід також передбачає спосіб для поліпшення комплаентності при лікуванні раку у суб'єкта, потребуючого такого лікування, який включає пероральне введення такому суб'єкту терапевтично ефективної кількості похідного гемцитабіну формули (І), як визначено в п. 1 формули винаходу, або його фармацевтично прийнятної солі. Похідні формули (І) отримують відповідно до способів, відомих в даній галузі (див. WO 98/32762 відносно додаткових деталей). Термін "терапевтично ефективна кількість", як тут використовується, відноситься приблизно до 0,1мг - 20 грамів на день похідного гемцитабіну формули (І) або його фармацевтично прийнятній солі, більш переважно, приблизно до 100мг - 2 грамів на день похідного гемцитабіну формули (І) або його фармацевтично прийнятній солі, в складі, 90893 6 що містить 0,001 - 100% вказаного похідного або його солі, приготованому в капсулі, таблетці, суміші, колоїдній суспензії або в інших системах для перорального введення. Надалі даний винахід описаний за допомогою прикладів і прикладених фігур (фиг. 1-4). Приклади розглядаються тільки як ілюстративні і не повинні розглядатися як такі, що обмежують. Фіг.1 показує протипухлинну активність складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну при прищепленому ракові товстої кишки Со5776. Фіг.2 показує протипухлинну активність складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну після внутрішньочеревинного введення миші з прищепленим раком товстої кишки людини Со6044. Фіг.3 показує пероральний вплив складного ефіру елаїдинової кислоти (5')-гемцитабіну на прищеплений Со6044. Фіг.4 показує середню масу тіла тварин, що піддаються лікуванню. ПРИКЛАДИ Приклад 1 Основні експерименти Коли сполуки, що досліджуються, вводяться в кожний третій день, з повторенням п'ять разів, причому обидві сполуки, що досліджуються, вводяться в їх максимально переносимих дозах (MTD), максимальна переносима доза для гемцитабіну становить приблизно 120мг/кг на ін'єкцію, в порівнянні з 40мг/кг на ін'єкцію для складного ефіру елаїдинової кислоти (5')-гемцитабіну. Це показане нижче за допомогою експериментів, представлених в таблиці 1 і таблиці 2, з використанням різних ліній мишей, а також різними ксенотрансплантатів раку товстої кишки людини. Протипухлинна активність складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну в моделі ксенотрансплантату раку товстої кишки людини Со5776 Рак товстої кишки людини Со5776 вводять самиці миші NCR:nu/nu підшкірно, і лікування починається, коли пухлини досягають середнього об'єму 100мм3. Лікування здійснюється внутрішньочеревинно за допомогою гемцитабіну (120мг/кг) або складного ефіру елаїдинової кислоти (5')-гемцитабіну (40мг/кг). Як можна побачити на Фіг.1, висока протипухлинна активність з точки зору зменшення зростання пухлини отримана як для гемцитабіну, так і для складного ефіру елаїдинової кислоти (5')-гемцитабіну. Токсичність в термінах втрати маси є схожою, при цьому дещо більша токсичність видна для гемцитабіну, але обидва, як вважається, знаходяться при максимальній переносимій дозі. 7 90893 8 Таблиця 1 Протипухлинна активність на самицях мишей NCR:nu/nu з імплантованим Colon 5776 (карциномою товстої кишки людини), яких лікують внутрішньочеревинно складним ефіром елаїдинової кислоти (5')-гемцитабіну або гемцитабіном Сполука Кількість мишей Дні лікуванСпосіб ня D8, 11, 14, В/ч 17, 20 Доза мг/кг Смерть через токсичність (d) BWC1 [%] Оптимальне Т/С [%] Сольовий зозчин 8 Складний ефір глаїдинової кислоти (5')гемцитабіну 8 D8, 11, 14, 17, 20 В/ч 40 0 -4 17* Гемцитабін 8 D8, 11, 14, 17, 20 В/ч 120 1(18) -5 17* 1 * значуще відрізняється від контрольного сольового розчину 1 BWC = зміна маси тіла, Т/С = об'єм пухлини, що зазнає лікування, по відношенню до об'єму контрольної пухлини В/ч - внутрішньочеревинно Протипухлинна активність складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну на моделі ксенотрансплантату раку товстої кишки людини Самицям мишей NCR:nu/nu, по 8 в групі, вводять ксенотрансплантат раку товстої кишки людини Со6044 і лікують внутрішньочеревинно на кож ний третій день по п'ять разів складним ефіром елаїдинової кислоти (5')-гемцитабіном (40мг/кг) або гемцитабіном (120мг/кг). Лікування починають, коли пухлини досягають середнього об'єму 100мм3. Отримують чудовий протипухлинний вплив для складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну. Таблиця 2 Протипухлинна активність на самцях мишей NMRI з імплантованим Со6044 (карциномою товстої кишки людини), яких лікують внутрішньочеревинно складним ефіром елаїдинової кислоти (5')-гемцитабіном або гемцитабіном Сполука кількість мишей Сольовий розчин 8 Складний ефір елаїдинової кислоти (5')-гемцитабіну 8 Гемцитабін 8 Дні лікування* D8, 11, 14, 17, 20 D8, 11, 14, 17, 20 D8, 11, 14, 17, 20 Спосіб Доза мг/кг Смерть через токсичність (d) В/ч BWC1 [D8-15] Оптимальне Т/С [%] -1 В/ч 40 0 -1 19* В/ч 120 0 -3 15* * значуще відрізняється від контрольного сольового розчину 1 BWC = зміна маси тіла, Т/С = об'єм пухлини, що зазнає лікування, по відношенню до об'єму контрольної пухлини В/ч - внутрішньочеревинно Приклад 2 Протипухлинна активність складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну проти Со6044 після перорального введення Протипухлинна активність після перорального введення складного ефіру елаїдинової кислоти (5')-гемцитабіну і гемцитабіну досліджується в перший раз на мишах NCR:nu/nu. Найнижчу початкову дозу вибирають на основі даних внутрішньочеревинного введення. Доза гемцитабіну, яка добре переноситься і є активною, коли вводиться внутрішньочеревинно (120мг/кг на ін'єкцію), є сильно токсичною, і є неможливою оцінка протипухлинної активності, оскільки гемцитабін є токсичним при всіх дозах, що досліджуються. У протилежність цьому, і несподівано для авторів, доза складного ефіру елаїдинової кислоти (5')-гемцитабіну (40мг/кг), яка, як показано, є сильно активною після внутрішньочеревинного введення, є також сильно активною і переносимою, коли вводиться перорально. Ці результати показані в Таблиці 3. Ці несподівані дані підтверджуються даними, 9 90893 показаними в Таблиці 4, де демонструється, що пероральне введення елаїдинової кислоти (5')гемцитабіну дає високу протипухлинну активність 10 при переносимих дозах з різними часовими режимами введення. Таблиця 3 Протипухлинна активність на самицях мишей NCR:nu/nu з імплантованим Colon 6044 (карциномою товстої кишки людини), яких лікують перорально складним ефіром елаїдинової кислоти (5')-гемцитабіном або гемцитабіном Сполука Смерть через токсичність (d) Дні лікування Спосіб 8 Q3x5 Пероральний 8 Q3x5 Пероральний 40 2/8 (15) -7 5(27)* 8 8 8 8 8 Q3x5 Q3x5 Q3x5 Q3x5 Q3x5 Пероральний Пероральний Пероральний Пероральний Пероральний 60 80 120 180 240 6/8 (12-24) 6/8 (16-22) 7/8 (11-16) 7/8 (11-16) 8/8 (11-15) -9 -6 -16 -22 -21 Токсично Токсично Токсично Токсично Токсично Сольовий розчин Складний ефір елаїдинової кислоти (5')гемцитабіну Гемцитабін Гемцитабін Гемцитабін Доза мг/кг BWC1 [%] D13 Кількість мишей Оптимальне Т/С [%] (на день) -2 * значуще відрізняється від контрольного сольового розчину Протипухлинна активність складного ефіру елаїдинової кислоти С5')-гемцитабіну проти Со6044 після перорального введення Таблиця 4 Протипухлинна активність на самицях мишей NCR:nu/nu з імплантованим Colon 6044 (карцинома товстої кишки людини) яких лікують перорально складним ефіром елаїдинової кислоти (5')-гемцитабіну Сольовий розчин Складний ефір елаїдинової кислоти (5')-гемцитабіну Кількість мишей 7 Дні лікування D7-11 Пероральний 7 D7, 14 7 Сполука D7, 14 D7, 10, 13, 16, 19 D7, 10, 13, 16, 19 D7, 10, 13, 16, 19 D7-11 D7-11 7 7 7 7 7 BWC1 Оптимальне Т/С [%] [%] (в день) -1 Доза мг/кг Токсичні смерті (d) Пероральний 100 1 (20) -4 4 (24)* Пероральний 50 0 0 22 (17)* Пероральний 20 1 (17) -3 16 (24)* Пероральний 15 0 -1 27 (24)* Пероральний 10 0 -1 35 (24)* Пероральний Пероральний 10 5 0 0 -5 -3 8 (17)* 10 (28)* Спосіб * значуще відрізняється від контрольного сольового розчину Висока активність, залежна від дози, видна при всіх досліджуваних режимах введення після перорального введення складного ефіру елаїди нової кислоти (5')-гемцитабіну. Значна протипухлинна активність спостерігається при всіх досліджених режимах введення. 11 90893 12 13 90893 14 15 Комп’ютерна верстка А. Крулевський 90893 Підписне 16 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюOral dosage forms of gemcitabine derivatives
Автори англійськоюMyhren Finn, Sandvold Marit Liland, Eriksen Ole Henrik
Назва патенту російськоюПероральная дозированная форма производных гемцитабина
Автори російськоюМирен Финн, Сандвольд Марит Лиланд, Эриксен Оле Хенрик
МПК / Мітки
МПК: A61K 31/7068, A61P 35/00
Мітки: гемцитабіну, похідних, пероральна, дозована, форма
Код посилання
<a href="https://ua.patents.su/8-90893-peroralna-dozovana-forma-pokhidnikh-gemcitabinu.html" target="_blank" rel="follow" title="База патентів України">Пероральна дозована форма похідних гемцитабіну</a>
Попередній патент: Спосіб та система багатопотокового процесора із змінним чергуванням
Наступний патент: Похідна сполука пропан-1,3-діону або її сіль
Випадковий патент: Бандаж колеса












