Похідна сполука пропан-1,3-діону або її сіль
Номер патенту: 90894
Опубліковано: 10.06.2010
Автори: Ямамото Хірофумі, Кавамінамі Ейдзі, Кінояма Ісао, Кусаяма Тосіюкі, Сін Такасі, Койке Таканорі, Такахасі Тацухіса, Сімада Іцуро, Мацумото Сунітіро, Осода Кадзухіко, Хісаміті Хіроюкі, Охнукі Кей, Хірано Масаакі
Формула / Реферат
1. Похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятна сіль:
Формула 16
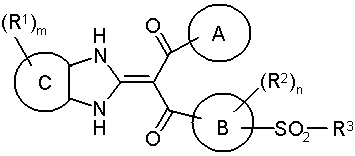 , (I)
, (I)
де символи в зазначеній формулі мають наступні значення:
А - необов'язково заміщений арил або необов'язково заміщений гетероарил,
цикл В - бензольний цикл або тіофеновий цикл,
цикл С - бензольний цикл або 5-7-членний аліфатичний вуглеводневий цикл, що необов'язково містить у циклі подвійний зв'язок,
R1 - однакові або різні і кожний являє собою галоген, необов'язково заміщену вуглеводневу групу, -О-(необов'язково заміщену вуглеводневу групу), необов'язково заміщену гетероциклічну групу, -S-(необов'язково заміщену вуглеводневу групу), -СО-(необов'язково заміщену вуглеводневу групу), -СО2-(необов'язково заміщену вуглеводневу групу), -О-СО-(необов'язково заміщену вуглеводневу групу), -SО-(необов'язково заміщену вуглеводневу групу), -SO2-(необов'язково заміщену вуглеводневу групу), -NO2, -CN, -СО2Н, необов'язково заміщену карбамоїльну, необов'язково заміщену сульфамоїльну або необов'язково заміщену аміногрупу,
R2 - однакові або різні і кожний являє собою галоген, R0, -O-R0 або галогензаміщений нижчий алкіл,
m, n - однакові або різні і кожний являє собою 0, 1 або 2,
R3 означає R0, -ОН, -О-необов'язково заміщений гетероарил, -N(R51)(R52), -N(R73)-N(R74)(R75),
Формули 17
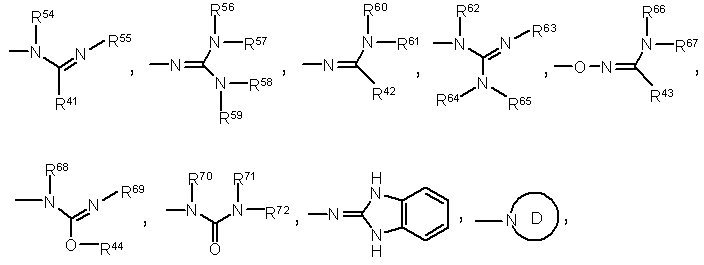
або ж разом з R2, -N=C(R45)-NH- або -NH-C(R45)=N-,
цикл D означає необов'язково заміщене гетероциклічне кільце, вибране з наступної групи:
Формули 18
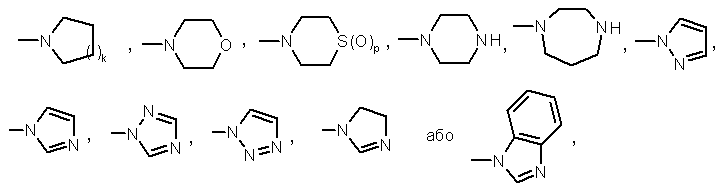
R0 - однакові або різні і кожний означає нижчий алкіл,
R00 - однакові або різні і кожний означає нижчий алкілен,
k - 1,2,3 або 4,
р - 0, 1 або 2,
R41, R42 і R43 - однакові або різні і кожний являє собою Н, необов'язково заміщений нижчий алкіл, -СНО, -СO-(необов'язково заміщений нижчий алкіл), необов'язково заміщений нижчий циклоалкіл, -СО2Н, -CO2-R0, -CONH2, -CO-NH(R0), -CO-N(R0)2, -R00-CONH(R0), -R00-CON(R0)2, необов'язково заміщений арил, необов'язково заміщену гетероциклічну групу, -R00-O-арил, -R00-SO-R0, -R00-SO2-R0, -R00-N(OH)-R0 або -R00-N(O-R0)-R0,
R44 і R45 - однакові або різні і кожний являє собою R0 або -R00-apил,
R51 і R52 - однакові або різні і кожний являє собою Н, необов'язково заміщений нижчий алкіл, R00-(необов'язково заміщений нижчий циклоалкіл), -R00-(необов'язково заміщений арил), необов'язково заміщений гетероарил, -CO-R0, -CO2-R0, -OH, -O-R0, -О-бензил, -R00-O-R00-OH або необов'язково заміщений циклоалкіл,
R54, R55, R57, R58, R61, R64, R67, R68, R70, R72, R73 і R74 - однакові або різні і кожний являє собою Н або R0,
R56, R59, R66, R69 і R71 - однакові або різні і кожний являє собою Н, R0 або -CO-R0,
R60 - Н, R0, -R00-OH або -CO-R0,
R62 - Н, R0, -O-R0 або -О-бензил,
R63 - Н, R0, -NH2 або -CO-R0,
R65 - Н, R0, -R00-OH, -CONH2 або -CO-R0,
R75 - Н, R0, -R00-apил, арил або гетероарил, і
R54 і R41, R57 і R58, R61 і R42, R68 і R44, R62 і R63, R62 і R65, і R63 і R65, кожні взяті разом, можуть утворити нижчий алкілен, необов'язково заміщений оксогрупою; за умови, що, коли А являє собою феніл, заміщений -СН(ОН)-СН2-ОН, і коли m і n, обидва, дорівнюють 0, тоді R3 являє собою групу за винятком -N(CH3)2.
2. Сполука за п. 1, де цикл С являє собою бензольний цикл, або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, де цикл В являє собою бензольний цикл, або її фармацевтично прийнятна сіль.
4. Сполука за п. 3, де А являє собою необов'язково заміщений феніл, необов'язково заміщений нафтил, необов'язково заміщений тієніл, необов'язково заміщений піридил, необов'язково заміщений тіазоліл, бензофураніл або дигідробензофураніл, або її фармацевтично прийнятна сіль.
5. Сполука за п. 4, де R3 являє собою -N(R51)(R52) або групу, вибрану з наступних:
Формули 19
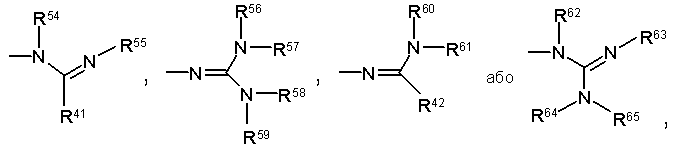
або її фармацевтично прийнятна сіль.
6. Сполука за п. 5, де m дорівнює 0, або її фармацевтично прийнятна сіль.
7. Похідне пропан-1,3-діону загальної формули (Іа) або його фармацевтично прийнятна сіль:
Формула 20
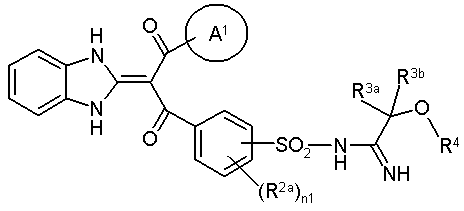 , (Іа)
, (Іа)
де символи в зазначеній формулімають наступні значення:
А1 означає феніл або тієніл, кожний з яких необов'язково заміщений 1-3 однаковими або різними замісниками, вибраними з наступної групи G:
група G означає атом галогену, нижчий алкіл або -О-нижчий алкіл,
R2a - атом галогену, нижчий алкіл або -О-нижчий алкіл,
R3a, R3b - однакові або різні і кожний являє собою Н або нижчий алкіл,
R4 означає Н, -С(=О)-нижчий алкіл або -С(=О)-гетероарил,
n1 - 0 або 1.
8. Сполука за п. 1, вибрана з наступної групи:
(2R)-N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)-3-оксопропаноїл]феніл}сульфоніл)-2-гідроксипропанімідамід,
N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)-3-оксопропаноїл]феніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
(2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
(2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-метилфеніл)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
(2R)-N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
(2R)-N-({5-[3-(3-xлopфeнiл)-2-(1,3-дигiдpo-2H-бeнзiмiдaзoл-2-iлiдeн)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2-фторфеніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
(2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
(2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3-фтор-4-метилфеніл)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
(2R)-N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
(2R)-N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід,
N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2-фторфеніл}сульфоніл)-2-гідрокси-2-метилпропанімідамід,
або її фармацевтично прийнятна сіль.
9. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль як активний інгредієнт.
10. Фармацевтична композиція за п. 9, що являє собою антагоніст рецептора гормону, що вивільняє гонадотропін (GnRH).
11. Фармацевтична композиція за п. 10, що являє собою терапевтичний засіб проти раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки.
12. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання антагоніста рецептора гормону, що вивільняє гонадотропін (GnRH), або лікарського засобу для лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки.
13. Спосіб лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки, що полягає у введенні пацієнту терапевтично ефективної кількості сполуки за п. 1 або її фармацевтично прийнятної солі.
Текст
1. Похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятна сіль: Формула 16 UA (21) a200712009 (22) 30.03.2006 (24) 10.06.2010 (86) PCT/JP2006/306641, 30.03.2006 (31) 2005-101437 (32) 31.03.2005 (33) JP (31) 2005-353577 (32) 07.12.2005 (33) JP (46) 10.06.2010, Бюл.№ 11, 2010 р. (72) ХІРАНО МАСААКІ, JP, КІНОЯМА ІСАО, JP, МАЦУМОТО СУНІТІРО, JP, КАВАМІНАМІ ЕЙДЗІ, JP, ОХНУКІ КЕЙ, JP, ЯМАМОТО ХІРОФУМІ, JP, ОСОДА КАДЗУХІКО, JP, ТАКАХАСІ ТАЦУХІСА, JP, СІН ТАКАСІ, JP, КОЙКЕ ТАКАНОРІ, JP, СІМАДА ІЦУРО, JP, ХІСАМІТІ ХІРОЮКІ, JP, КУСАЯМА ТОСІЮКІ, JP (73) АСТЕЛЛАС ФАРМА ІНК., JP (56) WO 2002002533 A1 JP 200095767 A WO 2005118556 A1 2 (19) 1 C2 (54) ПОХІДНА СПОЛУКА ПРОПАН-1,3-ДІОНУ АБО ЇЇ СІЛЬ 3 90894 R2 - однакові або різні і кожний являє собою галоген, R0, -O-R0 або галогензаміщений нижчий алкіл, m, n - однакові або різні і кожний являє собою 0, 1 або 2, 3 0 R означає R , -ОН, -О-необов'язково заміщений гетероарил, -N(R51)(R52), -N(R73)-N(R74)(R75), Формули 17 -СО2-(необов'язково заміщену вуглеводневу групу), -О-СО-(необов'язково заміщену вуглеводневу групу), -SО-(необов'язково заміщену вуглеводневу групу), -SO2-(необов'язково заміщену вуглеводневу групу), -NO2, -CN, -СО2Н, необов'язково заміщену карбамоїльну, необов'язково заміщену сульфамоїльну або необов'язково заміщену аміногаміногрупу, R56 R54 N R55 N R60 N , , N N O або ж разом з R2, C(R45)=N-, N R61 R42 R66 N N , N R58 R62 R70 , R71 N R69 N R64 R44 H N R72 , N N D R67 , O N R43 , N H O , N , R65 , N -N=C(R45)-NH- або -NH ( )k R63 N R59 R68 N N R57 N R41 4 O , N цикл D означає необов'язково заміщене гетероциклічне кільце, вибране з наступної групи: Формули 18 S (O)p , N N H, N NH , , N N N N , N N N , N N N , R0 - однакові або різні і кожний означає нижчий алкіл, R00 - однакові або різні і кожний означає нижчий алкілен, k - 1,2,3 або 4, р - 0, 1 або 2, R41, R42 і R43 - однакові або різні і кожний являє собою Н, необов'язково заміщений нижчий алкіл, СНО, -СO-(необов'язково заміщений нижчий алкіл), необов'язково заміщений нижчий циклоалкіл, СО2Н, -CO2-R0, -CONH2, -CO-NH(R0), -CO-N(R0)2, R00-CONH(R0), -R00-CON(R0)2, необов'язково заміщений арил, необов'язково заміщену гетероциклічну групу, -R00-O-арил, -R00-SO-R0, -R00-SO2-R0, R00-N(OH)-R0 або -R00-N(O-R0)-R0, R44 і R45 - однакові або різні і кожний являє собою R0 або -R00-apил, R51 і R52 - однакові або різні і кожний являє собою Н, необов'язково заміщений нижчий алкіл, R00(необов'язково заміщений нижчий циклоалкіл), R00-(необов'язково заміщений арил), необов'язково заміщений гетероарил, -CO-R0, -CO2-R0, -OH, O-R0, -О-бензил, -R00-O-R00-OH або необов'язково заміщений циклоалкіл, R54, R55, R57, R58, R61, R64, R67, R68, R70, R72, R73 і R74 - однакові або різні і кожний являє собою Н або R0, N N або , N N R56, R59, R66, R69 і R71 - однакові або різні і кожний являє собою Н, R0 або -CO-R0, R60 - Н, R0, -R00-OH або -CO-R0, R62 - Н, R0, -O-R0 або -О-бензил, R63 - Н, R0, -NH2 або -CO-R0, R65 - Н, R0, -R00-OH, -CONH2 або -CO-R0, R75 - Н, R0, -R00-apил, арил або гетероарил, і R54 і R41, R57 і R58, R61 і R42, R68 і R44, R62 і R63, R62 і R65, і R63 і R65, кожні взяті разом, можуть утворити нижчий алкілен, необов'язково заміщений оксогрупою; за умови, що, коли А являє собою феніл, заміщений -СН(ОН)-СН2-ОН, і коли m і n, обидва, дорівнюють 0, тоді R3 являє собою групу за винятком -N(CH3)2. 2. Сполука за п.1, де цикл С являє собою бензольний цикл, або її фармацевтично прийнятна сіль. 3. Сполука за п.2, де цикл В являє собою бензольний цикл, або її фармацевтично прийнятна сіль. 4. Сполука за п.3, де А являє собою необов'язково заміщений феніл, необов'язково заміщений нафтил, необов'язково заміщений тієніл, необов'язково заміщений піридил, необов'язково заміщений тіазоліл, бензофураніл або дигідробензофураніл, або її фармацевтично прийнятна сіль. 5. Сполука за п.4, де R3 являє собою -N(R51)(R52) або групу, вибрану з наступних: Формули 19 5 90894 R56 R54 N N R55 N , R60 , R58 R41 R59 або її фармацевтично прийнятна сіль. 6. Сполука за п.5, де m дорівнює 0, або її фармацевтично прийнятна сіль. 7. Похідне пропан-1,3-діону загальної формули (Іа) або його фармацевтично прийнятна сіль: Формула 20 H N N H O A1 R3a O SO2 (R2a)n1 N H N R57 N N 6 R3b O R4 NH , (Іа) де символи в зазначеній формулі мають наступні значення: А1 означає феніл або тієніл, кожний з яких необов'язково заміщений 1-3 однаковими або різними замісниками, вибраними з наступної групи G: група G означає атом галогену, нижчий алкіл або О-нижчий алкіл, R2a - атом галогену, нижчий алкіл або -О-нижчий алкіл, R3a, R3b - однакові або різні і кожний являє собою Н або нижчий алкіл, R4 означає Н, -С(=О)-нижчий алкіл або -С(=О)гетероарил, n1 - 0 або 1. 8. Сполука за п.1, вибрана з наступної групи: (2R)-N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-фторфеніл)-3оксопропаноїл]феніл}сульфоніл)-2гідроксипропанімідамід, N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3фторфеніл)-3-оксопропаноїл]феніл}сульфоніл)-2гідрокси-2-метилпропанімідамід, N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3фторфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-фторфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-метилфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N R62 R61 N N R63 або R42 N R64 R65 , (2R)-N-({5-[3-(3-xлopфeнiл)-2-(1,3-дигiдpo-2Hбeнзiмiдaзoл-2-iлiдeн)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-фтор-4-метилфеніл)-3-оксопропаноїл]2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, або її фармацевтично прийнятна сіль. 9. Фармацевтична композиція, що містить сполуку за п.1 або її фармацевтично прийнятну сіль як активний інгредієнт. 10. Фармацевтична композиція за п.9, що являє собою антагоніст рецептора гормону, що вивільняє гонадотропін (GnRH). 11. Фармацевтична композиція за п.10, що являє собою терапевтичний засіб проти раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки. 12. Застосування сполуки за п.1 або її фармацевтично прийнятної солі для одержання антагоніста рецептора гормону, що вивільняє гонадотропін (GnRH), або лікарського засобу для лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки. 13. Спосіб лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки, що полягає у введенні пацієнту терапевтично ефективної кількості сполуки за п.1 або її фармацевтично прийнятної солі. 7 Даний винахід стосується нових похідних пропан-1,3-діону, які придатні як фармацевтичні препарати, зокрема, терапевтичні засоби для лікування захворювань, залежних від статевих гормонів. Відомо, що гормон гіпоталамуса або гормон гіпофіза бере участь у контролюванні системи секреції периферичних гормонів. У загальному випадку секреція гормону передньої частки гіпофіза регулюється секрецією стимулюючих гормонів або секрецією супресуючих гормонів, які секретуються вищим центром, гіпоталамусом, або периферичних гормонів, які секретуються органами, що є мішенями для відповідних гормонів. Гонадотропін, вивільняючий гормон (далі використовують абревіатуру GnRH; крім того, GnRH називають рилізинг-фактором лютеїнізуючого гормону; LHRH), відомий як гормон, що контролює вивільнення статевих гормонів у вищій позиції, регулює секрецію лютеїнізуючого гормону (далі використовують абревіатуру LH), фолікулостимулюючого гормону (далі використовують абревіатуру FSH) і статевих гормонів у статевих органах за допомогою специфічного рецептора (далі використовують абревіатуру "рецептор GnRH"), що знаходиться в передній частці гіпофіза (Horumon to Rinsyo (Hormones and Clinical Medicine), spring extra number, 46, 46-57 (1998)). Припускають, що специфічні й селективні антагоністи рецептора GnRH є ліками для попередження й лікування захворювань, залежних від статевих гормонів (зокрема, раку передміхурової залози, раку грудей, ендометріозу, фіброми матки й т.п.), оскільки він регулює дію GnRH і контролює секрецію нижчих LH, FSH і статевих гормонів (Horumon to Rinsyo (Hormones and Clinical Medicine), spring extra number, (1998), див. вище; Cancer Res., 1, 293-297 (1941); Proc. Natl. Acad. Sci. USA, 87, 7100-7104 (1990)). У цей час пептидні сполуки, сетрорелікс (Proc. Natl. Acad. Sci. USA, 85, 1637-1641, 1988) і абарелікс (J. Urol. 167, 1670-1674, 2002) випущені на ринок як антагоністи рецептора GnRH, і з отриманої інформації можна чекати, що фармацевтичні препарати, здатні контролювати секрецію статевих гормонів, можуть бути засобами для лікування доброякісної гіперплазії передміхурової залози (J. Clinical Endocrinology and Metabolism (1998) 83, 11, 3826-3831). З іншого боку, як непептидні сполуки, що надають антагоністичну дію на рецептор GnRH, клінічні випробування проходила похідна сполука урацилу, NBI-42902 (J. Med. Chem., 48, 1169-1178, 2005), однак її розробка була припинена. У посиланні на патент 1 розкривається антагоністична дія на рецептор GnRH похідного сполуки пропан-1,3-діону. Формула 1 90894 8 (У зазначеній формулі А і В однакові або різні, і кожний з них являє собою необов'язково заміщений арил або необов'язково заміщений гетероцикл; деталі можна знайти в зазначеній вище публікації.) Однак у патенті не описується заміщена сульфонільна група (-SO2-R3) як замісник у циклі А або в циклі В і не розкриваються конкретні сполуки, що містять таку групу. Крім того, у посиланні на патент 2, що опублікований після дати пріоритету даної заявки на винахід, розкривається, що похідне сполуки пропан1,3-діону надає антагоністичну дію на рецептор GnRH. Формула 2 (У зазначеній формулі 2 цикл А означає необов'язково заміщений бензольний, необов'язково заміщений піридиновий або тіофеновий цикл, а цикл В означає заміщений бензольний або тіофеновий цикл; деталі можна знайти в зазначеній вище публікації.) Проте, зазначена структура відрізняється від сполуки згідно з даним винаходом тим, що вона містить у циклі В замісник, отриманий з 1гідроксіалкільної групи. Посилання на патент 1: технічний опис міжнародної публікації №02/02533. Посилання на патент 2: технічний опис міжнародної публікації №05/118556. Об'єктом даного винаходу є нова сполука, придатна як фармацевтичний препарат, що має сильну антагоністичну дію стосовно рецептора GnRH, зокрема, сполука, придатна як терапевтичний засіб для лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози й т.д. Автори даного винаходу провели подальше вивчення похідних пропан-1,3-діону. У результаті вони підтвердили, що 2-(1,3-дигідро-2Нбензімідазол-2-іліден)вмісні похідні пропан-1,3діону, у яких бензольний цикл і тіофеновий цикл містять як замісник групy-SCVR , мають сильну антагоністичну дію стосовно рецептора GnRH і володіють високою активністю при пероральному прийомі; у такий спосіб був здійснений даний винахід. Зокрема, даний винахід стосується наступного: [1] Похідне пропан-1,3-діону, представлене загальною формулою (І), або його фармацевтично прийнятна сіль: Формула 3 9 (де символи у формулі мають наступні значення: цикл А: необов'язково заміщений арил або необов'язково заміщений гетероарил, цикл В: бензольний цикл або тіофеновий цикл, цикл С: бензольний цикл або 5-7-членний аліфатичний вуглеводневий цикл, що необов'язково містить у циклі подвійний зв'язок, R1: однакові або різні, і кожний являє собою галоген, необов'язково заміщену вуглеводневу групу, -О-(необов'язково заміщену вуглеводневу групу), необов'язково заміщену гетероциклічну 90894 10 групу, -S-(необов'язково заміщену вуглеводневу групу), -С-(необов'язково заміщену вуглеводневу групу), -С2-(необов'язково заміщену вуглеводневу групу), -С-(необов'язково заміщену вуглеводневу групу), -SО-(необов'язково заміщену вуглеводневу групу), -SO2-(необов'язково заміщену вуглеводневу групу), -NO2, -CN, -СО2Н, необов'язково заміщену карбамоїльну, необов'язково заміщену сульфамоїльну або необов'язково заміщену аміногрупу, R2: однакові або різні, і кожний являє собою галоген, R0, -O-R0 або галогензаміщений нижчий алкіл, m, n: однакові або різні, і кожний позначає 0, 1 або 2, R3 означає R0, -ОН, -О-необов'язково заміщений гетероарил, -N(R51)(R52), -N(R73)-N(R74)(R75), Формули 4 або ж разом з R2, -N=C(R45)-NH- або -NHC(R )=N-, цикл D означає необов'язково заміщене гетероциклічне кільце, вибране з наступної групи: Формули 5 R0: однакові або різні, і кожний являє собою нижчий алкіл, R00: однакові або різні, і кожний являє собою нижчий алкілен, k: 1, 2, 3 або 4, р: 0, 1 або 2, R41, R42 і R43: однакові або різні, і кожний являє собою Н, необов'язково заміщений нижчий алкіл, СНО, -СО-(необов'язково заміщений нижчий алкіл), необов'язково заміщений нижчий циклоалкіл, групи -СО2Н, -CO2-R0, -CONH2, -СО-NH(R0), -CON(R0)2, -R00-CONH(R0), -R00-CON(R0)2, необов'язково заміщений арил, необов'язково заміщену гетероциклічну групу, -R00-O-apM, -R00-SO-R0, -R00-SO2-R0, -R00-N(OH)-R0 або 00 R -N(O-R0)-R0, R44 і R45: однакові або різні, і кожний являє собою R0 або -R00-apил, R51 і R52: однакові або різні, і кожний являє собою Н, необов'язково заміщений нижчий алкіл, R00-(необов'язково заміщений нижчий циклоалкіл), R00-(необов'язково заміщений арил), необов'язково заміщений гетероарил, -CO-R0, -CO2-R0, -OH, O-R0, -О-бензил, -R00-O-R00-OH або необов'язково заміщений циклоалкіл, R54, R55, R57, R58, R61, R64, R67, R68, R70, R72, R73 і R74: однакові або різні, і кожний являє собою Η або R0, R56, R59, R66, R69 і R71:однакові або різні, і кожний являє собою Н, R0 або -CO-R0, R60: Н, R0, -R00-OH або -CO-R0, R62: Н, R0, -O-R0 або -О-бензил, R63: Н, R0, -NH2 або -CO-R0, R65: Н, R0, -R00-OH, -CONH2 або -CO-R0, R75: Η, R0, -R00-apил, арил або гетероарил, i R54 і R41, R57 і R58, R61 і R42, R68 і R44, R62 і R63, 62 R і R65 і R63 і R65, кожні, узяті разом можуть утворити нижчий алкілен, необов'язково заміщений оксогрупою; за умови, що коли А являє собою феніл, заміщений групою -СН(ОН)-СН2-ОН і коли m і n, обидва, дорівнюють 0, тоді R3 являє собою гру 45 11 пу за винятком -N(CH3)2, це ж справедливо й далі по тексту опису); [2] сполука за п.[1], де цикл С являє собою бензольний цикл або її фармацевтично прийнятна сіль; [3] сполука за п.[2], де цикл В являє собою бензольний цикл або її фармацевтично прийнятна сіль; [4] сполука за п.[3], де А являє собою необов'язково заміщений феніл, необов'язково заміщений нафтил, необов'язково заміщений тієніл, необов'язково заміщений піридил, необов'язково заміщений тіазоліл, бензофураніл або дигідробензофураніл, або її фармацевтично прийнятна сіль; [5] сполука за п.[4], де R3 являє собою 51 N(R )(R52) або групу, вибрану з Формули 6 або її фармацевтично прийнятна сіль; [6] сполука за п.[5], де m дорівнює 0, або її фармацевтично прийнятна сіль; [7] похідне пропан1,3-діону загальної формули (Іа) або його фармацевтично прийнятна сіль: Формула 7 (де символи у формулі мають наступні значення: А1 означає феніл або тієніл, кожний з яких необов'язково заміщений 1-3 однаковими або різними замісниками, вибраними з наступної групи G: група G означає галоген, нижчий алкіл або -Онижчий алкіл, R2a означає галоген, нижчий алкіл або -Онижчий алкіл, R3a, R3b: однакові або різні, і кожний являє собою Η або нижчий алкіл, R4 означає Н, -С(=О)-нижчий алкіл або -С(=О)гетероарил, n1:0 або 1); [8] сполука за п.[1], або її фармацевтично прийнятна сіль, вибрана з наступної групи: (2R)-N-({3-[2-(l,3-дигiдpo-2H-бeнзiмiдaзoл-2iлiдeн)-3-(3-фтopфeнiл)-3оксопропаноїл]феніл}сульфоніл)-2гідроксипропанімідамід, N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)3-(3-фторфеніл)-3-оксопропаноїл] феніл }сульфоніл)-2-гідрокси-2-метилпропанімідамід, N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)3-(3-фторфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, 90894 12 (2R)-N-({5-[2-(l,3-дигiдpo-2H-бeнзiмiдaзoл-2iлiдeн)-3-(3-фтopфeнiл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-метилфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[3-(3,5-дифторфеніл)-2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[3-(3-хлорфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)3-оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксо-3-(2,4,5-трифторфеніл)пропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(3-фтор-4-метилфеніл)-3-оксопропаноїл]2-фторфеніл}сульфоніл)-2-гідроксипропанімідамід, (2R)-N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(2,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід, (2R)-N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід, N-({5-[3-(5-хлор-2-тієніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідрокси-2метилпропанімідамід; [9] фармацевтична композиція, що містить сполуку за п.[1] або її фармацевтично прийнятну сіль як активний інгредієнт; [10] фармацевтична композиція за п.[9], що являє собою антагоніст рецептора гонадотропін вивільняючого гормону (GnRH); [11] Фармацевтична композиція за п.[10], що являє собою терапевтичний засіб проти раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки; [12] застосування сполуки за п.[1] або її фармацевтично прийнятної солі для одержання антагоніста рецептора гонадотропін вивільняючого гормону (GnRH) або лікарського засобу для лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки; [13] спосіб лікування раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу й/або фіброми матки, що полягає у введенні пацієнтові терапевтично ефективної кількості сполуки за п.[1]. Сполуки згідно з даним винаходом мають сильний антагоністичний ефект стосовно рецептора 13 GnRH і додатково високою активністю при пероральному прийомі й, таким чином, придатні для лікування захворювань, залежних від статевих гормонів, зокрема, залежних від GnRH захворювань, наприклад, раку передміхурової залози, доброякісної гіперплазії передміхурової залози, раку грудей, ендометріозу, фіброми матки й т.п.Крім того, сполуки згідно з даним винаходом володіють чудовою метаболічною стійкістю в організмі людини і мають слабку лікарську взаємодію, а тому мають переважні експлуатаційні властивості як фармацевтичні засоби при застосуванні для зазначених захворювань. Далі даний винахід описується докладно. У даному описі "алкіл" і "алкілен" являють собою лінійні або розгалужені вуглеводневі ланцюги. "Нижчий алкіл" являє собою алкільну групу, що містить 1-6 атомів вуглецю, переважно, метил, етил, пропіл, ізопропіл, бутил, гексил і т.п."Нижчий алкілен" являє собою двовалентну групу, отриману з вищевказаного "нижчого алкілу" шляхом видалення одного будь-якого атома водню, переважно, алкілен, що містить 1-4 атома вуглецю, більш переважно, метилен, етилен, метилметилен і пропіл. "Нижчий алкенілен" являє собою алкенілен, що містить 2-6 атомів вуглецю й, щонайменше, один подвійний зв'язок, а саме, включає вінілен, пропенілен, 1-бутенілен, 2-бутенілен і т.п."Нижчий алкінілен" являє собою алкінілен, що містить 2-6 атомів вуглецю й, щонайменше, один потрійний зв'язок. "Галоген" включає F, СІ, Вr і І, переважно, F і СІ. "Галогенвмісний нижчий алкіл" являє собою алкіл, що містить 1-6 атомів вуглецю й заміщений, щонайменше, одним атомом галогену, переважно, являє собою C1-С6 алкіл, заміщений, щонайменше, одним F, більш переважно, фторметил, дифторметил, трифторметил і трифторетил. "Циклоалкіл" являє собою циклоалкіл, що містить 3-10 атомів вуглецю, які можуть бути з'єднані місточковими зв'язками. Переважно, являє собою циклоалкіл, що містить 3-7 атомів вуглецю, більш переважно, циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. "Арил" являє собою моноциклічну, біциклічну або трициклічну ароматичну групу, що містить 6-14 атомів вуглецю, і включає фенільну групу, конденсовану з "циклоалкілом", наприклад, інданіл, тетрагідронафтил, флуореніл. Він, переважно, означає феніл або нафтил, більш переважно, означає феніл. "Вуглеводнева група" являє собою групу, що містить 1-15 атомів вуглецю й атоми водню, і включає вищевказані алкіл, циклоалкіл і арил, а також арил-нижчий алкілен-, арил-нижчий алкенілен-, арил-нижчий алкінілен-, циклоалкіл-нижчий алкілен-, циклоалкіл-нижчий алкенілен- і циклоалкіл-нижчий алкінілен-, "5-7-членний аліфатичний вуглеводневий цикл" являє собою насичений вуглеводневий цикл, що містить 5-7 атомів вуглецю й атоми водню, а саме, включає циклопентан, циклогексан і циклогептан. "Гетероарил" є загальним терміном для 5- або 6-членної моноциклічної ароматичної групи, що містить 1-4 гетероатоми, вибраних з О, S і N (мо 90894 14 ноциклічний гетероарил), і для біциклічного гетероарилу, що утворюється при конденсації моноциклічних гетероарилів або бензольного циклу й моноциклічного гетероарилу, у якому кільцевий атом, S або N, може бути окислений з утворенням оксиду або діоксиду. Моноциклічний арил, зокрема, включає піридил, піроліл, піразиніл, піримідиніл, піридазиніл, триазиніл, імідазоліл, триазоліл, тетразоліл, тієніл, фурил, тіазоліл, піразоліл, ізотіазоліл, оксазоліл, ізоксазоліл, тіадіазоліл, оксадіазоліл. Він, далі, включає таутомери 2гідроксипіридилу, такі як 2-оксо-1Н-піридил. Переважними є тієніл, фурил, піроліл, тіазоліл, піридил, піразиніл. Біциклічний гетероарил, зокрема, включає бензотієніл, бензофураніл, індазоліл, індоліл, бензімідазоліл, бензотіазоліл, бензоксазоліл, хіназоліл, хіноксалініл, хінолініл, ізохінолініл, фталазиніл. Переважними є бензофураніл і бензотієніл. "Гетероциклічна група" являє собою 3-7членну моноциклічну або біциклічну гетероциклічну групу, що містить 1-4 гетероатоми, вибраних з О, S і N; і вона включає насичену циклічну групу, вищевказаний гетероарил і одержувану з нього частково гідровану циклічну групу. Наприклад, вона включає піридил, піразиніл, піримідиніл, піридазиніл, імідазоліл, бензімідазоліл, бензофураніл, бензотієніл, бензотіадіазоліл, бензотіазоліл, бензізотіазоліл, бензоксазоліл, бензізоксазоліл, піроліл, піролідиніл, тієніл, фурил, діоксаніл, діоксоланіл, триазиніл, триазоліл, тетразоліл, тіазоліл, тіадіазоліл, оксадіазоліл, піразоліл, піразолідиніл, ізотіазоліл, оксазоліл, ізоксазоліл, хіноліл, ізохіноліл, тетрагідрохіноліл, тетрагідроізохіноліл, хіназолініл, хіноксалініл, фталазиніл, піперидил, піперазиніл, азепаніл, діазепаніл, тетрагідрофураніл, морфолініл, метилендіоксифеніл, етилендіоксифеніл, тритіаніл, індоліл, ізоіндоліл, індолініл, індазоліл, тетрагідробензімідазоліл, хроманіл, хромоніл (4-оксо4Н-1-бензопіраніл), бензімідазолоніл (2,3-дигідро2-оксобензімідазоліл), 2-оксо-1Н-піридил. Переважним є 5-6-членний моноциклічний гетероарил; а більш переважними є фурил, тієніл, імідазоліл, тіазоліл або піридил. "Ацил" включає групу НСО-, вуглеводневу групу CO-, гетероциклічну групу CO-, гетероциклічну групу-алкілен-СО-, гетероциклічну групуалкенілен-СО-, гетероциклічну групу-алкінілен-СО, вуглеводневу групу-CS-, гетероциклічну групуCS-, гетероциклічну групу-алкілен-CS-, гетероциклічну групу-алкенілен-CS-, гетероциклічну групуалкінілен-CS-. Переважними є НСО-, вуглеводнева група CO- і гетероциклічна група СО-; і більше переважними є НСО-, ацетил, пропіоніл, бензоїл, нікотиноїл, теноїл, піролідинілкарбоніл або піперидилкарбоніл. "Необов'язково заміщений" являє собою "незаміщений" або "який містить від одного до п'яти однакових або різних замісників". У тому випадку, коли група містить множину замісників, замісники можуть бути однакові або різні. Аналогічно, у тому випадку, коли m і/або n дорівнює 2, дві групи R1 і/або R2 можуть бути однакові або різні. Замісниками в "необов'язково заміщеній вуглеводневій групі", переважно, є -ОН, -NO2, -CO2H, 15 атом галогену, арил, гетероциклічна група, R1013SiO-, R101-T101. R101 являє собою (1) Η, (2) С3-8 циклоалкіл, (3) гетероциклічну групу, (4) С1-8 алкіл, необов'язково заміщений [С6-14 арилом, необов'язково заміщеним групою R102, -OH, -NO2, -CO2H, галогеном, гетероциклічною групою, -С1-10 алкілом, -С1-10 алкілом або -С1-10 алкілом], (5) С6-14 арил, необов'язково заміщений [групою -ОН, -CN, -NO2, атомом галогену або -NR103-CO-C1-10 алкілом]; R102 являє собою атом галогену, -NO2, -ОН, СО2Н, -О-С1-10 алкіл або -СО-О-С1-10 алкіл; R103 являє собою (а) Н, (b) С3-8 циклоалкіл, (с) гетероциклічну групу, (d) С1-10 алкіл, необов'язково заміщений [С6-14 арилом, необов'язково заміщеним групою R102, гетероциклічною групою, необов'язково заміщеною групою R102, -OH, -NO2, -СО2Н, галогеном, гетероциклічною групою, -СО-С1-10 алкілом, -О-С1-10 алкілом або -СО-С1-10 алкілом], (e) С6-14 арил, необов'язково заміщений [-ОН, -CN, -NO2, галогеном або -NR104-CO-С1-10 алкілом]; R104 являє собою (а) Н, (b) С3-8 циклоалкіл, (с) гетероциклічну групу, (d) С1-10 алкіл, необов'язково заміщений [групою -СО2Н, -СО-О-С1-10 алкілом, С614 арилом або гетероциклічною групою], (e) С6-14 арил, необов'язково заміщений [групою -ОН, -CN, NO2 або атомом галогену]; Т101 являє собою -О-, -СО-, -СО-О-, -О-СО-, CO-NR103-, -NR103-CO- або -NR103-. Ті ж значення використовуються й далі по тексту опису. З вищевказаних більш переважним замісником в "необов'язково заміщеному нижчому алкілі" є галоген, -ОН, -O-R0, -O-CO-R0, -S-R0, -CO-R0, -ОСО-арил, -О-SO2-R0, -O-SO2-apил, -О-SО2-толіл, N3, -NH2, -NH(R0), -N(R0)2, -CN, -CO2H, -CO2-R0, CONH2, циклоалкіл, арил; а ще більш переважно, галоген, -ОН, -O-R0, -S-R0, циклоалкіл, арил. Більш переважним замісником в "необов'язково заміщеному арилі" є галоген, R0, -OH, -O-R0, -S-R0, галогензаміщений нижчий алкіл. Більше переважним замісником в "необов'язково заміщеному циклоалкілі" є R0, -ОН, -О-R0. Замісником в "необов'язково заміщеному гетероциклі", переважно, є (1) C3-8 циклоалкіл, (2) С614 арил, необов'язково заміщений групою С1-10 алкіл -О-, (3) гетероциклічна група, (4) С1-10 алкіл, необов'язково заміщений [С6-14 арилом, необов'язково заміщеним групою R106, -OH, -NO2, галогеном, гетероциклічною групою, -NR101R103, -О-С1-10 алкілом, -СО-вуглеводневою групою або -СОгетероциклічною групою]. Більш переважно, замісник є галогеном, R0, -OH, -O-R0, -R00-OH, -CO-R0, CO2-R0, галогензаміщеним нижчим алкілом, -OR00-apилoм, -CO2-R00-apилом, арилом, гетероарилом; а ще більш переважно, є галогеном, R0, -ОН, -O-R0, -R00-OH, галогензаміщеним нижчим алкілом, -О-бензилом, гетероарилом. Переважним замісником для циклу D в "необов'язково заміщеному гетероциклічному кільці" є -ОН, R0, -NH2, -R00-OH, галогензаміщений нижчий алкіл. "Необов'язково заміщений карбамоїл", "необов'язково заміщений сульфамоїл" або "необов'язково заміщена аміногрупа" означають, що один або два атоми водню при атомі азоту в них можуть бути заміщені будь-якою іншою групою, при цьому 90894 16 замісники можуть бути однакові або різні. Як замісники переважні групи, описані для замісників в "необов'язково заміщеному гетероциклічному кільці". Замісником в "необов'язково заміщеному арилі" і "необов'язково заміщеному гетероарилі" для циклу А, переважно, є (1) -CN, (2) -NO2, (3) галоген, (4) -ОН, (5) -СО2Н, (6) -Т104-[С1-10 алкіл, необов'язково заміщений (-ОН, галогеном, гетероциклічної групою, С6-14 арилом, необов'язково заміщеним галогеном, групою -NR101R103, -CO-R101, -CO-T101R101 або -T101-R101)], (7) -CO-[вуглеводнева група, необов'язково заміщена групою R105], (8) -СО[гетероциклічна група, необов'язково заміщена групою R105], (9) -О-[ацил, необов'язково заміщений групою R105], (10) -NR106R107 або (11) -CONR106R107. Τ104 являє собою простий зв'язок, -О-, -СО-Оабо -О-СО-; R105 являє собою -ОН, -СО2Н, -CN, -NO2, галоген, гетероциклічну групу, -NR101R103, С1-10 алкіл, необов'язково заміщений галогеном, -О-С1-10 алкіл, -СО-О-С1-10 алкіл, С6-14 арил, необов'язково заміщений [С1-10 алкілом, -О-С1-10 алкілом або -NR101 ацилом], ацил, -NR101-aцил або -NR101-SO2-(C6-14 арил, необов'язково заміщений С1-10 алкілом); R106 і R107, однакові або різні, і кожний являє собою Η або групу R105. Ті ж значення використовуються й далі по тексту опису. Крім того, далі описуються переважні способи здійснення даного винаходу. (1) Цикл А, переважно, являє собою необов'язково заміщені феніл, нафтил, піридил, піразил, тіазоліл, дигідробензофураніл, бензофураніл або тієніл; більш переважно, необов'язково заміщені феніл, нафтил, піридил, тіазоліл, дигідробензофураніл, бензофураніл або тієніл; ще більш переважно, необов'язково заміщені феніл, нафтил, піридил або тієніл. Замісником у циклі А, переважно, є галоген, R0, -O-R0, -ОН, -О-арил, -S-R0, -SO2-R0, 0 CO-R , арил, гетероарил, -CN, галогензаміщений нижчий алкіл; більш переважно, галоген, R0, -O-R0, -ОН, -S-R0, арил, галогензаміщений нижчий алкіл; ще більш переважно, F, СІ, R0, -O-R0, галогензаміщений нижчий алкіл. (2) m, переважно, дорівнює 0 або 1, більш переважно, 0. R1, переважно, являє собою галоген, необов'язково заміщену вуглеводневу групу, -О(необов'язково заміщена вуглеводнева група), -S(необов'язково заміщена вуглеводнева група), -С(необов'язково заміщена вуглеводнева група), NO2, необов'язково заміщену аміногрупу; більш переважно, галоген, R0, -O-R0; ще більш переважно, галоген. (3) n, переважно, дорівнює 0 або 1. R2, переважно, являє собою галоген, R0, -O-R0; більш переважно, галоген, R0; ще більш переважно, F. Залежно від займаної ним позиції замісник R2 перебуває, переважно, в орто- або пара-положенні стосовно групи -SO2-R3; більш переважно, в ортоположенні. (4) -SO2-R3, переважно, приєднана в метаположенні стосовно пропаноїльного ланцюга. (5) R3, переважно, являє собою R0, N(R51)(R52), 17 90894 18 Формули 8 більш переважно, R0, -N(R51)(R52), формулу (і), формулу (іі), формулу (ііі), формулу (iv); ще більш переважно, формулу (і), формулу (ііі). Іншим переважним варіантом R3 є наступне гетероциклічне кільце, і зазначений цикл може бути заміщений групою, вибраною з -ОН, R0, -NH2, -R00-ОН, галогензаміщеного нижчого алкілу. Формула 9 (6) R41 і R42, переважно, являє собою Н, необов'язково заміщений нижчий алкіл, -СО(необов'язково заміщений нижчий алкіл), необов'язково заміщений циклоалкіл, -CONH2, необов'язково заміщене гетероцикічне кільце, -R00-N(OH)R0, -R00-N(O-R0)-R0; більш переважно, Н, необов'язково заміщений нижчий алкіл, -С-(необов'язково заміщений нижчий алкіл), необов'язково заміщений циклоалкіл; ще більш переважно, означає необов'язково заміщений нижчий алкіл. Замісник в "необов'язково заміщеному нижчому алкілі" для R41 і R42, переважно, являє собою -NH2, -N(R0)2, OH, -O-R0, -O-CO-R0, -О-СО-гетероарил; більш переважно, -ОН, -О-CO-R0 або -О-СО-гетероарил; ще більш переважно, -ОН. Гетероциклічне кільце, переважно, являє собою піридил, піримідил, тієніл, фурил, піроліл. (7) R43, переважно, являє собою R0; більш переважно, метил. (8) R51 і R52, переважно, являє собою Η, необов'язково заміщений нижчий алкіл, необов'язково заміщений гетероарил, -O-R0; більш переважно, Н, необов'язково заміщений нижчий алкіл. Замісник у нижчому алкілі або гетероарилі, переважно, являє собою -ОН або -O-R0; більш переважно, ОН. Гетероцикл, переважно, являє собою піридил або тіазоліл. (9) R54, R55, R60 і R61, переважно, являють собою Н, метил; більш переважно, Н. (10) R56, R57, R58 і R59, переважно, являють собою Н, метил, -CO-R0; більш переважно, Η або ацетил; більш переважно, Н. (11) R62, переважно, являє собою Н, -O-R0; більш переважно, Н. (12) R63, переважно, являє собою Н, -NH2, CO-R0; більш переважно, Н. (13) R64 і R65, переважно, являють собою Н, метил, -R00-OH, -CONH2, ацетил; більш переважно, Н, метил; ще більш переважно, Н. (14) R66, R67, R68, R69, R70 і R72, переважно, являють собою Н. (15) R44, переважно, являє собою R0, більш переважно, метил. 71 0 (16) R , переважно, являє собою Н, R . Найбільш переважними варіантами здійснення даного винаходу є такі, які являють собою комбінацію наведених вище переважних груп (1)-(16). Сполука (І) згідно з даним винаходом включає геометричні ізомери за рахунок таутомеризма й геометричні ізомери щодо подвійного зв'язку в положенні 2 пропану, як описується нижче. Крім того, залежно від типу присутнього замісника, сполука може включати будь-які таутомери й геометричні ізомери. У даному описі може бути наведений лише один тип подібних ізомерів, однак даний винахід охоплює зазначені ізомери, а також виділені ізомери або їхні суміші. Формули 10 19 Формули 11 Сполука (І) може містити асиметричний атом вуглецю або мати осьову асиметрію, і, таким чином, зазначена сполука може включати оптичні ізомери, такі як (R)-форма або (S)-форма й т.д. Даний винахід може включати всі суміші зазначених ізомерів і виділених ізомерів. Крім того, даний винахід включає фармацевтично прийнятні проліки сполуки (І). Фармацевтично прийнятними проліками є сполуки, які містять групу, здатну перетворюватися в аміногрупу, ОН, СО2Н і подібні групи згідно з даним винаходом за рахунок сольволізу або у фізіологічних умовах. Прикладами групи або форм проліків є проліки, описані в Prog. Med., 5, 2157-2161 (1985), і проліки, описані в "PHARMACEUTICAL RESEARCH AND DEVELOPMENT" (Hirokawa Publishing, 1990), Vol.7, Drag Design, pp.163-198. Крім того, сполука згідно з даним винаходом може утворювати кислотно-адитивні солі або солі з основами, залежно від типу наявних у сполуці замісників. За умови, що зазначені солі є фармацевтично прийнятними солями, вони входять в об'єм даного винаходу. Зокрема, вони включають кислотно-адитивні солі з неорганічною кислотою, такою як хлористоводнева кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота й т.д.; або з органічною кислотою, такою як мурашина кислота, оцтова кислота, пропіонова кислота, щавлева кислота, малонова кислота, бурштинова кислота, фумарова кислота, малеїнова кислота, молочна кислота, яблучна кислота, винна кислота, лимонна кислота, метансульфонова кислота, етансульфонова кислота, п-толуолсульфонова кислота, аспарагінова кислота, глутамінова кислота й т.д.; а також солі з неорганічною основою, такою як натрій, калій, магній, кальцій, алюміній і т.д.; або з органічною основою, такою як метиламін, етила 90894 20 мін, етаноламін, лізин, орнітин і т.д.; і солі амонію й т.п. Даний винахід охоплює різні гідрати, сольвати й кристалічні поліморфні модифікації сполуки з'єднання згідно з даним винаходом, а також їх фармацевтично прийнятні солі. Способи одержання З урахуванням характерних ознак, що залежать від базової структури сполуки або від типу замісників, що втримуються в ньому, сполука згідно з даним винаходом і його фармацевтично прийнятна сіль можуть бути отримані за допомогою різних відомих синтетичних способів. Залежно від типу функціональної групи, функціональна група у вихідних сполуках і на стадії одержання проміжних сполук може бути заміщена захисною групою (групою, що може бути легко перетворена в зазначену функціональну групу), і це може виявитися технічно ефективним при одержанні зазначених сполук. Зазначена функціональна група включає, наприклад, аміногрупу, гідроксильну групу й карбоксильну групу. Захисні групи для них описані, наприклад, в "Protective Groups in Organic Synthesis, (3rd Ed., 1999)", Greene & Wuts, які можуть бути вибрані відповідним чином і використані відповідно до умов проведення реакції. У зазначеному способі захисна група, якщо необхідно, видаляється після того, як вона введена, і реакцію здійснюють таким чином, щоб одержати необхідну сполуку. Проліки сполуки (І) можуть бути отримані шляхом введення специфічної групи у вихідні сполуки й на стадії одержання проміжних сполук, аналогічно введенню вищевказаної захисної групи, або ж шляхом подальших перетворень отриманої сполуки (І). Реакцію можна здійснити за допомогою способів, відомих фахівцям в галузі техніки, таких як звичайна етерифікація, амідування, дегідратація й т.п. Нижче наводяться типові способи одержання сполук згідно з даним винаходом. Проте, способи одержання сполук згідно з даним винаходом не повинні бути обмежені наведеними нижче прикладами. Спосіб одержання 1: Формули 12 21 90894 22 (У зазначених формулах L1 означає відхідну групу; це ж позначення використовується й далі по тексту опису.) Даний спосіб є способом одержання сполуки загальної формули (Іb) згідно з даним винаходом шляхом взаємодії похідного 2-метилбензімідазолу (II) із сполукою (III), а потім з похідним фенілсульфонілу (VI). Відхідна група для L1 включає групу органічної сульфонової кислоти, таку як метансульфонілокси або п-толуолсульфонілокси, галоген і т.п.Як сполука (III) можуть використовуватися різні ангідриди кислот. Реакцію можна проводити без розчинника або в розчиннику, інертному в умовах проведення реакції, які охоплюють як охолодження, так і нагрівання. Температуру реакції звичайно встановлюють залежно від типу сполук. Використовуваний розчинник включає ароматичні вуглеводні, такі як бензол, толуол, ксилол; прості ефіри, такі як діетиловий ефір, тетрагідрофуран (ТГФ), діоксан, диглим, 1,2-диметоксіетан, 2-метоксидіетиловий ефір; галогенвмісні вуглеводні, такі як дихлорметан, 1,2дихлоретан, хлороформ; ацетонітрил, етилацетат або т.п.; і один або кілька зазначених розчинників можуть застосовуватися як індивідуально, так і в комбінації. Кожна із сполуки (II), сполуки (III) і сполуки (VI), залежно від реакції й сполук, можуть використовуватися в еквімолярній кількості або в надлишку. З деякими сполуками часто може виявитися доцільним проводити реакцію в присутності органічної основи (переважно, діізопропіламіну, N-метилморфоліну, 4-(N,Nдиметиламіно)піридину, триетиламіну, піридину, колідину, морфоліну, 2,6-лутидину) або неорганічної основи (переважно, гідриду натрію, карбонату калію, карбонату натрію, бікарбонату натрію, гідроксиду натрію, гідроксиду калію). Розчинник, що володіє основними властивостями, може використовуватися також як основа. Після виділення або без виділення сполука (IV) може бути використана в реакції на наступній стадії. У даному описі для зручності структура сполук (IV), сполуки (V) і відповідних їм сполук у порівняльному прикладі виражені у вигляді єдиної конфігурації стосовно їх геометричного ізомеризму, що визначається наявністю подвійного зв'язку, наявного в зазначених сполуках; однак деякі сполуки можуть мати геометричні ізомери щодо наявного в них подвійного зв'язку, а тому даний винахід включає подібні геометричні ізомери і їхні суміші. Спосіб одержання 2: Формули 13 Зазначений спосіб одержання являє собою введення групи, що відповідає R3, у вихідну сполуку (VII); а для сполуки (VIII) використовують різні азотвмісні сполуки й сполуки, що містять гідроксильну групу. Реакцію можна проводити без розчинника або в розчиннику, інертному в умовах проведення реакції, які охоплюють як охолодження, так і кип'ятіння зі зворотним холодильником. Температуру реакції звичайно встановлюють залежно від сполук. Використовуваний розчинник включає ароматичні вуглеводні, прості ефіри, галогенвмісні вуглеводні, Ν,Ν-диметилформамід (ДФМА), Ν,Νдиметилацетамід (DMA), N-метилпіролідон (NMP), етилацетат, ацетонітрил, піридин і т.п.; і один або кілька зазначених розчинників можуть застосовуватися як індивідуально, так і в комбінації. Сполука (VIII) може використовуватися в еквімолярній кількості або в надлишку. Залежно від типу сполуки часто може виявитися доцільним проводити реакцію в присутності органічної основи або неорганічної основи. Вихідна сполука (VII) може бути отримана по вищевказаному способі одержання 1. її можна також одержати з похідного сульфонової кислоти (L1=OH) відповідно до способу одержання 1 обробкою галогенуючим агентом, таким як тіонілхлорид, оксалілхлорид, оксихлорид фосфору й т.п. Спосіб одержання 3: Сполуки загальної формули (І), що мають різні замісники в групі R1, R2 або R3 або в циклі А, можуть бути легко отримані по реакції, що очевидна для фахівців, або шляхом її модифікацій, виходячи із сполук (І) згідно з даним винаходом. Наприклад, для цього можна здійснювати наступні реакції. (1) Амідування, сульфонамідування й етерифікація: Взявши як вихідну сполуку згідно з даним винаходом, що містить гідроксильну групу або аміногрупу, і використовуючи похідне карбонової кислоти або сульфонової кислоти або їх реакційноздатне похідне, можуть бути отримані різні амідні сполуки або складні ефіри. Альтернативно, взявши як вихідну сполуку згідно з даним винаходом, що містить групу карбонової кислоти або сульфонової кислоти, можна ввести її у взаємодію із сполукою, що має гідроксильну групу або аміногрупу. Реакцію проводять у такий спосіб: Використовуючи реакційноздатне похідне сполуки (зокрема, галогенангідрид, ангідрид кислоти, активний складний ефір) карбонової кислоти або сульфонової кислоти, можна застосувати спосіб, наведений вище для способу одержання 1 і способу одержання 2. Реакцію можна проводити в присутності агента, що конденсує (зокрема, дициклогексилка 23 рбодііміду (DCC), діізопропілкарбодііміду (DIPC), 3етил-1-(3-диметиламінопропіл)карбодііміду (WSC), 1,Г-карбонілбіс-1Н-імідазолу (CDI) або ж, що можливо, з додатковою добавкою (зокрема, Nгідроксисукциніміду (HONSu), 1гідроксибензотриазолу (НОВt), диметиламінопіридину (DMAP)). Реакцію можна також проводити, наприклад, по способу, наведеному в "Jikken Kagaku Koza (Courses in Experimental Chemistry, 4th Ed.)", Vol.22 (1992) (Maruzen), під редакцій хімічного товариства Японії. Ацилування по атому азоту сульфонаміду також можна провести подібним чином. (2) Окислювання: Сполуки, що містять первинну або вторинну гідроксильну групу, можуть бути окислені з утворенням сполук згідно з даним винаходом, що містять, відповідно, альдегідну або кетогрупу. Зазначену реакцію можна здійснити відомим способом (ADVANCED ORGANIC CHEMISTRY (John WILEY & SONS (1992) by J. March), у якій можна, наприклад, використати окислювач, такий як м-хлорнадбензойна кислота, перекис водню, перутенат тетрапропіламонію, реагент ДесаМартіна, у розчиннику, що інертний в умовах проведення реакції, такому як галогенвмісні вуглеводні. (3) Одержання уреїдних похідних: Сполуки згідно з даним винаходом, що містять аміногрупу або сульфонамідну групу, можуть вступати в реакцію з ізоціанатними сполуками або ціанатом калію з утворенням, як сполуки згідно з даним винаходом, відповідного похідного сечовини. Зазначену реакцію можна проводити в розчиннику, що інертний в умовах проведення реакції, такому як ароматичні вуглеводні, галогенвмісні вуглеводні, ДМФА, NMP, ацетонітрил, в інтервалі температур від кімнатної температури до температури кипіння зі зворотним холодильником. При проведенні реакції може виявитися доцільним додати органічну основу або неорганічну основу або ж додати кислоту, таку як оцтова кислота. Ізоціанатна сполука може бути отримана з відповідних вихідних сполук, тобто карбонової кислоти або її реакційноздатного похідного за допомогою добре відомих перетворень (див., зокрема, ADVANCED ORGANIC CHEMISTRY (John WILEY & SONS (1992) by J. March). (4) Гідроліз: Гідролізом карбоксилатного складного ефіру можна одержати сполуку згідно з даним винаходом, що містить карбоксильну групу. Гідроліз можна здійснити звичайним способом, у якому, наприклад, можна застосовувати спосіб видалення захисної групи карбоксилу, що описаний у вищенаведеному документі "Protective Groups in Organic Synthesis (3rd Ed.)"· 90894 24 (5) Відновлення: Для відновлення нітрогрупи в аміногрупу, відновлення азидної групи в аміногрупу й дегалогенування галогензаміщених ароматичних сполук використовують добре відому реакцію відновлення (COMPREHENSIVE ORGANIC SYNTHESIS 8 REDUCTION (Pergamon Press (1991)). Наприклад, вона включає (1) каталітичне відновлення, що проводять в атмосфері водню або в присутності донора водню, такого як форміат амонію, з використанням каталізатора, такого як паладій, платина або нікель, у розчиннику, такому як спирти, зокрема, метанол, етанол, або хлороформ, етилацетат або оцтова кислота, як при охолодженні, так і при нагріванні; (2) реакцію з використанням металу, такого як залізо, або дихлориду олова в присутності оцтової кислоти або хлористоводневої кислоти; або (3) реакцію з використанням відновника, такого як гідросульфіт натрію, у суміші таких розчинників як вода, спирти, ТГФ, як при охолодженні, так і при нагріванні. (6) Амінування або N-алкілування: Сполуку, що містить галогеналкільну або сульфонілокси групу, можна ввести у взаємодію з різними амінами з утворенням сполуки згідно з даним винаходом, що містить аміногрупу. Сполуку, що містить аміногрупу згідно з даним винаходом, може ввести в реакцію з будь-яким іншим алкілуючим агентом, при цьому в сполуку можна ввести алкільну групу. Алкілуючим агентом, переважно, є алкілгалогеніди й органічні сульфонати зі спиртами. Зазначену реакцію можна проводити в розчиннику, що інертний в умовах проведення реакції, такому як ароматичні вуглеводні, галогенвмісні вуглеводні, прості ефіри, кетони (ацетон, 2бутанон і т.п.), ацетонітрил, етилацетат, ДМФА, DMA або NMP, як при охолодженні, так і при нагріванні. Для більш гладкого протікання реакції доцільним може виявитися проведення реакції в присутності органічної основи або неорганічної основи. (7) Амідиногрупа й гуанідиногрупа: Сполука, що містить амідиногрупу або гуанідиногрупу, може бути отримана добре відомим способом. Наприклад, сполука, що містить амідиногрупу, може бути отримана по способу, наведеному в "Jikken Kagaku Koza (Courses in Experimental Chemistry, 4th Ed.)", Vol.20 (1992) (Maruzen), під редакцій хімічного товариства Японії; а сполука, що містить гуанідиногрупу, може бути отримана по способу, наведеному в "COMPREHENSIVE ORGANIC FUNCTIONAL GROUP TRANSFORMATIONS" (Pergamon Press (1995)), A. R. Katritzky, et al. Спосіб одержання 4: Формули 14 25 (У формулі L являє собою -S-нижчий алкіл, a L являє собою -S-нижчий алкіл або імідазол.) Стадія 1: Цю стадію проводять, щоб одержати похідне 1,3-дикетону (X) по реакції похідного метилкетону (IX) і сполуки (VI) у присутності основи з наступною обробкою різними сполуками (VIII), що мають основний азот. Реакцію можна здійснювати в присутності сильної основи, такої як діізопропіламід літію (LDA) у розчиннику, що інертний в умовах проведення реакції, такому як прості ефіри, зокрема, тетрагідрофуран (ТГФ), як при охолодженні, так і при нагріванні аж до кип'ятіння зі зворотним холодильником. Стадія 2: Цю стадію проводять, щоб одержати сполуку (XI), в якій обидві групи L2 і L3 означають -Sнижчий алкіл, по реакції похідного 1,3-дикетону (X) з дисульфідом вуглецю (CS2) у присутності основи з наступною обробкою нижчим алкілгалогенідом, таким як метилйодид. Реакцію можна проводити в присутності основи, такої як гідрид натрію (Na), у розчиннику, що інертний в умовах проведення реакції, наприклад, апротонному полярному розчиннику, такому як Ν,Ν-диметилформамід (ДМФА), як при охолодженні, так і при нагріванні. На цій стадії може виявитися доцільним додатково додати фторид калію. При проведенні вищевказаної послідовності перетворень замість дисульфіду вуглецю (CS2) можна використати 1,1'тіокарбонілдіімідазол з утворенням сполуки (XI), в якій L2 означає -S-нижчий алкіл, a L3 означає імідазол. Стадія 3: Цю стадію проводять, щоб одержати сполуку загальної формули (І) по реакції сполуки (XI), що має дві відхідні групи з похідною сполукою діаміну (XII). Реакцію можна проводити в розчиннику, що інертний в умовах проведення реакції, наприклад, у спиртах, таких як етанол, або апротонному полярному розчиннику, такому як диметилсульфок 90894 26 сид (ДМСО), як при охолодженні, так і при нагріванні аж до кип'ятіння зі зворотним холодильником. Сполуки згідно з даним винаходом також очищають і виділяють у вигляді вільних сполук, фармацевтично прийнятних солей, гідратів, сольватів або кристалічних поліморфних форм зазначених сполук. Фармацевтично прийнятні солі сполук (І) згідно з даним винаходом можна одержати, використовуючи звичайні реакції їхнього одержання. Виділення й очищення можна здійснити за допомогою звичайних хімічних методів, таких як екстракція, фракційна кристалізація, різні види фракційної хроматографії. Різні типи ізомерів можна виділити, підбираючи придатні вихідні сполуки або розділяючи ізомери на основі розходжень фізико-хімічних властивостей ізомерів. Наприклад, оптичний ізомер можна виділити у вигляді стереохімічно чистого ізомеру за звичайною методикою рацемічного розщеплення (наприклад, методом фракційної кристалізації, перетворюючи сполуку в діастереомерну сіль за допомогою оптично активної основи або оптично активної кислоти; або хроматографічним методом, використовуючи хиральну колонку, і т.п.). Його можна одержати також з придатної оптично активної вихідної сполуки. Фармакологічна активність сполук згідно з даним винаходом підтверджена наведеними нижче методами випробувань. Приклад випробувань 1. Тест на антагоністичний ефект стосовно рецептора GnRH: Антагоністичні ефекти сполук згідно з даним винаходом стосовно рецептора GnRH оцінюють, розраховуючи концентрацію, що на 50% інгібує зв'язування 125І-D-Trp6-LHRH з рецептором GnRH людини (ІС50), відповідно до опису посилання на патент 1, с 56 "1. Тест на антагоністичний ефект стосовно рецептора GnRH". Результати наведені в таблиці 1. 27 90894 Таблиця 1 Сполука Приклад 211 Приклад 245 Приклад 302 Приклад 482 Приклад 662 Приклад 696 ІС50 (нМ) 0,094 0,058 0,092 0,16 0,24 0,18 Як показано вище, сполуки згідно з даним винаходом, що містять "групу -SO2-R3", демонструють більш діючу антагоністичну активність стосовно рецептора GnRH, ніж сполуки порівняння, що мають групу -CO-R3. Приклад випробувань 2. Тест на антагоністичний ефект стосовно GnRH-індукованої реакції на підвищення рівня тестостерону в крові Антагоністичний ефект сполук стосовно гонадотропін вивільняючого гормону (GnRH) in vivo оцінюють по їх інгібуючій дії на реакцію на підвищення рівня тестостерону в крові, що індукують у щурів введенням GnRH (посилання на патент 1, с.57). У даному експерименті використовують самців щурів лінії Wistar (Nippon SLC) у віці 9 тижнів. GnRH (Peptide Institute, LH-RH (людини)) вводять внутрвшньом'язово в стегно кожного щура (30нг на щура). Тестовані сполуки розчиняють або суспендують в 0,5%-м водному розчині метилцелюлози (МС) і вводять перорально з дозою 3мг/кг за 2 або 6 годин до введення GnRH. Через годину після введення GnRH відбирають кров і концентрацію тестостерону в сироватці визначають методом специфічного радіоімуноаналізу (набір реагентів для RIA компанії Iatron). Інгібіторну активність (%) (ІА) тестованих сполук розраховують відповідно до формули: ІА=(TcTs)/(Tc-Tn) 100 (при зниженні до Τn, ІА=100%). У зазначеній формулі Τn означає концентрації тестостерону в сироватці щурів, яким не вводили 28 У вищевказаному посиланні на патент 1 розкривається карбонільна група як замісник у фенільній групі пропаноїлфенілу, але не розкривається сульфонільна група як замісник у фенільній групі пропаноїлфенілу. Тому для підтвердження корисності "групи -SO2-R3" активності сполук згідно з даним винаходом порівнюють із активностями сполук порівняння, що містять групу -CO-R3. Результати наведені в таблиці 2. GnRH; Тс означає концентрації тестостерону в сироватці щурів, яким замість тестованої сполуки вводили розчинник; Ts означає концентрації тестостерону в сироватці щурів, яким вводили тестовану сполуку. У підсумку, наприклад, інгібіторна активність сполук по прикладах 211, 302, 662 і 696 становить, щонайменше, 90% при дозі 3мг/кг. З наведених вище результатів випробувань виходить, що сполуки згідно з даним винаходом придатні як профілактичні/терапевтичні засоби для різних захворювань, залежних від статевих гормонів, таких як рак передміхурової залози, рак грудей, ендометріоз, фіброма матки, доброякісна гіперплазія передміхурової залози й т.д., оскільки вони мають діючий антагоністичний ефект стосовно рецептора GnRH. Композиція, що містить як активний інгредієнт одну або кілька сполук (І) згідно з даним винаходом або їхні солі, може бути приготовлена відповідно до загального способу, що застосовується у даній галузі техніки, з використанням фармацевтичних носіїв і наповнювачів, які звичайно застосовуються в даній галузі техніки. Терапевтичне введення може бути здійснене або перорально за допомогою таблеток, пігулок, капсул, гранул, порошків, рідин і т.д., або парентерально за допомогою внутрішньосуглобних, внутрішньовенних або внутрішньом'язових ін'єкцій, супозиторіїв, очних крапель, очних мазей, трансдермальних рідин, мазей, трансдермальних плас 29 тирів, черезслизових розчинів, черезслизових пластирів, інгаляторів і т.п. Згідно із даним винаходом, тверді композиції для перорального прийому включають таблетки, порошки або гранули й т.д., в яких один або кілька активних інгредієнтів змішані, щонайменше, з одним неактивним наповнювачем, таким як лактоза, маніт, глюкоза, гідроксипропілцелюлоза, мікрокристалічна целюлоза, крохмаль, полівінілпіролідон і/або алюмометасиликат магнію. Згідно з стандартними методами композиція може містити неактивні добавки, такі як лубриканти (зокрема, стеарат магнію), розпушувачі (зокрема, карбоксиметилкрохмаль натрію), стабілізатори, засоби, що полегшують солюбілізацію. Таблетки або пігулки, якщо необхідно, можуть бути покриті цукром або плівкою, здатною розчинятися в шлунку або кишечнику. Рідкі композиції для перорального прийому включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи й еліксири й містять звичайно застосовувані інертні розріджувачі, такі як очищена вода й етанол. Рідка композиція, крім інертного розріджувача, може містити додаткові добавки, такі як засоби, що полегшують солюбілізацію, зволожувачі й суспендуючі засоби, а також підсолоджувачі, віддушки, ароматизатори й антисептики. Ін'єкції для парентерального введення включають асептичні водні й неводні розчини, суспензії або емульсії. Розріджувачі для використання у водних розчинах включають, наприклад, дистильовану воду для ін'єкцій і фізіологічний сольовий розчин. Розріджувачі для використання в неводних розчинах включають, наприклад, пропіленгліколь, поліетиленгліколь, рослинну олію, таку як оливкова олія, спирти, такі як етанол, Polysorbate 80 (назва відповідно до Фармакопеї Японії). Подібні композиції можуть додатково включати засоби для підтримки тонусу, антисептики, зволожувачі, емульгатори, диспергатори, стабілізатори або засоби, що полегшують солюбілізацію. Зазначені композиції стерилізують фільтруванням через фільтр, що вловлює бактерії, або додаванням герміциду, або впливом радіації. Крім того, їх можна також приготувати у вигляді стерильних твердих композицій і розчинити або суспендувати у стерильному розчиннику для ін'єкцій безпосередньо перед їхнім використанням. Черезслизові композиції, такі як інгалятори й трансназальні засоби, застосовують у твердій, рідкій або напівтвердій формі, і їх можна приготувати відповідно до звичайних відомих способів. Наприклад, якщо необхідно, можуть додаватися відомі наповнювачі й додаткові регулятори рН, антисептики, поверхнево-активні речовини, лубриканти, стабілізатори й загусники й т.п.Для здійснення введення можуть використовуватися придатні пристрої для інгаляції або інсуфляції. Наприклад, за допомогою відомих пристроїв або розпилювачів, таких як дозовані інгалятори, сполуки можуть вводитися незалежно або ж у формі запропонованоїсуміші порошків. Крім того, сполуки, об'єднані з фармацевтично прийнятними носіями, можуть вводитися у формі розчинів або су 90894 30 спензій. Інгалятори для сухих порошків і т.п.можуть являти собою пристрої для однократного або багаторазового введення. Можуть також застосовуватися сухі порошки або капсули, що містять порошки. Далі, пристрій може бути у формі аерозольної упаковки під тиском і т.п., в якій використовують придатний газ-витісник, такий як хлорфторалкан або гідрофторалкан, або придатний газ, такий як діоксид вуглецю. У випадку перорального прийому денна доза на масу тіла звичайно становить від приблизно 0,001 до 100мг/кг, переважно, 0,1-30мг/кг, більш переважно, 0,1-10мг/кг. Дозу можна вводити один раз на день або ж розділити її на 2-4 дози. У випадку внутрішньовенного введення денна доза на масу тіла звичайно становить від приблизно 0,0001 до 10мг/кг і її вводять раз на день, або ж її можна розділити на кілька доз. У випадку черезслизового введення денна доза на масу тіла звичайно становить від приблизно 0,001 до 100мг/кг і її вводять раз на день, або ж її можна розділити на кілька доз. Дози визначають для кожного випадку залежно від симптомів, віку, статі й т.п. Приклади Способи одержання сполук (І) згідно з даним винаходом описуються більш докладно з посиланням на наступні приклади. Сполуки згідно з даним винаходом не слід обмежувати тими сполуками, що наведені в наступних прикладах. Способи одержання вихідних сполук наведені в довідкових прикладах. Абревіатури, використовувані в наведених довідкових прикладах, прикладах і таблицях, означають наступне: Ех: номер прикладу REx: номер довідкового прикладу No.: номер сполуки Dat: фізико-хімічні дані (FA: FAB-MS (M+H)+, FN: FAB-MS (M-H)-, ES+: ESI-MS (М+Н)+, ES-: ESIMS (М-Н)-, ЕІ: ΕΙ-MS (М+), АР+: APCI-MS (М+Н)+, АР-: APCI-MS (М-Н) , N1: δ (м.ч.) характеристичні 1 піки спектра H ЯМР у ДМСО-d6, N2: δ (м. ч.) характеристичні піки спектра 1Н ЯМР в CDCI3). Sal: сіль (НСI: гідрохлорид, без вказівки: вільна форма) Str: структурна формула pos: позиція, що її займає замісник Syn: спосіб одержання (числівник без буквеного покажчика означає номер прикладу, на який посилаються як на аналогічний спосіб при одержанні сполуки; числівник з буквою R означає номер довідкового прикладу, на який посилаються як на аналогічний спосіб при одержанні сполуки. Наприклад, R1 означає, що сполуку одержують по способу, що аналогічний наведеному в довідковому прикладі 1). Not Isolated: продукт не виділявся Me: метил Et: етил Рr: пропіл іРr: 2-пропіл сРr: циклопропіл Вu: бутил tBu: трет-бутил Вос: трет-бутоксикарбоніл 31 cBu: циклобутил Ms: метансульфоніл Ts: п-толуолсульфоніл Ph: феніл 2Ру: 2-піридил 3Ру: 3-піридил 4Ру: 4-піридил 1Naph: 1-нафтил 2Naph: 2-нафтил Ас: ацетил Piv: півалоїл Вn: бензил 2Fur: 2-фурил 3Fur: 3-фурил 4ТНР: тетрагідропіран-4-іл 2THF: тетрагідрофуран-2-іл Руrа: піразин-2-іл 2Тhi: 2-тієніл 3Тhi: 3-тієніл Числівник перед сполукою вказує на позицію замісника; кілька числівників означають заміщення декількома замісниками. Наприклад, 3,5-диМе-Рh означає 3,5-диметил феніл. Довідковий приклад 1: 3-фторбензоїлхлорид додають до суміші 2метилбензімідазолу, триетиламіну й діоксану, а потім нагрівають зі зворотним холодильником протягом 3 годин й охолоджують до кімнатної температури. Додають морфолін і при перемішуванні нагрівають до температури 70°С протягом 1 години, потім суміш розробляють і одержують 1-(3фторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)етанон. Довідковий приклад 2: 1-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)етанон і 3(хлорсульфоніл)бензоїлхлорид нагрівають зі зворотним холодильником у діоксані протягом 1 години, а потім охолоджують. Розбавляють етилацетатом, нерозчинні речовини відокремлюють фільтруванням. Фільтрат концентрують при зниженому тиску, а отриманий залишок очищають колонковою хроматографією на силікагелі. Продукт розбавляють етилацетатом, послідовно промивають насиченим водним розчином бікарбонату натрію й водою, сушать над безводним сульфатом магнію й розчинник упарюють при зниженому тиску, одержуючи 3-[3-(3,5-дифторфеніл)-2-(1,3дигідро-2Н-бензімідазол-2-іліден)-3оксопропаноїл]бензосульфонілхлорид. Довідковий приклад 3: Розчин тетрагідро-2Н-тіопіран-4-карбонітрилу в хлороформі при 0°С по краплях додають до розчину 77%-й м-хлорнадбензойної кислоти, а потім перемішують при кімнатній температурі протягом 3 годин. Додають надлишок насиченого водного розчину сульфіту натрію, а потім суміш розробляють і одержують 1,1-діоксид тетрагідро-2Нтіопіран-4-карбонітрилу. Довідковий приклад 4: Сполуку, отриману в довідковому прикладі 3, суспендують в етанолі й діетиловому ефірі й через отриману суспензіюпри 0°С протягом 30хв. барботують хлористий водень. Перемішують при 0°С ще протягом 15 годин й нерозчинні речовини відо 90894 32 кремлюють фільтруванням, а фільтрат концентрують при зниженому тиску, одержуючи гідрохлорид 1,1-діоксиду етил тетрагідро-2Н-тіопіран-4карбоксімідату. Довідковий приклад 5: Суспензію в етанолі сполуки, отриманої в довідковому прикладі 4 додають до насиченого розчину аміаку в етанолі при температурі 0°С, а потім перемішують при кімнатній температурі протягом 13 годин. Нерозчинні речовини відокремлюють фільтруванням, а фільтрат концентрують при зниженому тиску, одержуючи гідрохлорид 1,1-діоксиду тетрагідро-2Н-тіопіран-4-карбоксімідаміду. Довідковий приклад 6: 3,3,3-трифторпропаналь при 0°С при енергійному перемішуванні додають до суміші гідросульфату натрію й води, а потім перемішують ще протягом 10хв. По краплях додають водний розчин ціаніду калію, перемішують при 0°С протягом 1 години, а потім розробляють суміш і очищають продукт, одержуючи 4,4,4-трифтор-2гідроксибутаннітрил. Довідковий приклад 7: Порошок заліза додають до розчину бензил 2метил-3-нітробензоату в оцтовій кислоті, а потім перемішують при кімнатній температурі протягом 1,5 годин. Нерозчинні речовини відокремлюють фільтруванням, а фільтрат концентрують при зниженому тиску. Залишок розбавляють етилацетатом, нейтралізують насиченим водним розчином бікарбонату натрію й нерозчинні речовини відокремлюють фільтруванням. Фільтрат екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, сушать над безводним сульфатом магнію й розчинник упарюють при зниженому тиску. Додають етилацетат і до отриманого розчину при 0°С по краплях додають 4Μ розчин хлористого водню в етилацетаті. Осад відокремлюють фільтруванням і одержують бензил 3аміно-2-метилбензоат. Довідковий приклад 8: До суспензії сполуки, отриманої в довідковому прикладі 7, у суміші оцтової кислоти (40мл) і концентрованої хлористоводневої кислоти (12,5мл) при 0°С по краплях додають водний розчин (15мл) нітриту натрію (2,19г), а потім перемішують протягом 30хв. Отриману реакційну суміш при 0°С по краплях додають до суспензії дигідрату хлориду міді(ІІ) в оцтовій кислоті, через яку попередньо протягом 10хв. барботують діоксид сірки, а потім перемішують при кімнатній температурі протягом 19 годин. Реакційну суміш виливають у воду з льодом, розробляють і очищають, одержуючи бензил 3-(хлорсульфоніл)-2-метилбензоат. Довідковий приклад 9: Сполуці, отриманій в довідковому прикладі 8, дають провзаємодіяти у розчині трифтороцтової кислоти при нагріванні до температури 60°С протягом 17 годин й одержують 3-(хлорсульфоніл)-2метилбензойну кислоту. Довідковий приклад 10: Водний 50%-й розчин гідроксиламіну додають до розчину 3-ціанобензойної кислоти в метанолі й нагрівають зі зворотним холодильником протягом 11 годин. Реакційну суміш концентрують, розбав 33 ляють водою, доводять рН до значення в діапазоні від 2 до 3 за допомогою 1Μ розчину хлористоводневої кислоти, осад, що випав, відокремлюють фільтруванням і одержують 2[(гідроксіаміно)(іміно)метил]бензойну кислоту. ES+: 181. Довідковий приклад 11: Суміш сполуки, отриманої в довідковому прикладі 10, п-толуолсульфонової кислоти й триетоксиметану нагрівають зі зворотним холодильником протягом 30хв. Після охолодження суміш розбавляють ацетонітрилом, речовину, що не розчинілася, виділяють фільтруванням і одержують 3-(1,2,4оксадіазол-3-іл)бензойну кислоту. FA: 191. Довідковий приклад 71: При кімнатній температурі додають 3(хлорсульфоніл)-4-фторбензоїлхлориду (3,19г) до суспензії 2-(1,3-дигідро-2Н-бензімідазол-2-іліден)1-(3-фторфеніл)етанону (1,50г) в діоксані (75мл), а потім нагрівають до 110°С і перемішують протягом 1 години. Реакційну суміш охолоджують до кімнатної температури, речовини, що не розчинилися, відокремлюють фільтруванням, і суміш упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (гексан/етилацетат =3/1) і одержують 5-[2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3-(3-фторфеніл)-3оксопропаноїл]-2-фторбензосульфонілхлорид (2,10г). Довідковий приклад 207: 1,58Μ розчин н-бутиллітію в гексані (13,8мл) в атмосфері аргону по краплях додають до розчину діізопропіламіну (3,08мл) у безводному ТГФ (300мл), охолодженому до -78°С, і в такий спосіб одержують розчин LDA. Отриманий розчин нагрівають до -20°С і знову охолоджують до -78°С, а потім по краплях додають 3-фторацетофенон (2,07г) і перемішують при -78°С протягом 30хв. Потім по краплях додають 3(хлорсульфоніл)бензоїлхлорид (2,44г) і перемішують протягом 15хв. Окремо при кімнатній температурі гідрохлорид 2-гідрокси-2метилпропанімідаміду (3,05г) додають до розчину гідриду натрію (чистота 60%, 0,88г) у ТГФ (40мл) і перемішують при охолодженні до 0°С протягом 30хв. Потім до суміші в один прийом додають отриманий раніше розчин і перемішують при кімнатній температурі протягом 1 години. Додають насичений водний розчин хлориду амонію й екстрагують етилацетатом. Органічний шар промивають водою, сушать і упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =50/1) і одержують Ν-({3-[3-(3фторфеніл)-3-оксопропаноїл]феніл}сульфоніл)-2гідрокси-2-метилпропанімідамід (2,17г). Довідковий приклад 208: Фторид калію (3,30г) додають до розчину Ν({3-[3-(3-фторфеніл)-3оксопропаноїл]феніл}сульфоніл)-2-гідрокси-2метилпропанімідаміду (1,13г) у ДМФА (20мл) і охолоджують до 0°С. Потім до отриманої суміші по краплях додають дисульфід сірки (1,06г). Після цього по краплях додають розчин метилйодиду (0,95г) у ДМФА (4мл), нагрівають до кімнатної тем 90894 34 ператури й перемішують протягом 15хв. Додають воду й екстрагують етилацетатом. Органічний шар промивають водою, сушать і упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (гексан/етилацетат =1/2) і одержують N-({3-[2-(3-фторбензоїл)-3,3біс(метилтіо)акрилоїл]феніл}сульфоніл)-2гідрокси-2-метилпропанімідамід (1,32г). Довідковий приклад 209: При кімнатній температурі бензилбромід (8,85мл) і карбонат калію (10,3г) додають до розчину 2-метокси-3-нітробензойної кислоти (9,80г) у ДМФА (150мл), а потім перемішують протягом 70хв. Нерозчинні речовини відокремлюють фільтруванням, а потім упарюють при зниженому тиску. Додають етилацетат, водний розчин бікарбонату натрію й гексан і розділяють шари рідини. Органічний шар промивають спочатку водою, а потім насиченим сольовим розчином, сушать, а потім упарюють при зниженому тиску й одержують бензил 2-метокси-3-нітробензоат(14,3г). N2: 3,92 (ЗН, с), 5,39 (2Н, с), 7,23-7,47 (6Н, м), 7,90 (1Н, дд, J=8Гц, 2Гц), 8,05 (1Н, дд, J=8Гц, 2Гц). Залізо (13,9г) додають до розчину бензил 2метокси-3-нітробензоату (14,3г) в оцтовій кислоті (150мл), а потім перемішують при кімнатній температурі протягом 17,5 годин. Речовини, що не розчинилися, відокремлюють фільтруванням і суміш упарюють при зниженому тиску. Додають водний розчин бікарбонату натрію, етилацетат і целіт, речовини, що не розчинилися, відокремлюють фільтруванням, а потім шари рідини розділяють, виділяючи органічний шар. При кімнатній температурі додають 4N розчин хлористого водню в етилацетаті (12,5мл) і перемішують 30хв., а потім упарюють при зниженому тиску. Залишок піддають азеотропній обробці за допомогою толуолу й одержують гідро хлорид бензил 3-аміно-2метоксибензоату (14,4г). FA: 258. Розчин нітриту натрію (3,55г) у воді (20мл) по краплях додають до суспензії гідрохлориду бензил 3-аміно-2-метоксибензоату (14,4г) у суміші оцтової кислоти (110мл) і хлористоводневої кислоти (35мл), підтримуючи температуру суміші на рівні 0°С, а потім перемішують протягом 30хв. Окремо газоподібний діоксид сірки барботують через оцтову кислоту (125мл) при 0°С, а потім додають дигідрат хлориду міді(ІІ) (2,09г) і одержують розчин. Отриману вище суспензію солі діазонію додають до отриманого розчину, перемішують при 0°С протягом 35хв., а потім перемішують при кімнатній температурі протягом 17 годин. Отриману суміш виливають у крижану воду й, додавши суміш етилацетат/гексан (1/1), розділяють шари рідини. Органічний шар промивають водою й насиченим сольовим розчином, а потім упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (гексан/етилацетат =4/1) і одержують бензил 3-(хлорсульфоніл)-2метоксибензоат (12,9г). N1: 3,77 (3Н, с), 5,34 (2Н, с), 7,15 (1Н, т, J=8Гц), 7,35-7,50 (5Н, м), 7,68 (1Н, дд, J=8Гц, 2Гц), 7,93 (1Н, дд, J=8Гц, 2Гц). Розчин бензил 3-(хлорсульфоніл)-2метоксибензоату (12,9г) у трифтороцтовій кислоті 35 (95мл) перемішують при 70°С протягом 5 годин. Розчин декантують і упарюють при зниженому тиску. До залишку додають толуол і знову упарюють. Тверду речовину, що утворилася, відокремлюють фільтруванням, промивають толуолом і сушать, одержуючи 3-(хлорсульфоніл)-2метоксибензойну кислоту (6,52г). N1: 3,84 (3Н, с), 7,13 (1Н, т, J=8Гц), 7,67 (1Н, дд, J=8Гц, 2Гц), 7,91 (1Н, дд, J=8Гц, 2Гц), 13,86 (1Н, ушир.с). До суспензії 3-(хлорсульфоніл)-2метоксибензойної кислоти (3,00г) у тіонілхлориді (4,37мл) додають три краплі Ν,Νдиметилформаміду, а потім перемішують при температурі 60°С протягом 2 годин. Розчинник упарюють, залишок піддають азеотропній обробці за допомогою толуолу й одержують 3(хлорсульфоніл)-2-метоксибензоїлхлорид (3,22г). Довідковий приклад 210: При температурі 10°С карбонат цезію (5,81г) додають до розчину 3-фтор-5-нітробензойної кислоти (2,20г) у ДМФА (30мл) і перемішують протягом 30хв. Потім по краплях протягом 30хв. додають бензилбромід (2,07г), а потім перемішують ще протягом 10хв. Речовини, що не розчинилися, відфільтровують, а розчин упарюють при зниженому тиску. До залишку додають ефір і воду й розділяють рідкі фази, органічний шар сушать і упарюють, одержуючи бензил 3-фтор-5-нітробензоат (3,11г). ЕІ: 275. До розчину бензил 3-фтор-5-нітробензоату (3,11г) в оцтовій кислоті (31мл), додають залізо (3,16г), а потім перемішують при кімнатній температурі протягом 1 години. (Реакція екзотермічна, і температура реакції підвищується до 40°С.) Речовини, що не розчинилися, відфільтровують, а розчин упарюють при зниженому тиску. Додають водний розчин бікарбонату натрію, етилацетат і целіт і речовини, що не розчинилися, відфільтровують. Розділяють шари рідини й збирають органічну фазу. При кімнатній температурі додають 4N розчин хлористого водню в етилацетаті (4мл) і перемішують протягом 30хв. Тверду речовину, що потім утворилася, збирають фільтруванням і одержують гідрохлорид бензил 3-аміно-5-фторбензоату (2,18г). FA: 246. Водний розчин 3-аміно-5-фторбензоату (2,18г) у суміші оцтової кислоти (17мл) і концентрованої хлористоводневої кислоти (0,65мл), підтримуючи температуру суміші в діапазоні 5-10°С, а потім перемішують протягом 1 години. Окремо газоподібний діоксид сірки барботують через оцтову кислоту (100мл) при 0°С, а потім додають дигідрат хлориду міді(П) (330мг) і одержують розчин. Отриману вище суспензію солі діазонію в один прийом додають до отриманого розчину, перемішують при 0°С протягом 1 години, а потім перемішують при кімнатній температурі протягом 14 годин. Отриману суміш виливають у крижану воду й, додавши етилацетат, розділяють шари рідини. Органічний шар промивають водою й насиченим сольовим розчином, а потім упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (гексан/етилацетат =6/1) і одержують бензил 3-(хлорсульфоніл)-5-фторбензоат (2,30г). 90894 36 N1: 5,37 (2Н, с), 7,36-7,50 (5Н, м), 7,58 (1Н, м), 7,68 (1Н, м), 8,03 (1Н, м). Розчин бензил 3-(хлорсульфоніл)-5фторбензоату (2,30г) у трифтороцтовій кислоті (18мл) перемішують при нагріванні до 60°С протягом 18 годин. Маслянисту речовину, що плаває на поверхні рідини, видаляють, розчин декантують і упарюють при зниженому тиску. До залишку додають гексан і обробляють ультразвуком протягом 10хв. Тверду речовину, що утворилася, виділяють фільтруванням і одержують 3-(хлорсульфоніл)-5фторбензойну кислоту (1,37г). EI: 238. До суспензії 3-(хлорсульфоніл)-5фторбензойної кислоти (1,36г) у тіонілхлориді (2,03г) додають одну краплю Ν,Νдиметилформаміду, а потім перемішують при температурі 75°С протягом 1 години. Розчинник упарюють, залишок піддають азеотропній обробці за допомогою толуолу й одержують 3(хлорсульфоніл)-5-фторбензоїлхлорид (1,47г). Довідковий приклад 211: Бензил Ν,Ν'-дициклогексилімідокарбамат (0,82г) додають до розчину 2-аміно-3нітробензойної кислоти (0,36г) у ДМФА (3мл), нагрівають до температури 70°С і перемішують протягом 2 годин. Реакційну суміш охолоджують до кімнатної температури, додають до неї суміш етилацетат/ефір (1/1) і речовини, що не розчинилися не, видаляють фільтруванням. Фільтрат промивають спочатку водним розчином бікарбонату натрію, а потім водою й розчинник упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (гексан/етилацетат =3/1) і одержують бензил 2-аміно-3-нітробензоат (0,42г). FA: 273. До розчину бензил 2-аміно-3-нітробензоату (0,38г) у суміші етанол/вода (4/1) (40мл) додають спочатку порошок заліза (0,78г) і хлорид амонію (0,15г) і отриману суміш при енергійному перемішуванні нагрівають зі зворотним холодильником протягом 20хв. Речовини, що не розчинилися, видаляють фільтруванням ще гарячої суміші, фільтрат упарюють при зниженому тиску до приблизно 1/5 об'єму, а потім додають водний розчин бікарбонату натрію й екстрагують етилацетатом. Органічний шар промивають водою, сушать і упарюють при зниженому тиску, одержуючи бензил 2,3діамінобензоат (0,33г). За аналогією з довідковими прикладами 1-11, 71 і 207-211 одержують сполуки по інших довідкових прикладах, наведені нижче в таблицях 3-18, використовуючи відповідні вихідні сполуки. Структура, спосіб одержання й фізико-хімічні дані сполук по довідкових прикладах наведені в таблицях. Приклад 1: 60%-й гідрид натрію (809мг) додають до розчину гідрохлориду формамідину (1,92г) у ДМФА (30мл) і перемішують при кімнатній температурі протягом 15хв. Потім додають розчин 3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксопропаноїл]бензолсульфонілхлориду (далі називають вихідною сполукою А, 1,13г) у ДМФА (10мл) і перемішують при кімнатній температурі протягом 1,5 годин. Реакційну суміш виливають у надлишок водного розчину хлориду амо 37 нію й екстрагують етилацетатом. Органічний шар промивають водою, концентрують при зниженому тиску, очищають колонковою хроматографією на силікагелі (хлороформ/метанол =10/1) і кристалізують із суміші діетиловий ефір/н-гексан і одержують 3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-Н(імінометил) бензолсульфонамід (81мг). Приклад 2: Розчин вихідної сполуки А (300мг) у ДМФА (3мл) додають до гідрохлориду гліцинетилового ефіру (733мг) і триетиламіну (0,73мл) у ДМФА (10мл), а потім перемішують при кімнатній температурі протягом 30хв. Отриману суміш розбавляють водою, осад виділяють фільтруванням, сушать при зниженому тиску й одержують етил [({3[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)аміно]ацетат(505мг). Приклад 3: Аміноацетонітрил (177мг) додають при 0°С до розчину вихідної сполуки А (300мг) у ДМФА (10мл), а потім перемішують при кімнатній температурі протягом 1,5 годин. Додають надлишок насиченого водного розчину хлориду амонію, осад збирають фільтруванням, сушать при зниженому тиску й одержують N-(ціанометил)-3-[3-(3,5-дифторфеніл)2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3оксопропаноїл]бензолсульфонамід (242мг). Приклад 4: 2-амінопіридин (248мг) додають до розчину вихідної сполуки А (250мг) у піридині (10мл), потім перемішують при кімнатній температурі протягом 1 години й реакційну суміш концентрують при зниженому тиску. Отриманий залишок очищають колонковою хроматографією на силікагелі (нгексан/етилацетат =1/2), а потім перекристалізовують із суміші етилацетат/н-гексан і одержують 3[3-(3,5-дифторфеніл)-2-(1,3-Дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-К-піридин2-ілбензолсульфонамід (36мг). Приклад 5: Суміш 3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3-оксопропаноїл] бензолсульфонаміду (далі називають вихідною сполукою В, 500мг), оцтового ангідриду (5мл), піридину (10мл) і ДМФА (20мл) при перемішуванні нагрівають до температури 55°С протягом 2 годин. Реакційну суміш концентрують при зниженому тиску, розбавляють етилацетатом і послідовно промивають насиченим водним розчином бікарбонату натрію й водою. Розчинник упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =10/1), перекристалізовують із суміші етилацетат/н-гексан і одержують N-({3-[3-(3,5-дифторфеніл)-2-(1,3дигідро-2Н-бензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)ацетамід (58мг). Приклад 6: 60%-й гідрид натрію (21мг) додають до розчину вихідної сполуки В (240мг) і ізопропіл ізоціанату (0,4мл) в і-метил-2-піролідоні (6мл), а потім перемішують при кімнатній температурі протягом 1,5 годин. Отриману суміш розбавляють 1 Μ розчином 90894 38 хлористоводневої кислоти й екстрагують етилацетатом. Органічний шар промивають водою й розчинник упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (н-гексан/етилацетат =1/1), а потім перекристалізовують із суміші етилацетат/н-гексан і одержують 3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3-оксопропаноїл]-N[(ізопропіламіно)карбоніл]бензолсульфонамід (14мг). Приклад 7: Суміш вихідної сполуки В (787мг), ціанату калію (994мг), оцтової кислоти (10мл), води (25мл) і N-метилпіролідинону (30мл) при перемішуванні нагрівають до 100°С протягом 31 години. Після охолодження до кімнатної температури додають воду. Нерозчинні речовини відокремлюють фільтруванням, очищають колонковою хроматографією на силікагелі (хлороформ/метанол =10/1), а потім промивають діетиловим ефіром і одержують N(амінокарбоніл)-3-[3-(3,5-дифторфеніл)-2-(1,3дигідро-2Н-бензімідазол-2-іліден)-3-оксопропаноїл] бензолсульфонамід (15мг). Приклад 8: 1Μ водний розчин гідроксиду натрію (3,1мл) додають до розчину сполуки, отриманої в прикладі 2 (300мг), у ТГФ (10мл), а потім перемішують при кімнатній температурі протягом 3,5 годин. ТГФ упарюють при зниженому тиску, а потім додають надлишок 1Μ розчину хлористоводневої кислоти. Осад виділяють фільтруванням, сушать при зниженому тиску й одержують [({3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3оксопропаноїл]феніл}сульфоніл)аміно]оцтову кислоту (250мг). Приклад 9: Гідрохлорид диметиламіну (31мг), триетиламін (0,05мл), HOBt (51мг) і WSC-HCl (73мг) додають до розчину [({3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро2Н-бензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)аміно]оцтової кислоти (40мг) в ДМФА (5мл) і перемішують при кімнатній температурі протягом 1,5 годин. До реакційної суміші додають воду, а потім екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, сушать над безводним сульфатом магнію і концентрують при зниженому тиску. Залишок перекристалізовують із суміші етилацетат/н-гексан і отримують 2-[({3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксопропаноїл]феніл}сульфоніл)аміно]-2іміно-N,N-диметилацетамід (28мг). Приклад 10: При 0°С бензил піперазин-1-карбоксилат (1,37г) додають до розчину N-({3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксопропаноїл]феніл}сульфоніл)-3,5диметил-1Н-піразол-1-карбоксімідаміду (205мг) в ацетонітрилі (5мл) і нагрівають зі зворотним холодильником протягом 3 днів. Після охолодження додають етилацетат, промивають спочатку насиченим водним розчином хлориду амонію, потім водою й насиченим сольовим розчином і сушать над безводним сульфатом магнію. Розчинник упа 39 рюють при зниженому тиску й залишок очищають колонковою хроматографією на силікагелі (нгексан/етилацетат =1/4) і одержують бензил 4-[[({3[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)аміно](іміно)метил]піперазин1-карбоксилат (76мг). Приклад 11: 10%-й Pd-C (210мг) додають до розчину в етанолі (20мл) сполуки (205мг), отриманої в прикладі 10, а потім перемішують при кімнатній температурі протягом 19 годин в атмосфері водню (1атм.). Речовини, що не розчинилися, відокремлюють фільтруванням, а фільтрат концентрують при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =50/1) і перекристалізовують із суміші етилацетат/н-гексан, одержуючи N-({3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3оксопропаноїл]феніл}сульфоніл)піперазин-1карбоксімідамід (46мг). Приклад 12: Реагент Деса-Мартіна (15% мас. розчин у дихлорметані, 0,73мл) додають до розчину N-({3-[3(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол2-іліден)-3-оксопропаноїл]феніл}сульфоніл)-2гідроксипропанімідаміду (90мг) у дихлорметані (2мл), а потім перемішують при кімнатній температурі протягом 4 годин. До реакційної суміші додають етилацетат, промивають водою, сушать над безводним сульфатом магнію й органічний шар концентрують при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (н-гексан/етилацетат =2/1), перекристалізовують із суміші етилацетат/н-гексан і одержують N-({3-[3(3,5-дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол2-іліден)-3-оксопропаноїл]феніл}сульфоніл)-2оксопропанімідамід (57мг). Приклад 13: 2Μ розчин диметиламіну в ТГФ (0,85мл) додають до розчину 2-хлор-N-{3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3оксопропаноїл]феніл}сульфоніл)етанімідаміду (181мг) у ДМФА (5мл), а потім перемішують при кімнатній температурі протягом 1 години. До реакційної суміші додають воду, а потім екстрагують етилацетатом. Органічний шар промивають насиченим сольовим розчином, концентрують при зниженому тиску й залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =50/1), перекристалізовують із суміші етилацетат/н-гексан і одержують Ν-({3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксопропаноїл]феніл}сульфоніл)-2(диметиламіно)етанімідамід (76мг). Приклад 14: 3-[(Диметиламіно)сульфоніл]бензоїлхлорид (1,97г) додають до суміші 1-(3,5-дифторфеніл)-2(1,3-дигідро-2Н-бензімідазол-2-іліден)етанону (865мг), триетиламіну (1,6мл) і 2-метоксіетилового ефіру (10мл), а потім при перемішуванні нагрівають до температури 110°С протягом 30хв. Дода 90894 40 ють воду (0,06мл), а потім нагрівають зі зворотним холодильником ще протягом 30хв. Після охолодження додають воду й екстрагують етилацетатом. Органічний шар промивають водою, концентрують при зниженому тиску, залишок очищають колонковою хроматографією на силікагелі (нгексан/етил ацетат =1/1), перекристалізовують із суміші етилацетат/н-гексан і одержують 3-[3-(3,5дифторфеніл)-2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксопропаноїл]-N,Nдиметилбензолсульфонамід (391мг). Приклад 15: Вихідну сполуку В (500мг) додають до суспензії 60%-го гідриду натрію в ДМФА (20мл), а потім перемішують при кімнатній температурі. Додають диметилацеталь Ν,Ν-диметилацетаміду (0,48мл) і продовжують перемішувати при кімнатній температурі ще протягом 15 годин. До реакційної суміші додають насичений водний розчин хлориду амонію, осад, що утворився, виділяють фільтруванням і одержують (1Е)-N'-({3-[3-(3,5-дифторфеніл)-2(1,3-дигідро-2Н-бензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)-N,Nдиметилетанімідамід (267мг). Приклад 16: Оцтовий ангідрид (90мг) додають до розчину N-({3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)-2гідроксіетанімідаміду (225мг) у піридині (5мл), а потім перемішують при кімнатній температурі протягом 2 годин. Додають надлишок насиченого водного розчину хлориду амонію, а потім екстрагують етилацетатом. Органічний шар промивають водою, концентрують при зниженому тиску, залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =80/1), кристалізують із суміші етилацетат/н-гексан і одержують 2[({3-[3-(3,5-дифторфеніл)-2-(1,3-дигідро-2Нбензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)аміно]-2іміноетилоцтову кислоту (150мг). Приклад 17: 10%-й Pd-C (85мг) додають до суспензії N-({3[3-(3,5-дифторфеніл)-2-(5-нітро-1,3-Дигідро-2Нбензімідазол-2-іліден)-3оксопропаноїл]феніл}сульфоніл)етанімідаміду (845мг) в етилацетаті (150мл), а потім перемішують при кімнатній температурі протягом 22 годин в атмосфері водню (1атм.). Речовини, що розчинилися, видаляють фільтруванням, промивають етанолом, а фільтрат концентрують при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =30/1) і перекристалізовують із суміші етилацетат/нгексан, одержуючи N-({3-[2-(5-аміно-1,3-дигідро2Н-бензімідазол-2-іліден)-3-(3,5-дифторфеніл)-3оксопропаноїл]феніл} сульфоніл)етанімідамід (667мг). Приклад 18: При температурі -20(3 77%-ю мхлорнадбензойну кислоту (132мг) додають до суспензії N-[3-{2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-[3-(метилсульфаніл)феніл]-3оксопропаноїл}феніл)сульфоніл]етанімідаміду 41 (100мг) у дихлорметані (10мл), а потім перемішують протягом 3 годин. Додають надлишок насиченого водного розчину хлориду амонію, а потім екстрагують етилацетатом. Органічний шар промивають водою, концентрують при зниженому тиску, залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =60/1) і кристалізують із суміші етилацетат/н-гексан і одержують N-[3-{2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-[3-(метансульфоніл)феніл]-3оксопропаноїл}феніл)сульфоніл]етанімідамід (64мг). Приклад 19: Форміат амонію (260мг) і 10%-й Pd-C (250мг) додають до розчину N-({3-[3-(2-хлорпіридин-4-іл)2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3оксопропаноїл]феніл})етанімідаміду (500мг) у ДМФА (25мл), потім перемішують при кімнатній температурі протягом 3 годин. Речовини, що не розчинилися, видаляють фільтруванням, фільтрат концентрують при зниженому тиску й залишок промивають етилацетатом, одержуючи N-({3-[2(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-оксо-3піридин-4ілпропаноїл]феніл}сульфоніл)етанімідамід (372мг). Приклад 532: 1,2-фенілендіамін (81мг) додають до розчину N-[(3-{2-[(2,4-диметил-1,3-тіазол-5-іл)карбоніл]-3,3біс(метилтіо)акрилоїл}феніл)сульфоніл]-2гідрокси-2-метилпропанімідаміду (370мг) в ЕtOН (20мл), а потім кип'ятять зі зворотним холодильником протягом 13 годин. Після охолодження реакційну суміш концентрують при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =50/1), перекристалізовують із суміші етилацетат/н-гексан і одержують N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(2,4-диметил-1,3-тіазол-5-іл)-3оксопропаноїл]феніл}сульфоніл)-2-гідрокси-2метилпропанімідамід (310мг). Приклад 533: При охолодженні льодом 4N розчин хлористого водню в етилацетаті (0,09мл) додають до розчину N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-(2-диметоксипіридин-4-іл)-3оксопропаноїл]феніл}сульфоніл)-2-гідрокси-2метилпропанімідаміду (127мг) у суміші EtOH/діоксан (2/1) (4мл), а потім перемішують протягом 1 години. Реакційну суміш концентрують при зниженому тиску. До отриманого залишку додають водний розчин бікарбонату натрію, а потім екстра 90894 42 гують етилацетатом і концентрують при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =10/1) і одержують N-({3-[2-(1,3-дигідро-2Н-бензімідазол-2іліден)-3-оксо-(2-оксо-1,2-дигідропіридин-4іл)пропаноїл]феніл}сульфоніл)-2-гідрокси-2метилпропанімідаміду (18мг). Приклад 696: При кімнатній температурі гідрид натрію (579мг) додають до суспензії гідрохлориду (2R)-2гідроксипропанімідаміду (1,65г) у ТГФ (70мл), а потім нагрівають до температури 60°С і перемішують протягом 30хв. Реакційну суміш охолоджують до кімнатної температури й додають розчин 5[2-(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3фторфеніл)-3-оксопропаноїл]-2фторбензолсульфонілхлориду (2,10г) у ТГФ (35мл), а потім перемішують протягом 20хв. Додають воду й етилацетат і шари рідини розділяють, органічний шар промивають насиченим сольовим розчином і розчинник упарюють при зниженому тиску. Залишок очищають колонковою хроматографією на силікагелі (хлороформ/метанол =50/1) і одержують (2R)-N-({5-[2(1,3-дигідро-2Н-бензімідазол-2-іліден)-3-(3фторфеніл)-3-оксопропаноїл]-2фторфеніл}сульфоніл)-2-гідроксипропанімідамід (1,95г). За аналогією із прикладами 1-9, 532, 533 і 696 синтезують сполуки по інших прикладах, наведені нижче в таблицях 19-57, використовуючи відповідні вихідні сполуки. Структура, спосіб одержання й фізико-хімічні дані сполук по зазначених прикладах наведені в таблицях. У таблицях 58-70 наведені структури інших сполук згідно з даним винаходом. Вони легко можуть бути синтезовані відповідно до вищевказаних способів, способами, наведеними в прикладах, і способами, очевидними для фахівців, або з використанням модифікацій зазначених способів. У таблицях 58-70 використані наступні абревіатури для групи R3: С2: -NH(CH2)2OH, С3: -NH(CH2)3OH, GN: N=C(NH2)2, Формула 15 43 90894 44 45 90894 46 47 90894 48 49 90894 50 51 90894 52 53 90894 54 55 90894 56 57 90894 58 59 90894 60
ДивитисяДодаткова інформація
Назва патенту англійськоюPropane-1,3-dion derivative or salt thereof
Автори англійськоюHirano Masaaki, Kinoyama Isao, Matsumoto Shunichiro, Kawaminami Eiji, Ohnuki Kei, Yamamoto Hirofumi, Osoda Kazuhiko, Takahashi Tatsuhisa, Shin Takashi, Koike Takanori, Shimada Itsuro, Hisamichi Hiroyuki, Kusayama Toshiyuki
Назва патенту російськоюПроизводное соединение пропан-1,3-диона или его соль
Автори російськоюХирано Масааки, Кинояма Исао, Мацумото Сунитиро, Каваминами Эйдзи, Охнуки Кей, Ямамото Хирофуми, Осода Кадзухико, Такахаси Тацухиса, Син Такаси, Койке Таканори, Симада Ицуро, Хисамити Хироюки, Кусаяма Тосиюки
МПК / Мітки
МПК: A61P 5/24, A61K 31/427, A61K 31/501, A61K 31/4184, A61K 31/422, A61P 35/00, A61K 31/433, A61K 31/497, C07D 235/12, A61K 31/4192, A61K 31/4439, A61K 31/506, A61K 31/454, A61P 13/08, A61K 31/5377, A61K 31/5415, A61K 31/4196, A61K 31/496, A61P 15/00
Мітки: сполука, похідна, сіль, пропан-1,3-діону
Код посилання
<a href="https://ua.patents.su/73-90894-pokhidna-spoluka-propan-13-dionu-abo-sil.html" target="_blank" rel="follow" title="База патентів України">Похідна сполука пропан-1,3-діону або її сіль</a>
Попередній патент: Пероральна дозована форма похідних гемцитабіну
Наступний патент: Пристрій для ін’єкцій (кутовий пусковий механізм)
Випадковий патент: Системи і способи для обробки зливків із сплавів












