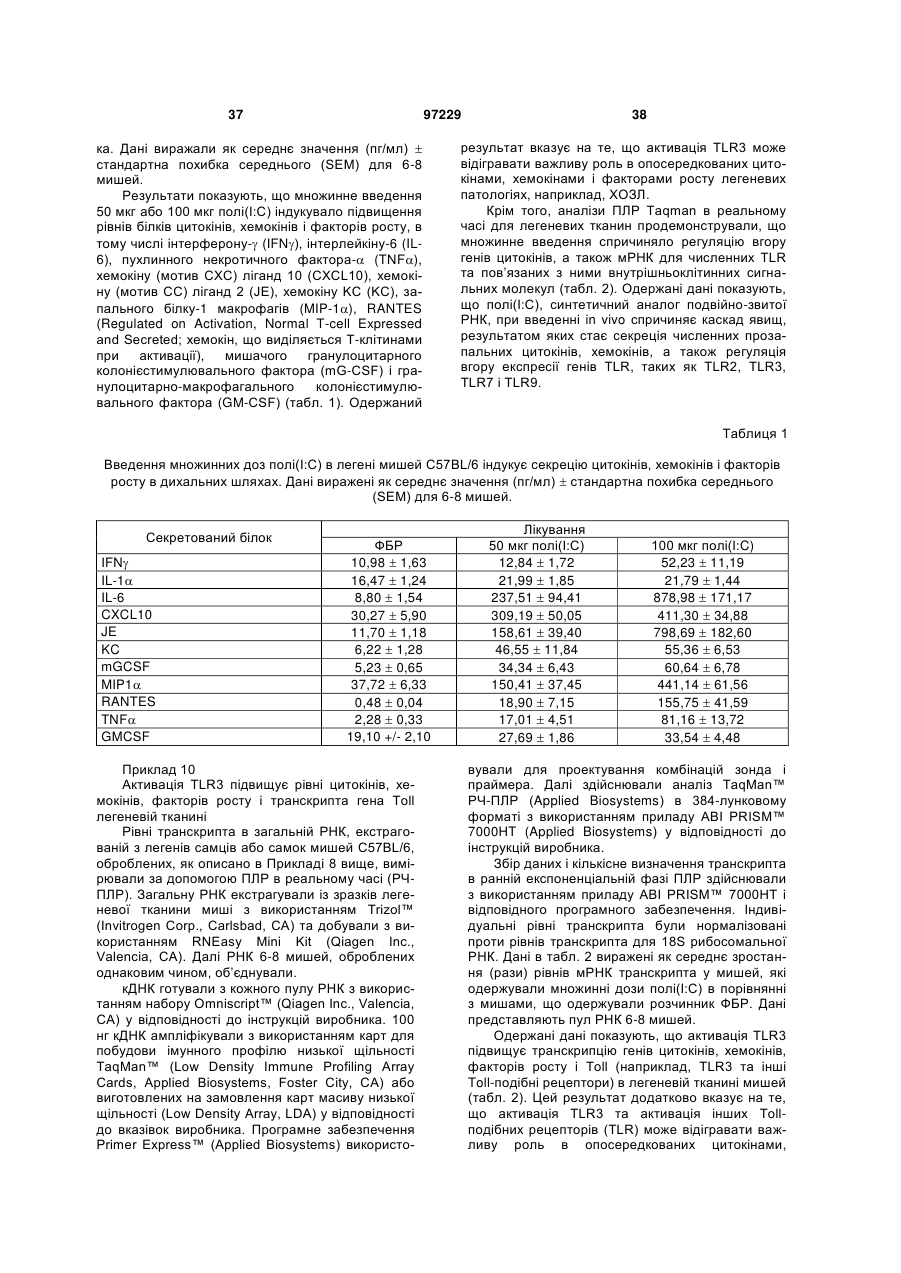
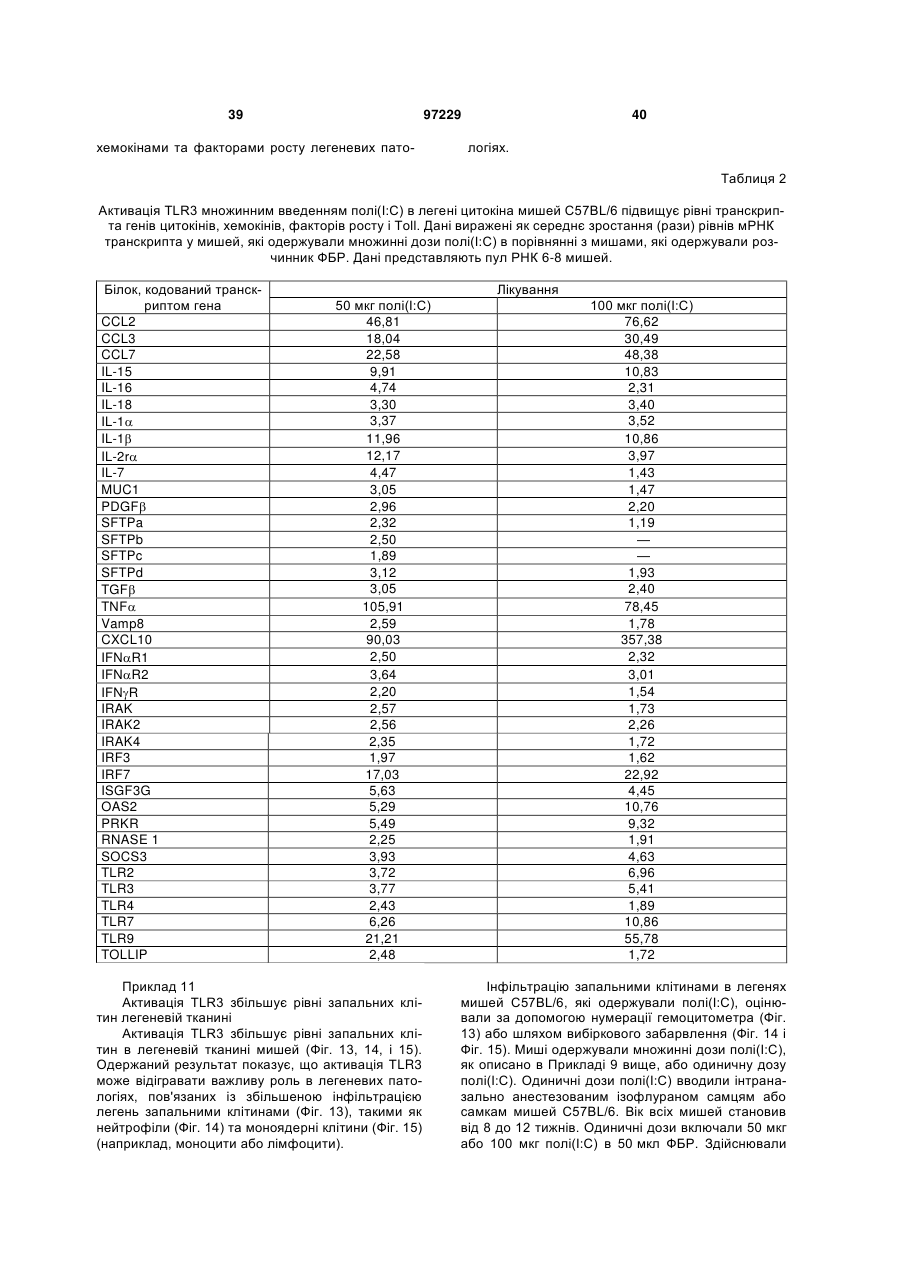
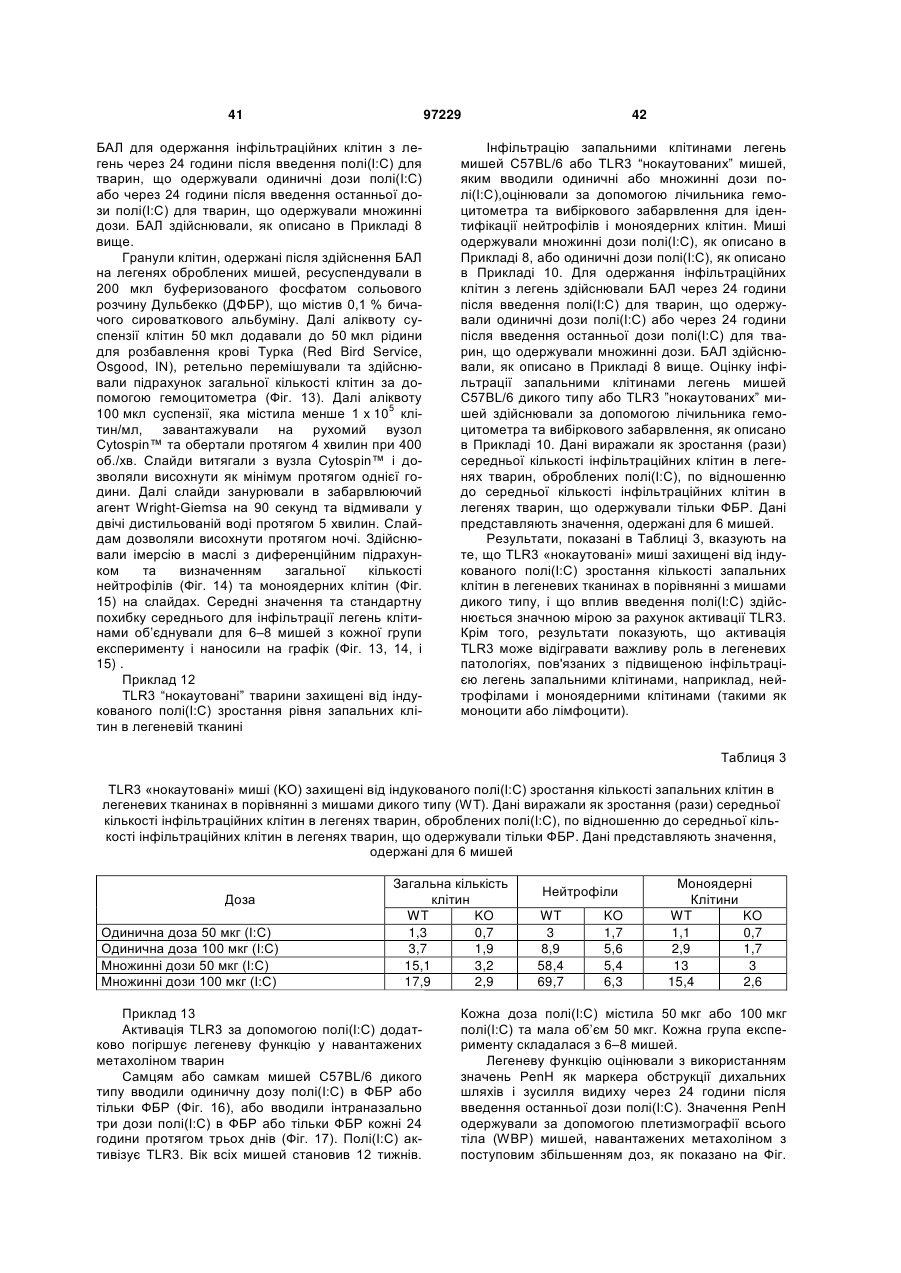
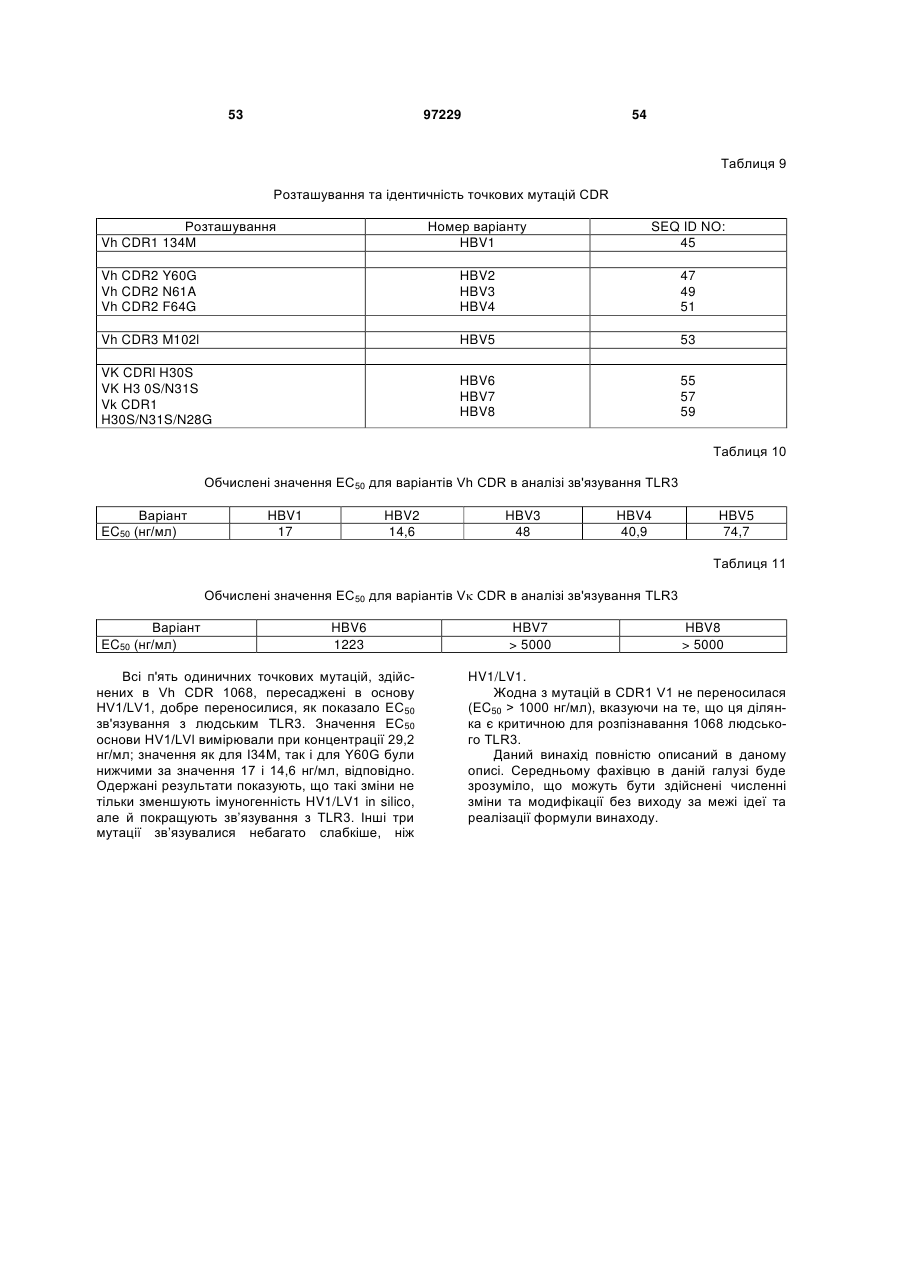
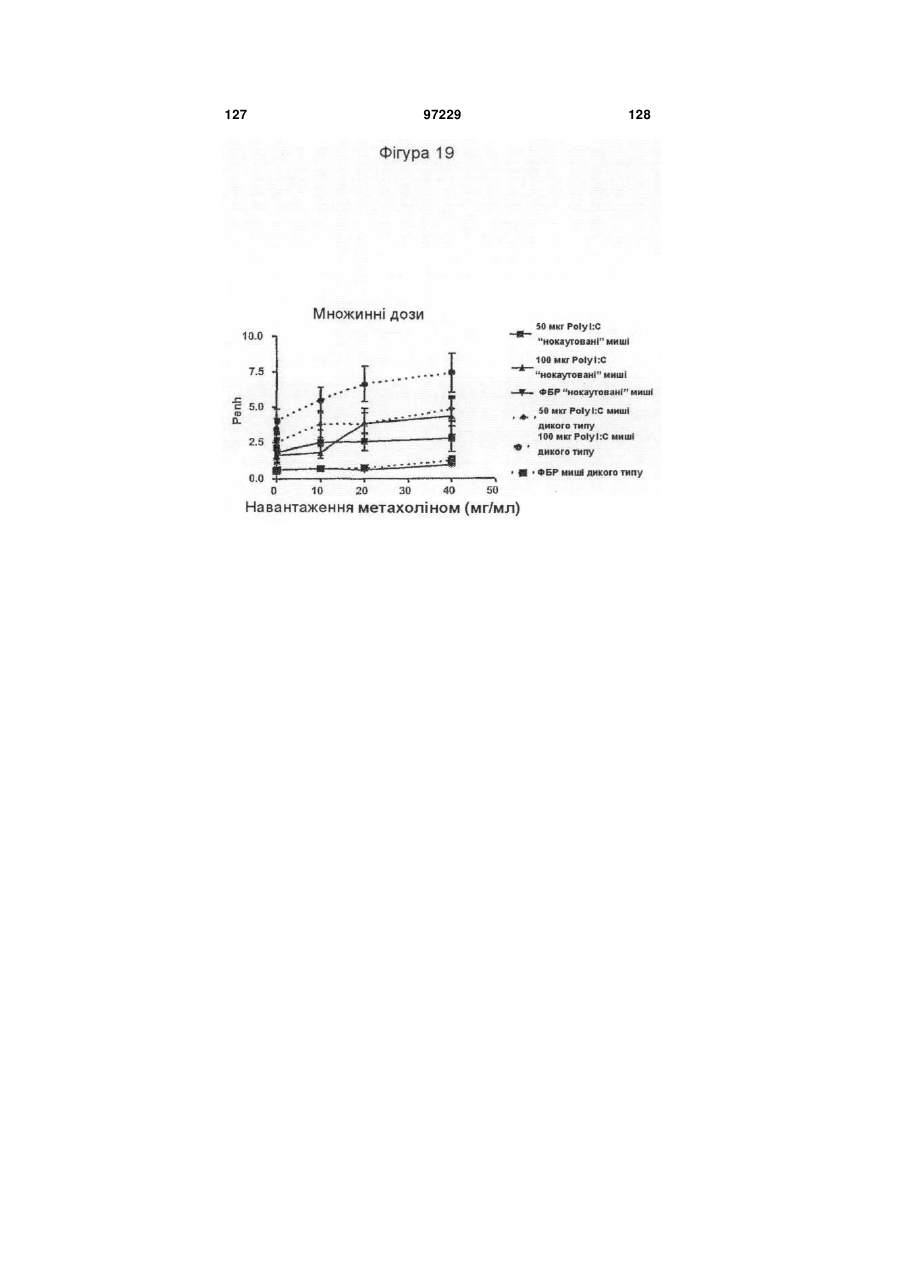
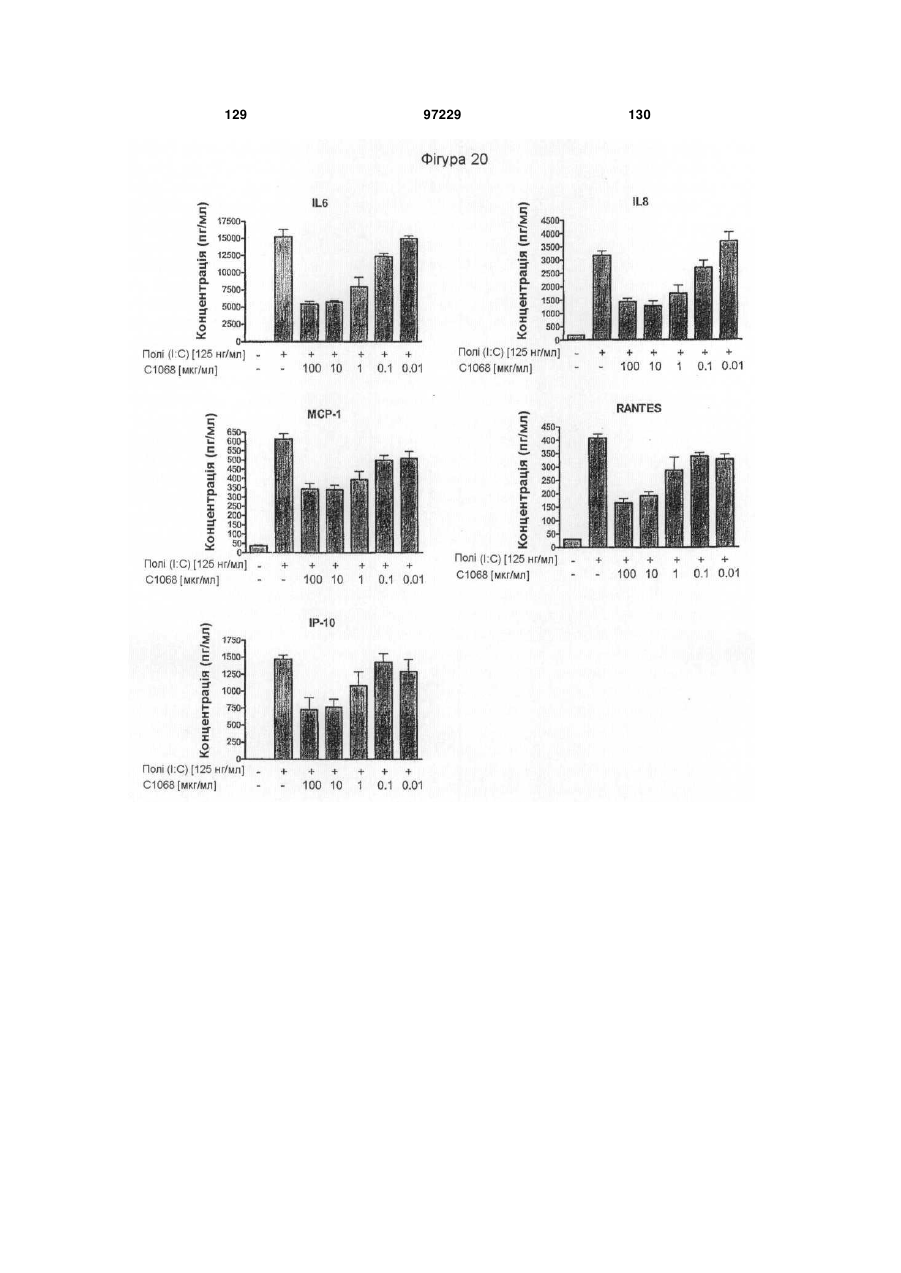
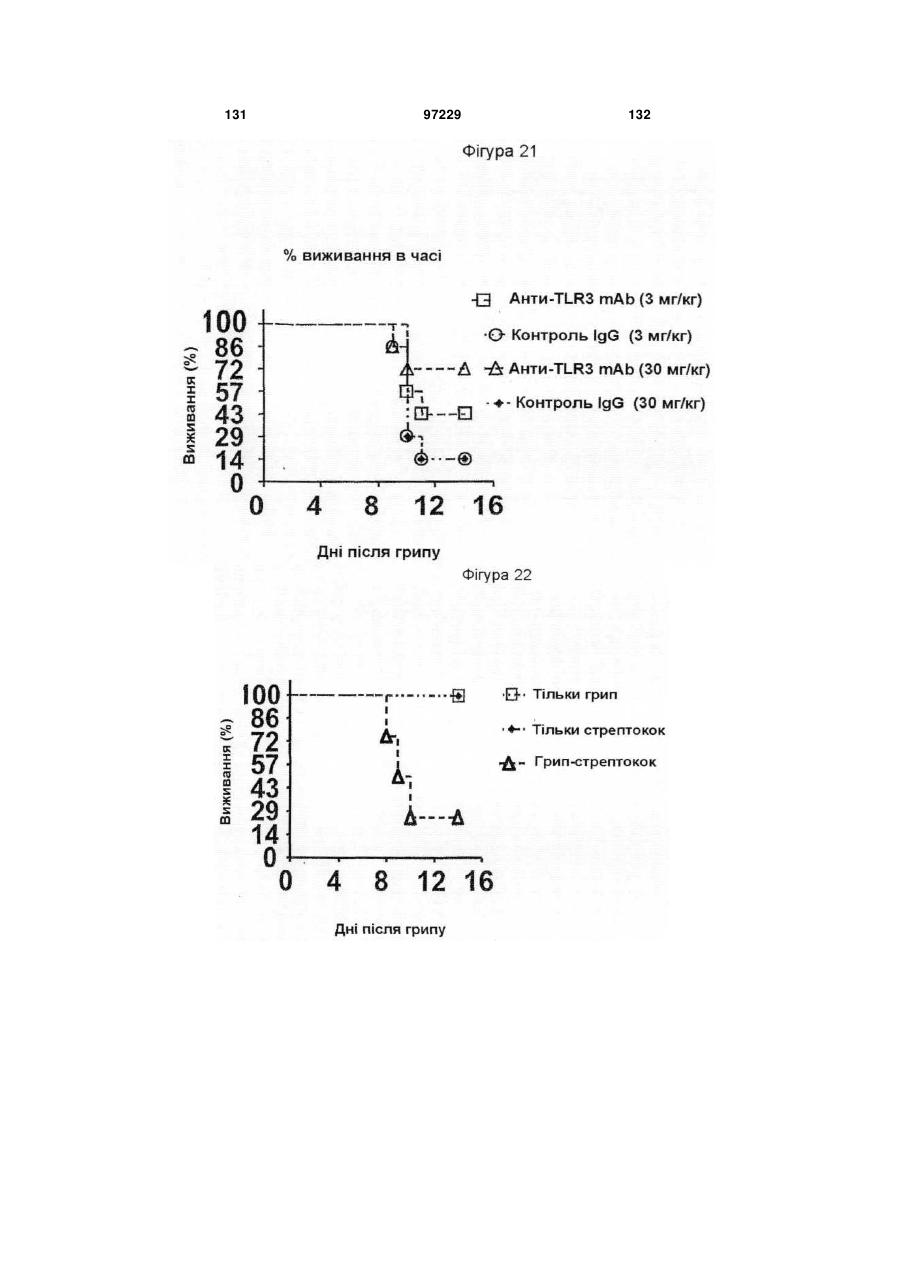
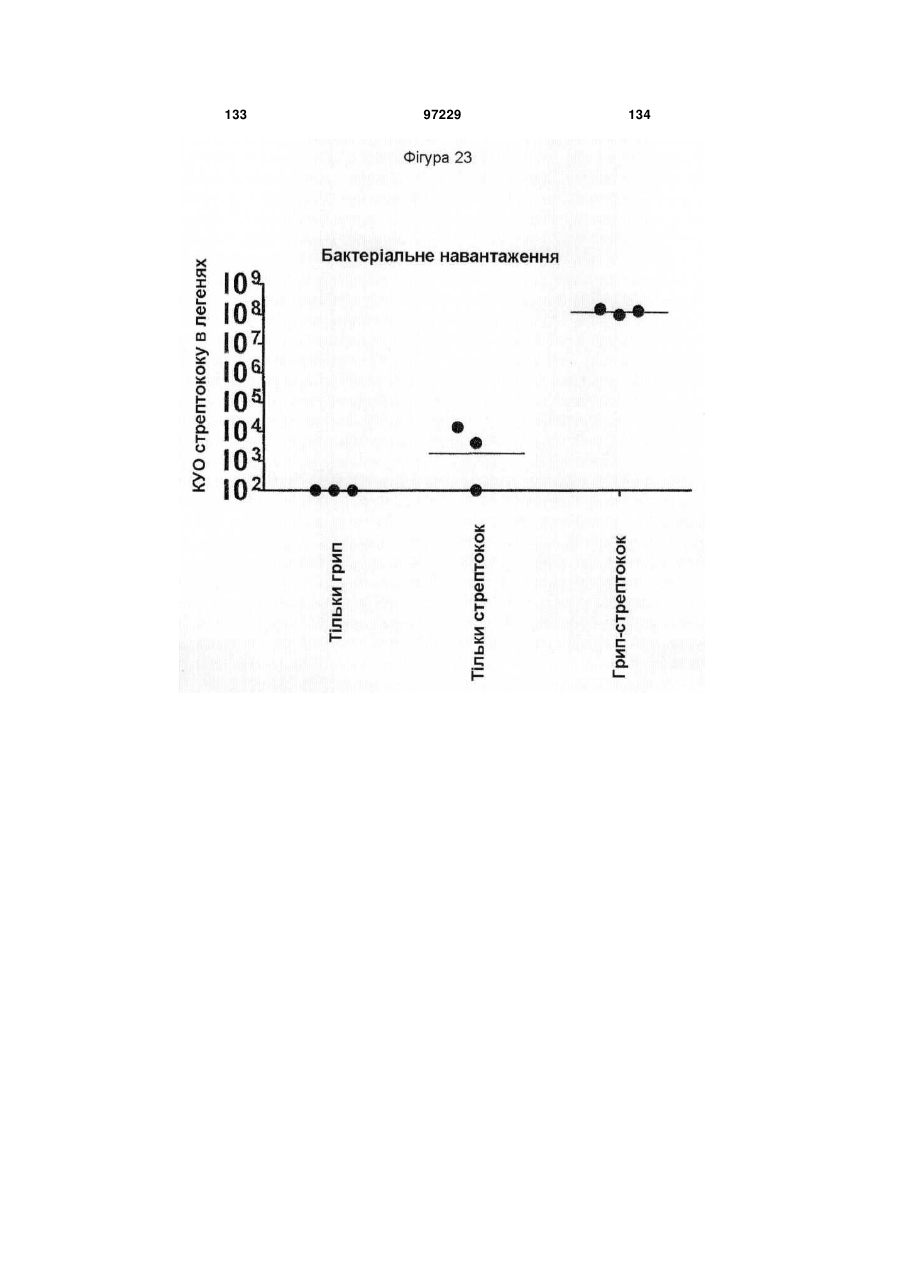
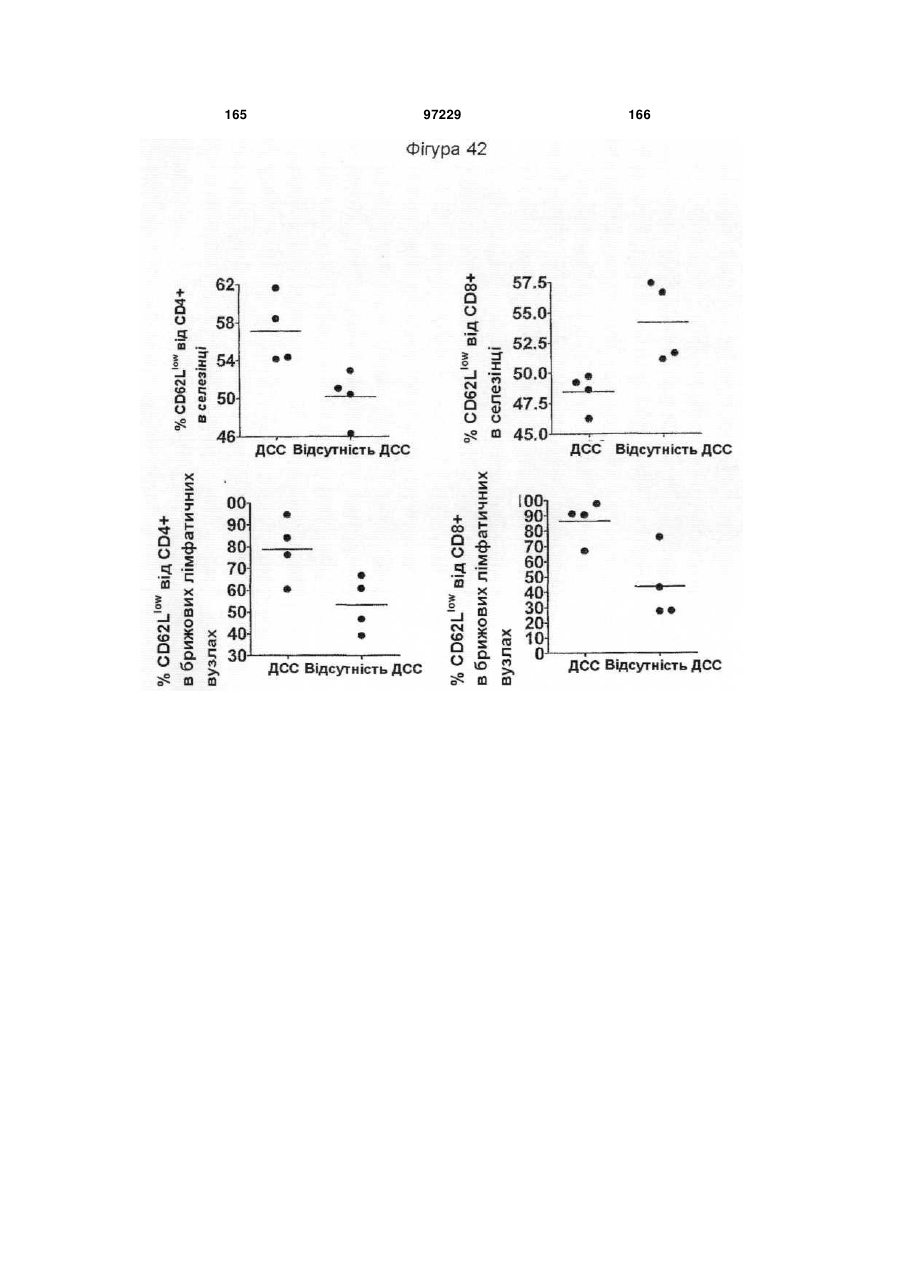
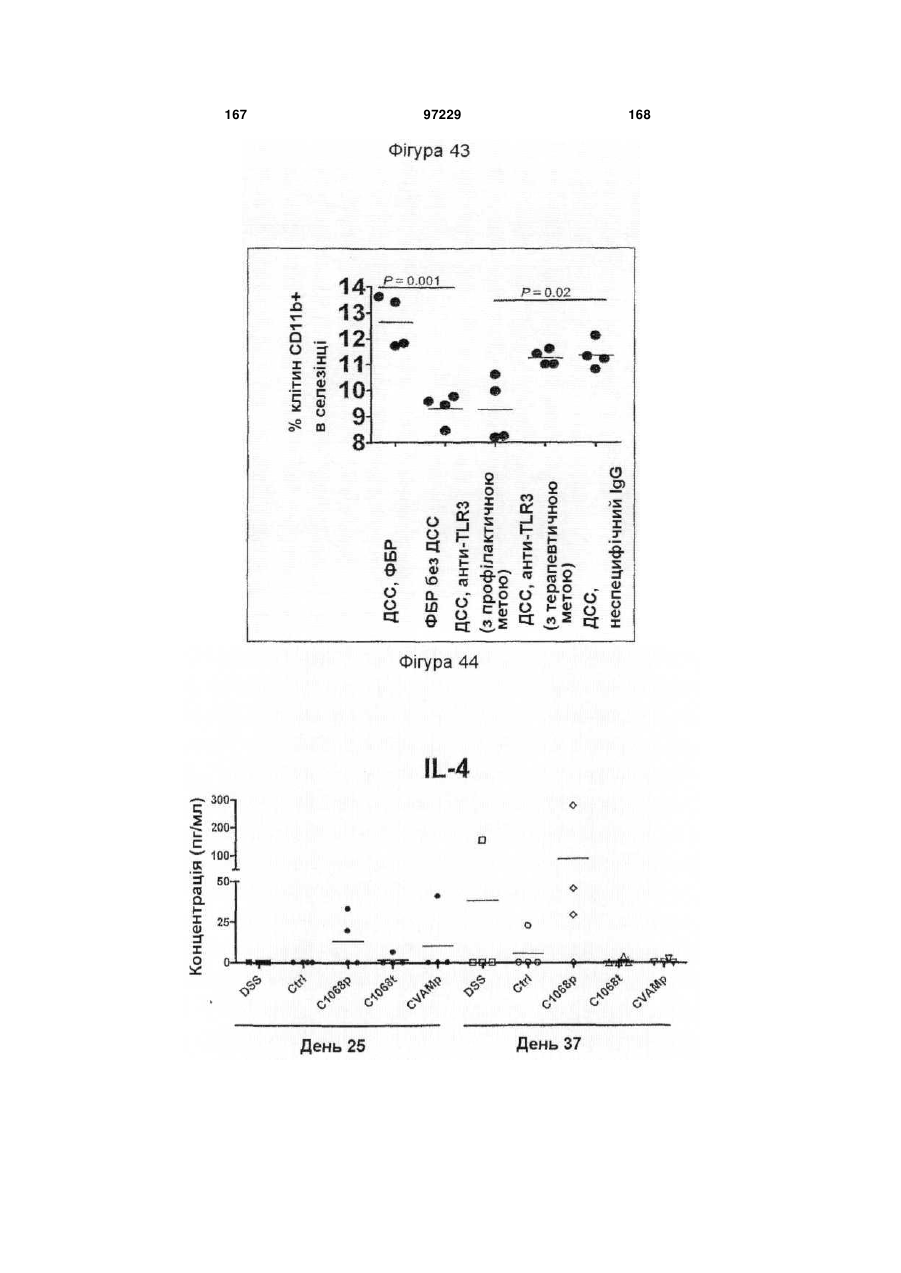
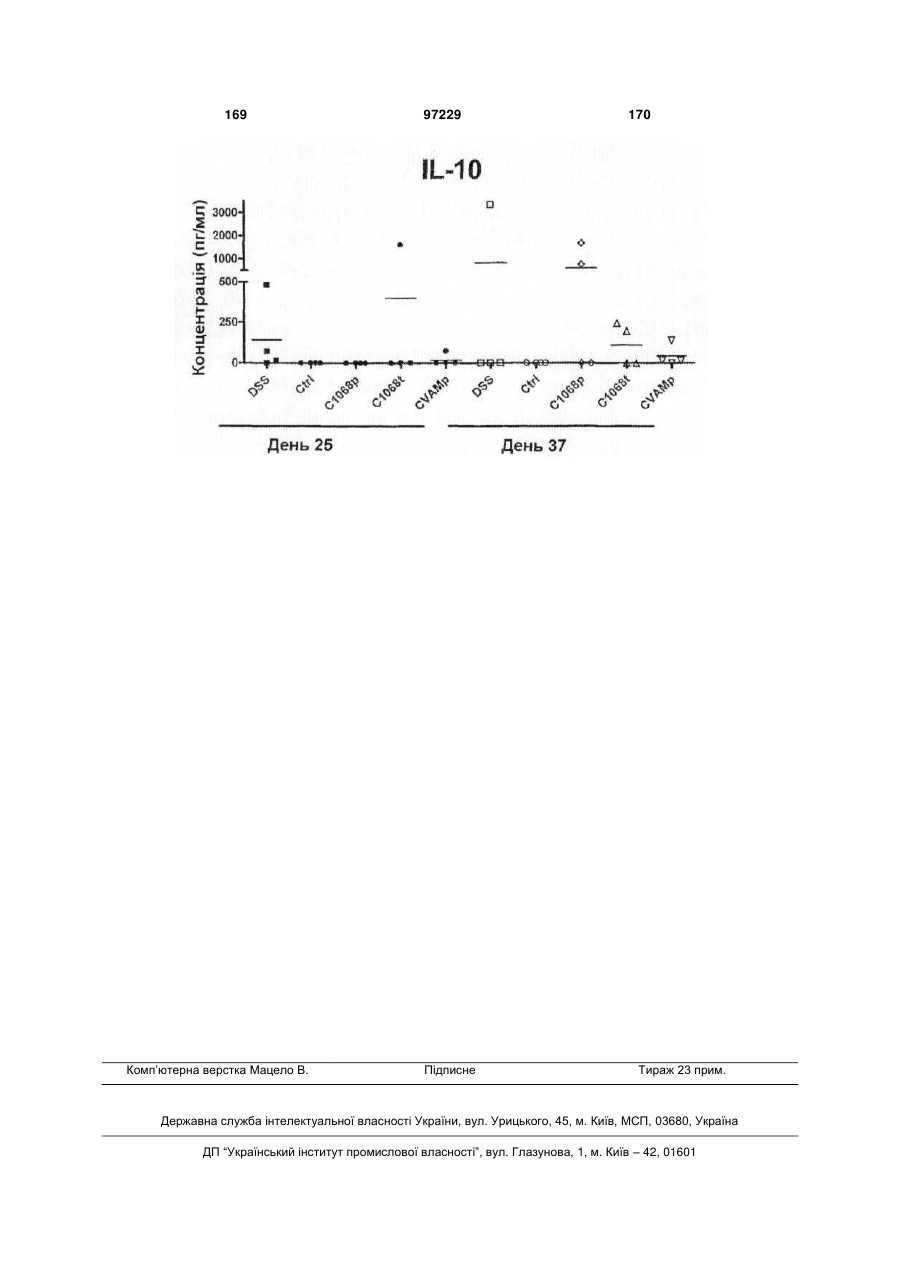
Ізольоване моноклональне антитіло, яке специфічно зв’язується з тoll-подібним рецептором 3 (tlr3)
Номер патенту: 97229
Опубліковано: 25.01.2012
Автори: Свііт Реймонд, Стояновіч-Сусулік Ведрана, Каннінгхем Марк, Гілес-Комар Джілл, Найт Девід М., Даффі Карен, Чен Шізгонг, Дас Анук, Рагхунатан Гопалан, Картон Джілл, Сан Матео Лені, Стовелл Ніколь, Ламб Роберта, Голетз Тереса Дж., Саріскі Роберт Т., Піча Крістен, Зхао Шанронг
Формула / Реферат
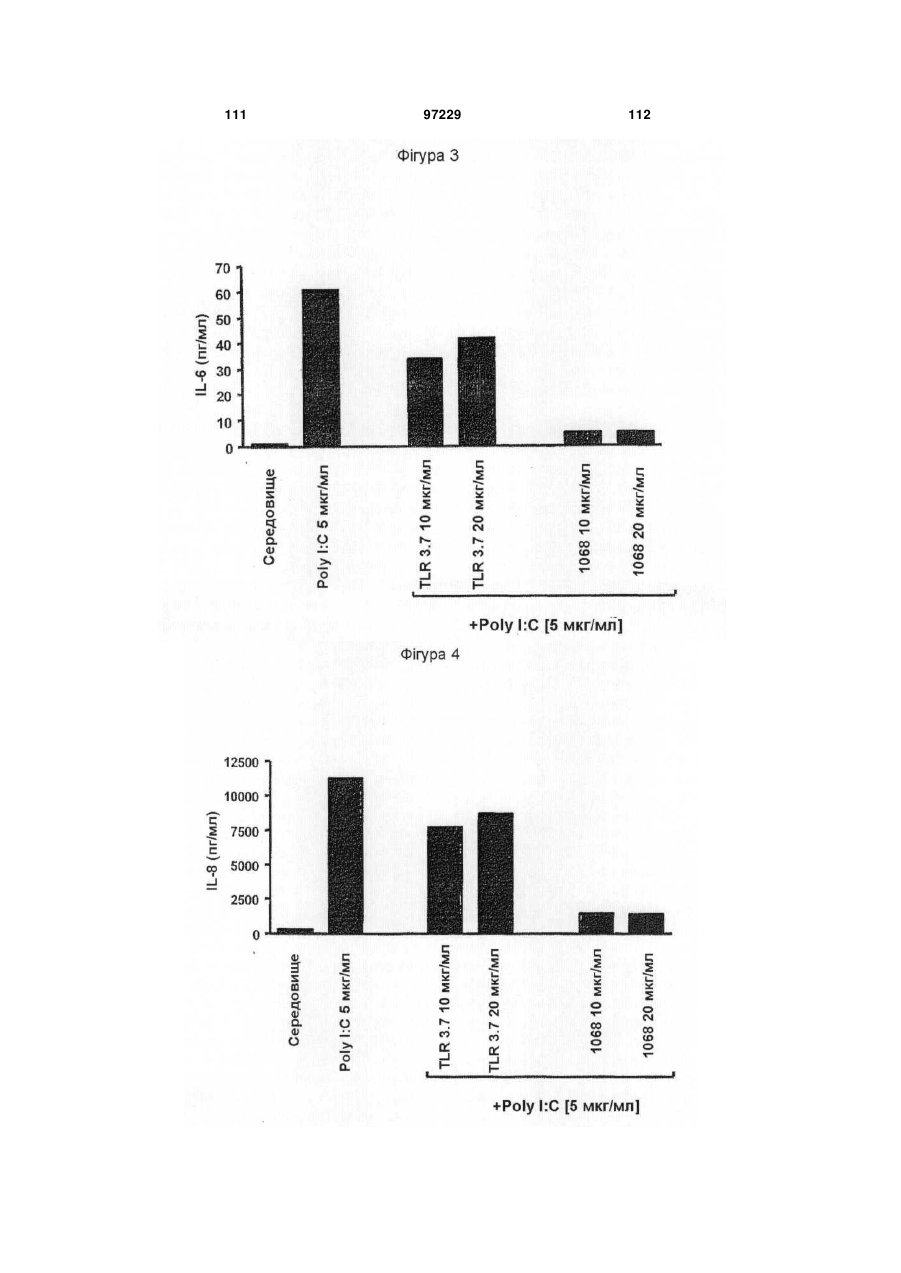
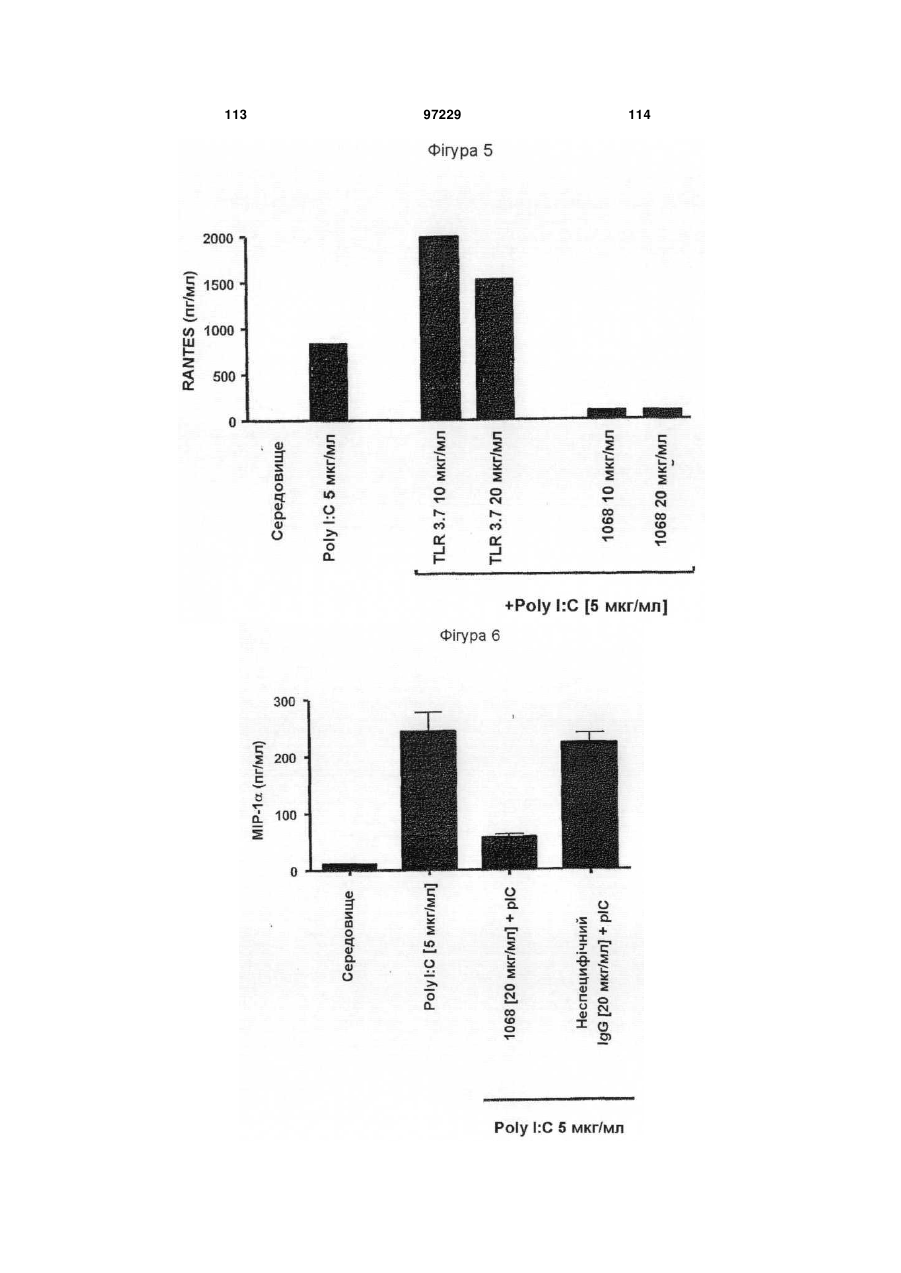
1. Ізольоване моноклональне антитіло, яке специфічно зв'язується з Toll-подібним рецептором 3 (TLR3) та інгібує клітинне продукування цитокіну RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted; хемокін, що виділяється Т-клітинами при активації), що містить амінокислотні послідовності ділянок, які визначають комплементарність важкого ланцюга (CDR), показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23.
2. Ізольоване антитіло за п. 1, яке відрізняється тим, що додатково інгібує клітинне продукування цитокіну, вибраного з групи, що складається з інтерлейкіну-6 (IL-6), інтерлейкіну-8 (IL-8) і запального білка макрофагів альфа (MІP1-альфа).
3. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить варіабельну ділянку важкого ланцюга (VH), що має амінокислотну послідовність, показану в SEQ ID NO: 6, та варіабельну ділянку легкого ланцюга (VL), що має амінокислотну послідовність, показану в SEQ ID NO: 16.
4. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить VH, що має амінокислотну послідовність, показану в SEQ ID NO: 25, 27, 29 або 31, та VL, що має амінокислотну послідовність, показану в SEQ ID NO: 33, 35, 37 або 39.
5. Ізольоване антитіло за п. 4, яке відрізняється тим, що VH має амінокислотну послідовність, показану в SEQ ID NO: 25, та VL має амінокислотну послідовність, показану в SEQ ID NO: 33.
6. Ізольоване антитіло за п. 1, яке відрізняється тим, що має людське походження.
7. Ізольоване антитіло за п. 1, яке відрізняється тим, що має мишаче походження.
8. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить фрагмент Fab.
9. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить фрагмент scFv.
10. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент є гуманізованим.
11. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент включає химерне антитіло.
12. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло кон'юговане з поліетиленгліколем.
13. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент містить мишачі антигенозв'язуючі залишки і залишки людського антитіла.
14. Ізольоване антитіло за п. 1, яке відрізняється тим, що має IgG4 ізотип.
15. Ізольоване антитіло за п. 14, яке відрізняється тим, що домен Fc включає мутації S228P, P234A і L235A.
16. Фармацевтична композиція, яка відрізняється тим, що містить ізольоване антитіло за п. 1 і фармацевтично прийнятний носій.
17. Ізольований полінуклеотид, який відрізняється тим, що кодує важкий ланцюг антитіла, який містить амінокислотні послідовності CDR, показані в SEQ ID NO: 9, 11 і 13, та легкий ланцюг антитіла, який містить амінокислотні послідовності CDR, показані в SEQ ID NO: 19, 21 і 23, де антитіло специфічно зв'язується з Toll-подібним рецептором 3 (TLR3).
18. Ізольований полінуклеотид, який відрізняється тим, що кодує важкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 6, 25, 27, 29, 31, та легкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 16, 33, 35, 37 або 39, де антитіло специфічно зв'язується з Toll-подібним рецептором 3 (TLR3).
19. Ізольований полінуклеотид за п. 18, який відрізняється тим, що містить послідовність, показану в SEQ ID NO: 5, 15, 26, 28, 30, 32, 34, 36, 38 або 40.
20. Вектор, який відрізняється тим, що містить ізольований полінуклеотид за пп. 17, 18 або 19.
21. Клітина-хазяїн, яка відрізняється тим, що містить вектор за п. 20.
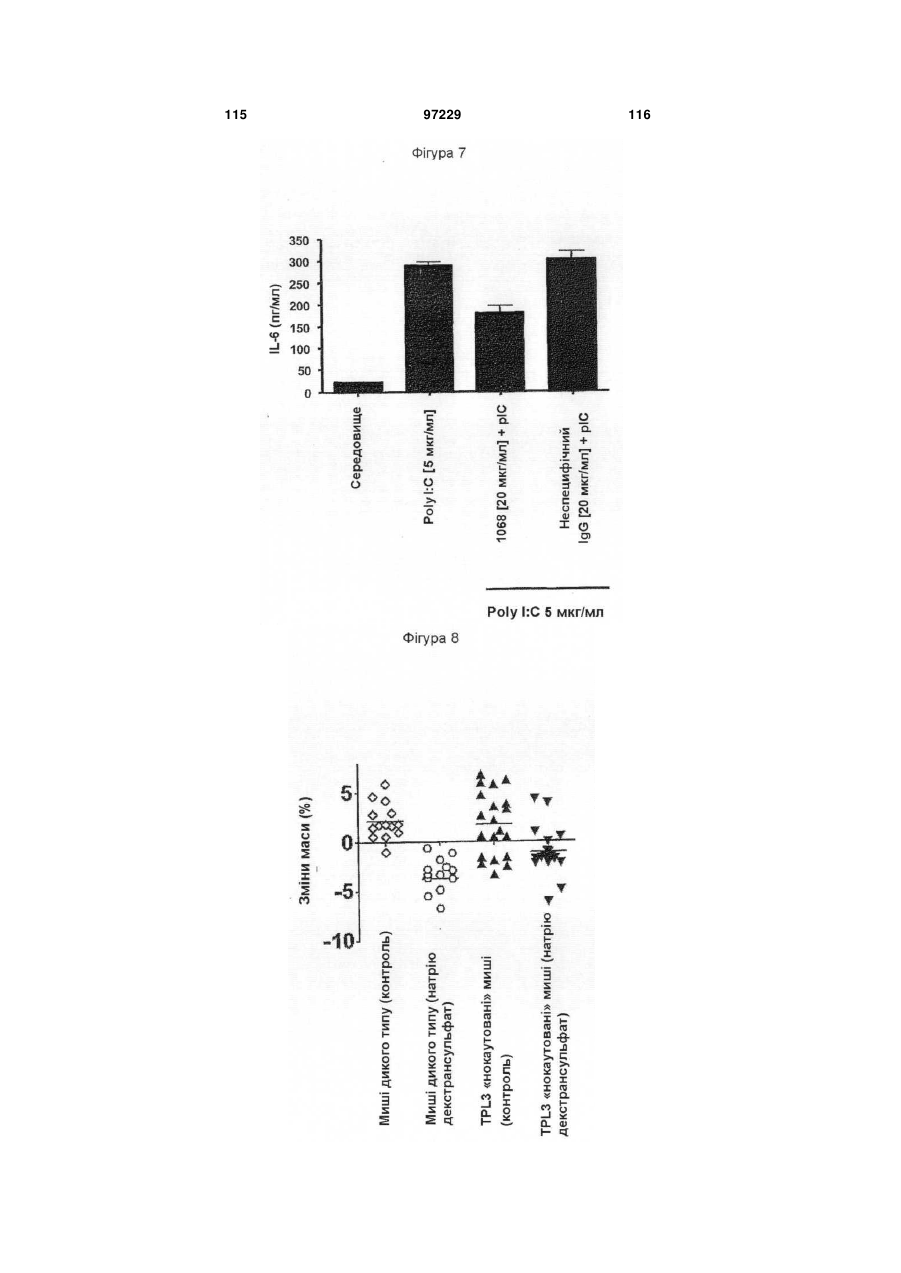
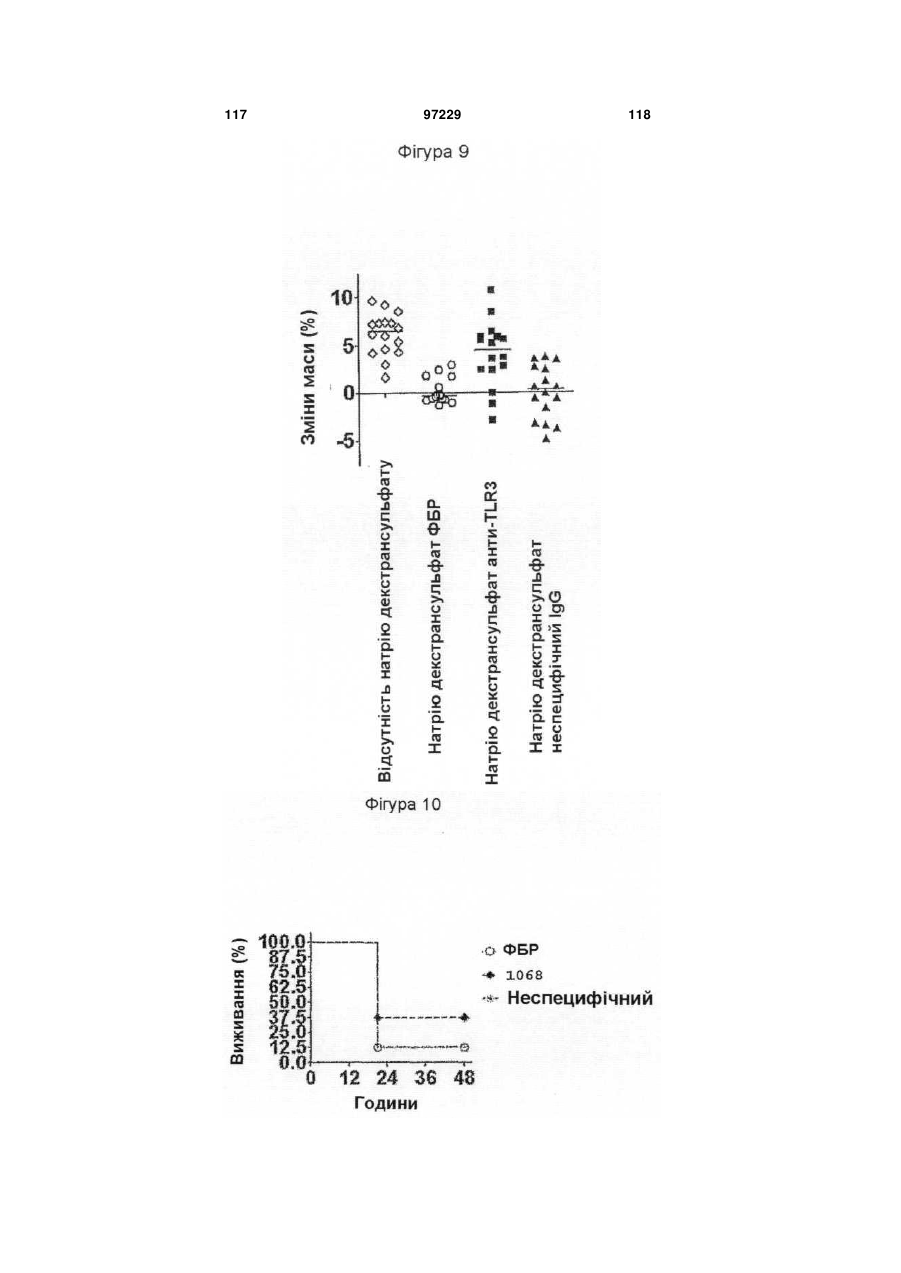
22. Спосіб одержання антитіла, що реагує з TLR3, який відрізняється тим, що включає культивування клітини-хазяїна за п. 21 і добування антитіла, продукованого клітиною-хазяїном.
23. Лінія клітин гібридоми, яка відрізняється тим, що продукує антитіло за п. 1.
24. Спосіб інгібування клітинного продукування RANTES, який відрізняється тим, що включає забезпечення контакту ізольованого антитіла за п. 1 з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для інгібування продукування RANTES.
25. Спосіб за п. 24, який відрізняється тим, що додатково інгібується клітинне продукування IL-6, IL-8 або MІP1-альфа.
26. Спосіб лікування або профілактики запального стану, який відрізняється тим, що включає введення терапевтично ефективної кількості ізольованого антитіла за п. 1 пацієнту, який потребує цього, протягом часу, достатнього для лікування або профілактики запального стану.
27. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою пов'язаний із сепсисом стан.
28. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою запальне захворювання кишечнику.
29. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою пов'язаний з інфекцією стан.
30. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою запальний легеневий стан.
31. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою діабет 2 типу, дисліпідемію або метаболічний синдром.
32. Спосіб за п. 26, який відрізняється тим, що запальний стан спричинений аутоімунним захворюванням.
33. Спосіб збільшення швидкості проліферації клітини, який відрізняється тим, що включає забезпечення контакту ізольованого антитіла за п. 1 з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для збільшення швидкості проліферації клітини.
34. Спосіб за п. 33, який відрізняється тим, що клітина присутня в тканині тварини.
35. Спосіб за п. 33, який відрізняється тим, що клітина являє собою епітеліальну клітину.
36. Спосіб за п. 35, який відрізняється тим, що тканина являє собою тканину ободової кишки.
37. Спосіб за п. 35, який відрізняється тим, що тканина виявляє патологію, пов'язану із запальним станом.
38. Спосіб за п. 37, який відрізняється тим, що запальний стан являє собою запальне захворювання кишечнику.
39. Спосіб лікування або профілактики стану, що є результатом загибелі клітини, який відрізняється тим, що включає введення терапевтично ефективної кількості ізольованого антитіла за п. 1 пацієнту, який потребує цього, протягом часу, достатнього для лікування стану.
40. Спосіб за пп. 26, 33 або 39, який відрізняється тим, що ізольоване антитіло являє собою ізольоване антитіло, яке реагує з TLR3 та має антигенозв'язуючу здатність моноклонального антитіла, яке містить амінокислотні послідовності CDR важкого ланцюга, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23.
41. Спосіб за п. 40, який відрізняється тим, що ізольоване антитіло, яке реагує з TLR3, містить амінокислотні послідовності CDR важкого ланцюга, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23.
42. Спосіб за п. 41, який відрізняється тим, що ізольоване антитіло містить VH, який має амінокислотну послідовність, показану в SEQ ID NO: 6, 25, 27, 29 або 31, та VL, який має амінокислотну послідовність, показану в SEQ ID NO: 16, 33, 35, 37 або 39.
Текст
1. Ізольоване моноклональне антитіло, яке специфічно зв'язується з Toll-подібним рецептором 3 (TLR3) та інгібує клітинне продукування цитокіну RANTES (Regulated on Activation, Normal Tcell Expressed and Secreted; хемокін, що виділяється Т-клітинами при активації), що містить амінокислотні послідовності ділянок, які визначають комплементарність важкого ланцюга (CDR), показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23. 2. Ізольоване антитіло за п. 1, яке відрізняється тим, що додатково інгібує клітинне продукування цитокіну, вибраного з групи, що складається з інтерлейкіну-6 (IL-6), інтерлейкіну-8 (IL-8) і запального білка макрофагів альфа (MІP1-альфа). 3. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить варіабельну ділянку важкого ланцюга (VH), що має амінокислотну послідовність, показану в SEQ ID NO: 6, та варіабельну ділянку легкого ланцюга (VL), що має амінокислотну послідовність, показану в SEQ ID NO: 16. 4. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить VH, що має амінокислотну послідовність, показану в SEQ ID NO: 25, 27, 29 або 31, та VL, що має амінокислотну послідовність, показану в SEQ ID NO: 33, 35, 37 або 39. UA (21) a200706796 (22) 30.11.2005 (24) 25.01.2012 (86) PCT/US2005/043373, 30.11.2005 (31) 60/631,815 60/636,399 60/641,877 60/713,195 60/727,610 (32) 30.11.2004 15.12.2004 06.01.2005 31.08.2005 18.10.2005 (33) US US US US US (46) 25.01.2012, Бюл.№ 2, 2012 р. (72) КАРТОН ДЖІЛЛ, US, КАННІНГХЕМ МАРК, GB/US, ДАС АНУК, US, ДАФФІ КАРЕН, US, НАЙТ ДЕВІД М., US, ЛАМБ РОБЕРТА, US, МБОУ МОУХАМАДОУ Л., US, РАГХУНАТАН ГОПАЛАН, US, САН МАТЕО ЛЕНІ, US, САРІСКІ РОБЕРТ Т., US, СТОВЕЛЛ НІКОЛЬ, US, СВІІТ РЕЙМОНД, US, ЗХАО ШАНРОНГ, CN/US, ЧЕН ШІЗГОНГ, US, ГІЛЕС-КОМАР ДЖІЛЛ, US, ПІЧА КРІСТЕН, US, СТОЯНОВІЧ-СУСУЛІК ВЕДРАНА, US, ГОЛЕТЗ ТЕРЕСА ДЖ., US (73) ЦЕНТОКОР, ІНК., US (56) MATSUMOTO MISAKO ET AL: "Establishment of a monoclonal antibody against human Toll-like receptor 3 that blocks double-stranded RNA-mediated signaling" BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, ACADEMIC PRESS INC. ORLANDO, FL, US, vol. 293, no. 5, 24 May 2002 (2002-05-24), pages 1364-1369, XP002974969 ISSN: 0006-291X. DUFFY ET AL: "Down modulation of human TLR3 function by a monoclonal antibody" CELLULAR 2 (19) 1 3 5. Ізольоване антитіло за п. 4, яке відрізняється тим, що VH має амінокислотну послідовність, показану в SEQ ID NO: 25, та VL має амінокислотну послідовність, показану в SEQ ID NO: 33. 6. Ізольоване антитіло за п. 1, яке відрізняється тим, що має людське походження. 7. Ізольоване антитіло за п. 1, яке відрізняється тим, що має мишаче походження. 8. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить фрагмент Fab. 9. Ізольоване антитіло за п. 1, яке відрізняється тим, що містить фрагмент scFv. 10. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент є гуманізованим. 11. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент включає химерне антитіло. 12. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло кон'юговане з поліетиленгліколем. 13. Ізольоване антитіло за п. 1, яке відрізняється тим, що антитіло або фрагмент містить мишачі антигенозв'язуючі залишки і залишки людського антитіла. 14. Ізольоване антитіло за п. 1, яке відрізняється тим, що має IgG4 ізотип. 15. Ізольоване антитіло за п. 14, яке відрізняється тим, що домен Fc включає мутації S228P, P234A і L235A. 16. Фармацевтична композиція, яка відрізняється тим, що містить ізольоване антитіло за п. 1 і фармацевтично прийнятний носій. 17. Ізольований полінуклеотид, який відрізняється тим, що кодує важкий ланцюг антитіла, який містить амінокислотні послідовності CDR, показані в SEQ ID NO: 9, 11 і 13, та легкий ланцюг антитіла, який містить амінокислотні послідовності CDR, показані в SEQ ID NO: 19, 21 і 23, де антитіло специфічно зв'язується з Toll-подібним рецептором 3 (TLR3). 18. Ізольований полінуклеотид, який відрізняється тим, що кодує важкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 6, 25, 27, 29, 31, та легкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 16, 33, 35, 37 або 39, де антитіло специфічно зв'язується з Toll-подібним рецептором 3 (TLR3). 19. Ізольований полінуклеотид за п. 18, який відрізняється тим, що містить послідовність, показану в SEQ ID NO: 5, 15, 26, 28, 30, 32, 34, 36, 38 або 40. 20. Вектор, який відрізняється тим, що містить ізольований полінуклеотид за пп. 17, 18 або 19. 21. Клітина-хазяїн, яка відрізняється тим, що містить вектор за п. 20. 22. Спосіб одержання антитіла, що реагує з TLR3, який відрізняється тим, що включає культивування клітини-хазяїна за п. 21 і добування антитіла, продукованого клітиною-хазяїном. 23. Лінія клітин гібридоми, яка відрізняється тим, що продукує антитіло за п. 1. 24. Спосіб інгібування клітинного продукування RANTES, який відрізняється тим, що включає забезпечення контакту ізольованого антитіла за п. 97229 4 1 з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для інгібування продукування RANTES. 25. Спосіб за п. 24, який відрізняється тим, що додатково інгібується клітинне продукування IL-6, IL-8 або MІP1-альфа. 26. Спосіб лікування або профілактики запального стану, який відрізняється тим, що включає введення терапевтично ефективної кількості ізольованого антитіла за п. 1 пацієнту, який потребує цього, протягом часу, достатнього для лікування або профілактики запального стану. 27. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою пов'язаний із сепсисом стан. 28. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою запальне захворювання кишечнику. 29. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою пов'язаний з інфекцією стан. 30. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою запальний легеневий стан. 31. Спосіб за п. 26, який відрізняється тим, що запальний стан являє собою діабет 2 типу, дисліпідемію або метаболічний синдром. 32. Спосіб за п. 26, який відрізняється тим, що запальний стан спричинений аутоімунним захворюванням. 33. Спосіб збільшення швидкості проліферації клітини, який відрізняється тим, що включає забезпечення контакту ізольованого антитіла за п. 1 з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для збільшення швидкості проліферації клітини. 34. Спосіб за п. 33, який відрізняється тим, що клітина присутня в тканині тварини. 35. Спосіб за п. 33, який відрізняється тим, що клітина являє собою епітеліальну клітину. 36. Спосіб за п. 35, який відрізняється тим, що тканина являє собою тканину ободової кишки. 37. Спосіб за п. 35, який відрізняється тим, що тканина виявляє патологію, пов'язану із запальним станом. 38. Спосіб за п. 37, який відрізняється тим, що запальний стан являє собою запальне захворювання кишечнику. 39. Спосіб лікування або профілактики стану, що є результатом загибелі клітини, який відрізняється тим, що включає введення терапевтично ефективної кількості ізольованого антитіла за п. 1 пацієнту, який потребує цього, протягом часу, достатнього для лікування стану. 40. Спосіб за пп. 26, 33 або 39, який відрізняється тим, що ізольоване антитіло являє собою ізольоване антитіло, яке реагує з TLR3 та має антигенозв'язуючу здатність моноклонального антитіла, яке містить амінокислотні послідовності CDR важкого ланцюга, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23. 41. Спосіб за п. 40, який відрізняється тим, що ізольоване антитіло, яке реагує з TLR3, містить амінокислотні послідовності CDR важкого ланцю 5 97229 6 га, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23. 42. Спосіб за п. 41, який відрізняється тим, що ізольоване антитіло містить VH, який має аміноки слотну послідовність, показану в SEQ ID NO: 6, 25, 27, 29 або 31, та VL, який має амінокислотну послідовність, показану в SEQ ID NO: 16, 33, 35, 37 або 39. Галузь винаходу Даний винахід стосується антагоністів Tollподібного рецептора 3 (TLR3), полінуклеотидів, що кодують антагоністи TLR3 або їх фрагменти, а також способів їх виготовлення і застосування. Патології, пов'язані із запальними станами, представляють значну проблему в галузі охорони здоров'я і можуть бути болісними, інвалідизуючими і смертельними. Наприклад, в США сепсис та пов’язані із сепсисом стани вражають більш ніж 750 тисяч людей щорічно із смертністю 28–50 %, що призводить до 215 000 смертельних випадків щорічно (Natanson et al., Crit. Care Med. 26:1927– 1931 (1998); Angus et al., Crit. Care Med. 29:13031310 (2001)). Інші запальні стани, такі як запальні захворювання кишечнику (IBD) — хвороба Крона і виразковий коліт — в США вражають більш ніж 1 мільйон людей на рік (Hanauer et al., Rev. Gastroenterol. Disord. 3:81-92 (2003)). Запальні стани легенів, що вражають легеневу функцію, такі як хронічне обструктивне захворювання легень (ХОЗЛ), астма і легеневі інфекції, також вражають значну кількість людей в США. ХОЗЛ, наприклад, вражає приблизно 10 мільйонів дорослих американців, і його зустрічальність росте (Mapel et al., Manag. Care Interface 17:61-66 (2004)). Патології, пов'язані з такими запальними станами та їх загостреннями, здійснюють суттєвий вплив на економіку та охорону здоров’я. Загострення легеневих захворювань, таких як астма і ХОЗЛ, характеризується погіршенням симптомів і зниженням легеневої функції. Вірусні інфекції супроводжуються загостренням багатьох легеневих захворювань (Johnston, Am. J. Respir. Crit. Care Med. 152: S46-52 (1995); Bandi et al, FEMS Immunol. Med. Microbiol. 37: 69-75 (2003)) і вважаються основною причиною загострень. Секреція прозапального цитокіну в легенях внаслідок вірусної інфекції являє собою критичну стадію сприяння запальній реакції при різних захворюваннях легень (Gern et al., Am. J. Respir. Cell. MoI. Biol. 28:731-737 (2003); Panina-Bordignon et al., Curr. Opin. PuIm. Med. 9:104-110 (2003)). Інсулінорезистентність визнана рисою метаболічного синдрому, який включає непереносність глюкози, інсулінорезистентність, ожиріння, гіпертригліцеридемію, низький рівень холестерину ЛПВЩ, гіпертензію та прискорений розвиток атеросклерозу (Wisse, J. Am. Soc. Nephrol. 15:2792800 (2004)). Хоча одночасна схильність до ожиріння, діабету 2 типу та інсулінорезистентності добре вивчена, молекулярні і клітинні механізми, які контролюють пов'язані з ожирінням інсулінорезистентність та діабет 2 типу, все ще залишаються незрозумілими. Той факт, що особи з ожирінням демонстру ють підвищені рівні прозапальних цитокінів, таких як TNF-α, IL-1b та IL-6, вказує на гіпотезу, що індукована ожирінням інсулінорезистентність являє собою запальний стан (Karin et al., Nat. Rev. Drug Discov. 3:17-26 (2004)). Таким чином, запалення, ожиріння, інсулінорезистентність та аберантний метаболізм ліпідів можуть являти собою загальні риси метаболічного синдрому. Фактично, нестероїдні лікарські засоби, такі як інгібітори циклооксигенази, що можуть перешкоджати дії ключових запальних факторів транскрипції, таких як NF-k і IKK, підвищують чутливість до інсуліну в тваринних моделях діабету 2 типу та у пацієнтів-людей (Karin et al., вище). До того ж, останні дані підтверджують зв'язок між інсулінорезистентністю і запаленням, що продемонстровано здатністю IKKb умовно «нокаутованих» мишей в мієлоїдних клітинах демонструвати глобальну чутливість до інсуліну і бути захищеними проти інсулінорезистентності, а також розвитком системної інсулінорезистентності у мишей, що надмірно експресують IKKb в печінці (Arkan et al., Nat. Med. 11:191-198 (2005); Cai et al., Nat. Med. 11:183-90 (2005)). В цілому, одержані результати забезпечують істотні підстави для пояснення зв'язку між ожирінням, інсулінорезистентністю і діабетом 2 типу та запальними захворюваннями. Розпізнавання мікробних антигенів імунною системою хазяїна опопосередковується через вроджені імунні рецептори, активація яких є важливою стадією в ініціюванні запальної реакції. Tollподібні рецептори (TLR) представляють сімейство вроджених імунних рецепторів, які виконують критичну роль в опосередковуванні імунної реакції на сторонні антигени. TLR3, наприклад, являє собою рецептор розпізнавання шаблонів у ссавців, що розпізнає подвійно звиту (ds) РНК, а також синтетичний аналог подвійно звитої РНК — полірибоінозинову-рибоцитидилову кислоту (полі(I:C)), (Alexopoulou et al., Nature 413: 732-238 (2001)). Крім того, показано, що TLR3 розпізнає ендогенні ліганди, такі як мРНК, вивільнену з некротичних клітин (Kariko et al., J. Biol. Chem. 26: 12542-12550 (2004)); це свідчить про те, що некротична загибель клітин в місцях запалення може сприяти активації TLR3. Активація TLR3 полі(I:C) або ендогенними лігандами мРНК індукує секрецію прозапальних цитокінів і хемокінів; цей факт свідчить про те, що агоністи TLR3 впливають на результат захворювання в ході пов'язаного з інфекцію запалення. Тому вважається, що TLR3 лігування in vivo відбувається в контексті вірусної інфекції (Tabeta et al., Proc. Natl. Acad. Sci. USA 101:3516-3521 (2004)) або некрозу, пов'язаного із запаленням (Kariko et al., J. Biol. Chem. 26: 12542-12550 (2004)). В ціло 7 му, одержані дані демонструють, що лігування TLR3 ініціює каскади подій фосфорилування і транскрипційної активації, які призводять до продукування численних запальних цитокінів, причому вважається, що останні сприяють вродженому імунітету (огляд Takeda and Akira, J. Derm. Sci. 34:73-82 (2004)). Крім того, вказані дані свідчать про те, що тривала активація TLR3 може бути критичним компонентом в модуляції пов'язаних з інфекцію запальних захворювань. Опубліковані дані підтримують цю гіпотезу, зокрема, з урахуванням фактів, які пов’язують надмірне продукування прозапальних цитокінів із синдромом системної запальної реакції, пов'язаними з інфекцію гострими цитокіновими штормами (cytokine storms) (огляд Van Amersfoort et al., Clin. Microbiol. Rev. 16: 379414 (2003)) та імуно-опосередкованими хронічними станами, такими як ревматоїдний артрит (огляд Miossec et al., Curr. Opin. Rheumatol. 16:218-222 (2004)) та запальні захворювання кишечнику (огляд Ogata and Hibi, Curr. Pharm. Des. 9: 11071113 (2003)). Хоча дослідження in vitro продемонстрували, що стимуляція епітеліальних клітин легенів за допомогою полі(I:C) спричиняє секрецію численних цитокінів, хемокінів та індукування факторів транскрипції і підвищення експресії рецепторів TLR (Ieki et al., Clin. Exp. Allergy 34: 745-52 (2004); Sha et al., Am. J. Respir. Cell. MoI. Biol. 31: 358-64 (2004)), фізіологічна доцільність таких явищ залишається незрозумілою. Вказані пов'язані із запальними станами патології, а також інші, які пов'язані з інфекціями, здійснюють істотний вплив на охорону здоров’я та економіку. Незважаючи на прогрес в багатьох областях медицини, до цього часу існує порівняно невелика кількість засобів лікування для багатьох з цих станів. Наприклад, загострення легеневих захворювань лікують високими дозами кортикостероїдів та ® анти-lgE, таким як XOLAIR (торгівельна назва омалізумабу). Продемонстровано, що інгаляційні кортикостероїди в комбінації з 2 агоністами ефективно зменшують частоту загострень. Однак, оскільки такі засоби лікування тільки зменшують ризик розвитку загострень та пов'язані із значними побічними ефектами, існує потреба в альтернативних схемах лікування для запобігання і лікування загострень легеневих захворювань. Таким чином, існує потреба в розумінні ролі TLR3 в запальних станах та використання цієї ролі для розробки агентів, таких як антагоністи, які ефективно лікують вказані стани. Короткий опис фігур На Фіг. 1 показані послідовності варіабельної ділянки важкого ланцюга моноклонального антитіла-антагоніста проти людського TLR3 (hTLR3) (CDR підкреслені). На Фіг. 2 показані послідовності варіабельної ділянки легкого ланцюга моноклонального антитіла-антагоніста проти TLR3 (hTLR3) (CDR підкреслені). На Фіг. 3 показано інгібування антагоністом TLR3 індукованого полі(I:C) продукування цитокіну IL-6 в клітинах, одержаних з легеневого епітелію 97229 8 людини. На Фіг. 4 показано інгібування антагоністом TLR3 індукованого полі(I:C) продукування цитокіну IL-8 в клітинах, одержаних з легеневого епітелію людини. На Фіг. 5 показано інгібування антагоністом TLR3 індукованого полі(I:C) продукування цитокіну RANTES в клітинах, одержаних з легень людини. На Фіг. 6 показано інгібування антагоністом TLR3 індукованого полі(I:C) продукування цитокіну MIP1-альфа в первинних бронхоепітеліальних клітинах людини. На Фіг. 7 показано інгібування антагоністом TLR3 індукованого полі(I:C) продукування цитокіну IL-6 в первинних бронхоепітеліальних клітинах людини. На Фіг. 8 показано вплив ―нокаутування‖ активності TLR3 на пов’язане із запальним захворюванням кишечнику зниження маси тіла. На Фіг. 9 показано інгібування антагоністом TLR3 пов’язаного із запальним захворюванням кишечнику зниження маси тіла. На Фіг. 10 показано збільшення виживаності в мишачій моделі сепсису шляхом лікування антагоністом TLR3. На Фіг. 11 показано зменшення антагоністом TLR3 продукування цитокіну IL-6 на мишачій моделі сепсису. На Фіг. 12 показано зменшення антагоністом TLR3 продукування цитокіну TNF-альфа на мишачій моделі сепсису. На Фіг. 13 показано індуковане полі(I:C) збільшення загальної кількості запальних клітин в легеневій тканині мишей. На Фіг. 14 показано індуковане полі(I:C) збільшення кількості нейтрофілів в легеневій тканині мишей. На Фіг. 15 показано індуковане полі(I:C) збільшення кількості моноядерних запальних клітин в легеневій тканині мишей. На Фіг. 16 показано, що активація TLR3 однією дозою полі(I:C) додатково погіршує легеневу функцію у мишей, навантажених метахоліном. На Фіг. 17 показано, що активація TLR3 множинними дозами полі(I:C) додатково погіршує легеневу функцію у мишей, навантажених метахоліном. На Фіг. 18 показано, що TLR3 «нокаутовані» миші захищені від індукованого єдиною дозою полі(I:C) погіршення легеневої функції в ході навантаження метахоліном. На Фіг. 19 показано, що TLR3 «нокаутовані» миші захищені від індукованого множинними дозами полі(I:C) погіршення легеневої функції в ході навантаження метахоліном. На Фіг. 20 показано вплив антагоніста TLR3 на продукування цитокінів і хемокінів в епітеліальних клітинах бронхів і легень людини. На Фіг. 21 показано підвищення виживання на мишачій моделі смертельної пневмонії в результаті профілактики і лікування антагоністом TLR3. На Фіг. 22 показано розвиток смертельної пневмонії на мишачій моделі після інфікування сублетальними дозами вірусу грипу A/PR/8 і Streptococcus pneumoniae. 9 На Фіг. 23 показано бактеріальне навантаження в легенях мишей, інфікованих вірусом грипу A/PR/8 і S. pneumoniae. На Фіг. 24A, B, C і D показано зв’язування гуманізованих анти-TLR3 mAb з hTLR3 в аналізах ELISA. На Фіг. 25 показано оцінку гуманізованих антиTLR3 mAb в аналізі клітинного вивільнення цитокіну. На Фіг. 26 показано оцінку варіантів mAb HBV1–HBV8 (за винятком HBV4) в клітинному аналізі біологічної активності з вимірюванням IP10. На Фіг. 27 показано оцінку варіантів mAb HBV1–HBV8 (за винятком HBV4) в клітинному аналізі біологічної активності з вимірюванням RANTES. На Фіг. 28 показано оцінку варіантів mAb HBV1–HBV8 (за винятком HBV4) в клітинному аналізі біологічної активності з вимірюванням IL-8. На Фіг. 29 показано оцінку варіантів mAb HBV1–HBV8 (за винятком HBV4) в клітинному аналізі біологічної активності з вимірюванням MCP-1. На Фіг. 30 показано оцінку варіантів mAb HBV1–HBV8 (за винятком HBV4) в клітинному аналізі біологічної активності з вимірюванням IL-6. На Фіг. 31A і B показано, що TLR3 «нокаутовані» миші, які одержували раціон з високим вмістом жирів, захищені від розвитку порушеної переносності глюкози, пов'язаної з раціоном з високим вмістом жирів. На Фіг. 32 показано, що TLR3 «нокаутовані» миші мають нормальні рівні глюкози в крові натщесерце після 26 тижнів споживання раціону з високим вмістом жирів. На Фіг. 33A, B і C показано зростання рівнів інсуліну натщесерце до і після навантаження глюкозою у TLR3 «нокаутованих» мишей після 26 тижнів споживання раціону з високим вмістом жирів. На Фіг. 34A, B, C, D і E показано покращені профілі ліпідів у TLR3 «нокаутованих» мишей, які одержували раціон з високим вмістом жирів протягом 30 тижнів, в порівнянні з мишами дикого типу на дієті з високим вмістом жирів. На Фіг. 35 показано експериментальний протокол профілактичного (Pr) і терапевтичного (T) лікування антагоністом TLR3 в ході індукування хронічного ДНС коліту. На Фіг. 36 показано захист за допомогою антагоністу TLR3 від зниження маси тіла в ході кожного циклу споживання ДНС. На Фіг. 37 показано зниження маси тіла та відновлення її за допомогою антагоністу TLR3 після другого циклу ДНС. На Фіг. 38 показано зниження маси тіла та відновлення її за допомогою антагоністу TLR3 після третього циклу ДНС. На Фіг. 39 показано вплив лікування антагоністом TLR3 на зниження маси тіла нетто, пов'язане з хронічним ДНС колітом. На Фіг. 40 показано вплив лікування антагоністом TLR3 на скорочення ободової кишки, пов'язане з хронічним ДНС колітом. На Фіг. 41A, B і C показано вплив лікування 97229 10 антагоністом TLR3 на важкість хронічного ДНС коліту. На Фіг. 41D, E і F показано гістопатологічний вплив лікування антагоністом hTLR3 при хронічному ДНС коліті. На Фіг. 42 показано активацію T-клітин при хронічному ДНС коліті. На Фіг. 43 показано вплив профілактичного лікування антагоністом TLR3 на пов’язане з ДНС збільшення кількості CD11b+ клітин в селезінці. На Фіг. 44 показано вплив лікування антагоністом TLR3 на системні рівні IL-4 та IL-10 при хронічному ДНС коліті. Короткий опис винаходу Один аспект винаходу являє собою антагоніст Toll-подібного рецептора 3 (TLR3), який інгібує клітинне продукування RANTES. Інший аспект винаходу являє собою ізольоване антитіло, яке реагує з TLR3 та володіє антигензв’язуючою здатністю моноклонального антитіла, що містить амінокислотні послідовності ділянок, що визначають комплементарність (CDR) важкого ланцюга, як показано в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, як показано в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольоване антитіло, яке реагує з TLR3 та містить амінокислотні послідовності ділянок, що визначають комплементарність важкого ланцюга (CDR), показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольоване антитіло, що має амінокислотну послідовність VH CDR1, показану Формулою (I): Thr Thr Tyr Trp Xaa1 His (I) де Xaa1 являє собою Ile або Met (SEQ ID NO: 61); амінокислотну послідовність VH CDR2, показану Формулою (II): Glu Ile Asn Pro Asn Asn Gly Arg Ile Asn Xaa 2 Xaa3 Glu Lys Xaa4 Lys Thr (II) де Xaa2 являє собою Tyr або Gly, Xaa3 являє собою Asn або Ala, та Xaa4 являє собою Phe або Gly (SEQ ID NO: 62); і амінокислотну послідовність VH CDR3, показану Формулою (III): Val Gly Val Xaa5 Ile Thr Thr Phe Pro Tyr (III) де Xaa5 являє собою Met або Ile (SEQ ID NO: 63); та VL CDR має амінокислотні послідовності, показані в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольований полінуклеотид, який кодує важкий ланцюг антитіла, що містить амінокислотні послідовності CDR, показані в SEQ ID NO: 9, 11 і 13. Інший аспект винаходу являє собою ізольований полінуклеотид, який кодує легкий ланцюг антитіла, що містить амінокислотні послідовності CDR, показані в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольований полінуклеотид, який кодує важкий ланцюг антитіла, що містить амінокислотну послідовність, 11 показану в SEQ ID NO: 6, 25, 27, 29, 31, 45, 47, 49, 51 або 53. Інший аспект винаходу являє собою ізольований полінуклеотид, який кодує легкий ланцюг антитіла, що містить амінокислотну послідовність, показану в SEQ ID NO: 16, 33, 35, 37 або 39. Інший аспект винаходу являє собою спосіб лікування або профілактики запального стану, що включає введення терапевтично ефективної кількості антагоніста TLR3 пацієнту, який потребує цього, протягом часу, достатнього для лікування або профілактики запального стану. Інший аспект винаходу являє собою спосіб збільшення швидкості проліферації клітин, який включає забезпечення контакту антагоніста TLR3 з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для збільшення швидкості проліферації клітини. Детальний опис винаходу Всі публікації, в тому числі, але не обмежуючись ними, патенти і патентні заявки, процитовані в даному описі, таким чином, включені шляхом посилання у всій їх повноті. Термін "антагоніст" в даному описі означає молекулу, яка частково або повністю інгібує, за будь-яким механізмом, вплив іншої молекули, такої як рецептор. В даному описі "антагоніст TLR3" або ―сполука, яка реагує з TLR3" означає молекулу, здатну, безпосередньо або непрямо, істотним чином нейтралізувати, зменшувати або інгібувати біологічну активність TLR3 або активацію рецептора TLR3. Такі антагоністи, можуть бути, наприклад, низькомолекулярними органічними сполуками, пептидами, поліпептидами, злитими білками, антитілами, фрагментами антитіл, міметитілами або полінуклеотидами. Термін "антитіла" в даному описі вживається в широкому значенні і включає молекули імуноглобуліну або антитіл, зокрема: поліклональні антитіла, моноклональні антитіла, в тому числі мишачі, людські, гуманізовані і химерні моноклональні антитіла та фрагменти антитіл. Загалом, антитіла являють собою білкові або пептидні ланцюги, які демонструють специфічне зв’язування з конкретним антигеном. Інтактні антитіла являють собою гетеротетрамерні глікопротеїни, які складаються з двох ідентичних легких ланцюгів та двох ідентичних важких ланцюгів. Типово, кожен легкий ланцюг зв'язаний з важким ланцюгом одним ковалентним дисульфідним зв’язком, тоді як кількість дисульфідних зв’язків між важкими ланцюгами різних ізотипів імуноглобуліну варіює. Кожен важкий і легкий ланцюг також містить розміщені на регулярних відстанях внутрішньоланцюгові дисульфідні містки. Кожен важкий ланцюг містить на одному кінці варіабельну ділянку (VH), за якою слідують численні константні ділянки. Кожен легкий ланцюг містить варіабельну ділянку на одному кінці (VL) і постійну ділянку на іншому кінці; постійна ділянка легкого ланцюга вирівняна з першою постійною ділянкою важкого ланцюга, а варіабельна ділянка легкого ланцюга вирівняна з варіабельною ділянкою важкого ланцюга. Легкі ланцюги антитіла будьяких видів хребетних можуть бути віднесені до 97229 12 одного з двох чітко визначених типів, а саме капа () і лямбда (), на базі амінокислотних послідовностей їх постійних ділянок. Імуноглобулін може бути віднесений до п'яти основних класів, а саме IgA, IgD, IgE, IgG та IgM, в залежності від амінокислотної послідовності постійної ділянки важкого ланцюга. IgA і IgG додатково класифікують як ізотип IgA1, IgA2, IgG1, IgG2, IgG3 та IgG4. Термін "фрагменти антитіла" означає частину інтактного антитіла, загалом антиген-зв'язуючу або варіабельну ділянку інтактного антитіла. Приклади фрагментів антитіла включають фрагменти Fab, Fab', F(ab')2 і Fv, діатіла (diabodies), одноланцюгові молекули антитіл та мультиспецифічні антитіла, утворені як мінімум з двох інтактних антитіл. Термін "антиген" в даному описі означає будьяку молекулу, здатну генерувати антитіла, безпосередньо або непрямо (альтернативна назва — імуноген). В межі визначення "антигену" включена нуклеїнова кислота, що кодує білок. "CDR" визначені як амінокислотні послідовності ділянок антитіла, що визначають комплементарність, які є гіперваріабельними ділянками важких і легких ланцюгів імуноглобуліну, Див., наприклад, Kabat et al., Sequences of Proteins of Immunological Interest, 4th ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). Існують три CDR або варіабельні ділянки важкого ланцюга і три CDR або варіабельні ділянки легкого ланцюга у варіабельній частині імуноглобуліну. Таким чином, "CDR" в даному описі означає, у відповідному контексті, всі три CDR важкого ланцюга або всі три CDR легкого ланцюга, або всі CDR важкого і легкого ланцюгів. CDR забезпечують більшість контактних залишків для зв'язування антитіла з антигеном або епітопом. Цільові CDR за даним винаходом походять з варіабельних послідовностей важкого і легкого ланцюга донорського антитіла, і включають аналоги природних CDR, причому вказані аналоги поділяють або зберігають таку ж специфічність зв’язування з антигеном та/або нейтралізуючу здатність, якими володіє донорське антитіло, з якого вони були одержані. Термін "епітеліальна клітина" в даному описі означає клітину, яка походить з клітин тканини оболонки, яка вкриває частину вільної поверхні (наприклад, шкіра) вистилає трубку або порожнину (наприклад, ободова кишка) тварини. Такі клітини можуть бути виділені окремо або можуть бути частиною більш високоорганізованої групи клітин, наприклад, таких, які звичайно містяться в тканинах, органах або в моделях in vitro. Термін "гомолог" означає послідовності білку, що мають ідентичність послідовності від 40 % до 100 % по відношенню до довідкової послідовності. Гомолог hTLR3 включає поліпептиди інших видів, які мають ідентичність послідовності від 40 % до 100 % по відношенню до відомої послідовності hTLR3. Відсоток ідентичності між двома пептидними ланцюгами може бути визначений шляхом попарного вирівнювання з використанням значень, встановлених за умовчанням для модуля AlignX програмного забезпечення Vector NTI 13 v.9.0.0 (Invitrogen Corp., Carslbad, CA). "TLR3" означає hTLR3 і його гомологи. Повна довжина амінокислотної послідовності людського TLR3 і кодуюча послідовність полінуклеотиду показані в SEQ ID NO: 1 і 2, відповідно. Термін "в комбінації з" в даному описі означає, що описані агенти можуть бути введені тварині разом в суміші, паралельно як окремі агенти або послідовно як окремі агенти в будь-якому порядку. Термін "запальний стан" в даному описі означає локалізовану реакцію на пошкодження клітин, яка опосередковується, зокрема, активністю цитокінів, хемокінів або запальних клітин (наприклад, нейтрофілів, моноцитів і лімфоцитів) та в більшості випадків характеризується болем, почервонінням, опуханням і втратою функції тканини. Термін "запальний легеневий стан" в даному описі означає запальний стан, що вражає легені або пов'язаний з ними. Термін "міметитіло" в даному описі означає білок, що має загальну формулу (I): (Vl-Pep-Lk-V2-Hg-CH2-CH3) (t) (I) де V1 являє собою частину N-кінця варіабельної ділянки імуноглобуліну, Pep являє собою поліпептид, який зв'язується з TLR3 на поверхні клітин, Lk являє собою поліпептид або хімічний зв’язок, V2 являє собою частину C-кінця варіабельної ділянки імуноглобуліну, Hg являє собою частину шарнірної ділянки імуноглобуліну, CH2 являє собою константну ділянку CH2 важкого ланцюга імуноглобуліну, і CH3 являє собою константну ділянку CH3 важкого ланцюга імуноглобуліну, та t незалежно являє собою ціле число від 1 до 10. Міметитіло може імітувати властивості і функції різних типів молекул імуноглобуліну, таких як IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgD і IgE, в залежності від амінокислотної послідовності константного домену важкого ланцюга, присутньої в конструкті. У деяких варіантах міметитіла V1 може бути відсутній. Міметитіло-антагоніст за даним винаходом впливає на біологічну активність TLR3 шляхом зв'язування з TLR3 на поверхні клітин. Термін "моноклональне антитіло" (mAb) в даному описі означає антитіло (або фрагмент антитіла), одержаний з популяції істотною мірою гомогенних антитіл. Моноклональні антитіла є високо специфічними, і звичайно спрямовані проти одного антигенного детермінанта. Характеристика "моноклональний" вказує на істотною мірою гомогенний характер антитіла і не вимагає продукування антитіла за будь-яким конкретним способом. Наприклад, мишачий mAb може бути одержаний за методом гібридоми з Kohler et al., Nature 256:495-491 (1975). Химерні mAb що містять варіабельні ділянки легкого ланцюга та важкого ланцюга, які походять з донорського антитіла (звичайно мишачого) в поєднанні з постійними ділянками легкого і важкого ланцюга, що походять з акцепторного антитіла (звичайно інші види ссавців, наприклад, людина), можуть бути одержані за способом, розкритим в Патенті США № 4,816,567. Гуманізовані mAb, що містять CDR, які походять з нелюдського донорського імуноглобуліну (звичайно мишачого), та решту одержаних з імуноглобуліну частин молекули, 97229 14 які походять з одного або більше людських імуноглобулінів, можуть бути одержані за методами, відомими фахівцям в даній галузі, наприклад, метод, розкритий в Патенті США № 5,225,539. Гуманізовані mAbs необов'язково можуть бути додатково модифіковані шляхом введення змінених залишків в несучий каркас для збереження спорідненості зв’язування за допомогою, наприклад, таких методів, як розкриті в Queen et al., Proc. Natl. Acad. Sci. (USA), 85:10029-10032 (1989) and Hodgson et al., Bio/Technology, 9:421 (1991) . Зразки людських каркасних послідовностей, придатних для гуманізації, розкриті, наприклад, в наступних джерелах: www.ncbi.nlm.nih.gov/entrez/query.fcgi; www.ncbi.nih.gov/igblast; www.atcc.org/phage/hdb.html; www.mrc-cpe.cam.ac.uk/ALIGNMENTS.php; www.kabatdatabase.com/top.html; ftp.ncbi.nih.gov/repository/kabat; www.sciquest.com; www.abcam.com; www.antibodyresource.com/onlinecomp.html; www.public.iastate.edu/~pedro/research_tools.ht ml; www.whfreeman.com/immunology/CH05/kuby05. htm; www.hhmi.org/grants/lectures/1996/vlab; www.path.cam.ac.uk/~mrc7/mikeimages.html; mcb.harvard.edu/BioLinks/Immunology.html; www.immunologylink.com; pathbox.wustl.edu/-hcenter/index.html; www.appliedbiosystems.com; www.nal.usda.gov/awic/pubs/antibody; www.m.ehimeu.ac.jp/~yasuhito/Elisa.html; www.biodesign.com; www.cancerresearchuk.org; www.biotech.ufl.edu; www.isac-net.org; baserv.uci.kun.nl/~jraats/linksl.html; www.recab.unihd.de/immuno.bme.nwu.edu; www.mrccpe.cam.ac.uk; www. ibt .unam.mx/vir/V_mice.html; http://www.bioinf.org.uk/abs; antibody.bath.ac.uk; www.unizh.ch; www.cryst.bbk.ac. uk/~ubcg07s; www.nimr.mrc.ac.uk/CC/ccaewg/ccaewg.html; www.path.cam.ac.uk/~mrc7/humanisation/TAHH P.html; www.ibt.unam.mx/vir/structure/stat_aim.html; www.biosci.missouri.edu/smithgp/index.html; www.jerini.de; imgt.cines.fr; and Kabat et al., Sequences of Proteins of Immunological Interest, U.S. Dept. Health (1987), кожне з яких включене до даного опису шляхом посилання у всій його повноті. Повністю людський mAb, в якому відсутні будь-які нелюдські послідовності, може бути одержаний з трансгенних мишей, що продукують людський імуноглобулін, за методами, описаними, наприклад, в Lonberg et al., Nature 368:856-859 (1994); Fishwild et al., Nature Biotechnology 14:845851 (1996) та Mendez et al., Nature Genetics 15:146156 (1997). Людський mAb також може бути одержаний та оптимізований з бібліотек дисплею фага 15 97229 за методами, описаними, наприклад, в Knappik et al., J. MoI. Biol. 296:57-86 (2000) та Krebs et al., J. Immunol. Meth. 254:67-84 (2001) . Термін "швидкість проліферації" в даному описі стосується зміни кількості клітин за одиницю часу або зміни кількості клітин, що демонструють маркер просування через клітинний цикл у напрямі поділу клітини, за одиницю часу. Такі маркери можуть бути морфологічними, можуть являти собою Амінокислота Аланін Аргінін Аспарагін Аспартат Цистеїн Глутамат Глютамін Гліцин Гістидин Ізолейцин Лейцин Лізин Метіонін Фенілаланін Пролін Серин Треонін Триптофан Тирозин Валін індикатори реплікації ДНК або продукти генної експресії. Термін ―біологічна активність TLR3" або ―активація рецептора TLR3‖ в даному описі стосується будь-якої активності, яка виникає в результаті зв'язування ліганду з TLR3 на поверхні клітини. В даному описі використовуються наступні традиційні одно- і трьохлітерні коди амінокислот: Трьохлітерний код ala arg asn asp cys glu gln gly his ile leu lys met phe pro ser thr trp tyr val Суть винаходу Даний винахід стосується антагоністів, здатних інгібувати опосередковане рецептором TLR3 проведення сигналу, а також застосування таких антагоністів. Вказані антагоністи TLR3 можуть мати властивості зв’язування з рецептором TLR3 та інгібування опосередкованого рецептором TLR3 проведення сигналу. Приклади механізмів, за якими такі антагоністи можуть інгібувати проведення сигналу TLR3, включають інгібування активності кінази, зменшення транскрипції або антагонізм по відношенню до рецептора. Інші антагоністи, здатні до інгібування опосередкованого рецептором TLR3 проведення сигналу за іншими механізмами, також знаходяться в межах різних аспектів і варіантів винаходу. Такі антагоністи є придатними як реактиви для досліджень, діагностичні реактиви і терапевтичні агенти. Один аспект винаходу являє собою антагоніст Toll-подібного рецептора 3 (TLR3), який інгібує клітинне продукування цитокіну RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted; хемокін, що виділяється Т-клітинами при активації). Інший аспект винаходу являє собою антагоніст TLR3, який інгібує клітинне продукування RANTES і цитокіну вибраного з групи, що складається з інтерлейкіну-6 (IL-6), інтерлейкіну-8 (IL-8) і запального білку-1 альфа макрофагів (MIP1альфа). Інший аспект винаходу являє собою ізольоване антитіло, яке реагує з TLR3 та володіє антигензв’язуючою здатністю моноклонального антитіла, яке містить амінокислотні послідовності ділянок, 16 Однолітерний код A R N D C E Q G H I L K M F P S T W Y V що визначають комплементарність важкого ланцюга (CDR), показані в SEQ ID NO: 9 (VH CDR1), 11 (VH CDR2) і 13 (VH CDR3), та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19 (VL CDR1), 21 (VL CDR2) і 23 (VL CDR3). Прикладом антитіла є моноклональне антитіло, що містить амінокислотні послідовності CDR важкого ланцюга, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності CDR легкого ланцюга, показані в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольоване антитіло, яке реагує з TLR3 та містить VH, що має амінокислотну послідовність, показану в SEQ ID NO: 6, і VL, що має амінокислотну полсдіовність, показану в SEQ ID NO: 16. Інший аспект винаходу являє собою ізольовані полінуклеотиди, що кодують будь-яке з антитіл або інших білкових антагоністів TLR3 за винаходом, або є комплементарними до них. Деякі приклади полінуклеотидів розкриті в даному описі, однак, інші полінуклеотиди, які забезпечують виродження генетичного коду, або привілейовані кодони в даній системі експресування, кодують антитіла або інші білкові антагоністи TLR3 за винаходом, також знаходяться в межах винаходу. Інший аспект винаходу являє собою важкий ланцюг антитіла, що містить амінокислотні послідовності CDR, показані в SEQ ID NO: 9, 11 і 13. Інший аспект винаходу являє собою ізольований полінуклеотид, що кодує легкий ланцюг антитіла, який містить амінокислотні послідовності CDR, показані в SEQ ID NO: 19, 21 і 23. Інший аспект винаходу являє собою ізольова 17 ний полінуклеотид, щокодує важкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 6. Приклад послідовності полінуклеотиду показаний в SEQ ID NO: 5. Інший аспект винаходу являє собою ізольований полінуклеотид, що кодує легкий ланцюг антитіла, який містить амінокислотну послідовність, показану в SEQ ID NO: 16. Приклад послідовності полінуклеотиду показаний в SEQ ID NO: 15. Інший аспект даного винаходу являє собою гуманізований mAb, який містить амінокислотну послідовність VH, показану в SEQ ID NO: 25, 27, 29 або 31, та амінокислотну послідовність VL, показану в SEQ ID NO: 33, 35, 37 або 39. Ізольовані полінуклеотиди, що кодують амінокислотні послідовності VH, показані в SEQ ID NO: 25, 27, 2 9 і 31, та амінокислотні послідовності VL, показані в SEQ ID NO: 33, 35, 37 і 39, також являють собою аспект винаходу. Вказані гуманізовані mAb містять амінокислотні послідовності VH CDR, показані в SEQ ID NO: 9, 11 і 13, та амінокислотні послідовності VL CDR, показані в SEQ ID NO: 19, 21 і 23. Приклади послідовностей нуклеїнових кислот, які кодують амінокислотні послідовності VH у відповідності до SEQ ID NO: 25, 27, 29 і 31, показані в SEQ ID NO: 26, 28, 30 і 32, відповідно. Приклади послідовностей нуклеїнових кислот, які кодують амінокислотні послідовності VL у відповідності до SEQ ID NO: 33, 35, 37 і 39, показані в SEQ ID NO: 34, 36, 38 і 40, відповідно. Один конкретний варіант гуманізованого моноклонального антитіла за винаходом включає амінокислотну послідовність VH, показану в SEQ ID NO: 25, та амінокислотну послідовність VL, показану в SEQ ID NO: 33. Інший варіант даного винаходу являє собою ізольоване антитіло, що має амінокислотну послідовність VH CDR1, показану Формулою (I): Thr Thr Tyr Trp Xaa1 His (I) там, де Xaa1 являє собою Ile або Met (SEQ ID NO: 61); амінокислотну послідовність VH CDR2, показану Формулою (II): Glu Ile Asn Pro Asn Asn Gly Arg Ile Asn Xaa 2 Xaa3 Glu Lys Xaa4 Lys Thr (II) де Xaa2 являє собою Tyr або Gly, Xaa3 являє собою Asn або Ala; та Xaa4 являє собою Phe або Gly (SEQ ID NO: 62); і амінокислотну послідовність VH CDR3, показану Формулою (III): Val Gly Val Xaa5 Ile Thr Thr Phe Pro Tyr (III) де Xaa5 являє собою Met або Ile (SEQ ID NO: 63); та VL CDR має амінокислотні послідовності, показані в SEQ ID NO: 19, 21 і 23. Приклади включають антитіло, що має амінокислотну послідовність VL, показану в SEQ ID NO: 33, та амінокислотну послідовність VH, яка містить VL-CDR1 Формули (I), де Xaa1 являє собою Met, та амінокислотні послідовності VL-CDR2 і VL-CDR3 є такими, як показано в SEQ ID NO: 11 і 13, відповідно (SEQ ID NO: 45, приклад нуклеїнової кислоти показаний в SEQ ID NO: 46). В цьому випадку Xaa 1 97229 18 являє собою Met; Xaa2 являє собою Tyr; Xaa3 являє собою Asn; Xaa4 являє собою Phe; та Xaa5 являє собою Met. Інші приклади включають антитіла, що мають амінокислотну послідовність VL, показану в SEQ ID NO: 33, та амінокислотну послідовність VH, яка включає амінокислотні послідовності VH-CDR1 і VH-CDR3, показані в SEQ ID NO: 9 і 13, відповідно, а також VH-CDR2 Формули (II), де: Xaa2 являє собою Gly, Xaa3 являє собою Asn, та Xaa4 являє собою Phe (SEQ ID NO: 47, приклад послідовності нуклеїнової кислоти показаний в SEQ ID NO: 48) ; Xaa2 являє собою Tyr, Xaa3 являє собою Ala, та Xaa4 являє собою Phe (SEQ ID NO: 49, приклад послідовності нуклеїнової кислоти показаний в SEQ ID NO: 50); і Xaa2 являє собою Tyr, Xaa3 являє собою Asn, та Xaa4 являє собою Gly (SEQ ID NO: 51, приклад послідовності нуклеїнової кислоти показаний в SEQ ID NO: 52). Інші приклади включають антитіло, що має амінокислотну послідовність VL, показану в SEQ ID NO: 33, та амінокислотну послідовність VH, яка містить амінокислотну послідовність VH-CDR1 і VHCDR2, показані в SEQ ID NO: 9 і 11, відповідно, а також VH-CDR3 Формули (III), де Xaa5 являє собою Ile (SEQ ID NO: 53, приклад послідовності нуклеїнової кислоти показаний в SEQ ID NO: 54). Сумарно, приклади включають антитіла, що містять одну з наступних комбінацій амінокислотних послідовностей VL і VH: VL SEQ ID NO: 33 33 33 33 33 VH SEQ ID NO: 45 47 49 51 53 Винахід додатково включає ізольовані антитіла, в яких VH має амінокислотну послідовність, показану в SEQ ID NO: 45, 47, 49, 51 або 53, та VL має амінокислотну послідовність, показану в SEQ ID NO: 33, 35, 37 або 39. Приклади антитіл-антагоністів можуть являти собою антитіла ізотипу IgG, IgD, IgGA або IgM. Крім того, вказані антитіла-антагоністи можуть бути модифіковані після трансляції за допомогою таких способів, як глікозилювання, ізомеризація, деглікозилювання або ковалентна модифікація, що не зустрічається в природі, наприклад, додавання фрагментів поліетиленгліколю (пегілювання) та ліпідизація. Такі модифікації можуть здійснюватися in vivo або in vitro. Наприклад, антитіла за винаходом можуть бути кон'юговані з поліетиленгліколем (ПЕГільовані) з метою покращення їх фармакокінетичного профілю. Кон’югація може бути здійснена за способами, відомими фахівцям в даній галузі. Показано, що кон’югація терапевтичних антитіл з ПЕГ підвищує фармакодинаміку, не перешкоджаючи функціонуванню. Див. Deckert et al., Int. J. Cancer 87: 382-390, 2000; Knight et al., Platelets 15: 409-418, 2004; 5 Leong et al., Cytokine 16: 106-119, 2001; and Yang et al., Protein Eng. 16: 19 761-770, 2003. Фармакокінетичні властивості антитіл за винаходом також можуть бути покращені шляхом модифікації Fc за методами, відомими фахівцям в даній галузі. Наприклад, важкі ланцюги ізотипу IgG4 містять мотив Cys-Pro-Ser-Cys (CPSC) в шарнірних ділянках, здатний до утворення між- або внутрішньоланцюгових дисульфідних зв’язків, тобто два залишки Cys в мотиві CPSC можуть утворювати дисульфідні зв’язки з відповідними залишками Cys в іншому важкому ланцюгу (міжланцюгові) або два залишки Cys в межах даного мотиву CPSC можуть утворювати дисульфідний зв’язок один з одним (внутрішньоланцюговий). Вважається, що in vivo ізомеразні ферменти здатні перетворювати зв’язки між важкими ланцюгами молекул IgG4 на зв’язки всередині ланцюга, і навпаки (Aalberse and Schuurman, Immunology 105:9-19 (2002)). Відповідно, оскільки пари важкий:легкий ланцюг (HL) в молекулах IgG4 із зв’язками всередині важкого ланцюга в шарнірній ділянці не зв’язані одна з одною ковалентними зв’язками, вони можуть роз'єднуватися в мономери HL, які далі повторно зв'язуються з мономерами HL, що походять з інших молекул IgG4, з утворенням біспецифічних, гетеродимерних молекул IgG4. В біспецифічному IgG антитілі дві Fab молекули антитіла відрізняються за епітопами, з якими вони зв'язуються. Заміна Ser228 в шарнірній ділянці IgG4 на Pro приводить до "IgG1-подібної поведінки", тобто молекули утворюють стійкі дисульфідні зв’язки між важкими ланцюгами і, таким чином, не зазнають обміну HL з іншими молекулами IgG4. В одному варіанті антитіла за винаходом будуть містити ділянку IgG4 Fc з мутацією S228P. Крім того, можуть бути видалені сайти, що в антитілах за винаходом впливають на зв'язування з рецепторами Fc, окрім запобіжного (salvage) рецептора FcRn. Наприклад, рецептори Fc, які беруть участь в здійсненні антитіло-залежної клітинної цитотоксичності (ADCC), можуть бути видалені з антитіл за винаходом. Наприклад, мутація Leu234/Leu235 в шарнірній ділянці IgG1 до L234A/L235A або мутація Phe234/Leu235 в шарнірній ділянці IgG4 до P234A/L235A мінімізує зв’язування FcR і зменшує здатність імуноглобуліну опосередковувати комплемент-залежну цитотоксичність та ADCC. В одному варіанті, антитіла за винаходом будуть включати ділянку IgG4 Fc з мутаціями P234A/L235A. В іншому варіанті винаходу антитіла будуть включати домен IgG4 Fc з мутаціями S108P, P114A і L115A, домен Fc, що має амінокислотну послідовність, показану в SEQ ID NO: 41. Приклад послідовності нуклеїнової кислоти, що кодує SEQ ID NO: 41, показаний в SEQ ID NO: 42. У важкому ланцюгу IgG4 з повною довжиною координати мутацій дорівнюють S228P, P234A і L235A. Молекули або фрагменти повністю людських, гуманізованих антитіл та антитіл з дозрілою спорідненістю знаходяться в межах винаходу, оскільки являють собою міметитіла, злиті білки та химерні білки. Антагоністи за винаходом можуть зв’язуватися 97229 20 з TLR3 із значенням Kd, що менше або дорівнює -7 -8 -9 -10 -11 -12 приблизно 10 , 10 , 10 , 10 , 10 або 10 M. Спорідненість даної молекули до рецептора TLR3, наприклад, hTLR3 може бути визначена експериментально з використанням будь-якого відповідного способу. В таких способах можуть бути використані інструменти Biacore або KinExA, а також аналізи ELISA або аналізи конкурентного зв'язування, відомі фахівцям в даній галузі. Молекули антагоністів, що зв'язуються з даним TLR3 гомологом з бажаною спорідненістю, можуть бути вибрані з бібліотек варіантів або фрагментів за методами, які включають дозрівання спорідненості антитіла та інші визнані в рівні техніки методи, придатні для молекул, що не є антитілами. Інший варіант винаходу являє собою вектор, який містить як мінімум один полінуклеотид за винаходом. Такі вектори можуть бути плазмідними векторами, вірусними векторами, векторами на базі транспозону або будь-якими іншими векторами, придатними для введення полінуклеотидів за винаходом в даний організм або генетичний код за допомогою будь-яких засобів. Інший варіант винаходу являє собою клітинухазяїн, що містить будь-який з полінуклеотидів за винаходом, наприклад, полінуклеотид, що кодує поліпептид, який містить SEQ ID NO: 9, SEQ ID NO: 11 і SEQ ID NO: 13, та полінуклеотид, що кодує поліпептид, який містить SEQ ID NO: 19, SEQ ID NO: 21 і SEQ ID NO: 23. Інші приклади клітинхазяїв містять полінуклеотид, що кодує поліпептид, який містить одну з SEQ ID NO: 25, 27, 29, 31, 45, 47, 49, 51 або 53, та полінуклеотид, що кодує поліпептид, який містить SEQ ID NO: 33, 35, 37 або 39. Такі клітини-хазяї можуть бути еукаріотними клітинами, бактеріальними клітинами, рослинними клітинами або іншими живими клітинами. Приклади еукаріотних клітин можуть походити із ссавців, комах, птахівабо інших тварин. Еукаріотні клітини ссавців включають безсмертні клітинні лінії, наприклад, клітинні лінії гібридом або мієломи, такі як мишачі лінії клітини SP2/0 (American Type Culture Collection [ATCC], Manassas, VA, CRL1581), NSO (European Collection of Cell Cultures [ECACC], Salisbury, Wiltshire, UK, ECACC No. 85110503), FO (ATCC CRL-1646) and Ag653 (ATCC CRL-1580) та Ag653 (ATCC CRL-1580). Прикладом клітинної лінії мієломи людини є U266 (ATTC CRLTIB-196). Інші придатні клітинні лінії включають лінії, одержані з клітин яєчнику китайського хом'яка (CHO), наприклад, CHO-Kl (ATCC CRL-61) або DG44. Інше варіант винаходу являє собою спосіб одержання антитіла, що реагує з TLR3, який включає культивування клітини-хазяїна за винаходом і добування антитіла, продукованого клітиноюхазяїном. Таке антитіло може являти собою антитіло-антагоніст TLR3, приклади якого наведені нижче, як mAb 1068, що містить амінокислотні послідовності важкого і легкого ланцюга, показані в SEQ ID NO: 6 і 16, відповідно, або гуманізований варіант CDR mAb 1068, який містить амінокислотні послідовності важкого ланцюга, показані в SEQ ID NO: 25, 27, 29, 31, 45, 47, 49, 51 або 53, таі амінокислотні послідовності легкого ланцюга, показані в 21 SEQ ID NO: 33, 35, 37 або 39. Інший варіант за винаходом являє собою лінію клітини гібридоми, яка продукує антитіло за винаходом. Способи лікування Даний винахід пропонує способи попередження і лікування станів, при яких бажаним є послаблення активності TLR3. Стани, які можна лікувати або попереджати за допомогою антагоністу TLR3, включають опосередковані цитокінами стани, а також стани, що повністю або частково є результатом активації TLR3 або проведення сигналу через шлях TLR3. Винахід включає спосіб інгібування клітинного продукування RANTES або RANTES разом з IL-6, IL-8 або MIP1-альфа, який включає забезпечення контакту антагоніста TLR3, наприклад, розкритого в даному описі ізольованого антитіла, з клітиною, яка експресує рецептор TLR3, протягом часу, достатнього для інгібування продукування вказаних цитокінів. Способи за винаходом можуть бути використані для лікування тваринного пацієнта, що належить до будь-якої класифікації. Приклади таких тварин включають ссавців, наприклад, людину, гризунів, собак, котів і сільськогосподарських тварин, а також тварин з інших класів, наприклад, птахів, рептилій та риб. Не обмежуючись будьякою конкретною теорією, ми вважаємо, що терапевтична користь антагоністів TLR3 буде результатом здатності таких антагоністів інгібувати секрецію прозапальних хемокінів і цитокінів, що відіграють роль в деяких запальних станах. Також вважається, що терапевтична користь антагоністів TLR3 буде результатом здатності таких антагоністів збільшувати проліферацію клітини і, таким чином, сприяти відновленню тканин. Наприклад, способи за винаходом є придатними для лікування або профілактики запальних станів і сприяння відновленню тканин (наприклад, при пораненні або опіку, що заживає після травматичного пошкодження) тканини пацієнта. Крім того, способи за винаходом також придатні для забезпечення щільності клітин in vitro. Будь-який антагоніст TLR3 може бути використаний в способах профілактики та лікування за винаходом. Як приклад, будь-яке з ізольованих антитіл, розкритих в даному описі, є придатним як антагоніст TLR3 для лікування або профілактики запальних станів або сприяння відновленню тканин. Конкретно, придатним є ізольоване антитіло, яке реагує з TLR3 та володіє антиген-зв'язуючою здатністю моноклонального антитіла, яке містить амінокислотні послідовності VH CDR, показані в SEQ ID NO: 9, SEQ ID NO: 11 і SEQ ID NO: 13, та амінокислотні послідовності VL CDR, показані в SEQ ID NO: 19, SEQ ID NO: 21 і SEQ ID NO: 23. Інші придатні антитіла містять VH, що має амінокислотну послідовність, показану в SEQ ID NO: 25, 27, 29, 31, 45, 47, 49, 51 або 53, та VL, що має амінокислотну послідовність, показану в SEQ ID NO: 33, 35, 37 або 39. Кількості даного антагоніста TLR3, достатні для лікування або профілактики даного запального стану, можуть бути легко визначені. У способах за винаходом антагоніст TLR3 може бути введе 97229 22 ний окремо або в комбінації як мінімум з однією іншою сполукою. Такі додаткові сполуки, можуть бути молекулами іншого антагоніста TLR3 або молекулами, терапевтична користь яких не опосередковується проведенням сигналу рецептором TLR3. Прикладами таких додаткових сполук є антибіотики, противірусні засоби, допоміжні засоби та інші сполуки, які зменшують рівні або активність цитокінів. В іншому варіанті способів лікування або профілактики запальних станів активність TLR3 зменшують шляхом інгібування експресії гена TLR3. Експресію гена TLR3 можна інгібувати будь-якими засобами, які зменшують експресію біологічної активності TLR3, з метою інгібування опосередкованого TLR3 проведення сигналу. Такі засоби включають, наприклад, інактивацію гена шляхом рекомбінації з інактивованою геномною ДНК (наприклад, ―нокаут‖ гена, вилучення промотора або інші способи здійснення мутагенезу гена) та інактивацію генного транскрипта (наприклад, шляхом сайленсингу РНК або анти-смислових РНК). Фахівцям в даній галузі буде відомо багато інших засобів для зменшення експресії активного TLR3. Таким чином, одним з аспектів винаходу є спосіб лікування або профілактики запального стану, який включає введення терапевтично ефективної кількості антагоніста TLR3 пацієнту, який потребує цього, протягом часу, достатнього для лікування або профілактики запального стану. Одним з прикладів таких запальних станів є стани, пов'язані із сепсисом. Сепсис являє собою системну реакцію на інфекцію, яка спричиняє недостатність органів і загибель у важких випадках. З медичної точки зору сепсис визначається як синдром системної запальної реакції (SIRS), що є результатом вірусної, бактеріальної, грибкової або паразитичної інфекції. Вивільнена вірусною, бактеріальною, грибковою або паразитичною інфекцією і некротичними клітинами подвійно звита РНК може сприяти виникненню сепсису. Пов'язані із сепсисом стани можуть включати SIRS, септичний шок або синдром множинної дисфункції органів (MODS). Не обмежуючись конкретною теорією, ми вважаємо, що лікування антагоністами TLR3 може забезпечити терапевтичну користь, збільшуючи тривалість життя (виживаність) пацієнтів, що страждають на пов'язані із сепсисом запальні стани, або попередити поширення місцевого запального явища (наприклад, в легені) до системного стану шляхом потенціювання вродженої антимікробної активності, виявлення синергетичної активності в комбінації з антимікробними агентами, мінімізації місцевого запального стану, що сприяє патології, або за допомогою будь-якої комбінації наведеного вище. Таке втручання може бути достатнім для створення можливості додаткового лікування (наприклад, лікування базової інфекції або зменшення рівня цитокінів), яке є необхідним для забезпечення виживання пацієнта. Іншим прикладом таких запальних станів є запальне захворювання кишечнику. Запальне захворювання кишечнику може бути хворобою Крона або виразковим колітом. Фахівцям в даній галузі відомі інші запальні захворювання кишечнику ві 23 домої або невідомої етіології, які спричиняють запалення кишечнику. Крім того, антагоністи TLR3 будуть придатними для лікування та профілактики позакишкових наслідків, пов'язаних з виразковим колітом або хворобою Крона, таких як артралгія та артрит, які включають анкілозивний спондиліт, сакроіліїт та псоріатичний спондилоартрит. Інші позакишкові наслідки включають ураження шкіри та слизових оболонок, наприклад, виразки ротової порожнини, вузлувату еритему (виникнення болісних затверділих овальних вузлів) та гангренозну піодермію, яка характеризується глибокими важкими виразками шкіри; офтальмологічні ускладнення, такі як епісклерит, запалення райдужної оболонки ока та увеїт; ниркові захворювання, такі як нефролітіаз; захворювання печінки та жовчовивідних шляхів, такі як первинний склерозивний холангіт — хронічне захворювання печінки, що характеризується фіброзним запаленням, пов'язаним з виразковим колітом або хворобою Крона; та захворювання кісток, в тому числі остеопороз та остеопенію, які можуть виникати як ускладнення тривалого введення кортикостероїдів. Також охоплюється індукована запальним захворюванням кишечнику легенева дисфункція і розлади дихальної системи, в тому числі інтерстиціальний пневмоніт, стеноз трахеї, бронхіоліт, облітеруючий бронхіоліт, що спричиняє пневмонію, легеневий васкуліт, саркоїдоз, хронічний бронхіт та клінічні стани, при яких виникають легеневі інфільтрати з еозинофілією. Іншим прикладом таких запальних станів є пов'язані з інфекцію стани, що можуть включати вірусну або бактеріальну пневмонію, зокрема важку пневмонію, цистофіброз, бронхіт, загострення з боку дихальних шляхів і синдром гострого респіраторного дистресу (ARDS). Такі пов'язані з інфекцією стани можуть включати множинні інфекції, такі як первинна вірусна інфекція і вторинна бактеріальна інфекція. Ще одним прикладом таких запальних станів є запальний легеневий стан. Приклади запальних легеневих станів включають спричинені інфекцією легеневі стани, зокрема, пов'язані з вірусними, бактеріальними, грибковими, паразитарними або пріонними інфекціями; спричинені алергеном легеневі стани; спричинені забруднюючим агентом легеневі стани, такі як асбестоз, силікоз або бериліоз; спричинені аспірацією вмісту шлунку легеневі стани; порушення регуляції імунної системи, генетично обумовлені запальні легеневі стани, такі як цистофіброз; а також спричинені фізичною травмою легеневі стани, такі як спричинене вентилятором ураження. Вказані запальні стани також включають астму, емфізему, бронхіт, ХОЗЛ, саркоїдоз, гістіоцитоз, лімфангіоміоматоз, гостре ураження легень, синдром гострої дихальної недостатності, хронічне захворювання легень, бронхолегеневу дисплазії, позагоспітальну пневмонію, госпітальну пневмонію, пов'язану з вентилятором пневмонію, сепсис, вірусну пневмонію, грипозну інфекцію, парагрипозну інфекцію, інфікування метапневмовірусом людини, інфікування респіраторним синцитіальним вірусом та Aspergillus або інші грибкові інфекції. 97229 24 Інші приклади таких запальних станів являють собою діабет 2 типу, ожиріння, дисліпідемію та метаболічний синдром. Антагоністи TLR3 є придатними для інгібування запальних процесів, пов'язаних з ожирінням та інсулінорезистентністю. Інгібування проведення сигналу TLR3 буде покращувати ліпідний профіль пацієнта, а саме зменшувати рівні загального холестерину та збільшувати співвідношення ЛПВЩ/ЛПНЩ. Інгібування проведення сигналу TLR3 також буде приводити до збільшення секреції інсуліну, таким чином, приводячи до покращення інсулінорезистентності. Існуючі засоби для лікування діабету 2 типу пов'язані з численними шкідливими побічними ефектами, в тому числі гіпоглікемією і збільшенням маси тіла. Очікується, що використання антагоніста TLR3 для лікування діабету 2 типу буде супроводжуватися меншою кількістю побічних ефектів і постійним фармакокінетичним профілем. Крім того, лікування сполукою, яка має тривалий період напіввиведення, такою як ізольоване антитіло за винаходом, вимагає менш частого введення доз. Додатково, покращення ліпідного профілю ймовірно буде затримувати або запобігати розвитку серцево-судинних захворювань, пов'язаних з ожирінням та діабетом 2 типу, таких як атеросклероз. Крім того, інгібування проведення сигналу TLR3 може приводити до зростання рівнів інсуліну в кровотіку шляхом прямої дії на острівцеві клітини підшлункової залози або впливу на ліпідний профіль і захищення острівців від пошкодження, індукованого високими рівнями ліпідів. Таким чином, інгібування TLR3 окремо або в комбінації з іншим лікуванням, ймовірно буде віддаляти необхідність в інсулінотерапії для хворих на діабет 2 типу та дозволить уникнути небажаних побічних ефектів, пов'язаних з інсулінотерапією. Крім того, пацієнти з гепатитом C та ВІЛінфекцією є схильними до розвитку інсулінорезистентності та діабету 2 типу внаслідок накопичення ліпідів в печінці або нездатності печінки відповідати на стимуляцію інсуліном внаслідок цирозу або фіброзу, які є результатом дії лікарських засобів. Інгібування проведення сигналу TLR3 за допомогою антагоністу TLR3 може бути спрямоване як на інфекцію, так і на інсулінорезистентність у цій популяції надзвичайно ―скомпрометованих‖ пацієнтів. Інші запальні стани і невропатії, які можна лікувати або попереджати у відповідності до способу за винаходом, включають множинний склероз, склерозивний еритематозний вовчак, а також нейродегенеративні розлади та розлади центральної нервової системи (ЦНС), в тому числі хворобу Альцгеймера, хворобу Паркінсона, хворобу Хантингтона, біполярний розлад та аміотрофний латеральний склероз (АЛС), захворювання печінки, в тому числі фіброз, гепатит С (HCV) та гепатит В (HBV), артрит, ревматоїдний артрит, псоріатичний артрит і ювенільний ревматоїдний артрит (JRA), остеопороз, остеоартрит, панкреатит, фіброз, енцефаліт, псоріаз, гігантськоклітинний артеріїт, анкілозивний спондиліт, аутоімунний гепатит, вірус імунодефіциту людини (ВІЛ), запальні стани шкіри, трансплантат, рак, алергію, 25 ендокринні захворювання, інші аутоімунні розлади та гіперчутливість дихальних шляхів. Інший аспект даного винаходу являє собою спосіб збільшення швидкості проліферації клітини, який включає зменшення активності TLR3 в клітині, наприклад, забезпечення контакту клітини з антагоністом TLR3. В одному варіанті цього аспекту винаходу клітина може походити з такої тканини, як епітелій або тканина ободової кишки. Епітеліальні клітини можуть походити з будь-якої епітеліальної тканини, такої як епітелій шлунковокишкового тракту, епітелій шкіри, епітелій легень або бронхолегеневий епітелій. Запальні стани можуть вражати будь-яку тканину, таку як серцева тканина і тканини шлунково-кишкового тракту, призводячи до структурних і функціональних аномалій в порівнянні з нормальною тканиною. У деяких випадках такі запальні стани можуть бути результатом генетичних факторів або інфекції. В інших ситуаціях такі запальні стани можуть бути результатом травматичних пошкоджень, таких як опіки. Фахівцям в даній галузі відомі численні запальні стани і пов'язані з ними патології різноманітних залучених тканин. Інший аспект винаходу являє собою спосіб лікування стану, що є результатом загибелі клітин, який включає введення терапевтично ефективної кількості антагоніста TLR3 пацієнту, який потребує цього, протягом часу, достатнього для лікування стану. Інший аспект винаходу являє собою спосіб профілактики стану, що є результатом загибелі клітини, який включає введення терапевтично ефективної кількості антагоніста TLR3 пацієнту, який потребує цього, протягом часу, достатнього для запобігання стану. Введення / Фармацевтичні композиції Спосіб введення для терапевтичного застосування антагоністів за винаходом може бути будьяким придатним способом, який доставляє агент хазяїну. Білки, антитіла, фрагменти антитіл і міметитіла, а також фармацевтичні композиції вказаних агентів є особливо придатними для парентерального введення, тобто підшкірного, внутрішньом'язового, внутрішньошкірного, внутрішньовенного, інтраназального або інгаляційного. Антагоністи за винаходом можуть бути виготовлені у вигляді фармацевтичні композицій, що містять ефективну кількість антагоніста, як активний інгредієнт, у фармацевтично прийнятному носії. Переважною є водна суспензія або розчин, що містить антагоніст, переважно буферизований при фізіологічних значеннях pH, у формі, готовій для ін'єкції. Композиції для парентерального введення звичайно включають розчин антагоніста за винаходом або його коктейль, розчинений у фармацевтично прийнятному носії, переважно водному носії. Можуть бути використані різноманітні водні носії, наприклад, 0,4 % сольовий розчин, 0,3 % розчин гліцину і т. п. Такі розчини є стерильними і загалом вільними від механічних включень. Вказані розчини можуть бути стерилізовані за допомогою традиційних, добре відомих методів стерилізації (наприклад, фільтрацією). Композиції можуть містити фармацевтично прийнятні допомі 97229 26 жні речовини, необхідні для наближення умов до фізіологічних, наприклад, агенти для корекції pH та буферні агенти, і т. п. Концентрація антагоніста за винаходом в такому фармацевтичному препараті може варіювати в широких межах, тобто, від менш ніж приблизно 0,5 %, звичайно від як мінімум приблизно 1 %, до 15 % або 20 % по масі, і буде вибиратися перш за все на базі показників об’єму рідини, в'язкості і т. п., у відповідності до конкретного вибраного способу введення. Таким чином, фармацевтична композиція за винаходом для внутрішньом'язової ін'єкції може містити 1 мл стерильної буферизованої води і від приблизно 1 нг до приблизно 100 мг, наприклад, від приблизно 50 нг до приблизно 30 мг або, більш переважно, від приблизно 5 мг до приблизно 25 мг антагоніста за винаходом. Подібним чином фармацевтична композиція за винаходом для внутрішньовенної інфузії може містити приблизно 250 мл стерильного розчину Рингера та від приблизно 1 мг до приблизно 30 мг, переважно, від 5 мг до приблизно 25 мг антагоніста за винаходом. Способи виготовлення композицій для парентерального введення добре відомі і детально описані, наприклад, в "Remington's Pharmaceutical Science", 15th ed., Mack Publishing Company, Easton, PA. Антагоністи за винаходом, якщо вони мають форму фармацевтичного препарату, можуть існувати у формі дозованої лікарської форми. Відповідна терапевтично ефективна доза може бути легко визначена фахівцями в даній галузі. При необхідності введення вибраної дози може повторюватися з відповідними проміжками часу, належним чином визначеними лікарем протягом періоду лікування. Антагоністи за винаходом можуть бути ліофілізовані для зберігання та відтворення у відповідному носії перед застосуванням. Ефективність цієї техніки продемонстрована для традиційних імуноглобулінів та білкових препаратів, і можуть використовуватися методи ліофілізації та відтворення, відомі з рівня техніки. Антагоністи можуть бути введені за будь-яким способом, який забезпечує доставку таких молекул в клітини. У випадку клітини in vitro введення антагоніста може бути здійснено, наприклад, шляхом додавання антагоніста в середовище для культивування. У випадку клітини in vivo введення антагоніста може бути здійснено, наприклад, шляхом внутрішньовенної ін’єкції антагоніста в тварину або тканину. Фахівцям в даній галузі відомі інші засоби для введення антагоністів в клітину in vitro або in vivo. Такі засоби також включають методи доставки агента хазяїну, які обговорювалися вище. Даний винахід далі буде описаний з посиланням на наступні конкретні, не обмежуючі приклади. Приклад 1 Ідентифікація анти-hTLR3 антагоністів mAb Антагоністи анти-hTLR3 mAb, здатні блокувати проведення сигналу через рецептор hTLR3, були ідентифіковані за допомогою клітинних скринінгових аналізів. Пул гібридом, які продукують антиhTLR3 mAb, генерували у мишей BALB/C з використанням стандартних методів (Kohler et a.1., 27 1976). Мишей імунізували hTLR3 шляхом внутрішньоклітинних ін’єкцій плазмідної ДНК, що кодують амінокислоти 1-703 hTLR3 (SEQ ID NO: 3). Амінокислоти 1-703 відповідають передбаченій позаклітинній ділянці hTLR3 (SEQ ID NO: 4). Мишам спочатку вводили ін’єкційно 10 мкг плазмідної ДНК, з другою ін’єкцією 10 мкг плазмідної ДНК через 2 тижні. Бустерну ін’єкцію 15 мкг ДНК вводили кожній миші через 2 тижні після другої ін’єкції 10 мкг плазмідної ДНК. За три дні до початку злиття В-клітин мишам внутрішньовенно вводили 15 мкг білку hTLR3 в буферизованому фосфатом сольовому розчині (ФБР; 10 мМ фосфату, 150 мМ NaCl, pH 7,4). Далі селезінку імунізованих мишей збирали і здійснювали злиття В-клітин з використанням стандартних методів (Kohler et a.1., 1976). Селекцію гібридом здійснювали з використанням середовища, яке містило гіпоксантин-аміноптерин-тимідин, та здійснювали скринінг спочатку на анти-TLR3 антитіла за допомогою аналізу з використанням зв'язаного з ферментом імуносорбенту (ELISA). Окремі гібридоми, які продукують анти-hTLR3 mAb, клонвали шляхом обмеженого розведення. Гібридоми, які продукують анти-TLR3 антагоністи mAb, ідентифікували за допомогою клітинних скринінгових аналізів з використанням лінії епітеліальних клітин легені людини A549, яка стабільно надмірно експресує hTLR3. Клітини A549 (ATCC CRL: CCL-185), використані для утворення скринінгових і контрольних ліній клітин для проведеннях вказаних випробувань, одержували з American Type Culture Collection (Manassas, VA). Лінія клітин для скринінгу являла собою клітинну лінію, одержану з A549, яка названа A549-hTLR3. Клітини A549-hTLR3 стабільно трансфікували плазмідним вектором експресії ссавців, що кодує hTLR3 і ген резистентності до неоміцину. Контрольна лінія клітини, одержана з A549, мала назву A549-neo. Клітини A549-neo стабільно трансфікували плазмідним вектором експресії ссавців, що кодує тільки ген резистентності до неоміцину. Такі стабільно трансфіковані лінії клітин одержували шляхом трансфекції Lipofectamine® (Invitrogen, Inc., Carlsbad, CA) у відповідності до інструкцій виробника і стандартних способів селекції та клонування. Клітини A549-hTRL3 і A549-neo культивували в стандартних умовах в мінімальному підтримуючому середовищі (MEM), яке містило 10 % ембріональної бичачої сироватки, 1 % MEM замінних амінокислот (Gibco Invitrogen, Inc., Carlsbad, CA), 1 мМ глутаміну, 1 мМ натрію пірувату, 20 мМ HEPES та 0,5 мг/мл G418. Клітинні скринінгові аналізи з використанням клітин A549-hTLR3 ідентифікували один mAb антагоніст hTLR3, позначений mAb 1068. Принцип, що лежить в основі даних скринінгових аналізів, полягав в тому, що стимуляція полі(I:C) рецептора hTLR3, присутнього в клітинах A549-hTLR3, приводить до збільшеного продукування цитокіну клітиною. Кандидат-антагоніст hTLR3 mAb, ідентифікований за допомогою скринінгових аналізів, буде інгібувати опосередковане полі(I:C) проведення сигналу через рецептор hTLR3 в клітинах A549hTLR3 і спричиняти зниження продукування цитокіну в порівнянні з контрольними клітинами 97229 28 A549-hTLR3, які не контактували з mAb. Скринінгові аналізи здійснювали шляхом інкубування клітин A549-hTLR3 з досліджуваним mAb протягом 30 хвилин при 37 °C перед додаванням 5 мкг/мл полі(І:C) (Amersham Biosciences Corp., Piscataway, NJ); через 24 години рівні цитокінів вимірювали в супернатантах культури клітин. Контрольні клітини A549-hTLR3 обробляли таким же чином, але ці клітини не інкубували з досліджуваним mAb. Багатоканальний аналіз Luminex® (Luminex Corp., Austin, TX) та специфічними для IL-6 (інтерлейкін-6), IL-8 (інтерлейкін-8), RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted; хемокін, що виділяється Т-клітинами при активації) кон'югованими з mAb гранулами використовувався у відповідності до інструкцій виробника для вимірювання рівнів продукування цитокінів клітинами в скринінгових аналізах. Антагоніст mAb 1068, що зв'язує HTLR3, був ідентифікований в ході таких аналізів. Послідовності нуклеїнової кислоти важкого і легкого ланцюга, що кодують важкий і легкий ланцюги mAb 1068, клонували з гібридомою, що експресує mAb 1068, з використанням стандартних методів. Послідовність нуклеїнової кислоти та амінокислотна послідовність важкого ланцюга та легкого ланцюга mAb 1068 показані на Фігурах. 1 і 2 та в SEQ ID NO. 6 і 16, відповідно. Лінії клітин, що включають послідовності нуклеїнової кислоти як важкого ланцюга, так і легкого ланцюга, які кодують рекомбінантний mAb 1068 (r1068), генерували з використанням стандартних способів. Приклад 2 Інгібування антагоністом hTLR3 продукування цитокінів IL-6, IL-8 і RANTES в клітинах, одержаних з легені людини Специфічні аналізи цитокінів IL-6, IL-8 і RANTES здійснювали шляхом інкубування клітин A549-hTLR3 з mAb 1068 або TLR3.7 mAb протягом 30 хвилин при температурі 37 C перед додаванням 5 мкг/мл полі(I:C) (Amersham Biosciences Corp., Piscataway, NJ), як показано на Фіг. 3, Фіг. 4 і Фіг. 5. Рівні цитокінів в супернатантах культури клітин вимірювали через 24 години з використанням приладу Luminex® (Luminex Corp., Austin, TX) та специфічних для IL-6, IL-8 або RANTES mAb кон'югованих гранул, відповідно. Аналізи Luminex® для кожного цитокіну здійснювали у відповідності до інструкцій виробника. Результати показують, що антагоніст hTLR3 mAb 1068 інгібує hTLR3-опосередковане продукування цитокінів IL-6 (Фіг. 3), IL-8 (Фіг. 4) і RANTES (Фіг. 5) в клітинах A549-hTLR3, одержаних з легеневого епітелію людини. Однак, hTLR3специфічний мишачий mAb TLR3.7 (eBioscience, San Diego, CA) не інгібував hTLR3опосередкованого індукованого полі(I:C) продукування IL-6 (Фіг. 3) і IL-8 (Фіг. 4) до такої ж міри, як mAb 1068. Щодо продукування (Фіг. 5) RANTES в цих клітинах, одержаних з легень людини, та mAb 1068 інгібував продукування, тоді як mAb TLR3.7 збільшував продукування RANTES. Зазначені відмінності між mAb 1068 і mAb TLR3.7 є важливими, оскільки попередня робота свідчила про те, що TLR3.7 mAb може здійснювати антагонізм по від 29 ношенню до рецептора hTLR3 (Matsumoto M. et al., Biochem. Biophys Res. Commun. 24:1364-1369 (2002)). Така попередня робота виявила, що TLR3.7 mAb, здається, інгібує продукування IFN-, індуковане полі(I:C) в клітинах MRC-5, одержаних з фібробластів людини (Matsumoto M. et al., Biochem. Biophys Res. Commun. 24:1364-1369 (2002)). Результати чітко вказують на те, що антагоніст hTLR3 mAb 1068 інгібує продукування більш широкого спектру цитокінів, ніж TLR3.7 mAb, і що вказані два mAb можна відрізнити один від одного на базі цих фактів. Приклад 3 Інгібування антагоністом hTLR3 інгібує продукування цитокінів MIP1-альфа та IL-6 в первинних бронхоепітеліальних клітинах людини Антагоніст hTLR3 mAb 1068 інгібує hTLR3опосередковане продукування цитокінів MIP1альфа (Фіг. 6) і IL-6 (Фіг. 7) в первинних бронхоепітеліальних клітинах людини. Специфічні аналізи цитокінів MІP1-альфа та IL-6 здійснювали шляхом інкубування первинних бронхо-епітеліальних клітин людини з mAb 1068 або препаратом неспецифічного поліклонального IgG миші протягом 30 хвилин при температурі 37 C перед додаванням 5 мкг/мл полі(I:C) (Amersham Biosciences Corp., Piscataway, NJ), як показано на Фіг. 6 або Фіг. 7. Рівні цитокінів в супернатантах культури клітин вимірювали через 24 години з використанням приладу Luminex® (Luminex Corp., Austin, TX) та специфічних MIP1-альфа або IL-6 mAb кон'югованих гранул, відповідно. Аналізи Luminex® для кожного цитокіну здійснювали у відповідності до інструкцій виробника. Первинні бронхо-епітеліальні клітини людини добували із зразків людської тканини і культивували з використанням стандартних способів. Приклад 4 ―Нокаутування‖ активності TLR3 зменшує важкість симптомів запального захворювання кишечнику Важкість симптомів запального захворювання кишечнику (ЗЗК) була зменшена на мишачій моделі ЗЗК шляхом ―нокаутування‖ активності гена рецептора TLR3 (Фіг. 8). Хвороба Крона і виразковий коліт можуть бути змодельовані у тварин, які споживають натрію декстран сульфат (НДС) (Hendrickson B.A. et al. , Clin Microbiol Rev. 15:79-94, 2002). Симптоми, які спостерігаються в таких тваринних моделях, включають істотне зменшення маси тіла (Фіг. 8) та утворення виразок епітеліалію. Зазначені симптоми імітують симптоми, які спостерігаються у хворих на ЗЗК, наприклад, виразковий коліт або хворобу Крона. В описаній мишачій моделі ЗЗК у оброблених НДС TLR3 ―нокаутованих‖ мишей не спостерігалося істотного зниження маси тіла (Фіг. 8), і за даними гістопатологічного аналізу розвивалося менш виражене пошкодження епітеліальних клітин в порівнянні з обробленими НДС мишами дикого типу. Одержані результати вказують на те, що проведення сигналу TLR3 може відігравати критичну роль в запальних процесах, наприклад, таких, які виникають при ЗЗК. В цих експериментах кожній з самок мишей 97229 30 дикого типу C57BL/6 або TLR3 ―нокаутованих‖ мишей (Alexopoulou et al., Nature, 423:732-738 (2001)) вводили 5 % (мас./об.) натрію декстрану сульфату (НДС) у питній воді для індукування гострого виразкового коліту або надавали питну воду ad libitum, як показано на Фіг. 8, протягом 5 днів. Вік всіх мишей становив 6-8 тижнів, і кожна група складалася як мінімум з 5 мишей. Розвиток коліту після обробки НДС оцінювали, спостерігаючи за змінами маси тіла (Фіг. 8), маси ободової кишки, консистенцією фекалій, ректальною кровотечею та гістопатологією ободової кишки. Всі зазначені оцінки здійснювали у відповідності до директив Комітету із догляду та використання тварин в установах (IACUC). Дані на Фіг. 8 наведені, як відсоток змін маси тіла в дні обробки 1–5. Кожне позначення представляє дані для однієї миші. WT позначає мишей дикого типу, KO позначає TLR3 ―нокаутованих‖ мишей. Горизонтальні лінії показують середнє значення. Наведені дані являють собою об’єднані дані трьох незалежних експериментів. Контрольні миші дикого типу і TLR3 ―нокаутовані‖ миші, які не одержували НДС (Фіг. 8) продемонстрували подібні зміни маси тіла (P = 0,6, t-тест). Миші дикого типу і TLR3 ―нокаутовані‖ миші, які одержували НДС (Фіг. 8) продемонстрували значущу відмінність у змінах маси тіла (P = 0,003, tтест). Ободову кишки для гістопатологічних аналізів добували з тварин на 5-й день експерименту. Ободову кишку фіксували в парафіні, нарізали та забарвлювали гематоксиліном та еозином з використанням стандартних способів. Характерні зрізи ободової кишки мишей дикого типу, які одержували НДС, демонстрували виразки слизової оболонки і щільні запальні інфільтрати, а також зниження кількості крипт і келихоподібних клітин. Характерні зрізи ободової кишки TLR3 ―нокаутованих‖ мишей, які одержували воду без добавок, мали морфологію і гістологію, подібні до тих, що спостерігалися в ободовій кишці мишей дикого типу, які одержували воду без добавок. Характерні секції ободової кишки TLR3 ―нокаутованих‖ мишей, які одержували НДС, містили певну кількість щільних клітинних інфільтратів, але демонстрували інтактний з інших точок зору епітелій слизової оболонки і мінімальне зниження кількості келиховидних клітин. Одержані гістопатологічні дані вказують на те, що у TLR3 ―нокаутованих‖ мишей, які одержували НДС, розвивалися менш виражені виразки епітелію, ніж у мишей дикого типу, які одержували НДС, і виявили, що активність TLR3 може відігравати критичну роль в запальних процесах, наприклад, таких, які мають місце при ЗЗК. Приклад 5 Лікування антагоністом hTLR3 зупиняє зниження маси тіла, пов’язане із запальним захворюванням кишечнику Лікування антагоністом hTLR3 зменшує вираженість пов’язаного із запальним захворюванням кишечнику (ЗЗК) зменшення маси тіла на мишачій моделі ЗЗК (Фіг. 9). Дані виявили, що лікування антагоністом TLR3 може пом'якшувати симптоми, пов'язані з ЗЗК, таким як виразковий коліт і хвороба Крона. Додатково, одержаний результат вказує 31 на те, що проведення сигналу TLR3 може відігравати важливу роль в запальних станах, таких як ЗЗК. В цих експериментах кожній з самок мишей дикого типу C57BL/6 вводили 5% (мас./об.) натрію декстрану сульфату (НДС) у питній воді для індукування гострого виразкового коліту або надавали питну воду ad libitum, як показано на Фіг. 9, протягом 5 днів. 0,2 мг mAb 1068 в носії ФБР, 0,2 мг препарату неспецифічного поліклонального антитіла IgG миші в носії ФБР, або тільки носій ФБР вводили мишам внутрішньочеревинною ін'єкцією щодня протягом перших 4 днів обробки НДС, як показано на Фіг. 9. Кожна ін'єкція включала 0,9 мл mAb або препарату неспецифічного IgG в ФБР або тільки 0,9 мл носія ФБР. Вік всіх мишей становив 6-8 тижнів, і кожна група складалася як мінімум з 5 мишей. Розвиток коліту після обробки НДС оцінювали, спостерігаючи за змінами маси тіла (Фіг. 9), маси ободової кишки, консистенцією фекалій, ректальною кровотечею та гістопатологією ободової кишки. Всі зазначені оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин в установах. Дані на Фіг. 9 наведені, як відсоток змін маси тіла в дні обробки 1–4. Кожне позначення представляє дані для однієї миші. Горизонтальні лінії показують середнє значення. Наведені дані являють собою об’єднані дані двох незалежних експериментів. Не спостерігалося істотної різниці в змінах маси тіла поміж мишами, які одержували НДС і mAb 1068, та мишами, які не одержували НДС (P > 0,05, тест Дунна; Фіг. 9). Зміни маси тіла у мишей, які одержували НДС і mAb 1068, істотним чином відрізнялися від змін маси тіла, які спостерігалися у мишей, що одержували НДС і неспецифічний IgG в ФБР або тільки ФБР (P < 0,01 в обох випадках; тест Дунна; Фіг. 9). Приклад 6 Зменшення вираженості хронічного коліту у TLR3 ―нокаутованих мишей‖ або мишей, лікованих антагоністом hTLR3 У всіх дослідженнях використовували самок мишей C57BL/6 дикого типуі TLR3 ―нокаутованих‖ мишей (KO) на базі C57BL/6 віком 6-8 тижнів (Alexopoulou et al., Nature 413:732-738, (2001)). Загалом здійснювали три цикли введення мишам 2 % (мас./об.) натрію декстрану сульфату (НДС) в питній воді (Okayasu et al., Gastroenterology 98:694-702 (1990)). Воду з НДС надавали ad libitum протягом 5 днів для індукції виразкового коліту, після чого надавали питну воду протягом 9 днів. Другий 5-денний цикл 2 % НДС розпочинали на 14-й день, після чого тварини відпочивали протягом 9 днів. Третій цикл 2 % НДС тривалістю 7 днів розпочинали в день 28. Мишей умертвляли в двох різних точках часу: або після другого періоду відпочинку на 25-й день дослідження, або після третього циклу НДС в 37-й день дослідження. Кожна група лікування складалася як мінімум з 8 мишей. Розвиток коліту оцінювали, спостерігаючи зміни маси тіла протягом експерименту, а також оцінювали інші параметри після умертвіння, в тому числі довжину ободової кишки, масу ободової кишки, консистенцію фекалій, ректальну кровотечу, а та 97229 32 кож гістопатологію ободової кишки після обробки НДС. Гістопатологію оцінював незалежний ветеринарний патолог всліпу щодо дизайну експерименту. Повздовжні секції ободової кишки були оцінені в балах щодо змін, в тому числі некрозу епітеліальних клітини, утворення виразок та відлущування епітелію, втрати крипт, проліферації клітин крипт, утворення грануляційної тканини у власній пластинці, грануляційної тканини в підслизовій, клітинного інфільтрату запаленої підслизової і набряку підслизової. Бали надавали з урахуванням розпосюдження пошкоджень як вказано нижче: 0, немає; 1, легкий, вогнищеві; 2, легкий, багатовогнищеві; 3, помірний, часто виявляється, але на обмежених ділянках; 4, виражений, часто виявляється в багатьох ділянках наданої тканини; 5, дуже тяжкий, поширюється на великі частини наданої тканини. Статистичний аналіз виконували з використанням тесту Стьюдента (JMP, SAS Institute; GraphPad Prism). Симптоми у пацієнтів з виразковим колітом і хворобою Крона включають зниження маси тіла, присутність крові в фекаліях, а також утворення виразок епітеліального шару в ободовій кишці. Таким чином, симптоми, індуковані у оброблених натрію декстрану сульфатом мишей, частково імітують симптоми, які спостерігаються у пацієнтів з виразковим колітом або хворобою Крона (Hendrickson et al., Clin. Microbiol. Rev. 15:79-94 (2002)). Кожен цикл споживання НДС індукує зниження маси тіла в даній моделі, як у мишей дикого типу, так і у мишей TLR3 KO. Однак, миші TLR3 KO зазнають значно меншого зниження маси тіла, ніж миші дикого типу. Миші TLR3 KO також демонструють меншу вираженість захворювання за оцінками розгорнутих вимірювань запалення і пошкодження ободової кишки: скорочення ободової кишки у мишей TLR3 KO було значно меншим, ніж те, що спостерігалося у мишей WT, і миші TLR3 KO продемонстрували набагато нижчу частоту ректальних кровотеч. Дані гістопатологічної оцінки пошкодження слизової оболонки ободової кишки узгоджувалися з даними вказаних розгорнутих вимірювань. Середні значення балів некрозу окремих клітин, утворення виразок епітелію, відлущування епітелію, зменшення крипт та абсцеси крипт були нижчими для мишей TLR3 KO, ніж для мишей WT. Сумарно одержані дані показують, що відсутність проведення сигналу TLR3 забезпечує частковий захист від захворювання на мишачій моделі хронічного коліту, і свідчать про те, що проведення сигналу TLR3 ймовірно загострює тяжкість захворювання ЗЗК у людини. Для того, щоб додатково продемонструвати роль TLR3 в модуляції захворювання, мишей WT C57BL/6 лікували анти-TLR3 антагоністом mAb 1068. Групи оброблених НДС мишей одержували 0,2 мг анти-TLR3 mAb 1068 профілактично (починаючи з першого циклу НДС, "Pr"), або "терапевтично" (починаючи з другого циклу НДС, "Th"; Фіг. 35). Контрольні групи оброблених НДС мишей одержували ФБР (контроль, розчинник), або 0,2 мг неспецифічного mAb (негативний контроль). Додаткова контрольна група не одержувала 33 НДС. Зірочки на Фіг. 35 представляють точки часу введення доз анти-TLR3 антагоніста mAb. Кожен цикл споживання НДС закінчувався зниженням маси тіла у всіх групах оброблених НДС мишей (Фіг. 36). Кожне позначення на Фіг. 36 представляє середнє значення як мінімум для 8 мишей, лінії помилок представляють середнє квадратичне відхилення. НДС вводили в дні 0–4, 14– 18 і 28–35. Однак, групи, які одержували лікування анти-TLR3 mAb продемонстрували менше зниження маси тіла і швидше відновлення маси тіла після 2-го циклу НДС в порівнянні з групами, що одержували ФБР або контрольний mAb (Фіг. 37). Зниження маси тіла після 3-го циклу НДС було також набагато меншим в групах, що одержували анти-TLR3 mAb (Фіг. 38). Середнє зниження маси тіла нетто з початку експерименту вивчення (День 0) до кінця дослідження (День 37) становило приблизно 20 % для оброблених НДС мишей, які одержували ФБР або контрольне mAb. Лікування анти-TLR3 mAb істотно зменшувало зниження маси тіла, до приблизно 10 % (Фіг. 39). Дані на Фіг. 39 наведені як % зміни маси тіла з початку експерименту (День 0) до кінця дослідження (День 37), таким чином, що позитивні значення показують збільшення маси тіла нетто, та від’ємні значення кількості показують зменшення маси тіла нетто. Відсоток зменшення маси тіла в групах, що одержували анти-TLR3 mAb, був значно меншим в порівнянні з групами, що одержували контрольний розчинник (ФБР) або неспецифічний IgG (профілактичне лікування анти-TLR3 [анти-TLR3 P] проти ФБР, P = 0,006; анти-TLR3 P проти неспецифічного IgG, P = 0,006); терапевтичне лікування антиTLR3 [анти-TLR3 Th] проти ФБР, P = 0,001; антиTLR3 Th проти неспецифічного IgG, P = 0,009). Кожне позначення представляє одну мишу; горизонтальні лінії представляють середнє значення. Лікування анти-TLR3 mAb також зменшувало ступінь скорочення ободової кишки. Довжина ободової кишки в групах мишей, які одержували антиTLR3 mAb з профілактичною або терапевтичною метою, була істотно більшою за довжину в групі розчинника або контрольного mAb (Фіг. 40). (антиTLR3 P проти ФБР, P = 0,009; анти-TLR3 P проти неспецифічного IgG, P = 0,01; анти-TLR3 Th проти ФБР, P = 0,03; анти-TLR3 Th проти неспецифічного IgG, P = 0,04). До того ж, пошкодження слизової оболонки ободової кишки було значно менш вираженим в групі, яка одержувала анти-TLR3 mAb з терапевтичною метою, в порівнянні з контрольними групами, які одержували ФБР або неспецифічний контрольний mAb, що оцінювали за легкими гістопатологічними змінами (зокрема, некроз епітеліальних клітини, випадіння крипт, утворення виразок та відлущення епітелію, втрата крипт і проліферація клітин крипт) та хронічними репаративними гістопатологічними змінами (зокрема, утворення грануляційної тканини в пластинці, грануляційна тканина в підслизовій, інфільтрація підслизової запальними клітинами і набряк підслизової; Фіг. 41a). Дані, показані на графіках, представляють сумарні значення для всіх гістопатологічних балів, суми для легких змін або суми для хронічних змін 97229 34 в кожній групі мишей, які одержали НДС і різні схеми лікування (Групи: 1, розчинник ФБР; 3, антиTLR3 mAb з профілактичною метою; 4, анти-TLR3 mAb з терапевтичною метою; 5, неспецифічний контрольний mAb). Круги в правій частині кожного графіку включають відмітки середніх значень і значень середнього квадратичного відхилення для кожної групи. Статистично істотні відмінності між групами представлені як круги з мінімальним перекриттям. Зокрема, лікування анти-TLR3 mAb зменшувало утворення епітеліальних виразок та запобігало утворенню грануляційної тканини в підслизовій і власній пластинці в порівнянні з групами ФБР або неспецифічного mAb (Фіг. 41b). Дані, наведені на графіках, представляють бали гістопатологічної оцінки для кожної групи мишей, які одержували НДС і різні схеми лікування (Групи: 1, розчинник ФБР; 3, анти-TLR3 mAb з профілактичною метою; 4, анти-TLR3 mAb з терапевтичною метою; 5, неспецифічний контрольний mAb). Круги в правій частині кожного графіку включають відмітки середніх значень і значень середнього квадратичного відхилення для кожної групи. Статистично істотні відмінності між групами представлені як круги з мінімальним перекриттям. Для визначення потенціальних імунних корелятів забезпеченого анти-TLR3 захисту, досліджували популяції імунних клітин і системні рівні цитокінів. Виявлено, що дія НДС супроводжувалася збільшенням кількості активованих T-клітин в селезінці та брижових лімфатичних вузлах (Фіг. 42), що узгоджується з опублікованими звітами, які демонструють залучення T-клітин в цій моделі хронічного коліту. Флоуцитометрію використовуlow вали для вимірювання зустрічальності CD62L Tклітин в селезінці та брижових лімфатичних вузлах, яка представляє системну та місцеву активацію T-клітин, відповідно. Хронічний коліт супроводжувався підвищеною зустрічальністю активованих CD4+ (хелперних) T-клітин в селезінці та брижових лімфатичних вузлах, вказуючи на загальне підвищення активації хелперних T-клітин. Зменшена зустрічальність активованих ефекторних CD8+ T-клітин в селезінці супроводжувалися збільшеною зустрічальністю активованих CD8+ Tклітин в брижових лімфатичних вузлах, вказуючи на спрямовану міграцію T-клітин до місця дії в кишечнику. Наведені дані, починаючи з дня 25, з наступним 2-м циклом НДС. Кожне позначення представляє дані для однієї миші, горизонтальні лінії показують середнє значення. Крім того, більш висока зустрічальність клітин CD11b+ була виявлена в селезінці оброблених НДС мишей, що може відображати пов'язане з колітом збільшення кількості запальних макрофагів. До того ж, профілактичне лікування анти-TLR3 mAb супроводжувалося істотним зменшенням зустрічальності селезінкових CD11b+ клітин до рівнів, що спостерігалися у контрольних мишей, не оброблених НДС (Фіг. 43). Відсоток CD11b+ клітин в селезінці оброблених НДС мишей, що одержували лікування анти-TLR3 mAb, був подібний до мишей, не оброблених НДС, та був істотно нижчим за значення оброблених НДС 35 мишей, які одержували ФБР (P = 0,001) або неспецифічний IgG (P = 0,02). Наведені дані, починаючи з дня 25, з наступним 2-м циклом НДС. Кожне позначення представляє дані для однієї миші, горизонтальні лінії показують середнє значення. Профілі цитокінів в сироватці оброблених НДС мишей також демонструють зміни, пов'язані з лікуванням анти-TLR3 mAb: підвищені рівні IL-4 і IL-10 були виявлені у мишей, які одержували анти-TLR3 mAb з профілактичною метою (Фіг. 44). Лікування анти-TLR3 mAb протягом індукування хронічного НДС коліту підвищувало системні рівні IL-4 та IL10. Наведені дані, починаючи з дня 25 і 37, які представлять точки часу після 2-го і 3-го циклів НДС, відповідно. Кожне позначення представляє дані для однієї миші, горизонтальні лінії показують середнє значення. Продемонстровано, що як IL-4, так і IL-10 відіграють ключові ролі в регуляції запалення. На специфічну роль IL-10 в контролі імунопатогенезу при ЗЗК вказує те спостереження, що у IL-10 «нокаутованих» мишей спонтанно розвивається коліт. Одержані результати свідчать про те, що лікування анти-TLR3 mAb змінює запальні і Tклітинні реакції індуковані споживанням НДС. Сумарно, вказані дані демонструють, що блокада проведення сигналу TLR3 за допомогою анти-TLR3 mAb може зменшити вираженість захворювання на хронічній моделі коліту і надати докази потенційної ефективності анти-TLR3 mAb для лікування ЗЗК у людини. Приклад 7 Лікування антагоністом hTLR3 збільшує виживання при сепсисі Сепсис може буди змодельований у тварин, наприклад, мишей, введенням D- галактозаміну і полі(I:C). В таких моделях D-галактозамін являє собою гепатотоксин, який відіграє роль "сенсибілізатора" сепсису, та полі(I:C) являє собою індукуючу сепсис молекулу, яка імітує подвійно звиту РНК і активізує TLR3. Результати показують, що лікування антагоністом TLR3 може приблизно вдвічі збільшити виживаність тварин у моделі сепсису на мишах. В цих експериментах самкам мишей C57BL/6 дикого типу шляхом внутрішньочеревинних ін’єкцій вводили 1 мг антагоніста hTLR3 mAb 1068 в розчиннику ФБР, 1 мг препарату неспецифічного мишачого поліклонального IgG в розчиннику ФБР або розчинник ФБР окремо, як показано на Фіг. 10. Кожна ін’єкція включала 1 мл mAb або препарату неспецифічного IgG в ФБР або тільки 1 мл розчинника ФБР. Наступного дня миші одержували 10 мкг полі(I:C) та 20 мг D-галактозаміну (Sigma-Aldrich Corp., St. Louis, MO) в 100 мкл стерильного ФБР шляхом внутрішньочеревинної ін'єкції, як показано на Фіг. 10. Виживання мишей контролювали двічі на день протягом 3 днів. Всі оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин. Результати показують, що лікування антагоністом hTLR3 збільшує виживаність тварин у моделі сепсису на мишах (Фіг. 10). Приклад 8 Лікування антагоністом hTLR3 зменшує продукування цитокінів IL-6 і TNF-альфа в моделі сепсису на мишах 97229 36 В моделі сепсису на мишах лікування антагоністом hTLR3 зменшує рівні пов’язаних із запаленням цитокінів IL-6 (Фіг. 11) і TNF-альфа (Фіг. 12) в сироватці. Цей результат показує, що інгібування активності TLR3 може сприяти виживанню при сепсисі, зменшуючи опосередковане TLR3 продукування цитокінів, які сприяють сепсису. Зразки сироватки мишей, оброблених, як описано в Прикладі 6 вище, готували шляхом забору крові з ретро-орбітальних пазух мишей, анестезованих CO2/O2, через 2 години після введення полі(I:C). Сироватку готували шляхом інкубації крові при кімнатній температурі з наступним центрифугуванням при 2500 об/хв протягом 15 хвилин. Зразки сироватки зберігали при температурі –80 C до проведення аналізу цитокінів. Рівні цитокінів в зразках сироватки вимірювали з використанням приладу Luminex® (Luminex Corp., Austin, TX) та специфічних для IL-6 (Фіг. 11) або TNF-альфа (Фіг. 12) кон'югованих з mAb гранул, відповідно. Аналізи Luminex® для кожного цитокіну здійснювали у відповідності до інструкцій виробника. Всі оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин в установах. Кожне позначення на Фіг. 11 і Фіг. 12 представляє дані для однієї миші. Горизонтальні лінії показують середнє значення. Наведені дані являють собою об’єднані дані двох незалежних експериментів. Лікування mAb 1068 істотно зменшувало рівні IL-6 в сироватці через 2 години після введення полі(I:C) (P = 0,04, t-тест; Фіг. 11). Лікування mAb 1068 істотно зменшувало рівні TNF-альфа в сироватці через 2 години після введення полі(I:C) (P = 0,03, t-тест; Фіг. 12). Приклад 9 Введення полі(I:C) індукує секрецію прозапальних цитокінів та регуляцію вгору експресії гена TLR в легенях Самцям або самкам мишей C57BL/6 дикого типу, анестезованим ізофлураном, вводили інтраназально три дози полі(I:C) в ФБР або тільки ФБР кожні 24 години протягом трьох днів. Вік всіх мишей становив дванадцять тижнів. Кожна доза полі(I:C) містила 50 мкг або 100 мкг полі(I:C), як показано в табл. 1. Об’єм кожної дози становив 50 мкл. Кожна група експерименту складалася з 6–8 мишей. Мишей умертвляли за допомогою CO2, вводили в легені канюлю через 24 години після введення останньої дози. Далі здійснювали бронхоальвеолярний лаваж (БАЛ) шляхом ін’єкції 1 мл ФБР в легені і одержання ексудату. Препарати БАЛ далі центрифугували до утворення гранул клітин і звільнені від клітини супернатанти збирали і зберігали при температурі –80 C до використання в багатоканальних аналізах цитокінів. Всі оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин в установах. Рівні цитокінів в супернатантах БАЛ вимірювали з використанням багатоканального аналізу Luminex® (Luminex Corp., Austin, TX) та специфічних для IFN, IL-1, IL-6, CXCL10, JE, KC, MGCSF, MIP1, RANTES, TNF або GMCSF кон'югованих з mAb гранул (LINCO Research, St. Charles, MO), відповідно. Аналізи Luminex® для кожного цитокіну здійснювали у відповідності до інструкцій виробни 37 97229 ка. Дані виражали як середнє значення (пг/мл) стандартна похибка середнього (SEM) для 6-8 мишей. Результати показують, що множинне введення 50 мкг або 100 мкг полі(I:C) індукувало підвищення рівнів білків цитокінів, хемокінів і факторів росту, в тому числі інтерферону- (IFN), інтерлейкіну-6 (IL6), пухлинного некротичного фактора- (TNF), хемокіну (мотив CXC) ліганд 10 (CXCL10), хемокіну (мотив CC) ліганд 2 (JE), хемокіну KC (KC), запального білку-1 макрофагів (MIP-1), RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted; хемокін, що виділяється Т-клітинами при активації), мишачого гранулоцитарного колонієстимулювального фактора (mG-CSF) і гранулоцитарно-макрофагального колонієстимулювального фактора (GM-CSF) (табл. 1). Одержаний 38 результат вказує на те, що активація TLR3 може відігравати важливу роль в опосередкованих цитокінами, хемокінами і факторами росту легеневих патологіях, наприклад, ХОЗЛ. Крім того, аналізи ПЛР Taqman в реальному часі для легеневих тканин продемонстрували, що множинне введення спричиняло регуляцію вгору генів цитокінів, а також мРНК для численних TLR та пов’язаних з ними внутрішньоклітинних сигнальних молекул (табл. 2). Одержані дані показують, що полі(I:C), синтетичний аналог подвійно-звитої РНК, при введенні in vivo спричиняє каскад явищ, результатом яких стає секреція численних прозапальних цитокінів, хемокінів, а також регуляція вгору експресії генів TLR, таких як TLR2, TLR3, TLR7 і TLR9. Таблиця 1 Введення множинних доз полі(I:C) в легені мишей C57BL/6 індукує секрецію цитокінів, хемокінів і факторів росту в дихальних шляхах. Дані виражені як середнє значення (пг/мл) стандартна похибка середнього (SEM) для 6-8 мишей. Секретований білок IFN IL-1 IL-6 CXCL10 JE KC mGCSF MIP1 RANTES TNF GMCSF ФБР 10,98 1,63 16,47 1,24 8,80 1,54 30,27 5,90 11,70 1,18 6,22 1,28 5,23 0,65 37,72 6,33 0,48 0,04 2,28 0,33 19,10 +/- 2,10 Приклад 10 Активація TLR3 підвищує рівні цитокінів, хемокінів, факторів росту і транскрипта гена Toll легеневій тканині Рівні транскрипта в загальній РНК, екстрагованій з легенів самців або самок мишей C57BL/6, оброблених, як описано в Прикладі 8 вище, вимірювали за допомогою ПЛР в реальному часі (РЧПЛР). Загальну РНК екстрагували із зразків легеневої тканини миші з використанням Trizol™ (Invitrogen Corp., Carlsbad, CA) та добували з використанням RNEasy Mini Kit (Qiagen Inc., Valencia, CA). Далі РНК 6-8 мишей, оброблених однаковим чином, об’єднували. кДНК готували з кожного пулу РНК з використанням набору Omniscript™ (Qiagen Inc., Valencia, CA) у відповідності до інструкцій виробника. 100 нг кДНК ампліфікували з використанням карт для побудови імунного профілю низької щільності TaqMan™ (Low Density Immune Profiling Array Cards, Applied Biosystems, Foster City, CA) або виготовлених на замовлення карт масиву низької щільності (Low Density Array, LDA) у відповідності до вказівок виробника. Програмне забезпечення Primer Express™ (Applied Biosystems) використо Лікування 50 мкг полі(I:C) 12,84 1,72 21,99 1,85 237,51 94,41 309,19 50,05 158,61 39,40 46,55 11,84 34,34 6,43 150,41 37,45 18,90 7,15 17,01 4,51 27,69 1,86 100 мкг полі(I:C) 52,23 11,19 21,79 1,44 878,98 171,17411,30 34,88 798,69 182,60 55,36 6,53 60,64 6,78 441,14 61,56 155,75 41,59 81,16 13,72 33,54 4,48 вували для проектування комбінацій зонда і праймера. Далі здійснювали аналіз TaqMan™ РЧ-ПЛР (Applied Biosystems) в 384-лунковому форматі з використанням приладу ABI PRISM™ 7000HT (Applied Biosystems) у відповідності до інструкцій виробника. Збір даних і кількісне визначення транскрипта в ранній експоненціальній фазі ПЛР здійснювали з використанням приладу ABI PRISM™ 7000HT і відповідного програмного забезпечення. Індивідуальні рівні транскрипта були нормалізовані проти рівнів транскрипта для 18S рибосомальної РНК. Дані в табл. 2 виражені як середнє зростання (рази) рівнів мРНК транскрипта у мишей, які одержували множинні дози полі(I:C) в порівнянні з мишами, що одержували розчинник ФБР. Дані представляють пул РНК 6-8 мишей. Одержані дані показують, що активація TLR3 підвищує транскрипцію генів цитокінів, хемокінів, факторів росту і Toll (наприклад, TLR3 та інші Toll-подібні рецептори) в легеневій тканині мишей (табл. 2). Цей результат додатково вказує на те, що активація TLR3 та активація інших Tollподібних рецепторів (TLR) може відігравати важливу роль в опосередкованих цитокінами, 39 97229 хемокінами та факторами росту легеневих пато 40 логіях. Таблиця 2 Активація TLR3 множинним введенням полі(I:C) в легені цитокіна мишей C57BL/6 підвищує рівні транскрипта генів цитокінів, хемокінів, факторів росту і Toll. Дані виражені як середнє зростання (рази) рівнів мРНК транскрипта у мишей, які одержували множинні дози полі(I:C) в порівнянні з мишами, які одержували розчинник ФБР. Дані представляють пул РНК 6-8 мишей. Білок, кодований транскриптом гена CCL2 CCL3 CCL7 IL-15 IL-16 IL-18 IL-1 IL-1 IL-2r IL-7 MUC1 PDGF SFTPa SFTPb SFTPc SFTPd TGF TNF Vamp8 CXCL10 IFNR1 IFNR2 IFNR IRAK IRAK2 IRAK4 IRF3 IRF7 ISGF3G OAS2 PRKR RNASE 1 SOCS3 TLR2 TLR3 TLR4 TLR7 TLR9 TOLLIP Лікування 50 мкг полі(I:C) 46,81 18,04 22,58 9,91 4,74 3,30 3,37 11,96 12,17 4,47 3,05 2,96 2,32 2,50 1,89 3,12 3,05 105,91 2,59 90,03 2,50 3,64 2,20 2,57 2,56 2,35 1,97 17,03 5,63 5,29 5,49 2,25 3,93 3,72 3,77 2,43 6,26 21,21 2,48 Приклад 11 Активація TLR3 збільшує рівні запальних клітин легеневій тканині Активація TLR3 збільшує рівні запальних клітин в легеневій тканині мишей (Фіг. 13, 14, і 15). Одержаний результат показує, що активація TLR3 може відігравати важливу роль в легеневих патологіях, пов'язаних із збільшеною інфільтрацією легень запальними клітинами (Фіг. 13), такими як нейтрофіли (Фіг. 14) та моноядерні клітини (Фіг. 15) (наприклад, моноцити або лімфоцити). 100 мкг полі(I:C) 76,62 30,49 48,38 10,83 2,31 3,40 3,52 10,86 3,97 1,43 1,47 2,20 1,19 — — 1,93 2,40 78,45 1,78 357,38 2,32 3,01 1,54 1,73 2,26 1,72 1,62 22,92 4,45 10,76 9,32 1,91 4,63 6,96 5,41 1,89 10,86 55,78 1,72 Інфільтрацію запальними клітинами в легенях мишей C57BL/6, які одержували полі(I:C), оцінювали за допомогою нумерації гемоцитометра (Фіг. 13) або шляхом вибіркового забарвлення (Фіг. 14 і Фіг. 15). Миші одержували множинні дози полі(I:C), як описано в Прикладі 9 вище, або одиничну дозу полі(I:C). Одиничні дози полі(I:C) вводили інтраназально анестезованим ізофлураном самцям або самкам мишей C57BL/6. Вік всіх мишей становив від 8 до 12 тижнів. Одиничні дози включали 50 мкг або 100 мкг полі(I:C) в 50 мкл ФБР. Здійснювали 41 97229 БАЛ для одержання інфільтраційних клітин з легень через 24 години після введення полі(I:C) для тварин, що одержували одиничні дози полі(I:C) або через 24 години після введення останньої дози полі(I:C) для тварин, що одержували множинні дози. БАЛ здійснювали, як описано в Прикладі 8 вище. Гранули клітин, одержані після здійснення БАЛ на легенях оброблених мишей, ресуспендували в 200 мкл буферизованого фосфатом сольового розчину Дульбекко (ДФБР), що містив 0,1 % бичачого сироваткового альбуміну. Далі аліквоту суспензії клітин 50 мкл додавали до 50 мкл рідини для розбавлення крові Турка (Red Bird Service, Osgood, IN), ретельно перемішували та здійснювали підрахунок загальної кількості клітин за допомогою гемоцитометра (Фіг. 13). Далі аліквоту 5 100 мкл суспензії, яка містила менше 1 х 10 клітин/мл, завантажували на рухомий вузол Cytospin™ та обертали протягом 4 хвилин при 400 об./хв. Слайди витягали з вузла Cytospin™ і дозволяли висохнути як мінімум протягом однієї години. Далі слайди занурювали в забарвлюючий агент Wright-Giemsa на 90 секунд та відмивали у двічі дистильованій воді протягом 5 хвилин. Слайдам дозволяли висохнути протягом ночі. Здійснювали імерсію в маслі з диференційним підрахунком та визначенням загальної кількості нейтрофілів (Фіг. 14) та моноядерних клітин (Фіг. 15) на слайдах. Середні значення та стандартну похибку середнього для інфільтрації легень клітинами об’єднували для 6–8 мишей з кожної групи експерименту і наносили на графік (Фіг. 13, 14, і 15) . Приклад 12 TLR3 ―нокаутовані‖ тварини захищені від індукованого полі(I:C) зростання рівня запальних клітин в легеневій тканині 42 Інфільтраціюзапальними клітинами легень мишей C57BL/6 або TLR3 ―нокаутованих‖ мишей, яким вводили одиничні або множинні дози полі(I:C),оцінювали за допомогою лічильника гемоцитометра та вибіркового забарвлення для ідентифікації нейтрофілів і моноядерних клітин. Миші одержували множинні дози полі(I:C), як описано в Прикладі 8, або одиничні дози полі(I:C), як описано в Прикладі 10. Для одержання інфільтраційних клітин з легень здійснювали БАЛ через 24 години після введення полі(I:C) для тварин, що одержували одиничні дози полі(I:C) або через 24 години після введення останньої дози полі(I:C) для тварин, що одержували множинні дози. БАЛ здійснювали, як описано в Прикладі 8 вище. Оцінку інфільтрації запальними клітинами легень мишей C57BL/6 дикого типу або TLR3 ‖нокаутованих‖ мишей здійснювали за допомогою лічильника гемоцитометра та вибіркового забарвлення, як описано в Прикладі 10. Дані виражали як зростання (рази) середньої кількості інфільтраційних клітин в легенях тварин, оброблених полі(I:C), по відношенню до середньої кількості інфільтраційних клітин в легенях тварин, що одержували тільки ФБР. Дані представляють значення, одержані для 6 мишей. Результати, показані в Таблиці 3, вказують на те, що TLR3 «нокаутовані» миші захищені від індукованого полі(I:C) зростання кількості запальних клітин в легеневих тканинах в порівнянні з мишами дикого типу, і що вплив введення полі(I:C) здійснюється значною мірою за рахунок активації TLR3. Крім того, результати показують, що активація TLR3 може відігравати важливу роль в легеневих патологіях, пов'язаних з підвищеною інфільтрацією легень запальними клітинами, наприклад, нейтрофілами і моноядерними клітинами (такими як моноцити або лімфоцити). Таблиця 3 TLR3 «нокаутовані» миші (KO) захищені від індукованого полі(I:C) зростання кількості запальних клітин в легеневих тканинах в порівнянні з мишами дикого типу (WT). Дані виражали як зростання (рази) середньої кількості інфільтраційних клітин в легенях тварин, оброблених полі(I:C), по відношенню до середньої кількості інфільтраційних клітин в легенях тварин, що одержували тільки ФБР. Дані представляють значення, одержані для 6 мишей Доза Одинична доза 50 мкг (I:C) Одинична доза 100 мкг (I:C) Множинні дози 50 мкг (I:C) Множинні дози 100 мкг (I:C) Загальна кількість клітин WT KO 1,3 0,7 3,7 1,9 15,1 3,2 17,9 2,9 Приклад 13 Активація TLR3 за допомогою полі(I:C) додатково погіршує легеневу функцію у навантажених метахоліном тварин Самцям або самкам мишей C57BL/6 дикого типу вводили одиничну дозу полі(I:C) в ФБР або тільки ФБР (Фіг. 16), або вводили інтраназально три дози полі(I:C) в ФБР або тільки ФБР кожні 24 години протягом трьох днів (Фіг. 17). Полі(I:C) активізує TLR3. Вік всіх мишей становив 12 тижнів. Нейтрофіли WT 3 8,9 58,4 69,7 KO 1,7 5,6 5,4 6,3 Моноядерні Клітини WT KO 1,1 0,7 2,9 1,7 13 3 15,4 2,6 Кожна доза полі(I:C) містила 50 мкг або 100 мкг полі(I:C) та мала об’єм 50 мкг. Кожна група експерименту складалася з 6–8 мишей. Легеневу функцію оцінювали з використанням значень PenH як маркера обструкції дихальних шляхів і зусилля видиху через 24 години після введення останньої дози полі(I:C). Значення PenH одержували за допомогою плетизмографії всього тіла (WBP) мишей, навантажених метахоліном з поступовим збільшенням доз, як показано на Фіг. 43 16 або Фіг. 17. Метахолін збільшував зусилля дихання і знижував легеневу функцію. Метахолін розчиняли в ФБР і вводили у вигляді розпиленого аерозолю. Всі оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин. Дані 5 на Фіг. 16 і 17 представляють середні значення і стандартну похибку середнього для кожної групи експерименту (6-8 мишей). Результати показують, що активація TLR3 додатково знижує легеневу функцію у навантажених метахоліном мишей дикого типу (Фіг. 16 та Фіг. 17). Такий результат свідчить про те, що активація TLR3 може додатково знижувати легеневу функцію у осіб, що вже страждають на ураження легень внаслідок інфекції, хронічного обструктивного захворювання легень (ХОЗЛ) або інших розладів. Таким чином, терапевтичні втручання, що забезпечують антагонізм по відношенню до активності TLR3, можуть запобігати подальшому зниженню легеневої функції у осіб, що вже мають знижену легеневу функцію. Приклад 14 TLR3 ―нокаутовані‖ тварини захищені від індукованого полі(I:C) погіршення легеневої функції в ході навантаження метахоліном Одиничні (Фіг. 18) і множинні (Фіг. 19) дози полі(I:C) вводили самцям або самкам мишей C57BL/6 дикого типу або TLR3 ―нокаутованих‖ мишей, як описано в Прикладі 12. Легеневу функцію оцінювали з використанням значень PenH, одержаних за допомогою плетизмографії, як описано в Прикладі 12. Введення метахоліну також здійснювали, як описано в Прикладі 12. Всі оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин. Дані на Фіг. 18 і 19 представляють середні значення і стандартну похибку середнього для кожної групи експерименту (6-8 мишей). TLR3 ―нокаутовані‖ миші захищені від індукованого полі(I:C) зниження легеневої функції в ході навантаження метахоліном (Фіг. 18 і Фіг. 19). Такий результат вказує на те, що терапевтичні втручання, які забезпечують антагонізм по відношенню до активності TLR3, можуть запобігати подальшому зниженню легеневої функції у осіб, що вже мають знижену легеневу функцію внаслідок інфекції, хронічного обструктивного захворювання легень (ХОЗЛ) або інших розладів, таких як астма. Додатково, одержаний результат показує, що вплив введення полі(I:C) великою мірою реалізується за рахунок активації TLR3. Приклад 15 Вплив антагоніста hTLR3 на продукування цитокінів і хемокінів в епітеліальних клітинах легенів та бронхів людини Лінія епітеліальних клітин бронхів людини BEAS-2B була одержана від American Type Culture Collection (CRL-9609). BEAS-2B культивували в колбах, вкритих колагеном І (BD Biosciences) у середовищі LHC-9, вільному від сироватки, і збирали після короткочасного промивання в 0,25 % трипсин/ЕДТА. Далі клітини промивали в вільному від сироватки середовищі LHC-9 (Biosource) і ресуспендували в середовищі LHC-9 з щільністю 97229 44 6 1 х 10 /мл. Клітини вміщували на вкритий колагеном І 96-лунковий планшет з пласким дном в кількості 200 мкл/лунку; для кажного набору умов культивування здійснювали культивування в трьох лунках. Після 6 годин інкубації для приєднання клітин середовище видаляли і замінювали на 200 мкл свіжого середовища. 10-Разові серійні розведення mAb 1068, починаючи з 100 мкг/мл, інкубували протягом 40 хв при температурі 37 C, після чого додавали 125 нг/лунку агоніста TLR3 полі(I:C). Супернатанти культур збирали через 24 години після стимуляції полі(I:C) та здійснювали багатоканальний аналіз Luminex® (Luminex Corp., Austin, TX) зразків для кількісного визначення рівнів експресії IL-6, IL-8, RANTES, MCP-1, IP-10, IFN-α, IFNγ, IL-1, IL-12, TNF-α, MCP-1 та IL-10, Одержані результати показують, що антиTLR3 антагоніст mAb 1068 (на Фіг. 20 показаний як mAb CNTO260) зменшує продукування IL-6, IL-8, RANTES, MCP-1 та IP-10 в стимульованих полі(I:C) клітинах BEAS-2B. Експресія IL-6, IL-8, RANTES, MCP-1 та IP-10 в зразках знижувалася при додаванні mAb 1068 дозозалежним чином, як показано на Фіг. 20. Експресії IFN-, IFN-, IL-I, IL12, TNF-α, MCP-1 та IL-10 в зразках не було виявлено. Приклад 16 Лікування антагоністом hTLR3 підвищує виживання при смертельній пневмонії В цих експериментах самок мишей C57BL/6 дикого типу віком 8–10 тижнів інфікували інтраназальним введенням 5 бляшко-утворюючих одиниць (PFU) вірусу грипу A/PR/8 в 50 мкл ФБР, і далі інфікували через 7 днів 50 колонієутворюючими одиницями (КУО) мікроорганізму S. pneumoniae в 50 мкл ФБР. При окремому введенні дози вірусів і бактерій були сублетальними, але разом ці дози були летальними для більшості мишей (Фіг. 22). Контрольні групи фальшиво інфікованих мишей одержували ФБР замість вірусу грипу A/PR/8 або S. pneumoniae. Ліковані антагоністом hTLR3 миші одержували 0,6 мг або 0,06 мг в 0,2 мл ФБР шляхом внутрішньочеревинної ін'єкції за 2 години до інокуляції S. pneumoniae в день 7 (профілактичне введення), і такі ж дози одержували знову в день 8 (терапевтичне введення). Контрольні групи фальшиво лікованих мишей одержували 0,6 мг або 0,06 мг неспецифічного IgG в ФБР внутрішньочеревинно. Кожна група лікування або контрольна група містила 7 мишей. Всі описані оцінки здійснювали у відповідності до існуючих директив з догляду та використання тварин. Вірус грипу A/PR/8 культивували на курячих яйцях (титр PFU визначали з використанням стандартних аналізів з клітинами MDCK) і зберігали у вигляді замороженого запасу вірусу для щеплень. Streptococcus pneumoniae (ATCC® номер: 6301™) для інокуляції вирощували протягом ночі на чашках з триптиказо-соєвим агаром з вмістом 5 % овечої крові (TSA/кров), після чого бактерії витягали з чашок і суспендували в буферизованому фосфатом сольовому розчині (ФБР). Титр бактеріальних КУО в суспензії ФБР обчислювали з 45 97229 використанням оптичної густини на довжині хвилі 600 нм, а також за допомогою стандартних способів. Далі готували інокулят бактерій в ФБР. КУО в інокуляті бактерій підтверджували за допомогою стандартних аналізів формування колоній для визначення кількості бактерій, присутніх в інокуляті, який вводять мишам. Після виготовлення матеріалів для інокуляції мишей інфікували інтраназально вірусом грипу A/PR/8 або S. pneumoniae, як описано вище. Фальшиво інфіковані миші одержували ФБР інтраназально, як описано вище. Ліковані антагоністом hTLR3 миші одержували внутрішньочеревинно mAb 1068, як з профілактичною, так і з лікувальною метою, як описано вище. Фальшиво ліковані контрольні миші одержували внутрішньочеревинно неспецифічний IgG в ФБР, як описано вище. Окремо дози вірусу грипу A/PR/8 і дози S. pneumoniae були тільки сублетальними, оскільки виживали 100 % мишей, інфікованих тільки вірусом або тільки бактеріями (Фіг. 22). Однак, комбінація вірусної та бактеріальної інфекції у вказаних сублетальних дозах спричиняли смертельну пневмонію у більшості мишей (Фіг. 22). Мишей умертвляли через 48 годин після інфікування бактеріями, легені збирали в асептичних умовах, гомогенізували в стерильному ФБР, готували розведення гомогенату в ФБР, і розведення вміщували на чашки з TSA/кров’ю для визначення бактеріального навантаження в легенях. Чашки інкубували до утворення видимих колонії та здійснювали підрахунок КУО. Як показано на Фіг. 23, попереднє інфікування сублетальною дозою вірусу грипу збільшувала бактеріальне навантаження в легенях мишей через 2 дні після інфікування S. pneumoniae. Введення 0,6 мг або 0,06 мг анти-TLR3 mAb 1068 на мишу в дні 8 і 9 збільшувало виживаність мишей, інфікованих вірусом грипу A/PR/8 та S. pneumoniae в порівнянні з контрольними мишами, які одержували 0,6 мг або 0,06 мг неспецифічного контрольного IgG mAb (Фіг. 21). Важливо, що маса тіла середньої самки миші C57BL/6 знаходилася в інтервалі від 18 г до 20 г; таким чином інтервал доз антагоніста TLR3, які вводили тваринам, становив приблизно від 3,0 мг/кг до 3,3 мг/кг маси тіла для мишей, які одержували 0,06 мг mAb 1068 або приблизно під 30 мг/кг до 33 мг/кг маси тіла для мишей, які одержували 46 0,6 мг mAb 1068. На Фіг. 21 нанесені відповідні позначення, щоб вказати нижню межу цього інтервалу. Приклад 17 Вплив активності TLR3 на швидкість проліферації епітеліальних клітин ободової кишки Швидкість проліферації епітеліальних клітин ободової кишки в мишачій моделі підвищувалася в результаті ―нокаутування‖ активності гена рецептора TLR3 (дані показані в табл. 4). В цих експериментах самкам мишей C57BL/6 дикого типу або TLR3 «нокаутованих» мишей, описаних вище, вводили 1 мг бромдезоксиуридину (BrdU) в 1 мл ФБР внутрішньочеревинно та умертвляли їх через 2 години. Вік всіх мишей знаходився в інтервалі 68 тижнів, і кожна група експерименту складалася як мінімум з 3 мишей. Ободову кишку витягали для гістопатологічного аналізу. Тканину ободової кишки фіксували, нарізали на сегменти, заливали парафіном та готували зрізи товщиною 5 мкм. Зрізи інкубували послідовно з мишачим анти-BrdU IgG mAb (BectonDickinson Biosciences, Inc., San Jose, CA), кон’югованим з пероксидазою хріну (HRP) козячим анти-мишачим IgG mAb (Becton-Dickinson Biosciences, Inc., San Jose, CA) та діамінобензидиновим (DAB) субстратом (Becton-Dickinson Biosciences, Inc., San Jose, CA) у відповідності до інструкції виробника. Здійснювали контрастне забарвлення інкубованих зрізів гематоксиліном за стандартними методами. Далі інкубовані зрізи досліджували візуально та здійснювали підрахунок кількості клітин, що мали позитивне для інкорпорації BrdU в ДНК забарвлення, в криптах ободової кишки. Підрахунок клітин здійснювали в 24 послідовних належним чином орієнтованих криптах в зрізі одного сегменту ободової кишки. Інкорпорацію BrdU використовували як сурогатний маркер для ідентифікації клітини, що просуваються через клітинний цикл, тобто проліферації клітин. В табл. 4 наведені значення швидкості проліферації, виражені як середня кількість BrdU забарвлених клітин на крипту ободової кишки на тварину за 2 години. Ці дані представлені як середня швидкість проліферації стандартне відхилення (P < 0,0001, T-тест). Дані показують, що інактивація TLR3 збільшує проліферацію епітеліальних клітин ободової кишки. Таблиця 4 Збільшені швидкості проліферації епітеліальних клітин ободової кишки у TLR3 ―нокаутованих‖ мишей (KO). Миші дикого типу Швидкість проліферації епітеліальних клітин ободової кишки Миші з ―нокаутованим‖ геном TLR3 2,4 0,6 5,6 1,6 Приклад 18 Вплив активності TLR3 на швидкість проліферації епітеліальних клітин ободової кишки в процесі одужання від запального захворювання кишечнику Швидкість проліферації епітеліальних клітин ободової кишки в процесі одужання на мишачій моделі запального захворювання кишечнику (ЗЗК) підвищувалася при ―нокаутуванні‖ активності гена рецептора TLR3 (табл. 5). В цих експериментах самкам мишей C57BL/6 дикого типу або мишей TLR3 KO, описаних вище, вводили 5% (мас./об.) розчин натрію декстрану сульфату (НДС) в питній воді протягом 3 днів з метою індукування гострого 47 97229 виразкового коліту. Далі мишей забезпечували водою без добавок до кінця експерименту через 30 годин. Мишам ін’єкційно вводили BrdU, як описано вище, через 6 годин того, як вони почали отримувати воду без добавок. Після цього мишам дозволяли одужувати від індукованого НДС виразкового коліту протягом 24 годин, після чого тварин умертвляли. Вік всіх мишей знаходився в інтервалі 6–8 тижнів, і кожна група експерименту складалася як мінімум з 3 мишей. Зразки ободової кишки для гістопатологічних аналізів проліферації клітин крипт готували і ана 48 лізували, як описано в Прикладі 15 вище. Дані швидкості проліферації виражали як середню кількість BrdU забарвлених клітин на крипту ободової кишки на тварину на 24 години. Одержані дані представлені як середня швидкість проліферації стандартне відхилення (P 5000 1820,0 4258,0 лення mAb та захоплення TLR3. Аналіз захоплення mAb здійснювали при температурі 25 C з використанням біодатчику Biacore 2000, обладнаного мікросхемою CM5 з поверхнями, модифікованими за допомогою протеїну А (6000 умовних одиниць, RU) при температурі 25 C шляхом стандартного сполучення з аміном. Антитіло розбавляли до 30 нМ і забезпечували захоплення протягом однієї хвилини на різних поверхнях з протеїном А. Ін’єкційно вводили TLR3 в концентраціях 0, 0,1, 0,3, 1.0, 3.0, і 9,0 нМ та асоціацію і дисоціацію контролювали протягом 5 хвилин. Модифіковані про 51 97229 теїном А поверхні відновлювали з використанням двох 6-секундних імпульсів 100 мМ фосфорної кислоти. Одержані набори даних щодо зв’язування були апроксимовані до моделі взаємодії 1:1 (CLAMP™). Обчислювали константи швидкості та їх співвідношення (KD = kd/ka) і помилку апроксимації шляхом оцінки видимих констант рівноваги. Аналіз захоплення TLR3 здійснювали при температурі 25°C з використанням біодатчику Biacore 3000, обладнаного мікросхемою CM5 з поверхнями, модифікованими за допомогою анти-His антитіла (R&D Systems) (10000 RU) при температурі 30 °C шляхом стандартного сполучення з аміном. Забезпечували захоплення людського гексагістидин-TLR3 з щільністю 80, 120 і 300 RU на трьох поверхнях, четверту поверхню використовували як контроль. Антитіло ін’єкційно вводили в концентраціях 0, 0,4, 1,1, 3,3, 10, і 30 нМ в двох повтореннях. Фази асоціації контролювали протягом трьох хвилин та дисоціацію контролювали протягом семи хвилин. Поверхні з анти-His антитілами регенерували з використанням двох 3-секундних імпуль 52 сів 50 мМ фосфорної кислоти. Одержані набори даних щодо зв’язування були апроксимовані до моделі взаємодії 1:1 (BIAeval™) з корекцією для різного дрейфу кожного профілю концентрації mAb. Обчислювали константи швидкості та їх співвідношення (KD = kd/ka) і помилку апроксимації шляхом оцінки видимих констант рівноваги. Обчислені результати KD наведені в табл. 8 нижче. Два вимірювання представляють 1) спорідненість зв’язування з анти-TLR3 mAb, захопленим на поверхні мікросхеми людським TLR3 у фазі розчину, таі 2) TLR3, захоплений на поверхні мікросхеми із застосуванням анти-TLR3 mAb у фазі розчину. Результати показують, що всі кандидати зберігають спорідненість порядку нМ, якщо TLR3 в фазі розчину захоплюється іммобілізованим mAb, підтверджуючим, що комбінаторні mAb зберігають характеристики зв’язування 1068. Якщо TLR3 був іммобілізований на мікросхемі, більшість кандидатів зберігала характеристики тісного зв’язування, і такий результат узгоджується з кривими зв'язування ELISA. Таблиця 8 Обчислені значення KD для комбінаторних mAb mAb 1068 (mIgG1) HV5/LV5 HV5/LV1 HVl/LVl HV4/LV3 HVl/LV7 KD із захопленням mAb 1,2 0,7 нМ KD із захопленням TLR3 0,316 0,06 нМ 1,1 нМ 2,0 нМ 3,9 нМ 0,5 нМ 7,2 нМ 0,7 0,001 нМ 0,65 0,07 нМ 1,7 1,2 нМ 3,4 2,8 нМ 90 18 нМ Зв'язуючу активність гуманізованого антиTLR3 mAb, проаналізовану за допомогою Biacore, також визначали в клітинному аналізі вивільнення цитокінів. Лінією епітеліальних клітин легені людини BEAS-2B вкривали 96-лунковий планшет, та до клітин додавали полі(I:C) або полі(I:C), попередньо інкубований з антитілом-кандидатом у вільній від сироватки матриці. Після проходження 4 днів середовище для кондиціонування видаляли і рівні розчинних цитокінів вимірювали за технологією Luminex®. Результати показані на Фіг. 25 і демонструють той факт, що біологічна активність вихідного mAb C1068, тобто нейтралізація активності TLR3, виміряна за зменшенням продукування прозапальних цитокінів клітинами, навантаженими з лігандом TLR3 — полі(I:C), збережена в гуманізованих mAb. Приклад 21 Створення та характеристика варіантів важкого і легкого ланцюга гуманізованого C1068 В аналізі імуногенності in silico ділянки CDR мишачого анти-TLR3 20 mAb 1068 виявили серії агретопів (aggretopes) в межах зв’язків CDR, якими можна маніпулювати з метою зменшення ба лів імуногенності послідовності. Як тільки ділянки, якими можна маніпулювати, були ідентифіковані, як послідовність, так і структурні критерії була застосовані для вирішення того, які заміни амінокислот потрібно використовувати. З використанням цих критеріїв були ідентифіковані чотири одиничні точкові заміни амінокислот у варіабельній ділянці важкого ланцюга (VH), і три мутації (одинична, подвійна і потрійна) були ідентифіковані у варіабельній ділянці легкого ланцюга (V). Всі вісім мутацій були здійснені незалежно на базі HV1/LV1 (наведені табл. 9). Інший тип заміни також був застосований з метою визначення впливу заміни залишку M102 на ізолейцин, це було здійснено для скорочення загальної кількості залишків метіоніну в CDR, оскільки ці залишки після трансляції можуть окиснюватися, спричиняючи модифікацію, яке потенційно може погіршувати розчинність білків. Вказані антитіла були створені та оцінені щодо зв’язування з TLR3 (див. табл. 10 і 11) та біологічної активності (див. Фіг. 26-30), як описано вище. 53 97229 54 Таблиця 9 Розташування та ідентичність точкових мутацій CDR Розташування Vh CDR1 134M Номер варіанту HBV1 SEQ ID NO: 45 Vh CDR2 Y60G Vh CDR2 N61A Vh CDR2 F64G HBV2 HBV3 HBV4 47 49 51 Vh CDR3 M102l HBV5 53 VK CDRl H30S VK H3 0S/N31S Vk CDR1 H30S/N31S/N28G HBV6 HBV7 HBV8 55 57 59 Таблиця 10 Обчислені значення EC50 для варіантів Vh CDR в аналізі зв'язування TLR3 Варіант EC50 (нг/мл) HBV1 17 HBV2 14,6 HBV3 48 HBV4 40,9 HBV5 74,7 Таблиця 11 Обчислені значення EC50 для варіантів V CDR в аналізі зв'язування TLR3 Варіант EC50 (нг/мл) HBV6 1223 Всі п'ять одиничних точкових мутацій, здійснених в Vh CDR 1068, пересаджені в основу HV1/LV1, добре переносилися, як показало EC50 зв'язування з людським TLR3. Значення EC50 основи HV1/LVl вимірювали при концентрації 29,2 нг/мл; значення як для I34M, так і для Y60G були нижчими за значення 17 і 14,6 нг/мл, відповідно. Одержані результати показують, що такі зміни не тільки зменшують імуногенність HV1/LV1 in silico, але й покращують зв’язування з TLR3. Інші три мутації зв’язувалися небагато слабкіше, ніж HBV7 > 5000 HBV8 > 5000 HV1/LV1. Жодна з мутацій в CDR1 V1 не переносилася (EC50 > 1000 нг/мл), вказуючи на те, що ця ділянка є критичною для розпізнавання 1068 людського TLR3. Даний винахід повністю описаний в даному описі. Середньому фахівцю в даній галузі буде зрозуміло, що можуть бути здійснені численні зміни та модифікації без виходу за межі ідеї та реалізації формули винаходу. 55 97229 56 57 97229 58 59 97229 60
ДивитисяДодаткова інформація
Назва патенту англійськоюIsolated monoclonal antibody that specifically binds to toll like receptor 3 (tlr3)
Автори англійськоюCarton Jill, Cunningham Mark, Das, Anuk, Duffy Karen, Knight David M., Lamb Roberta, Raghunathan Gopalan, San Mateo Lani, Sarisky, Robert, T., Stowell Nicole, Sweet Raymond, Zhao Shanrong, Chen Shizhong, GILES-KOMAR JILL, Picha, Kristen, Stojanovic-Susulic Vedrana, Goletz Theresa J.
Назва патенту російськоюИзолированное моноклональное антитело, которое специфически связывается с toll-подобным рецептором 3 (tlr3)
Автори російськоюКартон Джилл, Каннингхем Марк, Дас Анук, Даффи Карен, Найт Девид М., Ламб Роберта, Рагхунатан Гопалан, Сан Матео Лени, Сариски Роберт Т., Стовелл Николь, Свиит Реймонд, Зхао Шанронг, Чен Шизгонг, Гилес-Комар Джилл, Пича Кристен, Стоянович-Сусулик Ведрана, Голетз Тереса Дж.
МПК / Мітки
МПК: C12P 21/08, C07K 16/28, A61K 39/395, C12N 15/13, C12N 5/16, C12N 15/63
Мітки: яке, специфічно, тoll-подібним, рецептором, моноклональне, зв'язується, ізольоване, антитіло, tlr3
Код посилання
<a href="https://ua.patents.su/85-97229-izolovane-monoklonalne-antitilo-yake-specifichno-zvyazuehtsya-z-toll-podibnim-receptorom-3-tlr3.html" target="_blank" rel="follow" title="База патентів України">Ізольоване моноклональне антитіло, яке специфічно зв’язується з тoll-подібним рецептором 3 (tlr3)</a>