Спосіб одержання жіночих інбредних ліній з гібридів asteracea
Номер патенту: 105801
Опубліковано: 25.06.2014
Автори: Толєдо Жозе Франціску Ферраз ді, Карвальо Клаудіу Гілєрме Портела ді
Формула / Реферат
1. Спосіб одержання жіночих інбредних ліній з гібридів айстрових, згідно з яким одержання цих ліній полягає у зміні інбредних рекурентних ліній RHA, одержаних від самозапилення комерційних або некомерційних гібридів, на інбредні нерекурентні лінії НА з метою модифікації цих ліній НА до рослин з чоловічою стерильністю, причому вищезгаданий спосіб включає такі етапи:
a) схрещування будь-якої інбредної нерекурентної лінії НА айстрових, попередньо кастрованих або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, з інбредною рекурентною батьківською лінією RHA, яка містить ген відновлення фертильності;
b) одержання покоління F1, яке містить 50% генотипу рекурентної батьківської лінії RHA з етапу (а);
c) зворотне схрещування F1, попередньо кастрованого або підданого попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, з рекурентною батьківською лінією RHA з етапу (а);
d) одержання беккроса 1 (ВС1), який містить 75% фенотипу рекурентної батьківської лінії з етапу (а);
е) ідентифікація гетерозигот (Rfrf) та гомозигот (RfRf) покоління ВС1, одержаного на етапі (d);
f) зворотне схрещування ВС1 гетерозиготних (Rfrf) та гомозиготних (RfRf) рослин ВС1, попередньо кастрованих або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, з рекурентною батьківською лінією з етапу (а) з метою одержання ВС2, де лише насіння гетерозиготних рослин ВС1 дає наступне покоління;
g) одержання покоління ВСn від покоління ВСn-1 згідно з етапами (е) та (f);
h) здійснення після послідовного зворотного схрещування ідентифікації та самозапилення гетерозигот (Rfrf) та гомозигот (RfRf) покоління ВСn, одержаного на етапі (g), де самозапилення рослин Rfrf покоління ВСn забезпечує рослини НА (N rfrf) та рослини RHA (N RfRf та N Rfrf);
і) ідентифікація та самозапилення рослин НА (N rfrf) та рослин RHA (N RfRf та N Rfrf), одержаних від самозапилення рослин Rfrf на етапі (h);
j) зміна рослини НА (N rfrf), одержаної на етапі (h), до рослини з чоловічою стерильністю після послідовних зворотних схрещувань, причому нерекурентною батьківською лінією є будь-яка рослина, яка має цитоплазматичну чоловічу стерильність, а рекурентна батьківська рослина належить до лінії НА (N rfrf), де покоління F1 одержують на етапі ідентифікації рослин НА, описаних на етапі (і).
2. Спосіб за п. 1, який відрізняється тим, що етап (е) за п. 1, який полягає в ідентифікації покоління ВС1, що здійснюють згідно з такою процедурою:
a) запилення рослин з чоловічою стерильністю пилком, виробленим ВС1;
b) ідентифікація лінії, утвореної у ВС1 як домінантної гомозиготної для гена відновлення фертильності (RfRf), якщо вона дає 100% фертильних рослин після схрещування, вказаного на етапі (а);
c) ідентифікація лінії, утвореної у ВС1 як гетерозиготної для гена відновлення фертильності (Rfrf), якщо вона дає фертильні та стерильні рослини після схрещування, вказаного на етапі (а), де цей процес також здійснюють на етапі ідентифікації покоління ВСn (етап (h) за п. 1.
3. Спосіб за п. 1, який відрізняється тим, що етап (і) за п. 1, який полягає в ідентифікації рослин НА (N rfrf) та рослин RHA (N RfRf та N Rfrf), здійснюють згідно з такою процедурою:
a) запилення рослин з чоловічою стерильністю пилком, виробленим рослинами НА (N rfrf) та рослинами RHA (N RfRf та N Rfrf);
b) ідентифікація рослини НА (N rfrf), якщо вона дає 100 % стерильних рослин після схрещування, вказаного на етапі (а);
c) ідентифікація рослини RHA (N RfRf та N Rfrf), якщо вона дає 100 % фертильних рослин або фертильні та стерильні рослини, у будь-якій пропорції більше нуля.
4. Спосіб за п. 1, який відрізняється тим, що етап (f) за п. 1, який полягає в одержані лінії ВС2, здійснюють згідно з такою процедурою:
a) запилення квіток рослин ВС1, попередньо кастрованих або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, пилком рекурентної батьківської лінії RHA, вказаної на етапі (а) за п. 1;
b) одержання лінії ВС2, яка містить нормальну цитоплазму і має домінантний гомозиготний генотип для гена відновлення фертильності, від схрещування згідно з етапом (а), яке здійснювали з лінією ВС1, ідентифікованою згідно з етапом (b) за п. 2;
c) одержання лінії ВС2, яка містить нормальну цитоплазму і має генотип відновлення фертильності у гомозиготах та гетерозиготах, від схрещування згідно з етапом (а), яке здійснювали з лінією ВС1, ідентифікованою згідно з етапом (с) за п. 2.
5. Спосіб за п. 1, який відрізняється тим, що запилення рослин з чоловічою стерильністю здійснюється пилком, видобутим з зовнішнього кільця ділянок рослин ВС1, зони, у якій ця частина головки видаляється відразу після забирання пилку.
6. Спосіб за п. 1, який відрізняється тим, що квітки лінії ВС1, які підлягають запиленню пилком з рекурентної батьківської лінії RHA, розташовуються у центральній зоні ділянки.
7. Спосіб за п. 1, який відрізняється тим, що вищезгаданий спосіб є модифікацією етапу (h) за вищезгаданим пунктом, згідно з яким група рослин BCn (RfRf та Rfrf) самозапилюється, і рослини НА (N rfrf) та рослини RHA (N RfRf та N Rfrf) з цієї самозапиленої групи ідентифікують і піддають самозапиленню, як описано на етапі (і).
8. Спосіб за п. 1, який відрізняється тим, що передбачає застосування молекулярних маркерів або будь-якої іншої технології і з метою розпізнавання / ідентифікації гетерозиготних рослин та гомозиготних рослин стосовно гена відновлення фертильності.
9. Спосіб за п. 1, який відрізняється тим, що застосовані лінії айстрових являють собою Helianthus annuus.
10. Спосіб зміни ліній RHA за допомогою гена відновлення фертильності на лінії НА, причому ці лінії НА одержують від самозапилення лінії ВСn, гетерозиготної стосовно гена Rf, одержаної згідно з етапом (с) за п. 4.
11. Спосіб за п. 10, який відрізняється тим, що застосовані лінії айстрових являють собою Helianthus annuus.
Текст
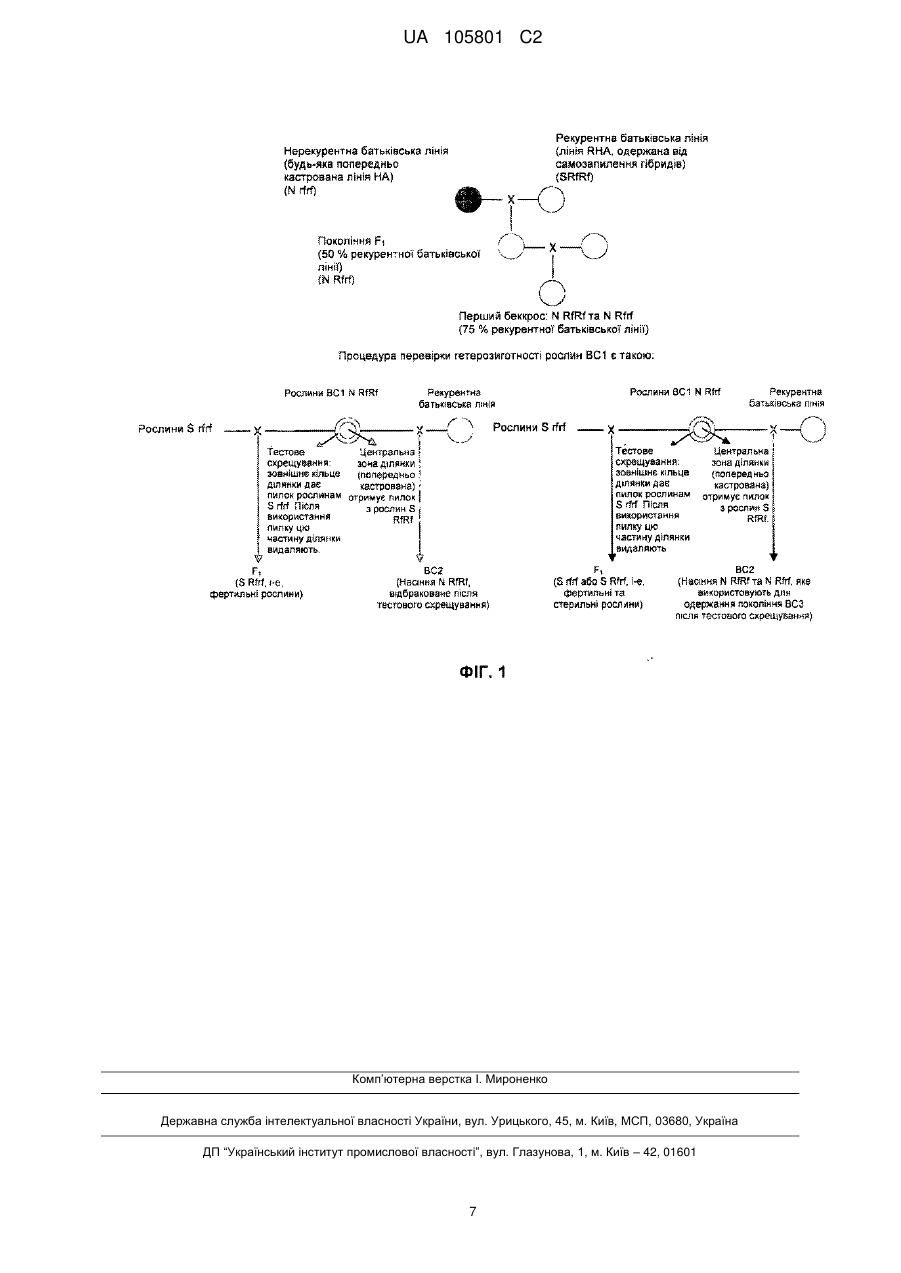
Реферат: Винахід належить до способу одержання жіночих інбредних ліній з гібридів айстрових з використанням виду Helianthus annuus як моделі. Спосіб згідно з винаходом ґрунтується на модифікації ліній з геном відновлення фертильності (Rf), одержаних від самозапилення гібридів, до ліній, які містять нормальну цитоплазму і не містять гена Rf. Після цього виводили лінії з чоловічою стерильністю. Завдяки застосуванню цієї методології, забезпечувалася можливість одержання жіночих ліній з комерційних гібридів соняшника. UA 105801 C2 (12) UA 105801 C2 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід належить до галузі селекції рослин для сільськогосподарських та декоративних цілей, зокрема, одержання жіночих інбредних ліній від гібридів соняшника, на основі стратегії схрещування між потрібними інбредними лініями. Рівень техніки Сільськогосподарське виробництво у світі традиційно ґрунтується на виведенні та поліпшенні конкретних генотипів згідно з характеристиками навколишнього середовища кожного регіону з метою пошуку сортів з підвищеним адаптивним потенціалом та, насамперед, вищою врожайністю. У зв'язку з цими характеристиками можна згадати пошуки засобів підвищення резистентності до патогенів, толерантності до абіотичного стресу, крім поліпшення характеристик, прямо пов'язаних з кінцевим продуктом, для якого призначається певна культура. Стратегія виведення більш привабливих з сільськогосподарської точки зору сортів полягає у виведенні гібридів. Ці гібриди в цілому є міцнішими й продуктивнішими порівняно з батьківськими рослинами, що, таким чином, знижує комерційну вартість батьківських інбредних ліній. Виробництво гібридного насіння включає штучне запилення між інбредними лініями, з достатнім перенесенням пилку та обмеженим самозапиленням. Пропонувалося багато способів обмеження самозапилення інбредних ліній, такі, як чоловіча стерильність, викликана хімічними агентами, генетична чоловіча стерильність, цитоплазматична чоловіча стерильність та самонесумісність. Цитоплазматична чоловіча стерильність, пов'язана з генами відновлення фертильності пилку, є одним з головних чинників, які сприяють виведенню комерційних гібридів соняшника (Helianthus annuus L.) у світі (MILLER, J.F.; FICK, G.N. The genetics of sunflower. In: SCHNEITER, A.A. (Ed.). Sunflower technology and production. Wisconsin: ASA-CSSA-SSSA, 1997. p.441-495.). Ця процедура є доцільною і широко застосовується й удосконалюється селекціонерами рослин для різних культурних сортів, як можна побачити з наведених документів US 4,627,192 (соняшник), US 11/854,665 (рукола), US 5,436,386 (сафлор), WO01/06845 (паслін), WO02/098209 (пшениця), US 10/344,752 (рис) та WO05/029945 (деревні породи) і у нових редакціях публікацій Coimbra, J.L.M., Bertoldo, J.G., Do Vale, N.M. Use of male sterility in the breeding of commercial rice hybrids Revista de Ciências Agroveterinárias. Lages, v.7, n.1, p.61-74, 2008. При застосуванні цієї стратегії для виробництва комерційних гібридів соняшника чоловічою батьківською інбредною лінією є CMS-HA, яка представляє характеристику цитоплазматичної чоловічої стерильності (цитоплазма S-типу), але без гена відновлення фертильності (Rf) у ядрі. Жіноча батьківська рослина, таким чином, є інбредною лінією з чоловічою стерильністю з генотипом S-rfrf. Чоловіча батьківська лінія є інбредною лінією RHA, яка може містити цитоплазму нормального типу (N) або S-типу (стерильну), але обов'язково повинна містити ген Rf. Таким чином, інбредна лінія RHA є лінією з чоловічою стерильністю, з генотипом S-RfRf або з генотипом N-RfRf. Одержаний в результаті гібрид є гібридом з чоловічою фертильністю з генотипом S-Rfrf. Інбредні лінії, які містять ген відновлення фертильності (інбредні лінії RHA) можуть бути виведені через самозапилення комерційних гібридів після селекції рослин з чоловічою стерильністю з розщеплюваних популяцій (MILLER, J.F.; VICK, B.A. Registration of four high linoleic sunflower germplasms. Crop Science, v.41, p.602, 2001; MILLER, J.F.; GULYA, T.J.; SEILER, G.J. Registration of five fertility restorer sunflower germplasms. Crop Science, v.42, p.989-991, 2002.; MILLER, J.F.; GREEN, C.E.; LI, Y.M.; CHANEY, R.L. Registration of three low cadmium (HA 448, HA 449, and RHA 450) confection sunflower genetic stocks. Crop Science, v.46, p.489-490, 2006; MILLER, J.F.; GULYA, T.J.; VICK, B.A. Registration of imidazolinone herbicide-resistant maintainer (HA 442) and fertility restorer (RHA 443) oilseed sunflower germoplasms. Crop Science, v.46, p.483484, 2006; MILLER, J.F.; GULYA, T.J. Registration of two restorer (RHA 439 and RHA 440) and one maintainer (HA 441) Sclerotinia-tolerant oilseed sunflower germplasms. Crop Science, v.46, p.482, 2006.). Ці інбредні лінії повинні піддаватися випробуванню потомства з метою гарантування наявності у них генотипу S-RfRf. З іншого боку, лінії з цитоплазматичною чоловічою стерильністю (лінії CMS-HA) можуть бути виведені через зворотне схрещування, в якому нерекурентна батьківська лінія є будь-якою інбредною лінією з цитоплазмою S-типу (з чоловічою стерильністю), а рекурентна зазвичай є інбредною лінією HA, яка була попередньо поліпшеною через кілька циклів селекції і має генотип N-rfrf. У програмах генетичного поліпшення для соняшника лінії HA є зберігачами ліній CMS-HA і походять від інших ліній HA (MILLER, J.F.; VICK, B.A. Registration of four high linoleic sunflower germplasms. Crop Science, v.41, p.602, 2001; MILLER, J.F.; VICK, B.A. Registration of four mid-range oleic acid sunflower genetic stocks. Crop Science, v.42, p.994, 2002.; MILLER, J.F.; SEILER, G.J. Registrations of five 1 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 oilseed maintainer (HA 429-HA 433) sunflower germplasm lines. Crop Science, v.43, p.2313-2314, 2003; MILLER, J.F.; GULYA, T.J. Registration of two restorer (RHA 439 and RHA 440) and one maintainer (HA 441) Sclerotinia-tolerant oilseed sunflower germplasms. Crop Science, v.46, p.482, 2006.; MILLER, J.F.; GREEN, C.E.; LI, Y.M.; CHANEY, R.L. Registration of three low cadmium (HA 448, HA 449, and RHA 450) confection sunflower genetic stocks. Crop Science, v.46, p.489-490, 2006; MILLER, J.F.; GULYA, T.J.; VICK, B.A. Registration of imidazolinone herbicide-resistant maintainer (HA 442) and fertility restorer (RHA 443) oilseed sunflower germoplasms. Crop Science, v.46, p.483-484, 2006, MILLER, J.F.; GULYA, T.J.; VICK, B.A. Registration of three maintainer (HA 444 to HA 446) and one restorer (RHA 447) high oleic oilseed sunflower germplasms. Crop Science, v.46, p.484-485, 2006). Класичний спосіб схрещування досі широко застосовується для ідентифікації зберігача та відновника фертильних ліній з метою їх застосування у виведенні гібридів соняшника, які представляють різні джерела цитоплазми з чоловічою стерильністю, як описано в опублікованому дослідженні Reddy, C.V.C.M.; Sinha, B., Reddy, A.V.V. and Redy, Y.R. Maintenance of Male Sterility and Fertility Restoration in Different CMS Sources of Sunflower (Helianthus annuus L.). Asian Journal of Plant Sciences 7(8):762-766, 2008. Можливість одержання ліній HA, а отже, ліній CMS-HA, з гібридів, зокрема, комерційних, яке нині здійснюється для інбредних ліній RHA, є цікавою альтернативою, оскільки вона забезпечує краще використання генетичного потенціалу адаптованих генотипів з потрібними ознаками. У цьому контексті мета даного винаходу полягає у забезпеченні способу одержання жіночих інбредних ліній з гібридів рослин родини айстрових з використанням соняшника як моделі та варіантів втілення, які застосовуються для одержання описаних результатів, за допомогою цього способу. Короткий опис винаходу Даний винахід забезпечує спосіб одержання жіночих інбредних ліній з гібридів рослинної родини айстрових з застосуванням виду Helianthus annuus як моделі. Для одержання цих жіночих інбредних ліній інбредні лінії RHA, одержані від самозапилення гібридів (комерційних або некомерційних), повинні бути змінені на інбредні лінії HA і у такий спосіб мають модифікувати ці лінії HA до рослин з чоловічою стерильністю. Вищезгаданий спосіб складається з кількох етапів схрещування та оцінки потомства, одержаного від запропонованих схрещувань, до яких належать такі: a) схрещування будь-якої інбредної лінії HA айстрових (нерекурентних батьківських рослин), попередньо кастрованих (або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів), з інбредною лінією RHA (рекурентних батьківських рослин), яка містить ген відновлення фертильності; b) одержання покоління F1, яке містить 50 % генотипу рекурентної батьківської рослини з етапу a; c) зворотне схрещування F1, попередньо кастрованого (або підданого попередній стерилізації пилку через застосування хімічних агентів або інших механізмів), з рекурентною лінією RHA з етапу a; d) одержання беккроса 1 (BC1), який містить 75 % фенотипу рекурентної батьківської рослини з етапу a; e) ідентифікація гетерозигот (Rfrf) та гомозигот (RfRf) покоління BC1, одержаного на етапі d; f) зворотне схрещування гетерозиготних (Rfrf) та гомозиготних (RfRf) рослин BC1, попередньо кастрованих (або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів), з рекурентною батьківською рослиною з етапу a з метою одержання BC2. Лише насіння гетерозиготних рослин BC1 дає наступне покоління; g) одержання покоління BCn від покоління BCn-1 згідно з етапами e та f. h) здійснення після послідовного зворотного схрещування ідентифікації та самозапилення гетерозигот (Rfrf) та гомозигот (RfRf) покоління BC n, одержаного на етапі g. Самозапилення рослин Rfrf покоління BCn забезпечує рослини HA (N rfrf) та рослини RHA (N RfRf та N Rfrf); i) ідентифікація та самозапилення рослин HA (N rfrf) та рослин RHA (N RfRf та N Rfrf), одержаних від самозапилення рослин Rfrf на етапі h. j) зміна рослини HA (N rfrf), одержаної на етапі h, до рослини з чоловічою стерильністю після послідовних зворотних схрещувань, причому нерекурентною батьківською рослиною є будь-яка рослина, яка має цитоплазматичну чоловічу стерильність, а рекурентною батьківська рослина належить до лінії HA (N rfrf). Покоління F1 одержують на етапі ідентифікації рослин HA, описаних на етапі i. Етап ідентифікації покоління BC1 згідно з заявленим способом включається до винаходу згідно з такою процедурою: запилення рослин з чоловічою стерильністю пилком, виробленим BC1; ідентифікація лінії, утвореної у BC1, як домінантної гомозиготної для гена відновлення 2 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 фертильності (RfRf), якщо вона дає 100 % фертильних рослин після схрещування; або ідентифікація лінії, утвореної у BC1, як гетерозиготної для гена відновлення фертильності (Rfrf), якщо вона дає фертильні та стерильні рослини. Цей процес також здійснюють на етапі ідентифікації покоління BCn (етап h). Ідентифікація рослин HA HA (N rfrf) та рослин RHA (N RfRf та N Rfrf), одержаних на етапі i згідно з заявленим способом, включається до винаходу згідно з такою процедурою: запилення рослин з чоловічою стерильністю пилком, виробленим випробуваними рослинами; ідентифікація рослини HA (N rfrf), якщо вона дає 100 % стерильних рослин після схрещування; або ідентифікація рослини RHA (N RfRf та N Rfrf), якщо вона дає 100 % фертильних рослин або фертильні та стерильні рослини у будь-якій пропорції. Одержання ліній BC2, вказаних на етапі f, як втілення способу згідно з винаходом, здійснюють через запилення квіток рослин BC1, попередньо кастрованих (або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів), пилком рекурентної лінії RHA, вказаної на етапі a; одержане в результаті потомство містить нормальну цитоплазму і має домінантний гомозиготний генотип для гена відновлення фертильності; або ж одержане в результаті потомство може належати до ліній BC1, які містять нормальну цитоплазму і мають генотип відновлення фертильності у гомозиготах та гетерозиготах. Описаний вище спосіб при втіленні виявляє, що запилення рослин з чоловічою стерильністю здійснюється пилком, видобутим з зовнішнього кільця ділянок рослин BC1, зони, у якій ця частина головки видаляється відразу після забирання пилку. Інший варіант втілення заявленого способу виявляє, що квітки BC1, які підлягають запиленню пилком з рекурентної лінії RHA, розташовуються у центральній зоні ділянки. Модифікація етапу h, як втілення заявленого способу, полягає у самозапиленні групи рослин BCn (RfRf та Rfrf) та ідентифікації й самозапиленні рослин HA (N rfrf) та рослин RHA (N RfRf та N Rfrf), які походять від цієї самозаплідненої групи, як описано на етапі i. Додатковий варіант втілення представленого способу полягає у застосуванні молекулярних маркерів або будь-якої іншої технології з метою розпізнавання / ідентифікації гетерозиготних рослин та гомозиготних рослин стосовно гена відновлення фертильності. Як варіанти втілення винаходу можуть бути згадані рослини, лінії та гібриди, одержані згідно зі способами даного винаходу. Короткий опис фігури Фігура 1. Одержання інбредних ліній соняшника, які містять нормальну цитоплазму, які є гетерозиготними або гомозиготними стосовно гена відновлення фертильності Rf. Детальний опис винаходу Інбредні лінії з цитоплазматичною чоловічою стерильністю, які походять від усіх ліній RHA, охоплених цим дослідженням, одержували з застосуванням способів, запропонованих даним винаходом. Звична процедура одержання жіночих ліній соняшника для виробництва гібридів вимагає послідовного самозапилення ліній HA та включення цитоплазматичної чоловічої стерильності у ці інбредні рослини HA (MILLER, J.F.; FICK, G.N. The genetics of sunflower. In: SCHNEITER, A.A. (Ed.). Sunflower technology and production. Wisconsin: ASA-CSSA-SSSA, 1997. p. 441-495). Методологія, описана й прийнята в цій роботі, крім створення ліній RHA та включення цитоплазматичної чоловічої стерильності у лінії HA, вимагає перетворення ліній RHA на лінії HA, що потребує п'яти циклів відтворення, еквівалентних трьом рокам (Фігура 1). Навіть при цьому можливість одержання ліній HA, а отже, ліній CMS-HA, з гібридів, здебільшого комерційних, яке нині здійснюється для інбредних ліній RHA, є цікавою альтернативою, оскільки вона забезпечує краще використання генетичного потенціалу адаптованих генотипів з потрібними ознаками, також для чоловічої батьківської лінії, з явними перевагами процесу одержання гібридів з поліпшеними генотипами для жіночих, а також для чоловічих рослин. У цьому контексті мета даного винаходу полягає у забезпеченні способу одержання жіночих інбредних ліній з гібридів рослин родини айстрових з використанням соняшника як моделі та варіантів втілення, які здійснюються з метою одержання описаних результатів за допомогою зазначеного способу. При застосуванні даного винаходу використовували лише генотипи, які експресують відновлення фертильності моногенним способом для CMS PET1, оскільки у понад 40 джерелах ідентифікованих CMS з часу виявлення PET1 CMS у 1968 р. (Leclercq, P. 1969. Une sterilité cytoplasmique chez le tournesol. Ann. Amelior. Plantes 19:99–106) від схрещування між H.petiolaris та H. annuus було виявлено, що відновлення фертильності переважно контролюється одним або двома генами (SERIEYS, H. Identification, study and utilization in breeding programs of new CMS sources. Helia, v.19, p.144-160, 1996). Крім цього, у переважній більшості комерційних 3 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 гібридів соняшника використовується вихідний CMS PET1 з єдиним геном відновлення фертильності. В останні роки було описано кілька інших джерел цитоплазматичної чоловічої стерильності, а також ідентифіковано й досліджено гени відновлення фертильності (Jan, C.C. and B.A. Vick. Registration of Seven Cytoplasmic Male-Sterile and Four Fertility Restoration Sunflower Germplasms. Crop Sci. 46:1829–1830 (2006). У варіанті втілення даного винаходу жіночі інбредні лінії гібридів соняшника було виведено з ліній RHA з геном відновлення фертильності Rf, одержаних через самозапилення гібридів. Ці лінії RHA спочатку модифікували до ліній HA з генотипом N-rfrf, а потім до ліній з цитоплазматичною чоловічою стерильністю з генотипом S-rfrf. У ще одному варіанті втілення винаходу лінії RHA модифікували до ліній HA через послідовне зворотне схрещування, схрещування будь-якої лінії HA (нерекурентної батьківської лінії) з інбредною лінією RHA (рекурентною батьківською лінією) (Фігура 1). У цих схрещуваннях, оскільки жіночі батьківські рослини (HA і покоління F1 та BC n) містять нормальну цитоплазму, їх попередньо піддавали кастрації. У кожному поколінні зворотного схрещування квітки, кастровані у центральній зоні плантації соняшників BCn, які є гомозиготними або гетерозиготними стосовно гена Rf, отримували пилок від рекурентних батьківських рослин з метою вироблення насіння покоління BCn+1. Лише насіння рослини BC n, гетерозиготної стосовно локусу Rf, давало наступне покоління. Після послідовних зворотних схрещувань гетерозиготи (Rfrf) та гомозиготи (RfRf) покоління BCn самозапилювалися. Від самозапилення рослин Rfrf покоління BC n одержували рослини HA (N rfrf) та рослини RHA (N RfRf та N Rfrf). Рослини HA (N rfrf) та рослини RHA (N RfRf та N Rfrf), одержані від самозапилення рослин Rfrf, самозапилювалися. Потім рослину HA (N rfrf) модифікували до рослин з чоловічою стерильністю через послідовне зворотне схрещування, у якому нерекурентною батьківською рослиною була будь-яка рослина з цитоплазматичною чоловічою стерильністю, а рекурентною батьківською рослиною була лінія HA (N rfrf) (MILLER, J.F.; FICK, G.N. The genetics of sunflower. In: SCHNEITER, A.A. (Ed.). Sunflower technology and production. Wisconsin: ASA-CSSA-SSSA, 1997. p.441-495). Покоління F1 одержували на етапі ідентифікації рослин HA. Процедура відбувалась як будь-яка система зворотного схрещування, зі схрещуванням рослин з чоловічою стерильністю з батьківською рослиною HA. Для відрізнення гетерозиготних рослин від гомозиготних стосовно локусу Rf здійснювали аналітичні схрещування з лініями CMS-Ha. Потомство лінії CMS-HA, схрещеної з батьківськими гетерозиготними стосовно Rf рослинами, включало фертильні та стерильні рослини, тоді, як схрещування з батьківськими гомозиготними стосовно Rf рослинами давало лише фертильні рослини. У соняшника пилкування квіток у зовнішньому кільці ділянки відбувається раніше, ніж у квіток у центральній зоні. Отже, для аналітичного схрещування квітки у зовнішньому кільці ділянки рослин BCn віддавали пилок для запліднення будь-якої лінії з чоловічою стерильністю і потім мали бути обов'язково видалені з цвітіння з метою уникнення запилення квіток з центральної зони, яке б застосовувалося для забезпечення безперервності беккросів BCn+1. Для відрізнення рослин HA (N rfrf) від рослин RHA (N RfRf та N Rfrf) здійснювали аналітичні схрещування з лініями CMS-HA. Потомство від лінії CMS-HA, схрещеної з рослинами HA (N rfrf) давало лише стерильні рослини, тоді, як схрещування з рослиною RHA (N RfRf та N Rfrf) давало фертильні та стерильні рослини. Відтворюваність перетворення процесу виділення жіночих ліній з гібридів на звичну селекційну практику також є пов'язаною з кількістю ліній RHA, які мають бути модифіковані до інбредних ліній HA. Один зі способів зменшення цієї кількості полягає у здійсненні перед модифікацією оцінки загальної та/або специфічної комбінаційної здатності ліній RHA шляхом використання топкросів до ізогенних інбредних ліній CMS-HA з чоловічими гібридними лініями або з лініями з генетичною чоловічою стерильністю або з лініями з високою комбінаційною здатністю. Зміні мають піддаватися лише елітні лінії, що, таким чином, зменшує необхідні час та зусилля. Додатковий варіант втілення винаходу полягає в тому, що аналітичним схрещуванням для відрізнення гетерозиготних рослин від гомозиготних рослин стосовно гена відновлення фертильності також може сприяти застосування молекулярних маркерів. Це також стосується характеристики CMS, контрольованої єдиним геном і особливо є доцільним у тих небагатьох описаних у літературі випадках відновлення фертильності у соняшнику, яке контролюється щонайбільше чотирма генами (VRANCEANU, V.A.; STOENESCU, F.M. Pollen fertility restorer gene from cultivated sunflower (Helianthus annuus L.). Euphytica, v.20, p.536-541, 1971.; ANASHCHENKO, A.V.; DUKA, M.V. Study of the genetic system of CMS-Rf in sunflower (Helianthus annuus L.) III. Restoration of male fertility in the CMS1-based hybrids. Genetika, v.21, p.2005-2010, 4 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 1985; IUORAS, M.; VRANCEANU, A.V.; BERVILLE, A. Cytoplasm: nucleus relationships in the CMS pollen fertility restoration in Fundulea 1 (ANT-1) CMS of sunflower. In: INTERNATIONAL SUNFLOWER CONFERENCE, 13., 1992, Pisa. Proceedings. Paris: International Sunflower Association, 1992. p.1072-1077; KURAL, A.; MILLER, J.F. The inheritance of male fertility restoration of the PET2, G1G1 e MAX1 sunflower cytoplasmic male sterility sources. In: INTERNATIONAL SUNFLOWER CONFERENCE, 13., 1992, Pisa. Proceedings. Paris: International Sunflower Association, 1992. p.1107-1112). Для джерела CMS PET1 молекулярні маркери (STS) для Rf 1 (моногенна спадковість) визначалися авторами публікації KUSTERER, B.; PRÜFE, M., LAZARESCU, E. ÖZDEMIR, N.; FRIEDT, W.; HORN, R. Mapping of the restorer gene Rf 1 in sunflower (Helianthus annuus L.). Helia, v.25, n.36, p.41-46, jul. 2002.), а потім могли застосовуватися для ідентифікації рослин Rf 1Rf1 та Rf1rf1). Приклад Лінії CMS-HA походили від 10 інбредних ліній RHA, одержаних через самозапилення та селекцію рослин кількох комерційних гібридів з Бразилії, без документування їхнього походження. Використовували лише генотипи, які експресували моногенне відновлення фертильності для CMS PET1. Для процесу виведення CMS-HA лінії RHA спочатку змінювали на інбредні лінії HA, через три зворотні схрещування (кількість, достатня для досягнення очікуваного відсотка рекурентної батьківської рослини понад 90 %) на лінію HA 300 (загальнодоступна інбредна лінія USDA-ARS), яку використовували як нерекурентну батьківську рослину. Рослини RfRf та Rfrf, одержані від третього покоління беккросів, потім самозапилювалися й ідентифікувалися через аналітичні схрещування з інбредною лінією CMSHA 300. Цю інбредну лінію CMS-HA також використовували для відсіювання рослин HA (N rfrf) від рослин RHA (N RfRf та N Rfrf), від потомства від самозапилених рослин Rfrf. Потім інбредні лінії HA змінювали на CMS-HA за допомогою трьох зворотних схрещувань на лінію CMS-HA 300, яку використовували як нерекурентну батьківську рослину, згідно з процедурою, описаною у публікації MILLER, J.F.; FICK, G.N. The genetics of sunflower. In: SCHNEITER, A.A. (Ed.). Sunflower technology and production. Wisconsin: ASA-CSSA-SSSA, 1997. p. 441-495. Усі схрещування, які здійснювалися для зміни рослин RHA на рослини HA, виконували в оранжерейних умовах з метою досягнення високого ступеня контролю над умовами експерименту. Однак схрещування для включення чоловічої стерильності у рослини HA здійснювали на експериментальному полі, як це зазвичай здійснюється у програмах селекції. Усі публікації та патентні заявки, згадані в описі, є адресованими спеціалістам у галузі, до якої належить цей винахід. Усі публікації та патентні заявки є включеними до цього опису шляхом посилання такою самою мірою, як це було б, якби кожна окрема публікація або патентна заявка була спеціально й окремо вказана як включена шляхом посилання. Хоча даний винахід було описано у певних деталях для пояснення та прикладу з метою більшої зрозумілості, очевидним є те, що існує можливість певних модифікацій без відхилення від обсягу супровідної формули винаходу. ФОРМУЛА ВИНАХОДУ 1. Спосіб одержання жіночих інбредних ліній з гібридів айстрових, згідно з яким одержання цих ліній полягає у зміні інбредних рекурентних ліній RHA, одержаних від самозапилення комерційних або некомерційних гібридів, на інбредні нерекурентні лінії НА з метою модифікації цих ліній НА до рослин з чоловічою стерильністю, причому вищезгаданий спосіб включає такі етапи: a) схрещування будь-якої інбредної нерекурентної лінії НА айстрових, попередньо кастрованих або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, з інбредною рекурентною батьківською лінією RHA, яка містить ген відновлення фертильності; b) одержання покоління F1, яке містить 50 % генотипу рекурентної батьківської лінії RHA з етапу (а); c) зворотне схрещування F1, попередньо кастрованого або підданого попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, з рекурентною батьківською лінією RHA з етапу (а); d) одержання беккроса 1 (ВС1), який містить 75 % фенотипу рекурентної батьківської лінії з етапу (а); е) ідентифікація гетерозигот (Rfrf) та гомозигот (RfRf) покоління ВС1, одержаного на етапі (d); f) зворотне схрещування ВС1 гетерозиготних (Rfrf) та гомозиготних (RfRf) рослин ВС1, попередньо кастрованих або підданих попередній стерилізації пилку через застосування 5 UA 105801 C2 5 10 15 20 25 30 35 40 45 50 55 60 хімічних агентів або інших механізмів, з рекурентною батьківською лінією з етапу (а) з метою одержання ВС2, де лише насіння гетерозиготних рослин ВС1 дає наступне покоління; g) одержання покоління ВСn від покоління ВСn-1 згідно з етапами (е) та (f); h) здійснення після послідовного зворотного схрещування ідентифікації та самозапилення гетерозигот (Rfrf) та гомозигот (RfRf) покоління ВС n, одержаного на етапі (g), де самозапилення рослин Rfrf покоління ВСn забезпечує рослини НА (N rfrf) та рослини RHA (N RfRf та N Rfrf); і) ідентифікація та самозапилення рослин НА (N rfrf) та рослин RHA (N RfRf та N Rfrf), одержаних від самозапилення рослин Rfrf на етапі (h); j) зміна рослини НА (N rfrf), одержаної на етапі (h), до рослини з чоловічою стерильністю після послідовних зворотних схрещувань, причому нерекурентною батьківською лінією є будь-яка рослина, яка має цитоплазматичну чоловічу стерильність, а рекурентна батьківська рослина належить до лінії НА (N rfrf), де покоління F1 одержують на етапі ідентифікації рослин НА, описаних на етапі (і). 2. Спосіб за п. 1, який відрізняється тим, що етап (е) за п. 1, який полягає в ідентифікації покоління ВС1, що здійснюють згідно з такою процедурою: a) запилення рослин з чоловічою стерильністю пилком, виробленим ВС1; b) ідентифікація лінії, утвореної у ВС1, як домінантної гомозиготної для гена відновлення фертильності (RfRf), якщо вона дає 100 % фертильних рослин після схрещування, вказаного на етапі (а); c) ідентифікація лінії, утвореної у ВС1, як гетерозиготної для гена відновлення фертильності (Rfrf), якщо вона дає фертильні та стерильні рослини після схрещування, вказаного на етапі (а), де цей процес також здійснюють на етапі ідентифікації покоління ВСn (етап (h) за п. 1. 3. Спосіб за п. 1, який відрізняється тим, що етап (і) за п. 1, який полягає в ідентифікації рослин НА (N rfrf) та рослин RHA (N RfRf та N Rfrf), здійснюють згідно з такою процедурою: a) запилення рослин з чоловічою стерильністю пилком, виробленим рослинами НА (N rfrf) та рослинами RHA (N RfRf та N Rfrf); b) ідентифікація рослини НА (N rfrf), якщо вона дає 100 % стерильних рослин після схрещування, вказаного на етапі (а); c) ідентифікація рослини RHA (N RfRf та N Rfrf), якщо вона дає 100 % фертильних рослин або фертильні та стерильні рослини, у будь-якій пропорції більше нуля. 4. Спосіб за п. 1, який відрізняється тим, що етап (f) за п. 1, який полягає в одержані лінії ВС2, здійснюють згідно з такою процедурою: a) запилення квіток рослин ВС1, попередньо кастрованих або підданих попередній стерилізації пилку через застосування хімічних агентів або інших механізмів, пилком рекурентної батьківської лінії RHA, вказаної на етапі (а) за п. 1; b) одержання лінії ВС2, яка містить нормальну цитоплазму і має домінантний гомозиготний генотип для гена відновлення фертильності, від схрещування згідно з етапом (а), яке здійснювали з лінією ВС1, ідентифікованою згідно з етапом (b) за п. 2; c) одержання лінії ВС2, яка містить нормальну цитоплазму і має генотип відновлення фертильності у гомозиготах та гетерозиготах, від схрещування згідно з етапом (а), яке здійснювали з лінією ВС1, ідентифікованою згідно з етапом (с) за п. 2. 5. Спосіб за п. 1, який відрізняється тим, що запилення рослин з чоловічою стерильністю здійснюється пилком, видобутим з зовнішнього кільця ділянок рослин ВС1, зони, у якій ця частина головки видаляється відразу після забирання пилку. 6. Спосіб за п. 1, який відрізняється тим, що квітки лінії ВС1, які підлягають запиленню пилком з рекурентної батьківської лінії RHA, розташовуються у центральній зоні ділянки. 7. Спосіб за п. 1, який відрізняється тим, що вищезгаданий спосіб є модифікацією етапу (h) за вищезгаданим пунктом, згідно з яким група рослин BCn (RfRf та Rfrf) самозапилюється, і рослини НА (N rfrf) та рослини RHA (N RfRf та N Rfrf) з цієї самозапиленої групи ідентифікують і піддають самозапиленню, як описано на етапі (і). 8. Спосіб за п. 1, який відрізняється тим, що передбачає застосування молекулярних маркерів або будь-якої іншої технології і з метою розпізнавання/ідентифікації гетерозиготних рослин та гомозиготних рослин стосовно гена відновлення фертильності. 9. Спосіб за п. 1, який відрізняється тим, що застосовані лінії айстрових являють собою Helianthus annuus. 10. Спосіб зміни ліній RHA за допомогою гена відновлення фертильності на лінії НА, причому ці лінії НА одержують від самозапилення лінії ВС n, гетерозиготної стосовно гена Rf, одержаної згідно з етапом (с) за п. 4. 11. Спосіб за п. 10, який відрізняється тим, що застосовані лінії айстрових являють собою Helianthus annuus. 6 UA 105801 C2 Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for obtaining female parent lines of asteraceae from hybrids
Автори англійськоюCarvalho, Claudio Guilherme Portela de, Toledo, Jose Francisco Ferraz de
Автори російськоюКарвальо Клаудиу Гилерме Портела ди, Толедо Жозе Франциску Ферраз ди
МПК / Мітки
МПК: A01H 1/02
Мітки: ліній, одержання, asteracea, інбредних, спосіб, гібридів, жіночих
Код посилання
<a href="https://ua.patents.su/9-105801-sposib-oderzhannya-zhinochikh-inbrednikh-linijj-z-gibridiv-asteracea.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання жіночих інбредних ліній з гібридів asteracea</a>
Попередній патент: Пристрій для очищення димового газу промислових подрібнювачів
Наступний патент: Лазер з плавним регулюванням виведення випромінювання з резонатора
Випадковий патент: Комбіноване крило літального апарата