Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою
Формула / Реферат
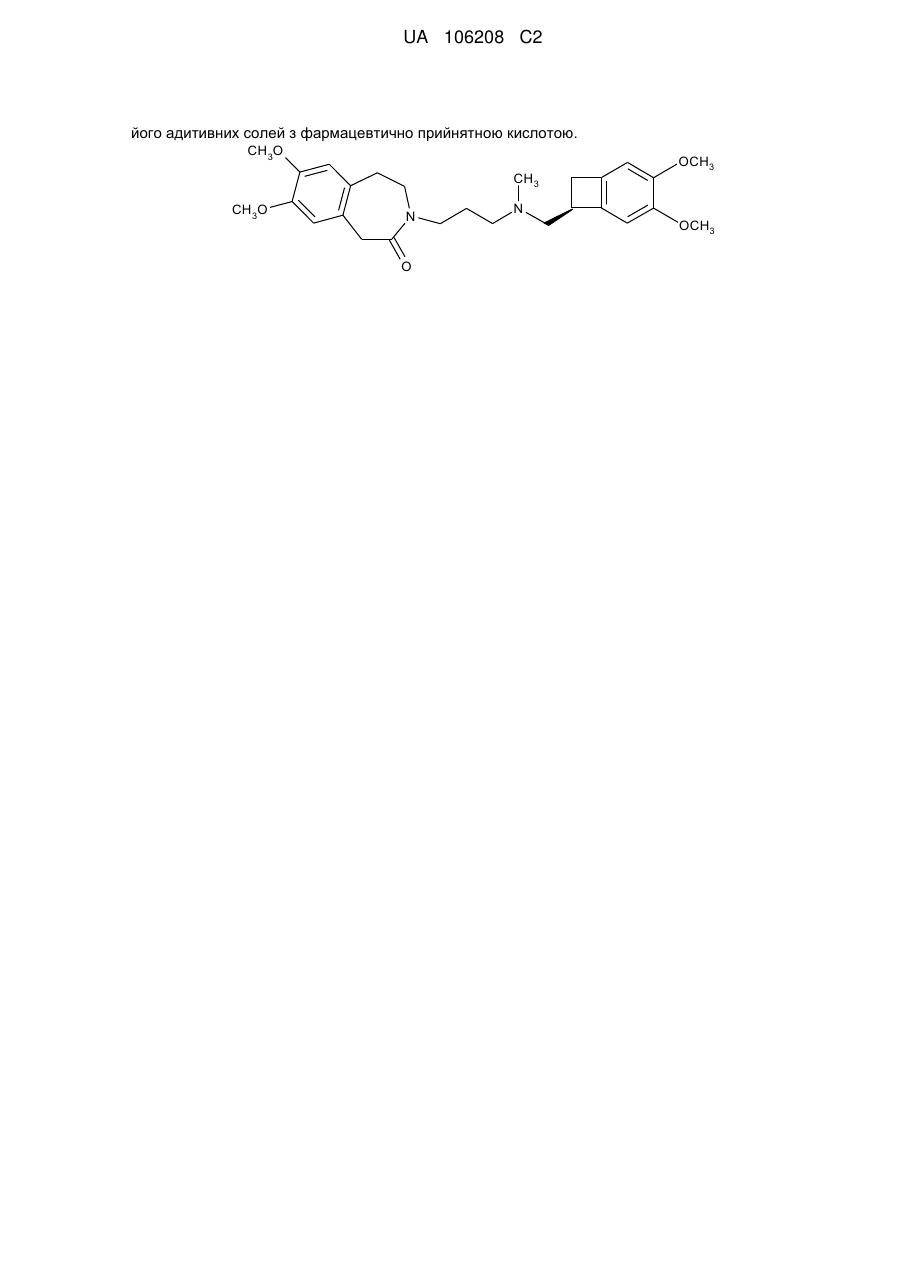
1. Спосіб синтезу івабрадину формули (І):
 , (I)
, (I)
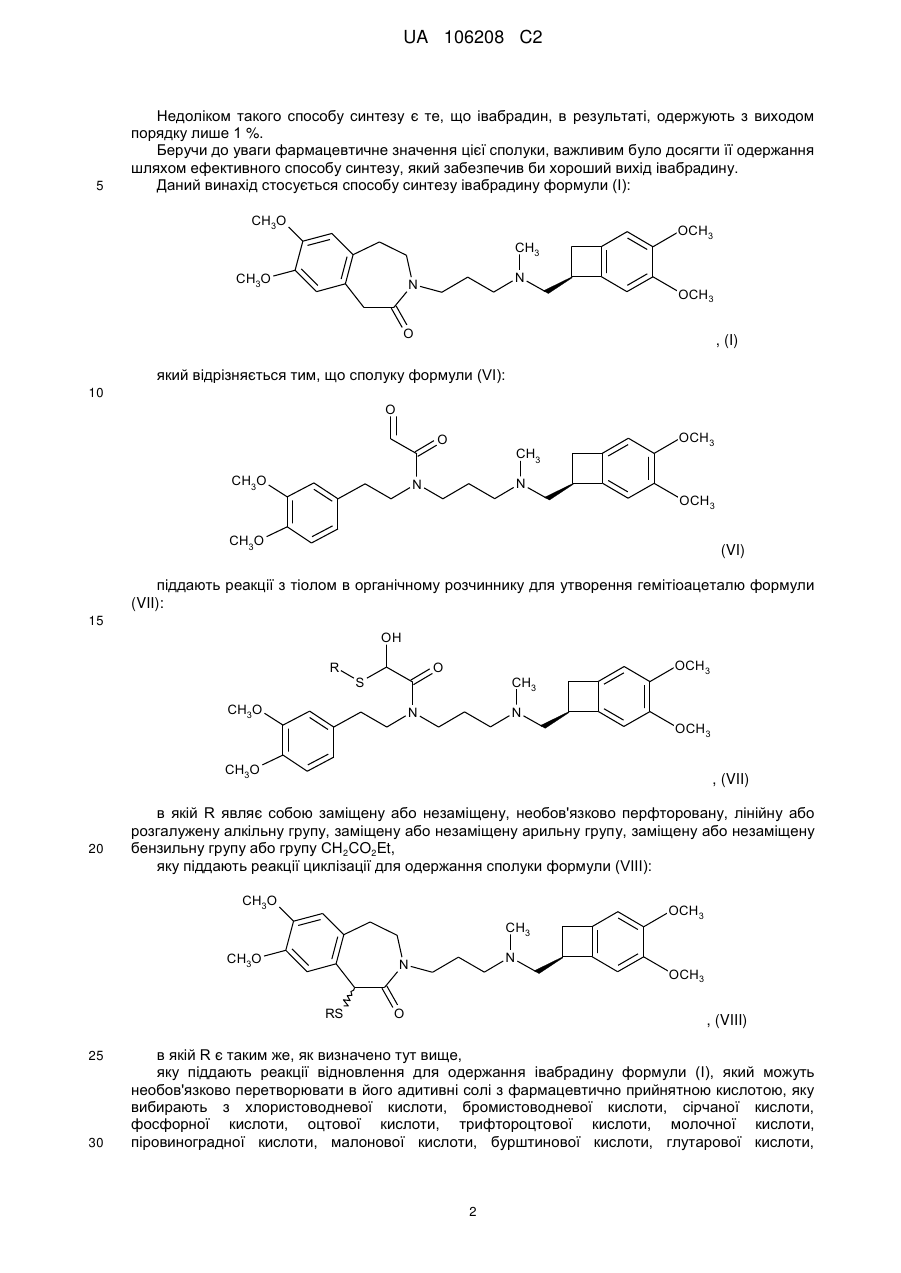
який відрізняється тим, що сполуку формули (VI):
 (VI)
(VI)
піддають реакції з тіолом в органічному розчиннику з утворенням гемітіоацеталю формули (VII):
 , (VII)
, (VII)
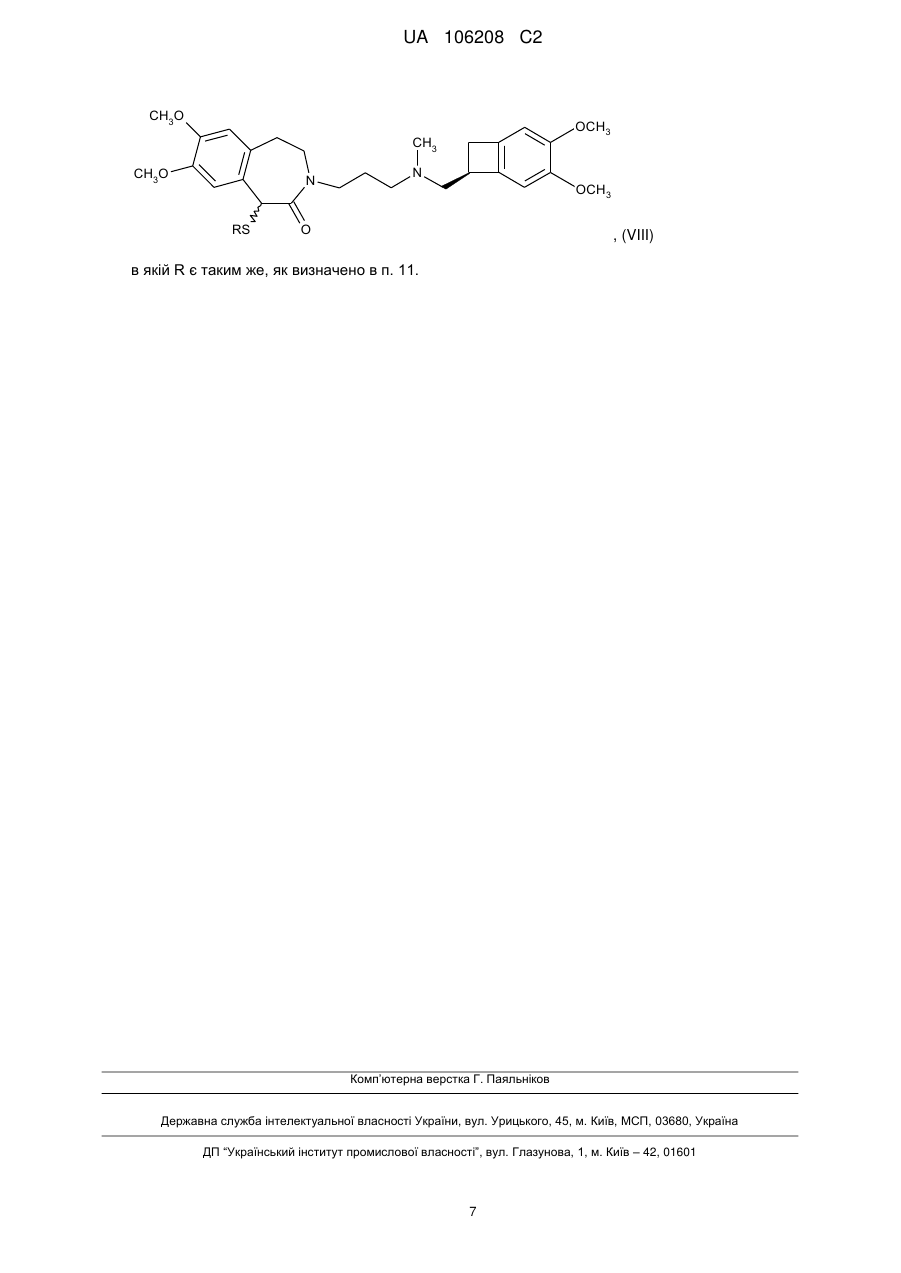
в якій R являє собою заміщену або незаміщену, необов'язково перфторовану, лінійну або розгалужену алкільну групу, заміщену або незаміщену арильну групу, заміщену або незаміщену бензильну групу або групу CH2CO2Et, яку піддають реакції циклізації з одержанням сполуки формули (VIII):
 , (VIII)
, (VIII)
в якій R є таким же, як визначено тут вище,
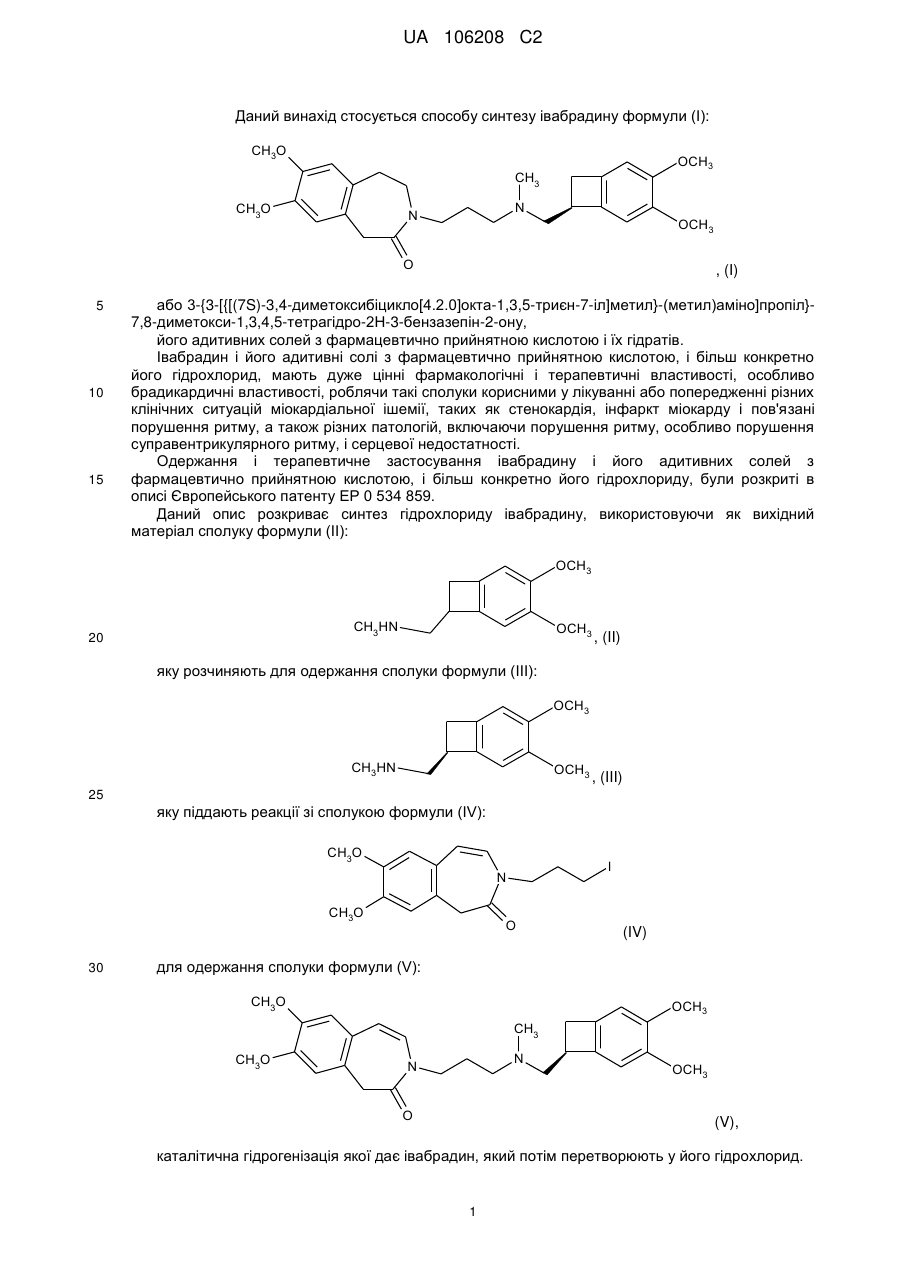
яку піддають реакції відновлення з одержанням івабрадину формули (І), який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати.
2. Спосіб синтезу за п. 1, який відрізняється тим, що органічний розчинник, який використовують в реакції утворення гемітіоацеталю формули (VII), являє собою дихлорметан.
3. Спосіб синтезу за п. 1 або 2, який відрізняється тим, що тіол, який вибирають для реакції зі сполукою формули (VI), являє собою тіофенол.
4. Спосіб синтезу за будь-яким з пп. 1-3, який відрізняється тим, що розчинник, який використовують в реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), являє собою дихлорметан.
5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності реагенту, який вибирають з оцтового ангідриду, трифтороцтового ангідриду і триметилсилілтрифторметансульфонату.
6. Спосіб синтезу за п. 5, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду.
7. Спосіб синтезу за п. 6, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду і кислоти Льюїса, яку вибирають з BF3·OEt2, Sc(OTf)3 і Yb(OTf)3.
8. Спосіб синтезу за п. 7, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду і BF3·OEt2.
9. Спосіб синтезу за будь-яким з пп. 1-8, який відрізняється тим, що реакцію відновлення сполуки формули (VIII) проводять у присутності нікелю Ренея в етанолі або у присутності йодиду самарію(ІІ) у тетрагідрофурані.
10. Сполука формули (VI):
 . (VI)
. (VI)
11. Сполука формули (VII):
 , (VII)
, (VII)
в якій R являє собою заміщену або незаміщену, необов'язково перфторовану, лінійну або розгалужену алкільну групу, заміщену або незаміщену арильну групу, заміщену або незаміщену бензильну групу або групу CH2CO2Et.
12. Сполука формули (VIII):
 , (VIII)
, (VIII)
в якій R є таким же, як визначено в п. 11.
Текст
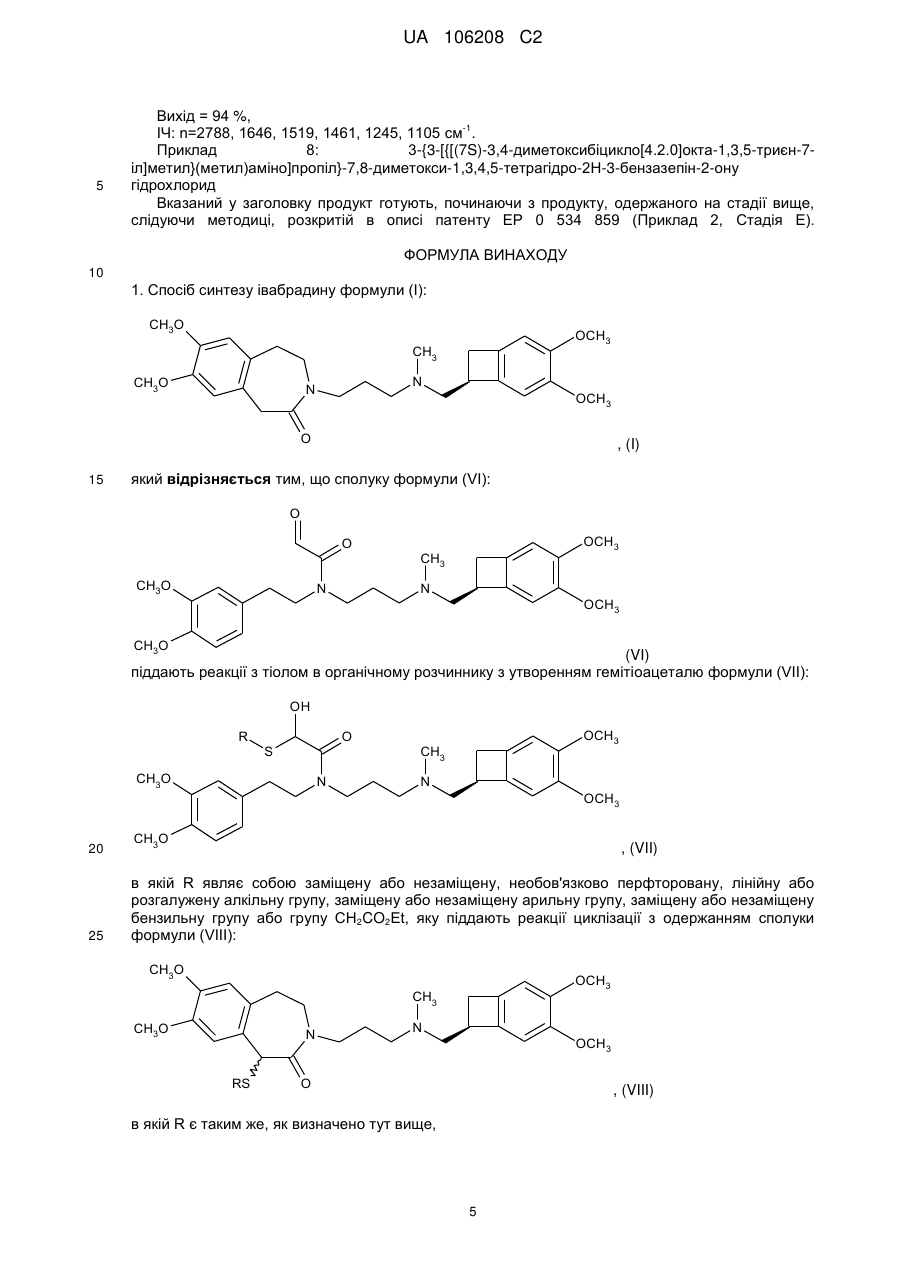
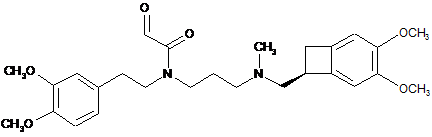
Реферат: Спосіб синтезу івабрадину формули (І): CH3O CH3 CH3O N O OCH3 N OCH3 , (I) З ФАРМАЦЕВТИЧНО UA 106208 C2 (12) UA 106208 C2 його адитивних солей з фармацевтично прийнятною кислотою. CH3O CH3 CH3O N O OCH3 N OCH3 UA 106208 C2 Даний винахід стосується способу синтезу івабрадину формули (І): CH3O OCH3 CH3 CH3O N N OCH3 O 5 10 15 , (I) або 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-(метил)аміно]пропіл}7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону, його адитивних солей з фармацевтично прийнятною кислотою і їх гідратів. Івабрадин і його адитивні солі з фармацевтично прийнятною кислотою, і більш конкретно його гідрохлорид, мають дуже цінні фармакологічні і терапевтичні властивості, особливо брадикардичні властивості, роблячи такі сполуки корисними у лікуванні або попередженні різних клінічних ситуацій міокардіальної ішемії, таких як стенокардія, інфаркт міокарду і пов'язані порушення ритму, а також різних патологій, включаючи порушення ритму, особливо порушення суправентрикулярного ритму, і серцевої недостатності. Одержання і терапевтичне застосування івабрадину і його адитивних солей з фармацевтично прийнятною кислотою, і більш конкретно його гідрохлориду, були розкриті в описі Європейського патенту ЕР 0 534 859. Даний опис розкриває синтез гідрохлориду івабрадину, використовуючи як вихідний матеріал сполуку формули (II): OCH3 CH3HN 20 OCH3 , (II) яку розчиняють для одержання сполуки формули (III): OCH3 CH3HN OCH3 , (III) 25 яку піддають реакції зі сполукою формули (IV): CH3O I N CH3O 30 O (IV) для одержання сполуки формули (V): CH3O OCH3 CH3 CH3O N N O OCH3 (V), каталітична гідрогенізація якої дає івабрадин, який потім перетворюють у його гідрохлорид. 1 UA 106208 C2 5 Недоліком такого способу синтезу є те, що івабрадин, в результаті, одержують з виходом порядку лише 1 %. Беручи до уваги фармацевтичне значення цієї сполуки, важливим було досягти її одержання шляхом ефективного способу синтезу, який забезпечив би хороший вихід івабрадину. Даний винахід стосується способу синтезу івабрадину формули (І): CH3O CH3 CH3O OCH3 N N OCH3 O , (I) який відрізняється тим, що сполуку формули (VI): 10 O O CH3O CH3 OCH3 N N OCH3 CH3O (VI) піддають реакції з тіолом в органічному розчиннику для утворення гемітіоацеталю формули (VII): 15 OH R O S CH3O CH3 OCH3 N N OCH3 CH3O 20 , (VII) в якій R являє собою заміщену або незаміщену, необов'язково перфторовану, лінійну або розгалужену алкільну групу, заміщену або незаміщену арильну групу, заміщену або незаміщену бензильну групу або групу CH2CO2Et, яку піддають реакції циклізації для одержання сполуки формули (VIII): CH3O CH3 CH3O 25 30 N N RS OCH3 OCH3 O , (VIII) в якій R є таким же, як визначено тут вище, яку піддають реакції відновлення для одержання івабрадину формули (І), який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, 2 UA 106208 C2 5 10 15 20 25 30 35 40 45 50 55 60 фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. Перевага надається розчиннику, який використовують в реакції утворення гемітіоацеталю формули (VII), який являє собою дихлорметан. Перевага надається тіолу, який вибирають для реакції зі сполукою формули (VI), який являє собою тіофенол. Перевага надається розчиннику, який використовують в реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), який являє собою дихлорметан. У переважному втіленні даного винаходу реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності реагенту, який вибирають з оцтового ангідриду, трифтороцтового ангідриду і триметилсилілтрифторметансульфонату. Найбільша перевага надається реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), яку проводять у присутності трифтороцтового ангідриду. Навіть ще більша перевага надається реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), яку проводять у присутності трифтороцтового ангідриду і кислоти Льюїса, яку вибирають з BF3·OEt2, Sc(OTf)3 і Yb(OTf)3. Навіть ще більша перевага надається реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), яку проводять у присутності трифтороцтового ангідриду і BF3·OEt2. Реакцію відновлення сполуки формули (VIII) переважно проводять у присутності нікелю Ренея в етанолі або у присутності йодиду самарію(ІІ) у тетрагідрофурані. Сполуки формули (VI), (VII) і (VIII) являють собою нові продукти, які є корисними як проміжні сполуки синтезу у хімічній або фармацевтичній промисловості, особливо у синтезі івабрадину, його адитивних солей з фармацевтично прийнятною кислотою і його гідратів, і як такі вони утворюють невід'ємну частину даного винаходу. Перелік використаних скорочень: ДМФ: N, N-диметилформамід; ДМСО: диметилсульфоксид; ТГФ: тетрагідрофуран; ІЧ: інфрачервоний. Нижченаведені приклади демонструють даний винахід. Точки плавлення (т.пл.) вимірюють, використовуючи блок Кофлера (БК). Інфрачервоні спектри зчитують на ІЧ-спектрометрі Bruker Tensor 27 з додатковим елементом Golden Gate ATR. Речовини вміщують на планшет у чистому вигляді. Приклад 1: трет-бутил[2-(3,4-диметоксифеніл)етил]карбамат Ди-трет-бутилдикарбонат (12 г; 55,2 ммоль) додають до розчину 2-(3,4диметоксифеніл)етиламіну (10 г; 55,2 ммоль) в дихлорметані (200 мл). Після реагування протягом 1 години при температурі навколишнього середовища, реакційну суміш концентрують під зниженим тиском. Залишок переміщують в пентан (100 мл) і, після реагування протягом 1 години при температурі навколишнього середовища, суспензію фільтрують над фритою. 13,2 г вказаного у заголовку продукту одержують у формі твердої речовини. Вихід = 85 %, т.пл. = 65±2 °C. Приклад 2: трет-бутил-3-[{[(7S)-3,4-диметоксибіцикло-[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл-[2-(3,4-диметоксифеніл)етил]карбамат NaH (60 % в олії) (1,14 г; 28,5 ммоль) додають, невеликими частинками, при температурі навколишнього середовища, до розчину сполуки, одержаної на стадії вище, (7,6 г; 27 ммоль) у 40 мл ДМФ. Після реагування протягом 1 години, при температурі навколишнього середовища, додають розчин 3-хлор-N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-Nметил-1-пропанаміну (7,68 г; 27 ммоль) у 16 мл ДМФ і потім реакційну суміш нагрівають при 80 °C протягом 3 годин. Після охолодження до температури навколишнього середовища, реакційну суміш виливають в суміш дистильованої води і льоду. Водну фазу екстрагують етилацетатом. Об'єднані органічні фази висушують над MgSO 4 і потім концентрують під зниженим тиском. Залишок очищують за допомогою хроматографії на кремнеземі (СН2Сl2/ЕtOН:95/5) і 9,1 г вказаного у заголовку продукту одержують у формі олії. Вихід = 64 %, -1 ІЧ: n=3340, 1678, 1519, 1167 см . Приклад 3: N-{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7-іл]метил}-N'-[2-(3,4диметоксифеніл)етил]-N-метил-1,3-пропандіамін 3 UA 106208 C2 5 10 15 20 25 30 35 40 45 50 55 60 9 г (17 ммоль) сполуки, одержаної на стадії вище, розчиняють у 2,8N розчині етанольної НСl. Після реагування протягом 2 годин при температурі навколишнього середовища, реакційну суміш концентрують під зниженим тиском. Залишок переміщують у 1N розчин гідроксиду натрію і потім водну фазу екстрагують етилацетатом. Після висушування органічної фази над MgSO 4 і потім концентрування під зниженим тиском, 6,8 г вказаного у заголовку продукту одержують у формі олії. Вихід = 93 %, -1 ІЧ: n=3304, 2793, 1261, 1236, 1205, 1153 см . Приклад 4: N-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-N-[2-(3,4-диметоксифеніл)етил]-2-гідроксіацетамід Стадія 1: 2-{{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-[2-(3,4-диметоксифеніл)етил]аміно}-2-оксоетилу ацетат До розчину сполуки, одержаної на стадії вище, (6,8 г; 15,8 ммоль) у 200 мл дихлорметану додають, при 0 °C, триетиламін (3,1 г; 22 ммоль) і потім, краплями, ацетоксіацетилу хлорид (2,1 мл; 19 ммоль). Після реагування протягом 0,5 години при температурі навколишнього середовища, реакційну суміш промивають дистильованою водою і потім органічну фазу висушують над MgSO4. Після концентрування органічної фази під зниженим тиском, 8 г вказаного у заголовку продукту одержують у формі олії і використовують на наступній стадії без очищення. Стадія 2: N-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-N-[2-(3,4-диметоксифеніл)етил]-2-гідроксіацетамід К2СО3 (8,3 г; 60,4 ммоль) додають до розчину сполуки, одержаної на стадії вище, (8 г) у 80 мл суміші вода/метанол (2/1). Після реагування протягом 1 години при температурі навколишнього середовища, реакційну суміш концентрують під зниженим тиском і потім залишок додають у дистильовану воду. Після екстрагування етилацетатом, об'єднані органічні фази висушують над MgSO4 і потім концентрують під зниженим тиском. 6,2 г вказаного у заголовку продукту одержують у формі олії. Вихід = 81 % (2 стадії), -1 ІЧ: n=3406, 2794, 1641, 1261, 1236, 1205, 1153 см . Приклад 5: N-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-N-[2-(3,4-диметоксифеніл)етил]-2-оксоацетамід До розчину оксалілхлориду (0,6 мл; 6,77 ммоль) у 25 мл дихлорметану додають, при -78 °C, розчин ДМСО (0,9 мл; 12,32 ммоль) у 5 мл дихлорметану. Після реагування протягом 1 години при -78 °C, додають розчин сполуки, одержаної на стадії вище, (3 г; 6,16 ммоль) у 25 мл дихлорметану протягом 0,5 години. Після реагування протягом години при -78 °C, додають триетиламін (4,3 мл; 30,8 ммоль); потім реакційну суміш перемішують протягом 3 годин при температурі навколишнього середовища і потім виливають у насичений водний розчин NaHCO 3. Органічну фазу висушують над MgSO4 і потім концентрують під зниженим тиском. 2,7 г вказаного у заголовку продукту одержують у формі олії. Вихід = 89 %, -1 ІЧ: n=2788, 1645, 1589, 1261, 1236, 1207, 1151 см . Приклад 6: 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-7,8-диметокси-1-(фенілсульфаніл)-1,3,4,5-тетрагідро-2Н-3бензазепін-2-он Тіофенол (0,53 мл; 5,17 ммоль) додають до розчину сполуки, одержаної на стадії вище, (2,6 г; 5,17 ммоль) у 60 мл дихлорметану. Після реагування протягом ночі, при температурі навколишнього середовища, додають, послідовно, трифтороцтовий ангідрид (6,5 мл; 47 ммоль) і потім BF3·OEt2 (6,5 мл; 26 ммоль). Реакційну суміш перемішують протягом 3 годин при температурі навколишнього середовища і потім виливають у насичений водний розчин NaHCO 3. Залишок, одержаний після висушування органічної фази над MgSO 4 і потім концентрування під зниженим тиском, очищують хроматографією на кремнеземі (CH2Cl2/EtOH/NH4OH 28 %: 97/3/0,3). 1,15 г вказаного у заголовку продукту одержують у формі олії. Вихід = 38 %, -1 ІЧ: n=2790, 1641, 1245, 1205, 1174 см . Приклад 7: 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-он Нікель Ренея (2,5 г) (50 % у Н2О) додають до розчину сполуки, одержаної на стадії вище (0,8 г; 1,39 ммоль) в етанолі. Після реагування протягом 1 години при нагріванні зі зворотним холодильником, суспензію охолоджують і потім фільтрують над целітом. 600 мг вказаного у заголовку продукту одержують у формі олії. 4 UA 106208 C2 5 Вихід = 94 %, -1 ІЧ: n=2788, 1646, 1519, 1461, 1245, 1105 см . Приклад 8: 3-{3-[{[(7S)-3,4-диметоксибіцикло[4.2.0]окта-1,3,5-триєн-7іл]метил}(метил)аміно]пропіл}-7,8-диметокси-1,3,4,5-тетрагідро-2Н-3-бензазепін-2-ону гідрохлорид Вказаний у заголовку продукт готують, починаючи з продукту, одержаного на стадії вище, слідуючи методиці, розкритій в описі патенту ЕР 0 534 859 (Приклад 2, Стадія Е). ФОРМУЛА ВИНАХОДУ 10 1. Спосіб синтезу івабрадину формули (І): CH3O OCH3 CH3 CH3O N N OCH3 O 15 , (I) який відрізняється тим, що сполуку формули (VI): O O CH3O OCH3 CH3 N N OCH3 CH3O (VI) піддають реакції з тіолом в органічному розчиннику з утворенням гемітіоацеталю формули (VII): OH R O S CH3O N OCH3 CH3 N OCH3 20 CH3O 25 в якій R являє собою заміщену або незаміщену, необов'язково перфторовану, лінійну або розгалужену алкільну групу, заміщену або незаміщену арильну групу, заміщену або незаміщену бензильну групу або групу CH2CO2Et, яку піддають реакції циклізації з одержанням сполуки формули (VIII): , (VII) CH3O OCH3 CH3 CH3O N RS N OCH3 O , (VIII) в якій R є таким же, як визначено тут вище, 5 UA 106208 C2 5 10 15 20 25 30 яку піддають реакції відновлення з одержанням івабрадину формули (І), який можуть необов'язково перетворювати в його адитивні солі з фармацевтично прийнятною кислотою, яку вибирають з хлористоводневої кислоти, бромистоводневої кислоти, сірчаної кислоти, фосфорної кислоти, оцтової кислоти, трифтороцтової кислоти, молочної кислоти, піровиноградної кислоти, малонової кислоти, бурштинової кислоти, глутарової кислоти, фумарової кислоти, винної кислоти, малеїнової кислоти, лимонної кислоти, аскорбінової кислоти, щавлевої кислоти, метансульфонової кислоти, бензолсульфонової кислоти і камфорної кислоти, і в його гідрати. 2. Спосіб синтезу за п. 1, який відрізняється тим, що органічний розчинник, який використовують в реакції утворення гемітіоацеталю формули (VII), являє собою дихлорметан. 3. Спосіб синтезу за п. 1 або 2, який відрізняється тим, що тіол, який вибирають для реакції зі сполукою формули (VI), являє собою тіофенол. 4. Спосіб синтезу за будь-яким з пп. 1-3, який відрізняється тим, що розчинник, який використовують в реакції циклізації сполуки формули (VII) для утворення сполуки формули (VIII), являє собою дихлорметан. 5. Спосіб синтезу за будь-яким з пп. 1-4, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності реагенту, який вибирають з оцтового ангідриду, трифтороцтового ангідриду і триметилсилілтрифторметансульфонату. 6. Спосіб синтезу за п. 5, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду. 7. Спосіб синтезу за п. 6, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду і кислоти Льюїса, яку вибирають з BF3·OEt2, Sc(OTf)3 і Yb(OTf)3. 8. Спосіб синтезу за п. 7, який відрізняється тим, що реакцію циклізації сполуки формули (VII) для утворення сполуки формули (VIII) проводять у присутності трифтороцтового ангідриду і BF3·OEt2. 9. Спосіб синтезу за будь-яким з пп. 1-8, який відрізняється тим, що реакцію відновлення сполуки формули (VIII) проводять у присутності нікелю Ренея в етанолі або у присутності йодиду самарію(ІІ) у тетрагідрофурані. 10. Сполука формули (VI): O O CH3O OCH3 CH3 N N OCH3 CH3O 35 . (VI) 11. Сполука формули (VII): OH R CH3O O S N OCH3 CH3 N OCH3 CH3O 40 , (VII) в якій R являє собою заміщену або незаміщену, необов'язково перфторовану, лінійну або розгалужену алкільну групу, заміщену або незаміщену арильну групу, заміщену або незаміщену бензильну групу або групу CH2CO2Et. 12. Сполука формули (VIII): 6 UA 106208 C2 CH3O OCH3 CH3 CH3O N RS N OCH3 O , (VIII) в якій R є таким же, як визначено в п. 11. Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори російськоюJean-Louis Peglion, Pascal Caignard
МПК / Мітки
МПК: A61K 31/55, A61P 9/10, A61P 9/06, C07D 223/16, C07D 405/12
Мітки: фармацевтично, івабрадину, солей, прийнятною, спосіб, адитивних, кислотою, синтезу
Код посилання
<a href="https://ua.patents.su/9-106208-sposib-sintezu-ivabradinu-i-jjogo-aditivnikh-solejj-z-farmacevtichno-prijjnyatnoyu-kislotoyu.html" target="_blank" rel="follow" title="База патентів України">Спосіб синтезу івабрадину і його адитивних солей з фармацевтично прийнятною кислотою</a>
Попередній патент: Система моніторингу підстрибування висівних секцій (варіанти)
Наступний патент: Холіновий водневий двокислотний співкристал 5-[(1z,2e)-2-метил-3-фенілпропеніліден]-4-оксо-2-тіоксо-3-тіазолідиноцтової кислоти
Випадковий патент: Спосіб виробництва ординарного рожевого столового малоокисненого вина