Спосіб одержання заміщених біфенілів
Номер патенту: 106723
Опубліковано: 10.10.2014
Автори: Смідт Себастіан Пер, Альтенхофф Ансгар Гереон, Шмідт-Лайтхофф Йоахім, Майвальд Фолькер, Віссель-Штолль Катрін, Кайл Міхаель
Формула / Реферат
1. Спосіб одержання заміщених біфенілів формули І
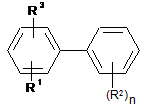 , I
, I
в якій замісники мають наступне значення:
R1 = нітро,
R2 = ціано, галоген, С1-С4-галогеналкіл, С1-С4-галогеналкокси або С1-С4-галогеналкілтіо,
n = 0, 1, 2 або 3, причому у випадку n = 2 або 3 залишки R2 можуть мати однакові або різні значення,
R3 = водень, ціано або галоген,
який відрізняється тим, що галогенбензол формули II
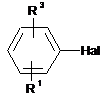 , II
, II
в якій Hal означає хлор або бром і R1 і R3 мають вказані вище значення, в присутності основи і паладієвого каталізатора, який складається з паладію і бідентатного фосфорного ліганду формули III
![]() , III
, III
причому Аr означає феніл, який може містити від одного до трьох замісників, вибраних з групи, що складається з метилу, метокси, фтору і хлору, і R4 і R5 кожного разу означають С1-С8-алкіл або С3-С6-циклоалкіл або R4 і R5 разом утворюють від 2- до 7-членний місток, який при бажанні може мати один С1-С6-алкільний замісник,
в розчиннику або розріджувачі піддають взаємодії з фенілбороновою кислотою IVa
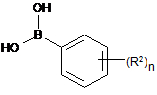 , IVa
, IVa
дифенілбориновою кислотою IVb
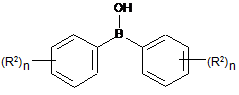 IVb
IVb
або сумішшю з IVa і IVb, де R2 і n кожного разу мають вказані вище значення.
2. Спосіб за п. 1, який відрізняється тим, що R2 означає галоген, n означає 2 або 3 і R3 означає водень або галоген.
3. Спосіб за п. 1, який відрізняється тим, що R2 означає фтор або хлор.
4. Спосіб за п. 1, який відрізняється тим, що R1 знаходиться в орто-положенні до фенільного кільця, яке має R2.
5. Спосіб за п. 1, який відрізняється тим, що R1 і R3 знаходяться в пара-положенні один до іншого.
6. Спосіб за п. 1, який відрізняється тим, що одержують біфеніли І, вибрані з групи, що складається з 3,4-дифтор-2'-нітробіфенілу, 2,4-дихлор-2'-нітробіфенілу, 3,4-дихлор-2'-нітробіфенілу, 3,4,5-трифтор-2'-нітробіфенілу.
7. Спосіб за п. 1, який відрізняється тим, що одержують 3,4,5-трифтор-2'-нітробіфеніл.
8. Спосіб за п. 1, який відрізняється тим, що Аr означає феніл.
9. Спосіб за п. 1, який відрізняється тим, що взаємодію проводять при температурі від 50 до 140 ºС.
10. Спосіб за п. 1, який відрізняється тим, що взаємодію проводять в суміші з води і органічного розчинника.
11. Спосіб за п. 8, який відрізняється тим, що як органічний розчинник застосовують простий ефір.
12. Спосіб за п. 1, який відрізняється тим, що взаємодії проводять під тиском від 1 до 6 бар.
13. 3,4,5-Трифтор-2'-нітробіфеніл.
14. Спосіб за п. 1, який відрізняється тим, що із заміщених біфенілів формули І потім відомим методом одержують піразолкарбоксаміди V
 , V
, V
причому n, R1, R2 мають значення, що зазначені в п. 1, і
R6 означає метил або галогенметил.
15. Спосіб за п. 14, який відрізняється тим, що піддають взаємодії одержані заміщені біфеніли І, вибрані з групи, що складається з 3,4-дифтор-2'-нітробіфенілу, 2,4-дихлор-2'-нітробіфенілу, 3,4-дихлор-2'-нітробіфенілу, 3,4,5-трифтор-2'-нітробіфенілу.
16. Спосіб за п. 14 або 15, який відрізняється тим, що піддають взаємодії 3,4,5-трифтор-2'-нітробіфеніл.
Текст
Реферат: Спосіб одержання заміщених біфенілів формули І R R 3 1 (R2) n ,I 1 причому R = нітро, 2 R = ціано, галоген, С1-С4-галогеналкіл, С1-С4-галогеналкокси або С1-С4-галогеналкілтіо, 3 n = від 0 до 3 і R = водень, ціано або галоген, який відрізняється тим, що галогенбензол формули II UA 106723 C2 (12) UA 106723 C2 R 3 Hal R 1 , II в якій Hal означає хлор або бром, в присутності основи і паладієвого каталізатора, який складається з паладію і бідентатного фосфорного ліганду формули III (Ar)2P R 5 R 4 P(Ar)2 , III 4 5 причому Аr означає при бажанні заміщений феніл і R і R кожного разу означають С1-С8-алкіл або С3-С6-циклоалкіл або разом утворюють від 2- до 7-членний місток, який при бажанні може мати С1-С6-алкільний замісник, піддають взаємодії в розчиннику або розріджувачі з фенілбороновою кислотою IVa OH HO B (R2) n , IVa дифенілбориновою кислотою IVb OH B (R2) n (R2) n IVb або сумішшю з IVa і IVb. UA 106723 C2 Опис Даний винахід відноситься до способу одержання заміщених біфенілів формули I 3 R I, R1 (R2)n 5 10 в якій замісники мають наступне значення: 1 R нітро або аміно, 2 R ціано, галоген, C1-C4-галогеналкіл, C1-C4-галогеналкокси або C1-C4-галогеналкілтіо, 2 n 0, 1, 2 або 3, причому у випадку n=2 або 3 залишки R можуть мати однакові або різні значення, 3 R водень, ціано або галоген, який відрізняється тим, що галогенбензол формули II 3 R Hal II, 1 R 15 1 3 в якій Hal означає хлор або бром і R і R мають вказані вище значення, в присутності основи і паладієвого каталізатора, який складається з паладію і бідентатного фосфорного ліганду формули III (Ar)2P 4 R 20 25 5 P(Ar)2 III R , причому Ar означає феніл, який може містити від одного до трьох замісників, вибраних з 4 5 групи, що складається з метилу, метокси, фтор і хлору, і R і R кожного разу означають C1-C84 5 алкіл або C3-C6-циклоалкіл або R і R разом утворюють від 2- до 7-членний місток, який при бажанні може містити C1-C6-алкільний замісник, в розчиннику або розріджувачі піддають взаємодії з фенілбороновою кислотою IVa OH HO 30 B IVa, 2 (R ) n дифенілбориновою кислотою IVb OH B 2 2 (R ) n (R )n 1 IVb UA 106723 C2 2 5 10 15 20 або сумішшю з IVa і IVb, де R і n кожного разу мають вказані вище значення. Каталізовані паладієм поєднання ароматичних сполук хлору з ароматичними бороновими кислотами і бориновими кислотами самі по собі є відомими. Так в WO 97/33846 описується, наприклад, поєднання 2-нітрохлорбензолу з галогензаміщеними ароматичними бороновими кислотами до одержання відповідним чином заміщених нітробіфенілів. Трифеніл-фосфін при подібних реакціях поєднання являє собою найбільш часто застосовний ліганд для паладію. Але застосування трифенілфосфіну як ліганду має в собі небезпеку, що застосовні як реагенти поєднання ароматичні боронові і боринові кислоти в великій кількості піддаються протодеборонізації і в цьому положенні незаміщені ароматичні сполуки утворюються у вигляді небажаних побічних продуктів. Це також має силу в тому випадку, коли для покращення вибірковості і виходу використовують трифенілфосфін в явному молярному надлишку, в перерахунку на паладієве джерело. Наразі було винайдено, що каталізована паладієм реакція ароматичних сполук хлору з галогензаміщеними ароматичними бороновими і бориновими кислотами при застосуванні бідентатних лігандів 1,3-біс-дифенілфосфаніл-пропан (dppp) протікає з дуже поганим виходом, ніж з трифенілфосфіном (див. приклад 2b в порівнянні з 2a). Однак якщо застосовують бідентатний ліганд, який є трохи модифікованим за допомогою інших замісників в алкільному ланцюгу, наприклад, 1,3-біс-дифенілфосфаніл-2,2-диметилпропан або 1,3-бісдифенілфосфаніл-2-етил-2-бутил-пропан, то несподівано одержують бажані продукти поєднання з дуже гарними виходами і в той же час тільки дуже незначно протодеборонизовані побічні продукти: 2 (R )n . 25 30 35 40 45 50 55 Інша перевага при використанні цього зазначеного останнім ліганду полягає в тому, що як необхідна кількість паладієвого джерела, так і кількість ліганду в порівнянні з процесом з трифенілфосфіном може бути явно зниженою. Тому що використовувані сполуки паладію загалом є дуже дорогими, то існує ця можливість зменшення використання паладію високої економічної вартості. До сих пір в літературних джерелах дуже рідко повідомлялось про застосування бідентатних біс-фосфінових лігандів в реакціях поєднання. В WO 98/16486 повідомляється про застосування ліпофільних аліфатичних бісфосфінів в реакціях звичайних ароматичних сполук хлору, однак без підтвердження прикладами. DE-A 4340490 описує застосування 1,2-біс(дициклогексилфосфаніл)-етану і 1,2-біс-(диетилфосфаніл)-етану в реакціях поєднання. В даному випадку за допомогою багатих електронами ароматичних сполук хлору досягали гарних результатів, однак не з ароматичними сполуками, які мають замісники, що віднімають електрони, такі як фтор або трифторметил. Зрозуміло, застосування повністю аліфатично заміщених фосфанів, загалом, є дуже обмеженим, тому що ці фосфани є дуже чутливими до впливу повітря і частково пірофорними. Тому в основі даного винаходу лежала задача, надати рентабельний і технічно здійснений в промисловому масштабі спосіб регіоселективного одержання заміщених біфенілів, який діє зі зменшеною концентрацією паладієвого каталізатора. Визначений на початку спосіб долає перераховані недоліки рівня техніки. Одержані відповідно до даного способу заміщені біфеніли I мають наступні переважні замісники: 1 R нітро або аміно, особливо переважно нітро; 2 R ціано, фтор, хлор, бром, трифторметил, трифторметокси або трифторметилтіо, особливо переважно фтор, хлор або трифторметилтіо, найбільш переважно фтор або хлор; n 2 або 3, особливо переважно 3; 3 R водень або галоген, зокрема водень або фтор. Найбільш переважним є одержання 3,4,5-трифтор-2’-нітро-біфенілу. Проведення суміжного гомогенно каталізованого біарильного перехресного поєднання Сузукі (Suzuki) переважно відбувається згідно з наступною схемою: 2 UA 106723 C2 5 10 15 20 25 30 35 40 При цьому переважно походять з фенілборонових кислот формули IVa або 2 дифенілборинових кислот формули IVb або сумішей з них, в яких R і n мають вказані вище значення. Найбільш переважними є 3,4,5-трифторфеніл-боронова кислота і ді(3,4,5-трифторфеніл)боринова кислота як вихідні сполуки (IVa відповідно IVb). Переважно виходять зі сполук (II), які містять єдину нітро- або аміногрупу, зокрема 2нітрохлорбензол або 2-амінохлорбензол або 2-амінобромбензол. Сполука II використовується, в перерахунку на фенілборонову кислоту IVa або дифенілборинову кислоту IVb, звичайно приблизно еквімолярно, переважно з надлишком, до прибл. 30-моль%. При цьому при розрахунку молярних співвідношень і надлишків слід приймати до уваги, що дифенілборинова кислота IVb, яка використається в чистому вигляді або як суміш з IVa, може мати два фенільних залишки. Як основу переважно застосовують гідроксиди лужних металів, гідроксиди лужноземельних металів, карбамати лужних металів, карбамати лужноземельних металів, гідрокарбамати лужних металів, ацетати лужних металів, ацетати лужноземельних металів, алкоголяти лужних металів і алкоголяти лужноземельних металів, в суміші і зокрема окремо. Як основа особливо переважними є гідроксиди лужних металів, гідроксиди лужноземельних металів, карбамати лужних металів, карбамати лужноземельних металів і гідрокарбамати лужних металів. Як основа зокрема переважними є гідроксиди лужних металів, наприклад, гідроксид натрію, гідроксид калію і гідроксид літію, а також карбамати лужних металів і гідрокарбамати лужних металів, наприклад, карбонат літію, карбонат натрію і карбонат калію. Але також як основи можуть використовуватися органічні основи, наприклад, третинні аміни. Переважно застосовують, наприклад, триетиламін або диметилциклогексиламін. Переважно основа використовується з долею від 100 до 500 моль-%, особливо переважно від 150 до 400 моль-%, в перерахунку на фенілборонову кислоту IVa або дифенілборинову кислоту IVb. Придатними джерелами паладію є, наприклад, соли паладію II, такі як хлорид паладію II або ацетат паладію II відповідно їх водні розчини, а також хлорид бісацетонітрилпаладію II або комплекси паладію з Pd в ступені окиснення 0. Особливо переважно застосовують хлорид паладію II. Придатні в алкільному ланцюгу заміщені, бідентатні фосфорні ліганди, а також їх одержання є відомими з більш ранньої заявки EP 08154184.9. При цьому переважними є 1,3-біс-(дифенілфосфаніл)-пропани III з незаміщеними 4 фенільними кільцями, зокрема ті, в яких R означає C1-C6-алкіл, такий як метил, етил, 1метилетил, n-бутил, 1-метилпропіл, 2- метилпропіл, n-пентил, 1-метилбутил, 2-метилбутил, 3метилбутил, n-гексил, 1-метилпентил, 2-метилпентил, 3-метилпентил і 4-метилпентил або 5 означає циклопропіл і R означає C1-C6-алкіл, такий як метил, етил, 1-метилетил, n-бутил, 1 3 UA 106723 C2 5 10 15 20 25 30 35 40 45 50 55 60 метилпропіл, 2- метилпропіл, n-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, n-гексил, 1метилпентил, 2-метилпентил, 3-метилпентил і 4-метилпентил, 4 5 або в яких R +R разом означають етан-1,2-діїл-, пропан-1,3-діїл-, бутан-1,4-діїл- або пентан-1,5-діїл-ланцюг. Особливо переважними фосфорними лігандами III є 1,3-біс-(дифенілфосфаніл)-2метилпропан, 1,3-біс-(дифенілфосфаніл)-2,2-диметилпропан, 1,3-біс-(дифенілфосфаніл)-2метил-2-етилпропан, 1,3-біс-(дифенілфосфаніл)-2,2-диетилпропан, 1,3-біс-(дифенілфосфаніл)2-метил-2-пропілпропан, 1,3-біс-(дифенілфосфаніл)-2-етил-2-пропілпропан, 1,3-біс(дифенілфосфаніл)-2,2-дипропілпропан, 1,3-біс-(дифенілфосфаніл)-2-метил-2-бутилпропан, 1,3-біс-(дифенілфосфаніл)-2-етил-2-бутилпропан, 1,3-біс-(дифенілфосфаніл)-2-пропіл-2бутилпропан, 1,3-біс-(дифенілфосфаніл)-2,2-дибутилпропан, 1,3-біс-(дифенілфосфаніл)-2метил-2-циклопропілпропан, 1,3-біс-(дифенілфосфаніл)-2-метил-2-циклобутилпропан, 1,3-біс(дифенілфосфаніл)-2-метил-2-циклопентил-пропан, 1,3-біс-(дифенілфосфаніл)-2-метил-2циклогексилпропан, 1,1-біс-(дифенілфосфаніл)-циклопропан, 1,1-біс-(дифенілфосфаніл)циклобутан, 1,1-біс-(дифенілфосфаніл)-циклопентан, 1,1-біс-(дифенілфосфаніл)-циклогексан, зокрема 1,3-біс-(дифенілфосфаніл)-2,2-диметилпропан і 1,3-біс-(дифенілфосфаніл)-2-етил-2бутилпропан. Реактивність комплексних лігандів може бути підвищена шляхом додавання четвертинної амонієвої солі, такий як бромід тетра-n-бутиламонію (TBAB) (див. наприклад, D. Zim et al., Tetrahedron Lett. 2000, 41, 8199). Як правило, комбінують від 0,5 до 5 молярних еквівалентів зазначених вище комплексних лігандів, зокрема 1,3-біс-дифенілфосфаніл-2,2-диметилпропан і 1,3-біс-дифенілфосфаніл-2етил-2-бутилпропан з одним еквівалентом солі паладію II. Особливо переважно використання одного молярного еквівалента комплексного ліганду, в перерахунку на сіль паладію II. Паладієве джерело в способі згідно з винаходом використовується з низькою долею вмісту від 0,001 до 5,0 моль-%, переважно від 0,1 до 1,0 моль-%, зокрема від 0,1 до 0,5 моль-%, в перерахунку на сполуку IVa або IVb. Для способу згідно з винаходом придатними органічними розчинниками є прості ефіри, такі як диметоксиетан, диметиловий ефір діетиленгліколю, тетрагідрофуран, 2метилтетрагідрофуран, 3-метилтетрагідрофуран, діоксан, трет.-бутилметиловий ефір і трет.бутил-етиловий ефір, вуглеводні, такі як n-гексан, n-гептан, гептанові суміші ізомерів, циклогексан, петролейний ефір, бензол, толуол і ксилол, спирти, такі як метанол, етанол, 1пропанол, 2-пропанол, етиленгліколь, 1-бутанол, 2-бутанол і трет.-бутанол, кетони, такі як ацетон, етилметилкетон і изо-бутилметилкетон, аміди, такі як диметилформамід, диметилацетамід і N-метилпіролідон, а також диметилсульфоксид, кожного разу окремо або в суміші. Переважними розчинниками є прості ефіри, такі як диметоксіетан, тетрагідрофуран, 2метил-тетрагідрофуран, 3-метилтетрагідрофуран і діоксан, вуглеводні, такі як циклогексан, толуол і ксилол, спирти, такі як етанол, 1-пропанол, 2-пропанол, 1-бутанол і трет.-бутанол, кожного разу окремо або в суміші. В одному особливо переважному варіанті в способі згідно з винаходом використовують воду, один або декілька нерозчинних в воді і один або декілька розчинних в воді розчинників, наприклад, суміші з води і діоксану, або води і тетрагідрофурану, або води, діоксану і етанолу, або води, тетрагідрофурану і метанолу, або води, толуолу і тетрагідрофурану, переважно води і тетрагідрофурану або води, тетрагідрофурану і метанолу. Переважно реакцію проводять в воді і тетрагідрофурані. Загальна кількість розчинника звичайно складає від 3000 до 100 і переважно від 2000 до 150 г на моль сполуки II. Доцільно для здійснення способу сполуку II, фенілборонову кислоту IVa відповідно дифенілборинову кислоту IVb, або суміш з обох, основу, а також каталітичну кількість паладієвого джерела додають в суміш з води і одного або декількох інертних органічних розчинників і перемішують при температурі від 50 °C до 140 °C, переважно від 70 °C до 110 °C, особливо переважно від 90 °C до 110 °C, протягом проміжку часу від 1 до 50, переважно від 2 до 24 годин. Залежно від застосовного розчинника і температури встановлюється тиск від 1 бар до 6 бар, переважно від 1 бар до 4 бар. Проведення може здійснюватися в звичайних придатних для подібних способів апаратах. Після остаточної взаємодії одержуваний як тверду речовину паладієвий каталізатор може бути відділений, наприклад, шляхом фільтрації і сирий продукт звільняють від розчинника відповідно розчинників. 4 UA 106723 C2 5 10 15 Потім може піддаватися подальшому очищенню методами, відомими спеціалісту в даній галузі техніки і відповідними кожному продукту, наприклад, шляхом перекристалізації, дистиляції, сублімації, зонного плавлення, кристалізації розплаву або хроматографії. Спосіб згідно з винаходом забезпечує сполуки I з дуже високими кількісними виходами при дуже гарній чистоті. Галогенбензоли II є відомими або можуть бути одержані згідно з відомими способами. Фенілборонові кислоти IVa і дифенілборинові кислоти IVb рівним чином є відомими або можуть бути одержані відомим чином (див. наприклад, заявку WO 2006/092429). 1 Одержані способом згідно з винаходом заміщені біфеніли I з R = нітро (біфеніли Ia), наприклад 3,4-дифтор-2’-нітро-біфеніл, 2,4-дихлор-2’-нітро-біфеніл, 3,4-дихлор-2’-нітро-біфеніл і 3,4,5-трифтор-2’-нітро-біфеніл, можуть бути переведені відомим чином за допомогою гідрування 1 у відповідно заміщені біфеніли I з R = аміно (біфеніли Ib). Заміщені біфеніли Ib в свою чергу представляють собою важні проміжні продукти для діючих речовин для захисту рослин, наприклад, фунгіцидно активні піразолкарбоксаміди V (див. наприклад, EP-A 589301 або WO 2006087343): 6 R O 3 R N H N V, N H3C (R2) n 6 20 25 30 35 40 45 50 причому R означає метил або галогенметил такий як дифторметил або трифторметил. Приклад одержання: синтез 3,4,5-трифтор-2’-нітробіфенілу a) одержання 3,4,5-трифторфеніл-боронової кислоти В реактор, інертизований азотом або аргоном, спочатку поміщали 83,2 г (3,42 моль) магнієвої стружки і потім додавали 1646,2 г сухого, нестабілізованого тетрагідрофурану. 30 г (0,14 моль) 3,4,5-трифторбромбензолу додавали по краплях при 25 °C при перемішуванні і очікували прискорення реакції Гриньяра. Прискорення реакції Гриньяра дало про себе знати завдяки спонтанному підвищенню температури до прибл. 32 °C. Потім додавали 571,9 г (2,71 моль) додаткового 3,4,5-трифторбромбензолу протягом 5 годин при 25-35 °C. Для доповнення реакції перемішували ще 2 години при 25-30 °C. У другому реакторі поміщали розчин з 328,0 г (3,16 моль) триметилборату і 452 г сухого, нестабілізованого тетрагідрофурану і попередньо охолоджували до -5 °C. Після цього додавали розчин Гриньяра з першого реактору протягом 2,5 годин. Надлишковий магній при цьому залишався в першому реакторі. Після остаточного додавання перемішували ще протягом 2 годин при 20-25 °C. Для гідролізу потім додавали 1326,1 г (2,76 моль) 7,6 %-ой хлористоводневої кислоти при 25 °C, після чого перемішували 1 час при 25 °C. Суміш нагрівали до 50 °C і фази розділяли. Після цього органічну фазу екстрагували за допомогою 603,9 г води при 50 °C і фазу промивної води знову відділяли. Потім шляхом відгону суміші тетрагідрофуран/вода органічну фазу концентрували. Одержували 1032,6 (82 %) 40 %-ого розчину 3,4,5-трифторфенілборонової кислоти в тетрагідрофурані, який безпосередньо використовували для наступних взаємодій. b) Одержання 3,4,5-трифтор-2’-нітро-біфенілу шляхом поєднання Сузукі 3,4,5трифторфенілборонової кислоти з 2-нітро-хлорбензолом В добре інертизовану посудину під тиском поміщали суміш з 49,6 г (0,113 моль) 40 %-ого розчину з 3,4,5-трифторфеніл-боронової кислоти в тетрагідрофурані з попередньої стадії a) з 121,6 г (0,304 моль) 10 %-ого розчину їдкого натру і 19,7 г (0,124 моль) 2-нітрохлорбензолу. Потім додавали відповідний ліганд при кімнатній температурі, перемішували і наприкінці хлорид паладію II. Потім реакційну суміш нагрівали до 105 °C. При цьому встановлювався тиск прибл. в 3-4 бар. Приблизно через 12 годин реакційного часу тиск в посудині знижували до нормального тиску, охолоджували до 30 °C і реакційну суміш зливали. Для переробки реакційну суміш ресуспендировали в простому трет.-бутилметиловому ефірі, фази розділяли і водну фазу двічі екстрагували простим трет.-бутилметиловим ефіром. Розчинники повністю відганяли під зниженим тиском, визначали навіску і вміст сирого 3,4,5-трифтор-2’-нітро-біфенілу аналізували за допомогою кількісної ВЕРХ. За бажанням сирий 3,4,5-трифтор-2’-нітро-біфеніл можна піддавати додатковому очищенню, наприклад, шляхом кристалізації з ізобутанолу. Після 5 UA 106723 C2 кристалізації з ізобутанолу одержують плавлення 79 °C. Прикл. b)-1 b)-2 b)-3 b)-4 5 Ліганд трифенілфосфан 1,3-біс-(дифенілфосфаніл)-пропан 1,3-біс-(дифенілфосфаніл)-2,2диметилпропан 1,3-біс-(дифенілфосфаніл)-2-етил-2бутилпропан чистий 3,4,5-трифтор-2’-нітро-біфеніл Моль% PdCl2 0,48 моль% ліганд 4,8 Співвідношення PdCl2: ліганд 1:10 0,26 0,26 0,26 0,26 з точкою 86 % Моль% 3,4,5трифторбензол 12 1:1 9% 29 0,26 1:1 97 % 2 0,26 1:1 96 % 2 Вихід Данні моль% PdCl2 і ліганду представлені в перерахунку кожного разу на 3,4,5трифторфеніл-бороновую кислоту. ФОРМУЛА ВИНАХОДУ 10 1. Спосіб одержання заміщених біфенілів формули І R R 15 3 1 (R2) n ,I в якій замісники мають наступне значення: 1 R = нітро, 2 R = ціано, галоген, С1-С4-галогеналкіл, С1-С4-галогеналкокси або С1-С4-галогеналкілтіо, 2 n = 0, 1, 2 або 3, причому у випадку n = 2 або 3 залишки R можуть мати однакові або різні значення, 3 R = водень, ціано або галоген, який відрізняється тим, що галогенбензол формули II R 3 Hal R 20 1 , II 1 3 в якій Hal означає хлор або бром і R і R мають вказані вище значення, в присутності основи і паладієвого каталізатора, який складається з паладію і бідентатного фосфорного ліганду формули III (Ar)2P R 25 5 R 4 P(Ar)2 , III причому Аr означає феніл, який може містити від одного до трьох замісників, вибраних з групи, 4 5 що складається з метилу, метокси, фтору і хлору, і R і R кожного разу означають С1-С8-алкіл 4 5 або С3-С6-циклоалкіл або R і R разом утворюють від 2- до 7-членний місток, який при бажанні може мати один С1-С6-алкільний замісник, в розчиннику або розріджувачі піддають взаємодії з фенілбороновою кислотою IVa OH HO B (R2) n , IVa 6 UA 106723 C2 дифенілбориновою кислотою IVb OH B (R2) n 5 10 15 20 25 (R2) n IVb 2 або сумішшю з IVa і IVb, де R і n кожного разу мають вказані вище значення. 2 3 2. Спосіб за п. 1, який відрізняється тим, що R означає галоген, n означає 2 або 3 і R означає водень або галоген. 2 3. Спосіб за п. 1, який відрізняється тим, що R означає фтор або хлор. 1 4. Спосіб за п. 1, який відрізняється тим, що R знаходиться в орто-положенні до фенільного 2 кільця, яке має R . 1 3 5. Спосіб за п. 1, який відрізняється тим, що R і R знаходяться в пара-положенні один до іншого. 6. Спосіб за п. 1, який відрізняється тим, що одержують біфеніли І, вибрані з групи, що складається з 3,4-дифтор-2'-нітробіфенілу, 2,4-дихлор-2'-нітробіфенілу, 3,4-дихлор-2'нітробіфенілу, 3,4,5-трифтор-2'-нітробіфенілу. 7. Спосіб за п. 1, який відрізняється тим, що одержують 3,4,5-трифтор-2'-нітробіфеніл. 8. Спосіб за п. 1, який відрізняється тим, що Аr означає феніл. 9. Спосіб за п. 1, який відрізняється тим, що взаємодію проводять при температурі від 50 до 140 °С. 10. Спосіб за п. 1, який відрізняється тим, що взаємодію проводять в суміші з води і органічного розчинника. 11. Спосіб за п. 8, який відрізняється тим, що як органічний розчинник застосовують простий ефір. 12. Спосіб за п. 1, який відрізняється тим, що взаємодії проводять під тиском від 1 до 6 бар. 13. 3,4,5-Трифтор-2'-нітробіфеніл. 14. Спосіб за п. 1, який відрізняється тим, що із заміщених біфенілів формули І потім відомим методом одержують піразолкарбоксаміди V R 6 O R 3 N H N N H3 C 30 (R2) n ,V 1 2 причому n, R , R мають значення, що зазначені в п. 1, і 6 R означає метил або галогенметил. 15. Спосіб за п. 14, який відрізняється тим, що піддають взаємодії одержані заміщені біфеніли І, вибрані з групи, що складається з 3,4-дифтор-2'-нітробіфенілу, 2,4-дихлор-2'-нітробіфенілу, 3,4-дихлор-2'-нітробіфенілу, 3,4,5-трифтор-2'-нітробіфенілу. 16. Спосіб за п. 14 або 15, який відрізняється тим, що піддають взаємодії 3,4,5-трифтор-2'нітробіфеніл. Комп’ютерна верстка М. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Назва патенту англійськоюMethod for producing substituted biphenyls
Автори англійськоюMaywald, Volker, Smidt, Sebastian Peer, Wisselstoll, Kathrin, Schmidt-Leithoff, Joachim, Altenhoff, Ansgar Gereon, Keil, Michael
Автори російськоюКайль Михаэль
МПК / Мітки
МПК: C07C 205/11, C07C 205/12
Мітки: одержання, спосіб, заміщених, біфенілів
Код посилання
<a href="https://ua.patents.su/9-106723-sposib-oderzhannya-zamishhenikh-bifeniliv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання заміщених біфенілів</a>
Попередній патент: Генетичні локуси, пов’язані зі стійкістю до летючої сажки у маїсу
Наступний патент: Спосіб отримання заміщених піримідинових похідних
Випадковий патент: Спосіб лікування бронхіальної астми у дітей













