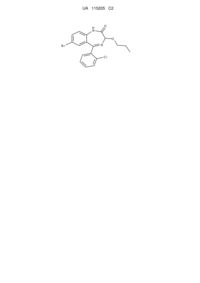
Застосування 7-бром-5-(о-хлорфеніл)-3-пропокси-1,2-дигідро-3н-1,4-бенздіазепін-2-ону для гальмування нейропатичного болю та судом різної етіології
Номер патенту: 115205
Опубліковано: 25.09.2017
Автори: Ларіонов Віталій Борисович, Павловський Віктор Іванович, Головенко Микола Якович, Андронаті Сергій Андрійович, Кабанова Тетяна Анатоліївна, Халімова Олена Ігорівна, Редер Анатолій Семенович, Волощук Наталія Іванівна
Формула / Реферат
Застосування сполуки формули 1
 1
1
як засобу, що гальмує нейропатичний біль та має протисудомну властивість.
Текст
Реферат: Винахід стосується медичної хімії, зокрема до застосування сполуки бенздіазепінового похідного: 7-бром-5-(о-хлорфеніл)-3-пропокси-1,2-дигідро-3Н-1,4-бенздіазепін-2-ону для гальмування нейропатичного болю без ульцерогенної дії і деяких судом, викликаних хімічними агентами та електростимуляцією. O H N O Br N Cl UA 115205 C2 (12) UA 115205 C2 O H N O Br N Cl UA 115205 C2 Винахід належить до медичної хімії, зокрема до застосування сполуки 7-бром-5-(охлорфеніл)-3-пропокси-1,2-дигідро-3Н-1,4-бенздіазепін-2-ону (1) для гальмування нейропатичного болю без утворення дефектів слизової оболонки шлунку (ульцерогенної дії) і деяких судом, викликаних хімічними агентами та електростимуляцією: O H N O Br N Cl 5 10 15 20 25 30 35 40 45 .1 Міжнародна асоціація з вивчення болю (IASP) визначає нейропатичний біль (НБ) як біль, "викликаний первинним ураженням або дисфункцією нервової системи" (див. Lau FH, Chung KС. Silas Weir Mitchell, MD: the physician who discovered causalgia. J Hand Surg. 2004; 29, pp. 181187). Згідно з оцінками, на неї страждають мільйони людей, хоча нині точні цифри недоступні. Більшість поширених захворювань, травм або втручань спричиняють НБ шляхом пошкодження соматосенсорних шляхів у периферичній або центральній нервовій системі. НБ відноситься до хронічних болів на відміну від гострих - ноцицептивних. До основних факторів, що призводить до виникнення НБ, відносять цукровий діабет, герпетическую інфекцію, перенесений інсульт, розсіяний склероз, злоякісні новоутворення, ВІЛ-інфекцію, а також посттравматичні і післяопераційні ушкодження периферичної нервової системи (див. James N. Campbell, Richard A. Meyer. Mechanisms of Neuropathic Pain. Neuron. 2006 October 5; 52(1): pp. 77-92). Для фармакотерапії НБ використовують місцеві анестетики, опіоїдні препарати, центральні міорелаксанти, антиаритмічні препарати, антидепресанти і антиконвульсанти. Серед нестероїдних протизапальних препаратів в деяких випадках використовують кеторолак. Однак, часті побічні ефекти обмежують застосування цих засобів (див. Данилов А.Б., Давыдов О.С. Нейропатическая боль. Москва: Боргес, 2007. 198 с.; Attal N., Cruccu G., Haanpaa Μ., Hansson P., Jensen T.S., Nurmikko Т., Sampaio C., Sindrup S., Wiffen P. EFNS guidelines on pharmacological treatment of neuropathic pain. European Journal of Neurology 2006, 13:1153-1169). Раніше нами було синтезовано низку похідних 3-алкокси-1,2-дигідро-3Н-1,4-бенздіазепін-2онів (див. Павловський В.І., Кабанова Т.Α., Халімова О.І., Ушаков І.Ю., Андронаті С.А. Застосування 1-метоксикарбонілметил-7-бром-5-феніл-3-ариламіно-1,2-дигідро-3Н-1,4бенздіазепін-2-онів як анальгетичних засобів //Пат. 103803, МПК (2013) CO7D 243/14, 243/26, 243/24, 209/00, заявка № а201114668; заявл. 12.12.2011; опубл. 25.011.2013. Бюл. № 22; Павловський В.І., Ушаков І.Ю., Андронаті С.Α., Кабанова Т.Α., Халімова О.І. 7-бром-5-феніл-3ариламіно-1,2-дигідро-3Н-1,4-бенздіазепін-2-они як анальгетичні агенти //Пат. 105703, МПК (2014) CO7D 243/14, 243/06, 243/16, 209/00, заявка № а201213432; заявл. 26.11.2012; опубл. 10.06.2014, Бюл. № 11; Павловський В.І., Семенішина К.О., Андронаті С.Α., Кабанова Т.Α., Халімова О.І., Редер А.С. Застосування 3-алкокси-1,2-дигідро-3Н-1,4-бенздіазепін-2-онів як високоактивних анальгетичних агентів //Пат 108246, МПК (2011) CO7D 243/14, 243/26), серед яких сполука 1, яка наведена вище, виявили високу анальгетичну активність в тесті "корчів", що були викликані внутрішньоочеревинним введенням оцтової кислоти. В основу винаходу поставлена задача - розширити спектр застосування сполуки 1 та поглибити знання щодо механізмів її дії. Поставлена задача вирішена експериментальним вивченням антиноцицептивної дії досліджуваної сполуки 1 на моделі НБ у щурів та на моделі болю за участю центральних механізмів, зокрема термоподразнення хвоста щурів ("tail flick"). Виходячи з наявних даних про позитивну відповідь постійного болю на антиконвульсанти в гострій і пароксизмальній фазі та враховуючи структуру 1 нами проведено визначення протисудомної дії сполуки на моделях коразолових судом та судом викликаних максимальним електорошоком (МЕШ). Нами врахована можлива побічна реакція (ульцерогенна дія) сполуки у піддослідних тварин, що виражається в утворенні дефектів слизової оболонки шлунково-кишкового тракту, або ж провокує рецидиви вже наявної виразкової хвороби. Ймовірність утворення виразок лікарського походження особливо велика при призначенні нестероїдних протизапальних препаратів у високих дозах і при тривалому застосуванні їх у вигляді таблеток. 1 UA 115205 C2 5 10 15 20 25 Поставлена задача вирішена дослідженням сполуки (формула 1), як засобу, що гальмує нейропатичний біль без ульцерогенної дії та має протисудомну властивість. Новим у винаході є те, що сполука 1 гальмує нейропатичний біль і деякі судоми, викликані коразолом та електростимуляцією (МЕШ) без утворення дефектів слизової оболонки шлунковокишкового тракту (ульцерогенної дії). Приклад 1 Оцінка антиноцицептивної дії досліджуваної сполуки (1) на моделі нейропатичного болю проведена на 50 щурах-самцях лінії Вістар масою 270-310 г. Модель нейропатичного болю відтворювали шляхом перев'язки сідничного нерва на рівні верхньої третини стегна на рівні підколінної ямки вище місця його трифуркацїї на n. tibialis, n. peroneus і n. suralis (див. Миронов А.Н. и др. Руководство по проведению доклинических исследований лекарственных средств. Часть первая. - Москва 2012. - С. 197-219). Розвиток патологічного процесу тривав 14 днів. Ступінь гіперальгезії визначали за допомогою долориметра (Dolorimeter Baseline, USA) шляхом визначення порогу больової чутливості (ПБЧ) - мінімальний тиск на нижню поверхню стопи щура (г/мм), який викликав больову реакцію у тварини (вокалізацію та/або відсмикування лапки). Кожній тварині проводили 5 спроб, за порогове значення приймали таку силу тиску, яка викликала позитивну відповідь принаймні в одній спробі. Порівнювали ПБЧ на неушкодженій та ушкодженій кінцівках на 14 день після перев'язки (патологія без лікування), а також на ушкодженій кінцівці через 2 години (пік дії) після введення препаратів. Досліджувану сполуку та референс-препарат (кеторолак) вводили внутрішньошлунково в дозах 0,5 та 3 мг/кг одноразово. Перев'язка сідничного нерва у тварин викликала розвиток нейропатичного больового синдрому, який проявлявся у поведінкових реакціях щура та зниженні порогу больової чутливості в середньому на 44-48 % (див. табл. 1). Дослідження анальгезуючої дії сполуки 1 в порівнянні з кеторолаком за умов їх внутрішньошлункового введення на моделі нейропатичного болю у щурів (М±m, n=10, де n - кількість тварин у дослідах) наведені у табл. 1. Таблиця 1 2 Групи Здорова кінцівка ПБЧ, г/мм Зміни порогу больової перцепції* -0,3±0,7 % Ушкоджена кінцівка Через 2 год. Зміни порогу після введення больової сполук перцепції* * 392,1±20,5 +0,59±0,8 % Контроль 392,4±24,0 390,7±22,4 Сполука 1 434,3±13,4 223,5±20,1 -48,4±4,6 % 269,3±19,4 +23,1±5,9 % 0,5 мг/кг Кеторолак 0,5 550,0±19,0 287,9±19,85 -47,3±3,9 % 355,0±19,5 +24,6±5,2 % мг/кг Сполука 1 523,6±28,1 295,7±29,9 -44,3±2,9 % 532,8±47,1 +82,5±6,1 % 3 мг/кг Кеторолак 3 547,1±15,1 296,4±19,6 -45,7±3,5 % 501,4±34,9 +70,1±6,2 % мг/кг Примітки: контроль - хибнооперовані тварини, які отримувала еквіоб'ємні кількості розчинників; * - відносно здорової кінцівки; ** - відносно патології до введення сполук. 30 35 40 За цих умов сполука 1 проявляла виразну дозозалежну анальгезуючу дію, про що свідчить зростання ПБЧ через 2 години після її внутрішньошлункового введення. В дозі 0,5 мг/кг, яка складала ЕД50 (за попередніми дослідженнями), антиноцицептивний ефект сполуки 1 становив в середньому 23,1 % відносно неушкодженої кінцівки. За цією активністю сполука 1 практично не відрізнялася від еквімолярної дози кеторолаку (+24,6 %). Збільшення дози сполуки 1 до 3 мг/кг супроводжувалась значним збільшенням її антиноцицептивної активності: зростання ПБЧ через 2 години становило +82,5 %, що було більшим, ніж аналогічна дія кеторолаку в такій же дозі (+70,1 %). Приклад 2 Сполука 1 в дозі 0,5 мг/кг на моделі термічного подразнення виявляла анальгезуючу дію, як при внутрішньому, так і парентеральному введенні. Більш виразною дія була при парентеральному введенні (див. Таблиця 2). Контроль: розчинник (твін, дист. вода, рНкоректор). Результати дослідження знеболюючої дії сполуки 1 та кеторолаку на моделі термічного подразнення (tail-flick). Ступінь підвищення ПБЧ відносно вихідного рівня (%), n=10, наведені у табл. 2. 2 UA 115205 C2 Таблиця 2 Сполука Сполука 1 0,5 мг/кг перорально Сполука 1 3 мг/кг перорально Контроль Сполука 1 0,5 мг/кг внутрішньоочеревинно Контроль Кеторолак 0,5 мг/кг перорально Кеторолак 3 мг/кг перорально Контроль 5 10 15 20 25 30 35 40 45 1 година 2 години 4 години 6 годин +13,2 +22,4 +21,7 +8,77 +60,7 +83,3 +65,2 +39,4 +0,5 +0,7 0 0 +27,4 +38,4 +42,3 +34,9 +0,2 +7,5 +43,4 0 +0,5 +14,6 +75,7 +0,2 +0,3 +28,6 +65,7 +0,5 +0,7 +12,1 +28,1 +0,5 За обох шляхів введення найбільш виразна дія була на 2-й годині, тривала протягом ще 2 годин, однак при внутрішноочеревинному введенні на 6-й годині ще зберігалась на достатньо високому рівні, а при введенні в шлунок суттєво зменшувалась. Кеторолак при введенні в еквімолярній дозі (0,5 мг/кг) за перорального введення за ступенем знеболюючої дії співставлявся зі сполукою на 4-й і 6-й годині. При введенні сполуки 1 та кеторолаку в дозах 3 мг/кг перорально (яка становить ЕД 50 за літературними даними для кеторолаку), ступінь аналгетичного ефекту сполуки перевершував референс препарат як по силі дії, так і за тривалістю. Приклад 3 Оцінка антиноцицептивної дії досліджуваної сполуки (1) на моделі формалінового тесту. Відомо, що больова реакція на підшкірне введення формаліну складається з двох фаз. Перша фаза формалінового тесту характеризується гострим болем, який виникає у відповідь на ін'єкцію хімічного подразника (триває близько 5 хв.) і пов'язана головним чином з прямою активацією тонких немієлінових С-волокон, більшість з яких передає імпульсацію від больових рецепторів. Друга фаза дозволяє оцінити тонічний біль, починається вона за 10-15 хв. після ін'єкції формаліну і триває 40-60 хв. Вона є результатом розвитку запального процесу у периферичних тканинах і змін функції нейронів задніх рогів сірої речовини спинного мозку, де лежать нейрони больових висхідних шляхів (див. Tjosen Α., Berge О., Hunskaar S., Rosland Η., Hole K. The formalin test: an evaluation of the method Pain. 1992, 51, p. 5-17). Морфін, кодеїн, нефопам та орфенадрин - аналгетики з центральним механізмом дії є активними в обох фазах, в той час як нестероїдні і протизапальні (індометацин, напроксен) та стероїдні препарати (дексаметазон, гідрокортизон) гальмують виключно другу стадію процеса. Ацетилсаліцилова кислота і парацетамол прявляють антиноцицептивну активність в обох фазах (див. Hunskaar S, Hole K. The formalin test in mice: dissociation between inflammatory and non-inflammatory pain. Pain. 1987; 30(1), p. 103-14). Інтенсивність больової відповіді у першу (больову) і другу (запальну) фази тесту оцінювали за тривалістю патернів вилизування (в секундах), типовій для даного тесту поведінковій реакції мишей. Зменшення тривалості патернів вилизування доводить наявність знеболювальної дії у об'єктів, які тестуються. Формаліновий тест проводили на білих нелінійних мишах самцях масою 20-24 г. Досліджені сполуки та препарат порівняння диклофенак-натрій, який має в моделі на миша двофазну дію (див. Zhi Yu Yin, Lu Li, Shuai-Shuai Chu, Qing Sun, Zheng-Liang Ma, Xiao-Ping Gu' Antinociceptive effects of dehydrocorydaline in mouse models of inflammatory pain involve the opioid receptor and inflammatory cytokines. Sci Rep. 2016, 6, p. 1-9) вводили внутрішньоочеревинно за 40 хв. до індукції запалення. Контрольна група мишей одержувала еквівалентну кількість фізіологічного розчину в емульсії з Твін-80. Утворення набряку провокували інплантарною ін'єкцією 3 %-го водного розчину формаліну об'ємом 0,01 мл за допомогою мікрошприца (20 мкл) в праву задню кінцівку тварин дослідних та контрольних груп. За піддослідною твариною спостерігали протягом 40 хв., фіксуючи час, витрачений твариною на лизання набряклої кінцівки. Інтенсивність больової відповіді у першу і другу фази тесту оцінювали зо кількістю і тривалістю патернів облизування (в секундах) ін'єктованої лапи. Час облизування підсумовували для кожної тварини. Здатність досліджуваних сполук впливати на больову поведінку піддослідних тварин у першій (больовій) фазі (0-5 хв.) і другій (запальній) фазі (15-40 хв.) визначали за зменшенням часу облизування набряклої кінцівки (див. The formalin test: an evaluation of the method /A. Tjolsen, O.-G. Berge, S. Hunskaar [et al.] // 3 UA 115205 C2 Pain. - 1992. - Vol. 51. - P. 5-17). Вплив сполуки 1 на больову поведінку мишей у формаліновому тесті представлена в таблиці 3. Таблиця 3 II фаза, % ефекту (зменшення часу лизання лапи) 3,00 91,10±18,80*** 98,4±15,0*** 0,10 76,00±6,50*** 54,00±8,60*** Сполука 1 0,01 15,00±4,11 32,10±10,10** Диклофенак натрію 10,00 51,00±11,64*** 53,60±11,02*** Достовірність відносно контролю при **р ≤ 0,01 у відношенні до контролю;***р ≤ 0,001 у відношенні до контролю. Доза, мг/кг 5 10 15 20 25 30 35 40 45 І фаза, % ефекту (зменшення часу лизання лапи) В дозі 0,1 мг/кг сполука 1 виявилась у 1,5 рази активнішим за диклофенак натрію, введений у дозі 10 мг/кг, у першій фазі тесту і порівняним до нього у другій. Дія сполуки 1 була перевірена у формаліновому тесті за умов її введення у діапазоні доз від 0,01 мг/кг до 3,0 мг/кг. Результати проведених експериментів демонструють її здатність знижувати больову поведінку тварин як у першій больовій, так і другій запальній фазах. Причому спостерігається в обох випадках дозозалежний характер дії сполуки. Таким чином, експериментальні дані, отримані на основі формалінового тесту, демонструють наявність значної анальгетичної та протизапальної активності у сполуки 1. Приклад 4 Враховуючи той факт, що сполука 1 впливає не тільки на больову, але й та запальну фази нами проведено поглиблене вивчення її протизапальної дії. Найбільш поширеною в плані скринінгу протизапальних речовин є модель запального набряку лапки щура, індукованого субплантарним введенням різних флогогенних агентів. За умов введення карагінану спостерігається достатньо виразна набрякова реакція, яка повільно розвивається і тривало зберігається. Максимальні розміри набряку спостерігаються через 2-4 години. Сполуки, які виявляють протизапальні та антиексудативні властивості гальмують розвиток запальних реакцій і знижують розмір набряку та гіперемії тканини. Протизапальні властивості досліджуваних сполук вивчали на моделі карагінанового набряку стопи щурів. В дослідах використовували самців білих щурів вагою 150-180 г. Перед введенням експериментальних речовин проводили вимірювання об'єму лапок щурів, в які у подальшому робили ін'єкції флогогену. Досліджувані сполуки та препарат порівняння диклофенак натрію вводили внутрішньоочеревинно за 40 хвилин перед індукцією запалення. Контрольна група щурів одержувала еквівалентну кількість фізіологічного розчину в емульсії з Твін-80. Гостре асептичне запалення викликали введенням 1 % водного розчину λ-карагінану об'ємом 0,1 мл під плантарний апоневроз задньої кінцівки тварин дослідних та контрольних груп (див. Тринус Ф.П. Нестероидные противовоспалительные средства /Φ.П. Тринус, Η.Α. Μοхорт, Б.М. Клебанов //К., 1975, С. 204-231., Winter С.A. Carrageenin-induced edema in hind paw of the rat as an assay for antiiflammatoru drugs /С.A. Winter, E.A. Risley, G.V. Nuss //Proc. Soc. Exp. Biol. Med. 1962. - Vol. 111. - P. 544-547). Виразність запальної реакції оцінюванли через дві та чотири години після введення флогогену. Реєстрацію величини набряку здійснювали за допомогою механічного вимірювання об'єму стоп у динаміці за А.С. Захаревським (див. Захаревский А.С. Влияние некоторых производных индола на нервную систему. Дисс. канд. мед. наук /Захаревский Александр Степанович - Минск. - 1969. - 78-80 с.). Про ступінь набряку судили за різницею в об'ємі між розміром набряклої стопи та розміром стопи перед індукцією запалення. Протизапальну ефективність досліджуваних сполук визначали за здатністю досліджуваних сполук пригнічувати запальну реакцію у дослідних тварин у порівнянні з контрольними і виражали у відсотках. Розрахунок проводили за наступною формулою: Відсоток пригнічення запалення = (ΔVк-ΔVд/ΔVк)·100 %, де: ΔVк - середнє збільшення об'єму набряклої лапки у контролі; ΔVд - середнє збільшення об'єму набряклої лапки у тварин, яким було введено експериментальні речовини. Протизапальна активність сполуки 1 на моделі запального набряку лапки щура, викликаного субплантарним введенням карагінану представлено в таблиці 4. 4 UA 115205 C2 Таблиця 4 Інгібування набряку через 2 Інгібування набряку через 4 години (%) години (%) 3,0 36,7±4,1** 25,00±2,7* Сполука 1 10,0 47,0±4,1*** 26,70±5,4* Диклофенак натрію 10,0 43,0±7,0*** 57,10±8,3*** Достовірність відносно контролю при *р < 0,05 у відношенні до контролю;**р < 0,01 у відношенні до контролю;***р < 0,001 у відношенні до контролю. Доза, мг/кг 5 10 15 20 25 30 35 Проведені дослідження показали, що сполука 1 помірно знижувала розмір набряку у дозі 3 мг/кг. Збільшення дози Сполуки 1 до 10 мг/кг призводила до зниження об'єму набряку порівняно до дії диклофенак натрію за 2 години, інгібування ексудативної реакції за 4 години було дещо нижчим. Приклад 5 У багатьох випадках наявність протисудомної (антиепілептичної) дії сполук сприяє прояву у них аналгетичних властивостей на відповідних моделях невралгії. Загальноприйнятим є проведення першочергового скринінгу нових протисудомних сполук на гризунах за допомогою коразолового тесту та МЕШ так як вони мають якісну відміну у розвитку та проявах судом. Вважають, що властивість сполуки запобігати виникненню судом в умовах МЕШ пов'язана з її здатністю перешкоджати розповсюдженню імпульсу по нервовій тканині. Цілком імовірно, що протидія розвитку судом, спричинених МЕШ, свідчить про потенційну ефективність сполуки при лікуванні значних моторних пароксизмів (див. Томпсон Ε. Лекарственные средства. Биоскрининг /Под ред. А.В. Стефанова, - К.: Авиценна, 1998. - 250 с.). Досліди виконані на нелінійних самцях мишей масою 19-29 г. Коразол вводили підшкірно в зоні шийного відділу спини. Виходячи з фізико-хімічних властивостей коразолу, спочатку було визначено форму кривої, що відображає залежність "доза-ефект" цього судомного агента. У нашому випадку ЕД95 коразолу (Sigma) стоновило 120 мг/кг. За станом тварин спостерігали протягом 30-60 хв. після ін'єкції коразолу з реєстрацією основного показника - первинних генералізованих клінічних судом, що супроводжуються втратою рефлексу перевертання. Для відтворення судом за допомогою МЕШ експериментальних тварин піддавали електричній стимуляції через електроди, закріплені на пінеальних ділянках (50 Гц, 50 мА для мишей тривалістю 0,2 с.). Підраховували кількість тварин з максимальною тонічною екстензією задніх кінцівок, яка виникає майже у 100 % тварин контрольної групи. Для вірогідного визначення EO50 використовували, 3 дози досліджуваної речовини, ефект кожної дози вивчали на 6-8 тваринах. В нашому випадку референтними препаратами для цієї моделі є габапентин та прегабалін, що є ефективними при післяопераційному використанні наркозу і при нейропатичному болю через рак. Препарати не є ефективними для лікування ВІЛ-асоційованої сенсорної нейропатії. У деяких країнах препарати схвалені для лікування парціальних епілептичних нападів та змішаних судомних розладів, проте немає достатніх даних щодо їх використання при генералізованій епілепсії (див. Huppertz HJ, Feuerstein TJ, Schulze-Bonhage A Myoclonus in epilepsy patients with anticonvulsive add-on therapy with pregabalin. Epilepsia 2001 42:790-792; Mathew NT, Rapoport A, Saper J, Magnus L, Klapper J, Ramadan N, Stacey B, Tepper S: Efficacy of gabapentin in migraine prophylaxis. Headache. 2001 Feb; 41(2): 119-28). Протисудомна дія сполуки 1 та препаратів порівняння наведені у таблиці 5. Таблиця 5 Сполука 1 Габапентин Прегабалін Коразол 0,91 (0,83-0,97) мг/кг 32 (50-200) мг/кг 31 (16-62) мг/кг МЕШ 8,2 (6-11) мг/кг 19 (16-24) мг/кг 73 (57-93) мг/кг Примітка: Показники, щодо габапентину та прегабаліну було запозичено нами з наступних літературних джерел (див. Akula KK, Dhir A, Kulkarni SK. Effect of various antiepileptic drugs in a pentylenetetrazol-induced seizure model in mice. Methods Find Exp Clin Pharmacol. 2009, 31(7), pp. 423-32.; Mark G. Vartanian, Louis L. Radulovic, Jack J. Kinsora, Kevin A. Serpa, Marguerite Vergnes, Edward Bertram, Charles P. Taylor. Activity profile of pregabalin in rodent models of epilepsy and ataxia. Epilepsy Research. 2006, 68 pp. 189-205). 5 UA 115205 C2 5 10 15 20 25 30 35 Дані таблиці 5 свідчать про те, що сполука 1 є більш ефективною, ніж габапентин та прегабалін в зазначених експериментальних моделях. Приклад 6 Недоліком більшості анальгетиків є той факт, що вони мають ульцерогену дію яка заважає їх довгостроковому вживанні. Нами було вивчено таку побічну дію сполуки 1 в гострому та субхронічному експериментах. В першому випадку сполуку у вигляді водної суспензії (Твін-80) вводили щурам одноразово внутрішньошлунково, які перед тим були позбавлені їжі протягом 16 годин з вільним доступом до води. Через 3 години тварин піддавали евтаназії за допомогою цервікальної дислокації, після розтину черевної порожнини вилучали шлунки та промивали їх в ізотонічному розчині натрію хлориду для видалення вмісту. Ушкодження шлунку визначали візуально. У другому, сполуку вводили внутрішньошлунково протягом 4 днів, після чого визначають ступінь ушкоджуючої дії на шлунок, як в попередньому досліді. Оцінку ульцерогенної дії проводили за 4-бальною шкалою: 0 балів - відсутність ушкоджень, 0,5 бали - гіперемія (переповнення кров'ю судин), 1 бал - поодинокі незначні ушкодження (1-3 точкових крововиливи або невеликих виразок), 2 бали - множинні (більше ніж 3) ураження (ерозії, точкові крововиливи) чи 1 виразка великих розмірів, 3 бали - значні та масивні ушкодження (ерозії, крововиливи) слизової оболонки шлунка (СОШ) значних розмірів (діаметр до 4 мм), 4 бали - грубі ушкодження (масивні крововиливи, ерозії, перфорації), які охоплюють всю поверхню СОШ. Визначали середній показник множинності ушкодження СОШ (кількість виразок на тварину) та тяжкість ушкодження (в балах). Сполуку 1 вводили в широкому діапазоні доз - при гострому дослідженні - 50, 250, 500 та 1000 мг/кг. Для субхронічного досліду було використано сполуку в дозі 50 мг/кг. Контрольні тварини отримували еквіоб'ємні кількості розчинника. Для визначення нешкідливості цієї сполуки у хронічному досліді за умов тривалого застосування, її вводили щурам протягом 28 днів в дозі, яка наближалась до ЕД50 за анальгезуючою дією (0,5 мг/кг). Результати дослідження ульцерогенної дії сполуки 1 в гострому експерименті наведені в таблиці 6. Вони показали, що введення досліджуваної сполуки у дозо-залежний спосіб викликало поодинокі незначні пошкодження СОШ, головним чином у вигляді ерозій та точкових крововиливів. Тяжкість ураження відповідала 1 та у окремих тварин 2 балам. Не було виявлено жодної тварини з більш тяжкими ураженнями СОШ. Максимальний показник середнього балу ушкодження слизової шлунка відмічався при використанні дози 1000 мг/кг, і становив 1,3±0,21. Подальше збільшення дози сполуки не проводили у зв'язку з неможливістю отримати належну суспензію. Тому визначити показник УД50 виявилось неможливим. Таблиця 6 Доза, мг/кг 50 мг/кг 250 мг/кг 500 мг/кг 1000 мг/кг контроль Кількість тварин з ураженнями СОШ різного ступеня 1 бал 2 бали 3 бали 4 бали 3 0 0 0 5 2 0 0 7 3 0 0 8 3 0 0 0 0 0 0 Середній бал Множинність ураження 0,2±0,13 0,8±0,25 1,0±0,21 1,3±0,21 0 0,5±0,34 0,9±0,31 1,2±0,25 2,0±0,37 0 40 45 50 Таким чином, наші дані показали відсутність пошкоджуючої дії сполуки 1 на СОШ за даних умов експерименту. Нами визначались також показники гастротоксичності СОШ за умов повторного внутрішньошлункового введення (протягом 4 днів в дозі 50 мг/кг). При макроскопічному огляді СОШ звертало увагу незначне зменшення складчастості СОШ та досить виразне зменшення кількості слизу. Оцінка ульцерогенної дії сполуки 1 в субхронічному експерименті (n=10) наведена в таблиці 7. Підрахунок кількості та ступеню уражень, результати якого представлені в таблиці, показав, що, як і за умов гострого експерименту, ураження СОШ у тварин відповідали 1-2 балам, більш глибоких або розповсюджених уражень нами не було виявлено. Середній ступінь тяжкості в цій групі становив 1,4±0,27 бали, а множинність становила 1,9±0,64 виразок 6 UA 115205 C2 на 1 тварину. Це також свідчить на користь відсутності гастротоксичного впливу цієї сполуки на шлунок. Таблиця 7 1 бал 6 0 50 мг/кг контроль 5 10 2 бали 5 0 3 бали 0 0 4 бали 0 0 1,4±0,27 0 1,9±0,64 0 Отже представлені дані свідчать про відсутність серйозного пошкоджуючого впливу на шлунок у досліджуваної сполуки, навіть за умов її введення у дуже великих дозах, які на декілька порядків перевищували середні ефективні дози і наближались до верхньої межі припустимих доз, які можна одноразово вводити щурам. Тому на наступному етапі доцільним стало визначення впливу сполуки 1 на шлунок при тривалому застосуванні (28 днів) в середній ефективній дозі 0,5 мг/кг. Оцінка ульцерогенної дії сполуки 1 (0,5 мг/кг) в хронічному експерименті наведена в таблиці 8. Таблиця 8 Доза, мг/кг Кількість тварин з ураженнями СОШ різного ступеня 1 бал 2 бали 3 бали 4 бали 0,5 мг/кг (n=14) Контроль (n=10) 15 Середній бал Множинність ураження 4 1 0 0 0,4±0,17 0,5±0,23 0 0 0 0 0 0 Результати засвідчили, що 28-денне внутрішньошлункове введення сполуки 1 в середньоефективній дозі 0,5 мг/кг не проявило негативного впливу на СОШ. З 14 тварин дослідної групи лише у 4 спостерігались поодинокі поверхневі ушкодження, які можна оцінити в 1 бал. У 1 щура виявлена виразка 2 ступеня. В цій групі множинність ураження становила 0,5±0,23, а середній бал - 0,4±0,17. ФОРМУЛА ВИНАХОДУ 20 Застосування сполуки формули 1 O H N O Br N Cl 1 25 як засобу, що гальмує нейропатичний біль та має протисудомну властивість. Комп’ютерна верстка О. Гергіль Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07D 243/24, A61K 31/5513
Мітки: застосування, гальмування, етіології, судом, різної, нейропатичного, болю, 7-бром-5-(о-хлорфеніл)-3-пропокси-1,2-дигідро-3н-1,4-бенздіазепін-2-ону
Код посилання
<a href="https://ua.patents.su/9-115205-zastosuvannya-7-brom-5-o-khlorfenil-3-propoksi-12-digidro-3n-14-benzdiazepin-2-onu-dlya-galmuvannya-nejjropatichnogo-bolyu-ta-sudom-rizno-etiologi.html" target="_blank" rel="follow" title="База патентів України">Застосування 7-бром-5-(о-хлорфеніл)-3-пропокси-1,2-дигідро-3н-1,4-бенздіазепін-2-ону для гальмування нейропатичного болю та судом різної етіології</a>
Попередній патент: Спосіб вирощування аg7ges5i методом спрямованої кристалізації з розплаву-розчину
Наступний патент: Спосіб синтезу клофарабіну
Випадковий патент: Спосіб прогнозування структурно-функціональних змін печінки при інфекційному мононуклеозі у дітей