Спосіб одержання [(1s)-[1a,2b,3b,4a(s)]]-4-[7-[[1-(3-хлор-2-тієніл)метил] пропіл]аміно]-3н-імідазо[4,5-b]піридин-3-іл]-n-етил-2,3-дигідроксициклопентанкарбоксаміду, способи одержання проміжних сполук для його одержання та проміжні сполуки
Номер патенту: 54479
Опубліковано: 17.03.2003
Автори: Паунер Торі Х., Цуей Чінг Т., Вальтер Френсіс Л., Ванасс Бенуа Дж., Гарсіа Ерве, Шах Харшавадан К., Рейллі Лоренс, Леон Патрік, О'Брайєн Майкл К., Томпсон Майкл Д.
Формула / Реферат
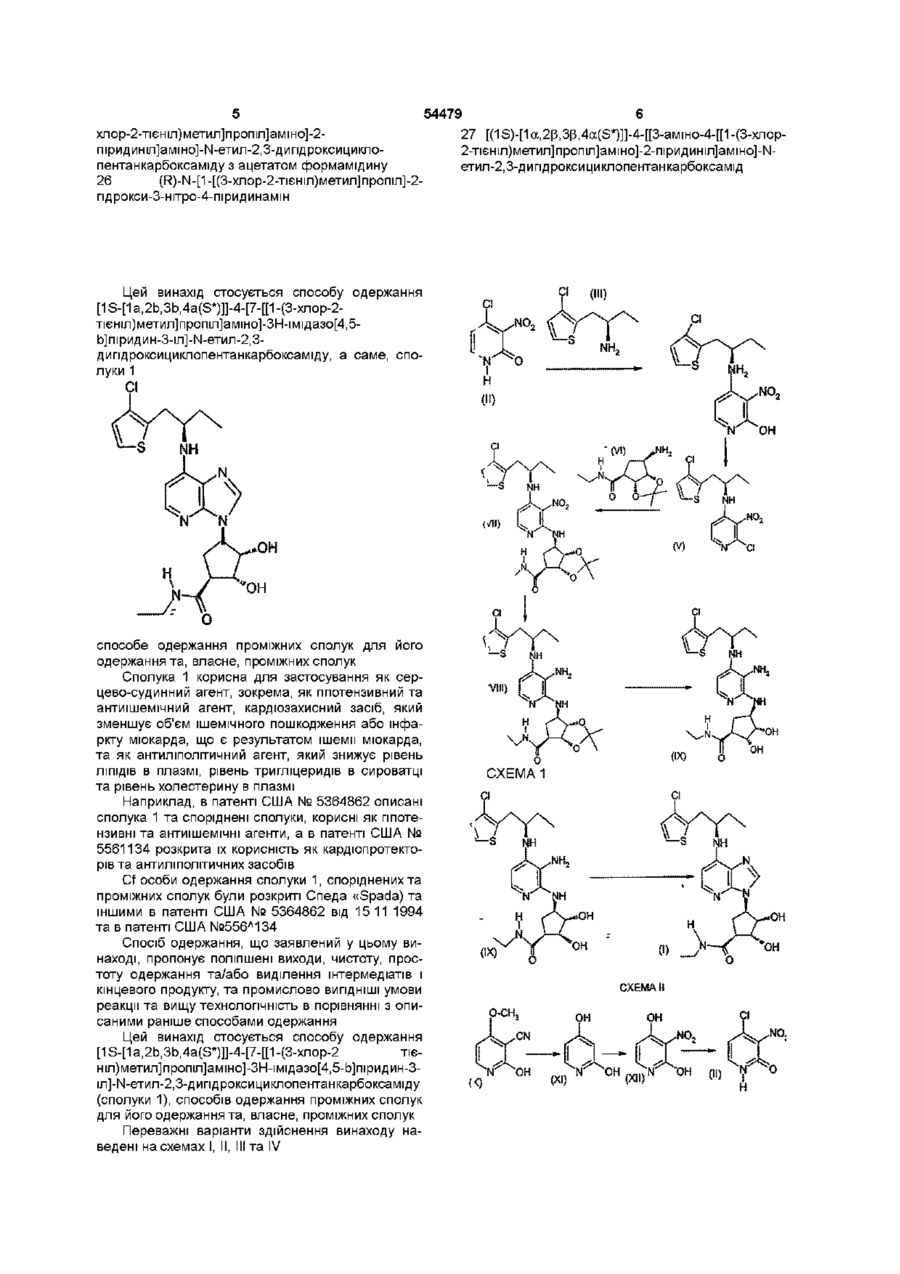
1. Спосіб одержання [(1S)-[1a,2b,3b,4a(S*)]]-4-[7-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3H-імідазо[4,5-b]піридин-3-іл]-N-етил-2,3-дигідроксициклопентанкарбоксаміду, який включає взаємодію [(1S)-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксициклопентанкарбоксаміду зі складним ефіром ортоформіату, ацетатом формамідину або диметилацеталем диметилформаміду.
2. Спосіб за п. 1, де реакцію проводять з ацетатом формамідину.
3. Спосіб за п. 1, який додатково включає гідроліз [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду з утворенням [(1S)-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксициклопентанкарбоксаміду.
4. Спосіб за п. 3, де гідроліз проводять в присутності водної хлористоводневої кислоти.
5. Спосіб одержання [(1S)-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксициклопентанкарбоксаміду, який включає гідроліз [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду.
6. Спосіб за п. 3, який додатково включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду з утворенням [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду.
7. Спосіб за п. 6, де згадане відновлення проводять в присутності платини на вологому вугіллі та форміату амонію, або в присутності цинку та ацетату амонію, або в присутності платини на вугіллі в присутності водню.
8. Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду, який включає відновлення [(3aR)-[Зaa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду в присутності платини на вологому вугіллі та форміату амонію.
9. Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду, який включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду в присутності цинку та ацетату амонію.
10. Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-xлop-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду, який включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду в присутності платини на вугіллі та водню.
11. Спосіб за п. 6, який додатково включає взаємодію (R)-2-xлop-N-[1-[(3-xлop-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну з (2R,3S)-ізопропілідендіокси-(4R)-аміно-(1S)-етиламінокарбонілциклопентаном з утворенням [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду.
12. Спосіб за п. 11, де реакцію проводять в присутності толуолу та карбонату лужного металу.
13. Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду, який включає взаємодію (R)-2-xлop-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну з (2R,3S)-ізопропіліден-діокси-(4R)-аміно-(1S)-етиламінокарбонілциклопентаном в присутності карбонату лужного металу.
14. Спосіб за п. 11, який додатково включає заміщення гідроксильної групи в (R)-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміні на атом хлору з утворенням (R)-2-хлор-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну.
15. Спосіб за п. 14, де заміщення проводять в присутності оксихлориду фосфору.
16. Спосіб одержання (R)-2-xлop-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну, який включає заміщення гідроксильної групи в (R)-N-[1-[(3-xлop-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміні.
17. Спосіб за п. 14, який додатково включає взаємодію 4-хлор-3-нітропіридин-2(1Н)-ону з (R)-3-хлор-a-етил-2-тіофенетанаміном з утворенням (R)-N-[1-[(3-xлop-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміну.
18. Спосіб за п. 17, де реакцію проводять в присутності ізопропанолу та Ν,Ν-діізопропілетиламіну.
19. Спосіб одержання (R)-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміну, який включає взаємодію 4-хлор-3-нітропіридин-2(1Н)-ону з (R)-3-хлор-a-етил-2-тіофенетанаміном.
20. Спосіб за п. 17, який додатково включає взаємодію 4-гідрокси-3-нітро-2(1Н)-піридону з оксихлоридом фосфору з утворенням 4-хлор-3-нітропіридин-2(1Н)-ону.
21. Спосіб одержання 4-гідрокси-3-нітро-2(1Н)-піридону, який включає гідроліз та декарбоксилювання 2-гідрокси-3-ціано-4-метоксипіридину з утворенням 2,4-дигідроксипіридину з наступним нітруванням 2,4-дигідроксипіридину.
22. Спосіб за п. 21, де гідроліз, декарбоксилювання та нітрування здійснюють каскадним методом, без необхідності проміжного виділення та очищення 2,4-дигідроксипіридину.
23. Спосіб одержання дигідрохлоридної солі [1S-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідрокси-циклопентанкарбоксаміду, який включає стадії:
взаємодії 4-хлор-3-нітропіридин-2(1Н)-ону з (R)-3-хлор-a-етил-2-тіофенетанаміном, одержуючи (R)-N-[1-[(3-хлор-2-тієніл)метил]пропіл-2-гідрокси-3-нітро-4-піридинамін, з наступним заміщенням гідроксильної групи в (R)-N-[1-[(3-xлop-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміні на атом хлору, одержуючи (R)-2-хлор-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинамін,
з наступною взаємодією (R)-2-хлор-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну з (2R,3S)-ізопропілідендіокси-(4R)-аміно-(1S)-етиламінокарбонілциклопентаном, одержуючи [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксамід, з наступним відновленням [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду до [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду, з наступним гідролізом [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду в присутності хлористоводневої кислоти, причому ці стадії здійснюють каскадним методом без необхідності проміжного виділення та очищення проміжних сполук:
[(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду,
[(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3-нітро-2-піридиніл]аміно]-N-етилтетрагідро-2,2-диметил-4Н-циклопента-1,3-діоксол-4-карбоксаміду,
(R)-2-хлор-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4-піридинаміну або
(R)-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинаміну.
24. Спосіб одержання [(1S)-[1a,2b,3b,4a(S*)]]-4-[7-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3H-імідазо[4,5-b]піридин-3-іл]-N-етил-2,3-дигідроксициклопентанкарбоксаміду в кристалічному вигляді, який включає стадії утворення вільної основи [1S-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксициклопентанкарбоксаміду з його дигідрохлоридної солі, з наступною взаємодією вільної основи з ацетатом формамідину, причому ці стадії здійснюють каскадним методом без необхідності проміжного виділення та очищення вільної основи.
25. Спосіб одержання [(1S)-[1a,2b,3b,4a(S*)]]-4-[7-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-3H-імідазо[4,5-b]піридин-3-іл]-N-етил-2,3-дигідроксициклопентанкарбоксаміду в кристалічному вигляді, який включає взаємодію дигідрохлориду [(1S)-[1a,2b,3b,4a(S*)]]-4-[(3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксицикло-пентанкарбоксаміду з ацетатом формамідину.
26. (R)-N-[1-[(3-хлор-2-тієніл)метил]пропіл]-2-гідрокси-3-нітро-4-піридинамін.
27. [(1S)-[1a,2b,3b,4a(S*)]]-4-[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-N-етил-2,3-дигідроксициклопентанкарбоксамід.
Текст
УКРАЇНА (19) U А (11,54479 (із) С2 (51)7 C07D409/12,471/04,409/14,407/14,213/61,2 13/64,213/69 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ ОПИС ДО ПАТЕНТУ НА ВИНАХІД (54) СПОСІБ ОДЕРЖАННЯ [(15)-[1А,2В,ЗВ,4А(5*)]]-4-[7-[[1-(3-ХЛОР-2-ТІЄНІЛ)МЕТИЛ] ПРОПІЛ]AMIНО]ЗНЧМІДАЗО[4,5-В]ПІРИДИН-ЗЧЛ]-М-ЕТИЛ-2,3-ДИПДРОКСИЦИКЛОПЕНТАНКАРБОКСАМІДУ, СПОСОБИ ОДЕРЖАННЯ ПРОМІЖНИХ СПОЛУК ДЛЯ ЙОГО ОДЕРЖАННЯ ТА ПРОМІЖНІ СПОЛУКИ (21)99073906 ( 2 2 ) 2 4 11 1997 (24)17 03 2003 (86) PCT/US97/21439, 24 11 1997 (31)60/032,764 (32)11 12 1996 (33) US (46) 17 03 2003, Бюл № 3, 2003 р (72) О'брайєн Майкл К , US, Гарсіа Ерве , FR, Леон Патрік , FR, Паунер Торі X , US, Рейллі Лоренс , US, Шах Харшавадан К, US, Томпсон Майкл Д , US, Цуей Чшг Т , US, Ванасс Бенуа Дж , US, Вальтер Френсіс Л , US (73) Авентіс Фармасьютікалз Продактс Інк , US (56) Пат 5364862 US, A61K31/44, Заявл 02 10 92, Опубл 15 11 94 Пат 5561134 US, A61K31/52, Заявл 03 1094, Опубл 01 10 96 (57) 1 Спосіб одержання [(1S)-[1a,2p,3p,4a(S*)]]-4-[7[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-ЗНімідазо[4,5-Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду, який включає взаємодію [(1 S)-[1 a,2p,3p,4a(S*)]]-4-[[3-aMiHO-4-[[1 (3-хлор-2-тієніл)метил]пропіл]аміно]-2піридиніл]амшо]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду зі складним ефіром ортоформіату, ацетатом формамідину або диметилацеталем диметилформаміду 2 Спосіб за п 1, де реакцію проводять з ацетатом формамідину 3 Спосіб за п 1, який додатково включає гідроліз [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1-(3хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]аміно]-І\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду з утворенням [(1 S)-[1 a,2p,3p,4a(S*)]]-4-[[3-aMiHO-4-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]амшо]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду 4 Спосіб за п 3, де гідроліз проводять в присутності водної хлористоводневої кислоти 5 Спосіб одержання [(1S)-[1a,2p,3p,4a(S*)]]-4-[[3амшо-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2піридиніл]аміно]-І\І-етил-2,3 дипдроксициклопентанкарбоксаміду, який включає гідроліз [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду 6 Спосіб за п 3, який додатково включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1 -(3-хпор2-тієніл)метил]пропіл]амшо]-3-нітро-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду з утворенням [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду 7 Спосіб за п 6, де згадане відновлення проводять в присутності платини на вологому вугіллі та форміату амонію, або в присутності цинку та ацетату амонію, або в присутності платини на вугіллі в присутності водню 8 Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]2-піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил4Н-циклопента-1,3-дюксол-4-карбоксаміду, який включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-3нггро-2-піридиніл]аміно]-М-етилтетрапдро-2,2диметил-4Н-циклопента-1,3-дюксол-4карбоксаміду в присутності платини на вологому вугіллі та форміату амонію 9 Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]-6[[3-аміно-4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]2-піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил4Н-циклопента-1,3-дюксол-4-карбоксаміду, який включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-3нггро-2-піридиніл]аміно]-М-етилтетрапдро-2,2диметил-4Н-циклопента-1,3-дюксол-4карбоксаміду в присутності цинку та ацетату амонію 10 Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]6-[[3-амшо-4-[[1 -(З-хлор-2тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-Метилтетрапдро-2,2-диметил-4Н-циклопента-1,3дюксол-4-карбоксаміду, який включає відновлення [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-xnop-2 О о> ю 54479 тієніл)метил]пропіл]аміно]-3-нітро-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду в присутності платини на вугіллі та водню 11 Спосіб за п 6, який додатково включає взаємодію (R)-2-xnop-N-[1-[(3-xnop-2тієніл)метил]пропіл]-3-нітро-4-піридинаміну з (2R,3S)-i3onpomnifleHflioKCH-(4R)-aMiHO-(1S)етиламшокарбоніл циклопентаном з утворенням [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-xnop-2тієніл)метил]пропіл]аміно]-3-нітро-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду 12 Спосіб за п 11, де реакцію проводять в присутності толуолу та карбонату лужного металу 13 Спосіб одержання [(3aR)-[3aa,4a,6a(R*),6aa]]6-[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-3нггро-2-піридиніл]аміно]-М-етилтетрапдро-2,2диметил-4Н-циклопента-1,3-дюксол-4карбоксаміду, який включає взаємодію (RJ-2-хлорг\І-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нггро-4піридинамшу з (2R,3S)-i3onpomnifleH-flioKCH-(4R)аміно-(13)-етиламшокарбоніл циклопентаном в присутності карбонату лужного металу 14 Спосіб за п 11, який додатково включає заміщення гідроксильної групи в (R)-N-[1-[(3-xnop-2тієніл)метил]пропіл]-2-пдрокси-3-нітро-4піридинамші на атом хлору з утворенням (R)-2хлор-г\І-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нггро-4піридинамшу 15 Спосіб за п 14, де заміщення проводять в присутності оксихлориду фосфору 16 Спосіб одержання (R)-2-xnop-N-[1 -[(З-хлор-2тієніл)метил]пропіл]-3-нітро-4-піридинаміну, який включає заміщення гідроксильної групи в (R)-N-[1[(3-хлор-2-тієніл)метил]пропіл]-2-пдрокси-3-нітро4-піридинамші 17 Спосіб за п 14, який додатково включає взаємодію 4-хлор-3-нітропіридин-2(1Н)-ону з (R)-3хлор-а-етил-2-тюфенетанаміном з утворенням (R)І\І-[1-[(3-хлор-2-тієніл)метил]пропіл]-2-пдрокси-3нітро-4-піридинамшу 18 Спосіб за п 17, де реакцію проводять в присутності ізопропанолута г\І,г\І-діізопропілетиламіну 19 Спосіб одержання (R)-N-[1-[(3-xnop-2тієніл)метил]пропіл]-2-пдрокси-3-нітро-4піридинамшу, який включає взаємодію 4-хлор-Знітропіридин-2(1Н)-ону з (R)-3-xnop-a-eTnn-2тюфенетанаміном 20 Спосіб за п 17, який додатково включає взаємодію 4-пдрокси-3-нітро-2(1Н)-піридону з оксихлоридом фосфору з утворенням 4-хлор-Знітропіридин-2(1 Н)-ону 21 Спосіб одержання 4-пдрокси-3-нітро-2(1Н)піридону, який включає гідроліз та декарбоксилювання 2-пдрокси-3-ціано-4-метоксипіридину з утворенням 2,4-дипдроксипіридину з наступним нітруванням 2,4-дипдроксипіридину 22 Спосіб за п 21, де гідроліз, декарбоксилювання та нітрування здійснюють каскадним методом, без необхідності проміжного виділення та очищення 2,4-дипдроксипіридину 23 Спосіб одержання дипдрохлоридної солі [1S[1 a,2p,3p,4a(S*)]]-4-[[3-aMiHO-4-[[1 -(З-хлор-2тієніл)метил]пропіл]аміно]-2-піридиніл]аміно]-І\Іетил-2,3-дипдрокси-циклопентанкарбоксаміду, який включає стадії взаємодії 4-хлор-3-нітропіридин-2(1Н)-ону з (R)-3хлор-а-етил-2-тюфенетанаміном, одержуючи (R)І\І-[1-[(3-хлор-2-тієніл)метил]пропіл-2-пдрокси-3нітро-4-піридинамш, з наступним заміщенням гідроксильної групи в (R)-N-[1-[(3-xnop-2тієніл)метил]пропіл]-2-пдрокси-3-нітро-4піридинамші на атом хлору, одержуючи (RJ-2-хлорМ-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нітро-4піридинамш, з наступною взаємодією (R)-2-xnop-N-[1-[(3-xnop-2тієніл)метил]пропіл]-3-нітро-4-піридинаміну з (2R,3S)-i3onpomnifleHflioKCH-(4R)-aMiHO-(1S)етиламшокарбоніл циклопентаном, одержуючи [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-xnop-2тієніл)метил]пропіл]аміно]-3-нітро-2піридиніл]амшо]-М-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксамід, з наступним відновленням [(3aR)-[3aa,4a,6a(R*),6aa]]-6[[4-[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-3-нітро2-піридиніл]амшо]-М-етилтетрапдро-2,2-диметил4Н-циклопента-1,3-дюксол-4-карбоксаміду до [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1-(3хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]амшо]-М-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду, з наступним гідролізом [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3амшо-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2піридиніл]амшо]-М-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду в присутності хлористоводневої кислоти, причому ці стадії здійснюють каскадним методом без необхідності проміжного виділення та очищення проміжних сполук [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1-(3хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду, [(3aR)-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-xnop-2тієніл)метил]пропіл]аміно]-3-нітро-2піридиніл]амшо]-М-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду, (R)-2-xnop-N-[1-[(3-xnop-2-TieHin)MeTnn]nponin]-3нітро-4-піридинамшу або (R)-N-[1-[(3-xnop-2-TieHin)MeTHn]npomn]-2-riflpoKCHЗ-нітро-4-піридинамшу 24 Спосіб одержання [(1S)-[1a,2p,3p,4a(S*)]]-4-[7[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-ЗНімідазо[4,5-Ь]піридин-3-іл]-М-етил-2,3дипдроксициклопентанкарбоксаміду в кристалічному вигляді, який включає стадії утворення вільної основи [1 S-[1 a,2p,3p,4a(S*)]]-4-[[3-aMiHO-4-[[1 (3-хлор-2-тієніл)метил]пропіл]аміно]-2піридиніл]амшо]-М-етил-2,3дипдроксициклопентанкарбоксаміду з його дипдрохлоридної солі, з наступною взаємодією вільної основи з ацетатом формамідину, причому ці стадії здійснюють каскадним методом без необхідності проміжного виділення та очищення вільної основи 25 Спосіб одержання [(1S)-[1a,2p,3p,4a(S*)]]-4-[7[[1-(3-хлор-2-тієніл)метил]пропіл]амшо]-ЗНімідазо[4,5-Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду в кристалічному вигляді, який включає взаємодію дипдрохлориду [(1 S)-[1 a,2p,3p,4a(S*)]]-4-[(3-aMiHO-4-[[1 -(З 54479 хлор-2-тієніл)метил]пропіл]амшо]-2піридиніл]аміно]-І\І-етил-2,3-дипдроксициклопентанкарбоксаміду з ацетатом формамідину 26 (R)-N-[1 -[(3-хлор-2-тієніл)метил]пропіл]-2пдрокси-З-нітро-4-піридинамш Цей винахід стосується способу одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(З-хлор-2тієніл)метил]пропіл]аміно]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду, а саме, сполуки 1 Сі способе одержання проміжних сполук для його одержання та, власне, проміжних сполук Сполука 1 корисна для застосування як серцево-судинний агент, зокрема, як гіпотензивний та антиішемічний агент, кардюзахисний засіб, який зменшує об'єм ішемічного пошкодження або інфаркту міокарда, що є результатом ішемії міокарда, та як антиліполітичний агент, який знижує рівень ЛІПІДІВ в плазмі, рівень тригліцеридів в сироватці та рівень холестерину в плазмі Наприклад, в патенті США № 5364862 описані сполука 1 та споріднені сполуки, корисні як гіпотензивні та антиішемічні агенти, а в патенті США № 5561134 розкрита їх корисність як кардюпротекторів та антиліполітичних засобів Cf особи одержання сполуки 1, споріднених та проміжних сполук були розкриті Спеда «Spada) та іншими в патенті США № 5364862 від 15 11 1994 та в патенті США №556Л134 Спосіб одержання, що заявлений у цьому винаході, пропонує поліпшені виходи, чистоту, простоту одержання та/або виділення штермедіатів і кінцевого продукту, та промислово ВИГІДНІШІ умови реакції та вищу технологічність в порівнянні з описаними раніше способами одержання Цей винахід стосується способу одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(З-хлор-2 тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5-Ь]піридин-3іл]-г\І-етил-2,3-дипдроксициклопентанкарбоксаміду (сполуки 1), способів одержання проміжних сполук для його одержання та, власне, проміжних сполук Переважні варіанти здійснення винаходу наведені на схемах І, II, III та IV 27 [(1 S)-[1 a,2p,3p,4a(S*)]]-4-[[3-aMiHO-4-[[1 -(3-хлор2-тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-г\Іетил-2,3-дипдроксициклопентанкарбоксамід 54479 тієніл)метил]пропіл]аміно]-2-піридинл]амшо]-г\Іетил-2,3-дипдроксициклопентанкарбоксаміду (сполука IX) з ацетатом формамідину, або зі складним ефіром ортоформіату, або з диметилацеталем диметилформаміду, необов'язково в присутності каталітичної КІЛЬКОСТІ неорганічної або органічної кислоти Ця реакція протікає переважно в присутності органічного розчинника або суміші органічних розчинників, води, або в суміші органічного розчинника або розчинників та води В конкретному втіленні способів, згідно з винаходом, реакція протікає переважно з ацетатом формамідину в н-бутилацетаті В переважному варіанті способу реакція протікає переважно з триетилортоформіатом в присутності каталітичної КІЛЬКОСТІ неорганічної або органічної кислоти, переважно хлористоводневої кислоти або камфорсульфокислоти Переважне втілення цього винаходу належить до способу одержання сполуки 1, переважно в кристалічному вигляді, що включає в себе стадії утворення сполуки IX в виді вільної основи з його дипдрохлоридної солі, з наступною взаємодією згаданої вільної основи з ацетатом формамідину, причому згадані стадії здійснюють каскадним чином без необхідності проміжного виділення та очищення сполуки IX в виді вільної основи Переважніше винахід належить до способу одержання сполуки 1 в кристалічному вигляді, який включає в себе взаємодією дипдрохлоридної солі сполуки IX з ацетатом формамідину, без початкового утворення вільної основи із сполука IX Наступним предметом цього винаходу є спосіб одержання сполуки IX, що включає гідроліз [3aR[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1-(3-xnop-2тієніл)метил]-пропіл]аміно]-2-піридиніл]амшо]-г\Іетилтетрапдро-2,2-диметил-4Н-циклопента-1,3дюксол4-карбоксаміду (сполука VIII), переважно в присутності органічного розчинника або суміші органічних розчинників та водної мінеральної або органічної кислоти Приклади таких органічних розчинників включають метанол, етанол, ізопропанол, етилацетат, толуол, тетрапдрофуран, тетрапдропіран та діоксан Переважним розчинником є метанол або суміш толуолу та ізопропанолу Переважною сумішшю для проведення гідролізу сполуки VIII в сполуку IX є тетрапдрофуран та водна хлористоводнева кислота, метанол, етанол або ізопропанол та водна хлористоводнева кислота, або етилацетат, або етилацетат та ізопропанол і водна хлористоводнева кислота Ще одним предметом цього винаходу є спосіб одержання сполуки VIII, що включає відновлення [3aR-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3-xnop-2тієніл)метил]-пропіл]амшо]-3-нітро-2піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нциклопента-1,3-дюксол-4-карбоксаміду (сполука VII), переважно, в присутності органічного розчинника або суміші органічних розчинників та води Приклади таких органічних розчинників включають метанол, етанол, ізопропанол, етилацетат, тетрапдрофуран, тетрапдропіран та діоксан Переважним розчинником є метанол Відновлення переважно протікає в інтервалі температур від близько 20°С до близьке 90°С, краще при температурі утворення флегми в сис 8 темі, в якій проводять відновлення В конкретному втіленні способів, згідно з винаходом, переважна температура складає біля 65°С або рівна температурі утворення флегми для відновлювальної системи при проведенні реакції в метанолі Відновлення сполуки VII до сполуки VIII протікає в присутності ВІДНОВНИКІВ, відомих в цій галузі або описаних в цій заявці Придатними відновниками є борпдрид калію в присутності хлориду МІДІ (І), залізо та водна хлористоводнева кислота, цинк та хлорид кальцію, платина на вугіллі або паладій на вугіллі в присутності водню, платина на вугіллі в присутності форміату амонію, цинковий пил в присутності ацетату амонію та платина на сіркованому вугіллі в присутності форміату амонію Згідно 4 винаходом переважним відновним агентом є платина на вологому вугіллі або цинковий пил в присутності речовин, здатних переносити водень до відновлюваної нітро-групи, переважно, ацетат амонію або платина на вугіллі в присутності водню Іншим предметом цього винаходу є спосіб одержання сполуки VII, що включає взаємодію (R)2-хлор-г\І-[1-[(3-хлор-2-тієніл)метил]пропіл]-3-нггро4-піридинамшу (сполука V) з 2R.3Si3onponinifleHflioKCH-4R-aMiHO-1Sетиламшокарбонілциклопантаном (сполука VI), переважно, в присутності апротонного органічного розчинника Придатні для цієї реакції апротонні органічні розчинники включають апротонні органічні прості ефіри, ароматичні вуглеводні, гетероароматичні вуглеводні, аліфатичні вуглеводні та апротонні органічні аміди Переважним органічним розчинником є толуол Згідно З винаходом, реакція сполуки V зі сполукою VI протікає в присутності основи Придатні для цієї реакції основи включають гідроксиди лужних металів, водні карбоніти лужних металів, водні гідрокарбонати лужних металів та апротонні органічні аміни Переважною основою є карбонат калію Ще одним предметом цього винаходу є спосіб одержання сполуки V, що включає заміщення гідроксильної групи в (R)-N-[1-[(3-xnop-2тієніл)метил]пропіл]-2-пдрокси-3-нітро-4піридинамші (сполука IV) на хлор-групу, переважно в присутності апротонного органічного розчинника Придатні для цієї реакції апротонні органічні розчинники включають апротонні органічні прості ефіри, ароматичні вуглеводні, гетероароматичні вуглеводні, аліфатичні вуглеводні та апротонні органічні аміди Переважним органічним розчинником є толуол Агенти, придатні для здійснення заміщення, включають в себе оксалілхлорид, трихлористий фосфор, п'ятихлористий фосфор, тюнілхлорид та оксихлорид фосфору Переважним агентом є оксихлорид фосфору Наступним предметом винаходу є спосіб одержання сполуки IV, що включає взаємодію 4-хлор3-нітропіридин-2(1Н)-ону (сполука II) з (R)-3-xnopа-етил-2-тюфенетанаміном (сполука III), переважно в органічному розчиннику або в суміші органічних розчинників, в воді, або в суміші органічного розчинника або органічних розчинників та води Приклади придатних органічних розчинників включають метанол, етанол, ізопропанол, етилацетат, 54479 тетрапдрофуран, тетрапдропіран та діоксан Приклади переважних розчинників включають в себе метанол, етанол, ізопропанол та суміш метанолу, етанолу або ізопропанолута води Згідно З винаходом, взаємодія сполуки II зі сполукою III протікає в присутності основи Придатні для цієї реакції основи включають в себе водні гідроксиди лужних металів водні карбонати лужних металів, водні гідрокарбонати лужних металів та апротонні органічні аміни Переважною основою є г\І,г\І-діізопропілетиламін Ще одним предметом винаходу є спосіб одержання сполуки II, що включає взаємодію 4пдрокси-3-нітро-2(1Н)-піридону (сполука XII) з оксихлоридом фосфору або тюнілхлоридом, переважно з оксихлоридом фосфору, в присутності органічного розчинника та в присутності основи Придатні для цієї реакції органічні розчинники включають в себе апротонні органічні прості ефіри, ароматичні вуглеводні, гетероароматичні вуглеводні, аліфатичні вуглеводні, галогензаміщені вуглеводні та апротонні органічні аміди Приклади придатних органічних розчинників включають в себе толуол, метил-трет-бутиловий ефір, диметилформамід, етилацетат, бутилацетат, 1-метил-2піролідинон, хлороформ та хлористий метилен Переважним органічним розчинником є толуол, а переважною основою є г\І,г\І-діізопропілетиламін Наступним предметом винаходу є спосіб одержання сполуки XII, що включає гідроліз та декарбоксилювання 2-пдрокси-3-ціано-4метоксипіридину з утворенням 2,4дипдроксипіридину з наступним нітруванням згаданого 2,4-дипдроксипіридину В конкретному втіленні способу гідроліз, декарбоксилювання та нітрування здійснюють «каскадним» методом без необхідності проміжного виділення та очищення згаданого 2,4-дипдроксипіридину, переважно шляхом послідовного нагрівання 2-пдрокси-3-ціано-4метоксипіридину з концентрованою фосфорною КИСЛОТОЮ, ПОТІМ З ЛЬОДЯНОЮ ОЦТОВОЮ КИСЛОТОЮ, потім з азотною кислотою Переважне втілення винаходу належить до способу одержання дипдрохлоридної солі сполуки IX, що включає в себе стадії взаємодії сполуки II зі сполукою III з утворенням сполуки IV з наступним заміщенням гідроксильної групи в сполуці IV на хлор-групу з утворенням сполуки V, за яким іде взаємодія сполуки V зі сполукою VI з утворенням сполуки VII, з наступним відновленням сполуки VII в сполуку VIII, з наступним гідролізом сполуки VIII в присутності хлористоводневої кислоти причому згадані стадії здійснюють «каскадним» методом, без необхідності проміжного виділення та очищення проміжних сполук VIII, VII, V або IV Для фахівця в цій галузі очевидно, що пдроксипіридини можуть існувати в виді таутомерних піридинонів, а піридинони можуть існувати в виді таутомерних пдроксипіридинонів ВІДПОВІДНО, сполуки II, III, X, XI та XII можуть існувати в виді ВІДПОВІДНОГО пдроксипіридину або піридону, або суміші цих двох форм Цей винахід далі ілюструється, але ніяк не обмежується, такими прикладами Приклад 1 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3 10 хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука 1) Моногідрат дипдрохлориду [1S[1 a,2b,3b,4a(S*)]]-4-[[3-aMiHO-4-[[1 -(З-хлор-2тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-г\Іетил-2,3-дипдроксициклопентан-карбоксаміду (сполука IX) (20г) суспендували в воді (120мл) та нагрівали цю суміш до 65°С для одержання розчину Додали бутилацетат (84,7г), після чого додали карбоніт натрію (15,2г) в воді (54г) Цю суміш перемішували при 55 ± 5°С біля 10 хвилин потім шари розділили та промили органічний шар насиченим розчином солі До органічного шару додали ацетат формамідину (10,3г) та перемішували суміш при 85 ± 5°С приблизно на протязі 2 годин Суміш охолодили до 55 ± 5°С, промили 5%-ним водним розчином гідрокарбонату натрію, потім водою До органічного шару додали воду (1,2г) при 55 ± 5°С, потім суміш охолодили до 21 ± 2°С на протязі близько 2 годин Суміш перемішували від 12 до 24 годин, відфільтрували, осад промили бутилацетатом та висушили в вакуумі при продуванні азотом при 52°С на протязі 24 годин, сдержавши в результаті [1S-[1a,2b,3b,4a(S*)]]-4-[7-[[1-(3-xnop2-тієніл)метил]пропіл]амшо]-ЗН-імідізо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксамід (сполуку 1) в вигляді гідрату, що містить біля 1,7% (м/м) води ЯМР 1Н (200 МГц, ДМСО) 5 0,915 (ЗН, т), 1,4 (ЗН, т), 3,2-3,0 (4Н, м), 4,91 (1Н, д), 6,3 (1Н д), 6,6 (1Н, ушир, д), 6,9 (1Н, д), 7,4 (1Н, д), 7,8 (1Н, д), 8,05 (1Н, ушир, т), 8,2 (1Н, с) Приклад 2 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука 1) н-Бутилацетат (54,3г) та ацетат формамідину (4,5г, 43ммоля) змішували при кімнатній температурі Суміш нагріли до 100°С та на протязі 21 хвилини додали моногідрат дипдрохлориду [1S[1 a,2b,3b,4a(S*)]]-4-[[3-aMiHO-4-[[1 -(З-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-М-етил-2,3дипдроксициклопентанкарбоксаміду (сполука IX) (8,4г, 15ммолей) Суміш перемішували при 100°С на протязі 1 години потім охолодили до 80°С та додали 8% м/м водного гідрокарбонату натрію (90мл) Суміш перемішували 5 хвилин, а після цього шари розділили Органічний шар (який витримували при 60°С) промили водою (45г) Потім органічний шар обробили активованим вугіллям (0,42г) та перемішували при 75°С на протязі 45 хвилин Реакційну суміш відфільтрували та охолодили фільтрат до 22°С на протязі 1 години Суміш перемішували 2 години при 22°С, а одержаний осад відфільтрували та промили н-бутилацетатом (бмл) Зібраний білий осад сушили в вакуумі при 50°С на протязі ночі при продуванні азотом, одержавши в результаті сполуку І Приклад З Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука 1) н-Бутилацетат (25,2г) та ацетат формамідину 12 11 54479 (2,81г, 27ммолей) змішували при кімнатній темпеВ літрову тригорлу круглодонну колбу, оснаратурі Суміш нагріли до 100°С та в інтервалі від щену механічною мішалкою, термопарою, впуском 94 до 100°С на протязі 11 хвилин додали суспеназоту та холодильником, послідовно завантажили зію моногідрату дипдрохлориду сполуки IX (8,4г, 14,5г ^)-3-хлор-а-етил-2-тюфенетанамшу (сполу15ммолеа) в н-бутилацетаті (30,6г), що має кімнака III), 10,9г 4-хлор-3-нітропіридин-2(1Н)-ону (спотну температуру, з промиванням н-бутилацетатом лука II), 35г 2-пропанолу (ІП) та 25мл N,N(9,0г), для повного перенесення суспензії Суміш дмзопропілетиламіну (ДІПЕА) Суміш перемшували перемішували при 100°С на протязі ЗО хвилин при 70 ± 2°С на протязі 7 годин, перш ніж реакційРеакційну суміш охолодили до 80°С та додали 8% ну суміш залишили охолоджуватися на протязі мім водного гідрокарбонату натрію (90мл) Суміш ночі до кімнатної температури 22 ± 3°С Суміш перемішували 5 хвилин, потім шари розділили сконцентрували до 41,4г сиропу, який потім розчиОрганічний шар (який витримували при 60°С) пронили в 425мл етилацетату Цей розчин промили мили водою (45г) Потім J органічний шар оброби125мл води, 2 х 50мл 5N розчину хлориду амонію ли активованим вугіллям (0,42г) та перемішували та 2 х 50мл насиченого розчину хлориду натрію, при 75°С на протязі 45 хвилин Реакційну суміш перед тим, як висушити над сульфатом натрію відфільтрували та охолодили фільтрат до 22°С на Розчин відфільтрували, упарили та виділили одепротязі 1 години Суміш перемішували 2 години ржаний осад фільтруванням, одержавши при цьопри 22°С, а одержаний осад виділили фільтруванму сполуку IV, т пл 150-152°С Мас-спектр (El), m/z ням, промили н-бутилацетатом (5мл), одержавши 328 (6%), ЯМР 1Н (500 МГц, ДМСО) 5 0,91 (ЗН, т), в результаті сполук І 1,8-1,6 (2Н, м), 3,1 (1Н, м), 3,95 (1Н, м), 5,9 (1Н, д), 7,0 (1Н, д), 7,3 (1Н, дд), 7,5 (1Н, д), 8,8 (1Н, д), 11,1 Приклад 4 (1Н) Одержання [3aR-[3aa,4a,6a(R*),6aa]]-6-[[3аміно-4-[[1-(3-хлор-2-тієніл)метил]-пропіл]амшо]-2Приклад 7 піридиніл]амшо]-М-етилтетрапдро-2,2-диметил-4НОдержання (R)-2-xnop-N-[1 -[(З-хлор-2циклопента-1,3-дюксол-4-карбоксаміду (сполука тієніл)метил]пропіл]-3-нітро-4-піридин-амшу (І поVIII) лу ка V) Змішували [3aR-[3aa,4a,6a(R*),6aa]]-6-[[3Розчин (R)-N-[1 -[(З-хлор-2-тіеніл )меаміно-4-[[1-(3-хлор-2-тієніл)метил]-пропіл]амшо]-3тил]пропіл]-2-пдрокси-3-нітро-4-піридин-амшу нггро-2-піридиніл]аміно]-М-етилтетрапдро-2,2(сполука IV) в толуолі (0,1моль в ЮОмл толуолу), диметил-4Н-циклопента-1,3-дюксол-4-карбоксамід що містить 2 еквіваленти пдрохлориду ДІПЕА, (сполука VII) (12,4г), метанол (32,4г) та 5%-ну планагріли до 60°С та при перемішуванні на протязі тину на вугіллі лвологу, проба 62,4%) (9,6г) Суміш 10 хвилин додали 20,6г оксохлориду фосфору дегазували азотом та додали форміат амонію Реакційну суміш перемішували при 60°С до заве10,0г) Суміш нагрівали при температурі близько ршення реакції (3 години) Після охолодження до 65°С на протязі 4 годин, охолодили до 23°С, від0°С 245г 2N хлориду натрію додавши з такою фільтрували за допомогою фільтра (SulkaFloc швидкістю, щоб температура реакції підтримува300), промиваючи етилацетатом (180,4г) Фільтрат лась нижче 10°С Двофазну суміш перемішували 1 промили 5%-ним водним розчином гідрокарбонату - 2 години при 0°С, перш ніж и залишили охолонатрію (50мл), потім напівнасиченим водним розджуватися до кімнатної температури на протязі чином хлориду натрію Органічний шар упарили в ночі Нижній ВОДНИЙ шар ВІДДІЛИЛИ И ВІД органічновакуумі при 50°С, одержавши сполуку VIII в вигляго шару Органічний шар упарили в вакуумі та ді піни, яку використали в наступній реакції без очистили залишок флеш-хроматофафією при подальшого обробляння елююванні сумішшю 25 75 етил ацетат гептан, одержавши в результаті сполуку V МС (El), m/z Приклад 5 345 (10%), ЯМР 1Н (500 МГц, CDCI3/3D3OD) 5 1,0 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[[3-aMiHO-4(ЗН, т), 1,5-1,8 (2Н, м), 2,9-3,2 (2Н, м), 3,8 (1Н, м), [[1-(3-хлор-2-тієніл)метил]пропіл]-амшо]-2 піриди6,5 (1Н, ушир, д), 6,6 (1Н,д), 7,15 (1Н,д), 7,9 (1Н,д) ніл]аміно]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука IX) Приклад 8 Сполуку VIII (11,2г) змішували з тетрапдрофуОдержання [3aR-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1 раном (160г) та на протязі 2 хвилин додавали кон(3-хлор-2-тієніл)метил]пропіл]-амшо]-3-нітро-2центровану хлористоводневу кислоту (7,8мл) Супіридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нміш перемішували 15 годин, потім охолодили до 0 циклопента-1,3-дюксол-4-карбоксаміду (сполука - 3°С та перемішували ще 1 годину Суміш відфіVII) льтрували та промили осад охолодженим (0 - 3°С) До розчину (R)-2-xnop-N-[1-[(3-xnop-2-TieHin метил-трет-бутиловим ефіром потім висушили в )метил]пропіл]-3-нітро-4-піридин-амшу (сполука V) вакуумі при 55 ± 5°С при продуванні азотом на в толуолі (0,1моль в ЮОмл толуолу) послідовно протязі 48 годин, одержавши сполуку IX в виді солі окремими порціями додавали 28,5г карбонату камоногідрату дипдрохлориду, т пл 135°С, маслію розміром 345 меш, потім 33,7г 2R.3Sспесгр (El), m/z 467 (50%), ЯМР 1Н (500 МГц, i3onponinifleHflioKCH-4R-aMiHO-1SДМСО) 5 0,91 (1Н, т), 1,05 (1Н т), 1,55 (2Н, м), 2,39 етиламшокарбонілциклопентану (сполука VI) Су(1Н), 3,11 (1Н), 4,01 (2Н), 6,24 (1Н), 6,36 (1Н), 6,98 спензію нагрівали при 98 ± 2°С на протязі 6 годин (1Н), 7,37 (1Н), 7,48 (1Н), 12,47 (1Н) Після закінчення реакції суспензію охолодили до кімнатної температури та при перемішуванні доПриклад 6 дали 230г води Водний шар ВІДДІЛИЛИ, а в органіОдержання (R)-N-[1 -[(З-хлор-2чний шар при перемішуванні завантажили 14,5% тієніл)метил]пропіл]-2-пдрокси-3-нітро-4-піридинм/м розчин хлориду амонію, перш ніж знову ВІДДІаміну (сполука IV) 14 13 54479 лити нижній водний шар Додала 100г води та шатися до кімнатної температури на протязі ночі ри знову розділили, Толуольний розчин упарили в Зранку нижній водний шар ВІДДІЛЯЛИ ВІД оргавакуумі та очистили залишок флешнічного шару, що містить (R)-2-xnop-N-[1-[(3-xnopхроматографією при елююванні сумішшю 60 40 2-тієніл)метил]пропіл]-3-нітро-4-піридинамш (спо5 етилацетат гептан триетиламш, одержавши лука V), та додали до органічного шару в вигляді + сполуку VII Мас-спектр (FAB-LRP), (М+Н) 538 окремих порцій 28,5г карбонату калію розміром 1 (100%), ЯМР Н (500 МГц, CDCI3) 5 1,0 (ЗН, т), 1,15 325 меш а потім 33,7г 2R,3S-i3onpomnifleHflioKCH(ЗН, т), 1,6 (1Н, м), 1,75 (Н, м), 2,6 (1Н, м), 2,8 (1Н, м), 3,1 (2Н, м), 3,35 (2Н, м), 5,95 (1Н, д), 6,85 (1Н, (сполука VI) Суспензію нагрівали при 98 ± 2°С на д), 7,1 (1Н д), 7,8 (1Н, д), 9,25 (1Н, д), 9,55 (2Н, д) протязі 2 - 6 годин Після закінчення реакції при перемішуванні додали 230г деюнізованої води Приклад 9 Водний шар вилучили, а в органічний шар при пеОдержання [3aR-[3aa,4a,6a(R*),6aa]]-6-[[3ремішуванні завантажили 14,5%-ний м/м водний аміно-4-[[1-(3-хлор-2-тієніл)метил]-пропіл]амшо]-2розчин хлориду амонію, потім знову ВІДДІЛЯЛИ НИпіридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4НЖНІЙ водний шар Додали 100г деюнізованої води циклопента-1,3-дюксол-4-карбоксаміду (сполука та шари знову розділяли VIII) В розчин [3aR-[3aa,4a,6a(R*),6aa]]-6-[[4-[[1-(3В розчин сполуки VII в толуолі (0,09моля в хлор-2-тієніл)метил]-пропіл]амшо]-4-карбпксаміду 85мл толуолу) при перемішуванні завантажили 24г (сполука VII) в толуолі завантажили при перемішуметанолу, 18г ІП та 54г ацетату амонію (15хв) ванні 24г метанолу, 18г ІП та 54г ацетату амонію Після ЦЬОГО невеликими порціями додали 35г пилу (15хв) Після ЦЬОГО невеликими порціями додали металевого цинку (до того часу, поки не спостері35г пилу металевого цинку (до того часу, поки не галось розігрівання) при підтримуванні температуспотерігалось розігрівання), підтримуючи темперари реакції нижче 40°С Після повного додання Zn туру реакції нижче 40°С Після повного додання Zn реакційну суміш перемішували при 40°С на протязі реакційну суміш перемішували при 40°С на протязі ЗО хвилин, перш ніж охолодити гетерогенну суміш ЗО хвилин, перш ніж охолодити гетерогенну суміш до 0°С Забарвлені в сірий колір солі відфільтрудо 0°С Забарвлені в сірий колір солі відфільтрували при 0°С та промили толуолом Фільтрат упавали при 0°С та промили толуолом Цей фільтрат рили в вакуумі та очистили залишок флеш(розчин [3aR-[3aa,4a,6a(R*),6aa]]-6-[[3-aMiHO-4-[[1хроматографією при елююванні сумішшю 90 10 (3-хлор-2-тієніл)метил]пропіл]аміно]-25 етилацетат гептан триетиламш, одержавши піридиніл]аміно]-г\І-етилтетрапдро-2,2-диметил-4Нсполуку VIII МС (М+Н)* 508 (100%), ЯМР 1Н (50( циклопента-1,3-дюксол-4-карбоксаміду (сполука МГц, ДМСО) 5 0,9 (ЗН, т), 1,0 (ЗН, т), 1,7-1,4 (ЗН, VIII) в толуолі) безпосередньо використовували в м), 2,35 (1Н, м), 2,95 (2Н, м), 3,1 (2Н, м), 5,75 (1Н, наступній реакції д), 6,0 (1Н, д), 7,0 (1Н, д), 7,25 (1Н, д), 8,15 (1Н, м) Приклад 10 Каскадне одержання [1S-[1a,2b,3b,4a(S*)]]-4[[3-амшо-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-г\І-етил-2,3дипдроксициклопентанкарбокс-аміду (сполука IX) В літрову тригорлу круглодонну колбу, оснащену механічною мішалкою, термопарою, впуском азоту та холодильником, послідовно завантажили 23,3г (Р)-3-хлор-а-етил-2-тюфенетанамшу (сполука III) пдрохлориду, 18,0г 4-хлор-З-нітропіридин2(1 Н)-ону (сполука II), 35г 2-пропанолу (ІП) та 33,3г N,N-flii3onpomn- етиламшу (ДІПЕА) Суміш перемішували при нагріванні завантаження при 70 ± 2°С на протязі від 5 до 7 годин Реакційну суміш залишили охолоджуватися на протязі ночі до кімнатної температури (20 ± 3°С) Зранку в реакційну колбу додали 240г толуолу та вилучили ІП^олуол в вигляді азеотропу шляхом перегонки при 80 90°С при пониженому тиску Залишковий ІП контролювали методом газової хроматографії Коли вміст ІП складав менше 0,1%, одержану двофазну суміш рідина/рідина, яка містить (R)-N[1-[(3-хлор-2-тієніл )метил]пропіл]-2-пдрокси-3нітро-4-піридинамш (сполука IV), охолодили до 60°С та на протязі 10 хвилин при перемішуванні додали 20,6г оксихлориду фосфору Реакційну суміш перемішували при 60°С до закінчення реакції (2 - 3 години), перш ніж охолодити та додати 245г 2N водного розчину гідроксиду натрію з такою швидкістю, щоб температура реакції підтримувалась нижче 10°С Двофазну суміш перемішували 1 - 2 години при 0°С, потім и залишили охолоджува До розчину сполуки VIII в толуолі додали 100г ІП та перемішували цю суміш при нагріванні при 50 ± 3°С На протязі декількох хвилин повільно додавали 31г концентрованої хлористоводневої кислоти Коли сполуку VIII було повністю витрачено, температуру реакції знизили до 22 ± 3°С та перемішували на протязі ночі Зранку суспензію охолодили до 0°С та додали 45г етилацетату Після перемішування при цій температурі на протязі 1 години осади відфільтрували та послідовно промили холодним (0°С) ІПта етилацетатом кімнатної температури Брудно-білий залишок з фільтра висушили при 40±3°С в вакуумі на протязі 10 годин, одержавши при цьому [1S-[1a,2b,3b,4a(S*)]]-4[[3-амшо-4-[[1-(3-хлор-2-тієніл)метил]пропіл]аміно]-2-піридиніл]амшо]-г\І-етил-2,3дипдроксициклопентанкарбоксамід в виді моногідрату дипдрохлориду Температура плавлення 135°С Приклад 11 Одержання 4-хлор-3-нітропіридин-2(1Н)-ону (сполука II) В колбу на 150мл помістили 2,4-дипдрокси-Знітропіридин (сполука XII) (10,0г, 0,064моля) та толуол (ЗОмл) Суміш перемішували з помірною швидкістю та нагріли до 47°С На протязі 10 хвилин через шприцевий насос додали оксихлорид фосфору (РОСІз) (4,4г, 0,0289моля), що призвело до розігрівання до 49°С г\І,г\І-діізопропілетиламін (ДІПЕА) (2,22г, 0,017моля) додали за 10 хвилин, що призвело до нагрівання до 51 °С На протязі 10 хвилин додали наступну порцію оксихлориду фо 16 15 54479 сфору (4,4г, 0,0289моля), після чого на протязі 10 сполуки IX в вигляді брудно-білого осаду хвилин додали наступну порцію ДІПЕА (2,22г, Приклад 14 0,017моля) На протязі 10 хвилин додали третю Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[[3-aMiHO-4порцію РОСІз(4,4г, 0,0289моля), після чого на про[[1-(3-хлор-2-тієніл)метил]пропіл]-амшо]-2 піридитязі 10 хвилин додали третю порцію ДІПЕА (2,22г, ніл]аміно]-І\І-етил-2,30,017моля), потім за 10 хвилин останню порцію дипдроксициклопентанкарбоксаміду (сполука IX) РОСІз (4,4г, 0,0289моля) (загальна КІЛЬКІСТЬ додаВ колбу Паара на 500мл завантажили 1,8г 5%ного РОСІз склала 17,7г), після чого на протязі 10 ноі Pt на вугіллі (Aldnch, волога, Degussi, F101 хвилин додали останню порцію ДІПЕА (2,22г, RA/W) та розчин сполуки VII в толуолі (8,9г, 0,017моля) (загальна КІЛЬКІСТЬ доданого ДІПЕА 16,6ммоля в 50г толуолу) Суміш струшували при 2 склала 8,9г) Після цього реакційну суміш перемітиску водню 52фунти/дюйм (3,6551 кг/м) на протяшували при 50°С на протязі 5 годин доти, поки за зі 15 годин при кімнатній температурі Чорну суданими ІРС сполука XII не була витрачена повнісспензію відфільтрували через целіт, одержавши тю Реакційну суміш залишили охолоджуватися до розчин сполуки VIII До цього розчину при 20°С 20°С на протязі ЗО хвилин та додали 50мл води за послідовно додали 2-пропанол (20г), толуол (57г) 1,6 години, дозволивши температурі підвищитись та концентровану хлористоводневу кислоту (7,4г) до 47°С Цю суміш перемішували чотири години, в та нагріли розчин до 45°С при механічному перецей же час вона охолоджувалась до 25°С Вміст мішуванні Через 2 години при цій же температурі відфільтрували, ДВІЧІ промивши його 15мл води, жовтувато-коричневий осад відфільтрували та потім ДВІЧІ 15мл толуолу Продукт висушили, одепромили 20мл 2-пропанолу Залишок на фільтрі ржавши сполуку II сушили на протязі 6 годин при 45°С, одержавши сполуку IX в виді моногідрату дипдрохлориду Приклад 12 Одержання 2,4-дипдрокси-З-нітропіридину (сполука XII) В колбі на 500мл, оснащеній механічною мішалкою та зворотним холоди шпиком, в атмосфері аргону змішували 86%-ну фосфорну кислоту (90мл, 151,3г) та 3-ціано-4-метокси-2(1Н)піридинон (сполука X) (30,0г, 0,20моля) Суміш нагрівали на масляній бані при 175 - 180°С на протязі 23 годин Реакційну суміш охолодили до 71 °С та додали льодяну оцтову кислоту (90мл, 94,5г) та нагрівали суміш при 90°С приблизно на протязі 90 хвилин Обережно, на протязі 15 хвилин додала димлячу азотну кислоту (густина = 1,52) (12,6г, 8,3мл) (відбулося слабке розігрівання) та нагрівали суміш до 90 - 95°С на протязі 2 годин Після цього до суміші додали воду (90мл) та продовжили нагрівання при 90°С на протязі 1 години Потім при перемішуванні суміш повільно охолодили до кімнатної температури, відфільтрували через скляний фільтр та промили осад водою, одержавши сполуку XII, т п 268°С, ЯМР 1Н (ДМСО) 5 7,44 (ЗН, д), 6,0(11-1, д), 3,5(21-1) Приклад 13 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[[3-aMiHO-4[[1-{3-хлор-2-тієніл)метил]пропіл]-амшо]-2піридиніл]амшо]-г\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука IX) В тригорлу круглодонну колбу, заповнену аргоном, при механічному перемішуванні послідовно завантажили 5%-ну Pt/C (Degussa type F101 RAM/, 21,6г, 2,71 ммоля), форміат амонію (34г, 543ммоля), розчин сполуки VII в етилацетаті (110мл, ще містять 29г сполуки VII, 54,3ммоля) та метанол (66г) Чорну суспензію нагрівали при 60°С на протязі 6 годин, охолодили до кімнатної температури та відфільтрували через целіт для вилучення нерозчинних частинок Залишок на фільтр промили 2 х 50мл етилацетату До об'єднаних фільтратів на протязі декількох хвилин при перемішуванні додали концентровану хлористоводневу кислоту (40мл та перемішували суміш на протязі З годин при кімнатній температурі За фільтруванням йшло сушіння при 50°С в вакуумній печі, в результаті одержали моногідрат дипдрохлориду Приклад 15 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполук а 1) В тригорлу круглодонну колбу, оснащену холодильником та магнітною мішалкою, послідовно додали сполуку IX в виді моногідрату дипдрохлориду (2,2г, 3,9ммоля) та деюнізовану воду (12г) Цю суспензію нагрівали до 65°С та додали водний розчин карбонату натрію (1,7г ІЧагСОз в 5г деюнізованої води, нагрітої до 65°С) Органічна фаза відділилась в вигляді світлого жовтуватокоричневого масла Після ЦЬОГО ДО двофазної суміші додали триетилортоформіат (6,8мл, 41ммоль) та ВІДДІЛИЛИ нижній водний шар Після додання концентрованої НСІ (90мкл) розчин нагрівам на протязі 5 годин при 80°С Розчин охолодили до 70°С, додали н-бутилацетат (Юмл) та промили органічний шар насиченим розчином карбонату натрію, потім водою та насиченим розчином солі Органічний шар охолодили до кімнатної температури та перемішували 16 годин Після фільтрування висушили при 50°С в вакуумній печі, одержавши сполуку І Приклад 16 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука 1) В тригорлу круглодонну колбу, оснащену холодильником та магнітною мішалкою, послідовно додали сполуку IX в виді моногідрату дипдрохлориду (2,0г, З.бммоля) та деюнізовану воду (12г) Цю суспензію нагріли до 65°С та додали водний розчин карбонату натрію (1,6г ІЧагСОз в 5г деюнізованої води, нагрітої до 65°С) Після ці ото до двофазної суміші додали триетилортоформіат (9,0мл, 54,3ммоля) та ВІДДІЛИЛИ НИЖНІЙ ВОДНИЙ шар Органічний шар промили деюнізованою водою (5мл) та знову ВІДДІЛИЛИ НИЖНІЙ шар Після додання (1Р)-(-)-10-камфорсульфокислоти (42мг, 0,18ммоля) розчин нагрівали на протязі 2 годин при 80°С та на протязі 15 годин при 25°С Реакцій 17 54479 ну суміш знову нагріли до 70°С, додали нбутилацетат (Юмл) та промила органічний шар насиченим розчином карбонату натрію, потім водою та насиченім розчином солі Органічний шар охолодили до кімнатної температури та перемішували 16 годин Після фільтрування висушили при 50°С в вакуумній печі, одержавши сполуку І Приклад 17 Одержання [1 S-[1 a,2b,3b,4a(S*)]]-4-[7-[[1 -(3хлор-2-тієніл)метил]пропіл]амшо]-ЗН-імідазо[4,5Ь]піридин-3-іл]-І\І-етил-2,3дипдроксициклопентанкарбоксаміду (сполука 1) В тригорлу круглодонну колбу на 250мл, оснащену механічною мішалкою, термопарою, впуском азоту та холодильником, при 22°С послідовно завантажили 8,4г сполуки IX в виді моногідрату дипдрохлориду, 54,3г н-бутилацетату та 4,5г ацетату формамідину Суспензію перемішували при нагріванні при 90°С на протязі від 2 до 4 годин 18 Після закінчення реакції (зникнення сполуки IX) реакційну суміш охолодили до 60°С та промили розбавленим розчином теплого гідрокарбонату натрію, а потім 45г теплої води Після відділення водних шарів органічний розчин обробили 400мг активованого вугілля та 0,5г води і нагрівали при перемішуванні при 70°С Ні протязі 45 хвилин Гарячу суспензію відфільтрували та охолодили фільтрат до кімнатної температури та перемішували ще 2 години при 22°С Одержаний осад виділили фільтруванням, промили бутилацетатом та висушили в вакуумній печі при 50°С Фахівець в цій галузі легко оцінить всі явні та приховані переваги цього винаходу, що спрямовані на досягнення поставленої мети та одержання технічного результату Описані при цьому сполуки та способи ілюструють переважні варіанти винаходу та ніяк не обмежують його об'єм Підписано до друку 03 04 2003 р Тираж 39 прим ТОВ "Міжнародний науковий комітет" вул Артема, 77, м Київ, 04050, Україна (044)236-47-24
ДивитисяДодаткова інформація
Назва патенту англійськоюA method for the preparation of [1s-[1a,2b,3b,4a(s)]]-4-[7-[[1-(3-chloro-2-thienyl)methyl]propyl]amino]-3h-imidazo(4,5-b]pyridin-3-yl]-n-ethyl-2, 3-dihydroxycyclopentanecarboxamide, methods for the preparation of intermediates thereto, and intermediates themselves
Назва патенту російськоюСпособ получения [1s-[1a,2b,3b,4a(s)]] -4-[7-[[1-(3-хлор-2-тиенил) метил] пропил]амино]-3н-имидазо [4,5-b]пиридин-3-ил]-n-этил -2,3-дигидроксициклопентанкарбоксамида, способы получения промежуточных соединений для его получения и промежуточные соединения
МПК / Мітки
МПК: A61P 3/06, C07D 471/04, C07D 213/69, C07D 409/14, A61P 9/12, A61P 9/00, C07D 409/12
Мітки: 1s)-[1a,2b,3b,4a(s)]]-4-[7-[[1-(3-хлор-2-тієніл)метил, способи, одержання, проміжних, сполук, спосіб, проміжні, сполуки, пропіл]аміно]-3н-імідазо[4,5-b]піридин-3-іл]-n-етил-2,3-дигідроксициклопентанкарбоксаміду
Код посилання
<a href="https://ua.patents.su/9-54479-sposib-oderzhannya-1s-1a2b3b4as-4-7-1-3-khlor-2-tiehnilmetil-propilamino-3n-imidazo45-bpiridin-3-il-n-etil-23-digidroksiciklopentankarboksamidu-sposobi-oderzhannya-promizhnikh-spol.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання [(1s)-[1a,2b,3b,4a(s)]]-4-[7-[[1-(3-хлор-2-тієніл)метил] пропіл]аміно]-3н-імідазо[4,5-b]піридин-3-іл]-n-етил-2,3-дигідроксициклопентанкарбоксаміду, способи одержання проміжних сполук для його одержання та проміжні сполуки</a>
Наступний патент: Спосіб отримання добрив з відходів спиртового виробництва
Випадковий патент: Спосіб одержання 3-заміщених 2-оксоіндолів