Сполуки бензопіранів, фармацевтична композиція на їх основі та спосіб лікування і/або профілактики захворювань
Номер патенту: 62909
Опубліковано: 15.01.2004
Автори: Чан Ваі Нгор, Томпсон Мервін, Морган Хелен Кейт Анн, Еванс Джон Морріс
Формула / Реферат
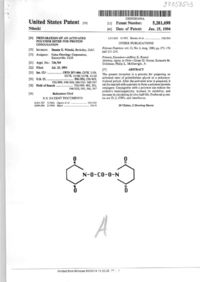
l. Соединения бензопиранов, формулы:
,
где один из R1 и R2 является H и другой представляет собой ацетил, R3, R4, R5 и R6 независимо выбраны из H и СН3; и R7 выбран из 2,3-дихлорфенила, 2,3-дихлор-4-фторфенила, 3,5-дихлорфенила, 3,5-дифторфенила, 2-тиофенила, 3-тиофенила, 2,5-дихлор-3-тиофенила, 2,3,5-трихлорфенила, 2,3,4-трифторфенила, фенила, 3-йодфенила, 5-фтор-2-метилфенила, 5-хлор-2-метоксифенила, 2,3-диметилфенила, З-хлор-4-фторфенила, 2-фтор-5-пиридила, 2-феноксифенила, 4-фторфенила, и 2-хлор-5-фтор-2-тиофенила, причем группа HN-CO-R7 представляет собой cis или trans к ОН группе и
выбранное из группы, состоящей из:
цис-6-ацетил-4S-(2,3-дихлорбензоиламино)-3,4-дигидро-2Н-1-бензопиран-3S-ол,
транс-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(3,5-дихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(3,5-дифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4-(2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол,
транс-6-ацетил-4S-(3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-диметил-2Н-1-бензопиран-3R-ол,
цис-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол,
транс-6-ацетил-4S-(2,3,5-трихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-бензоиламино-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(3-йодбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(5-фтор-2-метилбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4S-(5-хлор-2-метоксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4-(2,3-диметилбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол,
цис-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол,
цис-6-ацетил-4S-(3-хлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол,
транс-6-ацетил-4S-(2-фтор-5-пиридинкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
транс-6-ацетил-4-(2-фенооксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол,
транс-7-ацетил-4-(4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол,
транс-6-ацетил-4S-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол,
цис-6-ацетил-4S-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол и
цис-6-ацетил-4S-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол, или
их фармацевтически приемлемые соли.
2. Фармацевтическая композиция для использования в качестве лекарственного средства при лечении и/или профилактике беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от употребления вредных веществ, таких как кокаин, никотин, спирт и бензодиазепины, расстройств, поддающихся лечению и/или профилактике противосудорожными средствами, таких как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера, шизофрения и/или агрессивное состояние, отличающаяся тем, что включает соединение по п.1 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
3. Способ лечения и/или профилактики беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от употребления вредных веществ, таких как кокаин, никотин, спирт и бензодиазепины, расстройств, поддающихся лечению и/или профилактике противосудорожными средствами, таких как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера, шизофрения и/или агрессивное состояние, отличающийся тем, что страдающему от этих заболеваний пациенту вводят в качестве терапевтического агента эффективное или профилактическое количество соединения по п. 1 или его фармацевтически приемлемой соли.
Текст
Данное изобретение относится к новым соединениям, к способам их получения и к использованию их в качестве терапевтических агентов. В опубликованной заявке на Европейский Патент No. 0126311 раскрываются замещенные бензопирановые соединения, обладающие способностью снижать кровяное давление, и включающие в том числе, 6-ацетил-транс-4-4-(4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол. В документах ЕР-А-О 376 524, ЕР-А-О 205 292, ЕР-А-О 250 077, ЕР-А-О 093 535, ЕР-А-О 150 202, ЕР-АО 076 075 и W0/89/05808 (Бичам Груп плс) также описаны некоторые бензопирановые производные, которые обладают антигипертензивной активностью. Некоторые бензопирановые производные, которые, как полагают, обладают антигипертензивной активностью описываются также в ЕР-А-О 350 805 (Бирсдорф), ЕР-А-О 277 611, ЕР-А-О 277 612, ЕР-А-О 337 179 и ЕР-А-О 355 565 (Хёхст Актиенгезелльшафт); ЕР-А-О 466 131 (Ниссан Кемикал Индастриз Лтд), ЕР-А-0339562 (Ёситоми Фар-масьютикалз), ЕР-А-415 065 (Е.Мерк), ЕР-А-450415 (Сквибб), ЕР-А-0482934, ЕР-А-0296975, J0-2004-791 и W0\897103. В ЕР-А-О 430 621 и ЕР-А-О 385 584 (Бичам Груп плс) описано разделение некоторых промежуточных соединений, полезных для получения соединений, описанных в вышеупомянутых патентных заявках. В ЕР-А-О 139 992 (Бичам Груп плс) описаны некоторые бензопирановые производные с цис-изомерией в положениях 3 и 4, которые обладают антигипертензивной активностью. В PCT/GB92/O1045 (СмитКлайн Бичам плс) описаны некоторые фторбензоиламинобензопираны, пиранопиридины и тетрагидронафталины, у которых заместители в 3 и 4-положениях находятся в трансконфигурации друг к другу. Для этих соединений показано наличие также анксиолитической и противосудорожной активности. В PCT/GB93/02512 и PCT/GB93/02513 описаны дополнительные группы соединений, обладающих также противосудорожной активностью. Указанные патентные заявки не были опубликованы на дату приоритета настоящей заявки. Неожиданно было обнаружено, что некоторые из приведенных ниже соединений обладают противосудорожной активностью и, следовательно, полезны при лечении эпилепсии и, как считают также, полезны для лечения и профилактики беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от приема ряда вредных веществ, болезни Паркинсона, психоза, мигрени, сопровождающейся аурой или без нее, церебральной ишемии, ОСД, т.е. демономаниакальных навязчивых расстройств и/или панических и/или агрессивных состояний. Соответственно, настоящее изобретение предоставляет следующие соединения: цис-6-ацетил-4S-(2,3-дихлорбензоиламино)-3,4-дигидро-2Н-1-бензопиран-3S-ол, транс-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(3,5-дихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(3,5-дифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4-(2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол, транс-6-ацетил-4S-(3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-диметил-2Н-1-бензопиран-3R-ол, цис-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3Sол, транс-6-ацетил-4S-(2,3,5-трихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-бензоиламино-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(3-йодбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(5-фтор-2-метилбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4S-(5-хлор-2-метоксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол, транс-6-ацетил-4-(2,3-диметилбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол, цис-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол, цис-6-ацетил-4S-(3-хлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол, транс-6-ацетил-4S-(2-фтор-5-пиридинкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3Rол, транс-6-ацетил-4-(2-фенооксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол, транс-7-ацетил-4-(4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол, транс-6-ацетил-4S-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1бензопиран-3R-ол, цис-6-ацетил-4S-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран3S-ол, и цис-6-ацетил-4S-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол или их фармацевтически приемлемые соли. Такие соединения будут дальше называться соединениями формулы (I). Следует понимать, что соединения формулы (I) могут иметь хиральные атомы углерода в положениях 3 и 4 и поэтому могут существовать в виде энантиомеров. Настоящее изобретение охватывает каждый такой энантиомер и их смеси, включая рацематы. Следует также учитывать, что для разных случаев использования предпочтительны частные или отдельные энантиомерные формы, так, в ситуациях, отличных от субархноидального кровотечения или неврального шока, предпочтительно использовать 3R, 4S и 3S, 4S энантиомеры, а при субархноидальном кровотечении или невральном шоке предпочтительны 3S, 4S и 3R, 4R энантиомеры. Следует также учитывать, что соединение формулы (I) или его фармацевтически приемлемая соль также включают сольваты таких соединений, например, гидрат. Настоящее изобретение относится также к соединению формулы (I) или его фармацевтически приемлемой соли в рамках данного выше определения, которые имеют преимущественно 3S, 4S или 3R, 4S энантиомерную форму, в зависимости от того, находятся ли соединения в цис- или транс конфигурации. Например, термин "имеет преимущественно 3S, 4S энантиомерную форму" означает, что энантиомер 3S, 4S составляет более, чем 50% в сравнении с энантиомером 3R, 4R. Более предпочтительно, чтобы указанный энантиомер 3S, 4S присутствовал в количестве, большем, чем 60%, еще более предпочтительно присутствие энантиомера 3S, 4S в количестве более 70%, еще более предпочтительно присутствие энантиомера 3S, 4S в количестве более 80%, и еще гораздо более предпочтительно содержание 3S, 4S энантиомера в количестве более 90%. Наиболее предпочтительно, чтобы присутствовало более, чем 95% 3S, 4S энантиомера относительно 3R, 4R энантиомера. То же самое применимо и в случае 3R, 4S энантиомерной формы. Такие соединения и их фармацевтически приемлемые соли являются новыми и составляют основной аспект настоящего изобретения. Назначение млекопитающим для приема может производиться перорально, парентерально, под язык или трансдермально. Количество, эффективное для лечения описанных выше расстройств, зависит от обычных факторов, таких как характер и тяжесть заболевания, которое предстоит лечить, и от веса млекопитающего. Однако, единичная доза обычно содержит от 1 до 1000мг, подходящим образом, от 1 до 500мг, например, в диапазоне от 2 до 400мг, в частности, 2, 5, 10, 20, 30, 40, 50, 100, 200, 300 и 400мг активного соединения. Единичные дозы обычно назначаются для приема один или более раз в день, например, 1, 2, 3, 4, 5 или 6 раз в день, чаще от 1 до 4 раз в день, так, общая ежедневная доза для взрослого человека весом в 70кг составляет обычно в диапазоне от 1 до 1000мг, например, от 1 до 500мг, то есть примерно от 0,01 до 15мг/кг/день, а чаще от 0,1 до 6мг/кг/день, например, 1-6мг/кг/день. Весьма предпочтительно, чтобы соединение формулы (I) назначалось в виде единичной дозы композиции, такой как единичная пероральная доза, включая подъязычную форму, ректальную, местную или тоническую или парентеральную (в особенности внутривенную) композицию. Такие композиции готовят смешиванием, и подходящим образом приспосабливаются для перорального или парентерального назначения, они могут представлять собой таблетки, капсулы, пероральные жидкие препараты, порошки, гранулы, лепешки, реконституируемые порошки, инъекцируемые и инфузируемые растворы или суспензии или суппозитории. Предпочтительны пероральные композиции, в частности, композиции, имеющие определенный вид, поскольку они более удобны для общего использования. Таблетки и капсулы для перорального введения обычно представлены в виде единичной дозы и содержат традиционные эксципиенты, такие, как связующие вещества, наполнители, разбавители, вещества, используемые для изготовления таблеток, смазки, дезинтеграторы, красители, вкусовые вещества и смачивающие агенты. Таблетки могут также иметь покрытие, наносимое хорошо известными способами. Подходящие для использования наполнители включают целлюлозу, маннит, лактозу и другие сходные агенты. К подходящим дезинтеграторам относятся крахмал, поливинилпирролидон и производные крахмала, такие, как натрий-крахмал-гликоллят. Подходящие смазки включают, например, стеарат магния. Подходящие фармацевтически приемлемые смачивающие агенты или увлажнители включают лаурилсульфат натрия. Указанные твердые пероральные композиции могут быть приготовлены с помощью традиционных методов смешивания, наполнения, формования в виде таблеток и т.д. Повторные процедуры смешивания могут использоваться для улучшения распределения активного агента по всей композиции в том случае, когда она включает большие количества наполнителей. Такие операции хорошо известны в практике. Пероральные жидкие композиции могут иметь вид, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут представлять собой сухой продукт, готовый для разведения перед использованием водой или подходящим носителем. Такие жидкие композиции могут содержать традиционные добавки, такие как суспендирующие агенты, например, сорбит, сироп, метилцеллюлозу, желатин, гидроксиэтилцеллюлозу, гель стеарата алюминия или гидрированные пищевые жиры, эмульгирующие агенты, например, лецитин, моноолеат сорбитана или камедь акации; неводные носители (которые могут включать пищевые жиры), например, миндальное масло, фракционированное кокосовое масло, масляные сложные эфиры, такие, как эфиры глицерина, пропиленгликоля или этилового спирта; консерванты, например, метил или пропил п-гидроксибензоат или сорбиновую кислоту и, при желании, традиционные вкусовые вещества или красящие агенты. Пероральные препаративные формы композиций включают также традиционные пролонгированные формы, такие, как таблетки или гранулы, имеющие энтерическое покрытие. Для целей парентерального введения готовят жидкие единичные дозированные формы, содержащие описываемое соединение и стерильный носитель. Соединение может быть либо суспендировано, либо растворено, в зависимости от природы носителя и его концентрации. Парентеральные растворы обычно готовят с помощью растворения соединения в носителе и фильтр-стерилизации перед внесением в подходящую ампулу или сосуд и запечатыванием. Удобно, чтобы адьюванты, такие как локальные анестезирующие вещества, консерванты и забуферивающие агенты, также растворялись в носителе. Для повышения стабильности композиция может замораживаться после ее внесения в сосуд, а вода удаляется под вакуумом. Парентеральные суспензии, по существу, готовят таким же образом, за исключением того, что соединение суспендируется в носителе вместо растворения, и перед суспендированием в стерильном носителе стерилизуется подвержением действию этиленоксида. Благоприятным является включение в композицию поверхностно-активного вещества или увлажнителя для облегчения равномерного распределения соединения настоящего изобретения. Как это принято на практике, композиции сопровождаются обычно письменными или отпечатанными указаниями по использованию при соответствующем медицинском лечении. Настоящее изобретение далее представляет фармацевтическую композицию для использования для лечения и/или предупреждения беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от злоупотребления вредных веществ, таких как кокаин, никотин, спирт и бензодиазепины, расстройств, которые могут подвергаться лечению и/или профилактике противосудорожными средствами; таких, как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера, шизофрения и/или агрессивное состояние, которая включает соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Настоящее изобретение также предоставляет способ лечения и/или предупреждения беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от злоупотребления вредных веществ, таких как кокаин, никотин, спирт и бензодиазепины, расстройств, которые могут подвергаться лечению и/или профилактике противосудорожными средствами, таких, как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Альцгеймера, шизофрения и/или агрессивное состояние, который включает введение страдающему от этих заболеваний пациенту эффективного или профилактического количества соединения формулы (I) или его фармацевтически приемлемой соли. Согласно дополнительному аспекту, настоящее изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой соли для производства лекарств для лечения и/или предупреждения беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением или невральным шоком, состояний, связанных с отказом от употребления вредных веществ, таких как кокаин, никотин, спирт и бензодиазепины, расстройств, которые могут подвергаться лечению и/или профилактике противосудорожными средствами, таких как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь. Альцгеймера, шизофрения и/или агрессивное состояние. Согласно еще одному аспекту настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Согласно следующему аспекту настоящее изобретение относится к использованию соединения формулы (I) или его фармацевтически приемлемой соли в качестве терапевтического агента, в частности, для лечения и/или профилактики беспокойства, маниакального синдрома, депрессии, расстройств, связанных с субарахноидальным кровотечением, невральным шоком, состояний, связанных с отказом от употребления вредных веществ таких, как кокаин, никотин, спирт и бензодиазепины; расстройств, которые могут подвергаться лечению или профилактике противосудорожными средствами, таких, как эпилепсия, болезнь Паркинсона, психоз, мигрень, церебральная ишемия, болезнь Алыдгеймера, шизофрения и/или агрессивное состояние. Такие композиции могут быть получены способом, описанным ранее. Обычно цис-соединения формулы (I) могут быть получены из соответствующих транс-соединений, процедуры получения которых описаны- в ЕР-0126311, ЕР-0376542, ЕР-205292, ЕР-0250077, ЕР-0093535, ЕР-0150202, ЕР-0076075, W0/89/05808, ЕР-0350805, ЕР-0277611, ЕР-0277612, ЕР-0337179, ЕР-0339562, ЕР-0355565, ЕР-А-415 065 (Е. Merck), ЕР-А-450 415 (Сквибб) ЕР-0466131, ЕР-А-0482934, ЕР-А-0296975, J02004-791 и W0\897103. Цис-соединения формулы (I) могут быть получены с помощью процедур, описанных или аналогичных описанным в ЕР-А-0139992. Цис-соединения формулы (I) могут быть получены с помощью процедур, описанных Буррелли с соавт. (G. Burrelli et al, Tet. Letters, 31, 3649-3652, 1990) или с помощью процедур, описанных Квастом и Вилхауэром (U. Quast and E. Villhauer, Eur. J. Pharmacol, Molecular Pharmacology Section 245, 165-171, 1993). Должно быть понятно, что рацематы соединения формулы (I) могут быть разделены или энантиомерно очищенные соединения формулы (I) могут быть получены с использованием общепринятых в технике процедур, и особенно с использованием процедур, описанных в ЕР-0430631 и ЕР-0355584. Следует также отметить, что предпочтительно, чтобы соединения формулы (I) можно было получить в требуемой энантиомерной форме посредством образования хирально чистого зпоксида с использованием катализаторов и условий, описанных в основном в WO91\14694 или WO93\17026 с последующим превращением эпоксидов в нужное соединение формулы (I) с использованием описанных здесь процедур. Транс-соединения формулы (I) могут быть получены с помощью процедур, описанных в PCT/GB92/01045, которые включены в заявку для сведения, или транс-соединения формулы (I) могут быть получены с помощью методов, аналогичных описанным в одном из упомянутых патентов. С применением методов, аналогичных описанным в вышеупомянутых патентных публикациях и литературных источниках, были получены следующие ниже соединения. Приведенные ниже описания, примеры и результаты фармакологических испытаний иллюстрируют настоящее изобретение: Описание 1 2,3-дихлор-4-фтор-бензойная кислота 2,3-дихлорфторбензол (5г), трихлорид алюминия (6,91г) и ацетилхлорид (3,85мл) нагревают при температуре 130°С в течение 20 часов в атмосфере аргона. Черный остаток вливают в смесь концентрированная НСІ-лед и добавляют эфир. Разделяют полученные слои и органическую фазу промывают насыщенным раствором бикарбоната натрия и солевым раствором и сушат над безводным сульфатом магния. Фильтрование и выпаривание дают черный остаток, который обрабатывают н-гексаном. Раствор н-гексана фильтруют, и растворитель выпаривают с получением 2,3-дихлор-4-фторацетофенона (1,04г). Указанный неочищенный материал (0,69г), 5% раствор гипохлорита натрия (23мл) и диоксан (20мл) нагревают при температуре кипячения с обратным холодильником в течение 16 часов. Раствор охлаждают и выпаривают, и добавляют воду (20мл) вместе с конц. НСl до рН1, и твердое вещество, которое охлаждается, отфильтровывают и перекристаллизуют из смеси ацетон-вода с получением 2,3-дихлор-4фторбензойной кислоты (0,36г). Описание 2 цис 8-ацетил-2-(3-хлор-4-фторфенил)-3a,9b-дигидро-4,4-ди-метил-4Н-бензо[b]пирано[4,3-d]оксазол Раствор транс-6-ацетил-4S(3-хлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-бензо[1b]пиран3R-ола (Пример 62 в W0 94, 13656) (3,37г; 8,6ммоля) в сухом дихлорметане (90мл) и DAST (1,40мл; 10,59ммоля) выдерживают при комнатной температуре в течение 2 дней. Выпаривание под вакуумом, с последующей хроматографией остатка на Кизельгеле 60 в смеси 25% этилат/н-гексан дает целевой оксазолин в виде бесцветной камеди (2,50г; 7 8%). 1 Н ЯМР (CDCІ 3) d: 1,35 (3Н, с), 1,59 (3Н, с), 2,60 (3Н, с), 4,80 (1Н, д.), 5,35 (1Н, д.), 6,90 (1Н, д.), 7,15 (1Н, т.), 7,82 (1Н, м.), 8,00 (1Н, дд.), 8,10 (1Н, д.) Пример 1 цис 6-ацетил-4S-(2,3-дихлорбензоиламино)-3,4-дигидро-2Н-1-бензопиран-3S-ол Транс-6-ацетил-4S-(2,3-дихлорбензоиламино)-3,4-дигидро-2Н-1-бензопиран-3R-ол (0,84г) растворяют в дихлорметане (50мл). Добавляют диэтиламиносульфуртрифторид (DAST) (0,325мл) и перемешивают раствор в течение ночи. Смесь выпаривают досуха и хроматографируют на Кизельгеле 60. Градиентное элюирование с использованием CH2Cl2-EtОAc дает бледно-желтую камедь (0,71г), которую выдерживают в диоксане (20мл) и воде (6мл), содержащей 5 норм. H2SO4 (3мл), в течение 2-х дней. Смесь подщелачивают твердым бикарбонатом натрия, перемешивают в течение 2-х часов и выпаривают досуха. Смесь распределяют между этилацетатом и водой, и органический слой промывают солевым раствором. Органический слой сушат над безводным сульфатом натрия, фильтруют и выпаривают с получением бледно-желтой камеди (0,639г). Объединяют продукты предыдущей реакции (0,3г) и хроматографируют на Кизельгеле 60. Элюирование смесью дихлорметан-1% метанол дает белое твердое вещество (0,47г), а перекристаллизация из этилацетата-гексана, а затем из ацетона-гексана дает целевое соединение с Т. пл. 104-107°С. [a]D=-7,50° (МеОН, с=1,0) Пример 2 транс-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Соединение данного примера получают с помощью сочетания 2,3-дихлор-4-фторбензойной кислоты (Описание 1) с D-(-)-манделатом транс-6-ацетил-4S-амино-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3Rола по методу, применяемому в примере 1. Целевое соединение получают с помощью перекристаллизации из ацетона-гексана в виде кристаллов с Т. пл. 205-206°С; [a]20D=+17,6° (MeOH, c=0,44) Пример 3 транс-6-ацетил-4S-(3,5-дихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 220°С; [a]20D=+22,2° (МеОН, с=1,18) Пример 4 транс-6-ацетил-4S-(3,5-дифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Τ. пл. 203°С; [a]20D=+28,9° (MeOH, с=1,0) Пример 5 транс-6-ацетил-4-(2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол Т. пл. 175,5-177°С; Пример 6 транс-6-ацетил--4S-(3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 211-213°С; Пример 7 транс-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-диметил-2Н-1-бензопиран-3R-ол Т. пл. 194°С; [a]20D=-1,0° (MeOH, с=1,03) Пример 8 транс-6-ацетил-4S-(2,5-дихлор-3-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран3R-ол Желтовато-коричневая пена. ЯМР (CDCІ 3) d: 1,40 (3Н), 1,54 (3Н), 2,06 (1Н, д.), 3,84 (1Н, дд.), 5,60 (1Н, дд.), 6,92 (1Н, д.), 7,22 (1Н, шд.), 7,30 (1Н), 7,85 (1Н, дд.), 7,96 (1Н). Пример 9 транс-6-ацетил-4S-(2,3,5-трихлорбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 219-223°С; Пример 10 транс-6-ацетил-4S-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 167°С; [a]20D+3,0° (MeOH, с=0,945) Пример 11 транс-6-ацетил-4S-бензоиламино-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 188-191°С; Пример 12 транс-6-ацетил-4S-(3-иодбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 171-173°С; [a]20D=+15,5° (MeOH, с=1,00) Пример 13 транс-6-ацетил-4S-(5-фтор-2-метилбензоиламино)-3,4-дигидро-2,2-диметил-2H-1-бензопиран-3R-ол Т. пл. 194-196°С; Пример 14 транс-6-ацетил-4S-(5-хлор-2-метоксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 191-194°С; Пример 15 транс-6-ацетил-4-(2,3-диметилбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол Т. пл. 188-189°С; Пример 16 цис-6-ацетил-4S-(2,3-дихлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол Т. пл. 130°С; Пример 17 цис-6-ацетил-4S-(3-хлор-4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3S-ол Раствор оксазолина (D2) (2,5г; 668ммоля) в 1,4-диоксане (45мл), воде (15мл) и 5 норм. серной кислоте (6мл) выдерживают при комнатной температуре в течение 1 дня. Добавляют избыток NaHCO3, и перемешивают полученную суспензию при комнатной температуре в течение 2 часов. Смесь концентрируют под вакуумом и затем распределяют между этилацетатом и водой. Органический слой промывают водой, солевым раствором и сушат (Na2SO4). Выпаривание под вакуумом дает бледно-желтую камедь, которую хроматографируют на Кизельгеле 60 в смеси 25% этилацетат/н-гексан. Объединение соответствующих фракций с последующей перекристаллизацией из смеси ацетон/н-гексан дает целевое соединение в виде белых кристаллов. (1,20г; 46%). Т. пл. 151-153°С; Найдено: С - 61,04; Н - 4,91; N - 3,86. Для C20H19CIFNO4 расчет: С - 61,31; Н - 4,89 и N - 3,57% ν max (КВr): 3360, 3310, 2950, 1680, 1640, 1260 и 840см-1 1 Н ЯМР (CDCl3) d: 1,40 (3H, с), 1,56 (3Н, с), 2,12 (1Н, д., ex D2O), 2,50 (3Н, с), 3,84 (1Н, дд.), 5,62 (1Н, дд.), 6,91 (1Н, д.), 6,95 (1Н, ш.д.), 7,23 (1Н, т.), 7,75 (1Н, м.), 7,83 (1Н, дд.), 7,92 (1Н, д.), 7,96 (1Н, дд.). m/z: 391 (М+, 1%), 373 (4), 358 (88), 203 (50), 157 (100). Пример 18 цис-6-ацетил-4-(2,3,4-трифторбензоиламино)-3,4-дигидро-2,2-диметил-2H-1-бензопиран-3-ол ЯМР (CDCl3) d: 1,41 (3Н, с), 1,55 (3Н, с), 2,50 (3Н, с), 3,85 (1Н, дд.), 5,67 (1Н, дд.), 6,92 (1Н, д.), 7,03-7,20 (1Н, м.), 7,78-7,90 (2Н, м.), 95 (1Н, с.). Пример 19 транс-7-ацетил-4-(4-фторбензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол Т. пл. 189-193°С; Пример 20 транс-6-ацетил-4S-(2-фтор-5-пиридинкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3R-ол Т. пл. 84°С; Пример 21 транс-6-ацетил-4-(2-феноксибензоиламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3-ол Т. пл. 208°С; Соединения следующих примеров были получены с помощью процедур, аналогичных вышеописанным. Пример 22 транс-6-ацетил-4-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран3-ол Пример 23 цис-6-ацетил-4-(2-хлор-5-фтор-2-тиофенкарбониламино)-3,4-дигидро-2,2-диметил-2Н-1-бензопиран-3ол РЕЗУЛЬТАТЫ ФАРМАКОЛОГИЧЕСКИХ ИСПЫТАНИЙ 1. Тест на социальное общение крыс Соединения формулы (I) или их фармацевтически приемлемые соли могут подвергаться испытанию с целью дальнейшего использования в качестве фармацевтических средств в соответствии с приведенной ниже процедурой: Потенциальные анксиолитические свойства оценивают с использованием процедуры, определяющей уровень социального общения крыс, которая основана на методике, первоначально описанной Файлом (File, 1980, J. Neurosci. Methods, 2, 219-238). В этой модели анксиолитические средства селективно повышают социальное общение, независимо от какого-либо влияния на двигательную активность. Методика Самцов крыс Спрэг-Доли (Sprague-Dawley) (Чарльз Ривер, Великобритания, 250-300г) перед исследованием помещают поодиночке в отдельные клетки на 3 дня. В день испытания животных распределяют случайным образом на группы по 8-16 животных, которым вводят перорально в количестве 1мл/кг различные дозы исследуемого соединения (I) (1-300мг/кг) или носитель. На 60-ю минуту после введения дозы крыс помещают в паре с самцом, подобранным в соответствии с ним по весу и группе лечения (это был первый контакт животных) в бокс, используемый для оценки социального общения под ярким светом в непривычных условиях. Бокс выполнен из белого плексигласа размером 54x37x26см с прозрачной передней стенкой также из плексигласа. Пол разделен на 24 ровных квадрата и ярко освещен (115люкс). Время, проведенное в активном социальном общении (секунды), (при обнюхивании, ухаживании, хождении друг за другом, вставании, карабкании вверх или вниз, борьбе, покусывании) оценивается удаленным мониторингом ("слепой метод") по числу пересеченных крысами квадратов (как индекс двигательной активности). Среднее значение и стандартная ошибка для времени, проведенного в социальном общении, и количество пересеченных квадратов вычисляется затем для каждой конкретной группы лечения, а изменения, индуцированные лекарственным средством, выражаются в виде процента увеличения или уменьшения относительно контрольных значений. Статистические сравнения между группами, принимавшими носитель и лекарственное средство, были выполнены с использованием процедуры множественного сравнения Dunnett с последующей оценкой значимости посредством анализа вариантов. Лекарственные средства суспендируют в 1% метилцеллюлозе. МЭП ТЕСТ Тест на определение порогового значения развития максимального электрошокового припадка (МЭП) у грызунов является особенно чувствительным для обнаружения противосудорожной активности1. В этой модели противосудорожные средства повышают порог индуцированных электрических припадков, тогда как проконвульсанты снижают порог припадка. Методика Мышей (самцы, Чарльз Ривер, Великобритания. CD-1 штамм, 25-30г) распределяют случайным образом по группам, включающим 10-20 животных, и вводят им внутрибрюшинно в количестве 10мл/кг различные дозы исследуемого соединения (0,3-300мг/кг) или носителя. Затем через 30 или 60 минут после введения дозы мышей подвергают действию разового электрошока (0,1сек., 50Гц, синусовая волна), подводимого через корнеальные электроды. Среднее значение тока (и величина стандартной ошибки), необходимого для индуцирования эпилептического припадка у 50% (СС50) мышей в конкретной группе лечения определяют с помощью метода "вверх-вниз" ("up and down") Диксона и Муда (Dixon and Mood) (1948)2. Статистическое сравнение между группами, принимающими носитель и лекарственное средство, выполняют с использованием метода Литчфилда и Вилкоксона (Litchfield and Wilcoxon) (1949)3. Для контрольных животных значения СС 50 обычно составляет 14-18mА. При этом первых животных в контрольной группе подвергают действию тока силой 16mА. Если при этом не возникает тонического припадка, значение тока повышают на следующей исследуемой мыши. Если возникает тоническая судорога, действие тока снижают и так далее, до тех пор, пока все животные в группе не будут тестированы. Вычисляют процент снижения или повышения значения СС 50 для каждой группы в сравнении с контролем. Исследования осуществляют с использованием генератора шока на постоянном токе Хуго Сакс Электроник (Hugo Sachs Electronic Constant Current Shock Generator) с устройством контроля уровня шока от 0 до 300mА, при этом обычно используют шаговое значение в 2mА. Лекарственное средство суспендируют в 1% метилцеллюлозе. ССЫЛКИ 1. Losher W. and Schmidt D. (1988), Epilepsy Res., 2, 145-181. 2. Dixon W.J. and Mood A.M. (1948), J. Amer. Stat. Assn., 43, 109-126. 3. Litchfield J.T. and Wilcoxon F. (1949), J. Pharmacol. Exp. Ther., 96, 99-113. РЕЗУЛЬТАТЫ Соединение примера 17 повышает порог шока на 105% при пероральной дозе в 10мг/кг. х- Лабиринт Соединения формулы (I) или их фармацевтически приемлемые соли могут быть исследованы с целью дальнейшего терапевтического использования с помощью процедуры, приведенной ниже: Введение Тест на страх, с использованием х-лабиринта (Handley and Mithany, 1984) позволяет определить "исследовательскую" реакцию крыс в окружении, в котором имеются как анксиогенные (открытые проходы) и относительно неанксиогенные (закрытые проходы) участки. Селективное повышение способности к обследованию открытых проходов после введения лекарственного средства позволяет сделать вывод о наличии аксиолитического действия. Методика х-лабиринт, поднятый на 70см над полом, состоит из двух закрытых проходов размером: 45см (длина) x 15см (ширина) x 10см (высота) и двух открытых проходов размером: 45х10x1см, расположенных таким образом, что оба прохода каждого типа расположены друг против друга. Проходы обоих типов размечены на две равные секции. Крыс помещают в центр x-лабиринта и наблюдают за ними в течение 10 минут, измеряя и регистрируя следующие параметры: 1) количество входов и время, проведенное на участке (а) с открытым проходом, и (б) с закрытым проходом, (в) в конце открытых проходов и (г) в конце закрытых проходов; 2) количество пересеченных секций. Боязнь открытых участков превышает боязнь закрытых участков, и крысы в типичном случае демонстрируют отчетливое предпочтение закрытым проходам. Анксиолитические средства увеличивают количество входов и время, проведенное на внешней половине открытых проходов, а также процент входа и время, проведенное на полностью открытом участке. Эти 4 параметра, оценивающие уровень страха, а также общее число пересеченных секций, подсчитывают для каждого животного. Лекарственные средства вводят внутрибрюшинно или перорально животным, распределенным по группам, включающим от 6 до 12 крыс, за 30-60 минут до испытания. Статистическое сравнение между группами, принимающими носитель и лекарственное средство проводят с использованием "U''-теста Ман-Уитни (Mann-Whitney, "U"-test) (двусторонний критерий). S.L. Handley and S. Mithani, Arch. Pharmacol., 1984 327 1-5. 4. Задержка церебрального вазоспазма у беспородных собак Соединения формулы (I) или их фармацевтические соли могут быть исследованы с целью их фармацевтического использования с помощью процедур, приведенных ниже: В указанных исследованиях использовали 25 самцов беспородных собак весом от 9 до 12кг. Животных помещают в клетки и ухаживают за ними в соответствии с руководством по уходу и использованию лабораторных животных [DHEW (DHHS), публикация No (N1H) 85-23, пересмотренная в 1985г.]. Все процедуры, применяемые на лабораторных животных, утверждены Комитетом по уходу за животными и их использованию, СмитКлайн Бичам Фармакьютикал (Institutional Animal Care Committee of SmithKline Beecham Pharmaceutical). Каждое животное подвергают анестезии пентобарбиталом (35мг/кг, в/в) и помещают на подогреваемый операционный стол на спину. А затем всех животных подвергают трахеотомии, парализуют (тубокурарин; 0,1мг/кг, в/в) и подвергают искусственной вентиляции комнатным воздухом. В конце свободного выдоха проводят постоянную оценку уровня СО2 (et CO2) и периодически проводят анализ артериальной крови на газовый состав для подтверждения стабильности и достаточности вентиляции в ходе каждого эксперимента. В левую наружную яремную вену и правую бедренную артерию и вену помещают полиэтиленовые канюли для ввода лекарств, контролируя при этом уровень артериального давления и отбирая образцы крови. Через левую бедренную артерию с использованием французского дакронового катетера Лемана №5 (5 frenchLehman dakron catheter) (Bard, Tewksbury MA) проводят трансбедренную катетеризацию левой позвоночной артерии. Перед началом эксперимента поддерживают по необходимости анестезию введением пентобарбитала (5мг/кг, в/в). Действие соединений настоящего изобретения на острый церебральный вазоспазм оценивали у 15 собак. Для всех животных получают после внутрипозвоночной инъекции радиоконтрастного материала [Омнипак 300 (Omnipaque 300)] контрольную цифровую ангиограмму передней спинномозговой артерии и основной артерии. У каждой собаки с помощью прокола затылочной мембраны отбирают 4мл цереброспинальной жидкости и инъецируют 4мл аутологичной венозной крови. Через каждые 30 минут повторяют ангиографию после внутриполостного введения крови и идентифицируют и количественно определяют острый вазоспазм в основной и передней спинномозговой артерии. Инфузия носителя (10% полиэтиленгликоль 200) в течение 30 минут не оказывает эффекта на острый вазоспазм. Действие 30минутной инфузии исследуемых соединений на обратимый острый вазоспазм был показан как на основной, так и на передней спинномозговой артериях. Влияние соединений настоящего изобретения было также показано на модели собак, у которых при длительном введении происходит задержка церебрального вазоспазма (две модели церебрального вазоспазма с кровоизлиянием). В этой модели получают контрольную позвоночную ангиограмму и вводят внутриполостно в 1-ый день (как описано выше) аутологичную кровь. На третий день повторяют внутриполостное введение крови, а на 7 день у всех животных оценивают количественно на ангиограмме тяжелый запоздалый вазоспазм. Инфузия носителя (10% полиэтиленгликоль) в течение 60 минут не оказывала воздействия на запоздалый вазоспазм, наблюдаемый на основной и передней спинномозговой артериях (n=5). Влияние инфузии исследуемых соединений на обратимость значительно задержанного церебрального вазоспазма указывает на активность соединения. Соединения формулы (I) или их фармацевтически приемлемые соли могут быть исследованы с целью фармацевтического использования с помощью процедур, приведенных ниже: 1) Активность против болезни Паркинсона Модель крыс с поражением, вызванным 6-гидроксидопамином Указанный тест (Ungerstedt, U, 1971, Acta Physiol. Scand 367, 49-68, и/или Ungerstedt, U, 1971, Acta Physiol. Scand 367, 69-93) может быть использован для определения наличия у соединений формулы (I) или их фармацевтически приемлемых солей активности против болезни Паркинсона. 2) Анти-психотическая активность Модель крыс с гипердвигательной активностью, вызванной амфетамином Вышеуказанный тест (Kokkindis L. And Anisman, M, 1980, Psyhological Bulletin, 88, 551-579) может быть использован для определения наличия у соединений формулы (I) или их фармацевтически приемлемых солей антипсихотической активности. 3) Активность против мигрени Кортикальная распространяющаяся депрессия и мигрень Вышеуказанный тест (Wahl et al, 1987, Brain Researh, 411, 72-80) может быть использован для определения наличия антимигреневой активности у соединений формулы (I) или их фармацевтически приемлемых солей. Подготовка животных Эксперименты проводят на самках или самцах кошек (2,5-3,0кг), которых выдерживали без пищи в течение ночи, но обеспечивали свободный доступ к воде. Анастезию индуцировали 4-5% галотаном и поддерживали далее за счет внутривенного введения альфа-клоралозы (90-110мг/кг). Значение ректальной температуры и кислотно-щелочной уровень поддерживают в физиологическом диапазоне. Правую бедренную артерию и вены катетеризируют для измерения давления крови, отбора образцов артериальной крови и введения лекарственного средства. Определяют частоту сердечных сокращений на основе сигналов кровяного давления и записывают. Проводят левостороннюю краниотомию теменной кости и дуректомию и покрывают мозг слоем подогретого до температуры 37°С минерального масла. Определяют изменения в диаметре сосудов с помощью прижизненной видеомикроскопии и записывают результаты на видеопленку. Индукция кортикальной распространяющейся депрессии (CSD) CSD индуцировалась введением малого количества (30мг, кристаллический) КСI в область надсильвиевой извилины, удаленной от записывающих электродов, наблюдаемых сосудов и других сосудов крови. Поскольку мозг покрыт слоем теплого минерального масла, КСI растворяется медленно в мозге в течение 5 минут после нанесения. После этого оставшийся КСI удаляют с поверхности мозга с помощью смоченного в солевом растворе тампона. Изменение внеклеточного потенциала и диаметры артерий и вен записывают в течение 120 минут. Лечение лекарственным препаратом Соединение примера 17 в виде суспензии (10мг/кг, в/бр) или носитель (1% лабразол в/бр) вводят за 90 минут до индукции CSD. В течение всего периода наблюдений у контрольных животных (n=4) отслеживали воспроизводимые явления CSD, индуцированные КСl. В отличие от них, у животных, принимавших препарат примера 17 (n=3) в ответ на введение КСl отмечались только начальные явления CSD. Общее среднее (минимуммаксимум) число явлений CSD в контрольных и испытуемых группах составляло 5,5 (4-9) и 2 (1-2) соответственно. Общая длительность CSD подобных явлений составляла 60,3±6 минут (n=4) в контроле и была значительно снижена (р
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzopyrans, benzopyran-containing pharmaceutical composition, method for treatment and/or prevention of diseases
Назва патенту російськоюСоединения бензопиранов, фармацевтическая композиция на их основе и способ лечения и/или профилактики заболеваний
МПК / Мітки
МПК: A61P 25/22, A61P 25/08, A61K 31/38, A61P 9/10, A61K 31/35, A61P 25/28, A61K 31/4433, A61K 31/353, C07D 409/12, A61K 31/443, A61P 25/00, A61K 31/44, A61P 25/18, C07D 311/68, C07D 405/12, A61P 25/06, A61P 25/16, A61K 31/352, A61P 25/36, A61P 25/32, A61P 25/24, A61K 31/381, A61P 25/26
Мітки: лікування, захворювань, основі, бензопіранів, спосіб, профілактики, композиція, сполуки, фармацевтична
Код посилання
<a href="https://ua.patents.su/9-62909-spoluki-benzopiraniv-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-likuvannya-i-abo-profilaktiki-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Сполуки бензопіранів, фармацевтична композиція на їх основі та спосіб лікування і/або профілактики захворювань</a>