Похідні 2-арил-2н-піразоло[4,3-d]-піримідин-5,7(4н,6н)-діонів
Номер патенту: 85107
Опубліковано: 11.11.2013
Автори: Барус Маріана Маринівна, Вовк Михайло Володимирович, Братенко Михайло Калінінович
Формула / Реферат
Похідні 2-арил-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діонів загальної формули:
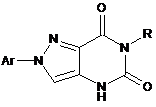 ,
,
де Ar=Ph, 4-BrC6H4; R=н-Bu, НО(СН2)2, Me2N(CH2)2, PhCH2, 4-С1С6Н4СН2, 4-МеС6Н4СН2, 4-МеОС6Н4СН2, 4-МеОС6Н4(СН2)2.
Текст
Реферат: Похідні 2-арил-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діонів загальної формули: O N Ar N N N H R O , де Ar=Ph, 4-BrC6H4; R=н-Bu, НО(СН2)2, Me2N(CH2)2, PhCH2, 4-С1С6Н4СН2, 4-МеС6Н4СН2, 4МеОС6Н4СН2, 4-МеОС6Н4(СН2)2. UA 85107 U (54) ПОХІДНІ 2-АРИЛ-2H-ПІРАЗОЛО[4,3-d]-ПІРИМІДИН-5,7(4H,6H)-ДІОНІВ UA 85107 U UA 85107 U Корисна модель належить до органічної хімії, а саме до способу одержання нових похідних гетероциклічної системи 1H-піразоло[4,3-d]-піримідину загальної формули: O N Ar N N N H 5 10 R O , де Аr=Ph, 4-BrC6H4; R=н-Bu, НО(СН2)2, Me2N(CH2)2, PhCH2, 4-СlС6Н4СН2, 4-МеС6Н4СН2, 4МеОС6Н4СН2, 4-МеОС6Н4(СН2)2 Сполуки такого типу можуть знайти застосування як біологічно активні речовини, а також як ключові системи для дизайну та синтезу препаратів із потенційною фармакологічною дією. Названі сполуки, їх властивості та застосування в патентних виданнях і науковій літературі не описані. Найближчими структурними аналогами сполук, які заявляються, є заміщені 2,4дигідропіразоло[4,3-d]піримідин-5,7-діони формули O N R 1 N N N R 15 1 2 R R 4 O 3 2 3 де R =Н, Ме, Et, н-Bu; R =Η, Cl, Me, Ph, 3-ClC6H4, 4-CF3C6H4, 3,4-Сl2С6Н3, C(О)Ме; R =Η, Me; R =Η, Me, Et, Me2CHCH2 4 20 25 30 Серед представників наведеної гетероциклічної системи виявлені стимулятори інсулінової секреції [1], антагоністи кортикотропінзвільнюючих рецепторів [2], селективні індуктори кальціотропіну [3]. Окрім цього сполуки ряду 2,4-дигідропіразоло[4,3-d]піримідин-5,7-діонів є важливими темплатами для дизайну антагоністів аденозинових рецепторів [4,5] та флуоресцентними зондами в рецепторзв'язуючих ензиматичних системах [6]. Для отримання похідних 2H-піразоло[4,3-d]піримідин-5,7-діонів зазвичай використовують два синтетичних підходи. Перший з них ґрунтується на піразолоанелюванні важкодоступних поліфункціональних урацилів [3,7-9]. В основі другого лежить принцип формування піридинового циклу за рахунок внутрішньомолекулярної конденсації амідів [10-13] або естерів [14] 4-амінопіразол-3-карбонових кислот. При цьому в ролі електрофільних складових для замикання піримідинового ядра використовуються високотоксичні реагенти - фосген та алкілізоціанати. Синтетична цінність методу також понижується доступністю вихідних естерів 4-амінопіразол-3-карбонових кислот, які утворюються у суміші із ізомерними естерами 4-амінопіразол-5-карбонових кислот і розділяються колонковою хроматографією [14]. Задачею корисної моделі є спосіб отримання нових поліфункціональних похідних 2Hпіразоло[4,3-d]піримідину загальної формули: 35 O N Ar N N N H 40 R O , де Аr=Ph, 4-BrC6H4; R=н-Bu, HO(CH2)2, Me2N(CH2)2, PhCH2, 4-СlС6Н4СН2, 4-MeC6H4CH2, 4MeOC6H4CH2,4-MeOC6H4(CH2)2 Для одержання сполук, які заявляються, запропонована двоетапна синтетична методологія. Суттю першого етапу є перетворення препаративно доступних естерів 1-арил-4-форміл-1Hпіразол-3-карбонових кислот [15] під дією перманганату калію в водно-ацетоновому розчині у 1 1 UA 85107 U 5 10 арил-3-етоксикарбоніл-1H-піразол-4-карбонові кислоти. На основі останніх з використанням простої процедури, яка передбачає їх послідовну взаємодію із етилхлороформіатом та азидом натрію та подальший термічний розклад проміжних азидів 1-арил-3-етоксикарбоніл-1H-піразол4-карбонових кислот, синтезовані базові об'єкти винаходу - естери 1-арил-4-ізоціанато-1Hпіразол-3-карбонових кислот. На другому етапі естери 1-арил-4-ізоціанато-1H-піразол-3карбонових кислот вводять у реакцію із первинними аліфатичними амінами в розчині толуолу при кімнатній температурі з подальшою взаємодією утворених етилових естерів 1-арил-4уреїдо-1Н-піразол-3-карбонових кислот із гідроксидом калію в киплячому етанолі. Проміжні і цільові продукти виділяють з реакційної суміші стандартними методами. Виходи кінцевих продуктів сягають 57-78 %. O O N Ar N OEt N KMnO4 Ar O OEt N COOH CH=O 1. EtOC(O)Cl 2. NaN3 N Ar OEt N 110 oC N=C=O RNH2 O N Ar N N N H 15 20 25 30 35 40 O R N KOH O -EtOH Ar N OEt NHC(O)NHR де Аr=Ph, 4-BrC6H4; R=н-Bu, НО(СН2)2, Me2N(CH2)2, PhCH2, 4-СlС6Н4СН2, 4-МеС6Н4СН2, 4МеОС6Н4СН2, 4-МеОС6Н4(СН2)2 Запропонований синтетичний підхід, який передбачає використання в ролі ключових об'єктів для формування піразоло[4,3-d]піримідинового циклу естерів 4-ізоціанато-1H-піразол-3карбонових кислот, має суттєву перевагу порівняно із естерами 4-аміно-1H-піразол-3карбонових кислот [14], оскільки дозволяє при взаємодії із первинними амінами отримувати широкий ряд проміжних етилових естерів 4-уреїдо-1H-піразол-3-карбонових кислот, в тому числі і тих, які містять в уреїдному фрагменті N-алкілфункціоналізовані замісники. Наявність останніх є принципово важливим для подальшої різноманітної модифікації піразоло[4,3-d]піримідинового ядра, що відкриває ефективний шлях до сполук, які можуть знайти практичне застосування як перспективні біорегулятори та базові об'єкти для створення комбінаторних бібліотек потенційних фармацевтичних речовин. Варто також відзначити, що перевагою знайденого способу циклізації етилових естерів 4-уреїдо-1H-піразол-3-карбонових кислот є її проведення в середовищі етанолу із використанням в ролі основи доступного та дешевого гідроксиду калію, на відміну від відомих процесів за участю набагато дорожчого трет-бутилату калію в розчині тетрагідрофурану. Отриманий результат не був заздалегідь передбачуваним, оскільки не виключалась можливість перебігу під дією гідроксиду калію альтернативної реакцій омилення естерної групи і утворення 4-уреїдо-1H-піразол-3-карбонових кислот. Насправді ж перетворення етилових естерів 4-уреїдо-1H-піразол-3-карбонових кислот в запропонованих умовах реалізується з високою регіоселективністю і з виходами 57-78 % приводить до цільових піразоло [4,3d]піримідин-5,7(4H, 6H)-діонів. Будова та склад всіх отриманих сполук доведені даними елементного аналізу, ІЧ-спектрів та 1 спектрів ЯМР Н. Корисна модель ілюструється загальними методами одержання 1-арил-3-етоксикарбоніл1H-піразол-4-карбонових кислот, етилових естерів 1-арил-4-ізоціанато-1H-піразол-3-карбонової кислоти, етилових естерів 1-арил-4-{[(алкіламіно)карбоніл]аміно}-1H-піразол-3-карбонової кислоти, 6-алкіл-2-арил-2H-піразоло[4,3-d]тримідин-5,7(4H, 6H)-дюнів та фізико-хімічними характеристиками всіх синтезованих сполук. Загальний спосіб одержання 1-арил-3-етоксикарбоніл-1H-піразол-4-карбонових кислот. 2 UA 85107 U 5 10 15 20 25 30 35 40 45 50 55 60 До суспензії 7.9 г KMnО4 в 50 мл ацетону і 10 мл води додавали при перемішуванні 0.05 моль естеру 1-арил-4-форміл-1H-піразолпіразол-3-карбонової кислоти з такою швидкістю, щоб температура реакційної суміші не перевищувала 20 °C. Реакційну суміш перемішували 12 год., виливали в 200 мл крижаної води, твердий залишок відфільтровували, промивали 100 мл води, фільтрат підкислювали 10 мл 20 %-ного розчину соляної кислоти, утворений осад відфільтровували, промивали 50 мл води і кристалізували із етанолу. Приклад 1. 3-Етоксикарбоніл-1-феніл-1H-піразол-4-карбонова кислота. -1 Вихід 73 %, т. пл. 139-140 °C. ІЧ спектр, ν, см : 1730 (C=О), 2540-2850 (СООН). Спектр ЯМР 1 Н, δ, м.д. (J, Гц): 1.39 (3Н, т, J=7.2, СН3), 4.34 (2Н, д, J=7.2, CH2), 7.39-7.42 (1Н, м, HAr), 7.50-7.55 (2Н, м, HAr), 7.92 (2Н, д, J=7.8, HAr), 9.18 (1Н, с, Н-5), 11.98 (1Н, с, СООН). Знайдено, %: С 60.13; + Η 4.76; N 10.80. [М+1] 260. C13H12N2O4. Вирахувано, %: С 60.00; Η 4.65; Ν 10.76. Μ 260.25. Приклад 2. 1-(4-Бромофеніл)-3-етоксикарбоніл-1H-піразол-4-карбонова кислота. -1 Вихід 61 %, т.пл. 168-170 °C. ІЧ спектр, ν, см : 1730 (С=О), 2520-2860 (СООН). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 1,43 (3Н, т, J=7.0, CH3), 4,28 (2Н, д, J=7,0, СН2), 7,63 (2Н, д, J=8,2, HAr), 7,97 (2Н, д, J=8,2, HAr), 9,16 (1H, с, Н-5), 12,11 (1Н, с, СООН). Знайдено, %: С 45,90; Η 3,20; N 8,08. + C13H11BrN2O4. [M+1] 340. Вирахувано, %: С 46,04; Η 3,27; Ν 8,26.Μ 339,15. Загальний спосіб одержання етилових етерів 1-арил-4-ізоціанато-1H-піразол-3-карбонової кислоти. До розчину 0.01 моль 1-арил-3-етоксикарбоніл-1H-піразол-4-карбонової кислоти та 2.7 мл (0.02 моль) триетиламіну в 30 мл тетрагідрофурану додавали при перемішуванні і охолодженні до -10 °C 1.65 г (0,015моль) етилхлороформіату, перемішували при цій температурі 0,5 гд, а потім додавали 1,62 г. (0,025 моль) азиду натрію в 10 мл води і перемішували ще 1 год. Реакційну суміш виливали в 100 мл крижаної води, екстрагували толуолом (3×25 мл), сушили безводним MgSO4, фільтрували і кип'ятили до закінчення виділення азоту (~2 год.). Толуол відганяли при пониженому тиску, твердий залишок кристалізували із суміші бензол-гексан, 3:1. Приклад 3. Етиловий естер 4-ізоціанато-1-феніл-1H-піразол-3-карбонової кислоти. -1 1 Вихід 82 %, т. пл. 93-95 °C. ІЧ спектр, ν, см : 1730 (СО), 2250 (N=C=O). Спектр ЯМР Н, δ, м. ч. (J, Гц): 1,44 (3Н, т, J=7,4, СН3), 4,47 (2Н, д, J=7,4, СН2), 7,34 (1Н, т, J=7,6, HAr), 7,46 (2Н, т, J=7,8, HAr), 7,66 (2Н, д, J=7,8, HAr), 7.77 (1Н, с, Н-5). Знайдено, %: С 60,70; Η 4,35; N 16,30. C13H11N3О3. Вирахувано, %: С 60,56; Η 4,27; N 16,33. Приклад 4. Етиловий естер 1-(4-бромофеніл)-4-ізоціанато-1H-піразол-3-карбонової кислоти. -1 1 Вихід 77 %, т. пл. 118-120 °C. ІЧ спектр, ν, см : 1730 (С=О), 2250 (Ν=C=O). Спектр ЯМР Н, δ, м.ч. (J, Гц): 1,41 (3Н, т, J=7.2, СН3), 4,30 (2Н, д, J=7,2, СН2), 7,61 (2Н, д, J=8,4, HAr), 7,80 (1Н, с, Н-5), 7,95 (2Н, д, J=8,4, HAr).Знайдено, %: С 46,40; Η 2,90; Ν 12,35. C13H10BrN3O3. Вирахувано, %: С 46,45; Η 3,00; Ν 12,50. Загальний спосіб одержання етилових естерів 1-арил-4-{[(алкіламіно)карбоніл]аміно}-1Hпіразол-3-карбонової кислоти. До розчину 0.002 моль етилового ефіру 1 -арил-4-ізоціанато-1Н-піразол-3-карбонової кислоти в 5 мл толуолу додавали 0,002 моль відповідного алкіламіну і залишали при кімнатній температурі на 3 год. До реакційної суміші додавали 5 мл гексану і через 1 год. відфільтровували утворений осад, промивали гексаном, сушили і кристалізували із етанолу. Приклад 5. Етиловий естер 1-феніл-4-{[(бутиламіно)карбоніл]аміно}-1H-піразол-3-карбонової кислоти. -1 Вихід 84 %, т. пл. 90-91 °C. ІЧ спектр, ν, см : 1690, 1725 (C=O), 3255, 3340 (Ν-Η). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 0,89 (3Н, т, J=6,8, СН3), 1,32-1,43 (7Н, м, СН3+2СН2), 3,11 (2Н, т, J=6,6, CH2N), 4,38 (2Н, к, J=6,8, ОСН2СН3), 7,37-7,55 (4Н, м, 3HAr+NH), 7,83 (2Н, д, J=8,2,HAr), 8.39 (1Н, с, Н-5), 8,68 (1Н, с, NH). Знайдено, %: С 61,78; Η 6,79; Ν 16,88. C17H22N4O3. Вирахувано, % С 61,80; Η 6,71; Ν 16,96. Приклад 6. Етиловий естер 1-феніл-4-{[(2-гідроксиетиламіно)карбоніл]-аміно}-1H-піразол-3-карбонової кислоти. -1 Вихід 73 %, т. пл. 155-157 °C. ІЧ спектр, ν, см : 1690, 1725 (С=О), 3260, 3345 (Ν-Η). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1.35 (3Н, т, J=6,8, СН3), 3,19 (2Н, т, J=5,8, NСН2CH2OH), 3,57 (2Н, т, J=5,8, NCH2CH2OH), 4,38 (2Н, к, J=6,8, СН2СН3), 4,75 (1Н, ш.с, ОН), 7,18-7,38 (4Н, м, HAr+NH), 7,83 (2Н, д, J=7,6, HAr), 8,4 с (1Н, с, Н-5), 8,82 (1Н, с, NH). Знайдено, %: С 56,52; Η 5,61; Ν 17,55. С15Н18N4О4. Вирахувано, % С 56,60; Η 5,70; Ν 17,60. 3 UA 85107 U 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 7. Етиловий естер 1-феніл-4-{[(2-[N, N-диметиламіно]етиламіно)-карбоніл]-аміно}-1H-піразол-3карбонової кислоти. -1 Вихід 70 %, т. пл. 103-104 °C. ІЧ спектр, ν, см : 1695, 1720 (С=О), 3240, 3335 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,37 (3Н, т, 7=6,8, СН2СН3), 2,17 [6Н, с, N(CH3)2], 2,32 [2Н, т, J=6,0, NHCH2CH2N(CH3)2], 3,21 [2Н, т, J=6,0, NHCH2CH2N(CH3)2], 4,39 (2H, к, J=7,2, СН2СН3), 7,39-7,55 (4Н, м, 3HAr+NH), 7,84 (2Н, д, J=8,0, HAr), 8,48 (1Н, с, Н-5), 8,69 (1Н, с, NH). Знайдено, %: С 58,31; Η 6,01; N 21,38 C16H20N5O3. Вирахувано, % 58,17; Η 6,10; Ν 21,20. Приклад 8. Етиловий естер 1-феніл-4-{[(бензиламіно)карбоніл]-аміно}-1H-піразол-3-карбонової кислоти. -1 Вихід 88 %, т. пл. 160-162 °C. ІЧ спектр, ν, см : 1700, 1730 (С=О), 3255, 3365 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,36 (3Н, т, J=6,8, СН3), 4,39 (2Н, д, J=5,4, CH2Ph), 4,41 (2Н, к, J=6,8, 0 ОСН2СН3), 7,26-7,90 (11Н, м, HAr+NH), 8,52 (1Н, с, Н-5), 8,70 (1Н, с, NH). Знайдено, /,: С 65,66; Η 5,41; Ν 15,29. C20H20N4O3. Вирахувано, % 65,92; Η 5.53; Ν 15,37. Приклад 9. Етиловий естер 1-феніл-4-{[(4-хлоробензиламіно)карбоніл]-аміно}-1Н-піразол-3-карбонової кислоти. -1 Вихід 92 %, т. пл. 178-179 °C. ІЧ спектр, ν, см : 1690, 1730 (С=О), 3250, 3360 (Ν-Η). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,36 (3Н, т, J=7,2, СН3), 4,32 (2Н, д, J=5,2, СН2С6Н4Сl-4), 4,39 (2Н, к, J=7,2, ОСН2СН3), 7,33-7.44 (5Н, м, HAr), 7,31 (2Н, т, J=7,6, HAr), 7,84-7,92 (3Н, м, HAr+NH), 8,53 (1Н, с, Н5), 8,69 (1Н, с, ΝΗ). Знайдено, %: С 59,96; Η 4,61; Ν 13,85. С20Н19СlN4О3. Вирахувано, % 60,23; Η 4,80; Ν 14,05. Приклад 10. Етиловий естер 1-феніл-4-{[(4-метилбензиламіно)карбоніл]-аміно}-1H-піразол-3-карбонової кислоти. -1 Вихід 86 %, т. пл. 182-183 °C. Ч спектр, ν, см : 1685, 1730 (С=О), 3270, 3355 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,36 (3Н, т, J-6,8, СН3), 2,29 (3Н, с, СН3), 4,28 (2Н, д, J=5,4, СН2С6Н4СН34), 4,39 (2Н, к, J=6,8, ОСН2СН3), 7,15 (2Н, д, J=7,6, HAr), 7,20 (2Н, д, J=7,6, HAr), 7,38 (1H, т, J=7,6, HAr), 7,53 (2Н, т, 7-7,6, HAr), 7,84-7,88 (3Н, м, HAr+NH), 8,49 (1Н, с, Н-5), 8,70 (1Н, с, NH). Знайдено, %: С 66,87; Η 5,98; N 14,61. C21H22N4O3. Вирахувано, % 66,65; Η 5,86; Ν 14,80. Приклад 11. Етиловий естер 1-феніл-4-{[(2-{4-метоксифеніл}етиламіно)-карбоніл]-аміно}-1Н-піразол-3карбонової кислоти. -1 Вихід 77 %, т. пл. 105-106 °C. ІЧ спектр, ν, см : 1700, 1725 (С=О), 3270, 3350 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,36 (3Н, т, J=7,2, СН3), 2,70 (2Н, т, J=6,8, NHCH2CH2C6H4OCH3-4), 3,31 (2Н, т, J=6,8, NHCH2CH2C6H4OCH3-4), 3,73 (3Н, с, ОСН3), 4,38 (2Н, к, J=7,2, ОСН2СН3), 6,87 (2Н, д, J=8,0, HAr), 7,16 (2Н, д, J=8,0, HAr), 7,37-7,56 (4Н, м, HAr+NH), 7,85 (2Н, д, J=8,0, HAr), 8,42 (1Н, с, Н-5), 8,70 (1Н, с, NH). Знайдено, %: С 64,93; Η 5,86; Ν 13,77. C22H24N4O4. Вирахувано, % 64,69; Η 5,92; Ν 13,72. Приклад 12. Етиловий естер 1-(4-бромофеніл)-4-{[(бензиламіно)карбоніл]-аміно}-1H-піразол-3-карбонової кислоти. -1 Вихід 81 %, т. пл. 160-161 °C. ІЧ спектр, ν, см : 1695, 1730 (С=О), 3245, 3365 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,35 (3Н, т, J=7,2, СН3), 4,34 (2Н, к, J=5,6, CH2Ph), 4,40 (2Н, к, J=7,2, ОСН2СН3), 7,24-7,39 (5Н, м, HAr), 7,72 (2Н, д, J=7,8, HAr), 7,86-7,91 (3Н, м, HAr+NH), 8,51 (1Н, с, NH), 8,73 (1Н, с, Н-5). Знайдено, %: С 54,41; Η 4,19 Ν 12,48. C20H19BrN4O3. Вирахувано, % 54,19; Η 4,32; Ν 12,64. Приклад 13. Етиловий естер 1-(4-бромофеніл)-4-{[({4-метилокси}бензил-аміно)карбоніл]-аміно}-1Hпіразол-3-карбонової кислоти. -1 Вихід 84 %, т. пл. 185-187 °C. ІЧ спектр, ν, см : 1700, 1725 (С=О), 3250, 3360 (N-H). Спектр 1 ЯМР Н, δ, м.ч. (J, Гц): 1,35 (3Н, т, J=6,8, СН3), 3,74 (3Н, с, СН3О), 4,25 (2Н, д, J=5,6, СН2С6Н4ОСН3-4), 4,38 (2Н, к, J=6,8, ОСН2СН3), 6,86 (2Н, д, J=8,2, HAr), 7,23 (2Н, д, J=8,2, HAr), 7,70 (2Н, д, J=8,4, HAr), 8,81-8,86 (3Н, м, HAr+NH), 8,47 (1Н, с, NH), 8,74 (1Н, с, Н-5). Знайдено, %: С 53,53; Η 4,31; Ν 11,77. C21H21BrN4O4. Вирахувано, % 53,29; Η 4,47; Ν 11,84. Приклад 14. Етиловий естер 1-(4-бромофеніл)-4-{[(2-{4-метоксифеніл}-етиламіно)карбоніл]аміно}-1Hпіразол-3-карбонової кислоти. -1 Вихід 73 %, т. пл. 150-151 °C. ІЧ спектр, ν, см : 1700, 1725 (С=О), 3255, 3345 (Ν-Η). Спектр 1 ЯМР Н, δ, мл. (J, Гц): 1,35 (3Н, т, J=7,2, СН3), 2,70 (2Н, т, J=6,6, NНСН2СН2С6Н4ОСН3-4), 3,31 4 UA 85107 U 5 10 15 20 25 30 35 40 45 50 55 60 3,38 (2Н, м, NHCH2CH2C6H4OCH3-4), 4,38 (2Н, к, J=7,2, ОСН2СН3), 6,86 (2Н, д, J=8,4, HAr), 7,16 (2Н, д, J=8,4, HAr), 7,44 (1Н, с, NH), 7,71 (2Н, д, J=8,4, HAr), 7,84 (2Н, д, J=8,4, HAr), 8,41 (1Н, с, NH), 8,72 (1Н, с, Н-5). Знайдено, %: С 54,03; Η 4,91; N 11,36. C22H23BrN4O4. Вирахувано, % 54,22; Η 4,76; Ν 11,50. Загальний спосіб одержання 6-алкіл-2-арил-2H-піразоло[4,3-d] піримідин-5,7(4H, 6H)-діонів. До розчину г (0.001 моль) КОН в 10 мл етанолу додавали 0.001 моль етилового ефіру 1арил-4-{[(алкіламіно)карбоніл]аміно}-1Н-шразол-3-карбонової кислоти І кип'ятили 3 год. Реакційну суміш підкислювали 10 %-ним розчином соляної кислоти до рН 2, утворений осад відфільтровували, промивали водою, сушили і кристалізували із оцтової кислоти. Приклад 15. 6-(н-Бутил)-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 63 %, т. пл. 190-191 °C. ІЧ спектр, ν, см : 1675, 1715 (С=О), 3345 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 0,93 (3Н, т, J=7,0, СН3), 1,40-1,47 (4Н, м, СН2СН2), 3,62 (2Н, J=6,2, NCH2), 7,387,54 (3Н, м, HAr), 7,88 (2Н, д, J=8,0, HAr), 8,42 (1Н, с, Н-3), 11,22 (1Н, с, NH). Знайдено, %: С + 63,61; Η 5,53; Ν 19,49; [M+1] 283. C15H16N4O2. Вирахувано, % 63,37; Η 5,67; Ν 19,71. Приклад 16. 6-(2-Гідроксиетил)-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 70 %, т. пл. 225-226 °C. ІЧ спектр, ν, см : 1675, 1720 (С=О), 3360 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 3,55 (2Н, т, J=6,0, HOCH2CH2N), 3,99 (2Н, т, J=6,0, HOCH2CH2N), 4,80 (1Н, ш.с, ОН), 7,42-7,51 (3Н, м, HAr), 7,95 (2Н, д, J=7,8, HAr), 8,39 (1Н, с, Н-3), 11,32 (1Н, с, NH). Знайдено, + %: С 57,61; Η 4,59; N 20,36; [М+1] 273. C13H12N4O3. Вирахувано, % 57,35; Η 4,44; Ν 20,58. Приклад 17. 6-[2-(Диметиламіно)етил]-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 61 %, т. пл. 295-298 °C. ІЧ спектр, ν, см : 1670, 1715 (С=О), 3365 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 2,20 [6Н, с, (CH3)2N], 3,42 [2Н, т, J=6,0, CH2CH2N(CH3)2], 4,00 [2Н, т, J=6,0, CH2CH2N(CH3)2], 7,27-7,43 (3Н, м, HAr), 7,94 (2Η, д, J=7,6, HAr), 8,37 (1Н, с, Н-3), 11,38 (1Н, ш.с, + ΝΗ). Знайдено, %: С 60,47; Η 5,49; Ν 23,66; [M+1] 300. C15H17N5O2. Вирахувано, % 60,19; Η 5,72; Ν 23,40. Приклад 18. 6-Бензил-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 78 %, т. пл. 282-284 °C. ІЧ спектр, ν, см : 1670, 1715 (С=О), 3350 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 5,10 (2Н, с, СН2), 7,25-7,84 (10Н, м, HAr), 8,41 (1Н, с, Н-5), 11,46 (1Н, с, ΝΗ). + Знайдено, %: С 67,68; Η 4,31; Ν 17,45; [M+1] 319. C18H14N4O2. Вирахувано, % 67,92; Η 4,43; 17,60. Приклад 19. 6-(4-Хлоробензил)-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. Вихід 74 %, т. пл. -1 1 >300 °C. ІЧ спектр, ν, см : 1675, 1720 (С=О), 3360 (ΝΗ). Спектр ЯМР Н, δ, м.ч. (J, Гц): 5,07 (2Н, с, СН2), 7,36-7,57 (7Н, м, HAr), 7,95 (2Н, д, J=7,6 Гц, HAr), 8,41 (1Н, с, Н-5), 11,49 (1Н, с, NH). + Знайдено, %: С 62,47; Η 4,00; N 15,51; [М+1] 353. C19H15ClN4O2. Вирахувано, % 62,22; Η 4,12; Ν 15,27. Приклад 20. 6-(4-Метилбензил)-2-феніл-2H-піразоло[4,3-й]піримідин-5,7(4H, 6H)-діон. Вихід 77 %, т. пл. -1 1 210-212 °C. ІЧ спектр, ν, см : 1675, 1720 (С=О), 3370 (Ν-Η). Спектр ЯМР Н, δ, м.ч. (J, Гц): 5,05 (2Н, с, СН2), 7,10-7,56 (7Н, м, HAr), 7,96 (2Н, д, J=7,8, HAr), 8,39 (1Н, с, Н-3), 11,46 (1Н, с, NH). + Знайдено, %: С 69,71; Η 5,30; Ν 16,38; [M+1] 333. C20H18N4O2. Вирахувано, % 69,35; Η 5,24; N16,17. Приклад 21. 6-[2(4-Метокси)етил]-2-феніл-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 66 %, т. пл. 259-262 °C. ІЧ спектр, ν, см : 1680, 1720 (С=О), 3375 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 2,81 (2Н, т, J=6,8, NCH2CH2C6H4OCH3-4)S 3,73 (3Н, с, СН3О), 4,07 (2Н, т, J=6,8, NСН2СН2С6Н4ОСН3-4), 6,84 (2Н, д, J=8,4, HAr), 7,15 (2Н, д, J=7,6, HAr), 7,44 (1Н, т, J=7,8, HAr), 7,57 (2Н, д, J=8,0, HAr), 7.96 (2Н, д, J=8.4, HAr), 8,38 (1Н, с, Н-5), 11,35 (1Н, с, NH). Знайдено, %: С + 66,07; Η 5,10; Ν 15,30; [M+1] 363. С20Н18N4О3. Вирахувано, % 66,29; Η 5,01; Ν 15,46. Приклад 22. 6-Бензил-2-(4-бромофеніл)-2Я-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 67 %, т. пл. 279-283 °C. ІЧ спектр, ν, см : 1675, 1715 (С=О), 3365 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 5,09 (2Н, с, СН2), 7,25-7,35 (5Н, м, HAr), 7,72 (2Н, д, J=8,0, HAr), 7,94 (2Н, д, + J=8.0, HAr), 8,44 (1Н, с, Н-3), 11,49 (1Н, с, NH). Знайдено, %: С 54,70; Η 3,16; Ν 17,31; [M+1] 398. C18H13BrN4O2. Вирахувано, % 54,43; Η 3,30; Ν 17,10. Приклад 23. 5 UA 85107 U 5 10 15 20 25 30 35 40 45 50 55 6-(4-Метокси)бензил-2-(4-бромофеніл)-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діон. -1 Вихід 61 %, т. пл. 268-271 °C. ІЧ спектр, ν, см : 1670, 1715 (С=О), 3355 (Ν-Η). Спектр ЯМР 1 Н, δ, м.ч. (J, Гц): 3,73 (3Н, с, СН3О), 5,03 (2Н, с, СН2), 6,86 (2Н, д, J=7.8, HAr), 7,29 (2Н, д, J=7.8, HAr), 7,73 (2Н, д, J=8.0, HAr), 7,91 (2Н, д, J=8.0, HAr), 8,34 (1Н, с, Н-3), 11,29 (1Н, с, NH). Знайдено, + %: С 52,17; Η 3.02; N 12,81; [М+1] 428. C18H13BrN4O2. Вирахувано, % 52,32; Η 3,17; Ν 13,56. Приклад 24. 6-[2-(4-Метокси)етил]-2-(4-бромофеніл)-2H-піразоло[4,3-(і]піри-мідин-5,7(4H, 6H)-діон. Вихід -1 1 57 %, т. пл. 259-261 °C. ІЧ спектр, ν, см : 1675, 1720 (С=О), 3360 (Ν-Η). Спектр ЯМР H, δ, м.ч. (J, Гц): 2,79 (2Н, т, J=7,0, NСН2СН2С6Н4ОСН3-4), 3,73 (3Н, с, СН3О), 4,05 (2Н, т, J=7,0, NCH2CH2C6H4OCH3-4), 6,86 (2Н, д, J=8,0, НAr), 7,15 (2Н, д, J=8,0, HAr), 7,74 (2Н, д, J=8,4, НAr), 7,93 (2Н, д, J-8,4, НAr), 8,40 (1H, с, Н-3), 11,37 (1Н, с, NH). Знайдено, %: С 54,19; Η 3,70; N 12,85; + [М+1] 442. С20Н17ВrN4О3. Вирахувано, % 54,44; Η 3,88; N12,70. Джерела інформації: 1. Pat. ЕР 1637532. 22 March 2006. Nakajama Т., Ueno К., Nomoto Υ., Matsumoto Υ., Yano Η., Nakanishi S., Takasaki K., Kusaka H. Fused pyrimidine derivatives / http://ep.espacenet.com 2. Koshiwagi Т., Takumoro I., Watanabe Y., Yato M. Pyrazolopyrimidine derivative / http://ep.espacenet.com 3. Gilbert A.M., Caltabiano S., Koehu F.E., Chen Zh… Francisco G.P., Ellingboe J.W., Kharode Y., Mangine A.M., Francis R., Traismit M., Gralnick D. Pyrazolopyrimidine-2,4-dion sulfonamides: novel and selective calciotonin inducers // J. Med. Chem.-2002. - Vol. 45. - P. 2342-2345. 4. Lenzi O., Colotta V., Catarzi D., Varano F., Poli D., Filacchioni G., Vatani K., Vincenzi F., Borea P.A., Paoletta S., Morizzo E., Мого S. 2-Phenylpyrazolo[3,4-d]pyrimidin-7-one as new scaffold to obtain potent and selective human A3 adenozine receptor antagonist recognition // J/ Med. Chem.2009. - Vol. 52. - P. 7640-7652. 5. Baraldi P.G., Saponato G., Tabrizi M.A., Baraldis S., Pomagnoli R., Mornon A.R., Varani K., Borea P.A., Predi D. Pyrrolo-and pyrazolo[3,4-e][l, 2,4]triazolo[l, 5-c]pyrimidines as adenozine receptor antagonists // Bioorg. Med. Chem.-2012. - Vol. 20. - P. 1046-1059. 6. Medza G., Wierzchowski J., Kierdaszuk В., Shugar D. Fluorescence emission properties of 8aza analogues of coffeine, theophylline and related N-alkel xantines // Bioorg. Med. Chem. 2009. Vol.17. - P. 2585-2591. 7. Hirota К., Yamada Υ., Asao Т., Kitade Υ., Senda S. Pyrimidine derivatives and related compounds. XL. Synthesis of 7-substituted pyrimido[5,4-d]pyrimidmes // Chem. Pharm. Bull.-1981. Vol. 29. - P. 3060-3062. 8. Zhang F., Kulesha Α., S.Rami., Bernet В., Vasella A. 6-(Diazomethyl)-l, 3bis(methyloxymethyl)uracils. Synthesis and transformation into annulated pyrimidindiones // Helv. Chim. Acta.-2008. - Vol. 91. - P. 1201-1218. 9. Hirota K., Yamada Y., Asso Т., Senda S. Pyrimidine derivatives and related compounds. P.41. Reactions of l, 3,6-trimethyl-5-nitrouraci and its 6-brommrthylanalogue with amines and hydrazines. Synthesis of pyrazolo[4,3-d]pyrimidine N-oxides and their ring expansion to [5,4-d]pyrimidines //J. Chem. Soc. Perkin Trans. 1.-1982. - P. 277-284. 10. Robins R., Fught F.W., Grauer A.D., Jones J.W. Potential purine antagonists. II. Synthesis of some 7 and 5,7-substituted pyrazolo[4,3-d]-pyrimidines // J. Amer. Chem. Soc-1956. - Vol.78. - P. 2418-2492. 11. Papesh V., Dodson R.M. Isomeric pyrazolo[4,3-d]pyromodinediones // J. Org. Chem.-1965. Vol. 30. - P. 199-203. 12. Ramosamy K.S., Amador R.B., Habib Q., Roug F., Han X., David Y.L., Huang J., Z. Houg, An. H. Solid-phase paralles synthesis of 4-p-D-ribofuranosylpyrazolo[4,3-d]pyrimidine nucleozides // Nucleozides, Nicleotides> nucleic Acids.-2005. - Vol. 24-P. 1947-1970. 13. Long R.A., Gerster J.F., Townsend L.B. Derivatives of the new ring system pyrazolo[4,3-d]-vtriazino and the synthesis of 5,7-disubstituted 3-methylpyrazolo[4,3-d]pyrimidines and 5,7disubstituted 3-methylpyrazolo[4,3-d]pyrimidine 6-oxides which are structurally related to the nucleozide antibiotics Formicin and Formicin 1 // J. Heterocyclic Chem.-1970. - Vol. &. - P. 863-870. 14. H. Brady Т., Vu К., Barber J.R., Ng S.C., Zhou Y. Synthesis of novel 2,3-substituted-2,4dihydro-ptrazolo[4,3-d]pyrimidine-5,7-diones//Tetrahedron Lett.-2009. - Vol. 50. - P. 6223-6227. 15. Братенко М.К., Барус М.М., Вовк М.В. Полифункциональные пиразолы. 5. Препаративный синтез 1-арил-4-формил-1Н-пиразол-3-карбоновых кислот // Химия гетероцикл. соед.-2009. - № 12. - С. 1817-1822. 6 UA 85107 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ Похідні 2-арил-2H-піразоло[4,3-d]піримідин-5,7(4H, 6H)-діонів загальної формули: O N Ar 5 N N N H R O , де Ar=Ph, 4-BrC6H4; R=н-Bu, НО(СН2)2, Me2N(CH2)2, PhCH2, 4-С1С6Н4СН2, 4-МеС6Н4СН2, 4МеОС6Н4СН2, 4-МеОС6Н4(СН2)2. Комп’ютерна верстка І. Мироненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюVovk Mykhailo Volodymyrovych, Bratenko Mykhailo Kalinikovych, Barus Mariana Marynivna
Автори російськоюВовк Михаил Владимирович, Братенко Михаил Калиникович, Барус Мариана Мариновна
МПК / Мітки
МПК: C07D 403/00
Мітки: 2-арил-2н-піразоло[4,3-d]-піримідин-5,7(4н,6н)-діонів, похідні
Код посилання
<a href="https://ua.patents.su/9-85107-pokhidni-2-aril-2n-pirazolo43-d-pirimidin-574n6n-dioniv.html" target="_blank" rel="follow" title="База патентів України">Похідні 2-арил-2н-піразоло[4,3-d]-піримідин-5,7(4н,6н)-діонів</a>
Попередній патент: Привід круглов’язальної машини
Наступний патент: Спосіб одержання 5-арил-1,3,4,5-тетрагідро-2н-1-бензазепін-2-онів
Випадковий патент: Розгрузочна втулка













