Препарат у вигляді таблетки саксагліптину з покриттям і спосіб його виготовлення
Формула / Реферат
1. Таблетка з покриттям, яка відрізняється тим, що включає ядро таблетки та
a) внутрішній ізолювальний шар покриття, нанесений на ядро таблетки;
b) другий шар покриття, який включає лікарський засіб, нанесений на внутрішній ізолювальний шар покриття на ядрі таблетки; та
c) необов'язково зовнішній захисний шар покриття, нанесений на другий шар покриття на ядрі таблетки, де лікарським засобом у другому шарі покриття є саксагліптин
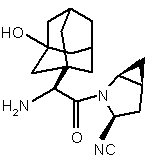
або його фармацевтично прийнятна сіль.
2. Таблетка з покриттям за п. 1, яка відрізняється тим, що вказаний внутрішній ізолювальний шар покриття включає рецептуру покривального полімеру, яка включає полімер на базі полівінілового спирту (ПВС), причому вказаний другий шар покриття включає лікарський засіб, що являє собою саксагліптин, і рецептура покривального полімеру включає полімер на базі ПВС, і вказаний інший захисний шар покриття включає рецептуру шару покриття, що включає полімер на базі ПВС.
3. Таблетка з покриттям за п. 1, яка відрізняється тим, що вказаний другий шар покриття включає від 0,1 до 70 % (мас.) лікарського засобу та від 30 до 99,5 % (мас.) покривального полімеру, на базі маси другого шару покриття.
4. Таблетка з покриттям за п. 2, яка відрізняється тим, що рецептура покривального полімеру в другому шарі покриття становить щонайменше приблизно 2 мг при масі ядра таблетки 200 мг, та кількість лікарського засобу становить щонайменше 0,2 мг при масі таблетки 200 мг.
5. Таблетка з покриттям за п. 1, яка відрізняється тим, що додатково включає третій зовнішній захисний шар покриття, розташований на вказаному другому шарі покриття.
6. Таблетка з покриттям за п. 5, яка відрізняється тим, що вказаний другий шар покриття включає полімер на базі ПВС.
7. Таблетка з покриттям за п. 5, яка відрізняється тим, що кожний з внутрішнього ізолювального шару покриття і зовнішнього захисного шару включає полімер на базі ПВС.
8. Таблетка з покриттям за п. 7, яка відрізняється тим, що полімер на базі ПВС в другому шарі покриття є таким же, як полімер на базі ПВС в інших шарах покриття.
9. Таблетка з покриттям за п. 8, яка відрізняється тим, що полімер на базі ПВС складається з полівінілового спирту.
10. Таблетка з покриттям за п. 1, яка відрізняється тим, що в другому шарі покриття присутній лікарський засіб в кількості від приблизно 0,2 до приблизно 140 мг і покривальний полімер присутній в кількості від приблизно 2 до приблизно 140 мг, і в кожному з внутрішнього ізолювального шару покриття і необов'язково зовнішнього захисного шару покриття, покривальний полімер присутній в кількості від приблизно 1 до приблизно 100 мг.
11. Таблетка з покриттям за п. 1, яка відрізняється тим, що ядро таблетки включає один або більше наповнювачів, необов'язково один або більше зв'язувальних агентів, необов'язково один або більше дезінтегрантів і необов'язково один або більше змащувальних агентів для таблетування.
12. Таблетка з покриттям за п. 11, яка відрізняється тим, що ядро таблетки включає мікрокристалічну целюлозу, лактози моногідрат, натрій кроскармелозу і магнію стеарат.
13. Таблетка з покриттям за п. 1, яка відрізняється тим, що має наступний склад:
Матеріал ядра таблетки плацебо
Інтервал %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг
лактоза
20-75 %/40-150 мг
мікрокристалічна целюлоза
20-75 %/40-150 мг
натрій кроскармелоза
2-10 %/4-20 мг
магнію стеарат
0,2-2 %/0,4-4 мг
Перший внутрішній ізолювальний шар покриття
%/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг
покривальний полімер та, необов'язково, пластифікатор і агенти для полегшення ковзання
1-3 %/2-6 мг
Другий шар покриття
%/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг
інгібітор DPP4 (вільна основа або гідрохлорид)
0,25-70 %/0,5-140 мг
покривальний полімер та, необов’язково, пластифікатор і агенти для полегшення ковзання
1-50 %/2-100 мг
Третій зовнішній захисний шар покриття
%/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг
покривальний полімер та, необов'язково, пластифікатор, агенти для полегшення ковзання і барвник
1-5 %/2-10 мг.
14. Таблетка з покриттям за п. 1, яка відрізняється тим, що для таблетки дозуванням 5 мг другий шар покриття включає 5 мг лікарського засобу і 5 мг покриття на базі полімеру та для таблетки дозуванням 2,5 мг шар покриття включає 2,5 мг лікарського засобу і 20 мг покриття на базі полімеру.
15. Спосіб виготовлення таблетки з покриттям, який відрізняється тим, що включає:
a) забезпечення ядра таблетки;
b) покриття таблетки внутрішнім ізолювальним шаром покриття, рецептура якого включає щонайменше один покривальний полімер;
c) сушіння таблетки з покриттям для утворення на ній внутрішнього ізолювального шару покриття;
d) нанесення на покриту таким чином таблетку другого шару покриття, рецептура якого включає саксагліптин та щонайменше один покривальний полімер;
e) сушіння покритої таким чином таблетки для утворення другого шару покриття на ній;
f) необов'язкове нанесення на покриту таким чином таблетку третього зовнішнього захисного шару покриття, рецептура якого включає щонайменше один покривальний полімер; і
g) сушіння покритої таким чином таблетки для утворення таблетки з покриттям за винаходом.
16. Спосіб за п. 15, який відрізняється тим, що шари покриття наносять у вигляді суспензії покривального полімеру.
Текст
1. Таблетка з покриттям, яка відрізняється тим, що включає ядро таблетки та a) внутрішній ізолювальний шар покриття, нанесений на ядро таблетки; b) другий шар покриття, який включає лікарський засіб, нанесений на внутрішній ізолювальний шар покриття на ядрі таблетки; та c) необов'язково зовнішній захисний шар покриття, нанесений на другий шар покриття на ядрі таблетки, де лікарським засобом у другому шарі покриття є саксагліптин 2 (19) 1 3 88168 13. Таблетка з покриттям за п. 1, яка відрізняєтьМатеріал ядра таблетки плацебо лактоза мікрокристалічна целюлоза натрій кроскармелоза магнію стеарат 4 ся тим, що має наступний склад: Інтервал %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг 20-75 %/40-150 мг 20-75 %/40-150 мг 2-10 %/4-20 мг 0,2-2 %/0,4-4 мг Перший внутрішній ізолювальний шар покриття покривальний полімер та, необов'язково, пластифікатор і агенти для полегшення ковзання Другий шар покриття інгібітор DPP4 (вільна основа або гідрохлорид) покривальний полімер та, необов’язково, пластифікатор і агенти для полегшення ковзання Третій зовнішній захисний шар покриття покривальний полімер та, необов'язково, пластифікатор, агенти для полегшення ковзання і барвник %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг 1-3 %/2-6 мг %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг 0,25-70 %/0,5-140 мг 1-50 %/2-100 мг %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг 1-5 %/2-10 мг. 14. Таблетка з покриттям за п. 1, яка відрізняється тим, що для таблетки дозуванням 5 мг другий шар покриття включає 5 мг лікарського засобу і 5 мг покриття на базі полімеру та для таблетки дозуванням 2,5 мг шар покриття включає 2,5 мг лікарського засобу і 20 мг покриття на базі полімеру. 15. Спосіб виготовлення таблетки з покриттям, який відрізняється тим, що включає: a) забезпечення ядра таблетки; b) покриття таблетки внутрішнім ізолювальним шаром покриття, рецептура якого включає щонайменше один покривальний полімер; c) сушіння таблетки з покриттям для утворення на ній внутрішнього ізолювального шару покриття; d) нанесення на покриту таким чином таблетку другого шару покриття, рецептура якого включає саксагліптин та щонайменше один покривальний полімер; e) сушіння покритої таким чином таблетки для утворення другого шару покриття на ній; f) необов'язкове нанесення на покриту таким чином таблетку третього зовнішнього захисного шару покриття, рецептура якого включає щонайменше один покривальний полімер; і g) сушіння покритої таким чином таблетки для утворення таблетки з покриттям за винаходом. 16. Спосіб за п. 15, який відрізняється тим, що шари покриття наносять у вигляді суспензії покривального полімеру. Ця заявка претендує на пріоритет за тимчасовою заявкою США № 60/575,3 19, поданою 28 травня 2004 p., повне розкриття якої в даному описі включено шляхом посилання. Даний винахід стосується препарату у вигляді таблетки з покриттям, який включає ядро таблетки, покрите лікарським засобом, таким як інгібітор DPP4, наприклад, саксагліптин, а також способу виготовлення такого препарату у вигляді таблетки з покриттям. Сполука структури (надалі згаданий вище інгібітор DPP4 або саксагліптин) являє собою активний при прийомі всередину оборотний (DPP4) інгібітор дипептидилпептидази-4, що являє собою терапевтичний агент для лікування цукрового діабету 2 типу, який розкритий в Патенті США № 6,395,767. Після споживання їжі вивільняється інсулінотропний гормон GLP-1, який в свою чергу індукує вивільнення інсуліну з підшлункової залози. Певна кількість GLP-1 інактивується DPP4, присутнім в плазмі і ендотелії капілярів кишечнику. Таким чином, якщо DPP4 інгібується, доступна більша кількість GLP-1 для активізації вивільнення інсуліну з підшлункової залози. Перевага такого механізму вивільнення інсуліну полягає в тому, що інсулін виробляється тільки у відповідь на їжу. Таким чином, проблеми гіпоглікемії, пов'язаної з іншими лікарськими засобами для лікування діабету, ймовірно, будуть меншими у випадку інгібітора DPP4. або її гідрохлорид, 5 88168 6 Згаданий вище інгібітор DPP4 являє собою нестійку сполуку, що схильна до внутрішньомолекулярної циклізації, як показано нижче. Утворення циклічного амідину (СА) Утворений продукт деградації, циклічний амідин (переважно цис-циклічний амідин (ЦА)), є терапевтично неактивним, тобто, його утворення є небажаним. Вказана реакція циклізації може відбуватися як в твердому стані, так і в стані розчину. Швидкість внутрішньомолекулярної циклізації збільшується, якщо препарат піддають розповсюдженим способам обробки, таким як волога грануляція, ролерне ущільнення або таблетування. Крім того, допоміжні речовини, які використовують найчастіше, при змішуванні з цією сполукою можуть збільшувати швидкість циклізації. Крім того, рівень цис-циклічного амідину зростає при збільшенні співвідношення лікарський засіб/допоміжна речовина, що створює більше труднощів у випадку низькодозових лікарських форм. З урахуванням вказаних властивостей молекули, виробництво традиційної лікарської форми у вигляді таблетки для інгібітора DPP4, яка є переважною лікарською формою, являє собою нежиттєздатний варіант. На цей час, препарати у вигляді капсул, що містять суху суміш інгібітора DPP4 і звичайно використовувані допоміжні речовини виробляються в невеликих масштабах і використовуються для клінічних випробувань. Розмір препаратів у вигляді капсул, що містять інгібітор DPP4, також буде проблематичним, оскільки це буде включати помел для контролю розміру частинок інгібітора DPP4, таким чином, щоб виробляти капсули з меншою дозою без проблем однорідності вмісту. Додатково, більшість терапевтичних агентів як окремий об'єкт або як комбінований продукт для лікування діабету доступні у таблетованій лікарській формі. Оскільки таблетована лікарська форма з використанням традиційного виробничого процесу не є можливою для інгібітора DPP4, його виробництво з іншими терапевтичними агентами, у вигляді комбінованої таблетки є навіть більш проблематичним. Таким чином, можна побачити, що існує чітка потреба в стабільних фармацевтичних препаратах, що містять лікарські засоби, які піддаються внутрішньомолекулярній циклізації, що приводить до утворення продуктів деградації, таких як циклічні амідини, які є терапевтично неактивними. Патент США №6,395,767, виданий Robl et al. (надалі Robl et al.) розкриває інгібітори дипептидилпептидази IV на базі конденсованого з циклопропілом піролідину (інгібітори DPP4), які включають сполуки, що мають структуру або фармацевтично прийнятну сіль вказаних компонентів, де фармацевтично прийнятна сіль може являти собою гідрохлорид або сіль трифтороцтової кислоти. Robl et al. розкривають, що інгібітори DPP4, в тому числі описані вище, можуть бути введені в такі форми, як таблетки, капсули, гранули або порошки. Відповідно до даного винаходу пропонується таблетка з покриттям, яка може включати лікарський засіб, який піддається внутрішньомолекулярній циклізації, але є несподівано стабільним в нормальних умовах зберігання, а саме при 30 °С і 60 % відносної вологості. Таблетка з покриттям за винаходом включає ядро таблетки (також має назву "ядро", "ядро таблетки", "плацебо", "ядро таблетки плацебо" або "композиція ядра") та a) шар покриття, яким вкрите ядро, причому шар покриття являє собою внутрішній ізолювальний шар, утворений щонайменше одним покривальним полімером; b) другий шар покриття, розташований над внутрішнім ізолювальним покриттям, утворений лікарським засобом і щонайменше одним покривальним полімером, який переважно є таким же покривальним полімером, як полімер у внутрішньому ізолювальному шарі; і необов'язково c) зовнішній захисний шар покриття, розташований над другим шаром покриття, утворений щонайменше одним покривальним полімером, який переважно являє собою такий же покривальний полімер, як в другому шарі покриття і внутрішньому ізолювальному шарі, але немає потреби в обов'язковому включенні таких же кількостей такого полімеру. Лікарський засіб переважно буде являти собою інгібітор DPP4 структури: або його фармацевтично прийнятну сіль, наприклад, гідрохлорид, що також має назву Сполуки А. 7 В переважному варіанті таблетка з покриттям за винаходом буде включати ядро таблетки, утворене одним або більше агентів, що забезпечують об'єм, або заповнювачів, необов'язково один або більше зв'язувальних агентів, необов'язково один або більше дезінтегрантів, і необов'язково один або більше змащувальних агентів для таблетування, a) внутрішній ізолювальний шар покриття, що включає щонайменше один покривальний полімер, який переважно являє собою полімер на базі полівінілового спирту (ПВС); b) другий шар покриття, розташований над ізолювальним шаром покриття а), що включає щонайменше один лікарський засіб і щонайменше один покривальний полімер, що переважно являє собою полімер на базі ПВС, і переважно є таким же, як покривальний полімер внутрішнього шару ізолювального покриття. Описані вище шари покриття нанесені на ядро таблетки, переважно, шляхом розпилення на ядро таблетки. В найбільш переважному варіанті винаходу зовнішній захисний або третій шар покриття буде нанесений на другий шар(який містить лікарський засіб) покриття і функціонуватиме, як захисний шар. Третій або захисний шар покриття може переважно включати компоненти, подібні до другого шару покриття, за винятком того, що він не буде включати лікарський засіб, але може необов'язково включати один або більше барвників і може необов'язково включати такі ж кількості вказаних компонентів. Необов'язково, четвертий шар (який включає компоненти, подібні до третього шару), що містить барвники і покривальний полімер, може також бути нанесений з метою розрізнення таблеток різного дозування. Перші, другі, треті і четверті шари покриття можуть бути утворені однаковими або різними покривальними полімерами. Було виявлено, що таблетки з покриттям за винаходом демонструють вищу хімічну стабільність в порівнянні з традиційними таблетками, виробленими з використанням традиційної сухої грануляції або способів вологої грануляції. Підхід покриття також полегшить виготовлення комбінованого препарату проблематичного лікарського засобу з іншим лікарським засобом шляхом використання таблетки іншого лікарського засобу у вигляді початкової таблетки (замість ядра таблетки або плацебо, згаданих вище) і нанесення внутрішнього ізолювального покриття та другого шару покриття, що містить проблематичний лікарський засіб і покривальний полімер та необов'язково, але переважно, зовнішній захисний шар покриття на таблетці іншого лікарського засобу. Таблетки з покриттям за винаходом можуть бути виготовлені переважно з використанням апаратів для нанесення покриття з перфорованим баком. Також може бути використане нанесення покриття в псевдозрідженому шарі і нанесення покриття розпиленням. Крім того, у відповідності до даного винаходу, пропонується спосіб виготовлення таблетки з по 88168 8 криттям за винаходом, причому спосіб включає наступні стадії a) забезпечення ядра таблетки; b) шар таблетки з внутрішнім ізолювальним шаром покриття препарату, який включає щонайменше один покривальний полімер; c) сушіння таблетки з покриттям для утворення на ній внутрішнього ізолювального шару покриття; d) нанесення на покриту таким чином таблетку другого шару покриття препарату, який включає лікарський засіб та щонайменше один покривальний полімер; e) сушіння покритої таким чином таблетки для утворення другого шару покриття (який містить лікарський засіб) на ній; f) необов'язково, але переважно, нанесення на покриту таким чином таблетку третього зовнішнього захисного шару покриття препарату, що включає щонайменше один покривальний полімер; і g) необов'язково, нанесення на покриту таким чином таблетку четвертого зовнішнього захисного шару покриття, який включає щонайменше один покривальний полімер і барвник, і h) сушіння покритої таким чином таблетки для утворення таблетки з покриттям за винаходом. В переважному варіанті способу за винаходом кожен з наступних шарів: внутрішній ізолювальний шар покриття препарату, другий шар покриття препарату і зовнішній захисний шар(и) покриття препарату(ів) буде наноситися у вигляді суспензії покривального полімеру в розчиннику покриття. Третій і четвертий зовнішні захисні шари покриття не обов'язково повинні включати . лікарський засіб (хоча це може бути за бажанням), і може бути утворений з інших компонентів першого шару покриття та/або другого шару покриття. Другий шар покриття може бути утворений з компонентів першого шару покриття та/або третього та/або четвертого шару покриття, але не обов'язково містить такі ж кількості вказаних компонентів. При одержанні таблетки з покриттям за винаходом готують покривальну суспензію, яка включає покривальний полімер у воді. Інші розчинники покриття, які можуть бути використані, включають етанол, метанол та ізопропіловий спирт, а також воду, якій віддається перевага. Таблетки, що являють собою плацебо (не містять лікарського засобу) та утворюють ядра таблеток, покривають суспензією внутрішнього ізолювального шару та сушать. Суспензію другого шару покриття, що містить лікарський засіб і покривальний полімер, наносять на покриті таким чином таблетки , які далі сушать. Якщо таблетка з покриттям за винаходом повинна включати зовнішній захисний шар, суспензію покриття готують, як у випадку суспензії внутрішнього ізолювального шару покриття, але без лікарського засобу. Суспензією покриття далі будуть покриті таблетки з попередньо нанесеним покриттям, як описано для внутрішнього ізолювального шару покриття і другого шару покриття, з метою утворення захисного шару покриття на них. 9 Таблетки з покриттям за винаходом корисні в лікуванні у ссавців, наприклад людей, собак і кішок, діабету II типу. Ядро таблетки або плацебо, яке використовують в таблетці з покриттям за винаходом, буде включати традиційну фармацевтичну допоміжну речовину, з метою утворення фармацевтично прийнятного твердого ядра таблетки. Ядро таблетки може мати форму таблетки, гранули, зернятка (beadlet) або пігулки, причому все вищенаведене колективно має назву ядра таблетки. Таблетка з покриттям за винаходом буде містити лікарський засіб, наприклад, згаданий вище інгібітор DPP4, саксагліптин, в кількості, що знаходиться в межах інтервалу від приблизно 0.1 до приблизно 70 % (мас.) і переважно від приблизно 1 до приблизно 50 % (мас.) ядра таблетки. Ядро таблетки, яке використовують в таблетці з покриттям за винаходом, переважно містить a) щонайменше один агент для збільшення маси або наповнювач; b) необов'язково щонайменше один зв'язувальний агент; c) необов'язково щонайменше один дезінтегрант; та d) переважно, але необов'язково щонайменше один змащувальний агент; де а) кількість агента для збільшення маси або наповнювача знаходиться в межах інтервалу від приблизно 1 до приблизно 95 % (мас), переважно від приблизно 10 до приблизно 85 % (мас); b) кількість зв'язувального агента знаходиться в межах інтервалу від приблизно 0 до приблизно 20 % (мас), переважно від приблизно 1 до приблизно 10 % (мас); c) кількість дезінтегранта знаходиться в межах інтервалу від приблизно 0 до приблизно 20 % (мас), і переважно від приблизно 0.25 до приблизно 10 % (мас); і d) кількість змащувального агента знаходиться в межах інтервалу від приблизно 0 до приблизно 5 % (мас), переважно від приблизно 0.2 до приблизно 2 % (мас), причому всі наведені вище значення % (мас), базуються на масі ядра таблетки. Переважно, агенти для збільшення маси являють собою мікрокристалічну целюлозу і лактози моногідрат; дезінтегрант являє собою натрій кроскармелозу; і змащувальний агент являє собою магнію стеарат. Ядра таблетки, присутні в таблетках з покриттям за даним винаходом, можуть бути виготовлені за допомогою різноманітних процесів і порядку додавання допоміжних речовин. Корисність вказаних препаратів не обмежується конкретною лікарською формою або виробничим процесом. Ядра таблетки можуть вироблятися шляхом вологої грануляції, сухої грануляції, прямого змішування або будь-якого іншого фармацевтично прийнятного процесу. У відповідності до даного винаходу, пропонується переважний спосіб виготовлення ядер таблеток, які використовують в таблетках з покриттям за винаходом, що включає стадії змішування однієї або більше допоміжних речовин, наприклад, 88168 10 агента для збільшення маси, необов'язково зв'язувального агента і необов'язково дезінтегранта. Переважно до суміші додають змащувальний агент, щоб полегшити формування таблетки. Кількість агентів для збільшення маси або наповнювачів в композиціях ядра таблетки за винаходом знаходиться в межах інтервалу від приблизно 1 до приблизно 95 % (мас.) і переважно від приблизно 10 до приблизно 85 % (мас.) по відношенню до складу ядра. Приклади агентів для збільшення маси або заповнювачів, придатних для використання у відповідності до даного опису, включають, не обмежуючись ними, похідні целюлози, наприклад, мікрокристалічну целюлозу або целюлозу деревини, лактозу, сахарозу, крохмаль, прежелатинізований крохмаль, глюкозу, маніт, фруктозу, ксиліт, сорбіт, крохмаль кукурудзяний, модифікований кукурудзяний крохмаль, неорганічні солі, наприклад, карбонат кальцію, фосфат кальцію, фосфат дикальцію, сульфат кальцію, декстрин/декстрати, мальтодекстрин, цукри, що піддаються пресуванню, а також інші відомі агенти для збільшення маси або наповнювачі, та/або суміші двох або більше з вказаних компонентів, переважно, мікрокристалічної целюлози. Зв'язувальний агент необов'язково присутній в фармацевтичних композиціях за винаходом в кількості від приблизно 0 до приблизно 20 % маси, переважно від приблизно 1 до приблизно 10 % (мас.) маси ядра. Приклади зв'язувальних агентів, придатних для використання у відповідності до даного опису, включають, не обмежуючись ними, гідроксипропілцелюлозу, крохмаль кукурудзяний, крохмаль прежелатинізований, модифікований кукурудзяний крохмаль, полівінілпіролідон (ПВП) (молекулярна маса від приблизно 5 000 до приблизно 1 000 000, переважно приблизно 40000), гідроксипропілметилцелюлозу (ГПМЦ), лактозу, акацієву камедь, етилцелюлозу, ацетат целюлози, а також восковий зв'язувальний агент, наприклад, віск карнаубський, парафін, спермацет,поліетилени або віск мікрокристалічний, а також інший традиційний зв'язувальний агент та/або суміш двох або більше з вказаних компонентів, переважно, гідроксипропіл целюлозу. Дезінтегрант необов'язково міститься у фармацевтичній композиції за винаходом в кількості від приблизно 0 до приблизно 20 % (мас), переважно від приблизно 0,25 до приблизно 10 % (мас.) по відношенню до складу ядра. Приклади дезінтегрантів, придатних для використання в даному описі, включають, не обмежуючись ними, натрій кроскармелозу, кросповідон, крохмаль, крохмаль картопляний, крохмаль прежелатинізований, крохмаль кукурудзяний, натрій крохмаль гліколят, мікрокристалічну целюлозу з низьким ступенем заміщення, гідроксипропілцелюлозу або інший відомий дезінтегрант, переважно, натрій кроскармелозу. Оптимально у фармацевтичній композиції за винаходом буде присутній змащувальний агент в кількості від приблизно 0,1 до приблизно 5 % (мас), переважно від приблизно 0,2 до приблизно 2 % (мас) по відношенню до складу ядра. Приклади змащувальних агентів для таблетування, при 11 88168 датних для використання в даному описі, включають, не обмежуючись ними, стеарат магнію, стеарат цинку, стеарат кальцію, тальк, карнаубський віск, стеаринову кислоту, пальмітинову кислоту, натрію стеарилфумарат або гідрогенізовані масла та жири, або інші відомі змащувальні агенти для таблетування, та/або суміші двох або більше з вказаних компонентів, переважно, стеарат магнію. Внутрішній ізолювальний шар покриття препарату (також має назву першого шару покриття) буде включати до 95 % полімеру, на базі маси внутрішнього ізолювального шару покриття і може бути виготовлений, як описано вище. Рецептура буде включати найменше один покривальний полімер і розчинник покриття, як викладено вище, що переважно являє собою воду, яка використовується для обробки і видаляється в процесі сушіння. Полімер шару покриття може являти собою гідроксипропілметилцелюлозу, полівініловий спирт (ПВС), етилцелюлозу, метакрилові полімери або гідроксипропілцелюлозу, переважно ПВС. Шар покриття також може необов'язково включати пластифікатор, наприклад, триацетин, діетилфталат, трибутилсебацат або поліетиленгліколь (ПЕГ), переважно ПЕГ; та засіб проти злипання або агент для полегшення ковзання, наприклад, тальк, колоїдний кремнію діоксид або магнію стеарат, агент для надання непрозорості, наприклад, двоокис титана. Шар покриття також може включати барвники на базі заліза оксиду. Матеріал покриття є комерційно доступним під торговою назвою Опадрі® HP або Опадрі® II білий. Рецептура другого шару покриття переважно буде подібною за складом до рецептури першого шару покриття, хоча вона буде включати лікарський засіб, переважно інгібітор DPP4, в кількості від приблизно 0.5 до приблизно 70 %, переважно від приблизно 30 до приблизно 50 % (мас), на базі маси другого шару покриття. Третій зовнішній захисний шар покриття переважно буде мати склад, подібний до першого шару покриття. Четвертий шар покриття, якщо він присутній, переважно буде мати склад, подібний до третього зовнішнього захисного шару покриття і за бажанням буде включати барвник, наприклад, в кількості Матеріал таблетки плацебо Агент для збільшення маси Лактоза Мікрокристалічна целюлоза Дезінтегрант Натрій кроскармелоза Змащувальний агент Магнію стеарат 12 від приблизно 0.5 до приблизно 5.0 % на базі маси четвертого шару покриття. Внутрішній ізолювальний шар покриття, переважно буде утворений з шару покривального полімеру в кількості від приблизно 10 до приблизно 95 %, переважно від приблизно 20 до приблизно 90 % (мас), внутрішнього ізолювального шару покриття, необов'язково пластифікатора в кількості від приблизно 10 до приблизно 30 %, переважно від приблизно 15 до приблизно 20 % (мас.) шару покриття, та засобу проти злипання або агента для полегшення ковзання в кількості від приблизно 15 до приблизно 30 %, переважно від приблизно 10 до приблизно 15 % маси внутрішнього шару ізоляційного покриття. Другий шар покриття переважно буде утворений з шару покривального полімеру в кількості від приблизно 30 до приблизно 99,5 %, переважно від приблизно 40 до приблизно 60 % (мас.) другого шару покриття, та лікарського засобу в кількості від приблизно 0,25 % до приблизно 70 %, переважно від приблизно 20 до приблизно 50 % (мас.) другого шару покриття. Полімер шару покриття в другому шарі покриття буде присутній в кількості щонайменше приблизно 5 мг при масі ядра таблетки 200 мг, і лікарський засіб буде присутній в кількості щонайменше приблизно 0,5 мг. Третій зовнішній захисний шар покриття переважно буде мати склад, подібний до складу першого шару покриття. Внутрішній ізолювальний шару покриття буде присутній в кількості від приблизно 1 до приблизно 5 %, переважно від приблизно 1 до приблизно 3 % (мас.) від кінцевої маси таблетки з покриттям; другий шар (містить лікарський засіб) покриття буде присутній в кількості від приблизно 0,25 до приблизно 70 %, переважно від приблизно 1 до приблизно 50 % (мас.) від кінцевої маси таблетки з покриттям, в залежності від дозування; та кількість третього зовнішнього захисного шару покриття і четвертого шару, якщо вони присутні, для кожного буде становити від приблизно 1 до приблизно 10 %, переважно від приблизно 1 до приблизно 5 % (мас.) від кінцевої маси таблетки з покриттям. Переважні препарати у вигляді таблетки з покриттям відповідно до винаходу описані нижче. Можливий інтервал %/мг (мас.) по відношенню до ядра таблетки плацебо 200мг 2-95%/4-190 мг 0-95%/0-190 мг 0-95%/0-190 мг 0-20 %/ 0-40 мг 0-20 %/ 0-40 мг 0,1-5%/0,2-10 мг 0,1-5%/0,2-10 мг Переважний інтервал %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг 10-85 %/20-170 мг 20-75%/40-150 мг 20-75%/40-150 мг 0,25-10%/0,5-20 мг 2-10%/4-20 мг 0,2-2 %/ 0,4-4 мг 0,2-2 %/ 0,4-4 мг 13 88168 14 Перший внутрішній ізолюваль- %/мг (мас.) по відношенню до яд- %/мг (мас.) по відношенню до ядний шар покриття ра таблетки плацебо 200 мг ра таблетки плацебо 200 мг Покривальний полімер та, необов'язково, пластифікатор і 0,5-50 %/1 -100 мг 1-3%/2-6 мг агенти для полегшення ковзання Другий шар покриття Інгібітор DPP4 (вільна основа або гідрохлорид) Покривальний полімер та, необов'язково, пластифікатор і агенти для полегшення ковзання %/мг (мас.) по відношенню до яд- %/мг (мас.) по відношенню до ядра таблетки плацебо 200 мг ра таблетки плацебо 200 мг 0,1-70%/0,2-140 мг 1-50%/2-100 мг 1-70%/2-140 мг 1-50%/2-100 мг Третій зовнішній захисний шар %/мг (мас.) по відношенню до яд- %/мг (мас.) по відношенню до ядпокриття ра таблетки плацебо 200 мг ра таблетки плацебо 200 мг Покривальний полімер та, необов'язково, пластифікатор, 0,5-50 %/1-100 мг 1-5%/2-10 мг агенти для полегшення ковзання і барвник Наступний робочий Приклад представляє переважний варіант винаходу. ПРИКЛАД Ядро таблетки Лактози моногідрат (Національний формуляр) Целюлоза мікрокристалічна (Національний формуляр) Натрій кроскармелоза (Національний формуляр) Магнію стеарат (Національний формуляр) Загалом: Внутрішній ізолювальний шар покриття Опадрі® HP, який містить наступні інгредієнти Полівініловий спирт 40 % ПЕГ 20 % Тальк 15 % Титана діоксид 25 % Середній шар Інгібітор DPP4, саксагліптин Опадрі® HP Зовнішній захисний шар Опадрі® HP 500 г ядер таблеток були виготовлені, як вказано нижче. Моногідрат лактози, натрій кроскармелозу і мікрокристалічну целюлозу змішували в планетарному міксері. Суміш далі змащували, змішуючи з попередньо просіяним магнію стеаратом, з використанням міксера Turbula. Змащену суміш пресували з використанням пресу з одним робочим положенням або з використанням ротаційної машини в таблетки плацебо по 200 мг. Внутрішній ізолювальний шар покриття Партія розміром 500 г таблеток з покриттям, які містили 2.5 мг DPP4, наступного складу була виготовлена, як описано нижче Маса (мг) % (мас.) по відношенню до ядра таблетки плацебо 200 мг 99 мг (49,5 %) 90 мг (45 %) 10мг(5%) 1 мг (0,5 %) 200 мг (100,0%) 4 мг (2 %) 2,5 мг (1,25%) 20мг(10%) 4 мг (2 %) Суспензію внутрішнього ізолювального шару покриття готували, як вказано нижче. 0,1 н НСІ (приблизно 226,7 г) в металевому контейнері безперервно перемішували за допомогою розбалансувального (lightening) міксера. 40 г порошку Опадрі® HP швидко додавали у лійку. Після того, як додавання порошку було завершене, продовжували перемішування при низькій швидкості, до одержання візуально однорідної суміші. Вимірювали рН одержаної суспензії і доводили рН до 2 з використанням концентрованої НСІ або NaOH. 15 Встановлювали наступні параметри апарату для нанесення покриття Glatt. Параметри апарату для нанесення покриття Glatt Швидкість насоса 3,5-5 мл/хв Швидкість бака 20 об./хв Тиск повітря 1,5 бар Температура вхідного повітря 50 °С Температура виснаженого вхідного приблизно 38 °С Швидкість потоку повітря 80 м3/год Дистанція від гармати до шару 6,5 дюйм Розмір насадки 0,8 мм Ядра таблетки попередньо підігрівали в баку для нанесення покриття протягом приблизно 10-15 хвилин. 30 нагрітих таблеток зважували. Сушіння таблеток продовжували, поки з таблетки виходила волога, до тих пір, поки маса таблетки ставала константою. Кінцева маса 30 таблеток була спроектована як А. 30 таблеток покривали суспензією внутрішнього ізолювального шару покриття, виготовленою, як описано вище, з використанням апарату для нанесення покриття Glatt. 30 таблеток зважували 10 хвилин (та реєстрували масу), поки маса таблетки не досягла цільового значення (Рівняння 1). Таблетки з покриттям сушили нагріванням до тих пір, поки маса таблетки не ставала постійною. Кінцеву масу таблетки з нанесеним таким чином покриттям, позначали як В. Рівняння 1: Цільова маса = А х 1,02 = В Середній шар покриття (лікарський засіб) Суспензію середнього шару покриття, що містить лікарський засіб, готували, як вказано нижче. 12,5 г інгібітора DPP4 (вільна основа) додавали до 1000 мл 0,1 н НСІ в металевому контейнері. Вимірювали рН і доводили значення рН до 2. НСІ безперервно перемішували і 100 г Опадрі® HP швидко додавали у лійку. Далі суміш перемішували при низькій швидкості до тих пір, поки суміш не ставала візуально однорідною. рН суспензії підтримували на рівні 2 з використанням концентрованої НСІ, або 1 н НСІ, в міру необхідності. На ядра таблеток з нанесеним ізолювальним покриттям, виготовлені, як описано вище, наносили покриття з покривальної суспензії, що містила інгібітор DPP4, виготовленої, як описано вище, з використанням апарату для нанесення покриття Glatt. 30 таблеток з нанесеним ізоляційним шаром покриття зважували, спочатку кожні 30 хвилин, 88168 16 потім кожні 15 хвилини та реєстрували масу, до тих пір, поки не була досягнута цільова маса (Рівняння 2). Таблетки з нанесеним таким чином покриттям сушили нагріванням до тих пір, поки маса таблетки не ставала постійною. Кінцеву маса 30 таблеток позначали як С. Рівняння 2: Цільова маса = = В + 30 х (2,925 (еквівалент до 2,5 мг вільної основи) + 20 мг) = = В + 687,75 мг =С Кількість лікарського засобу, нанесеного в складі покриття на таблетки, визначали з використанням ВЕРХ, оптоволоконного аналізу, ІЧспектрометрії у найближчій області або інших придатних засобів. Процес нанесення покриття зупиняли, якщо цільова кількість лікарського засобу була нанесена. Зовнішній захисний шар покриття Таблетки з нанесеним таким чином покриттям далі покривали суспензією Опадрі® HP, яку використовували для утворення внутрішнього ізолювального шару покриття. 30 таблеток зважували кожні 10 хвилин і реєстрували масу до тих пір, поки маса таблетки не досягала цільового значення (Рівняння 3). Таблетки сушили нагріванням до тих пір, поки маса таблетки не ставала постійною. Кінцеву маса 30 таблеток позначали як D. Рівняння 3: Цільова маса = С + 30 х 4 мг = С + 120 мг = D Таблетки з нанесеним таким чином покриттям переносили в придатний контейнер. Виготовлені таким чином таблетки за винаходом мали більш високу стабільність в порівнянні з традиційними препаратами у вигляді таблеток (де лікарський засіб знаходиться в ядрі) і препаратами у вигляді капсул. Одержані вище таблетки з покриттям за винаходом, що містили 2,5 мг лікарського засобу, зберігали в різних умовах зберігання до 41 тижня включно і збирали дані стабільності, які стосувалися присутності продукту розкладу циклічного амідину (переважно цис-циклічного амідину (ЦисЦА)). Як показано в Таблиці 1 нижче, Цис-ЦА не був виявлений при зберіганні в умовах 25°С/60% відносної вологості. Рівні Цис-ЦА становили 0,22% і 0,32% при зберіганні в умовах 30°С/60% відносної вологості та умовах 40°С/75% відносної вологості, відповідно. Вказані рівні є значно нижчими за ті, які спостерігали для препаратів у формі капсул, що містили 5 мг і 20 мг лікарського засобу (наведені в Таблиці 2). 17 Комп’ютерна верстка І.Скворцова 88168 Підписне 18 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюCoated tablet formulation comprising saxaglipitin and method for forming thereof
Автори англійськоюDesai Divyakant, Li Bing V.
Назва патенту російськоюПрепарат в виде таблетки саксаглиптина с покрытием и способ его изготовления
Автори російськоюДесаи Дивякант, Ли Бинг В.
МПК / Мітки
МПК: A61K 31/403, A61P 3/10, A61K 9/24
Мітки: вигляді, виготовлення, спосіб, таблетки, саксагліптину, покриттям, препарат
Код посилання
<a href="https://ua.patents.su/9-88168-preparat-u-viglyadi-tabletki-saksagliptinu-z-pokrittyam-i-sposib-jjogo-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Препарат у вигляді таблетки саксагліптину з покриттям і спосіб його виготовлення</a>
Попередній патент: Пристрій для ін’єкцій
Наступний патент: Застосування пептидних сполук для лікування невропатичного болю, пов’язаного з трійчастим нервом
Випадковий патент: Спосіб сухого гасіння коксу












