Спосіб одержання ароматичних амінів у присутності комплексу паладію, що включає фероценілбіфосфіновий ліганд
Формула / Реферат
1. Спосіб одержання сполук формули І
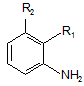 , (І)
, (І)
де
група R1 є групою А1
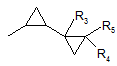 , А1
, А1
де групи R3, R4 і R5 є кожна воднем; і група R2 є воднем; в якому сполуку формули II
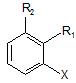 , (ІІ)
, (ІІ)
де групи R1 і R2 визначені, як зазначено для формули І, і X є хлором, піддають взаємодії з аміаком у присутності основи і каталітичної кількості щонайменше однієї комплексної сполуки паладію, де комплексна сполука паладію включає щонайменше один фероценілбіфосфіновий ліганд.
2. Спосіб за п. 1, де комплексна сполука паладію включає щонайменше один ліганд, вибраний із R(-)-ди-трет-бутил[l-[(S)-2-(дициклогексилфосфініл)фероценіл]етил]фосфіну і рацемічного ди-трет-бутил[1-[2-(дициклогексилфосфініл)фероценіл]етил]фосфіну.
3. Спосіб за п. 1, де комплексна сполука паладію включає рацемічний ди-трет-бутил-[1-[2-(дициклогексилфосфініл)фероценіл]етил]фосфін.
4. Спосіб за п. 1, де комплексну сполуку паладію використовують при співвідношенні від 1:10000 до 1:10 відносно сполуки формули II.
5. Спосіб за п. 1, де сполуку формули II використовують при концентрації від 0,01 М до 5 М.
Текст
1. Спосіб одержання сполук формули І R2 2 3 одержанні фунгіцидів, таких як описані, наприклад, у патентному документі WO 04/035589. Хімічні препарати для сільського господарства звичайно виробляють у великих кількостях. Наприклад, виробництво фунгіциду хлорталонілу склало у 2005 році більше ніж 23000 метричних тонн. У загальних рисах, аніліни зі стерично менш жорсткими орто-замісниками, такі як ортотоліламін, можуть бути одержані взаємодією галогенбензолів з аміаком за допомогою каталізованих паладієм реакцій крос-поєднання, описаних у публікації Journal of the American Chemical Society, 128, 10028-10029, 2006. Але успішне застосування паладійвмісних каталізаторів за одностадійного амінування більш стерично утруднених галогенбензолів, таких як орто-біциклопропілзаміщених галогенбензолів, 5-галогенбензонорборненів або 5галогенбензонор-борнадієнів, описане не було. Згідно з патентним документом WO 03/074491, орто-біциклопропілзаміщені первинні аніліни можуть бути одержані взаємодією відповідних ортобіциклопропілзаміщених галогенбензолів у результаті двостадійного хімічного перетворення спочатку за каталізованою паладієм (II) реакцією з бензофеноніміном і потім взаємодією продуктів реакції з гідрохлоридом гідроксиламіну та ацетатом натрію або з кислотами, наприклад, хлористоводневою кислотою. Однак така методика одержання первинних анілінів є незручною при великомасштабному виробництві орто 94764 4 біциклопропілзаміщених первинних анілінів, внаслідок необхідності проведення другої стадії і відносно високої ціни бензофеноніміну. Крім того, в патентному документі WO 03/074491 методика описана виключно для бром- або йодбензолів, але не для хлорбензолів. Було виявлено, що методика, описана в патентному документі WO 03/074491, мало підходить для імінування з високими виходами менш реакційноздатних, але більш дешевих 2-(2-хлорфеніл)біциклопропанів. У патентному документі WO 06/061226 розкрите та описане успішне одностадійне амінування стерично утруднених ортобіциклопропілзаміщених галогенбензолів при використанні мідьвмісних каталізаторів. Така методика одержання первинних анілінів не є прийнятною для великомасштабного виробництва ортоалкілзаміщених первинних анілінів внаслідок високої вартості видалення і переробки відходів солі міді. Крім того, було виявлено, що описана в патентному документі WO 06/061226 методика погано підходить для амінування з високими виходами менш реакційноздатних, але більш дешевих 2-(2хлор-феніл)біциклопропанів. У патентному документі WO 04/035589 описані різні 5-аміно-бензонорборнени або 5-амінобензонорборнадієни, способи їхнього одержання та їхнє застосування як проміжних сполук при одержанні мікробіоцидів. Згідно з патентним документом WO 04/035589, ці аміни можуть бути одержані, як показано на схемі 1 нижче. Схема 1 У синтезі, показаному на схемі 1, 3нітробензол, що утворюється з 6-нітроантранілової кислоти (А), взаємодіє з циклічним 1,4-дієном (В), таким як 5-ізопропілциклопентадієн, з утворенням 5-нітробензонорборнадієну (С) за реакцією ДільсаАльдера. За стандартних умов каталітичного відновлення (наприклад, використання нікелю Ренея або паладію на вугіллі в розчиннику, такому як метанол), відновлюються і 5-нітрогрупа, і 2,3подвійний зв'язок 5-нітробензонорборнадієну (С) з утворенням 5-аміно-бензонорборнену (D). За м'яких умов каталітичного відновлення (наприклад, використання металічного цинку в присутності хлористого амонію або амальгами алюмінію), утворюються амінобензонорборнадієни (Е). Прикладом сполуки (D) є 5-аміно-9ізопропілбензонорборнен, який є попередником аміду, наприклад, аміду 3-дифторметил-1-метил1Н-піразол-4-карбонової кислоти. Недоліком синтезу, показаного на схемі 1, є утворення ряду небажаних ізомерних домішок. Наприклад, при одержанні за реакцією Дільса4 5 Альдера 5-нітробензонорборнадієну (С), де R , R , 6 7 R і R усі є Н, і Y є СН-ізопропілом, утворюються такі регіоізомери: 5 94764 Нажаль, необхідний ізомер С1 утворюється з відносно низьким виходом. Хоча небажані ізомери можуть бути видалені або в кінці реакції ДільсаАльдера, або на більш пізній стадії за допомогою традиційних методів, таких як фракційна кристалізація або фракційна дистиляція, або за допомогою хроматографічних методів, цей синтетичний підхід не придатний у належній мірі для великомасштабного виробництва. Відповідно, завданням даного винаходу є розробка нового способу одержання ортобіциклопропіл- або орто-С6-С7алкілзаміщених первинних анілінів, 5-амінобензонорборненів і 5амінобензонорборнадієнів, який позбавлений від згаданих вище недоліків відомого способу і дозволяє одержувати ці сполуки за економічно доцільних витрат і легко керованим методом із високими виходами та з високою якістю. Відповідно, даний винахід стосується способу одержання сполук формули І де R1 є 1,3-диметилбутилом, триметилбутилом або групою А1 1,3,3 де R3, R4 і R5 кожна незалежно одна від одної є воднем або С1-С4алкілом; і R2 є воднем; або R1 і R2 разом утворюють групу А2 6 де R6 і R7 кожна незалежно одна від одної є воднем або С1-С4алкілом; або R1 і R2 разом утворюють групу А3 де R8 і R9 кожна незалежно одна від одної є воднем або С1-С4алкілом; де сполука формули II де R1 і R2 визначені для формули І, і X є бромом або хлором, взаємодіє з аміаком у присутності основи і каталітичної кількості щонайменше однієї комплексної сполуки паладію, де комплексна сполука паладію включає щонайменше один фероценілбіфосфіновий ліганд. Сполуки формули І знаходяться у різних стереоізомерних формах. Спосіб згідно з винаходом включає одержання зазначених індивідуальних стереоізомерних форм і одержання сумішей зазначених стереоізомерних форм у будь-якому співвідношенні. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 є групою А1, де R3, R4 і R5 кожна незалежно одна від одної є воднем або С1-С4алкілом; і R2 є воднем; або R1 і R2 разом утворюють групу А2, де R6 і R7 кожна незалежно одна від одної є воднем або С1-С4алкілом; або R1 і R2 разом утворюють групу А3, де R8 і R9 кожна незалежно одна від одної є воднем або С1-С4алкілом. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 є A1, R3 є воднем або С1-С4алкілом і R2, R4 і R5 є воднем. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 є А1, R3 є воднем або метилом і R2, R4 і R5 є воднем. 7 Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули ІА Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 є 1,3-диметилбутилом і R2 є воднем. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 є 1,3,3-триметилбутилом і R2 є воднем. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 і R2 разом утворюють групу А2, де R6 і R7 кожна незалежно одна від одної є воднем або С1С4алкілом. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 і R2 разом утворюють групу А2, де R6 і R7 кожна є метилом. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 і R2 разом утворюють групу А3, де R8 і R9 кожна незалежно одна від одної є воднем або С1С4алкілом. Переважно, щоб спосіб згідно з винаходом застосовувався для одержання сполук формули І, де R1 і R2 разом утворюють групу А3, де R8 і R9 кожна є метилом. Переважно, щоб у способі згідно з винаходом застосовувалися сполуки формули II, де X є бромом. Переважно, щоб у способі згідно з винаходом застосовувалися сполуки формули II, де X є хлором. У способі згідно з винаходом сполуки формули II звичайно можуть бути використані в концентраціях від 0,01 М до 5 М. Більш переважно, щоб сполуки формули II використовувалися в концентраціях від 0,1 М до 5 М. Найбільш переважно, щоб сполуки формули І використовувалися в концентраціях від 0,1 М до 2 М. Можливість використання високих концентрацій сполуки формули II є важливою перевагою способу згідно з винаходом, оскільки при високих концентраціях речовини, яку виділяють, потрібно менше розчинника, що робить спосіб згідно з винаходом особливо придатним для великомасштабного виробництва. Комплексні сполуки паладію, які використовують у способі згідно з винаходом, утворюються з попередника паладію і щонайменше одного фероценілбіфосфінового ліганду. Переважно, щоб у способі згідно з винаходом комплексні сполуки паладію були присутніми в розчиненій формі у вигляді комплексів паладій-ліганд. Комплексні сполуки паладію в способі згідно з винаходом можуть бути використані у вигляді вже утворених комплексних сполук паладію, або вони утворюються in situ в способі згідно з винаходом. При утворенні комплексних сполук паладію попередник паладію взаємодіє щонайменше з одним фероценілбіфосфіновим лігандом. У випадку неповної взаємодії може мати місце ситуація, коли 94764 8 незначні кількості попередника паладію або ліганду не розчиняються в реакційній суміші. Придатними попередниками паладію є ацетат паладію, дихлорид паладію, розчин дихлориду паладію, паладій2 (дибензиліден-ацетон)3 або паладій (дибензиліден-ацетон)2, паладій тетракис(трифенілфосфін), паладій на вугіллі, паладій дихлорбіс(бензонітрил), паладій (трис-третбутилфосфін)2 або суміш паладій2 (дибензиліденацетон)3 і паладій (трис-трет-бутилфосфін)2. Фероценілбіфосфінові ліганди є бідентатними третинними фосфіновими лігандами, що звичайно використовуються в реакціях, каталізованих паладієм. Такі бідентатні ліганди займають два координаційних місця і тому здатні утворювати хелати зі сполуками паладію. Придатними фероценілбіфосфіновими лігандами є: (R)-(-)-1-[(S)-2(дициклогексилфосфіно)фероценіл]етилди-третбутилфосфін 1,1-біс(дифенілфосфіно)фероцен (dppf), 1,1біс(ди-трет-бутилфосфіно)фероцен, (R)-(-)-1-[(S)2(біс(4трифторметилфеніл)фосфіно)фероценіл]етилдитрет-бутилфосфін, (R)-(-)-1-[(S)-2-(ди(3,5-бicтрифторметилфеніл)фосфіно)фероценіл]етилдициклогексилфосфін , (R)-(-)-1-[(S)-2-(ди(3,5-біс-трифторметилфеніл)фосфіно)фероценіл]етилди(3,5диметилфеніл)фосфін, (R)-(-)-1-[(S)-2(дициклогексилфосфіно)фероценіл]етилдициклогексилфосфін, (S)-(+)-1[(R)-2(дициклогексилфосфіно)фероценіл]етилдициклогексилфосфін, (S)-(+)-1[(R)-2(дициклогексилфосфіно)фероценіл]етилдифенілфосфін, (R)-(-)-1-[(S)-2(бic(3,5-диметил-4метоксифеніл)фосфіно)фероценіл]етилдициклогексилфосфін , (S)-(+)-1-[(R)-2-(дифурилфосфіно)фероценіл]етилди-3,5ксилілфосфін, (R)-(-)-1-[(S)-2(дифенілфосфіно)фероценіл]-етил-ди-третбутилфосфін, (S)-(+)-1-[(R)-2(дифенілфосфіно)фероценіл]етилди-третбутилфосфін, (R)-(-)-1-[(S)-2(дифенілфосфіно)фероценіл]етилдициклогексилфосфін, (R)-(+)-1[(R)-2(дифенілфосфіно)фероценіл]етилдициклогексилфосфін, (S)-(+)-1[(R)-2(дифенілфосфіно)фероценіл]етилдициклогексилфосфін, (R)-(-)-1 9 [(S)-2(дициклогексилфосфіно)фероценіл]етилдифенілфосфін, (R)-(-)-1-[(S)-2(дифеніл)фосфіно)фероценіл]етилди(3,5диметилфеніл)фосфін, (R)-(-)-1-[(S)-2-(ди-третбутилфосфіно)фероценіл]етилди-о-толілфосфін (R)-(-)-1-[(S)-2-(бic(3,5-димeтил-4мeтoкcифeнiл)фocфінo)-фepoцeнiл]eтилди-третбутилфосфін (R)-(-)-1-[(S)-2(дieтилфocфiнo)фepoцeнiл]eтилди-тpeтбyтилфocфiн (R)-(-)-1-[(S)-2-(P-метил-Pізопропілфосфіно)фероценіл]етилдициклогексилфосфін (R)-(-)-1-[(S)-2-(P-мeтил-Pфeнiлфocфiнo)фepoцeнiл]eтил-ди-тpeтбутилфосфін та їхні рацемічні суміші, зокрема, рацемічні суміші 1-[2-(ди-третбутилфосфіно)фероценіл]етилди-о-толілфосфіну, 1-[2-(дициклогексилфосфіно)фероценіл]етилдитрет-бутилфосфіну і 1-[2(дифенілфосфіно)фероценіл]етилдициклогексилфосфіну. 94764 10 У способі згідно з винаходом може бути використана одна комплексна сполука паладію або суміш комплексних сполук паладію. При одержанні комплексної сполуки паладію перевага надається використанню як попередника паладію ацетату паладію, паладій2(дибензиліденацетону)3, паладій(дибензиліден-ацетону)2, розчину дихлориду паладію, дихлориду паладію або суміші паладій2(дибензиліден-ацетону)3 і паладій(трис-трет-бутилфосфіну)2. Особлива перевага надається використанню ацетату паладію або дихлориду паладію. Для утворення комплексної сполуки паладію використовують щонайменше один ліганд. Перевага надається використанню комплексних сполук паладію, які включають щонайменше один ліганд, вибраний із (R)-(-)-1-[(S)-2(дициклогексилфосфіно)фероценіл]етилди-третбутилфосфіну і рацемічного 1-[2(дициклогексилфосфіно)фероценіл]етилди-третбутилфосфіну. Перевага надається використанню комплексних сполук паладію, які включають рацемічний 1-[2(дициклогексилфосфіно)фероценіл]етилди-третбутил фосфін. У способі згідно з винаходом комплексні сполуки паладію, попередники паладію і/або ліганди використовують у каталітичних кількостях. Переважно, щоб комплексні сполуки паладію використовувалися при співвідношенні від 1:10 до 1:10000 відносно сполук формули II, особливо, при співвідношенні від 1:100 до 1:1000. Переважно, щоб попередники паладію використовувалися при співвідношенні від 1:10 до 1:10000 відносно сполук формули II, особливо при співвідношенні від 1:100 до 1:1000. Переважно, щоб ліганди використовувалися при співвідношенні від 1:10 до 1:10000 відносно сполук формули II, особливо, при співвідношенні від 1:100 до 1:1000. Придатними основами є, наприклад, алкоголяти, наприклад, трет-бутилат натрію, трет-бутилат калію, метилат натрію або етилат натрію, або неорганічні основи, такі як карбонати, наприклад, K2СО3, Na2CO3 або Cs2CO3, гідроксиди, наприклад, NaOH або KОН, фосфати, наприклад, K3РО4, або аміди, наприклад, LiNH2, NaNH2 або KNH2; в одному варіанті здійснення перевага надається алкоголятам, і особлива перевага надається третбутилату натрію; в іншому варіанті здійснення перевага надається амідам, і особлива перевага надається NaNH2, KNH2 або їхній суміші. Коли як основу використовують NaOH або KОН, може бути використаний каталізатор міжфазового перенесення, такий як, наприклад, цетилтриметиламоній бромід. Придатними кількостями основи для цієї реакції є, наприклад, від 1 до 3 еквівалентів, особливо від 1 до 2 еквівалентів. Реакція згідно з винаходом може бути проведена в інертному розчиннику. В одному варіанті здійснення винаходу реакцію згідно з винаходом проводять в інертному розчиннику. Придатними розчинниками є, наприклад, сполуки формули V 11 де R є С1-С6алкілом, переважно, метилом; диметоксіетан; трет-бутилметиловий ефір; тетрагідрофуран; діоксан; трет-бутанол; толуол; ксилол; анізол або триметилбензоли, такі як, наприклад, мезитилен; і також їхні суміші; переважними розчинниками є диметоксіетан, тетрагідрофуран або диглім. У такому варіанті здійснення, переважно, щоб інертний розчинник був безводним. Реакцію згідно з винаходом проводять при кімнатній температурі або при підвищеній температурі, переважно, в температурному інтервалі від 50°С до 180°С, зокрема, в температурному інтервалі від 50°С до 120°С. Реакцію згідно з винаходом звичайно проводять при підвищеному тиску. В одному варіанті здійснення реакцію згідно з винаходом проводять при тиску в інтервалі 1-100 бар, переважно, в інтервалі 5-80 бар. Час проведення реакції згідно з винаходом звичайно становить від 1 до 48 годин, переважно, від 4 до 30 годин, зокрема, від 4 до 18 годин. Реакція згідно з винаходом може бути проведена в атмосфері інертного газу. Наприклад, як інертний газ використовують азот або аргон. 94764 12 В одному варіанті здійснення реакції згідно з винаходом реакцію проводять в атмосфері азоту. У реакціях згідно з винаходом аміак використовують в еквімолярних кількостях або у надлишку відносно сполук формули II, переважно, аж до 500-кратного надлишку, зокрема, аж до 200кратного надлишку, більш конкретно, в інтервалі від 80-кратного до 120-кратного надлишку. В одному варіанті здійснення винаходу аміак використовують в інтервалі від 10-кратного до 30-кратного надлишку. У способі згідно з винаходом аміак може бути введений у реактор у рідкій формі або в газовій формі. Сполуки формули II, де X є бромом, R1 є групою А1 і R2 є воднем, добре відомі і можуть бути одержані відповідно до способів, описаних у патентному документі WO 03/074491. Сполуки формули II, де X є хлором, R1 є групою A1 і R2 є воднем, можуть бути одержані способом, аналогічним до способів, описаних у патентному документі WO 03/074491 для відповідних сполук формули II, де X є бромом, R1 є групою А1 і R2 є воднем. Наприклад, сполука формули II, де X є хлором, R1 є групою А1 і R2, R3, R4 і R5 є воднем (сполука номер В1), може бути одержана, як показано на схемі реакції 1 і як пояснено у прикладах А1-АЗ, які наведені далі: Схема 2 Приклад синтезу A1: Одержання 3-(2хлорфеніл)-1-циклопропіл-пропенону: 61 г 30% розчину гідроксиду натрію змішують із 350 мл води і 97,5 г (1,1 моль) циклопропілметилкетону і нагрівають до 90°С при перемішуванні. До одержаної суміші додають по краплях 143,5 г (1 моль) 2-хлорбензальдегіду і проводять перемішування протягом 5 годин. У процесі перемішування, після 2 годин і після додаткових 3 годин, у кожному випадку додають 2 мл циклопропілметилкетону. Після сумарного часу реакції 6 годин проводять охолодження до 50°С. Реакційну суміш фільтрують і фази розділяють. Органічну фазу концентрують. Одержують 188,6 г 3-(2-хлорфеніл)1-циклопропілпропенону у вигляді жовтого масла. 1 Н ЯМР (CDCl3): 0,95-1,04 (м, 2Н); 1,16-1,23 (м, 2Н); 2,29-2,37 (м, 1H); 6,83 (д, J=15 Гц); 7,27-7,35 (м, 2Н); 7,40-7,47 (м, 1H); 8,03 (д, J=15 Гц). Приклад синтезу A2: Одержання 5-(2хлорфеніл)-3-циклопропіл-4,5-дигідро-1H-піразолу: 250 г етанолу додають до 188,6 г 3-(2хлорфеніл)-1-циклопропілпропенону (1 моль), одержаного відповідно до прикладу А1. Додають по краплях 53 г (1,05 моль) гідрату гідразину при 20°С при перемішуванні. Реакційну суміш перемі шують при 70°С протягом 2 годин. Реакційну суміш потім охолоджують до 50°С. Додають суміш 5,5 г дигідрату щавлевої кислоти (0,044 моль) і 20 г етанолу, в результаті чого осаджується тверда речовина. Реакційну суміш охолоджують до 25°С і фільтрують через вакуум-фільтр із пористого скла та промивають 50 г етанолу. Одержують жовтий фільтрат, який концентрують шляхом випаровування у ротаційному випарнику при 60°С і тиску до 20 мілібар з одержанням жовтого масла. Одержують 201,5 г ізомерної суміші, що містить як основний компонент 5-(2-хлорфеніл)-3-циклопропіл-4,5дигідро-1Н-піразол у вигляді жовтого масла. Приклад синтезу A3: Синтез 2-(2хлорфеніл)біциклопропілу: До розчину 50 г (0,36 моль) карбонату калію в 600 г етиленгліколю додають при 190°С протягом 2 годин 201,5 г 5-(2-хлорфеніл)-3-циклопропіл-4,5дигідро-1H-піразолу, одержаного, як описано в прикладі А2. Потім проводять перемішування протягом 2 годин при 190°С. Ознакою закінчення реакції є припинення виділення газу. Реакційну суміш потім охолоджують до 100°С, у результаті чого відбувається розшарування фаз, і верхню фазу продукту відділяють. Одержують 158 г 2-(2 13 хлорфеніл)біциклопропілу у вигляді неочищеного продукту, який може бути додатково очищений, наприклад, ректифікацією. 1 Н ЯМР (CDCl3): 0,0-1,13 (м, 8Н); 1,95-2,02 (м, 0,63Н, транс-ізомер) і 2,14-2,22 (м, 0,37Н, цисізомер); 6,88-6,94 (м); 7,05-7,24 (м); 7,31-7,42 (м). Сполуки формули II, де X є бромом або хлором, і R1 і R2 разом утворюють групу А2 або А3, можуть бути одержані згідно зі способами, описаними в патентному документі WO 07/068417. Комплексні сполуки паладію, попередники паладію і ліганди, що використовуються в способі згідно з винаходом, добре відомі і, переважно, випускаються в промисловому масштабі. Далі даний винахід пояснюється більш детально за допомогою таких прикладів: Приклад Р1: Одержання 2бісциклопропіланіліну (співвідношення субстрат/каталізатор = 20:1) Суміш 385 мг 2-(2-хлорфеніл)біциклопропілу (2 ммоль, співвідношення транс/цис близько 3:2), 288 мг трет-бутоксиду (трет-бутилату) натрію (3 ммоль), 22,4 мг ацетату паладію (0,1 ммоль), 61 мг R-(-)-ди-трет-бутил-[1-[(S)-2(дициклогексилфосфаніл)-1фероценіл]етил]фосфіну (0,11 ммоль), 4 г газоподібного аміаку (0,235 моль) і 1,5 мл дигліму перемішували при підвищеному тиску в резервуарі високого тиску при 160°С протягом 18 годин (атмосфера аргону). Потім суміш розбавляли 20 мл етилацетату і фільтрували. Рідку фазу, що залишилася, концентрували при зниженому тиску, і неочищений матеріал очищали колонковою хроматографією на силікагелі (елюент: етилацетат/гептан 1:5). 0,26 г (75% від теоретичного) чистого 2-бісциклопропіланіліну одержували у вигляді злегка коричнюватої рідини (співвідношення транс/цис близько 1:1). Приклад Р2: Одержання 2бісциклопропіланіліну (співвідношення субстрат/каталізатор = 100:1) Суміш 385 мг 2-(2-хлорфеніл)біциклопропілу (2 ммоль, співвідношення транс/цис близько 3:2), 288 мг трет-бутоксиду натрію (3 ммоль), 4,5 мг ацетату паладію (0,02 ммоль), 12,2 мг R(-)-ди-третбутил[1-[(S)-2-(дициклогексилфосфаніл)-1фероценіл]етил]фосфіну (0,022 ммоль), 4 г газоподібного аміаку (0,235 моль) і 1,5 мл тетрагідрофурану перемішували при підвищеному тиску в резервуарі високого тиску при 120°С протягом 17 годин (атмосфера аргону). Вихід 2бісциклопропіланіліну визначали за допомогою газової хроматографії: 86% (сума ізомерів). Приклад Р3: Одержання 2бісциклопропіланіліну (співвідношення субстрат/каталізатор = 100:1) Суміш 385 мг 2-(2-хлорфеніл)біциклопропілу (2 ммоль, співвідношення транс/цис близько 3:2), 288 мг трет-бутоксиду натрію (3 ммоль), 4,5 мг ацетату паладію (0,02 ммоль), 12,2 мг R(-)-ди-третбутил-[1-[(S)-2-(дициклогексил-фосфаніл)-1фероценіл]етил]фосфіну (0,022 ммоль), 4 г газоподібного аміаку (0,235 моль) і 1,5 мл диметоксіетану перемішували при підвищеному тиску в резервуарі високого тиску при 120°С протягом 16 годин 94764 14 (атмосфера аргону). Вихід 2-бісциклопропіланіліну визначали за допомогою газової хроматографії: 80% (сума ізомерів). Приклад Р3: Одержання 2бісциклопропіланіліну (співвідношення субстрат/каталізатор = 500:1) Суміш 385 мг 2-(2-хлорфеніл)біциклопропілу (2 ммоль, співвідношення транс/цис близько 3:2), 288 мг трет-бутоксиду натрію (3 ммоль), 0,9 мг ацетату паладію (0,004 ммоль), 2,44 мг R(-)-дитрет-бутил-[1-[(S)-2-(дициклогексилфосфаніл)-1фероценіл]етил]-фосфіну (0,0044 ммоль), 4 г газоподібного аміаку (0,235 моль) і 1,5 мл диметоксіетану перемішували при підвищеному тиску в резервуарі високого тиску при 120°С протягом 16 годин (атмосфера аргону). Вихід 2-бісциклопропіланіліну визначали за допомогою газової хроматографії: 86% (сума ізомерів). Приклад Р4: Одержання 2бісциклопропіланіліну (співвідношення субстрат/каталізатор = 100:1) В атмосфері аргону 599 мг (1,1 ммоль) (R)-(-)1-[(S)-2(дициклогексилфосфіно)фероценіл]етилди-третбутил фосфіну і 160 мг (0,24 ммоль) ацетату паладію (тример) у 2 мл диметоксіетану перемішували протягом 30 хвилин при кімнатній температурі і протягом 1 хвилини при 50°С. В атмосфері аргону додавали каталітичну систему і 2 мл диметоксіетану до 20,8 г (95%, 0,11 моль) 2-(2хлорфеніл)біциклопропілу і 10,5 г (0,11 моль) третбутилату натрію в 30 мл диметоксіетану в автоклаві. Потім додавали 36 г (2,11 моль) аміаку (рідкого) і суспензію нагрівали до 119°С при тиску 61 бар. Після 18 годин реакційну масу охолоджували до кімнатної температури, продували двічі азотом і швидко охолоджували за допомогою 30 мл води. Реакційну масу фільтрували через гіперпотік, фільтр ополіскували ксилолом і водою, і водну фазу екстрагували тричі ксилолом. Органічні розчинники видаляли під вакуумом. Вміст 2бісциклопропіланіліну визначали за допомогою газової хроматографії: 78% (площа піка на хроматограмі), вихідний матеріал, що залишився: 4,97% (площа піка на хроматограмі). Крім того, виявляються 3,57% (площа піка на хроматограмі) димерного побічного продукту і 3,55% (площа піка на хроматограмі) дегалогенованого побічного продукту. Приклад Р5: Одержання 5-аміно-9ізопропілбензонорборнену, збагаченого синізомером (співвідношення субстрат/каталізатор = 100:1) Суміш 221 мг 5-хлор-9ізопропілбензонорборнену (1 ммоль, >98% синізомеру), 192 мг трет-бутоксиду натрію (2 ммоль), 2,25 мг ацетату паладію (0,01 ммоль), 6,1 мг R(-)ди-трет-бутил-[1-[(S)-2-(дициклогексилфосфаніл)1-фероценіл]етил]фосфіну (0,011 ммоль), 4 г газоподібного аміаку (0,235 моль) і 5 мл диметоксіетану перемішували при підвищеному тиску в резервуарі високого тиску при 100°С протягом 21 години (атмосфера аргону). Вихід 5-аміно-9ізопропілбензонорборнену визначали за допомо 15 гою газової ізомеру). 94764 хроматографії: 90% (>98% син 16 При здійсненні вищенаведених прикладів можуть бути одержані такі сполуки формули І: Таблиця 1 Сполуки формули І Сполука № А1 А2 А3 А4 А5 А6 R1 R2 R3 R4 R5 R6 R7 R8 R9 А1 А2 Н Н Н СН3 Н Н Н Н СН3 Н СН3 Н СН3 Н СН3 Н А2 А2 А2 А2 Нижченаведені сполуки формули II є придатними для використання в способі згідно з винаходом: Таблиця 2 Сполуки формули II Сполука № В1 В2 B3 В4 В5 В6 В7 В8 В9 В10 В11 B12 X R1 R2 R3 R4 R5 R6 R7 R8 R9 СІ СІ СІ СІ СІ СІ Вr Вr Вr Вr Вr Br Аl Аl Н Н Н СН3 н СН3 Н Н Н Н Н Н Н Н СН3 Н СН3 Н СН3 Н СН3 Н СН3 H СН3 H СН3 Н СН3 H А2 А2 А3 А3 А1 А1 Н Н А2 А2 А3 A3 У результаті створення даного винаходу можна амінувати орто-біциклопропілзаміщені галогенбензоли, 5-галогенбензонорборнени і 5галогенбензонорборнадієни з високими виходами і з низькими витратами. Вихідні сполуки способу даного винаходу відрізняються тим, що вони легко доступні і легко транспортуються і, крім того, вони є недорогими. У переважному варіанті здійснення способу згідно з винаходом паладій і/або комплексну сполуку паладію, використовувану в способі, піддають рециркуляції. Цей варіант здійснення є варіантом способу згідно з винаходом, який становить особливий інтерес з економічної точки зору. У переважному варіанті здійснення винаходу використовують сполуки формули II, де X є хлором. Вихідні сполуки цього переважного варіанту здійснення способу винаходу визнаються особливо легко доступними і дешевими. Однак, відомо, що за умов каталізованого паладієм кроспоєднання цей клас стерично утруднених нереакційноздатних вихідних сполук щонайменше субстратів орто-заміщених хлорбензолів, особливо важко амінувати внаслідок надзвичайно низької реакційної здатності групи хлору, що відходить, у 17 94764 порівнянні з субстратами бромбензолу. Оскільки даний варіант здійснення винаходу робить дані вихідні сполуки доступними для каталізованого паладієм крос-поєднання, цей варіант здійснення, Комп’ютерна верстка М. Ломалова 18 відповідно, є варіантом способу згідно з винаходом, який становить особливий інтерес з економічної точки зору. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of aromatic amines in the presence of palladium complex compound comprising ferrocenyl-biphosphine ligand
Автори англійськоюWalter Harald, Nettekoven, Ulrike
Назва патенту російськоюСпособ получения ароматических аминов в присутствии комплекса палладия, который включает ферроценилбифосфиновый лиганд
Автори російськоюВальтер Харальд, Неттекофен Ульрике
МПК / Мітки
МПК: C07C 209/10
Мітки: присутності, паладію, фероценілбіфосфіновий, ліганд, ароматичних, одержання, комплексу, спосіб, амінів, включає
Код посилання
<a href="https://ua.patents.su/9-94764-sposib-oderzhannya-aromatichnikh-aminiv-u-prisutnosti-kompleksu-paladiyu-shho-vklyuchaeh-ferocenilbifosfinovijj-ligand.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання ароматичних амінів у присутності комплексу паладію, що включає фероценілбіфосфіновий ліганд</a>
Попередній патент: Спосіб теплоізоляції шляхом напилення самозміцненого покриття на ізоляційні панелі будівлі
Наступний патент: Аніліди 4-r-2,3-діоксо-1,4-дигідропіразин-1-ілоцтових кислот, що проявляють протисудомну активність
Випадковий патент: Таксоїди, способи їх одержання та фармацевтична композиція, що їх містить












