Аніліди 4-r-2,3-діоксо-1,4-дигідропіразин-1-ілоцтових кислот, що проявляють протисудомну активність
Номер патенту: 94765
Опубліковано: 10.06.2011
Автори: Рибальченко Тетяна Леонідівна, Шиньова Надія Валеріївна, Перехода Ліна Олексіївна, Георгіянц Вікторія Акопівна
Формула / Реферат
Аніліди 4-R-2,3-діоксо-1,4-дигідропіразин-1-ілоцтових кислот загальної формули:
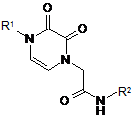 ,
,
де R1 = Bn або С6Н4-Сl(4), або С6Н5, або С6Н3-(СН3)2(3,5), або С6Н4-ОСН3(3), або С6Н3-(ОСН3)2(3,4);
R2 = C6H3-(OCH3)2 або С6Н4-ОСН3, або С6Н3-(ОСН3)2(2,4), або С6Н3-(ОСН3)2(3,5), або (СН2)2-С6Н5, або С6Н3-ОСН3(4)-Сl(5), або С6Н4-Вr, або С6Н3-(ОСН3)2(3,4),
які виявляють протисудомну активність.
Текст
Аніліди 4-R-2,3-діоксо-1,4-дигідропіразин-1ілоцтових кислот загальної формули: 2 3 94765 4 O R1 O R1 O N + NH H N Cl R2 O N N O O 1 2 Для отримання цільових продуктів синтезу до розчину відповідного 1-R-1,4-дигідропіразин-2,3діону в розчині диметилформаміду додавали безводний карбонат калію і відповідний амід хлороцтової кислоти. Вихідні аніліди (арилалкіламіди) хлороцтових кислот були попередньо отримані загальноприйнятою реакцією амідування галогенкарбонових кислот. Винахід ілюструється наступними прикладами: Приклад 1 Одержання заявленої сполуки аніліду 4-R-2,3діоксо-1,4-дигідропіразин-1-ілоцтової кислоти при 1 2 R = Bn, R = C6H3-(OCH3)2(3,4) (Сполука 1). До розчину 2,02 г (1 моль) 1-бензил-1,4дигідропіразин-2,3-діону в 5 мл диметилформаміду додають 0,4 г (3 моль) безводного карбонату калію та 1,2 моль 3,4-диметоксифеніламіду хлороцтової кислоти. Отриману суміш нагрівають при 90 °С впродовж 2 годин. Після охолодження додають 10 мл води та відфільтровують осад, який утворився. Продукт перекристалізовують з диметилформаміду. Вихід: 1,52 г (75 %), Тпл 168-170 °С, М.м. 395,4. Брутто-формула: C20H19N3O5. Розраховано: С 62,65 %, Н 5,52 %, N 10,96 %, О 20,86 %. Знайдено: С 62,59 %, Н 5,47 %, N 10,87 %, О 20,94 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,22, 1Н, с; 7,35-6,85, 8Н, м; 6,65, 2Н, м; 4,92 2Н, с; 4,55, 2Н, с; 3,62, 6Н, д. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н4-Сl(4), R = C6H4-OCH3(3), вихідними речовинами виступають 1хлорфеніл-1,4-дигідропіразин-2,3-діон та мметоксифеніламід хлороцтової кислоти (Сполука 2). Вихід: 1,58 г (71 %), Тпл 158-160 °С, М.м. 385,8. Брутто-формула: С19Н18СlN3O4. Розраховано: С 58,84 %, Н 4,68 %, N 10,83 %, О 16,50 %, Сl 9,14 %. Знайдено: С 58,79 %, Н 4,61 %, N 10,76 %, О 16,61 %, Сl 9,22 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,25, 1Н, с; 7,27, 7Н, м, 6,67, 3Н, м; 4,95 2Н, с; 4,55, 2Н, с; 3,72, 3Н, д. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н5, R = C6H3-(OCH3)2(2,4), вихідними речовинами виступають 1-феніл-1,4 N H 3 R2 . дигідропіразин-2,3-діон та 2,4-диметоксифеніламід хлороцтової кислоти (Сполука 3). Вихід: 1,47 г (78 %), Тпл 182-184 °С, М.м. 381,4. Брутто-формула: С20Н21N3О5. Розраховано: С 62,65 %, Н 5,52 %, N 10,96 %, О 20,86 %. Знайдено: С 62,58 %, Н 5,64 %, N 11,07 %, О 20,92 %. Спектр ПМР , м.ч., ДМСО-Д6: 9,42, 1Н, с; 7,677,45, 6Н, м; 4,65, 2Н, с; 6,67-6,42, 4Н, м; 3,82, 3Н, с; 3,72, 3Н, с. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н3-(СH3)2(3,5), R = С6Н3-(ОСН3)2(2,4), вихідними речовинами виступають 1-(3',5'диметилфеніл)-1,4-дигідропіразин-2,3-діон та 2,4диметоксифеніламід хлороцтової кислоти (Сполука 4). Вихід: 1,73 г (80 %), Тпл 96-98 °С, М.м. 409,5. Брутто-формула: C22H23N3О5. Розраховано: С 64,22 %, Н 6,12 %, N 10,21 %, О 19,44 %. Знайдено: С 64,18 %, Н 6,21 %, N 10,18 %, О 19,51 %. Спектр ПМР , м.ч., ДМСО-Д6: 9,48, 1Н, с, 7,326,51, 8Н, м; 4,58, 2Н, с; 2,28, 6Н, м; 2,27, 6Н, с. Згідно з наведеною схемою отримують 4-Н2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н3-(CH3)2(3,5), R = С6Н3-(ОСН3)2(3,5), вихідними речовинами виступають 1-(3',5'диметилфеніл)-1,4-дигідропіразин-2,3-діон та 3,5диметоксифеніламід хлороцтової кислоти (Сполука 5). Вихід: 1,62 г (75 %), Тпл 221-223 °С, М.м. 409,2. Брутто-формула: С22Н23N3O5. Розраховано: С 64,22 %, Н 6,12 %, N 10,21 %, О 19,44 %. Знайдено: С 64,18 %, Н 6,18 %, N 10,31 %, О 19,38 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,25, 1Н, с; 7,08, 3Н, д; 6,84-6,23, 5Н, м; 4,55 2Н, с; 3,72, 6Н, с; 2,28, 6Н, с. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н3-(СH3)2(3,5), R = С6Н3-(ОСН3)2(3,4), вихідними речовинами виступають 1-(3',5'диметилфеніл)-1,4-дигідропіразин-2,3-діон та 3,4диметоксифеніламід хлороцтової кислоти (Сполука 6). Вихід: 1,68 г (78 %), Тпл 198-200 °С, М.м. 409,2. Брутто-формула: C22H23N3O5. 5 Розраховано: С 64,22 %, Н 6,12 %, N 10,21 %, О 19,44 %. Знайдено: С 64,18 %, Н 6,21 %, N 10,15 %, О 19,38 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,15 1Н, с; 7,33-6,84, 6Н, м; 6,68, 2Н, м; 4,58 2Н, с; 3,68, 6Н, д; 2,28, 6Н, с. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н4-ОСН3(3), R = (CH2)2-C6H5, вихідними речовинами виступають 1-(3'-метоксифеніл)1,4-дигідропіразин-2,3-діон та метилбензиламід хлороцтової кислоти (Сполука 7). Вихід: 1,53 г (70 %), Тпл 202-204 °С, М.м. 379,2. Брутто-формула: С21Н21N3O4. Розраховано: С 66,13 %, Н 6,08 %, N 11,02 %, О 16,78 %. Знайдено: С 66,18 %, H 6,18 %, N 11,09 %, О 16,69 %. Спектр ПМР , м.ч., ДМСО-Д6: 8,28, 1Н, с; 7,486,98, 9Н, м; 6,58, 2Н, т; 4,38, 2Н, с; 3,72, 3Н, с; 3,35, 2Н, т, 2,71,2Н, т. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6H4-ОСН3(3), R = С6Н3-(ОСН3)2(3,5), вихідними речовинами виступають 1-(3'метоксифеніл)-1,4-дигідропіразин-2,3-діон та 3,5диметоксифеніламід хлороцтової кислоти (Сполука 8). Вихід: 1,68 г (77 %), Тпл 216-218 °С, М.м. 412,2. Брутто-формула: С21Н21N3O6. Розраховано: С 61,01 %, Н 5,61 %, N 10,16 %, О 23,22 %. Знайдено: С 61,09 %, Н 5,58 %, N 10,25 %, О 23,18 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,22, 1Н, с; 7,45-6,22, 9Н, м; 4,53, 2Н, с; 3,72, 3Н, с; 3,62, 6Н, д. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н4-ОСН3(3), R = С6Н3-(ОСН3)2(3,4), вихідними речовинами виступають 1-(3'метоксифеніл)-1,4-дигідропіразин-2,3-діон та 3,4диметоксифеніламід хлороцтової кислоти (Сполука 9). Вихід: 1,68 г (77 %), Тпл 198-200 °С, М.м. 412,2. Брутто-формула: С21Н21N3О6. Розраховано: С 61,01 %, Н 5,61 %, N 10,16 %, О 23,22 %. Знайдено: С 60,95 %, Н 5,71 %, N 10,25 %, О 23,18 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,15, 1Н, с; 7,42-6,88, 7Н, м; 6,73, 2Н, т; 4,58,2Н, с; 3,68, 9Н, д. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = C6H3-(OCH3)2(3,4), R = (CH2)2-C6H5, вихідними речовинами виступають 1-(3',4'диметоксифеніл)-1,4-дигідропіразин-2,3-діон та метилбензиламід хлороцтової кислоти (Сполука 10). Вихід: 1,81 г (73 %), Тпл 196-198 °С, М.м. 409,2. Брутто-формула: C22H23N3O5. Розраховано: С 64,22 %, Н 6,12 %, N 10,21 %, О 19,44 %. Знайдено: С 64,18 %, Н 6,18 %, N 10,31 %, О 19,34 %. 94765 6 Спектр ПМР , м.ч., ДМСО-Д6: 8,25, 1Н, с; 7,286,95, 8Н, м; 6,55, 2Н, т; 4,35, 2Н, с; 3,72, 6Н, д; 3,27, 2Н, с; 2,22, 2Н, т. Згідно з наведеною схемою отримують 4-Р2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = C6H3-(OCH3)2(3,4), R = С6Н3-ОСН3(4)Сl(5), вихідними речовинами виступають 1-(3',4'диметоксифеніл)-1,4-дигідропіразин-2,3-діон та 5хлор-4-метоксмфеніламід хлороцтової кислоти (Сполука 11). Вихід: 1,79 г (72 %), Тпл 208-210 °С, М.м. Брутто-формула: С21Н20С1N3О6. Розраховано: С 56,32 %, Н 4,95 %, N 9,38 %, О 21,43 %, Сl 7,92 %. Знайдено: С 56,38 %, Н 4,87 %, N 9,42 %, О 21,51 %, Сl 7,84 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,28, 1Н, с; 7,72-7,02, 6Н, м; 6,62, 2Н, м; 4,58,2Н, с; 3,78, 9Н, т. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н3-СО(СН3)2(3,4), R =C6H4-Вr(4), вихідними речовинами виступають 1-(3',4'диметоксифеніл)-1,4-дигідропіразин-2,3-діон та 4бромфеніламід хлороцтової кислоти (Сполука 12). Вихід: 1,91 г (77 %), Тпл 272-274 °С, М.м. 460,2. Брутто-формула: C20H18BrN3O5. Розраховано: С 51,96 %, Н 4,36 %, N 9,09 %, О 17,30 %, Br 17,28 %. Знайдено: С 51,91 %, Н 4,28 %, N 9,14 %, О 17,37 %, Br 17,36 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,41, 1Н, с; 7,52-7,02, 7Н, м; 6,62, 2Н, м; 4,60, 2Н, с; 3,78, 6Н, д. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = С6Н3-(ОСH3)2(3,4), R = С6Н3-(ОСН3)2(3,5), вихідними речовинами виступають 1-(3',4'диметоксифеніл)-1,4-дигідропіразин-2,3-діон та 3,5-диметоксифеніламід хлороцтової кислоти (Сполука 13). Вихід: 1,81 г (73 %), Тпл 198-200 °С, М.м. 441,2. Брутто-формула: С22Н23N3O7. Розраховано: С 59,59 %, Н 5,68 %, N 9,48 %, 0 25,25 %. Знайдено: С 59,64 %, Н 5,74 %, N 9,56, О 25,34 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,28, 1Н, с; 7,05-6,22, 8Н, м; 4,61, 2Н, с; 3,78, 12Н, т. Згідно з наведеною схемою отримують 4-R2,3-діоксо-1,4-дигідропіразин-1-ілоцтову кислоту 1 2 при R = C6H3-(OCH3)2(3,4), R = С6Н3-(ОСН3)2(3,4), вихідними речовинами виступають 1-(3',5'диметоксифеніл)-1,4-дигідропіразин-2,3-діон та 3,4-диметоксифеніламід хлороцтової кислоти (Сполука 14). Вихід: 1,86 г (75 %), Тпл 182-184 °С, М.м. 441,2. Брутто-формула: C22H23N3O7. Розраховано: С 59,59 %, Н 5,68 %, N 9,48 %, О 25,25 %. Знайдено: С 59,64 %, Н 5,74 %, N 9,54 %, О 25,34 %. Спектр ПМР , м.ч., ДМСО-Д6: 10,15, 1Н, с; 7,32-7,02, 6Н, м; 6,61, 2Н, м; 3,72, 12Н, т. Приклад 2 7 94765 Вивчення проявів протисудомної активності ряду заявлених сполук проводили на білих безпородних щурах вагою 200 г на широковживаній моделі судом, викликаних аналептиком кордіаміном. Лабораторних тварин розподілили на групи відповідно до препарату, що вони одержували: 1. Контрольна патологія - кордіамін - 1 група. 2. Тварини, що отримали сироп Депакін, що містить вальпроат натрію у дозі 5,764 г/100 мл - 2 група. 3. Тварини, яким було введено синтезовані сполуки - 3-20 групи. Препарати, що досліджувалися, вводили в шлунок щурів через зонд у розчині 2 мл 1 % крохмального гелю із розрахунку 0,05 мг препарату на 1 кг маси тіла. Депакін сироп вводили також в шлунок щурів через зонд, як і досліджувані сполуки, у вигляді готового перорального розчину у дозі 30 мг/кг маси тіла (відповідно до інструкції до застосування). Кордіамін вводили внутрішньом'язово у дозі 300 мг/кг маси тіла через 30 хвилин після введення досліджуваної сполуки. Латентний період виникнення судом визначали 8 безпосередньо після введення кордіаміну. Рівень судомної готовності оцінювали через 1 годину після виникнення судом [4]. Як показники досліджувалися латентний період прояву судом, після введення досліджуваних сполук, та сила конвульсій за наступною шкалою: 0 балів - відсутність рухливого збудження та судомної реакції; 1 бал - здригування та незначна бігова реакція; 2 бали - виражена бігова реакція з наступним падінням на бік та клонічними судомами; 3 бали - клініко-тонічна екстензія; 4 бали - судомний напад з тонічним напруженням всієї мускулатури. Поведінку дослідних тварин оцінювали за наступними показниками: збудливість, реактивність, спонтанна активність, положення тіла, положення кінцівок, тонус кінцівок. Відсутність судом (не приймаючи до уваги тремор) є показником протисудомної активності досліджуваної сполуки [4]. Таблиця 1 Вивчення протисудомної активності досліджуваних сполук на моделі кордіамінових судом у щурів Латентний пері- Прояв судом після латентно- Прояв судом через од, хв. го періоду, бали 1 год., бали Кордіамін 3±0,5 3,4±0,5 3,8±0,2 Депакін 48±4 2,0±0,3 2,1±0,3 сироп Сполука 1 5±1,5 2,3±0,3 3,6±0,4 Сполука 2 5±1,5 2,1±0,3 3,4±0,4 Сполука 3 5±0,4 2,8±0,3 1,7±0,4 Сполука 4 13±4,0 1,8±0,5 1,4±0,5 Сполука 5 6±0,5 3,7±0,4 3,2±0,4 Сполука 6 15±2 1,5±0,2 2,2±0,5 Сполука 7 5±1,2 3,4±0,4 3,0±0,4 Сполука 8 13±3,5 2,2±0,7 1,5±0,4 Сполука 9 15±2 2,0±0,3 1,5±0,3 Сполука 10 15±2,7 2,3±0,3 1,8±0,4 Сполука 11 25±2,5 1,2±0,2 1,4±0,2 Сполука 12 15±3,2 3,2±0,6 2,2±0,3 Сполука 13 3±0,4 3,7±0,4 2,6±0,5 Сполука 14 25±3,0 1,5±0,2 0,9±0,2 Речовина Аналіз даних таблиці 1 свідчить про наявність протисудомної активності заявлених сполук. Більшість досліджуваних сполук здатна відстрочувати судомні напади у порівнянні з контролем та захищати тварин від загибелі при судомах, викликаних аналептиком кордіаміном. Так, сполуки 4, 6, 8, 9, 10, 11, 12, 14 суттєво подовжують латентний період виникнення судом (13-25 хв.). Найбільш активними виявились сполука 11 та сполука 14, які подовжують латентний період виникнення судомного нападу до 25 хв. та після закінчення латентного періоду піддослідні тварини демонстрували незначну збудливість, що виявляє кращі результати, ніж препарат порівняння сироп Депакін. Тварини, що вижили, % 16,7 Вага тварин, г 194±4,3 100 197±5,2 70 87 100 100 16,7 100 50 100 100 100 100 100 50 100 204±2,1 198±4,1 197±2,3 198±3,7 199±3,6 198±3,5 205±3,4 201±2,3 202±3,5 197±3,4 196±3,2 196±2,7 204±2,4 201±2,7 Всі заявлені сполуки проявляють протисудомну активність на рівні або перевищують дію препарату порівняння. Заявлені сполуки можуть бути одержані в умовах хіміко-фармацевтичних підприємств за доступною технологією без використання токсичних реагентів. Проведені авторами дослідження свідчать про доцільність їх застосування як лікарських субстанцій протисудомних препаратів у медичній практиці для лікування нервовопсихічних захворювань, які супроводжуються судомами. Джерела інформації 1. Машковский М.Д. Лекарственные средства: В 2 т. - М.: ООО «Издательство Новая Волна»: 14-е изд. 2003. - T.1. - С. 45. 9 94765 2. Компендиум 2007 - лекарственные препараты / Под ред. В.Н. Коваленко, А.П. Викторова. - К.: МОРИОН, 2007. - Т. 1. - С. Л-410-Л-411. 3. Методические указания по изучению противосудорожной активности фармакологических веществ / Т.А. Воронина, Л.Н. Неробкова // Руко Комп’ютерна верстка Л. Купенко 10 водство по экспериментальному (доклиническому изучению новых фармакологических веществ. Москва: Ремедиум, 2005. - С. 138-146. 4. Гацура В.В. Методы первичного фармакологического исследования биологически активных веществ. - М.: Медицина. - 1974. - 143 с. Підписне Тираж 24 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAnilides of 4-r-2,3-dioxo-1,4-dihydropyrazine-1-yl-acetic acids exhibiting anticonvulsant activity
Автори англійськоюHeorhiants Viktoria Akopivna, Shyniova Nadia Valeriivna, Perekhoda Lina Oleksiivna, Rybalchenko Tetiana Leonidivna
Назва патенту російськоюАнилиды 4-r-2,3-диоксо-1,4-дигидропиразин-1-илуксусных кислот, проявляющие противосудорожную активность
Автори російськоюГеоргиянц Виктория Акоповна, Шинёва Надежда Валерьевна, Перехода Лина Алексеевна, Рыбальченко Татьяна Леонидовна
МПК / Мітки
МПК: A61P 25/08, A61K 31/4965, C07D 241/18
Мітки: протисудомну, проявляють, 4-r-2,3-діоксо-1,4-дигідропіразин-1-ілоцтових, кислот, активність, аніліди
Код посилання
<a href="https://ua.patents.su/5-94765-anilidi-4-r-23-diokso-14-digidropirazin-1-iloctovikh-kislot-shho-proyavlyayut-protisudomnu-aktivnist.html" target="_blank" rel="follow" title="База патентів України">Аніліди 4-r-2,3-діоксо-1,4-дигідропіразин-1-ілоцтових кислот, що проявляють протисудомну активність</a>
Попередній патент: Спосіб одержання ароматичних амінів у присутності комплексу паладію, що включає фероценілбіфосфіновий ліганд
Наступний патент: Спосіб зварювання листоподібних компонентів один з одним та зварювальний кондуктор для використання у способі
Випадковий патент: Похідні піперидину, що мають активність по відношенню до ccr5 (хемокінового рецептора 5)









