Дигідрохлориди 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів в ролі блокаторів рн-чутливих іонних каналів
Номер патенту: 96837
Опубліковано: 25.02.2015
Автори: Кришталь Олег Олександрович, Вовк Михайло Володимирович, Сукач Володимир Андрійович, Бута Андрій Зеновійович, Максимюк Олександр Петрович
Формула / Реферат
Дигідрохлориди 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів загальної формули:
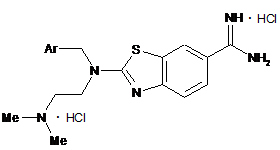 ,
,
де Ar=Ph (I), 4-СlС6Н4 (II), 4-MeC6H4 (III), 4-CF3C6H4 (IV)
в ролі блокаторів рН-чутливих іонних каналів.
Текст
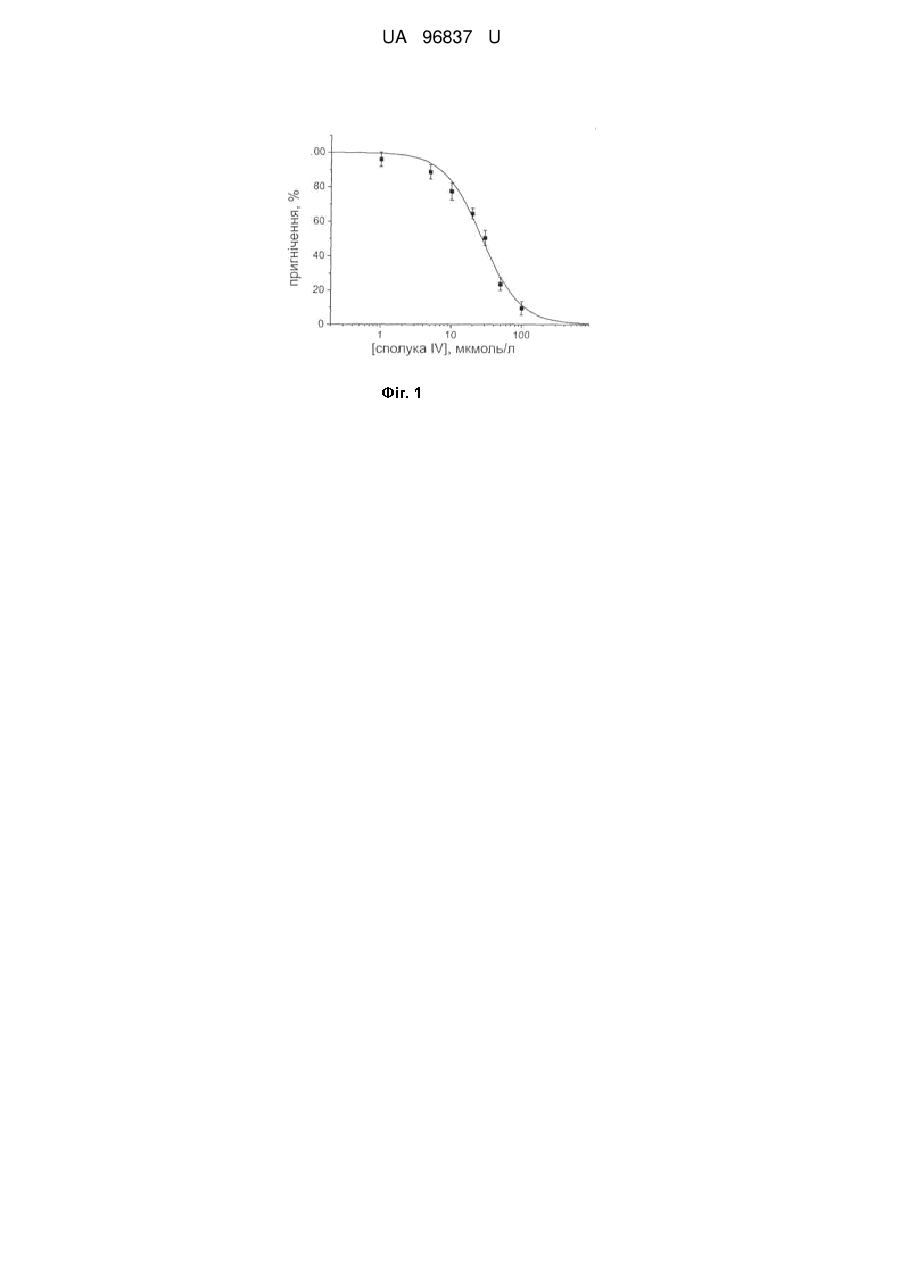
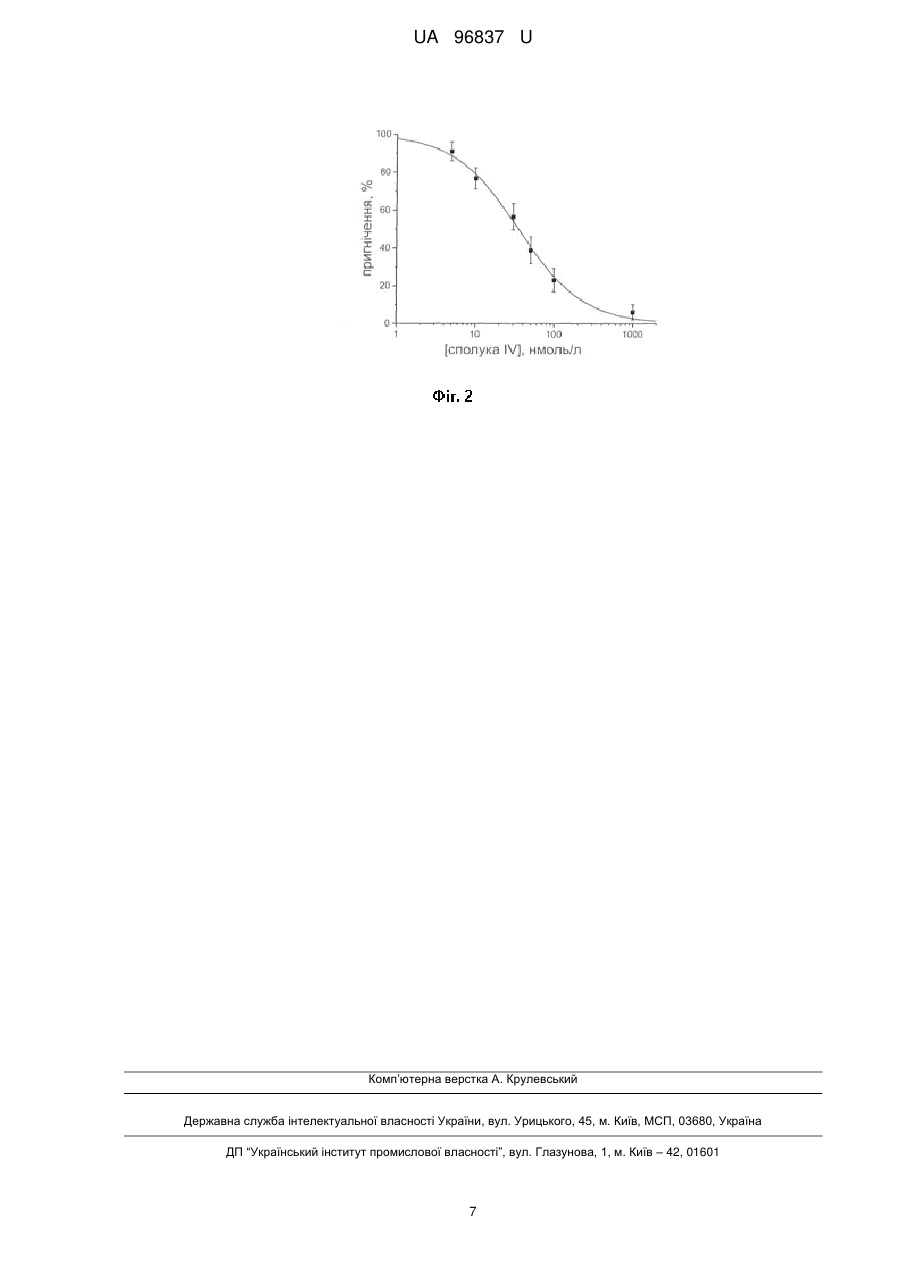
Реферат: Дигідрохлориди 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів загальної формули: NH Ar S N . HCl NH2 N Me N . HCl Me , де Ar=Ph (I), 4-СlС6Н4 (II), 4-MeC6H4 (III), 4-CF3C6H4 (IV) в ролі блокаторів рН-чутливих іонних каналів. РОЛІ UA 96837 U (12) UA 96837 U UA 96837 U Корисна модель належить до органічної хімії та медицини, а саме до нових похідних 2діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів загальної формули: NH Ar S N . HCl NH2 N Me N . HCl Me 5 10 15 20 25 30 35 40 , де Ar = Ph (І), 4-СlС6Н4 (II), 4-МеС6Н4 (IIІ), 4-CF3C6H4 (IV). Запропоновані нові сполуки, спосіб їх отримання, властивості і застосування в науковій літературі та патентних виданнях не описані. Із шести типів рН-чутливих іонних каналів нервової системи ссавців (ASIC) найбільш поширеним в центральній нервовій системі є підтип ASIC1a. Він активується підкисленням зовнішньоклітинного середовища і викликає іонний транзіентний струм за рахунок проникності для іонів натрію та кальцію [1, 2]. В більшості випадків ASIC1a активується при рН 6,9, амплітуда струму зростає при подальшому зниженні рН і досягає стану насиченості при рН близько 6,0 [3, 4]. Встановлено, що у нейронах амигдали субодиниці ASIC1a є навіть більш чутливими до падіння концентрації протонів - канали відкриваються вже при рН 7,2 [5]. Очевидно, що роль такої екстремальної чутливості для виявлення каналом своїх різноманітних функцій є надзвичайно важливою, оскільки вважається, що, головним чином, коливання рН рівня в фізіологічних процесах нервової системи відбуваються в незначних межах, тоді як жорсткіші кислі умови зустрічаються досить рідко. Протони у підвищених концентраціях діють як агоністи ASIC при синаптичній передачі. В зв'язку з цим спостерігається чіткий взаємозв'язок між активацією ASIC та певними фізіологічними процесами в мозку, такими як навчання, виникнення пам'яті, відчуття тривоги тощо [3, 6]. В дослідженнях з генетично модифікованими тваринами було показано, що ASIC є суттєвими чинниками ініціювання довготривалої потенціації в гіпокампі та впливають на функцію NMDA рецепторів, але останні опубліковані наукові дані в цій області є неоднозначними [7]. Різноманітні патофізіологічні процеси, включаючи епілепсію, розсіяний склероз, ішемічні хвороби, травматичні ушкодження мозку, депресія, пошкодження спинного мозку, біль при запаленнях та головний біль супроводжуються явищем ацидозу (надмірного підкислення середовища), що приводить до активації ASIC1a [8, 9]. Нещодавно було встановлено, що фармакологічне блокування ASIC1a специфічним природним інгібітором-токсином РсТх1а, а також видалення каналу на генетичному рівні суттєвим чином впливає на вищезгадані патологічні стани та підтверджує цінність ASIC1a як молекулярної мішені для розробки фармакологічних засобів. Окрім цього, вагома роль ASIC1a в таких важливих мозкових процесах, як навчання та пам'ять досі залишається не розкритою в повній мірі саме через відсутність активних та селективних блокаторів для використання у відповідних дослідженнях. В силу сказаного вище пошук селективних антагоністів ASIC1a є однією із найважливіших проблем сучасної нейрофізіології. Найближчими аналогами за фармакологічною дією сполук, які заявляються, є амілорид відомий діуретик з широким спектром блокувальної дії на натрієві іонні канали [1], антикоагулянт нафамостат, для якого виявлений побічний ефект блокування ASIC1a і ASIC3 [5] та його кумаринові аналоги - дигідрохлориди (3-карбоксамідино-2-оксо-2H-хромен-7-іл)-4гуанідин-бензоату (КАХГБ) [10]. При цьому блокувальний ефект нафамостату та препаратів ряду КАХГБ, який виражається значеннями концентрації половинного пригнічення (ІС50) активованих струмів ASIC1a сягає відповідно 13,5 та 7,0 мкмоль/л, що явно недостатньо для їх поглибленого нейрофізіологічного дослідження. 1 UA 96837 U NH O N H N H2N O O NH2 10 NH2 O NH2 O O NH N H 5 R NH2 NH N Cl NH * HCl O NH N H NH2 NH2 Амілорид Нафамостат КАХГБ Задачею корисної моделі є синтез нових ефективних сполук з вираженими властивостями до блокування рН-чутливих іонних каналів. Вирішення поставленої задачі досягається синтезом нових похідних 2-діалкіламіно-1,3бензотіазол-6-карбоксамідамідів Для одержання такого типу сполук нами запропонована препаративно ефективна 3-стадійна схема, яка базується на використанні в ролі вихідної сполуки доступного 2-хлоро-6ціанобензотіазолу і реалізується через ряд синтетичних перетворень: 1) нуклеофільне заміщення хлору в 2-хлоро-6-ціанобензотіазолі діалкіламінами в розчині ДМФА в присутності надлишку карбонату калію; 2) перетворення 6-ціаногрупи в амідоксиміну при дії гідроксиламіну в киплячому етанолі; 3) відновлення амідоксимної групи до амідинової цинковим пилом в оцтовій кислоті. CN S Ar + Cl Ar K2CO3 HN CN S N N N N Me Me N Me Me NH2OH NH Ar S N . HCl NH2 N Zn / AcOH Ar N HCl N Me N 20 25 NH2 N . HCl Me Me 15 S OH N Me , де Аr = Ph (I), 4-ClC6H4 (II), 4-MeC6H4 (III), 4-CF3C6H4 (IV). Схема ілюструється прикладами синтезу проміжних та цільових сполук, структура яких 1 підтверджена аналітичними даними та результатами вимірів ІЧ - та ЯМР Н спектрів. Загальний спосіб одержання 2-діалкіламіно-1,3-бензотіазол-6-карбонітрилів. Суміш 1,56 гр (8 ммоль) 2-хлор-5-ціанобензотіазолу та 2,09 г (8,5 ммоль) діалкіламіну в присутності карбонату калію 4,42 г (32 ммоль) в 50 мл диметилформаміду нагрівають при перемішуванні при 140 °С протягом 6 год. Диметилформамід видаляють у вакуумі, залишок обробляють водою і відфільтровують. Очищають екстракцією з киплячого розчину гексантолуол (3:1). Розчинник упарюють і затирають в суміші гексан - діетиловий етер (1:1). Приклад 1. 2-{Бензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбо-нітрил). Вихід 75 %. Т. топл. 1 110-112 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 7,83 (с, 1Н), 7,57 (д, J=8,2, 2Н), 7,47 (м, 4Н), 7,41 (д, J=8,2, 2Н), 7,24 (с, 1Н), 4,94 (с, 2Н), 3,62 (т, J=7,0, 2H), 2,59 (т, J=7,0, 2H), 2,23 (с, 6Н). Знайдено, %: С 68,11; Н 6,12; N 16,38. C19H20N4S. Вирахувано, %: С 67,83; Н 5,99; N 16,55. Приклад 2. 2 UA 96837 U 5 10 15 20 25 30 35 40 45 50 55 2-{4-Хлорбензил[2-(диметиламіно)етил]аміно}-1,3-бензо-тіазол-6-карбонітрил. Вихід 72 %. Т. 1 топл. 122-124 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 7,87 (с, 1H), 7,60 (д, J=8,0, 2Н), 7,41 (м, 3Н), 7,32 (д, J=8,0, 2Н), 7,20 (с, 1Н), 4,95 (с, 2Н), 3,64 (т, J=7,4, 2H), 2,61 (т, J=7,4, 2H), 2,25 (с, 6Н). Знайдено, %: С 61,79; Н 5,03; N 9,48. C9H19ClN4S. Вирахувано, %: С 61,53; Н 5,16; N 9,56. Приклад 3. 2-{4-Метилбензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбонітрил. Вихід 69 %. 1 Т. топл. 118-120 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 7,90 (с, 1Н), 7,65 (д, J=8,0, 2Н), 7,35 (м, 3Н), 7,33 (д, J=8,0, 2Н), 7,26 (с, 1Н), 4,96 (с, 2Н), 3,68 (т, J=7,6, 2Н), 2,63 (т, J=7,6, 2Н), 2,40 (с, 3Н), 2,22 (с, 6Н). Знайдено, %: С 68,80; Н 6,21; N 16,14. C 20H22N4S. Вирахувано, %: С 68,54; Н 6,33; N 15,99. Приклад 4. 2-{4-Трифторометилбензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбонітрил. 1 Вихід 70 %. Т. топл. 130-132 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 7.91 (с, 1Н), 7,63 (д, J=8,4, 2Н), 7,42 (м, 3Н), 7,29 (д, J=8,4, 2Н), 7,19 (с, 1Н), 4,90 (с, 2Н), 3,61 (т, J=7,2, 2Н), 2,60 (т, J=72, 2Н), 2,27 (с, 6Н). Знайдено, %: С 59,61; Н 4,70; N 14,04. C 20H19F3N4S. Вирахувано, %: С 59,39; Н 4,74; N 13,85. Загальний спосіб одержання 2-діалкіламіно-N'-гідрокси-1,3-бензо-тіазол-6-карбоксімідамідів. До нагрітого до кипіння розчину 5 ммоль 2-діалкіламіно-1,3-бензотіазол-6-карбонітрилу в 20 мл етанолу обережно порціями додають розчин 1,04 г (15) ммоль гідрохлориду гідроксиламіну у 5 мл води. Суміш кип'ятять протягом 4 год, розчинник упарюють, залишок розчиняють в дихлорометані та промивають водою. Органічний шар сушать над сульфатом натрію та упарюють. Залишок кристалізують з ацетонітрилу. Приклад 5. 2-{Бензил[2-(диметиламіно)етил]аміно}-N'-гідрокси-1,3-бензотіазол-6-карбоксімідамід. Вихід 1 81 %. Т. топл. 151-153 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 9,56 (с, 1Н), 7,77 (с, 1Н), 7,55 (д, J=8,2, 2Н), 7,42 (м, 4Н), 7,31 (д, J=8,2, 2Н), 7,33 (с, 1Н), 6,67 (с, 2Н), 4,97 (с, 2Н), 3,58 (т, J=7,2, 2Н), 2,60 (т, J=7,2, 2H), 2,22 (с, 6Н). Знайдено, %: С 61,49; Н 6,33; N 18,73. C 19H23N5OS. Вирахувано, %: С 61,76; Н 6,27; N 18,95. Приклад 6. 2-{4-Хлоробензил[2-(диметиламіно)етил]аміно}-N'-гідрокси-1,3-бензотіазол-61 карбоксімідамід. Вихід 83 %. Т. топл. 167-169 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 9,60 (с, 1Н), 7,68 (с, 1Н), 7,52 (д, J=8,3, 2Н), 7,40 (м, 3Н), 7,24 (д, J=8,3, 2Н), 7,30 (с, 1Н), 6,70 (с, 2Н), 4,99 (с, 2Н), 3,52 (т, J=7,5, 2Н), 2,67 (т, J=7,5, 2H), 2,29 (с, 6Н). Знайдено, %: С 56,69; nН 5,31; N 17,62. C19H22ClN3OS. Вирахувано, %: С 56,546; Н 5,49; N 17,34. Приклад 7. 2-{4-Метилбензил[2-(диметиламіно)етил]аміно}-N'-гідрокси-1,3-бензотіазол-61 карбоксімідамід. Вихід 82 %. Т. топл. 165-167 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 9,63 (с, 1Н), 7,63 (с, 1Н), 7,45 (д, J=8,5, 2Н), 7,34 (м, 3Н), 7,25 (д, J=8,5, 2Н), 7,25 (с, 1Н), 6,74 (с, 2Н), 4,98 (с, 2Н), 3,50 (т, J=7,6, 2Н), 2,62 (т, J=7,6, 2Н), 2,35 (с, 3Н), 2,29 (с, 6Н). Знайдено, %: С 62,77; Н 6,76; N 18,15. C20H25N5OS. Вирахувано, %: С 62,64; Н 6,57; N 18,26. Приклад 8. 2-{4-Трифторометилбензил[2-(диметиламіно)етил]аміно}-N'-гідрокси-1,3-бензотіазол-61 карбоксімідамід. Вихід 85 %. Т. топл. 171-173 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 9,66 (с, 1Н), 7,70 (с, 1Н), 7,63 (д, J=8,1, 2Н), 7,37 (м, 3Н), 7,25 (д, J=8,1, 2Н), 7,27 (с, 1Н), 6,74 (с, 2Н), 5,00 (с, 2Н), 3,55 (т, J=7,5, 2Н), 2,67 (т, J=7,5, 2Н), 2,34 (с, 6Н). Знайдено, %: С 55,09; Н 5,01; N 16,23. C20H22F3N5OS. Вирахувано, %: С 54,91; Н 5,07; N 16,01. Загальний спосіб одержання дигідрохлоридів 2-діалкіламіно-1,3-бензотіазол-6карбоксімідамідів. До розчину 5 ммоль 2-діалкіламіно-N'-гідрокси-1,3-бензотіазол-6-карбоксімідаміду в 20 мл льодяної оцтової кислоти додають 1,3 г (20 ммоль) цинкового пилу і перемішують протягом 48 год при кімнатній температурі. Реакційну суміш фільтрують, розчинник упарюють, залишок розчиняють в 25 мл дихлорометану та додають 50 мл 20 %-ного розчину гідроксиду натрію. Органічний шар промивають водою, сушать над сульфатом натрію та упарюють. До залишку додають надлишок спиртового розчину хлороводню, витримують 1 год, упарюють та сушать у вакуумі. Приклад 9. 2-{Бензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбоксімід-амід дигідрохлорид. 1 Вихід 67 %. Т. топл. 173-175 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 10,20 (с, 1Н), 9,80 (с, 4Н), 7,91 (с, 1Н), 7,77 (д, J=8,0, 2H), 7,62 (м, 4Н), 7,44 (д, J=8,0, 2H), 7,45 (с, 1Н), 5,03 (с, 2Н), 3,78 (т, 3 UA 96837 U 5 10 15 20 25 J=7,7, 2H), 2,94 (т, J=7,7, 2H), 2,88 (с, 6Н). Знайдено, %: С 57,51; Н 5,29; N 16,88. C 19H23Cl2N5S. Вирахувано, %: С 57,77; Н 5,46; N 16,71. Приклад 10. 2-{Хлоробензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбокс-імідамід ' дигідрохлорид. Вихід 66 %. Т. топл. 173-175 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 10,26 (с, 1Н), 9,88 (с, 4Н), 7,90 (с, 1Н), 7,73 (д, J=8,2, 2H), 7,61 (м, 3Н), 7,43 (д, J=8,2, 2Н), 7,47 (с, 1Н), 5,05 (с, 2Н), 3,77 (т, J=7,8, 2H), 2.96 (т, J=7,8, 2Н), 2,89 (с, 6Н). Знайдено, %: С 50,04; Н 4,67; N 15,44. C19H22Cl3N5S. Вирахувано, %: С 49,74; Н 4,83; N 15,26. Приклад 11. 2-{Метилбетил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбоксімідамід 1 дигідрохлорид. Вихід 63 %. Т. топл. 168-170 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 10,29 (с, 1Н), 9,82 (с, 4Н), 7,99 (с, 1Н), 7,85 (д, J=8,4, 2Н), 7,65 (м, 3Н), 7,41 (д, J=8,6, 2H), 7,42 (с, 1Н), 5,08 (с, 2Н), 3,78 (т, J=8,0, 2Н), 2,93 (т, J=8,0, 2H), 2,85 (с, 6Н), 2,34 (с, 3Н). Знайдено, %: С 54,54; Н 5,86; N 16,12. C20H25Cl2N5S. Вирахувано, %: С 54,79; Н 5,75; N 15,97. Приклад 12. 2-{Трифторометилбензил[2-(диметиламіно)етил]аміно}-1,3-бензотіазол-6-карбоксімідамід 1 дигідрохлорид. Вихід 65 %. Т. топл. 174-176 °С. Спектр ЯМР Н, DMSO-d6, , м. ч.: 10,27 (с, 1Н), 9,89 (с, 4Н), 7,93 (с, 1Н), 7,78 (д, J=8,4, 2Н), 7,61 (м, 3Н), 7,43 (д, J=8,4, 2Н), 7,50 (с, 1Н), 5,07 (с, 2Н), 3,73 (т, J=7,8, 2H), 2,97 (т, J=7,8, 2H), 2,90 (с, 6Н). Знайдено, %: 48,47; Н 4,59; N 14,45. C20H22Cl2F3N2S. Вирахувано, %: С 48,73; Н 4,50; N 14,22. 2-Діалкіламіно-1,3-бензотіазол-6-карбоксімідаміди (I-IV) в умовах in vitro викликають залежне оборотне пригнічення струмів ASIC1a-типу на мембрані клітин людської ембріональної нирки (НЕК-293). Активація струмів викликалась зниженням рівня рН від 7,4 до 6,7 шляхом швидкої заміни кондиціонуючого розчину (рН=7,4) на активаційний (рН=6,7) протягом ~50 мс при підтримуючому мембранному потенціалі -60 мВ. Значення пригнічення амплітуди струму рН-чутливих іонних каналів 1а типу на мембрані клітин НЕК-293 дією вказаних похідних у концентрації 100 нмоль/л наведені у табл. Таблиця Пригнічення ASIC1a-струму під дією сполук (I-IV) Сполука І II III IV 30 35 40 45 50 Ступінь пригнічення ASIC1a-струму у клітинах НЕК-293 (%) 34 40 70 76 Найбільш активною із наведеного ряду є сполука IV, яка рН-залежно зменшує амплітуду струму hASIC1a каналу (Фіг. 1). Її найважливішою властивістю виявилась рН-залежність дії, внаслідок чого ефективність інгібування зростає у напрямку підвищення рН активаційного розчину (від 5 до 6,7) і що показово, досягає максимуму при значенні рН, що спостерігається в умовах ішемії мозку (6,5-6,7). До того ж, така властивість антагоніста вказує на існування у структурі рецептор-іонофорного комплексу двох сайтів зв'язування: специфічного - «рН-сенсор» та алостеричного, що є частиною катіонної пори. Фіг. 1. Дозо-залежна дія речовини (IV) на амплітуду струму опосередкованого гомомерними hASIC1a іонними каналами у клітинах лінії НЕК-293 за рН 5,0 та за рН 6,7 - фіг. 2. Помітною є чітко виражена рН-залежність дії антагоніста (ІС50 = 27 мкмоль/л; ІС50 = 35 нмоль/л) відповідно. Таким чином блокувальна дія найактивнішої сполуки (IV) на рН-чутливі іонні канали підтипу ASIC1a перевищує рівень відомих аналогів - нафамастату та КАХГБ в 386 та 200 разів відповідно. Знайдені антагоністи можуть бути прототипами для створення принципово нових високоефективних нейропротекторних лікарських засобів. Приклад 13. Культивування клітин лінії НЕК-293 Клітини людської ембріональної нирки (НЕК-293), що ендогенно експресують на мембрані гомомерний ASIC1a-рецептор зростали у культуральному поживному середовищі, утворюючи моношар клітин на дні пластикових чашок Петрі чи у флеках. За оптимальних умов культивування (t = 37 °С, СО2 = 5 %) кількість клітин подвоювалася приблизно через кожні 36 годин. Після 3-4 днів культивування клітин, коли щільність моношару досягала 80-90 % площі поверхні дна чашки, проводили їх пересадку. Під час процедури пересадки клітин 4 UA 96837 U 5 10 15 20 25 30 35 40 45 50 55 60 дотримувались такої послідовності: спершу відбирали з чашки Петрі поживне середовище, а чашку з клітинами відмивали один раз стерильним розчином PBS (розчин на основі фосфатного 2+ 2+ буфера) (без іонів Са та Mg ). Після цього у чашку додавали 1-2 мл трипсин-ЕДТА розчину на 2-3 хв, для того, щоб моношар клітин відкріпився від дна чашки (але не на триваліший час, щоб не зазнали ферментативного руйнування білкові комплекси на мембрані клітин). Для того, щоб зупинити процес трипсинизації, у чашку Петрі додавали 5-10 мл повноцінного культурального середовища і обережно розсуспензовували клітини. Потім переносили необхідну кількість клітинної суспензії у малі чашки Петрі (діаметром 3,5 см), у які попередньо налито по 2-3 мл культурального середовища. Приклад 14. Електрофізіологічні дослідження Вимірювання струмів проводилось за методом фіксації потенціалу в режимі відведення від цілої клітини (whole cell patch-clamp). Протон-активовані струми викликались прикладанням розчину Рінгера з рН = 5,0, а також при потребі рН активаційного розчину змінювали (з 5,0 до 6,0-6,7). Струми реєструвались за підтримуваного потенціалу у -60 мВ. Скляні мікропіпетки (опір 2-3 МОм) заповнювались штучним внутрішньоклітинним розчином, що містив (у ммоль/л): KF 120; Tris-Cl 20 (рН доводився до значення 7,3 за допомогою КОН). В ролі зовнішньоклітинного розчину використовувався фізіологічний розчин Рінгера (рН = 7,4). Експерименти проводились при кімнатній температурі. Усі хімічні реагенти, що використовувалися під час експериментів, вироблені компанією Sigma (США). Приклад 15. Дослідження блокувальної дії дигідрохлоридів 2-діалкіламіно-1,3-бензотіазол-6карбоксімідамідів (І-IV) на рН-чутливі іонні канали. Вимірювання струмів проводилося за методом фіксації потенціалу в режимі відведення від цілої клітини. Протон-активовані струми викликались прикладанням розчину Рінгера (рН = 5,0), а також при потребі рН активаційного розчину змінювали (з 5,0 до 6,0-6,7). Струми реєструвались за підтримуваного потенціалу у мінус 60 мВ. Скляні мікропіпетки (опір 2-3 мОм) заповнювались розчином, що містив (у ммоль/л): фториду калію 120; Tris-Cl 20 (рН доводився до значення 7,3 за допомогою гідроксиду калію). В ролі зовнішньоклітинного розчину використовувався фізіологічний розчин Рінгера (рН = 7,35). Експерименти проводились при кімнатній температурі (20±2) °С. Усі хімічні реагенти, що використовувалися під час експериментів, вироблені компанією Sigma (США). Скринінг речовин проводився методом фіксування потенціалу у конфігурації «ціла клітина». При переході з кондиціонуючого розчину з рН = 7,35 (розчин Рінгера) до активаційного розчину з рН = 5,0 (кислий розчин Рінгера) (швидкість зміни розчину ~50 мс) при підтримуваному внутрішньоклітинному потенціалі мінус 60 мВ спостерігалась активація рН-чутливих іонних каналів у вигляді трансмембранних струмів амплітудою 400-800 (для ASIC1a) та 1000-5000 пА (для ASIC3), які швидко десенситизувались (протягом 3-5 с). Дослідження дії речовин проводилось на гомомерних ASIC1a-іонних каналах людських ембріональних ниркових клітин (НЕК-293) і на нативних АSІС3-іонних каналах нейронів задньо-корінцевих гангліїв щура (DRG), котрі були підкультивовані 1-2 дні. Зовнішньоклітинний розчин містив: 130 ммоль/л хлориду натрію; 2 ммоль/л хлориду кальцію; 5 ммоль/л хлориду калію; 2 ммоль/л хлориду магнію, 10 HEPES; рН = 7.5 при температурі (25±1) °С доведений розчином гідроксиду натрію з масовою часткою основної речовини 5 %. Склад активаційного розчину аналогічний кондиціонуючому, за винятком буфера (HEPES замінювався на MES), а рН = 5,0 при температурі (25±1) °С доведений розчином гідроксиду натрію (при потребі до 6,0 або 6,7). Піпетки заповнювалися внутрішньоклітинним розчином наступного складу (у ммоль/л): 20 Tris-Cl, 120 фториду калію; рН 7,3 при температурі (25,0±0,5) °С доведений водним розчином гідроксиду калію з масовою часткою основної речовини 5 %. Література [1] Yermolaieva О., Leonard A.S., Schnizler M.K., Abboud F.M., Welsh M.J. // Extracellular acidosis increases neuronal cell calcium by activating acid-sensing ion channel 1a. Proc. Natl. Acad. Sci. USA. - 2004. - Vol. 101, № 17. - P. 6752-6757. [2] Feldman D.H., Horiuchi M., Keachie K., Mccauley E., Bannerman P., Itoh A., Itoh Т., Pleasure D. Characterization of acid-sensing ion channel expression in oligodendrocyte-lineage cells. Glia. 2008. - Vol. 56, № 11. - P. 1238-1249. [3] Waldmann R., Champigny G., Bassilana F., Heurteaux C., Lazdunski M. // A proton-gated cation channel involved in acid-sensing. Nature. - 1997. - Vol. 386, № 6621. - P. 173-177. [4] Babini E., Paukert M., Geisler H.S., Grunder S. // Alternative splicing and interaction with diand polyvalent cations control the dynamic range of acid-sensing ion channel 1 (ASIC1). J. Biol. Chem. - 2002. - Vol. 277, № 44. - P. 41597-41603. 5 UA 96837 U 5 10 15 [5] Ziemann A.E., Allen J.E., Dahdaleh N.S., Drebot I.I., Coryell M.W., Wunsch A.M., Lynch С.М., Faraci F.M., Howard M.A. 3rd, Welsh M.J., Wemmie J.A. // The amygdala is a chemosensor that detects carbon dioxide and acidosis to elicit fear behavior. Cell. - 2009. - Vol. 139, № 5. - P. 10121021. [6] Krishtal O. // The ASICs: Signaling molecules? Modulators? // Trends in Neurosciences. 2003. - Vol. 26, № 9. P. 477-483. [7] Wu P.Y., Huang Y.Y., Chen C.C., Hsu T.T., Lin Y.C., Weng J.Y., Chien T.C., Cheng I.H., Lien C.C. // Acid-sensing ion channel-1a is not required for normal hippocampal LTP and spatial memory. J. Neurosci. - 2013. - Vol. 33, № 5. - P. 1828-1832. [8] Xiong Z.-G., Zhu X.-M., Chu X.-P., Minami M., Hey J., Wei W.-L., MacDonald J.F., Wemmie J.A., Price M.P., Welsh M.J., Simon R.P. // Cell - 2004. - Vol. 118. - P. 687-698. [9] Chu X.P., Xiong Z.G. // Acid-sensing ion channels in pathological conditions. Adv. Exp. Med. Biol. - 2013. - Vol. 961. - P. 419-431. [10] Патент 66987 Україна. Дигідрохлориди (3-карбоксамідино-2-оксо-2Н-хромен-7-іл)-4гуанідинобензоатів, які виявляють властивості блокаторів рН чутливих іонних каналів / Сукач В.А., Вовк М.В., Максимюк О.П., Бута А.З., Кришталь О.О; заявники та патентовласники Інститут органічної хімії НАН України, Інститут фізіології ім. О.О. Богомольця НАН України. - u 2011 08744; заявл. 12.07.2011; опубл. 25.01.2012. Бюл. № 2. 20 ФОРМУЛА КОРИСНОЇ МОДЕЛІ Дигідрохлориди 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів загальної формули: NH Ar S N . HCl NH2 N Me 25 N . HCl Me , де Ar=Ph (I), 4-СlС6Н4 (II), 4-MeC6H4 (III), 4-CF3C6H4 (IV) в ролі блокаторів рН-чутливих іонних каналів. 6 UA 96837 U Комп’ютерна верстка А. Крулевський Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 7
ДивитисяДодаткова інформація
Автори англійськоюVovk Mykhailo Volodymyrovych, Sukach Volodymyr Andriiovych
Автори російськоюВовк Михаил Владимирович, Сукач Владимир Андреевич
МПК / Мітки
МПК: C07D 277/82, A61K 31/37, C07D 277/62
Мітки: блокаторів, ролі, рн-чутливих, каналів, іонних, 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів, дигідрохлориди
Код посилання
<a href="https://ua.patents.su/9-96837-digidrokhloridi-2-dialkilamino-13-benzotiazol-6-karboksamidamidiv-v-roli-blokatoriv-rn-chutlivikh-ionnikh-kanaliv.html" target="_blank" rel="follow" title="База патентів України">Дигідрохлориди 2-діалкіламіно-1,3-бензотіазол-6-карбоксамідамідів в ролі блокаторів рн-чутливих іонних каналів</a>
Попередній патент: Електрична скороварка із засобом вимірювання ваги вихідного продукту
Наступний патент: Електроакустичний перетворювач
Випадковий патент: Сегментна шпонка