Піридо[2,3-d]піримідинони і їх застосування як інгібіторів pі3
Номер патенту: 95113
Опубліковано: 11.07.2011
Автори: Плєве Міхаель Бруно, Намбу Мітчелл Девід, Дресс Клаус Рупрехт, Каня Роберт Стівен, Джонсон Мері Кетрін, Бхумралкар Діліп, Ченг Хенгмяо, Періш Мейсон Алан, Хоффман Джакуі Елізабет, Тран Ханг Туан, Лє Фуонг Ті Куй
Формула / Реферат
1. Сполука Формули (І)
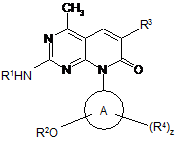 (І)
(І)
або її сіль,
де:
R1 є Н або (С1-С6)алкіл, необов'язково, заміщений принаймні однією R5 групою;
А є 3-10-членна циклоалкільна група;
R2 є (С1-С6)алкіл, заміщений принаймні однією R6 групою;
R3 є (С1-С6)алкіл, (С2-С8)алкеніл, галоген, ціано, -(CH2)nC(O)OR10, -(CH2)nC(O)N(R11aR11b), COR12, (С6-С14)арил або (С2-С9)гетероарил, де згаданий (С1-С6)алкіл, (С2-С8)алкеніл, (С6-С14)арил і (С2-С9)гетероарил, необов'язково, заміщений принаймні однією R9 групою;
кожен R4 є незалежно -ОН, галоген, CF3, -NR11aR11b, (С1-С6)алкіл, (С1-С6)алкеніл, (С1-С6)алкініл;
кожен R5 є незалежно -ОН, галоген, CF3;
кожен R6 є незалежно -ОН, -C(O)R12, -C(O)NR11aR11b, -(CH2)nC(O)OR10, -(CH2)nC(O)N(R11aR11b);
кожен R9 є незалежно -ОН, галоген, CF3, -NR11aR11b, (С1-C6)алкіл, (С1-C6)алкеніл, (С1-C6)алкініл, (С1-C6)алкокси, ціано, (С3-С10)циклоалкіл, (С2-С9)циклогетероалкіл, (С6-С14)арил, (С2-С9)гетероарил, -C(O)R12, -C(O)NR11aR11b, -(CH2)nC(O)OR10, -(CH2)nC(O)N(R11aR11b), -OC(O)R12, -NR11aC(O)R12 або -NR11aC(O)N(R11aR11b);
кожен R10 є незалежно Н або (С1-С6)алкіл;
R11a i R11b є кожен незалежно Н або (С1-С6)алкіл;
R12 є (С1-C6)алкіл;
кожен n є незалежно 0, 1 або 2;
z є цілим числом, що незалежно вибирають з 0 або 1.
2. Сполука або її сіль за пунктом 1, де А є циклогексил.
3. Сполука або сіль за пунктом 1 або 2, де R3 є (С6-С14)арил або (С2-С9)гетероарил, де згаданий (С6-С14)арил або (С2-С9)гетероарил, необов'язково, заміщений принаймні однією R9 групою.
4. Сполука за пунктом 1, яку вибирають з групи, що містить:
2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-6-(6-метоксипіридин-3-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метил-6-хінолін-3-ілпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-6-(2-метоксипіримідин-5-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метил-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-6-бром-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-4-метил-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-(транс-4-{[(2S)-2,3-дигідроксипропіл]окси}циклогексил)-6-(6-метоксипіридин-3-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-4-метил-6-хінолін-3-ілпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-[цис-4-(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-6-(2-метоксипіримідин-5-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-6-(6-метоксипіридин-3-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-6-бром-8-[цис-4-(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-аміно-6-[6-(диметиламіно)піридин-3-іл]-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он;
2-({транс-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід;
метил ({транс-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетат;
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метил-6-(1Н-піразол-3-іл)піридо[2,3-d]піримідин-7(8Н)-он,
2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]-4-метил-6-(1-метил-1Н-піразол-4-іл)піридо[2,3-d]піримідин-7(8Н)-он,
2-({цис-4-[2-аміно-6-(6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({цис-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({цис-4-[2-аміно-4-метил-7-оксо-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({цис-4-[2-аміно-4-метил-6-(1-метил-1Н-піразол-4-іл)-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({цис-4-[2-аміно-6-(2-метоксипіримідин-5-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-{[цис-4-(2-аміно-4-метил-7-оксо-6-хінолін-3-ілпіридо[2,3-d]піримідин-8(7Н)-іл)циклогексил]оксі}ацетамід,
2-({транс-4-[2-аміно-6-(6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-{[транс-4-(2-аміно-4-метил-7-оксо-6-хінолін-3-ілпіридо[2,3-d]піримідин-8(7Н)-іл)циклогексил]оксі}ацетамід,
2-({транс-4-[2-аміно-6-(2-метоксипіримідин-5-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({транс-4-[2-аміно-4-метил-7-оксо-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-({транс-4-[2-аміно-4-метил-6-(1-метил-1Н-піразол-4-іл)-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетамід,
2-аміно-8-[транс-3-(2-гідроксіетокси)циклобутил]-6-(6-метоксипіридин-3-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он,
2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-[транс-3-(2-гідроксіетокси)циклобутил]-4-метилпіридо[2,3-d]піримідин-7(8Н)-он,
2-аміно-8-[транс-3-(2-гідроксіетокси)циклобутил]-6-(2-метоксипіримідин-5-іл)-4-метилпіридо[2,3-d]піримідин-7(8Н)-он,
2-({транс-3-[2-аміно-6-(6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклобутил}оксі)ацетамід,
2-({транс-3-[2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклобутил}оксі)ацетамід,
2-({транс-3-[2-аміно-6-(2-метоксипіримідин-5-іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)-іл]циклобутил}оксі)ацетамід, або її сіль.
5. Сполука Формули (II)
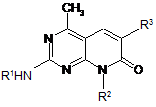 (II)
(II)
або її сіль, де:
R1 є Н або (С1-С6)алкіл, необов'язково, заміщений принаймні однією R4 групою;
R2 є (С1-С6)алкіл, (С2-С8)алкеніл, (С3-С10)циклоалкіл, (С5-С8)циклоалкеніл, (С2-С9)циклогетероалкіл або -(СН2)n(С6-С14)арил, де згаданий (C1-С6)алкіл, (С2-С8)алкеніл, (С3-С10)циклоалкіл, (С5-С8)циклоалкеніл, (С2-С9)циклогетероалкіл і -(СН2)n(С6-С14)арил, необов'язково, заміщений принаймні однією R4 групою;
R3 є (С1-С6)алкіл, (С2-С8)алкеніл, ціано, -(CH2)nC(O)OR5a або -(CH2)nC(O)N(R5aR5b), де згаданий (С1-С6)алкіл або (С2-С8)алкеніл, необов'язково, заміщений принаймні однією R4 групою;
кожен R4 є незалежно -ОН, галоген, CF3, -NR5aR5b, (С1-С6)алкіл, (С1-С6)алкокси, ціано, (С3-С10)циклоалкіл, -S(O)mR5a, -S(O)mNR5aR5b, -C(O)R5a або -C(O)NR5aR5b;
R5a i R5b є кожен незалежно Н, (С1-С6)алкіл, (С2-С9)циклогетероалкіл, (С2-С9)гетероарил або (С6-С14)арил;
кожен m є незалежно 1 або 2; і
кожен n є незалежно 0, 1, 2, 3 або 4.
6. Сполука або її сіль за пунктом 5, де R3 є -(CH2)nC(O)N(R5aR5b).
7. Сполука або її сіль за пунктом 5 або 6, де R2 вибирають з групи, що містить ізопропіл, аліл, циклопентил, циклобутил, гідроксициклогексил, гідроксициклопентил, гідроксициклобутил, гідроксициклогептил, метоксіетил, метоксипропіл, етил, метил, циклопропіл, циклопропілметил, циклопропілетил, 2-метил-2-гідроксипропіл, 3-метил-3-гідроксибутил, метоксибензил і хлорбензил.
8. Сполука за пунктом 5, яку вибирають з групи, що містить:
2-аміно-8-(транс-4-гідроксициклогексил)-4-метил-7-оксо-N-1Н-піразол-5-іл-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
2-аміно-N-(1-етил-1Н-піразол-5-іл)-8-(транс-4-гідроксициклогексил)-4-метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
8-циклопентил-4-метил-2-метиламіно-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6-карбонової кислоти (1Н-піразол-3-іл)-амід;
2-аміно-8-ізопропіл-4-метил-7-оксо-N-1Н-піразол-5-іл-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
2-аміно-N-(1-етил-1Н-піразол-5-іл)-8-ізопропіл-4-метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
8-циклoпeнтил-N-[(1-етил-1Н-піразол-4-іл)метил]-4-метил-2-(метиламіно)-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
8-циклопентил-4-метил-2-(метиламіно)-7-оксо-N-піридин-2-іл-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід;
8-циклопентил-N-ізоксазол-3-іл-4-метил-2-(метиламіно)-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6-карбоксамід,
або її сіль.
9. Фармацевтична композиція, що містить принаймні одну сполуку або її сіль за пунктом 1 і фармацевтично прийнятний носій або розріджувач.
10. Фармацевтична композиція, що містить принаймні одну сполуку або її сіль за пунктом 5 і фармацевтично прийнятний носій або розріджувач.
11. Спосіб лікування анормального росту клітин у ссавця, який цього потребує, що включає стадію введення згаданому ссавцю терапевтично ефективної кількості принаймні однієї сполуки або її солі за пунктом 1.
12. Спосіб за пунктом 11, де анормальним ростом клітин є рак.
13. Спосіб лікування анормального росту клітин у ссавця, який цього потребує, що включає стадію введення згаданому ссавцю терапевтично ефективної кількості принаймні однієї сполуки або її солі за пунктом 5.
14. Спосіб за пунктом 13, де анормальним ростом клітин є рак.
15. Спосіб інгібування ферментної активності РІ3-Kα, в якому вводять у контакт РІ3-Kα фермент з РІ3-Kα-інгібувальною кількістю принаймні однієї сполуки або її солі за пунктом 1.
16. Спосіб інгібування ферментної активності РІ3-Kα, в якому вводять у контакт РІ3-Kα фермент з РІ3-Kα-інгібувальною кількістю принаймні однієї сполуки або її солі за пунктом 5.
17. Застосування сполуки або її солі за пунктом 1 при виготовленні медикаменту для лікування анормального росту клітин у ссавця.
18. Застосування сполуки або її солі за пунктом 5 при виготовленні медикаменту для лікування анормального росту клітин у ссавця.
Текст
1. Сполука Формули (І) 2 (19) 1 3 2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]4-метил-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин7(8Н)-он; 2-аміно-6-бром-8-[транс-4-(2гідроксіетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-4метил-6-(1Н-піразол-4-іл)піридо[2,3-d]піримідин7(8Н)-он; 2-аміно-8-(транс-4-{[(2S)-2,3дигідроксипропіл]окси}циклогексил)-6-(6метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-4метил-6-хінолін-3-ілпіридо[2,3-d]піримідин-7(8Н)он; 2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-[цис-4(2-гідроксіетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-6(2-метоксипіримідин-5-іл)-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-8-[цис-4-(2-гідроксіетокси)циклогексил]-6(6-метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-6-бром-8-[цис-4-(2гідроксіетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8Н)-он; 2-аміно-6-[6-(диметиламіно)піридин-3-іл]-8-[транс4-(2-гідроксіетокси)циклогексил]-4метилпіридо[2,3-d]піримідин-7(8Н)-он; 2-({транс-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід; метил ({транс-4-[2-аміно-6-(5-фтор-6метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3d]піримідин-8(7Н)-іл]циклогексил}оксі)ацетат; 2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]4-метил-6-(1Н-піразол-3-іл)піридо[2,3-d]піримідин7(8Н)-он, 2-аміно-8-[транс-4-(2-гідроксіетокси)циклогексил]4-метил-6-(1-метил-1Н-піразол-4-іл)піридо[2,3d]піримідин-7(8Н)-он, 2-({цис-4-[2-аміно-6-(6-метоксипіридин-3-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({цис-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({цис-4-[2-аміно-4-метил-7-оксо-6-(1Н-піразол-4іл)піридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({цис-4-[2-аміно-4-метил-6-(1-метил-1Н-піразол4-іл)-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({цис-4-[2-аміно-6-(2-метоксипіримідин-5-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-{[цис-4-(2-аміно-4-метил-7-оксо-6-хінолін-3ілпіридо[2,3-d]піримідин-8(7Н)іл)циклогексил]оксі}ацетамід, 2-({транс-4-[2-аміно-6-(6-метоксипіридин-3-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 95113 4 2-{[транс-4-(2-аміно-4-метил-7-оксо-6-хінолін-3ілпіридо[2,3-d]піримідин-8(7Н)іл)циклогексил]оксі}ацетамід, 2-({транс-4-[2-аміно-6-(2-метоксипіримідин-5-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({транс-4-[2-аміно-4-метил-7-оксо-6-(1Н-піразол4-іл)піридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-({транс-4-[2-аміно-4-метил-6-(1-метил-1Нпіразол-4-іл)-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклогексил}оксі)ацетамід, 2-аміно-8-[транс-3-(2-гідроксіетокси)циклобутил]-6(6-метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8Н)-он, 2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-[транс3-(2-гідроксіетокси)циклобутил]-4-метилпіридо[2,3d]піримідин-7(8Н)-он, 2-аміно-8-[транс-3-(2-гідроксіетокси)циклобутил]-6(2-метоксипіримідин-5-іл)-4-метилпіридо[2,3d]піримідин-7(8Н)-он, 2-({транс-3-[2-аміно-6-(6-метоксипіридин-3-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклобутил}оксі)ацетамід, 2-({транс-3-[2-аміно-6-(5-фтор-6-метоксипіридин-3іл)-4-метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклобутил}оксі)ацетамід, 2-({транс-3-[2-аміно-6-(2-метоксипіримідин-5-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7Н)іл]циклобутил}оксі)ацетамід, або її сіль. 5. Сполука Формули (II) CH3 R3 N R1HN N N R2 O (II) або її сіль, де: 1 R є Н або (С1-С6)алкіл, необов'язково, заміщений 4 принаймні однією R групою; 2 R є (С1-С6)алкіл, (С2-С8)алкеніл, (С3С10)циклоалкіл, (С5-С8)циклоалкеніл, (С2С9)циклогетероалкіл або -(СН2)n(С6-С14)арил, де згаданий (C1-С6)алкіл, (С2-С8)алкеніл, (С3С10)циклоалкіл, (С5-С8)циклоалкеніл, (С2С9)циклогетероалкіл і -(СН2)n(С6-С14)арил, необо4 в'язково, заміщений принаймні однією R групою; 3 R є (С1-С6)алкіл, (С2-С8)алкеніл, ціано, 5a 5a 5b (CH2)nC(O)OR або -(CH2)nC(O)N(R R ), де згаданий (С1-С6)алкіл або (С2-С8)алкеніл, необов'яз4 ково, заміщений принаймні однією R групою; 4 5a 5b кожен R є незалежно -ОН, галоген, CF3, -NR R , (С1-С6)алкіл, (С1-С6)алкокси, ціано, (С35a 5a 5b 5a С10)циклоалкіл, -S(O)mR , -S(O)mNR R , -C(O)R 5a 5b або -C(O)NR R ; 5a 5b R i R є кожен незалежно Н, (С1-С6)алкіл, (С2С9)циклогетероалкіл, (С2-С9)гетероарил або (С6С14)арил; кожен m є незалежно 1 або 2; і кожен n є незалежно 0, 1, 2, 3 або 4. 3 6. Сполука або її сіль за пунктом 5, де R є 5a 5b (CH2)nC(O)N(R R ). 2 7. Сполука або її сіль за пунктом 5 або 6, де R вибирають з групи, що містить ізопропіл, аліл, циклопентил, циклобутил, гідроксициклогексил, гід 5 95113 6 роксициклопентил, гідроксициклобутил, гідроксициклогептил, метоксіетил, метоксипропіл, етил, метил, циклопропіл, циклопропілметил, циклопропілетил, 2-метил-2-гідроксипропіл, 3-метил-3гідроксибутил, метоксибензил і хлорбензил. 8. Сполука за пунктом 5, яку вибирають з групи, що містить: 2-аміно-8-(транс-4-гідроксициклогексил)-4-метил7-оксо-N-1Н-піразол-5-іл-7,8-дигідропіридо[2,3d]піримідин-6-карбоксамід; 2-аміно-N-(1-етил-1Н-піразол-5-іл)-8-(транс-4гідроксициклогексил)-4-метил-7-оксо-7,8дигідропіридо[2,3-d]піримідин-6-карбоксамід; 8-циклопентил-4-метил-2-метиламіно-7-оксо-7,8дигідропіридо[2,3-d]піримідин-6-карбонової кислоти (1Н-піразол-3-іл)-амід; 2-аміно-8-ізопропіл-4-метил-7-оксо-N-1Н-піразол5-іл-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; 2-аміно-N-(1-етил-1Н-піразол-5-іл)-8-ізопропіл-4метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; 8-циклoпeнтил-N-[(1-етил-1Н-піразол-4-іл)метил]4-метил-2-(метиламіно)-7-оксо-7,8дигідропіридо[2,3-d]піримідин-6-карбоксамід; 8-циклопентил-4-метил-2-(метиламіно)-7-оксо-Nпіридин-2-іл-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; 8-циклопентил-N-ізоксазол-3-іл-4-метил-2(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-карбоксамід, або її сіль. 9. Фармацевтична композиція, що містить принаймні одну сполуку або її сіль за пунктом 1 і фармацевтично прийнятний носій або розріджувач. 10. Фармацевтична композиція, що містить принаймні одну сполуку або її сіль за пунктом 5 і фармацевтично прийнятний носій або розріджувач. 11. Спосіб лікування анормального росту клітин у ссавця, який цього потребує, що включає стадію введення згаданому ссавцю терапевтично ефективної кількості принаймні однієї сполуки або її солі за пунктом 1. 12. Спосіб за пунктом 11, де анормальним ростом клітин є рак. 13. Спосіб лікування анормального росту клітин у ссавця, який цього потребує, що включає стадію введення згаданому ссавцю терапевтично ефективної кількості принаймні однієї сполуки або її солі за пунктом 5. 14. Спосіб за пунктом 13, де анормальним ростом клітин є рак. 15. Спосіб інгібування ферментної активності РІ3Kα, в якому вводять у контакт РІ3-Kα фермент з РІ3-Kα-інгібувальною кількістю принаймні однієї сполуки або її солі за пунктом 1. 16. Спосіб інгібування ферментної активності РІ3Kα, в якому вводять у контакт РІ3-Kα фермент з РІ3-Kα-інгібувальною кількістю принаймні однієї сполуки або її солі за пунктом 5. 17. Застосування сполуки або її солі за пунктом 1 при виготовленні медикаменту для лікування анормального росту клітин у ссавця. 18. Застосування сполуки або її солі за пунктом 5 при виготовленні медикаменту для лікування анормального росту клітин у ссавця. Пріоритет цієї заявки заявлений в попередній заявці US № 60/845,065, що подана 15 вересня 2006, попередній заявці US № 60/947,852, що подана 3 липня 2007 і попередній заявці US № 60/952,628, що подана 30 липня 2007, вміст яких включений як посилання у всій їх повноті. Представлений винахід стосується нових 4метилпіридопіримідинонів і їх солей, їх синтезу і їх застосування як модуляторів або інгібіторів ферменту фосфоінозитид 3-кінази альфа (PI3-Kα). Сполуки представленого винаходу корисні для модулювання (наприклад, інгібування) активності PI3-Kα і для лікування захворювань або станів опосередкованих PI3-Kα, таких як наприклад, хворобливі стани пов„язані з анормальним ростом клітин, такі як рак. Передумови створення винаходу Фосфоінозитид 3-кінази (PI3-K) каналізують синтез вторинних месенджерів фосфатидилінозиту (PI) PI(3)P, PI(3,4)P2 і PI(3,4,5)P3 (PIP3). (Fruman et al., Phosphoinositide kinases, Annu. Rev. Biochem. 67 (1998), pp. 481–507; Knight et al., A Pharmacological Map of the PI3-K Family Defines a Role for p110α in Insulin Signaling, Cell 125 (2006), pp. 733-747.) В прийнятному клітинному контексті, ці три ліпіди контролюють різноманітні фізіологічні процеси, що включають ріст клітини, виживання, диференціацію і хемотаксис. (Katso et al., Cellular function of phosphoinositide 3-kinases: implications for development, homeostasis, and cancer, Annu. Rev. Cell Dev. Biol. 17 (2001), pp. 615–675.) PI3-K родина включає принаймні 15 різних ферментів, що підрозділяються на класи за структурною гомологією, з окремою субстратною специфічністю, системою експресії і шляхами регулювання. Головною ізоформою PI3-кінази в раку є Клас I PI3-Kα, що включає каталітичну (p110α) і адаптерну (p85) підодиниці. (Stirdivant et al., Cloning and mutagenesis of the p110α subunit of human phosphoinositide 3‟-hydroxykinase, Bioorg. Med. Chem. 5 (1997), pp. 65-74.) 3-Фосфорильовані фосфоліпіди (PIP3), що генеруються PI3-K, діють як вторинні месенджери втягнутої кінази з ліпідів„язувальними доменами (включаючи плекстрім гомологічні (PH) регіони), такі як Akt і фосфоінозитид-залежна кіназа-1 (PDK1). (Vivanco & Sawyers, The Phosphatidylinositol 3-Kinase–Akt Pathway In Human Рак, Nature Reviews Рак 2 (2002), pp. 489-501.) Приєднання Akt до мембрани PIP3 викликає транслокацію Akt до плазматичної мембрани, введення Akt в контакт з PDK1, що відповідає за активуван 7 ня Akt. Пухлино-пригнічуюча фосфатаза, PTEN, дефосфорилює PIP3 і таким чином діє як негативний регулятор активації Akt. PI3-K, Akt і PDK1 є важливими в регулюванні багатьох клітинних процесів включаючи регулювання клітинного циклу, проліферацію, виживання, апоптоз і рухливість і є важливими компонентами молекулярних механізмів захворювання, таких як рак, діабет і імунне запалення. Декілька компонентів PI3-K/Akt/PTEN шляху втягнуті в онкогенез. На додаток рецептора фактора росту тірозинкіназ, інтегринзалежна адгезія клітини і G-протеїн зв„язувальні рецептори активують PI3-K і безпосередньо, і не безпосередньо через молекули адаптери. Функціональна втрата PTEN (найбільш звичайно мутований пухлиносупресорний ген в раку після p53), онкогенні мутації в PIK3CA гені, що кодує PI3-Kα, ампліфікація PIK3CA гену і надмірна експресія Akt звичайні в багатьох злоякісних утвореннях. (дивіться, наприклад, Samuels, et al., High frequency of mutations of the PIK3CA gene in human cancers, Science 304 (2004), p. 554; Broderick et al., Mutations in PIK3CA in anaplastic oligodendrogliomas, high-grade astrocytomas, and medulloblastomas, Cancer Research 64 (2004), pp. 5048-5050.). Таким чином, PI3-Kα є цікавою ціллю для розробки протиракового препарату, оскільки такі агенти, як очікується, будуть інгібувати проліферацію і долати резистентність до цитотоксичних агентів в ракових клітинах. Існує потреба в одержанні нових інгібіторів PI3-Kα, що є добрими кандидатами в лікарські засоби. Вони повинні бути біодоступними, стабільними до метаболізму і мати відмінні фармакокінетичні властивості. В одному з втілень, представлений винахід є сполукою формулою (I) або її сіллю, де: 1 R є H або (C1 - C6) алкіл, необов„язково, замі5 щений принаймні однією R групою; A є 3 - 10 членна циклоалкільна група; 2 R є (C1 - C6) алкіл заміщений принаймні одні6 єю R групою, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C14) арил, (C2 - C9) гетероарил, 7a 7b 8a 8b NR R , або -N=CR R , де кожен згаданий (C3 C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 C14) арил і (C2 - C9) гетероарил, необов„язково, 9 заміщений принаймні однією R групою; 3 R є (C1 - C6) алкіл, (C3 - C10) циклоалкіл, (C2 C9) циклогетероалкіл, (C2 - C8) алкеніл, (C2 - C8) 10 алкініл, галоген, ціано, -(CH2)nC(O)OR , 11a 11b 12 (CH2)nC(O)N(R R ), COR , (C6 - C14) арил або (C2 - C9) гетероарил, де згаданий (C1 - C6) алкіл, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C2 - C8) алкеніл, (C2 - C8) алкініл, (C6 - C14) арил і 95113 8 (C2 - C9) гетероарил, необов„язково, заміщений 9 принаймні однією R групою; 4 кожен R є незалежно -OH, галоген, CF3, 11a 11b NR R , (C1 - C6) алкіл, (C1 - C6) алкеніл, (C1 - C6) алкініл, (C1 - C6) алкокси, ціано, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C14) арил, (C2 12 11a 11b C9) гетероарил, -C(O)R -C(O)NR R , 12 11a 11b 11a 12 S(O)mR , -S(O)mNR R , -NR S(O)mR 10 11a 11b 12 (CH2)nC(O)OR , -(CH2)nC(O)N(R R ), -OC(O)R , 11a 12 11a 11a 11b -NR C(O)R або -NR C(O)N(R R ), де кожен згаданий (C1 - C6) алкіл, (C1 - C6) алкеніл, (C1 - C6) алкініл, (C1 - C6) алкокси, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C12) арил і (C2 - C9) гетероарил, необов„язково, заміщений принаймні 13 однією R групою; 5 кожен R є незалежно -OH, галоген, CF3, 11a 11b -NR R , (C1 - C6) алкіл, (C1 - C6) алкокси, ціано, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, 12 (C6 - C14) арил, (C2 - C9) гетероарил, -S(O)mR , 11a 11b 12 11a 11b S(O)mNR R , -C(O)R або -C(O)NR R , де кожен згаданий (C1 - C6) алкіл, (C1 - C6) алкокси, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C14) арил і (C2 - C9) гетероарил, нео9 бов„язково, заміщений принаймні однією R групою; 6 кожен R є незалежно -OH, (C1 - C6) алкініл, ціано, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероал12 кіл, (C6 - C14) арил, (C2 - C9) гетероарил, -C(O)R 11a 11b 12 11a 11b C(O)NR R , -S(O)mR , -S(O)mNR R , 11a 12 10 NR S(O)mR -(CH2)nC(O)OR , 11a 11b 12 11a 12 (CH2)nC(O)N(R R ), -OC(O)R , -NR C(O)R 11a 11a 11b або -NR C(O)N(R R ), де кожен згаданий (C1 C6) алкініл, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C12) арил і (C2 - C9) гетероарил, 13 необов„язково, заміщений принаймні однією R групою; 7a 7b R і R є кожен незалежно H, (C1 - C6) алкіл, (C2 - C6)алкеніл, (C2 - C6)алкініл, (C3 - C10) циклоалкіл, або (C6 - C10)арил, де кожен згаданий (C1 - C6) алкіл, (C2 - C6)алкеніл, (C2 - C6)алкініл, (C3 - C10) циклоалкіл і (C6 - C10)арил, необов„язково, заміще9 7a 7b ний принаймні однією R групою; або R і R можуть бути узяті разом з атомом азоту утворюючи 5 - 8 членне гетероциклічне кільце, де згадане гетероциклічне кільце має 1 - 3 кільцевих гетероатомів, що вибирають з групи, яка містить N, O, і S і де згадане 5 - 8 членне циклогетероалкільне кіль9 це, необов„язково, заміщене принаймні однією R групою; 8a 8b R і R є кожен незалежно H, (C1 - C6) алкіл або (C3 - C10) циклоалкіл, де кожен згаданий (C1 C6) алкіл і (C3 - C10) циклоалкіл, необов„язково, 9 заміщений принаймні однією R групою; 9 кожен R є незалежно -OH, галоген, CF3, 11a 11b NR R , (C1 - C6) алкіл, (C1 - C6) алкеніл, (C1 - C6) алкініл, (C1 - C6) алкокси, ціано, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C14) арил, (C2 12 11a 11b C9) гетероарил, -C(O)R -C(O)NR R , 12 11a 11b 11a 12 S(O)mR , -S(O)mNR R , -NR S(O)mR 10 11a 11b 12 (CH2)nC(O)OR , -(CH2)nC(O)N(R R ), -OC(O)R , 11a 12 11a 11a 11b -NR C(O)R або –NR C(O)N(R R ), де кожен згаданий (C1 - C6) алкіл, (C1 - C6) алкеніл, (C1 - C6) алкініл, (C1 - C6) алкокси, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C12) арил і (C2 - C9) гетероарил, необов„язково, заміщений принаймні 9 13 однією R групою; 10 кожен R є незалежно H або (C1 - C6) алкіл; 11a 11b R і R є кожен незалежно H, (C1 - C6) алкіл, (C2 - C9) циклогетероалкіл, (C2 - C9) гетероарил або (C6 - C12) арил, де кожен згаданий (C1 - C6) алкіл, (C2 - C9) циклогетероалкіл, (C2 - C9) гетероарил і (C6 - C12) арил, необов„язково, заміщений 13 принаймні однією R групою; 12 кожен з R є незалежно (C1 - C6) алкіл, (C3 C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C2 C9) гетероарил або (C6 - C14) арил, де кожен згаданий (C1 - C6) алкіл, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C2 - C9) гетероарил і (C6 - C14) арил, необов„язково, заміщений принаймні однією 13 R групою; 13 кожен з R є незалежно -OH, галоген, CF3, (C1 - C6) алкіл, (C1 - C6) алкеніл, (C1 - C6) алкініл, (C1 C6) алкокси, ціано, (C3 - C10) циклоалкіл, (C2 - C9) циклогетероалкіл, (C6 - C14) арил, (C2 - C9) гетероарил, аміно, карбоніл, C-амідо, сульфініл, Sсульфонамідо, C-карбоксил, N-амідо або Nкарбаміл; кожен m є незалежно 1 або 2; кожен n є незалежно 0, 1, 2, 3, або 4; і кожен z є цілим числом, що незалежно вибирають з 0, 1, 2, 3, 4, 5, 6, 7 або 8. Одним з аспектів цього втілення є сполука Формули (I), як описано вище, де A вибирають з групи, що містить циклобутил, циклопентил і циклогексил. Наступним аспектом цього втілення є сполука 3 Формули (I), як описано вище, де R є (C6 - C14) арил або (C2 - C9) гетероарил, де згаданий (C6 C14) арил або (C2 - C9) гетероарил, необов„язково, 9 заміщений принаймні однією R групою. Наступним аспектом цього втілення є сполука Формули (I), як описано вище, яку вибирають з групи, що містить: 2-аміно-6-(5-фтор-6метоксипіридин-3-іл)-8-[транс-4-(2гідроксиетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[транс-4-(2гідроксиетокси)циклогексил]-6-(6-метоксипіридин3-іл)-4-метилпіридо[2,3-d]піримідин-7(8H)-он; 2аміно-8-[транс-4-(2-гідроксиетокси)циклогексил]-4метил-6-хінолін-3-ілпіридо[2,3-d]піримідин-7(8H)он; 2-аміно-8-[транс-4-(2гідроксиетокси)циклогексил]-6-(2метоксипіримідин-5-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[транс-4-(2гідроксиетокси)циклогексил]-4-метил-6-(1Hпіразол-4-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-6-бром-8-[транс-4-(2гідроксиетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[цис-4-(2гідроксиетокси)циклогексил]-4-метил-6-(1Hпіразол-4-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-8-(транс-4-{[(2S)-2,3дигідроксипропіл]окси}циклогексил)-6-(6метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[цис-4-(2гідроксиетокси)циклогексил]-4-метил-6-хінолін-3ілпіридо[2,3-d]піримідин-7(8H)-он; 2-аміно-6-(5фтор-6-метоксипіридин-3-іл)-8-[цис-4-(2гідроксиетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[цис-4-(2 95113 10 гідроксиетокси)циклогексил]-6-(2метоксипіримідин-5-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-[цис-4-(2гідроксиетокси)циклогексил]-6-(6-метоксипіридин3-іл)-4-метилпіридо[2,3-d]піримідин-7(8H)-он; 2аміно-6-бром-8-[цис-4-(2гідроксиетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-6-[6(диметиламіно)піридин-3-іл]-8-[транс-4-(2гідроксиетокси)циклогексил]-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-({транс-4-[2-аміно-6-(5фтор-6-метоксипіридин-3-іл)-4-метил-7оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід; метил ({транс-4-[2аміно-6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетат; 2-аміно-8-[транс-4-(2гідроксиетокси)циклогексил]-4-метил-6-(1Hпіразол-3-іл)піридо[2,3-d]піримідин-7(8H)-он, 2аміно-8-[транс-4-(2-гідроксиетокси)циклогексил]-4метил-6-(1-метил-1H-піразол-4-іл)піридо[2,3d]піримідин-7(8H)-он, 2-({цис-4-[2-аміно-6-(6метоксипіридин-3-іл)-4-метил-7-оксопіридо[2,3d]піримідин-8(7H)-іл]циклогексил}окси)ацетамід, 2({цис-4-[2-аміно-6-(5-фтор-6-метоксипіридин-3-іл)4-метил-7-оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-({цис-4-[2-аміно-4метил-7-оксо-6-(1H-піразол-4-іл)піридо[2,3d]піримідин-8(7H)-іл]циклогексил}окси)ацетамід, 2({цис-4-[2-аміно-4-метил-6-(1-метил-1H-піразол-4іл)-7-оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-({цис-4-[2-аміно-6(2-метоксипіримідин-5-іл)-4-метил-7оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-{[цис-4-(2-аміно-4метил-7-оксо-6-хінолін-3-ілпіридо[2,3-d]піримідин8(7H)-іл)циклогексил]окси}ацетамід, 2-({транс-4-[2аміно-6-(6-метоксипіридин-3-іл)-4-метил-7оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-{[транс-4-(2-аміно4-метил-7-оксо-6-хінолін-3-ілпіридо[2,3d]піримідин-8(7H)-іл)циклогексил]окси}ацетамід, 2({транс-4-[2-аміно-6-(2-метоксипіримідин-5-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-({транс-4-[2-аміно4-метил-7-оксо-6-(1H-піразол-4-іл)піридо[2,3d]піримідин-8(7H)-іл]циклогексил}окси)ацетамід, 2({транс-4-[2-аміно-4-метил-6-(1-метил-1H-піразол4-іл)-7-оксопіридо[2,3-d]піримідин-8(7H)іл]циклогексил}окси)ацетамід, 2-аміно-8-[транс-3(2-гідроксиетокси)циклобутил]-6-(6метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он, 2-аміно-6-(5-фтор-6метоксипіридин-3-іл)-8-[транс-3-(2гідроксиетокси)циклобутил]-4-метилпіридо[2,3d]піримідин-7(8H)-он, 2-аміно-8-[транс-3-(2гідроксиетокси)циклобутил]-6-(2-метоксипіримідин5-іл)-4-метилпіридо[2,3-d]піримідин-7(8H)-он, 2({транс-3-[2-аміно-6-(6-метоксипіридин-3-іл)-4метил-7-оксопіридо[2,3-d]піримідин-8(7H)іл]циклобутил}окси)ацетамід, 2-({транс-3-[2-аміно6-(5-фтор-6-метоксипіридин-3-іл)-4-метил-7оксопіридо[2,3-d]піримідин-8(7H)іл]циклобутил}окси)ацетамід, 2-({транс-3-[2-аміно6-(2-метоксипіримідин-5-іл)-4-метил-7 11 оксопіридо[2,3-d]піримідин-8(7H)іл]циклобутил}окси)ацетамід, або її сіль. Наступним аспектом представленого винаходу є сполука Формули (II) або її сіль, де: 1 R є H або (C1 - C6) алкіл, необов„язково, замі4 щений принаймні однією R групою; 2 R є (C1 - C6) алкіл, (C2 - C8) алкеніл, (C3 - C10) циклоалкіл, (C5 - C8) циклоалкеніл, (C2 - C9) циклогетероалкіл або -(CH2)n(C6 - C14) арил, де згаданий (C1 - C6) алкіл, (C2 - C8) алкеніл, (C3 - C10) циклоалкіл, (C5 - C8) циклоалкеніл, (C2 - C9) циклогетероалкіл і -(CH2)n(C6 - C14) арил, необов„язково, заміще4 ний принаймні однією R групою; 3 R є (C1 - C6) алкіл, (C2 - C8) алкеніл, ціано, 5a 5a 5b (CH2)nC(O)OR або -(CH2)nC(O)N(R R ), де згаданий (C1 - C6) алкіл або (C2 - C8) алкеніл, нео4 бов„язково, заміщений принаймні однією R групою; 4 кожен R є незалежно -OH, галоген, CF3, 5a 5b NR R , (C1 - C6) алкіл, (C1 - C6) алкокси, ціано, (C3 5a 5a 5b - C10) циклоалкіл, -S(O)mR , -S(O)mNR R , 5a 5a 5b C(O)R або -C(O)NR R ; 5a 5b R і R є кожен незалежно H, (C1 - C6) алкіл, (C2 - C9) циклогетероалкіл, (C2 - C9) гетероарил або (C6 - C14) арил; кожен m є незалежно 1 або 2; і кожен n є незалежно 0, 1, 2, 3, або 4. Наступним аспектом цього втілення є сполука 3 5a 5b Формули (II), де R є -(CH2)nC(O)N(R R ). Наступним аспектом цього втілення є сполука 2 Формули (II), де R вибирають з групи, що містить ізопропіл, аліл, циклопентил, циклобутил, гідроксициклогексил, гідроксициклопентил, гідроксициклобутил, гідроксициклогептил, метоксиетил, метоксипропіл, етил, метил, циклопропіл, циклопропілметил, циклопропілетил, 2-метил-2гідроксипропіл, 3-метил-3-гідроксибутил, метоксибензил і хлорбензил. Наступним аспектом представленого винаходу є сполука Формули (II), як описано вище, яку вибирають з групи, що містить: 2-Аміно-8-(транс-4гідроксициклогексил)-4-метил-7-оксо-N-1Hпіразол-5-іл-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; 2-аміно-N-(1-етил-1H-піразол-5-іл)-8(транс-4-гідроксициклогексил)-4-метил-7-оксо-7,8дигідропіридо[2,3-d]піримідин-6-карбоксамід; 8Циклопентил-4-метил-2-метиламіно-7-оксо-7,8дигідро-піридо[2,3-d]піримідин-6-карбонової кислоти (1H-піразол-3-іл)-амід; 2-аміно-8-ізопропіл-4метил-7-оксо-N-1H-піразол-5-іл-7,8дигідропіридо[2,3-d]піримідин-6-карбоксамід; 2аміно-N-(1-етил-1H-піразол-5-іл)-8-ізопропіл-4метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; 8-циклопентил-N-[(1-етил-1H-піразол4-іл)метил]-4-метил-2-(метиламіно)-7-оксо-7,8дигідропіридо[2,3-d]піримідин-6-карбоксамід; 8 95113 12 циклопентил-4-метил-2-(метиламіно)-7-оксо-Nпіридин-2-іл-7,8-дигідропіридо[2,3-d]піримідин-6карбоксамід; і 8-циклопентил-N-ізоксазол-3-іл-4метил-2-(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-карбоксамід, або її сіль. Наступним аспектом представленого винаходу є сполука Формули (III) або її сіль, де: 1 R є H або (C1 - C6) алкіл, необов„язково, замі4 щений принаймні однією R групою; 2 R є спіроциклічна група, необов„язково, замі4 щена принаймні однією R групою; 3 R є (C1 - C6) алкіл, (C2 - C8) алкеніл, ціано, 5 6a 6b (CH2)nC(O)OR , -(CH2)nC(O)N(R R ), (C6 - C14) арил або (C2 - C9) гетероарил, де згаданий (C1 C6) алкіл або (C2 - C8) алкеніл, необов„язково, за4 міщений принаймні однією R групою, і де згаданий (C6 - C14) арил або (C2 - C9) гетероарил, нео7 бов„язково, заміщений принаймні однією R групою; 4 кожен R є незалежно -OH, галоген, CF3, 6a 6b -NR R , (C1 - C6) алкіл, (C1 - C6) алкокси, ціано, 6a 6a 6b (C3 - C8) циклоалкіл, -S(O)mR , -S(O)mNR R , 6a 6a 6b C(O)R або -C(O)NR R ; 5 кожен R є незалежно H або (C1 - C6) алкіл; 6a 6b R і R є кожен незалежно H, (C1 - C6) алкіл, (C2 - C9) циклогетероалкіл, (C2 - C9) гетероарил або (C6 - C14) арил; 7 6a 6b кожен з R є незалежно -OH, галоген, -NR R , ціано, (C1 - C6) алкіл, (C1 - C6) алкокси, (C3 - C10) 6a циклоалкіл, (C2 - C9) циклогетероалкіл, -S(O)mR , 6a 6b 5 -S(O)mNR R , -(CH2)nC(O)OR , 6a 6b 6a 6a 6b (CH2)nC(O)N(R R ), -OC(O)R , або -NR C(O)R , де кожен згаданий (C1 - C6) алкіл, (C1 - C6) алкокси, (C2 - C9) циклогетероалкіл і (C3 - C10) циклоалкіл, 4 необов„язково, заміщений принаймні однією R групою; кожен m є незалежно 1 або 2; і кожен n є незалежно 0, 1, 2, 3, або 4. Наступним аспектом представленого винаходу є сполука, що вибирають з групи, яка містить: 2аміно-8-(транс-4-гідроксициклогексил)-6-(6метоксипіридин-3-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-(цис-4гідроксициклогексил)-6-(6-метоксипіридин-3-іл)-4метилпіридо[2,3-d]піримідин-7(8H)-он; 2-аміно-6-[6(диметиламіно)піридин-3-іл]-8-(транс-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-(транс-4гідроксициклогексил)-4-метил-6-хінолін-3ілпіридо[2,3-d]піримідин-7(8H)-он; 2-аміно-6-(2,3дигідро-1,4-бензодіоксин-6-іл)-8-(транс-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-6-(5-фтор-6метоксипіридин-3-іл)-8-(транс-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-(транс-4 13 гідроксициклогексил)-4-метил-6-(6-піролідин-1ілпіридин-3-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-6-(5-фтор-6-метоксипіридин-3-іл)-8-(цис-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-6-(6-етоксипіридин-3іл)-8-(транс-4-гідроксициклогексил)-4метилпіридо[2,3-d]піримідин-7(8H)-он; 2-аміно-6-[6(диметиламіно)піридин-3-іл]-8-(цис-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-(транс-4метоксициклогексил)-4-метил-6-(1H-піразол-4іл)піридо[2,3-d]піримідин-7(8H)-он; 2-аміно-8-(цис4-гідрокси-4-метилциклогексил)-4-метил-6-(1Hпіразол-4-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-8-(транс-4-гідроксициклогексил)-4-метил-6(1H-піразол-3-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-8-(цис-4-гідроксициклогексил)-6-(2метоксипіримідин-5-іл)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-аміно-8-(транс-4гідроксициклогексил)-6-(2-метоксипіримідин-5-іл)4-метилпіридо[2,3-d]піримідин-7(8H)-он; 8-(транс4-гідроксициклогексил)-6-(6-метоксипіридин-3-іл)4-метил-2-(метиламіно)піридо[2,3-d]піримідин7(8H)-он; 2-(етиламіно)-6-(5-фтор-6метоксипіридин-3-іл)-8-(транс-4гідроксициклогексил)-4-метилпіридо[2,3d]піримідин-7(8H)-он; 2-(етиламіно)-8-(транс-4гідроксициклогексил)-6-(2-метоксипіримідин-5-іл)4-метилпіридо[2,3-d]піримідин-7(8H)-он; 2-аміно-8(транс-4-гідроксициклогексил)-4-метил-6-(1-метил1H-піразол-4-іл)піридо[2,3-d]піримідин-7(8H)-он; 2аміно-8-(транс-4-гідроксициклогексил)-4-метил-6(1H-піразол-4-іл)піридо[2,3-d]піримідин-7(8H)-он; 2[(2,2-дифторетил)аміно]-8-(транс-4гідроксициклогексил)-6-(6-метоксипіридин-3-іл)-4метилпіридо[2,3-d]піримідин-7(8H)-он, або її сіль. Наступним втіленням є будь-які аспекти описані вище в комбінації з будь-яким іншим аспектом описаним вище, які не протирічать їм. Представлений винахід також стосується фармацевтичної композиції, що містить принаймні одну сполуку, як тут описано, або її сіль, і фармацевтично прийнятний носій або розріджувач. Представлений винахід також стосується способу лікування анормального росту клітин, або будь-якого PI3-Kα-опосередкованого захворювання або стану, у ссавця, який цього потребує, що включає стадію введення згаданому ссавцю терапевтично ефективної кількості принаймні однієї сполуки як тут описано, або її солі. Наприклад, в одному з втілень, анормальним ростом клітини є рак. В наступному втіленні, анормальним ростом клітин не є рак. Представлений винахід також стосується способу інгібування ферментної активності PI3-Kα, що включає контактування PI3-Kα ферменту з PI3-Kαінгібувальною кількістю принаймні однієї сполукою, як тут описано, або її сіллю. Представлений винахід також стосується застосування будь-якої із сполук, як тут описано, або її солі, при виготовленні медикаменту для лікування анормального росту клітин у ссавця. Представлений винахід також стосується способів одержання сполук, як тут описано, використовуючи способи показані в особливих прикладах 95113 14 тут і в загальних способах синтезу A, B, C, д, E, F, H і I, як тут описано. Представлений винахід також стосується будь-яких сполук описаних вище або їх солей, для використання як медикаменту. Представлений винахід також стосується застосування будь-яких сполук описаних вище або їх солей, для виготовлення медикаменту для лікування анормального росту клітини. Короткий опис малюнків На ФІГ. 1 показаний приклад дозо-залежної протипухлинної дії 2-аміно-8-(транс-4гідроксициклогексил)-6-(6-метоксипіридин-3-іл)-4метилпіридо[2,3-d]піримідин-7(8H)-ону (Сполука 152) на модель PC3 пухлини. ФІГ. 2 показаний приклад дозо-залежної протипухлинної дії Сполуки 152 на моделі SKOV3 пухлини. ФІГ. 3 показаний приклад дозо-залежної протипухлинної дії Сполуки 152 на моделі U87MG пухлини. Як тут використовується, терміни “включає” і “містить” використовуються в їх вільному необмеженому значенні. Терміни "гало" і/або “галоген” стосуються фтору, хлору, брому або йоду. Термін “(C1 - C6)” алкіл стосується насиченого моновалентного вуглеводневого радикалу, що має нерозгалужену або розгалужено будову і містить від 1 до 6 атомів вуглецю. Прикладами (C1 - C6) алкільних груп є метил, етил, пропіл, 2-пропіл, нбутил, ізо-бутил, трет-бутил, пентил і т.і.. Терміни “Me” і “метил,” як тут використовується, означають -CH3 групу. Терміни “Et” і “етил,” як тут використовується, означають -C2H5 групу. Термін "(C2 - C8) алкеніл", як тут використовується, означає алкільний замісник, що містить від 2 до 8 вуглеців і має принаймні один вуглецьвуглецевий подвійний зв„язок. Вуглець-вуглецевий подвійний зв„язок в такій групі може бути розташований деінде серед 2 - 8 вуглецевого ланцюга утворюючи стабільну сполуку. Такі групи включають і E, і Z ізомери згаданого алкенільного замісника. Прикладами таких груп є, але не обмежується, етеніл, пропеніл, бутеніл, аліл і пентеніл. Термін “аліл,” як тут використовується, означає CH2CH=CH2 групу. Термін, “C(R)=C(R),” як тут використовується, представляє вуглець-вуглецевий подвійний зв„язок, в якому кожен вуглець є заміщеним R групою. Як тут використовується, термін “(C2 - C8) алкініл” означає алкільний замісник, що містить від 2 до 8 вуглеців і має принаймні один вуглецьвуглецевий потрійний зв„язок. Вуглець-вуглецевий потрійний зв„язок в такій групі може бути розташований деінде серед 2 - 8 вуглецевого ланцюга утворюючи стабільну сполуку. Прикладами таких груп є, але не обмежується, етин, пропін, 1-бутин, 2-бутин, 1-пентин, 2-пентин, 1-гексин, 2-гексин і 3гексин. Термін "(C1 - C8) алкокси", як тут використовується, означає O-алкільну групу, де згадана алкільна група містить від 1 до 8 атомів вуглецю і є нерозгалуженою, розгалуженою або циклічною. Прикладами таких груп є, але не обмежується, 15 метокси, етокси, е-пропілокси, ізо-пропілокси, нбутокси, ізо-бутокси, трет-бутокси, циклопентилокси і циклогексилокси. Термін “(C6 - C14) арил”, як тут використовується, означає групу похідну від ароматичного вуглеводню, що містить від 6 до 14 атомів вуглецю. Прикладами таких груп є, але не обмежується, феніл або нафтил. Терміни “Ph” і “феніл,” як тут використовуються, означають -C6H5 групу. Термін “бензил,” як тут використовується, означає -CH2C6H5 групу. “(C2 - C9) гетероарил”, як тут використовується, означає ароматичну гетероциклічну групу, що має загалом від 5 до 10 атомів в кільці і містить від 2 до 9 атомів вуглецю і від одного до чотирьох гетероатомів кожен з яких незалежно вибирають з O, S і N і, за умови, що кільце згаданої групи не містить два сусідні O атоми або два сусідні S атоми. Гетероциклічні групи включають бензоконденсовані циклічні системи. Прикладами ароматичних гетероциклічних груп є піридиніл, імідазоліл, піримідиніл, піразоліл, триазоліл, піразиніл, тетразоліл, фурил, тієніл, ізоксазоліл, тіазоліл, оксазоліл, ізотіазоліл, піроліл, хінолініл, ізохінолініл, індоліл, бензімідазоліл, бензoфураніл, цинолілніл, індазоліл, індолізиніл, фталазиніл, піридазиніл, триазиніл, ізоіндоліл, птеридиніл, пуриніл, оксадіазоліл, тіадіазоліл, фуразиніл, бензoфуразиніл, бензoтіофеніл, бензoтіазоліл, бензоксазоліл, хіназолініл, хіноксалініл, нафтиридиніл і фуропіридиніл. C2 - C9 гетероарильні групи можуть бути C-приєднаними або N-приєднаними, коли це можливо. Наприклад, група похідна від піролу може бути пірол-1-ілом (N-приєднаним) або пірол-3-ілом (C-приєднаним). Крім того, група похідна від імідазолу може бути імідазол-1-ілом (Nприєднаним) або імідазол-3-ілом (C-приєднаним). “(C2 - C9) циклогетероалкіл”, як тут використовується, означає неароматичну, моноциклічну, біциклічну, трициклічну, спіроциклічну або тетрациклічну групу, що має загалом від 4 до 13 атомів в кільцевій системі і містить від 2 до 9 атомів вуглецю і від 1 до 4 гетероатомів кожен з яких незалежно вибирають з O, S і N і, за умови, що кільце згаданої групи не містить два сусідні O атоми або два сусідні S атоми. Крім того, такі C2 - C9 циклогетероалкільні групи можуть містити оксозамісник по будь-якому доступному атому, що дає стабільну сполуку. Наприклад, така група може містити оксоатом по доступному атомі вуглецю або атому азоту. Така група може містити більше ніж один оксозамісник, якщо це допустимо з хімічної точки зору. Крім того, зрозуміло, що коли така C 2 - C9 циклогетероалкільна група містить атом сірки, згаданий атом сірки може бути окислений одним або двома атомами кисню утворюючи або сульфоксид, або сульфон. Прикладом 4 членної циклогетероалкільної групи є азетидиніл (похідне від азетидину). Прикладом 5 членної циклогетероалкільної групи є піролiдиніл. Прикладом 6 членної циклогетероалкільної групи є піперидиніл. Прикладом 9 членної циклогетероалкільної групи є індолініл. Прикладом 10 членної циклогетероалкільної групи є 4H-хінолізиніл. Додатковими прикладами таких C2 - C9 циклогетероалкільних груп є, але не обме 95113 16 жується, тетрагідрофураніл, дигідрофураніл, тетрагідротієніл, тетрагідропіраніл, дигідропіраніл, тетрагідротіопіраніл, піперидино, морфоліно, тіоморфоліно, тіоксаніл, піперазиніл, азетидиніл, оксетаніл, тієтаніл, гомопіперидиніл, оксепаніл, тієпаніл, оксазепаніл, діазепаніл, тіазепаніл, 1,2,3,6тетрагідропіридиніл, 2-піролiніл, 3-піролініл, індолініл, 2H-піраніл, 4H-піраніл, діоксаніл, 1,3діоксоланіл, піразолiніл, дітіаніл, дітіоланіл, дигідропіраніл, дигідротієніл, дигідрофураніл, піразолідиніл, імідазолініл, імідазолідиніл, 3азабіцикло[3.1.0]гексаніл, 3азабіцикло[4.1.0]гептаніл, 3H-індоліл хінолізиніл, 3оксопіперазиніл, 4-метилпіперазиніл, 4етилпіперазиніл і 1-оксо-2,8-діазаспіро[4.5]дец-8ил. Термін "(C3 - C10) циклоалкільна група" означає насичене, моноциклічне, конденсоване, спіроциклічне або поліциклічне кільце, що має загалом від 3 до 10 кільцевих атомів вуглецю. Прикладами таких груп є, але не обмежується, циклопропіл, циклобутил, циклопентил, циклопентеніл, циклогексил, циклогептил і адамантил. Термін "спіроциклічний", як тут використовується, має загальновідоме значення, тобто, будьяка сполука, що має два або більше кілець, де два з кілець мають один спільний атом вуглецю. Кільця спіроциклічної сполуки, як тут визначено, незалежно мають від 3 до 20 кільцевих атомів. Переважно, вони мають 3 - 10 кільцевих атомів. Необмежуючими прикладами спіроциклічної сполуки є спіро[3.3]гептан, спіро[3.4]октан і спіро[4.5]декан. Термін “(C5 - C8) циклоалкеніл” означає ненасичені, моноциклічні, конденсовані, спіроциклічні структури, що мають загалом від 5 до 8 кільцевих атомів вуглецю. Прикладами таких груп є, але не обмежується, циклопентеніл, циклогексеніл. Термін "ціано" стосується -CN групи. "Альдегідна" група стосується карбонільної групи, де R є водень. "Алкокси" група стосується і -O-алкільної, і -Oциклоалкільної групи, як тут визначено. "Алкоксикарбоніл" стосується -C(O)OR. "Алкіламіноалкільна" група стосується -алкілNR-алкільної групи. "Алкілсульфонільна" група стосується SO2алкілу. "Аміно" група стосується -NH2 або -NRR' групи. "Аміноалкільна" група стосується -алкіл-NRR' групи. "Амінокарбоніл" стосується -C(O)NRR'. "Арилалкільна" група стосується -алкіларилу, де алкіл і арил є такими як тут визначено. "Арилокси" група стосується і -O-арильної, і O-гетероарильної групи, як тут визначено. "Арилоксикарбоніл" стосується -C(O)Oарилу. "Арилсульфоніл" група стосується -SO2арилу. "C-амідо" група стосується -C(O)NRR' групи. "Карбонільна" група стосується -C(O)R. "C-карбоксильна" група стосується -C(O)OR групи. "Карбоксильна" група стосується Cкарбоксильної групи, в якій R є водень. "Ціано" група стосується -CN групи. 17 "Діалкіламіноалкільна" група стосується (алкіл)N(алкіл)2 групи. "Гало" або "галоген" стосується фтору, хлору, брому або йоду. "Гетероаліциклокси" група стосується гетероаліциклічної-O групи з гетероаліциклілом, як тут визначено. "Гетероарилоксильна" група стосується гетероарил-O групи з гетероарилом як тут визначено. "Гідрокси" група стосується -OH групи. "N-амідо" група стосується -R'C(O)NR групи. "N-карбамільна" група стосується -ROC(O)NRгрупи. "Нітро" група стосується -NO2 групи. "N-Сульфонамідо" група стосується -NRS(O)2R групи. "N-тіокарбамільна" група стосується ROC(S)NR' групи. "O-карбамільна" група стосується -OC(O)NRR' групи. "O-карбоксильна" група стосується RC(O)O групи. "O-тіокарбамільна" група стосується OC(S)NRR' групи. “Оксо” група стосується карбонільного замісника, так що алкіл заміщений оксо, стосується кетогрупи. "Перфторалкільна група" стосується алкільної групи, де всі атоми водню замінені атоми фтору. "Фосфонільна" група стосується -P(O)(OR)2 групи. "Силільна" група стосується -Si(R)3 групи. "S-сульфонамідо" група стосується -S(O)2NRгрупи. "Сульфінільна" група стосується -S(O)R групи. "Сульфонільна" група стосується -S(O)2R групи. "Тіокарбонільна" група стосується -C(=S)-R групи. "Тригалометанкарбонільна" група стосується Z3CC(O) групи, де Z є галоген. "Тригалометансульфонамідо" група стосується Z3CS(O)2NR-групи. "Тригалометансульфонільна" група стосується Z3CS(O)2 групи. "Тригалометильна" група стосується -CZ3 групи. "C-карбоксильна" група стосується -C(O)OR груп. Термін “заміщений” означає, що певна група або замісник несе один або більше замісників. Термін “незаміщений,” означає, що певна група не несе замісників. Термін “необов„язково заміщений” означає, що певна група є незаміщеною або заміщеною одним або більше замісників. Зрозуміло, що в сполуках представленого винаходу, коли група згадується як “незаміщена” або є “заміщеною” декількома групами, тоді буде заповнюватись валентності всіх атомів у сполуці, валентності, що залишились на такій групі, заповнюються воднем. Наприклад, якщо C6 арильна група, також тут називається “феніл”, заміщена одним додатковим замісником, фахівцю в цій галузі буде зрозуміло, що така група має 4 відкриті положення, зо залишились на атомах вуглецю C6 арильного кільця (6 95113 18 початкових положень, мінус одне до якого приєднаний залишок сполуки представленого винаходу, мінус додатковий замісник, залишається 4). В таких випадках, 4 атоми вуглецю, що залишились, є зв„язаними з одним атомом водню для заповнення їх валентностей. Аналогічно, якщо C6 арильна група в представлених сполуках згадується як “дизаміщена,” фахівцю в цій галузі буде зрозуміло, що це означає, що C6 арил має 3 атомів вуглецю, які є незаміщеними. Ці три незаміщені атоми вуглецю є зв„язаними з одним атомом водню для заповнення їх валентностей. Термін "сольват" використовується для опису комплексу між сполуками представленого винаходу і молекулами розчинника. Прикладами сольватів є, але не обмежується, сполуки винаходу у комбінації з водою, ізопропанолом, етанолом, метанолом, диметилсульфоксидом (ДМСО), етилацетатом, оцтовою кислотою, етаноламіном або ї сумішами. Термін "гідрат" може бути використаний, коли згаданим розчинником є вода. Особливо розглядається, що в представленому винаході одна молекула розчинника може бути зв„язаною з одною молекулою сполуки представленого винаходу, такий як гідрат. Крім того, спеціально розглядається, що в представленому винаході більше ніж одна молекула розчинника може бути зв„язаною з одною молекулою сполуки представленого винаходу, такий як дигідрат. Крім того, спеціально розглядається, що в представленому винаході менше ніж одна молекула розчинника може бути зв„язаною з одною молекулою сполуки представленого винаходу, такий як гемігідрат. Крім того, сольвати представленого винаходу розглядаються як сольвати сполук представленого винаходу, що зберігають біологічну ефективність негідратованої форми сполуки. Термін "фармацевтично прийнятна сіль", як тут використовується, означає сіль сполуки представленого винаходу, що зберігає біологічну ефективність вільних кислот і основ певного похідного і що не є біологічно або іншим чином небажаною. Термін “фармацевтично прийнятна рецептура”, як тут використовується, означає комбінацію сполуки винаходу або її солі або сольвату і носія, розріджувача і/або наповнювача(ів), що є сумісними із сполукою представленого винаходу і не шкідливі для їх реципієнта. Фармацевтичні рецептури можна одержати за методиками відомими середньому фахівцю в цій галузі. Наприклад, сполуки представленого винаходу можна сформулювати із звичайними наповнювачами, розріджувачами або носіями і сформувати у таблетки, капсули і т.і. Прикладами наповнювачів, розріджувачів і носіїв, що є придатними для таких рецептур є наступні: наповнювачи, такі як крохмаль, цукри, маніт і похідні кремнію; зв„язувальні агенти, такі як карбоксиметилцелюлоза і інші похідні целюлози, алгінати, желатин і полівінілпіролідон; зволожувальні агенти, такі як гліцерин; дезінтегрувальні агенти, такі як повідон, крохмальгліколят натрію, натрій карбоксиметилцелюлоза, агар, карбонат кальцію і бікарбонат натрію; агенти для уповільнення розчинення, такі як парафін; уповільнювачі ресорбції, такі як четвертинні амонієві сполуки; поверхнево 19 активні агенти, такі як ацетиловий спирт, моностеарат гліцерину; адсорбційні носії, такі як каолін і бентоніт; і змащувальні агенти, такі як тальк, стеарат кальцію і магнію і тверді поліетиленгліколі. Кінцеві фармацевтичні форми можуть бути пігулками, таблетками, порошками, лозенгами, саше, облатками або стерильними запакованими порошками і т.і., в залежності від типу використовуваного наповнювача. Крім того, спеціально планується, що фармацевтично прийнятні рецептури представленого винаходу можуть містити більше ніж один активний інгредієнт. Наприклад, такі рецептури можуть містити більше ніж одну сполуку згідно з представленим винаходом. Альтернативно, такі рецептури можуть містити одну або більше сполук представленого винаходу і один або більше додаткових агентів, що знижують анормальний ріст клітин. Термін “PI3-Kα-інгібувальна кількість” як тут використовується, стосується кількості сполуки представленого винаходу або її солі або сольвату, що необхідна для інгібування ферментної активності PI3-Kα in vivo, такого як ссавець, або in vitro. Кількість таких сполук, щ необхідна для викликання такого інгібування, можна визначити без надмірних експериментів використовуючи способи описані тут і способи відомі середньому фахівцю в цій галузі. Термін “інгібування активності PI3-Kα фермента”, як тут використовується, означає зменшення активності або функціонування PI3-Kα ферменту або in vitro, або in vivo, наприклад у ссавця, такого як людина, шляхом контактування ферменту із сполукою представленого винаходу. Термін “PI3-Kα” як тут використовується означає PI3-Kα або його мутанти або будь-які відомі PI3-Kα ізоформні зрощені варіанти. Термін "терапевтично ефективна кількість", як тут використовується, означає кількість сполуки представленого винаходу або її солі, що, коли вводиться ссавцю, що потребує такого лікування, є достатньою для забезпечення лікування, як тут визначено. Таким чином, терапевтично ефективною кількістю сполуки представленого винаходу або її солі є кількість достатня для модулювання або інгібування активності PI3-Kα ферменту, такого що хворобливий стан, що опосередкований активністю PI3-Kα ферменту, зменшується або полегшується. Терміни "лікування" і "терапія" стосується анормального росту клітин або будь-якого захворювання або стану опосередкований активністю PI3Kα ферменту у ссавця, зокрема, людини, і включає: (i) профілактику захворювання або стану, що має місце у суб„єкта, який може бути схильний до стану, так що лікування становить профілактичне лікування для патологічного стану; (ii) модулювання або інгібування захворювання або стану, тобто, затримка його розвитку; (iii) полегшення захворювання або стану, тобто, викликання регресу захворювання або стану; або (iv) полегшення і/або ослаблення захворювання або стану або симптомів захворювання або стану, наприклад, полегшення запальної відповіді без адресації на захворювання або стан, що лежить в основі. Стосовно 95113 20 анормального росту клітин, такого як рак, ці терміни просто означають, що середня тривалість життя особи, що має анормальний ріст клітин, буде збільшуватись або що один або більше симптомів захворювання зменшаться. Якщо не вказано інше, всі посилання тут на сполуки винаходу включають посилання на солі, сольвати і їх комплекси, включаючи поліморфи, стереоізомери, таутомери і їх мічені ізотопами версії. Наприклад, сполуками представленого винаходу можуть бути їх фармацевтично прийнятні солі і/або фармацевтично прийнятні сольвати. “Анормальний ріст клітини", як тут використовується, якщо невказано інше, стосується росту клітини, що не залежить від нормальних регуляторних механізмів (наприклад, втрата контактного інгібування), включаючи анормальний ріст нормальних клітин і ріст анормальних клітин. Це включає, але не обмежується, анормальний ріст: пухлинні клітини (пухлини), що проліферують шляхом експресування мутованих тирозинкіназ або надмірно експресують рецептор тірозинкінази; доброякісні і злоякісні клітини інших проліферативних захворювань, в яких має місце активація аберантної тірозинкінази; будь-які пухлини, що проліферують завдяки рецептору тірозинкінази; будь-які пухлини, що проліферують завдяки активації аберантної серин/треонінкінази; доброякісні і злоякісні клітини інших проліферативних захворювань, в яких має місце активація аберантної серин/треонінкінази; пухлини і доброякісні, і злоякісні, що експресують активований Ras онкоген; пухлнні клітини і доброякісні, і злоякісні, в яких Ras протеїн активується внаслідок онкогенної мутації в іншому гені; доброякісні і злоякісні клітини інших проліферативних захворювань, в яких має місце активація аберантного Ras. Прикладами таких доброякісних проліферативних захворювань є псоріаз, доброякісна гіпертрофія простати, вірусу папіломи людини (HPV) і рестиноз. "Анормальний ріст клітини" також стосується і включає анормальний ріст клітин, як доброякісних, так і злоякісних, внаслідок активації ферменту - фарнезилтрансферази. Терміни "анормальний ріст клітини" і "гіперпроліферативний розлад" використовуються в цій заявці по черзі. Термін "стереоізомери" стосується сполук, що мають ідентичну хімічну будову, але відрізняються розташуванням їх атомів або груп у просторі. Зокрема, термін "енантіомери" стосується двох стереоізомерів сполуки, що є дзеркальними відображеннями один одного. Терміни “рацемічний” або “рацемічна суміш”, як тут використовується, стосується 1:1 суміші енантіомерів певної сполуки. Термін "діастереомери", з іншого боку, стосується відношення між парами стереоізомерів, що містять два або більше асиметричних центрів і не є дзеркальними відображеннями один одного. У відповідності із звичайною практикою в цій галузі, символ , використовуваний в структурних формулах тут, зображає зв„язок, що є точкою приєднання фрагменту або замісника до ядра або каркасу структури. У відповідності з іншою тради 21 95113 цією, в деяких структурних формулах тут, атоми вуглецю і зв„язані з ними атоми водню чітко не CH3 зображаються, наприклад, льну групу, означає мети CH3 означає етильну групу, означає циклопентильну групу, і.т.. Сполуки представленого винаходу можуть мати асиметричні атоми вуглецю. Зв„язки між атомами в сполуках представленого винаходу можуть бути зображені тут використовуючи суцільну лінію ( ), суцільний клин ( ) або пунктирний клин ( ). Застосування суцільної лінії для зображення зв„язків з асиметричних атомів вуглецю призначене для позначення, що включені всі можливі стереоізомери при цьому атомі вуглецю. Застосування або суцільного, або пунктирного клину для зображення зв„язків з асиметричного атому вуглецю покликане показати, що включений тільки показаний стереоізомер. Можливо, що сполуки винаходу можуть містити більше ніж один асиметричний атом вуглецю. В таких сполуках, застосування суцільної лінії для зображення зв„язків від асиметричного атому вуглецю покликане показати, що включені всі можливі стереоізомери. Застосування суцільної лінії для зображення зв„язків від одного або більше асиметричних атомів вуглецю в сполуках винаходу і застосування суцільного або пунктирного клину для зображення зв„язків від інших асиметричних атомів вуглецю в тій же самій сполуці є способом показати, що присутня суміш діастереомерів. Якщо група, як наприклад, “R” зображається як “плаваюча” на циклічній системі A у формулі: A (R)z тоді, якщо не вказано інше, замісник “R” може розташовуватись на будь-якому атомі циклічної системи, за умови заміщення зображеного, передбачуваного або чітко визначеного водню на одному з атомів кільця, за умови, що утворюється стабільна структура. Кільцевою системою A може бути, наприклад, але не обмежується арил, гетероарил, циклоалкіл, циклогетероалкіл, спіроцикліл або конденсована циклічна система. Якщо група “R” зображається як “плаваюча” на циклічній системі A, що містить насичені вуглеці, тоді “z” може бути більше ніж один, за умови заміщення зображеного, передбачуваного або чітко визначеного водню кільця A; тоді, якщо не вказано інше, коли одержувана структура є стабільною, два “R” можуть розташовуватись на одному атомі вуглецю. Наприклад, коли R є метил група, може існувати гермінальний диметил на вуглеці кільця A. В іншому прикладі, два “R” на одному атомі вуглецю, включаючи вуглець, можуть утворювати кільце, утворюючи таким чином спіроциклічне кільце (“спіроциклічна група”). Звичайні методики для одержання/виділення 22 індивідуальних енантіомерів включають хіральний синтез з придатних оптично чистих попередників або розділення рацемату (або рацемату солі або похідного) використовуючи, наприклад, хіральну високоефективну рідинну хроматографію (ВЕРХ). Альтернативно, рацемат (або рацемічний попередник) може реагувати з придатною оптичноактивною сполукою, наприклад, спиртом, або, у випадку, коли сполука містить кислотний або основний замісник, кислотою або основою, такою як винна кислота або 1-фенілетиламін. Одержану діастереомерну суміш можна розділити хроматографічно і/або фракційною кристалізацією і один або обидва діастереомери перетворюють у відповідний чистий енантіомер(и) за допомогою засобів добре відомих фахівцю в цій галузі. Хіральні сполуки винаходу (і їх хіральні попередники) можна одержати в енантіомерно збагаченій формі використвоуючи хроматографію, типово ВЕРХ, на асиметричній смолі з рухомою фазою, що складається з вуглеводню, типово гептану або гексану, що містить від 0 до 50% ізопропанолу, типово від 2 до 20%, і від 0 до 5% алкіламіну, типово 0,1% діетиламіну. Концентрування елюенту дає збагачену суміш. Стереоізомерні конгломерати можна розділити за допомогою звичайних методик відомих фіхівцям в цій галузі; дивіться, наприклад, "Stereochemistry of Organic Compounds" by E L Eliel (Wiley, New York, 1994), опис якої включений сюди як посилання у всій своїй повноті. Коли сполука винаходу містить алкенільну або алкеніленову групу, можливе існування геометричних цис/транс (або Z/E) ізомерів. Коли сполука містить, наприклад, кето або оксимну групу або ароматичний замісник, може мати місце таутомерний ізомеризм ('таутомеризм'). Прикладами таутомеризму є кето-енольні таутомери. Одна сполука може проявляти більше ніж один тип ізомеризму. Включеними в межі рамок винаходу є всі стереоізомери, геометричні ізомери і таутомерні форми сполук винаходу, включаючи сполуки, що проявляють більше ніж один тип ізомеризму і суміші одного або більше. Цис/транс ізомери можуть бути розділені використовуючи звичайні методики добре відомі фахівцю в цій галузі, наприклад, хроматографію і фракційну кристалізацію.. Сполуки представленого винаходу можуть вводитись як проліки. Таким чином, деякі похідні сполук Формули (I), які можуть мати незначну або зовсім не мати фармакологічної активності, коли вводяться ссавцю, перетворюються у сполуку Формули (I), що має бажану активність, наприклад, гідролітичне розщеплення. Такі похідні відносяться до “проліків”. Проліки можуть бути, наприклад, одержані шляхом заміщення прийнятних груп присутніх в сполуці Формули (I) деякими замісниками відомими середньому фахівцю в цій галузі. Дивіться, наприклад “Pro-drugs as Novel Delivery Systems”, Vol. 14, ACS Symposium Series (T Higuchi and W Stella) і “Bioreversible Carriers in Drug Design”, Pergamon Press, 1987 (ed. E B Roche, American Pharmaceutical Association), описи яких включені сюди як посилання у всій їх повноті. Деякими прикладами таких проліків є: естерний замісник замість карбоксильної групи; етерний заміс 23 ник або амідний замісник замість спиртової групи; і амідний замісник замість первинної або вторинної аміногрупи. Наприклад, сполука показана як Приклад 31 нижче є одним з прикладів де водень в спиртовому заміснику замінений амідною групою. Інші приклади заміщу вальних груп відомі фахівцю в цій галузі. Дивіться, наприклад “Design of Prodrugs" by H Bundgaard (Elsevier, 1985), опис якої включений сюди як посилання у всій його повноті. Також можливо, що деякі сполуки Формули (I) можуть самі по собі діяти як проліки інших сполук Формули (I). Солі представленого винаходу можна одержати згідно із способами відоми середньому фахівцю в цій галузі. Прикладами солей є, але не обмежується, ацетатні, акрилатні, бензолсульфонатні, бензоатні (такі як хлорбензоатні, метилбензоатні, динтіробензоатні, гідроксибензоатні і метоксибензоатні), бікарбонатні, бісульфатні, бісульфітні, бітартратні, боратні, бромідні, бутин-1,4-діолатні, кальцій едетатні, камсилатні, карбонатні, хлоридні, капроатні, каприлатні, клавуланатні, цитратні, деканоатні, дигідрохлоридні, дигідрофосфатні, едетатні, едисилатні, естолатні, езилатні, етилсукцинатні, форміатні, фумаратні, глуцептатні, глюконатні, глутаматні, гліколатні, гліколіларсанілатні, гептаноатні, гексин-1,6-діолатні, гексилрезорцинатні, гідрабамінові, гідробромідні, гідрохлоридні, -гідроксибутиратні, йодидні, ізобутиратні, ізотіонатні, лактатні, лактобіонатні, лауратні, малатні, малеатні, малонатні, манделатні, мезилатні, метафосфатні, метан-сульфонатні, метилсульфатні, моногідрофосфатні, мукатні, напсилатні, нафталін-1-сульфонатні, нафталін-2-сульфонатні, нітратні, олеатні, оксалатні, памоатні (ембонатні), пальмітатні, пантотенатні, фенілацетатні, фенілбутиратні, фенілпропіонатні, фталатні, фосфатні/дифосфатні, полігалактеронатні, пропансульфонатні, пропіонатні, пропіолатні, пірофосфатні, піросульфатні, салицилатні, стеаратні, субацетатні, субератні, сукцинатні, сульфатні, сульфонатні, сульфітні, танатні, тартратні, теослатні, тозилатні, триeтіододатні і валератні солі. Сполуки представленого винаходу, що є основними по природі здатні утворювати широкий перелік різних солей з різними неорганічними і органічними кислотами. Хоча такі солі повинні бути фармацевтично прийнятними для введення тваринам, бажаним на практиці є спочатку виділити сполуку представленого винаходу з реакційної суміші як фармацевтчино неприйнятну сіль і потім просто перетворити назад у вільноосновну сполуку шляхом обробки лужним реагентом і в подальшому перетворити вільну основу у фармацевтично прийнятну кислотноадитивну сіль. Кислотноадитивні солі основних сполук цього винаходу можна одержати шляхом обробки основної сполуки по суті еквівалентною кількістю вибраної мінеральної або органічної кислоти у водному середовищі або в придатному органічному розчиннику, такому як метанол або етанол. Після упарювання розчинник, одержують бажану тверду сіль. Бажану кислотну сіль також можна осадити з розчину вільної основи в органічному розчиннику шляхом додавання до розчину прийнятної мінеральної або органічної 95113 24 кислоти. Ті сполуки представленого винаходу, що є кислими за природою здатні утворювати основні солі з різними фармакологічно прийнятними катіонами. Прикладами таких солей є солі лужних і лужноземельних металів і, зокрема, солі натрію і калію. Всі ці солі одержуються з використанням загальновідомих методик. Хімічними основами, які використовуються як реагенти для одержання фармацевтично прийнятних основних солей цього винаходу, є основи які утворюють нетоксичні основні солі з кислими сполуками представленого винаходу. Такими нетоксичними основними солями є похідні від таких фармакологічно прийнятних катіонів, як натрій, калій, кальцій і магній, і т.і.. Ці солі можна одержати шляхом обробки відповідних кислотних сполук водним розчином, що містить бажані фармакологічно прийнятні катіони і потім упарити одержаний розчин досуха, переважно при пониженому тиску. Альтернативно, вони також можуть бути одержані шляхом змішування разом нижчих спиртових розчинів кислотних сполук і бажаного алкоксиду лужного металу і наступного упарювання одержаного розчину досуха таким же самим чином, як описано раніше. В будь-якому випадку, переважно використовуються стехіометричні кількості реагентів для забезпечення повноти реакції і максимальних виходів бажаного кінцевого продукту. Якщо сполука винаходу є основою, бажану сіль можна одержати будь-яким придатним способом доступним в цій галузі, наприклад, обробкою вільної основи неорганічною кислото, такою як хлорводнева кислота, броводнева кислота, сірчана кислота, азотна кислота, фосфорна кислота і т.і., або з органічною кислотою, такою як оцтова кислота, малеїнова кислота, бурштинова кислота, манделова кислота, фумарола кислота, малонова кислота, піровиноградна кислота, щавлева кислота, гліколева кислота, саліцилова кислота, піранозидолова кислота, така як глюкуронова кислота або галактуронова кислота, альфа-гідрокси кислота, така як лимонна кислота або винна кислота, амінокислота, така як аспарагінова кислота або глютамінова кислота, ароматична кислота, така як бензoйна кислота або цинамова кислота, сульфонова кислота, така як п-толуолсульфонова кислота або етансульфонова кислота або т.і.. Якщо сполука винаходу є кислотою, бажану сіль можна одержати будь-яким придатним способом, наприклад, обробкою вільної кислоти неорганічною або органічною основою, такою як амін (первинний, вторинний або третинний), гідроксидом лужного металу або гідроксидом лужноземельного металу або т.і.. Ілюстративними прикладами придатних солей є органічні солі похідні від амінокислот, таких як гліцин і аргінін, аміак, первинні, вторинні і третинні аміни, і циклічні аміни, такі як піперидин, морфолін і піперазин, і неорганічні солі похідні натрію, кальцію, калію, магнію, марганцю, заліза, міді, цинку, алюмінію і літію. У випадку агентів, що є твердими, середньому фахівцю в цій галузі повинно бути зрозуміло, що сполуки винаходу, агенти і солі можуть існувати в різних кристалічних або поліморфних формах, всі 25 з яких попадають в межі рамок представленого винаходу і окреслюються формулами. Винахід також включає ізотопічно-мічені сполуки винаходу, в яких один або декілька атомів замінена атомами, що мають те ж саме атомне число, але атомну масу або масове число, що відрізняється від атомної маси або масового числа, яке домінує в природі. Прикладами ізотопів придатних для включення в сполуки винаходу є ізотопи 2 3 11 13 14 водню, такі як H і H, вуглецю, такі як C, C і C, 36 18 хлору, такі як Cl, фтору, такі як F, йоду, такі як 123 125 13 15 15 I і I, азоту, такі як N і N, кисню, такі як O, 17 18 32 35 O і O, фосфору, такі як P і сірки, такі як S. Деякі ізотопічно-мічені сполуки винаходу, наприклад, ті що включають радіоактивний ізотоп, є корисними в дослідженнях лікарського засобу і/або розподілення субстрату в тканині. Радіоактивні 3 14 ізотопи тритію, H, і вуглецю-14, C, є особливо корисними для цих цілей з огляду на легкість їх включення і легкість детектування. Заміщення 2 тяжчими ізотопами, такими як дейтерій, H, може давати деякі терапевтичні переваги внаслідок збільшення метаболітичної стабільності, наприклад, збільшення в vivo часу напіврозкладу або зменшення необхідної дози, і звідси може бути переважним в деяких випадках. Заміщення позитрон емі11 18 15 13 туючими ізотопами, такими як C, F, O і N, може бути корисним в дослідженнях позитронноемісійної топографії (PET) для визначення блокування рецептора субстратом. Ізотопічно-мічені сполуки винаходу загалом можна одержати за допомогою звичайних методик відомих спеціалісту в цій галузі або за допомогою процесів аналогічних тим, що описуються тут, використовуючи прийнятні мічені ізотопами реагенти замість не мічених реагентів використовуваних раніше. Сполуки представленого винаходу можуть бути сформульовані у фармацевтичні композиції, як описано нижче, в будь-якій фармацевтичній формі, яка для фахівця в цій галузі є придатною. Фармацевтичні композиції винаходу містять терапевтично ефективну кількість принаймні однієї сполуки представленого винаходу і інертний фармацевтично прийнятний носій або розріджувач. Для лікування або профілактики захворювань або станів опосередкованих PI3-Kα, фармацевтична композиція винаходу вводиться у формі придатної рецептури одержаної шляхом комбінування терапевтично ефективної кількості (тобто, PI3-Kα модулювальної, регулювальної або інгібувальної кількості ефективної для досягнення терапевтичного ефекту) принаймні однієї сполуки представленого винаходу (як активного інгредієнту) з одним або більше фармацвтично прийнятних носіїв, які можуть бути вибрані, наприклад, з розріджувачів, екціпієнтів і допоміжних агентів, що полегшують переробку активних сполук у кінцеві фармацевтичні рецептури. Використовувані фармацевтичні носії можуть бути або твердими, або рідкими. Прикладами твердих носіїв є лактоза, цукроза, тальк, желатин, агар, пектин, акація, стеарат магнію, стеаринова кислота і т.і.. Прикладами рідких носіїв є сироп, арахісова олія, оливкова олія, вода і т.і.. Також, 95113 26 композиції винаходу можуть включати часовідсрочуваний або часопролонгувальний матеріал відомий в цій галузі, такий як моностеарат гліцерилу або дістеарат гліцерилу окремо або з воском, етилцелюлоза, гідроксипропілметилцелюлоза, метилметакрилат або т.і.. Також можуть бути додані добавки або екціпієнти для забезпечення бажаних властивостей рецептури. Наприклад, може бути доданий підвищувач біодоступності, такий як Лабразол, Гелуцир або т.і., або формулятор, такий як КМЦ (карбокси-метилцелюлоза), ПГ (пропіленгліколь) або ПЕГ (поліетиленгліколь). Наприклад, коли одержується капсульна рецептура, може бути ® доданий Гелуцир , напівтвердий розріджувач, що захищає активні інгредієнти від світла, вологи і окислення. Якщо використовується твердий носій, рецептура може бути таблетованою, поміщеною у тверду желатинову капсулу у формі порошку або кульок або сформована у пігулку або лозенг. Кількість твердого носія може змінюватись, але загалом буде становити від приблизно 25 мг до приблизно 1 г. Якщо використовується рідкий носій, рецептура може бути у формі сиропу, емульсії, м‟якої желатинової капсули, стерильного розчину або суспензії для ін„єкції у ампулі або пляшечці або неводної рідкої суспензії. Якщо використовується напівтвердий носій, рецептура може бути у формі рецептури в твердій і м„якій желатиновій капсулі. Композиції винаходу одержують у формі одиничної дози прийнятної для вибраного шляху введення, наприклад парентерального або перорального введення. Для одержання придатної водорозчинної дозованої форми, сіль сполуки представленого винаходу можна розчинити у водному розчині органічної або неорганічної кислоти, такої як 0,3 M розчин бурштинової кислоти або лимонної кислоти. Якщо розчинна сіль недоступна, агент може бути розчинений в придатному співрозчиннику або комбінаціях співрозчинників. Прикладами придатних співрозчинників є спирт, пропіленгліколь, поліетиленгліколь 300, полісорбат 80, гліцерин і т.і. в концентраціях в інтервалі від 0 до 60% від загального об„єму. В типовому втілення, сполуку представленого винаходу розчиняють в ДМСО і розводять водою. Композиція також може бути у формі розчину солі активного інгредієнту в прийнятному водному розчиннику, такому як вода або ізотонічний салін або розчин декстрози. Характер рецептури залежить від вибраного шляху введення. Для ін„єкції, агенти з сполук представленого винаходу можуть бути сформульовані у водні розчини, переважно у фізіологічно сумісних буферах, таких як розчин Ханка, розчин Рінгера або фізіологічний салін. Для трансмукозального введення, в рецептурі використовують прийнятні пенетранти для покращення проникнення через бар„єр. Такі пенетранти загалом відомі в цій галузі. Для орального введення, сполуки можна сформулювати шляхом поєднання активних сполук з фармацевтично прийнятними носіями добре відомими в цій галузі. Такі носії допомагають сполукам винаходу сформулюватись в таблетки, пігулки, 27 лозенги, драже, капсули, рідини, гелі, сиропи, суспензії, дисперсії і т.і., для орального вживання пацієнтом. Фармацевтичні рецептури для орального застосування можна одержати використовуючи твердий екціпієнт, необов„язково, розмелюючи одержану суміш, і перетворюючи суміш у гранули, після додавання інших придатних допоміжних речовин, якщо це необхідно, з одержанням таблеток і ядер драже. Корисними екціпієнтами є, зокрема, наповнювачи, такі як цукри, включаючи лактозу, цукрозу, маніт або сорбіт; і похідні целюлози, такі як, наприклад, кукурудзяний крохмаль, пшеничний крохмаль, рисовий крохмаль і картопляний крохмаль і інші матеріали, такі як желатин, трагакантова камедь, метилцелюлоза, гідроксипропілметилцелюлоза, натрій карбоксиметилцелюлоза, і/або полівінілпіролідин (PVP). При бажанні, можна додати дезінтегрувальний агент, такий як поперечно зшитий полівінілпіролідон, агар або алгінова кислота. Також може бути використана сіль, така як алгінат натрію. На ядра драже можна нанести прийнятне покриття. З цією ціллю можна використати концентровані розчини цукрів, які можуть необов„язково містити гуміарабік, тальк, полівінілпіролідон, гель карбополю, поліетиленгліколь і/або діоксид титану, лакувальні розчини і придатні органічні розчинники або суміші. До таблеток або покриття драже можуть додаватись фарбники або пігменти призначені для ідентифікації або розрізняння різних комбінацій активних агентів. Фармацевтичні композиції, які можуть бути використані орально включають капсули із щільною насадкою виготовлені з желатину, також як і м„які капсули, що закриваються, виготовлені з желатину і пластифікатору, такого як гліцерин або сорбіт. Капсули із щільною насадкою можуть містити активний інгредієнти в суміші з наповнювачем, таким як лактоза, зв„язувальний агент, такий як крохмаль, і/або змащувальний агент, такий як тальк або стеарат магнію і, необов„язково, стабілізатори. В м„яких капсулах, активні сполуки можна розчинити або суспендувати в придатних рідинах, таких як жирні олії, рідкий парафін, рідкі поліетиленгліколі, кремофор, капмул, середньо або довголанцюгові моно-, ди- або тригліцериди. Також до цих рецептур можна додавати стабілізатори. Всі рецептури для перорального введення повинні бути в дозах придатних для такого введення. Для букального введення, композиції можуть мати форму таблеток або лозенгів сформованих звичайним чином. Для інтраназального введення або за допомогою інгаляції, сполуки для використанння згідно з представленим винаходом звичайно вивільнюються у формі аерозольного спрею використовуючи аерозольний контейнер або розпилювач і придатний пропелант, наприклад, без обмеження, дихлордифторметан, трихлорфторметан, дихлортетрафторетан або діоксид вуглецю. У випадку аерозолю, одиницю дозування можна контролювати за допомогою клапана для вивільнення виміряної кількості. Можуть бути сформовані капсули і картриджі, наприклад, з желатину для застосування в інгаляторі або пристрої для вдування, що міс 95113 28 тять порошкову суміш сполуки і придатної порошкової основи, такої як лактоза або крохмаль. Сполуки можуть бути сформовані для парентерального введення за допомогою ін„єкції, наприклад, ін„єкції болюсу або безперервного вливання. Рецептури для ін„єкції можуть бути представлені у формі одиничної дози, наприклад, в ампулах або в багатодозових контейнерах, з добавкою консерванту. Композиції можуть набувати таку форму, як суспензії, розчини або емульсії в масляному або водному розчинниках, і можуть містити формулювальні агенти, такі як суспендувальні, стабілізувальні і/або диспергувальні агенти. Фармацевтичні композиції для парентерального введення є водними розчинами водорозчинної форми, такої як, без обмеження, сіль активної сполуки. Крім того, суспензії активних сполук можна одержати в ліпофільному розчиннику. Придатними ліпофільними розчинниками є жирні олії, такі як кунжутова олія, сиснтетичні естери жирних кислот, такі як етилолеат і тригліцериди, або матеріали, такі як ліпосоми. Водні ін„єкційні суспензії можуть містити речовини які підвищують в„язкість суспензії, такі як натрій карбоксиметилцелюлозу, сорбіт або декстран. Необов„язково, суспензія також може містити придатні стабілізатори і/або агенти, що підвищують розчинність сполук, дозволяючи одержати висококонцентровані розчини. Альтернативно, активний інгредієнт може бути порошком для відновлення перед використанням приданим розчинником, наприклад, стерильною пірогенвільною водою. На додаток до рецептур описаних раніше, сполуки також можна сформулювати як рецептури депо. Такі довгодіючі рецептури можна вводити шляхом імплантації (наприклад, підшкірно або внутрішньом„язово) або за допомогою внутрішньом„язової ін„єкції. Сполука цього винаходу може бути сформульована для цього шляху введення використовуючи придатні полімерні або гідрофобні матеріали (наприклад, у вигляді емульсії в фармакологічно прийнятній олії), з іонообмінними смолами або як погано розчинне похідне, таке як, без обмеження, погано розчинна сіль. Необмежуючим прикладом фармацевтичного носія для гідрофобних сполук винаходу є система співрозчинника, що містить бензиловий спирт, неполярну поверхневоактивну речовину, водозмішуваний органічний полімер і водну фазу, таку як система співрозчинника VPD. VPD є розчином 3% в/о бензилового спирту, 8% в/о неполярної поверхнево-активної речовини Полісорбат 80 і 65% в/о поліетиленгліколю 300, доведений до необхідного об„єму абсолютним етанолом. Система співрозчинника VPD (VPD:D5W) містить VPD розведений 1 : 1 5% розчином декстрози у воді. Ця система співрозчинника добре розчиняє гідрофобні сполуки і сама по собі є низькотоксичною при системному введенні. Природно, пропорції такої системи співрозчинника можуть значно змінюватись без значного впливу на характеристики її розчинності і токсичності. Крім того, може змінюватись індивідуальність компонентів співрозчинника: наприклад, замість Полісорбату 80 можуть бути використані інші низькотоксичні неполярні поверхнево-активні речовини, 29 може бути змінений розмір фракції поліетиленгліколю, поліетиленгліколь може бути замінений іншими біосумісними полімерами, наприклад, полівінілпіролідон, і декстроза може бути замінена іншими цукрами або полісахаридами. Альтернативно, можуть бути використані інші системи вивільнення гідрофобних фармцевтичних сполук. Ліпосоми і емульсії є добре відомими прикладами розчинників або носіїв для гідрофобних лікарських засобів. Крім того, також можуть бути використані деякі органічні розчинники, такі як диметилсульфоксид, хоча часто за рахунок більшої токсичності. Крім того, сполуки можуть бути вивільнені використовуючи систему тривалого вивільнення, таку як напівпроникні матриці з твердих гідрофобних полімерів, що містить терапевтичний агент. Прийняті і добре відомі фахівцю в цій галузі різні матеріали тривалого вивільнення. Капсули тривалого вивільнення можуть, в залежності від їх хімічної природи, вивільнювати сполуки протягом від декількох тижнів до 100 днів. В залежності від хімічної природи і біологічної стабільності терапевтичного реагенту, можуть бути використані додаткові стратегії для стабілізації протеїну. Фармацевтичні композиції приведені тут також можуть містити придатні тверді або гелеві носії або екціпієнти. Ці носії і екціпієнт можуть забезпечувати покращення біодоступності погано розчинних лікарських агентів. Прикладами таких носіїв або екціпієнтів є карбонат кальцію, фосфат кальцію, різні цукри, крохмалі, похідні целюлози, желатин і полімери, такі як поліетиленгліколі. Крім того, можуть бути використані добавки або екціпієнт, такі як Gelucire®, Capryol®, Labrafil®, Labrasol®, Lauroglycol®, Plurol®, Peceol® Трансcutol® і т.і.. Крім того, фармацевтичні композиції можуть бути включені в пластири для шкіри для вивільнення лікарського засобу безпосередньо на шкіру. Повинно бути зрозуміло, що фактичні дози агентів цього винаходу будуть змінюватись в залежності від особливості використовуваного агента, особливості сформульованої композиції, шляху введення і певного місця, хазяїна і захворювання, що лікується. Фахівець в цій галузі використовуючи звичайні тести по визначенню з огляду на експериментальні дані для даної сполуки може встановити оптимальні дози для даних станів. Для орального введення, типова загально використовувана добова доза буде становити від приблизно 0,001 до приблизно 1000 мг/кг ваги тіла, з курсами лікування, що повторюються через прийнятні інтервали. Крім того, фармацевтично прийнятні рецептури представленого винаходу можуть містити сполуку представленого винаходу або її сіль або сольват від кількості від приблизно 10 мг до приблизно 2000 мг, або від приблизно 10 мг до приблизно 1500 мг, або від приблизно 10 мг до приблизно 1000 мг, або від приблизно 10 мг до приблизно 750 мг, або від приблизно 10 мг до приблизно 500 мг, або від приблизно 25 мг до приблизно 500 мг, або від приблизно 50 до приблизно 500 мг, або від приблизно 100 мг до приблизно 500 мг. Додатково, фармацевтично прийнятні рецептури представленого винаходу можуть містити 95113 30 сполуку представленого винаходу або її сіль або сольват, в кількості від приблизно 0,5 м/м% до приблизно 95 м/м%, або від приблизно 1 м/м% до приблизно 95 м/м%, або від приблизно 1 м/м% до приблизно 75 м/м%, або від приблизно 5 м/м% до приблизно 75 м/м%, або від приблизно 10 м/м% до приблизно 75 м/м%, або від приблизно 10 м/м% до приблизно 50 м/м%. Сполуки представленого винаходу або їх солі або сольвати можуть бути введенні ссавцю, що страждає від анормального росту клітин, такого як людина, або окремо, або як частину фармацевтично прийнятної рецептури, один раз на день, двічі на день, тричі на день або чотири рази на день, або навіть більш часто. Середньому фахівцю в цій галузі повинно бути зрозуміло, стосовно сполук представленого винаходу, певної фармацевтичної рецептури, дози і кількості доз, що даються протягом дня ссавцю, який потребує такого лікування, що всі вони вибираються в межах знань середнього фахівця в цій галузі і може бути визначена без надмірних зусиль. Сполуки представленого винаходу є корисними для модулювання або інгібування PI3-Kα активності. Відповідно, ці сполуки є корисними для профілактики і/або лікування хворобливих станів пов„язаних з анормальним ростом клітин, таких як рак, окремо або в комбінації з іншими протираковими агентами. Цей винахід також стосується лікування анормального росту клітин у ссавця, включаючи людину, що включає введення згаданому ссавцю сполуки формули (I), як визначено вище, або її солі або сольвату, в кількості ефективній для лікування анормального росту клітин. В одному з втілень цього способу, анормальним ростом клітин є рак, включаючи, але не обмежується, мезотеліома, гепатобіліарний (печінки і жовчних шляхів) рак, первинна або вторинна пухлина ЦНС, первинна або вторинна пухлина мозку, рак легені (НДКРЛ і ДКРЛ), рак кістки, рак підшлункової залози, рак шкіри, рак голови або шиї, шкірна або внутрішньоочна меланома, рак яічників, рак товстої кишки, ректальний рак, рак анального регіону, рак шлунку, гастроінтестинальний (шлунковий, колоректальний і дуоденальний) рак, рак грудей, рак матки, карцинома фалопієвих труб, карцинома ендометрію, карцинома шийки, карцинома вагіни, карцинома вульви, хвороба Ходжкіна, рак стравоходу, рак малої кишки, рак ендокринної системи, рак щитовидної залози, рак паращитовидної залози, рак надниркової залози, саркома м„якої тканини, рак уретри, рак пенісу, рак простати, тестикулярний рак, хронічна або гостра лейкемія, хронічна мієлоїдна лейкемія, лімфоцитна лімфома, рак міхура, рак нирки або сечоводу, карцинома ренальних клітин, карцинома ниркової лоханки, неоплазма центральної нервової системи (ЦНС), первинна лімфома ЦНС, лімфома неХоджкіна, пухлина спинного мозку, гліома стовбура головного мозку, пітуітарна аденома, адренокортикальний рак, рак жовчного міхура, множинна мієлома, холангіокарцинома, фібросаркома, нейробластома, ретинобластома або комбінація одно 31 го або більшої кількості згаданих вище видів раку. В одному з втілень представленого винаходу рак вибирають з раку легені (НДКРЛ і ДКРЛ), раку голови або шиї, раку яічників, раку товстої кишки, ректального раку, раку анального регіону, раку шлунку, раку грудей, раку нирки або сечоводу, карциноми ренальних клітин, карциноми ниркової лоханки, неоплазми центральної нервової системи (ЦНС), первинної лімфоми ЦНС, лімфоми неХоджкіна, пухлини спинного мозку або комбінації одного або більшої кількості згаданих вище видів раку. В іншому втіленні представленого винаходу, рак вибирають з раку легені (НДКРЛ і ДКРЛ), раку яічників, раку товстої кишки, ректального раку, раку анального регіону або комбінації одного або більшої кількості згаданих вище видів раку. В іншому втіленні представленого винаходу, рак вибирають з раку легені (НДКРЛ і ДКРЛ), раку яічників, раку товстої кишки, ректального раку або комбінації одного або більшої кількості згаданих вище видів раку. В іншому втіленні згаданого способу, згаданим анормальним ростом клітин є доброякісне проліферативне захворювання, включаючи, але не обмежується, псоріаз, доброякісна гіпертрофія простати або рестеноз. Цей винахід також стосується способу лікування анормального росту клітин у ссавця, який включає введення згаданому ссавцю сполуки представленого винаходу або її солі або сольвату в кількості, що є ефективною при лікуванні анормального росту клітин в комбінації з протипухлинним агентом, що вибирають з групи, яка містить інгібітори мітозу, алкілувальні агенти, антиметаболіти, інтеркалюючі антибіотики, інгібітори фактора росту, інгібітори клітинного циклу, ферменти, інгібітори топоізомерази, модифікатори біологічної відповіді, антитіла, цитотоксини, антигормони і антиандрогени. В одному з втілень представленого винаходу протипухлинним агентом, що використовують у поєднанні із сполукою представленого винаходу і фармацевтичними композиціями описаними тут, є антиангіогенні агенти, інгібітор кінази, інгібітор pan кінази або інгібітор фактора росту. Переважними інгібіторами pan кінази є Sutent™ (сунітиніб), описаний в патенті US № 6,573,293 (Pfizer Inc., NY, USA). Антиангіогенними агентами є, але не обмежується, наступні агенти, такі як інгібітори EGF, інгібітори EGFR, інгібітори VEGF, інгібітори VEGFR, інгібітори TIE2, інгібітори IGF1R, інгібітори COX-II (циклооксигенази II), інгібітори MMP-2 (матриксної-металопротеїнази 2) і інгібітори MMP-9 (матриксної-металопротеїнази 9). Переважними інгібіторами VEGF є, наприклад, Avastin (бевацизумаб), анти-VEGF моноклональне антитіло від Genentech, Inc. of South San Francisco, California. Додатковими інгібіторами VEGF є CP547,632 (Pfizer Inc., NY, USA), AG13736 (Pfizer Inc.), ZD-6474 (AstraZeneca), AEE788 (Novartis), AZD-2171, VEGF Trap (Regeneron/Aventis), Vatalanib (також відомий як PTK-787, ZK-222584: Novartis & Schering AG), Macugen (пегаптанібу октанатрій, NX-1838, EYE-001, Pfizer 95113 32 Inc./Gilead/Eyetech), IM862 (Cytran Inc. of Kirkland, Washington, USA); і ангіозим, синтетична рибозома від Ribozyme (Boulder, Colorado) і Chiron (Emeryville, California) і їх комбінації. Інгібітори VEGF корисні на практиці представленого винаходу описуються в патенті US 6,534,524 і 6,235,764, обидва з яких включені у всій їх повноті для всіх цілей. Додаткові інгібітори VEGF описуються в, наприклад, WO 99/24440, WO 95/21613, WO 99/61422, патенті US 5,834,504, WO 98/50356, патенті US 5,883,113, патенті US 5,886,020, патенті US 5,792,783, патенті US 6,653,308, WO 99/10349, WO 97/32856, WO 97/22596, WO 98/54093, WO 98/02438, WO 99/16755 і WO 98/02437, всі з яких включені сюди як посилання у всій їх повноті. Іншими антиангіогенними сполуками є ацитредин, фенретинід, талідомід, золедронова кислота, ангіостатин, аплидин, циленгтид, комбрестатин A4, ендостатин, галофугінон, ребімастат, ремоваб, Ревлімід, сквуламін, україн, Вітаксин і їх комбінації. Іншими протипроліферативними агентами, що можуть бути використані в комбінації із сполуками представленого винаходу є інгібітори фарнезилпротеїнтрансферази і інгібітори рецептора тирозинкінази PDGFr, включаючи сполуки описані і заявлені в наступному: патенті US 6,080,769; патенті US 6,194,438; патенті US 6,258,824; патенті US 6,586447; патенті US 6,071,935; патенті US 6,495,564; і патенті US 6,150,377; патенті US 6,596,735; патенті US 6,479,513; WO 01/40217; U.S. 2003-0166675. Кожен із згаданих вище патентів і заявок включена сюди як посилання у всій їх повноті. PDGRr інгібіторами є, але не обмежується, сполуки описані в міжнародних публікаціях WO01/40217 і WO2004/020431, вміст яких включений у всій їх повноті для всіх цілей. Переважними інгібіторами PDGFr є CP-673,451 і CP-868,596 і їх солі, фірми Пфайзер. Переважними інгібіторами GARF є AG-2037 (пелітрексол і його солі) фірми Пфайзер. GARF інгібітори корисні на практиці представленого винаходу описуються в патенті US 5,608,082, який включений у всій його повноті для всіх цілей. Прикладами корисних COX-II інгібіторів, які можуть бути використані у поєднанні із сполукою Формули (I) і фармацевтичними композиціями TM описаними тут є Целебрекс (целекоксиб), парекоксиб, деракоксиб, ABT-963, MK-663 (еторікоксиб), COX-189 (Луміракоксиб), BMS 347070, RS 57067, NS-398, Бекстра (валдекоксиб), паракоксиб, Віокс (рофекоксиб), SD-8381, 4-Метил-2-(3,4диметилфеніл)-1-(4-сульфамоїл-феніл)-1H-пірол, 2-(4-Етоксифеніл)-4-метил-1-(4-сульфамоїлфеніл)1H-пірол, T-614, JTE-522, S-2474, SVT-2016, CT-3, SC-58125 і Аркоксіа (еторікоскиб). Крім того, COXII інгібітори описуються в патентній заявці US 2005-0148627 і US 2005-0148777, вміст яких включений у всій їх повноті для всіх цілей. В особливому втіленні, протипухлинним агентом є целекоксиб (патент US 5,466,823), валдекоксиб (патент US 5,633,272), парекоксиб (патент US 5,932,598), деракоксиб (патент US 5,521,207), SD8381 (патент US 6,034,256, Приклад 175), ABT-963 33 (WO 2002/24719), рофекоксиб (CAS № 162011-907), MK-663 (або еторікоскиб), як описано в WO 1998/03484, COX-189 (Луміракоксиб) як описано в WO 1999/11605, BMS-347070 (патент US 6,180,651), NS-398 (CAS 123653-11-2), RS 57067 (CAS 17932-91-3), 4-Метил-2-(3,4-диметилфеніл)1-(4-сульфамоїл-феніл)-1H-пірол, 2-(4Етоксифеніл)-4-метил-1-(4-сульфамоїлфеніл)-1Hпірол або мелоксикам. Іншими корисними інгібіторами, як протипухлинними агентами, використовували в комбінації із сполукою представленого винаходу і фармацевтичними композиціями описаними тут є аспірин і нестероїдні протизапальні лікарські засоби (НСПЗЛК), які інгібують фермент, що утворює простагландини (циклооксигеназа I і II), призводячи до низьких рівнів простагландинів, є, але не обмежується, наступні, Салсалат (Амігезік), Діфлунізал (Долобід), Ібупрофен (Мотрін), Кетопрофен (Орудіс), Набуметон (Релафен), Піроксикам (Фелден), Напроксен (Алев, Напрзін), Диклофенак (Волтарен), Індометацин (Індоцин), Суліндак (Кліноріл), Толметин (Толектин), Етодолак (Лодин), Кеторолак (Торадол), Оксапрозин (Діапро) і їх комбінації. Переважними інгібіторами COX-I є ібупрофен (Мотрин), нуприн, напрксен (Алев), індометацин (Індоцин), набуметон (Релафен) і їх комбінації. Націленими агентами використовуваними в комбінації з сполукою представленого винаходу і фармацевтичними композиціями описаними тут є інгібітори EGFr, такі як Іресса (гефітиніб, AstraZeneca), Тарцева (ерлотиніб або OSI-774, OSI Pharmaceuticals Inc.), Ербітукс (цетуксимаб, Imclone Pharmaceuticals, Inc.), EMD-7200 (Merck AG), ABX-EGF (Amgen Inc. і Abgenix Inc.), HR3 (Cuban Government), IgA антитіла (University of Erlangen-Nuremberg), TP-38 (IVAX), EGFR злитий протеїн, EGF-вакцина, анти-EGFr імуноліпосоми (Hermes Biosciences Inc.) і їх комбінації. Переважними інгібіторами EGFr є Іресса, Ербітукс, Тарцева і їх комбінації. Іншими протипухлинними агентами є сполуки, що вибирають з інгібіторів pan erb рецептора або інгібіторів ErbB2 рецептора, таких як CP-724,714 (Pfizer, Inc.), CI-1033 (канертиніб, Pfizer, Inc.), Херцептин (трастузумаб, Genentech Inc.), Омітарг (2C4, пертузумаб, Genentech Inc.), TAK-165 (Takeda), GW-572016 (лонафарніб, GlaxoSmithKline), GW-282974 (GlaxoSmithKline), EKB-569 (Wyeth), PKI-166 (Novartis), dHER2 (HER2 Vaccine, Corixa і GlaxoSmithKline), APC8024 (HER2 Vaccine, Dendreon), анти-HER2/neu бісспецифічне антитіло (Decof Cancer Center), B7.her2.IgG3 (Agensys), AS HER2 (Research Institute for Rad Biology & Medicine), трифункціональне біспецифічне антитіло (University of Munich) і mAB AR-209 (Aronex Pharmaceuticals Inc) і mAB 2B-1 (Chiron) і їх комбінації. Переважними erb селективними протипухлинними агентами є Херцептин, TAK-165, CP-724,714, ABX-EGF, HER3 і їх комбінації. Переважними інгібіторами pan erbb рецептора є GW572016, CI1033, EKB-569 і Омітарг і їх комбінації. Додатковими erbB2 інгібіторами є сполуки описані в WO 98/02434, WO 99/35146, WO 95113 34 99/35132, WO 98/02437, WO 97/13760, WO 95/19970, патенті US 5,587,458 і патенті US 5,877,305, кожен з яких включений сюди як посилання у всій повноті. Інгібіторами ErbB2 рецептора корисними в представленому винаході є також сполуки описані в патентах US 6,465,449 і 6,284,764, і в WO 2001/98277, кожен з яких включений сюди як посилання у всій їх повноті. Додатково, інші протипухлинні агенти можуть бути вибрані з наступних агентів, BAY-43-9006 (Onyx Pharmaceuticals Inc.), Генасенс (аугмеросен, Genta), Панітумумаб (Abgenix/Amgen), Зевалін (Schering), Вексар (Corixa/GlaxoSmithKline), Аберлікс, Алімта, EPO 906 (Novartis), діскодермолід (XAA-296), ABT-510 (Abbott), Неовастат (Aeterna), ензастаурин (Eli Lilly), Комбрестатин A4P (Oxigene), ZD-6126 (AstraZeneca), флавопіридол (Aventis), CYC-202 (Cyclacel), AVE-8062 (Aventis), DMXAA (Roche/Antisoma), Тімітак (Eximias), Темодар (темозоломід, Schering Plough) і Ревілімд (Celegene) і їх комбінації. Інші протипухлинні агенти можуть бути вибрані з наступних агентів, CyPat (ципротерон ацетат), Гістерелін (гістерелін ацетат), Пленаіксіс (абералікс депо), Атразентан (ABT-627), Сатраплатин (JM-216), таломід (Талідомід), Тератоп, Теміліфен (DPPE), ABI-007 (паклітаксель), Евіста (ралоксифен), Атаместан (Biomed-777), Ксіотакс (поліглутамат паклітаксель), Таргетин (бексаротин) і їх комбінації. Додатково, інші протипухлинні агенти можуть бути вибрані з наступних агентів, Тризаон (тирапазамін), Апосін (ексисулінд), Невастат (AE-941), Цеплен (гістаміну дигідрохлорид), Оратецин (рубітекан), Вірулізин, Гастрімун (G17DT), DX-8951f (ексатекану мезилат), Онконаз (ранпірнас), BEC2 (мітумоаб), Ксцитрин (мотексафін гадолінію) і їх комбінації. Додаткові протипухлинні агенти можуть бути вибрані з наступних агентів, CeaVac (CEA), НеуТрексин (триметрасат глюкуронат) і їх комбінації. Додаткові протипухлинні агенти можуть бути вибрані з наступних агентів, ОваРекс (ореговомаб), Осідем (IDM-1) і їх комбінації. Додаткові протипухлинні агенти можуть бути вибрані з наступних агентів, Адвексін (ING 201), Тіразон (тірапазамін) і їх комбінації.Додаткові протипухлинні агенти можуть бути вибрані з наступних агентів, RSR13 (ефапроксірал), Котара (131I chTNT 1/b), NBI-3001 (IL-4) і їх комбінації. Додаткові протипухлинні агенти можуть бути вибрані з наступних агентів, Канваксин, GMK вакцина, PEG Інтерон A, Таксопрексін (ДНК/паклітаксель) і їх комбінації. Іншими протипухлинними агентами є інгібітор MEK1/2 від Pfizer PD325901, інгібітор MEK від Array Biopharm ARRY-142886, інгібітор CDK2 від Bristol Myers BMS-387,032, інгібітор CDK від Pfizer PD0332991 і AXD-5438 від AstraZeneca і їх комбінації. Додатково, також можуть бути використані інгібітори mTOR, такі як CCI-779 (Wyeth) і похідні рапаміцину RAD001 (Novartis) і AP-23573 (Ariad), інгібітори HDAC, SAHA (Merck Inc./Aton Pharmaceuticals) і їх комбінації. Додатковими протипухлинними агентами є інгібітор Аурора 2 VX 35 680 (Vertex) і інгібітор Chk1/2 XL844 (Exilixis). Наступні цитотоксичні агенти, наприклад, один або більше вибраних з групи, що містить епірубіцин (Елленсе), доцетаксель (Таксотер), паклітаксель, Зінекард (дексазоксан), рітуксімаб (Рітуксан), іматиніб мезилат (Глівек) і їх комбінації, можуть бути використані в комбінації з сполукою представленого винаходу і фармацевтичними композиціями описаними тут. Винахід також передбачає використання сполук представленого винаходу разом з гормональною терапією, включаючи, але не обмежується, ексеместан (Аромазин, Pfizer Inc.), леупрорелін (Лупрон або Леуплін, TAP/Abbott/Takeda), анастразол (Арімідекс, Astrazeneca), гозрелін (Золадекс, AstraZeneca), доксеркальциферол, фадрозол, форместан, тамоксифену цитрат (тамоксифен, Нолвадекс, AstraZeneca), Казодекс (AstraZeneca), Абарелікс (Praecis), Трелстар і їх комбінації. Винахі також стосується застсоування сполук представленого винаходу разом з гормональними агентами, такими як антиестрогени, включаючи, але не обмежується, фулвестрант, тореміфен, ралоксифен, лазофоксіфен, летрозол (Фемара, Novartis), антиандрогени, такі як бікалутамід, флутамід, міфепристон, нілутамід, Казодекс™(4'ціано-3-(4-фторфенілсульфоніл)-2-гідрокси-2метил-3'-(трифторметил)пропіоанілід, бікалутамід) і їх комбінації. Крім того, винахід забезпечує сполуку представленого винаходу окремо або в комбінації з одним або більше продуктів підтримуючого лікування, наприклад, продукт, що вибирають з групи, яка містить Філграстим (Нейпоген), ондансетрон (Зофран), Фрагмін, Прокрит, Алоксі, Еменд або їх комбінації. Особливо переважними цитотоксичними агентами є Камптосар, Ербітукс, Іресса, Глівек, Таксотер і їх комбінації. Наступні інгібітори топоізомерази I можуть бути використані як протипухлинні агенти: камптотецин; іринотекан HCl (Камптосар); едотекарин; оратецин (Суперген); ексатекан (Даічі); BN-80915 (Роше) і їх комбінації. Особливо переважними інгібіторами топоізомерази II є епірубіцин (Елленсе). Алкілувальними агентами є, але не обмежується, N-оксид азотистого іприту, циклофосфамід, іфосфамід, мелфалан, бусульфан, мітобронітол, карбохіон, тіотепа, ранімустин, німустин, темозоломід, AMD-473, алтретамін, AP-5280, апазіхон, блосталіцин, бендамустин, кармустин, естрамустин, фотемустин, глюфосфамід, іфосфамід, KW2170, мафосфамід і мітолактол; алкілувальними сполуками координованої платини є, але не обмежується, цисплатин, Параплатин (карбоплатин), ептаплатин, лобарлатин, недаплатин, Елоксатин (оксаліплатин, Sanofi) або сатрплатин і їх комбінації. Особливо переважними алкілувальними агентами є Елоксатин (оксаліплатин). Антиметаболітами є, але не обмежується, метотрексат, 6-меркаптопурину рибозид, меркаптопурин, 5-фторурацил (5-FU) окремо або в комбінації з леуковорином, тегафур, UFT, доксифлуридин, кармофур, цитарабін, цитарабін скфосфат, еноцитабін, S-1, Алімта (динатрій преметрексед, 95113 36 LY231514, MTA), Гемзар (гемцитабін, Eli Lilly), флударабін, 5-азацитидин, капецитабін, кладрибін, клофарабін, децитабін, ефлорнітин, етинілцитидин, цитозину арабінозид, гідроксисечовина, TS1, мелфалан, неларабін, нолатрексед, окфосфат, динатрій преметрексед, пентостатин, пелітрексол, ралтітрексед, тріапін, триметрексат, відарабін, вінкристин, вінорелбін; або, наприклад, один з переважних антиметаболітів описаних в Європейській заявці № 239362, такий як N-(5-[N-(3,4-дигідро2-метил-4-оксохіназолін-6-ілметил)-N-метиламіно]2-теноїл)-L-глютамінова кислота і їх комбінації. Антибіотиками є інтеркалюючі антибіотики і є, але не обмежується: акларубіцин, актиноміцин D, амрубіцин, аннаміцин, адріаміцин, блеоміцин, даунорубіцин, доксорубіцин, елсаміьруцин, епірубіцин, галарубіцин, ідарубіцин, мітоміцин C, неморубіцин, неокарциностатин, пепломіцин, пірарубіцин, ребекаміцин, стималамер, стрептозоцин, валрубіцин, зиностатин і їх комбінації. Протипухлинними речовинами виділеними з рослин є, наприклад, сполуки що вибирають з інгібіторів мітозу, наприклад, вінбластин, доцетаксель (Таксотер), паклітаксель і їх комбінації. Цитотоксиними топоізомеразаінгібувальними агентами є один або більше агентів, що вибирають з групи, яка містить акларубіцин, амонафід, балотекан, камптотецин, 10-гідроксиcамптотецин, 9амінокамптотецин, дифломотекан, іринотекан HCl (Камптосар), едотекарин, епірубіцин (Елленсе), етопозид, ексатекан, гіматекан, луртотекан, мітоксантрон, пірарубіцин, піксантрон, рубітекан, собузоксан, SN-38, тафлупозид, топотекан і їх комбінації. Переважними цитотоксиними топоізомеразаінгібувальними агентами є один або більше агентів, що вибирають з групи, яка містить камптотецин, 10-гідроксиcамптотецин, 9-амінокамптотецин, іринотекан HCl (Капмтосар), едотекарин, епірубіцин (Елленсе), етопозид, SN-38, топотекан і їх комбінації. Імунологічними агентами є інтерферони і ряд інших агентів, що підсилюють імунітет. Інтерферонами є інтерферон альфа, інтерферон альфа-2a, інтерферон альфа-2b, інтерферон бета, інтерферон гама-1a, інтерферон гама-1b (Актиммун) або інтерферон гама-n1 і їх комбінації. Іншими агентами є філграстим, лентінан, сізофілан, ТераЦис, убенімекс, WF-10, алдеслеукін, алемтузумаб, BAM-002, дакарбазин, даклізумаб, денілеукін, гемтузумаб озогаміцин, ібритумомаб, іміквімод, ленограстим, лентінан, вакцина меланоми (Корікса), молграмостин, ОнкоVAX-CL, сарграмостим, тазонермін, теклеукін, тималазин, тозітумомаб, Вірулізин, Z-100, епратузумаб, мутумомаб, ореговомаб, пемтумомаб (Y-muHMFG1), Провенге (Дендреон) і їх комбінації. Модифікаторами біологічної відповіді є агенти, що модифікують захисні механізми живих організмів або біологічні відповіді, такі як виживання, ріст або диференціація клітин тканини спрямовуючи їх на протипухлинну активність. Такими агентами є крестин, лентінан, сізофіран, піцибаніл, убенімекс і їх комбінації. Іншими протираковими агентами, що можуть 37 бути використані в комбінації із сполукою представленого винаходу є алітретіноін, ампліген, атресентану бексаротен, бортезоміб, Бозентан, кальцитріол, ексісулінд, фінестерид, фотемустин, ібандронова кислота, мілтефозин, мітоксантрон, lаспарагіназа, прокарбазин, дакарбазин, гідроксикарбамід, пегаспаргаза, пентостатин, тазаротн, Телцита (TLK-286, Telik Inc.), Велкад (бортемазіб, Millenium), тритеноін і їх комбінації. Кординаційними сполуками платини є, але не обмежується, цисплатин, карбоплатин, недаплатин, оксаліплатин і їх комбінації. Похідними камптотецину є, але не обмежується, камптотецин, 10-гідроксикамптотецин, 9амінокамптотецин, іринотекан, SN-38, едотекарін, топотекан і їх комбінації. Іншими протипухлинними агентами є мітоксатрон, l-аспарагіназа, прокарбазин, дакарбазин, гідроксикарбамід, пентостатин, третиноїн і їх комбінації. Також можуть бути використані протипухлинні агенти здатні підвищувати протипухлинні імунні відповіді, такі як CTLA4 (цитотоксичний лімфоцит ний антиген 4) антитіла, і інші агенти здатні блокувати CTLA4, такі як MDX-010 (Медарекс) і CTLA4 сполуки описані в патенті US 6,682,736; і антипроліферативні агенти, такі як інші інгібітори фарнезилтрасферази, наприклад, інгібітори фарнезилтрасферази. Додатково, специфічні CTLA4 антитіла, що можуть бути використані в комбінації із сполуками представленого винаходу є сполуки описані в патентах US 6,682,736 і 6,682,736, обидва з яких включені сюди як посилання у всій їх повноті. Специфічними IGF1R антитілами, що можуть бути використані в комбінованих способах представленого винаходу, є антитіла описані в WO 2002/053596, яка включена сюди як посилання у всій своїй повноті. Специфічними CD40 антитілами, що можуть бути використані в комбінованих способах представленого винаходу, є антитіла описані в WO 2003/040170, яка включена сюди як посилання у всій своїй повноті. Як протипухлинні агенти також можуть бути використані генотерапевтичні агенти, такі як TNFerade (GeneVec), який епресує TNFальфа у відповідь на радіоопромінення. В одному з втілень представленого винаходу, статини можуть бути використані в комбінації із сполукою представленого винаходу і її фармацевтичними композиціями. Статини (інгібітори HMGCoA редуктази) можуть бути вибрані з групи, що містить аторвастатин (Ліпітор™, Pfizer Inc.), провастатин (Правахол™, Bristol-Myers Squibb), ловастатин (Мевакор™, Merck Inc.), Симвастатин (Зокор™, Merck Inc.), флувастатин (Лескол™, Novartis), церівастатин (Байкол™, Bayer), розувастатин (Крестор™, AstraZeneca), ловастатин і ніацин (Адвікор™, Kos Pharmaceuticals), похідні і їх комбінації. 95113 38 В переважному втіленні, статин вибирають з групи, що містить аторвастатин і ловастин, похідні і їх комбінації. Іншими агентами корисними як протипухлинні агенти є Кадует. В наступних Підготовчих прикладах і Прикладах, “Ac” означає ацетил, “Me” означає метил, “Et” означає етил, “Ph” означає феніл, “BOC”, “Boc” або “boc” означає N-трет-бутоксикарбоніл, “DCM” (CH2Cl2) означає метиленхлорид, “DIPEA” або “DIEA” означає діізопропілетиламін, “DMA” означає N,N-диметилацетамід, "ДМФА" означає N,Nдиметилформамід, “ДМСО" означає диметилсульфоксид, “DPPP” означає 1,3біс(дифенілфосфіно)пропан, “HOAc” означає оцтову кислоту, “IPA” означає ізопропіловий спирт, “NMP” означає 1-метил-2-піролідинон, “TEA” означає триетиламін, “TFA” означає трифтороцтову кислоту, “DCM” означає дихлорметан, “EtOAc” означає етилацетат, “MgSO4” означає сульфат магнію, “Na2SO4” означає сульфат натрію, “MeOH” означає метанол, “Et2O” означає діетиловий етер, “EtOH” означає етанол, “H2O” означає воду, “HCl” означає хлорводневу кислоту, “POCl3” означає оксихлорид фосфору, “K2CO3” означає карбонат калію, “ТГФ” означає тетрагідрофуран, “DBU” означає 1,8-діазабіцикло[5.4.0]ундец-7-ен, “LiHMDS” або “LHMDS” означає гексаметилдисилазид літію, “TBME” або "MTBE" означає третбутилметиловий етер, “LDA” означає діізопропіламід літію, “N” означає Нормальний, “M” означає молярний, “мл” означає мілілітр, “ммоль” означає мілімоль, “мкмоль” означає мікромоль, “ек.” означає еквівалент, “C” означає градуси Цельсія, “Па” означає паскаль. Способи одержання Сполуки представленого винаходу можна одержати використовуючи реакційні шляхи і схеми синтезу показані нижче, і використовуючи методики доступні в цій галузі та вихідні матеріали, що легко доступні. Здійснення деяких втілень представленого винаходу описується детально в наступних прикладах, але середній фахівець в цій галузі повинен розуміти, що описані підготовці приклади можуть бути легко адаптовані для одержання інших втілень представленого винаходу. Наприклад, синтез нерозкритих сполук згідно з винаходом можна здійснити шляхом модифікацій очевидних для фахівця в цій галузі, наприклад, використовуючи прийнятно захищені групи, що заважають, шляхом зміни на інші придатних реагентів відомих в цій галузі або за допомогою звичайних модифікацій умов реакцій. Альтернативно, інші реакції приведені тут або відомі в цій галузі будуть розпізнаватись як такі, що є адаптованими для одержання інших сполук винаходу. В одному із загальних способів синтезу, сполуки загальної формули 3 одержують згідно із Способом A. 39 95113 40 Спосіб A CH 3 CH 3 X N H3C S O N N R2 O CH 3 X N R1HN Стадія 1 R3 N N 1 N R2 O R1HN Стадія 2 N 2 N R2 O 3 Сполуку 1, де X є Cl, Br або I і одержання описано в WO2005105801, перетворюють у сполуку 2 шляхом обробки аміном формули R1NH2 в придатному розчиннику, наприклад, діоксан, в присутності основи, наприклад, триетиламін, при підвищеній температурі в інтервалі від 40C до 220C протягом часу в інтервалі від декількох годин до декількох днів. Сполуку 2 перетворюють у сполуку 3 шляхом обробки борною кислотою формули R3B(OH)2 або відповідним естером борної кислоти, з наступним модифікуванням за умов реакції Сузукі відомих фахівцю в цій галузі. В іншому загальному способі синтезу, сполуки загальної формули 8 одержують згідно із Способом B. Спосіб B O CH 3 CH 3 R1HN OR 4 Br N N N R2 Стадія 1 O O N R1HN CH 3 OR 4 N 4 N R2 O R1HN Стадія 2 OR 4 N 5 CH 3 R1HN CH 3 OH N N R2 N R2 O 6 O N Стадія 3 O N O N Стадія 4 O R1HN NR 5R6 N 7 N R2 O 8 Сполуку 4 перетворюють у сполуку 5 реакцією з естером акрилату в присутності N-циклогексилN-метилциклогексанаміну, три-третбутилфосфонію тетрафторборату, хлориду літію і трис(дибензиліденацетон)дитетракіс(трифенілфос фін)паладій (0), в придатному розчиннику, наприклад, 1,4-діоксан, при температурі в інтервалі від 50C до 75C протягом від півгодини до декількох днів. Сполуку 5 перетворюють у сполуку 6 шляхом гідрування. Гідроліз естерного похідного 6, з наступним утворенням аміду, дає сполуку Формули 8. В іншому загальному способі синтезу, сполуки загальної формули 11 одержують згідно із Способом C. Спосіб C CH 3 CH 3 Br N R1HN N N R2 O CH 3 B(OH) 2 N Стадія 1 R1HN N 9 N R2 O R3-X R3 N Стадія 2 R1HN N 10 N R2 O 11 Сполуку 9 перетворюють у сполуку 10 шляхом обробки триметилборатом і бутиллітієм в придатному розчиннику, наприклад, ТГФ, при низькій температурі в інтервалі від -40C до -90C. Сполуку 10 перетворюють у сполуку 11 реакцією з R3-X з наступною реакцією Сузукі за умов відомих фахівцю в цій галузі. В іншому загальному способі синтезу, сполуки загальної формули 16 одержують згідно із Способом D. Спосіб D Br N H3C S N CH 3 CH 3 CH 3 N H R2OH O Стадія 1 Br N H3C S N 12 N R2 O R3 N H3C Стадія 2 S N 13 14 CH 3 CH 3 R3 N Стадія 3 H3C S O N 15 N R2 O N R2 R3 N Стадія 4 R1 N H N 16 N R2 O O Br S N N H R2OH O N H3C CH 3 CH 3 CH 3 Стадія 1 Br N H3C S N N R2 12 R3 N H3C Стадія 2 O S N 13 41 42 CH 3 CH 3 R3 N H3C S O N O 14 95113 Стадія 3 N R2 N R2 R3 N R1 Стадія 4 O N H N 15 N R2 O 16 Сполука 12 реагує із спиртом формули R2OH в присутності трифенілфосфіну і діетилазодикарбоксилату (DEAD) в придатному розчиннику, наприклад, ТГФ, при температурі в інтервалі від кімнатної 0C до 60C з одержанням сполуки Формули 13. Сполуку 13 перетворюють у сполуку 14 шляхом обробки борною кислотою формули R3-B(OH)2 або відповідного естеру борної кислоти, з наступ ною модифікацією Сузукі за умов реакції відомих фахівцю в цій галузі. Сполуку 14 окислюють одержуючи сполуку 15 використовуючи реагенти, такі як, наприклад, м-хлорпербензойна кислота (MCPBA). Обробка сполуки 15 аміном Формули R1NH2 дає сполуку 16. В іншому загальному способі синтезу, сполуки формули 21 одержують згідно із Способом E. Спосіб E Br S N N H R2X O N H3C CH 3 CH 3 CH 3 Стадія 1 Br N H3C S N N R2 17 R3 N O H3C Стадія 2 S N 18 CH 3 R3 N S O O Стадія 3 N N R2 R3 N Стадія 4 O R1 N H N 20 N R2 O 21 Сполуку 17 перетворюють у сполуку 18 шляхом обробки R2X, де X є Cl, Br або I, в присутності основи, наприклад, гідрид натрію, в придатному розчиннику, такому як, наприклад, ДМФА, при температурі в інтервалі від 25C до 100C. Сполуку 18 перетворюють у сполуку 19 шляхом обробки борною кислотою формули R3-B(OH)2 або відповідним борним естером, з наступною реакцією Сузукі за умов відомих фахівцю в цій галузі. Сполуку 19 окислюють одержуючи сполуку 20 використовуючи реагенти, такі як, наприклад, MCPBA. Обробка сполуки 20 аміном Формули R1NH2 в придатному розчиннику, такому як, наприклад, ТГФ при кипінні із зворотнім холодильником дає сполуку Формули 21. В іншому загальному способі синтезу, сполуки загальної формули 28 одержують згідно із Способом F. Спосіб F CH 3 CH 3 N H2N + N Стадія 1 H2N 23 CH 3 R4 O Стадія 3 H2N Стадія 2 H2N NH R2 R4 Стадія 4 H2N N N R2 26 CH 3 CH 3 X N H2N NH 24 R2 N 25 Стадія 5 N CH 3 O N NH R2 O N R3 N N N R2 27 X N N 22 O CH 3 N R2 NH 2 Cl O 19 CH 3 H3C N R2 O Стадія 6 H2N N N R2 28 O O 43 95113 Комерційно доступну сполуку 22 перетворюють у сполуку 23 реакцією з аміном формули R2NH2 в придатному розчиннику, такому як, наприклад, диметилацетамід, в присутності основ, таких як карбонат калію і діізопропілетиламін, при підвищеній температурі в інтервалі від 40C до 220C протягом часу в інтервалі від декількох годин до декількох днів. Сполуку 23 перетворюють у сполуку 24, де X є Cl, Br або I шляхом обробки Nгалосукцинамідом в придатному розчиннику, такому як хлороформ або тетрахлорид вуглецю, при кімнатній температурі протягом часу в інтервалі від 30 хв до декількох годин. Сполуку 24 перетворюють у сполуку 25 реакцією з естеру акрилату в присутності три-o-толілфосфіну, ацетат тетракіс(трифенілфосфін)паладій (II) і триетиламіну при підвищеній температурі. Сполуку 25 перетворюють у сполуку 26 шляхом нагрівання розчину сполуки 25, тіофенолу або KOtBu, і органічної основи, такої як триетиламін і DBU, в придатному розчиннику, такому як диметилацетамід при підвищеній темпе 44 ратурі в інтервалі від 40C до 220C, протягом часу в інтервалі від декількох годин до декількох днів. Сполуку 26 перетворюють у сполуку 27 шляхом обробки N-галосукцинамідом в придатному розчиннику, такому як ДМФА при кімнатній температурі, протягом часу в інтервалі від 30 хв до декількох годин. Сполуку 27 потім перетворюють у сполуку 28 реакцією з борною кислотою формули R3-B(OH)2 або відповідним борним естером, в присутності основи, наприклад, карбонат калію, і хлориду біс(трифенілфосфін)тетракіс(трифенілфосфін)пал адій (II), в придатному розчиннику, такому як розчин ДМФА і води, при підвищеній температурі в інтервалі від 70C до 120C, протягом часу від декількох годин до декількох днів. Спосіб F можна використати, наприклад, для 2 одержання сполуки 28 де R є необов„язково заміщена спіроциклічна група. Спосіб G В боксі з рукавичками, послідовно додавали до 2,0 мл реакційної пробірки Personal Chemistry Microwave: одну трикутну магнітну мішалку, розчин прийнятного арилгалоїду 29 в ДМФА (300 мкл, 75 ммоль, 1,0 ек., 0,25 M), прийнятну борну кислоту або борний естер в ДМФА (300 мкл, 75 мкмоль, 1,0 ек., 0,25 M), каталізатор Pd(PPh3)4 в безводному ТГФ (300 мкл, 3,75 мкмоль, 0,05 ек., 0,0125 M) і K2CO3 в дегазованій ДІ воді (94 мкл, 188 мкмоль, 2,5 ек., 2,0 M). Пробірку закривали кришкою з мембраною і виймали з боксу, реакційні суміші нагрівали в Personal Chemistry Microwave Synthesizer 15 хвилин при 130 C. Реакційні суміші переносили в 13 100 мм пробірку для тестування. Пробірки для мікрохвильовки промивали ДМФА (1,0 мл) і промивні розчини ДМФА об„єднували з оригінально виділеним матеріалом. Розчинники видаляли і до кожної пробірки додавали EtOAc (1 мл) і ДІ воду (1 мл). Після перемішування і центрифугування, надосадкову рідину переносили до нової 13 100 мм пробірки для тестування. Водну фазу екстрагували більше двох разів свіжим EtOAc (1 мл). Об„єднані органічні фази екстрагували ДІ водою (1 мл) і вод. NaCl (1 мл). Органічну фазу фільтрували через шприцевий фільтр і фільтрат упарювали. Залишки відновлювали в ДМСО і неочищений матеріал піддавали ВЕРХ очищенню використовуючи ацетонітрил/вода з 0,05% TFA, як рухому фазу, на колонці Agilent Zorbax Extend C18. Спосіб H CH 3 CH 3 N H2N + N Cl R2 O A N NH 2 NH Стадія 2 A O R2 N 32 CH 3 R4 O Стадія 3 N NH A O R2 34 R4 N H2N Стадія 4 N N A O R2 35 CH 3 X N H2N R3 N N NH A O R2 33 CH 3 Стадія 5 N CH 3 O H2N H2N O N X N Стадія 1 H2N 31 O CH 3 N A O O Стадія 6 H2N N N A O O O CH 3 CH 3 N H2N + N O R2 Cl A N NH 2 N 32 45 95113 CH 3 R4 O H2N N R4 H2N Стадія 4 N A CH 3 R3 N N O O R2 X N H2N N 35 CH 3 Стадія 5 NH A O 33 46 R2 N NH A O R2 34 N CH 3 O H2N Стадія 3 NH Стадія 2 A O R2 O N X N Стадія 1 H2N 31 O CH 3 N A O H2N Стадія 6 O R2 36 N N A O R2 37 Комерційно доступну сполуку 31 перетворюють у сполуку 32 реакцією з аміном формули R2-OA-NH2, де A є необов„язково заміщений C3-10 циклоалкіл, в придатному розчиннику, такому як, наприклад, диметилацетамід, в присутності основ, таких як карбонат калію і діізопропілетиламін, при підвищеній температурі в інтервалі від 40C до 220C, протягом часу в інтервалі від декількох годин до декількох днів. Сполуку 32 перетворюють у сполуку 33, де X є Cl, Br або I, шляхом обробки Nгалосукцинамідом в придатному розчиннику, такому як хлороформ або тетрахлорид вуглецю, при кімнатній температурі, протягом часу в інтервалі від 30 хв до декількох годин. Сполуку 33 перетворюють у сполуку 34 реакцією з естером акрилату в присутності три-o-толілфосфіну, ацетату тетракіс(трифенілфосфін)паладій (II) і триетиламіну, при підвищеній температурі. Сполуку 34 перетворюють у сполуку 35 шляхом нагрівання розчину сполуки 34, тіофенолу або KOtBu, і органічних ос O нов, таких як триетиламін і DBU, в придатному розчиннику, такому як диметилацетамід, при підвищеній температурі в інтервалі від 40C до 220C, протягом часу в інтервалі від декількох годин до декількох днів. Сполуку 35 перетворюють у сполуку 36 шляхом обробки N-галосукцинамідом в придатному розчиннику, такому як ДМФА, при кімнатній температурі протягом часу в інтервалі від 30 хв до декількох годин. Сполуку 36 потім перетворюють у сполуку 37 реакцією з борною кислотою формули R3-B(OH)2 або відповідним борним естером, в присутності основи, наприклад, карбонат калію, і хлориду біс(трифенілфосфін)тетракіс(трифенілфосфін)пал адій (II), в придатному розчиннику, такому як розчин ДМФА і води, при підвищеній температурі в інтервалі від 70C до 150C, протягом часу від декількох годин до декількох днів. Спосіб I CH 3 CH 3 Br N H3C N N H O A N H3C NH 2 R2 X N Cl Стадія 1 CH 3 CH 3 Br N NH A O H CH 3 N Стадія 2 H2N CH 3 Br N Стадія 3 41 NH A O R2 Сполуку формули 34 також можна одержати як описано в Способі I. Сполуку 38 перетворюють у сполуку 39 реакцією з аміном формули HO-ANH2 в придатному розчиннику, такому як, наприклад, диметилацетамід, в присутності основ, таких як карбонат калію і діізопропілетиламін, при підвищеній температурі в інтервалі від 40C до 220C, протягом часу в інтервалі від декількох го O N Стадія 4 NH A O R2 40 CH 3 N N CH 3 39 38 Br N H3C H2N O N 34 CH 3 NH A O R2 дин до декількох днів. Сполуку 39 перетворюють у сполуку 40 реакцією з R2X в придатному розчиннику, такому як ДМФА в присутності основи, такої як гідрид натрію, при температурі в інтервалі від кімнатної температури до 100C. Сполуку 40 перетворюють у сполуку 41 шляхом обробки гідроксиаміном у водному етанолі при температурі в інтервалі від кімнатної температури до 80C. Спо 47 луку 41 перетворюють у сполуку 34 реакцією з естером акрилату в присутності три-oтолілфосфіну, ацетату тетракіс(трифенілфосфін)паладій (II) і триетиламіну при підвищеній температурі. Сполуку 34 потім перетворюють у сполуку Формули 37 згідно з методиками описаними в Способі H. Приклади Приклади і підготовчі приклади приведені нижче додатково ілюструють і розкривають сполуки представленого винаходу і способи одержання таких сполук. Приклади 1 - 100 забезпечують детальні стадії синтезу для одержання Сполук 101, 104-107, 109, 113-114, 116, 120-121, 123, 129-130, 132-133, 147-152, 179, 192, 193, 247-252, 263-264, 267-270, 275, 284 і 285 представленого винаходу. Таблиця 1 розкриває сполуки представленого винаходу, що були одержані використовуючи загальні способи A-I описані тут. Таблиця 2 розкриває біохімічні і клітинні дані для сполук представленого винаходу. Таблиця 3 розкриває дані ефективності стосовно ксенотрансплантату у мишей для Сполуки 152 представленого винаходу. Таблиця 4 розкриває дані фармакокінетичної і фармакодинамічної (ФК-ФД) кореляції в моделях ксенотрансплантатів. Зрозуміло, що рамки представленого винаходу не обмежуються будь-яким чином рамками наступних прикладів і підготовчих прикладів. В наступних прикладах, молекули з єдиним хіральним центром, якщо невказано інше або приведена структурна формула або хімічна назва, існують як рацемічна суміш. Ці молекули з двома або більше хіральними центрами, якщо невказано інше або приведена структурна формула або хімічна назва, , існують як рацемічна суміш діастереомерів. Окремі енантіомери/діастереомери можуть бути одержані за способами відомими фахівцю в цій галузі. Різні вихідні матеріали і інші реагенти одержували з комерційних джерел, таких як Aldrich Chemical Company, і використовувались без дода1 ткового очищення, якщо невказано інше. H-ЯМР спектр знімали на приладі Bruker при 300 МГц або 13 400 МГц і C-ЯМР спектри знімали при 75 МГц. ЯМР спектри знімали як CDCl3 розчини (виражали в м.ч.), використовуючи хлороформ як стандарт (7,25 м.ч. і 77,00 м.ч.) або ДМСО-D6 (2,50 м.ч. і 39,51 м.ч.) або CD3OD (3,4 м.ч. і 4,8 м.ч. і 49,3 м.ч.), або внутрішній стандарт тетраметилсилан (0,00 м.ч.), коли необхідно. Коли необхідно використовували інші ЯМР розчини. Коли одержували складний пік, використовували наступні скорочення для його позначення: с (синглет), д (дублет), т (триплет), м (мультиплет), ш (широкий), дд (дублет дублетів), дт (дублет триплетів). Константи розщеплення, коли дані, приведені в Герцах (Гц). Приклад 1. 2-Аміно-8-циклопентил-6-(3гідроксифеніл)-4-метилпіридо[2,3-d]піримідин7(8H)-он (Сполука 147) 95113 48 Me OH N H2N N N O До розчину 2-аміно-6-бром-8-циклопентил-4метилпіридо[2,3-d]піримідин-7(8H)-ону (100 мг, 0,31 ммоль), 3-гідроксифенілборної кислоти (50 мг, 1,2 екв.), дихлорбіс(трифенілфосфін)тетракіс(трифенілфосфін)пал адій (II) (6,5 мг, 009 ммоль), ДМФА (2 мл) в 10 мл пляшечці для мікрохвильовки додавали карбонат калію (3 M, 0,8 мл). Розчин дегазували використовуючи N2 10 хв, закривали і нагрівали в мікрохвильовому реакторі 10 хв при 120 C. Після завершення, реакцію розводили 1 N NaOH (10 мл) і EtOAc (50 мл). EtOAc шар відокремлювали, сушили над MgSO4, фільтрували і концентрували при пониженому тиску. Неочищений продукт піддавали хроматографічному очищенню. Одержували вказану в заголовку сполуку (82,1 мг, 79% вихід). + НРМС: 337 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 9,37 (1H, с), 7,87 (1H, с), 7,19 (3H, м), 7,11 (1H, с), 7,03 (1H, д), 6,746,71 (1H, м), 6,04-5,99 (1H, м), 2,55 (3H, с), 2,242,22 (2H, м), 2,02 (2H, м), 1,77-1,75 (2H, м), 1,601,58 (2H, м). Приклад 2. 2-Аміно-6-бром-8-циклопентил-4метилпіридо[2,3-d]піримідин-7(8H)-он Me Br N H2N N N O До розчину 6-бром-8-циклопентил-4-метил-2(метилсульфініл)піридо[2,3-d]піримідин-7(8H)-ону (0,80 г, 2,16 ммоль) в діоксані (5 мл) додавали гідроксид амонію (30%, 2,6 мл). Суміш нагрівали при 110 C в закритій пробірці 30 хвилин. Розчин концентрували у вакуумі і екстрагували етилацетатом (3 30 мл). Об„єднані органічні розчини промивали насиченим водним хлоридом натрію, сушили (безводний сульфат натрію), фільтрували і концентрували досуха одержуючи вказану в заголовку сполуку як коричневу кристалічну речовину (0,65 г, 93%). + НРМС: 324 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,34 (1H, с), 7,27 (2H, шс), 6,01-5,93 (1H, м), 2,51 (3H, с), 2,16-2,13 (2H, м), 2,00-1,98 (2H, м), 1,75-1,72 (2H, м), 1,571,54 (2H, м). Приклад 3. 6-Бром-8-циклопентил-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он Me Br N Me N H N N O Згідно методиці описаній в Прикладі 2, вико 49 ристовуючи метиламін (2M в ТГФ) замість гідроксиду амонію, одержували вказану в заголовку сполуку з 90% виходом. + НРМС: 338 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,36 (1H, с), 7,82 (1H, шс), 5,98-5,94 (1H, м), 2,86 (3H, с), 2,51 (3H, с), 2,28 (2H, м), 1,99-1,97 (2H, м), 1,75-1,72 (2H, м), 1,62 (2H, м). Приклад 4. 6-Бром-8-циклопентил-4-метил-2(етиламіно)піридо[2,3-d]піримідин-7(8H)-он Me Br N Et N H N N O Згідно методиці описаній в Прикладі 2, використовуючи етиламін (2M в ТГФ) замість гідроксиду амонію, одержували вказану в заголовку сполуку з 93% виходом. + НРМС: 352 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,35 (1H, с), 7,90 (1H, шс), 6,01-5,93 (1H, м), 3,34 (2H, м), 2,51 (3H, с), 2,27 (2H, м), 1,96 (2H, м), 1,75 (2H, м), 1,62 (2H, м), 1,15 (3H, м). Приклад 5. Одержання 2-аміно-8-циклопентил6-(1H-піразол-4-іл)-4-метилпіридо[2,3-d]піримідин7(8H)-ону (Сполука 101) N NH Me N H2N N N O До розчину 2-аміно-6-бром-8-циклопентил-4метилпіридо[2,3-d]піримідин-7(8Н)-ону (100 мг, 0,31 ммоль), трет-бутил 4-(4,4,5,5-тетраметил1,3,2-діоксоборолан-2-іл)-1Н-піразол-1карбоксилату (110 мг, 1,2 екв.), дихлорбіс(трифенілфосфін)тетракіс(трифенілфосфін)паладій (II) (6,5 мг, 009 ммоль), ДМФА (2 мл) в 10 мл пляшечці для мікрохвильовки додавали карбонат калію (3 М, 0,8 мл). Розчин дегазували використовуючи N2 10 хв і потім закривали і нагрівали в мікрохвильовому реакторі 10 хв при 120 °С. Після завершення, реакцію розводили 1 N NaOH (10 мл) і ЕtOАс (50 мл). ЕtOАс шар промивали 3N НСІ, сушили над MgSO4, фільтрували і концентрували при пониженому тиску. Неочищений продукт піддавали хроматографічному очищенню. Одержували вказану в заголовку сполуку (62,5 мг, 65% вихід). + НРМС: 311 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,26 (2H, шс), 8,13 (1H, с), 7,09 (2H, шс), 6,04-5,99 (1H, м), 2,59 (3H, с), 2,27-2,23 (2H, шм), 2,04 (2H, шм), 1,77-1,74 (2H, шм), 1,62 (2H, шм). Приклад 6. 2-Метиламіно-6-карбонітрил-8циклопентил-4-метилпіридо[2,3-d]піримідин-7(8H)он (Сполука 133) 95113 50 Me N N Me N H N N O Розчин 6-Бром-8-циклопентил-4-метил-2метиламіно-8H-піридо[2,3-d]піримідин-7-ону (150 мг, 0,15 ммоль) і ціаніду тетраетиламонію 946 мг, 0,30 ммоль); DABCO (33 мг, 0,30 ммоль) в ацетонітрилі (2 мл) перемішували при 22 C протягом 3 днів. Завершення реакції контролювали за РХМС і суміш упарювали і хроматографували. (70,6 мг, 61% вихід). + НРМС: 284 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,68 (1H, с), 8,31 (1H, м), 5,90-5,85 (1H, м), 2,91 (3H, м), 2,51 (3H, с), 2,28 (2H, шм), 1,96 (2H, шм), 1,77 (2H, шм), 1,62 (2H, шм). Приклад 7. 8-Циклопентил-4-метил-2(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-карбоксамід (Сполука 123) Me O N Me N H NH2 N N O Розчин 2-метиламіно-6-карбонітрил-8циклопентил-4-метилпіридо[2,3-d]піримідин-7(8H)ону (90 мг, 3,20 ммоль) в 3M HCl (10 мл) перемішували при 110 C протягом 24 г. Завершення реакції контролювали за РХМС і суміш упарювали і хроматографували. (32,2 мг, 45% вихід). + НРМС: 302 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,80 (1H, шс), 8,68 (1H, с), 8,13 (1H, м), 7,62 (1H, шс), 5,98-5,96 (1H, м), 2,91 (3H, м), 2,51 (3H, с), 2,33 (2H, шм), 1,99 (2H, шм), 1,78 (2H, шм), 1,65 (2H, шм). Приклад 8. (E)-8-циклопентил-6-(2гідроксивініл)-4-метил-2-(метиламіно)піридо[2,3d]піримідин-7(8H)-он (Сполука 120) Me OH N Me N N N O H 6-Бром-8-циклопентил-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он (336 мг, 1,0 ммоль), 1-(вінілокси)бутан (501 мг, 5,0 ммоль), N-циклогексил-N-метилциклогексанамін (254 мг, 1,3 ммоль), тетрафторборат три-третбутилфосфонію (8,70 мг, 0,03 ммоль), хлорид літію (127 мг, 3,0 ммоль), трис(дибензиліденацетон)дипаладій (0)) (27,5 мг, 0,03 ммоль) і 1,4-діоксан (10 мл) додавали до реакційної колби спорядженої магнітною мішалкою. Реакційну колбу промивали азотом, закривали і нагрівали при 75 C протягом 75 хв. Дані РХМС показала, що і утворюються проміжний вініловий етер і продукт (4:6). Реакційну суміш охолоджува 51 95113 ли до кімнатної температури, фільтрували через ™ Целіт і промивали діоксаном (10 мл). Фільтрат і промивні розчини об„єднували і додавали моногідрат пара-толуолсульфонової кислоти (761 мг, 4,0 ммоль). Реакцію перемішували при кімнатній температурі 1 г. Дані РХМС показали, що весь проміжний вініловий етер гідролізував у бажаний продукт. Розчинник видаляли при пониженому тиску до залишку і додавали етилацетат (120 мл) і промивали водним розчином карбонату калію (5 м/о %), водою і розсолом. Органічний шар сушили над сульфатом натрію і розчинник видаляли при пониженому тиску до жовтого твердого залишку, який кристалізували з гептану, що кипить. При охолодженні до кімнатної температури, утворювались жовті кристали і їх збирали фільтруванням одержуючи вказану в заголовку сполуку (190 мг, 62 % вихід) після двох стадій. + РХМС: 301 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 8,49 (с, 1H) 5,79 6,19 (м, 1H) 5,23 - 5,76 (м, 1H) 3,10 (д, J = 4,78 Гц, 3 H) 2,72 (с, 3 H) 2,60 (с, 3 H) 2,34 - 2,54 (м, 2H) 1,98 - 2,15 (м, 2H) 1,80 - 1,94 (м, 2H) 1,65 - 1,78 (м, 2H). 1 H ЯМР (ДМСО-d6, 400 МГц) 8,35 (с, 1H) 7,81 8,21 (м, 1H) 5,75 - 6,05 (м, 1H) 2,90 (т, J = 5,41 Гц, 3 H) 2,60 (с, 1H) 2,53 - 2,57 (м, 5 H) 2,20 - 2,42 (м, 2H) 1,91 - 2,11 (м, 2H) 1,70 - 1,85 (м, 2H) 1,52 - 1,69 (м, 2H). Приклад 9. (E)-Етил 3-(8-циклопентил-4метил-2-(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-іл)акрилат Me O N Me N H O N N Me O 6-Бром-8-циклопентил-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он (375 мг, 1,1 ммоль), етилакрилат (442 мг, 4,42 ммоль), N-циклогексил-N-метилциклогексанамін (280 мг, 1,43 ммоль), тетрафторборат три-третбутилфосфонію (9,61 мг, 0,03 ммоль), хлорид літію (42,4 мг, 3,3 ммоль), трис(дибензиліденацетон)дипаладій(0) (30,3 мг, 0,03 ммоль) і 1,4-діоксан (10 мл) додавали до реакційної колби спорядженої магнітною мішалкою. Реакційну колбу промивали азотом, закривали і нагрівали при 75 C протягом 75 хв. Реакційну суміш охолоджували до кімнатної температури, фі™ льтрували через Целіт і промивали етилацетатом. Фільтрат і промивні розчини об„єднували і леткі речовини видаляли при пониженому тиску до жовтого твердого залишку. Цей твердий залишок кристалізували з гептан:етилацетат, що кипить, (50 мл: 50 мл). При охолодженні до кімнатної температури утворювались голкоподібні жовті кристали і їх збирали фільтруванням одержуючи вказану в заголовку сполуку як бета-транс ізомер (356 мг, 90 % вихід). + РХМС: 357 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 7,88 (с, 1H) 7,71 (д, J = 15,86 Гц, 1H) 6,96 (д, J = 15,86 Гц, 1H) 6,03 (с, 52 1H) 5,46 (с, 1H) 4,25 (к, J = 7,22 Гц, 2H) 3,09 (д, J = 5,04 Гц, 3 H) 2,58 (с, 3 H) 2,42 (с, 2H) 1,91 - 2,19 (м, 3 H) 1,86 (с, 2H) 1,28 - 1,37 (м, 3 H). Приклад 10. Етил 3-(8-циклопентил-2(етиламіно)-4-метил-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-іл)пропаноат (Сполука 132) Me O N Et N H O N N Me O (E)-етил 3-(8-циклопентил-2-(етиламіно)-4метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)акрилат (525 мг, 1,4 ммоль), одержували аналогічно методиці Прикладу 9, розчиняли в етанолі (150 мл) в 500 мл реакційній пляшці Parr™ і розчин дегазували використовуючи азот 5 хв. Додавали Pd/C (450,0 мг) (Aldrich 330108-50G, порція 08331KC, паладій, 10 мас.% суха маса на активованому вугіллі, вологий, Дегусса тип E101 NE/W, води приб. 50 %). Реакцію гідрували при тиску водню 50 псі при кімнатній температурі 18 г. Каталізатор фільтрували і промивали етанолом (20 мл). Фільтрат і промивні розчини об„єднували і леткі речовини видаляли при пониженому тиску до твердого залишку. Залишок кристалізували з гептану, що кипить, (30 мл). При охолодженні до кімнатної температури утворювались білі голкоподібні кристали і їх збирали фільтруванням одержуючи вказану в заголовку сполуку (338 мг, 64 % вихід). + РХМС: 373 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 7,55 (с, 1H) 5,83 6,12 (м, J = 17,88, 8,81, 8,56 Гц, 1H) 5,21 (с, 1H) 4,12 (к, J = 7,13 Гц, 2H) 3,38 - 3,63 (м, 2H) 2,87 (т, J = 7,30 Гц, 2H) 2,67 (т, J = 7,30 Гц, 2H) 2,53 (с, 3 H) 2,31 - 2,46 (м, 2H) 1,99 - 2,10 (м, 2H) 1,77 - 1,91 (м, 2H) 1,63 - 1,74 (м, 2H) 1,19 - 1,31 (м, 6 H). Приклад 11. 3-(8-Циклопентил-2-(етиламіно)-4метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)пропіонова кислота (Сполука 130) Me O N Et N H OH N N O Етил 3-(8-циклопентил-2-(етиламіно)-4-метил7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)пропаноат (167 мг, 0,45 ммоль) розчиняли в ТГФ (5 мл) в реакційній колбі спорядженій магнітною мішалкою. Гідроксид літію (35 мг, 1,46 ммоль) розчиняли у воді (5 мл) і потім додавали до реакційної колби. Реакційну суміш перемішували при кімнатній температурі 3 г. Леткі речовини видаляли при пониженому тиску до білого твердого залишку. Додавали водну хлорводневу кислоту (3,26 ммоль, 3,26 мл 1,0 M розчину). Білу тверду речовину збирали фільтруванням як вказану в заголовку сполуку (125 мг, 81 % вихід). + РХМС: 345 (M+H) . 1 H ЯМР (D2O, 400 МГц) 7,54 (с, 1H) 5,56 - 5,81 (м, 1H) 3,22 (к, J = 7,22 Гц, 2H) 2,60 (т, J = 7,55 Гц, 53 95113 2H) 2,31 - 2,38 (м, 5 H) 1,91 - 2,05 (м, 2H) 1,77 1,90 (м, 2H) 1,58 - 1,71 (м, 2H) 1,46 - 1,58 (м, 2H) 1,06 (т, J = 7,30 Гц, 3 H). Приклад 12. 3-(8-Циклопентил-2-(етиламіно)-4метил-7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)-N,N-диметилпропанамід (Сполука 121) Me O Me N N Me Et N N N O H 3-(8-циклопентил-2-(етиламіно)-4-метил-7оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)пропіонову кислоту (94 мг, 0,27 ммоль), диметиламін (1,09 ммоль, 0,55 мл 2,0 M розчину в ТГФ), триетиламін (27,6 мг, 0,27 ммоль), O-(7азабензoтриазол-1-іл)-N,N,N‟N‟-тетраметилуронію гексафторфосфат (HATU, 104 мг, 0,27 ммоль) і ДМФА (3,0 мл) додавали до реакційної колби спорядженої магнітною мішалкою. Реакційну суміш нагрівали при 50 C протягом 26 г. Реакцію гасили водою (2 мл) і леткі речовини видаляли при пониженому тиску до залишку. Додавали етилацетат (70 мл) і воду (30 мл) і добре збовтували. Органічний шар відокремлювали, промивали водою (2 30 мл), розсолом (30 мл) і сушили над сульфатом натрію. Розчинник видаляли при пониженому тиску до залишку, який очищали використовуючи силікагель (100 % петролейний ефір до 100 % етилацетат). Фракції об„єднували і леткі речовини видаляли до безбарвного масла, як вказану в заголовку сполуку (55 мг, 54 % вихід). + РХМС: 372 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 7,66 (с, 1H) 5,85 6,07 (м, 1H) 3,38 - 3,60 (м, 2H) 3,03 (с, 3 H) 2,94 (с, 3 H) 2,88 (т, J = 7,30 Гц, 2H) 2,68 (т, J = 7,43 Гц, 2H) 2,54 (с, 3 H) 2,34 - 2,48 (м, 2H) 1,97 - 2,14 (м, 2H) 1,78 - 1,91 (м, 2H) 1,62 - 1,75 (м, 3 H) 1,27 (т, J = 7,18 Гц, 3 H). Приклад 13. 8-Циклопентил-2-(етиламіно)-6-(3гідроксипропіл)-4-метилпіридо[2,3-d]піримідин7(8H)-он (Сполука 129) Me N Et N H 54 продукту обробляли основою одержуючи вказану в заголовку сполуку (34 мг, 61 % вихід). + РХМС: 331 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 7,53 (с, 1H) 5,85 6,12 (м, 1H) 3,57 - 3,65 (м, 2H) 3,51 - 3,57 (м, 2H) 2,96 (с, 1H) 2,71 (т, J = 7,05 Гц, 2H) 2,58 (с, 3 H) 2,35 (с, 2H) 1,99 - 2,12 (м, 2H) 1,79 - 1,91 (м, 4 H) 1,61 - 1,77 (м, 3 H) 1,28 (т, J = 7,18 Гц, 3 H). Приклад 14. 8-Циклопентил-2-(2-гідрокси-2метилпропіламіно)-6-(3-гідроксифеніл)-4метилпіридо[2,3-d]-піримідин-7(8H)-он (Сполука 114) Me Me Me HN N O N N O OH До розчину 6-бром-8-циклопентил-2-(2гідрокси-2-метилпропіламіно)-4-метилпіридо[2,3d]піримідин-7(8H)-ону (52,5 мг, 0,133 ммоль), 3гідроксифенілборної кислоти (20,5 мг, 0,149 ммоль), карбонату калію (3 M, 0,06 мл) в ДМФА (1,2 мл) додавали дихлорбіс(трифенілфосфін)паладій (II) (5 мг, 0,007 ммоль). Суміш дегазували використовуючи N2, закривали і нагрівали 30 хв при 110 C. Суміш виливали в розсіл і екстрагували EtOAc. EtOAc шар сушили (безводний сульфат натрію), фільтрували і концентрували при пониженому тиску. Неочищений продукт очищали хроматографією одержуючи вказану в заголовку сполуку (12 мг, 22%). + НРМС: 409 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 7,73 (1H, с), 7,287,33 (1H, м), 7,09-7,20 (2H, м), 6,79-6,89 (1H, м), 5,90-6,10 (1H, м), 5,13-5,88 (1H, м), 3,54 (2H, д, J = 6,32 Гц), 2,58 (3H, с), 2,25-2,49 (2H, м), 1,96-2,18 (2H, м), 1,79-1,95 (2H, м), 1,63-1,77 (4H, м), 1,31 (6H, с). Приклад 15. 6-Бром-8-циклопентил-2-(2гідрокси-2-метилпропіламіно)-4-метилпіридо[2,3d]піримідин-7(8H)-он Me Br N OH N OH N Me Me HN N N O OH Етил 3-(8-циклопентил-2-(етиламіно)-4-метил7-оксо-7,8-дигідропіридо[2,3-d]піримідин-6іл)пропаноат (60 мг, 0,16 ммоль) розчиняли в етанолі (5 мл) і метанолі (2 мл). До реакційного розчину повільно додавали боргідрид натрію (18 мг, 0,48 ммоль). Протікання реакції контролювали РХМС. Додавали порціями ще боргідрид натрію для завершення реакції після 20 г при кімнатній температурі. Реакцію гасили водою і розчинники видаляли при пониженому тиску досуха. Додавали воду (15 мл) і продукт екстрагували етилацетатом (3 30 мл). Органічний шар сушили над сульфатом натрію і розчинник видаляли при пониженому тиску до залишку, який очищали ВЕРХ. TFA сіль До розчину 6-бром-8-циклопентил-4-метил-2(метилсульфініл)піридо[2,3-d]піримідин-7(8H)-ону (600 мг, 1,62 ммоль) і 1-аміно-2-метилпропан-2олу (294 мг, 2,34 ммоль) в діоксані (6 мл) додавали триетиламін (1,2 мл, 8,6 ммоль). Суміш нагрівали при 110 C в закритій пробірці 1 г. Розчин виливали в розсіл і екстрагували етилацетатом. Органічну частину сушили (безводний сульфат натрію), фільтрували і концентрували досуха. Неочищений продукт очищали флеш хроматографією на силікагелі одержуючи вказану в заголовку сполуку як тверду речовину (565 мг, 88%). + НРМС: 395, 397 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,07 (1H, с), 5,91 55 95113 6,13 (1H, м), 5,46-5,90 (1H, м), 3,52 (2H, д, J = 6,32 Гц), 2,54 (3H, с), 2,17-2,43 (2H, м), 1,95-2,16 (2H, м), 1,76-1,95 (2H, м), 1,56-1,74 (3H, м), 1,30 (6H, с). Приклад 16. 8-Циклопентил-2-(2-гідрокси-2метилпропіламіно)-6-(6-метоксипіридин-3-іл)-4метилпіридо[2,3-d]піримідин-7(8H)-он (Сполука 116) OMe Me N N Me Me HN N N O OH До розчину 6-бром-8-циклопентил-2-(2гідрокси-2-метилпропіламіно)-4-метил-піридо[2,3d]піримідин-7(8H)-ону (50 мг, 0,126 ммоль), 6метоксипіридин-3-ілборної кислоти ( 21 мг, 0,137 ммоль), карбонату калію (3 M, 0,06 мл) в ДМФА (1,2 мл) додавали дихлорбіс(трифенілфосфін)паладій (II) (4,5 мг, 0,0064 ммоль). Суміш дегазували використовуючи N2, закривали і нагрівали 30 хв при 110 C. Розчинник видаляли при пониженому тиску. Неочищену суміш очищали хроматографією одержуючи вказану в заголовку сполуку (23,6 мг, 44%). + НРМС: 424 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,31 (1H, д, J = 2,27 Гц), 7,97 (1H, дд, J = 8,59, 2,53 Гц), 7,72 (1H, с), 6,81 (1H, д, J = 8,59 Гц), 5,88-6,12 (1H, м), 5,28-5,86 (1H, м), 3,97 (3H, с), 3,55 (2H, д, J = 6,32 Гц), 2,59 (3H, с), 2,26-2,47 (2H, м), 1,98-2,17 (2H, м), 1,791,98 (2H, м), 1,65-1,77 (3H, м), 1,32 (6H, с). Приклад 17. 8-Циклопентил-4-метил-2(метиламіно)-6-(піримідин-5-іл)піридо[2,3d]піримідин-7(8H)-он (Сполука 107) N Me N N Me N H N N O Згідно з методикою описаною в Прикладі 14, використовуючи 6-бром-8-циклопентил-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он замість 6-бром-8-циклопентил-2-(2-гідрокси-2метилпропіламіно)-4-метилпіридо[2,3-d]піримідин7(8H)-ону, піримідин-5-ілборну кислоту замість 3гідроксифенілборної кислоти, одержували вказану в заголовку сполуку 10% вихід. + НРМС: 337 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 9,19 (1H, с), 9,03 (1H, с), 7,80 (1H, с), 5,69-6,29 (1H, м), 3,11 (3H, д, J = 5,05 Гц), 2,65 (3H, с), 2,27-2,54 (2H, м), 1,97-2,25 (4H, м), 1,82-1,97 (2H, м), 1,51-1,80 (2H, м). Приклад 18. 8-Ізопропіл-6-(6-метоксипіридин3-іл)-4-метил-2-(метиламіно)піридо[2,3d]піримідин-7(8H)-он (Сполука 113) 56 OMe Me N N Me N H N N Me O Me Згідно з методикою описаною в Прикладі 14, використовуючи 6-бром-8-ізопропіл-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он замість 6-бром-8-циклопентил-2-(2-гідрокси-2метилпропіламіно)-4-метилпіридо[2,3-d]піримідин7(8H)-ону, одержували вказану в заголовку сполуку 11% вихід. + НРМС: 340 (M+H) . 1 H ЯМР (CDCl3, 400 МГц) 8,31 (1H, д, J = 2,02 Гц), 7,99 (1H, дд, J = 8,72, 2,40 Гц), 7,71 (1H, с), 6,80 (1H, д, J = 8,59 Гц), 5,72-6,03 (1H, м), 3,97 (3H, с), 3,09 (3H, д, J = 5,05 Гц), 2,58 (3H, с), 1,65 (6H, д, J = 6,82 Гц). Приклад 19. 6-Бром-8-ізопропіл-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он Me Br N HN Me N N O Me Me До розчину, що перемішується, 6-бром-8ізопропіл-4-метил-2-(метилсульфініл)піридо[2,3d]піримідин-7(8H)-ону (175 мг, 0,508 ммоль) в 1,4діоксані (2,5 мл) додавали метиламін (0,80 мл, 2,0 M в ТГФ, 1,6 ммоль). Суміш закривали і нагрівали при 110 C в мікрохвильовці протягом 15 хв. Розчинник упарювали і неочищений продукт промивали EtOAc/гексан одержуючи вказану в заголовку сполуку (158 мг, 76%). + НРМС: 311, 313 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,06 (1H, с), 5,556,19 (1H, м), 5,19-5,46 (1H, м), 3,07 (3H, д, J = 5,05 Гц), 2,52 (3H, с), 1,62 (6H, д, J = 6,32 Гц). Приклад 20. 6-Бром-8-ізопропіл-4-метил-2(метилсульфініл)піридо[2,3-d]піримідин-7(8H)-он Me Br N O S N N O Me Me Me При перемішуванні і охолодженні (-20 C), до розчину 6-бром-8-ізопропіл-4-метил-2-(метилтіо)піридо[2,3-d]піримідин-7(8H)-ону (380 мг, 1,16 ммоль) в CH2Cl2 (25 мл) додавали MCPBA (340 мг, 77%, 1,52 ммоль). Після перемішування при 30 хв (-20C - 0 C), суміш гасили насиченим водним NaHCO3, екстрагували EtOAc, сушили і упарювали. Неочищений продукт промивали EtOAc/гексан одержуючи вказану в заголовку сполуку (190 мг, 48%). + НРМС: 344, 346 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,78 (1H, с), 5,605,97 (1H, м), 2,92 (3H, с), 2,79 (3H, с), 1,56 (6H, д, J = 6,82 Гц). Приклад 21. 6-Бром-8-ізопропіл-4-метил-2 57 95113 58 (метилтіо)піридо[2,3-d]піримідин-7(8H)-он Me Me N S Me N N Me HN Me O Me До суспензії NaH (120 мг, 5,00 ммоль) в ДМФА (15 мл) додавали 6-бром-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-он (572 мг, 2 ммоль). Суміш нагрівали при 46 C. Розчин трохи охолоджували і додавали 2-йодпропан (0,30 мл, 3,0 ммоль). Суміш нагрівали при 46 C протягом 30 хв і потім охолоджували до кімнатної температури і розділяли між водою і етилацетатом. Органічну фазу сушили (MgSO4) і концентрували. Неочищений продукт очищали флеш хроматографією на силікагелі, використовуючи EtOAc/гексан, одержуючи вказану в заголовку сполуку (390 мг, 59%). + НРМС: 328, 330 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,60 (1H, с), 5,455,99 (1H, м), 2,64 (3H, с), 2,58 (3H, с), 1,54 (6H, д, J = 6,82 Гц). Приклад 22. 6-(5-(Амінометил)-2-фторфеніл)8-циклопентил-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он (Сполука 104) O При перемішуванні і охолодженні (-78 C) до розчину 6-бром-8-циклопентил-4-метил-2(метиламіно)-піридо[2,3-d]піримідин-7(8H)-ону (1,00 г, 2,94 ммоль) і триметилборату (1,40 мл, 12,6 ммоль) в ТГФ (60 мл) додавали BuLi (9,5 мл, 1,6 M, 15,2 ммоль). Після перемішування 20 хв, суміш гасили малою кількістю 2 N HCl і води, екстрагували EtOAc (3 рази), сушили і упарювали. Неочищену суміш очищали хроматографією на силікагелі одержуючи вказану в заголовку сполуку (157,2 мг, 18%). + НРМС: 303 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 8,58 (1H, с), 8,57 (1H, с), 8,36 (1H, с), 7,58-8,03 (1H, м), 5,64-6,14 (1H, м), 2,79-2,98 (3H, м), 2,52-2,62 (3H, м), 2,122,41 (2H, м), 1,87-2,12 (2H, м), 1,44-1,86 (4H, м). Приклад 24. 6-(6-Метоксипіридин-3-іл)-4метил-2-(метиламіно)піридо[2,3-d]піримідин-7(8H)он (Сполука 153) OMe Me N Me N H NH2 Me N N N N N H N F Me B(OH)2 N Br N O До розчину 8-циклопентил-4-метил-2(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-ілборної кислоти (30 мг, 0,099 ммоль), 3-бром-4-фторбензиламіну гідрохлориду ( 28,7 мг, 0,119 ммоль), карбонату калію (3 M, 0,10 мл) в DME (0,5 мл) і EtOH (0,5 мл) додавали тетракіс(трифенілфосфін)паладій (0) (6 мг, 0,005 ммоль). Суміш дегазували використовуючи N2, закривали і нагрівали 1 г при 100 C в мікрохвильовці. Суміш видаляли при пониженому тиску. Неочищений продукт очищали хроматографією одержуючи вказану в заголовку сполуку (16,4 мг, 43,3%). + НРМС: 382 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 7,73 (1H, с), 7,46 (1H, д, J = 6,06 Гц), 7,29-7,40 (1H, м), 7,07 (1H, т, J = 8,84 Гц), 6,14-6,73 (1H, м), 5,78-6,12 (1H, м), 3,844,11 (2H, м), 3,08 (3H, д, J = 4,80 Гц), 2,48-2,67 (4H, м), 2,32 (3H, д, J = 6,57 Гц), 1,91-2,06 (2H, м), 1,751,91 (2H, м), 1,51-1,72 (2H, м). Приклад 23. 8-Циклопентил-4-метил-2(метиламіно)-7-оксо-7,8-дигідропіридо[2,3d]піримідин-6-ілборна кислота N N H O До розчину 6-(6-метоксипіридин-3-іл)-4-метил2-(метилсульфініл)піридо[2,3-d]піримідин-7(8H)ону (147 мг, 0,445 ммоль) в 1,4-діоксані (2,5 мл) додавали метиламін (1,1 мл, 2,0 M в ТГФ, 2,2 ммоль). Суміш закривали і нагрівали при 110 C в мікрохвильовці 10 хв. Суміш концентрували при пониженому тиску одержуючи тверду речовину. Неочищену тверду речовину промивали водою і EtOAc, перекристалізували з ДМСО/EtOAc одержуючи вказану в заголовку сполуку (80 мг, 61%). + НРМС: 298 (M+H) . 1 H ЯМР (ДМСО-d6, 400 МГц): 11,68-12,05 (1H, м), 8,50 (1H, д, J = 1,77 Гц), 8,05 (1H, дд, J = 8,59, 2,53 Гц), 8,02 (1H, с), 7,23-7,71 (1H, м), 6,86 (1H, д, J = 8,59 Гц), 3,89 (3H, с), 2,86 (3H, д, J = 4,29 Гц), 2,54 (3H, с). Приклад 25. 6-(6-Метоксипіридин-3-іл)-4метил-2-(метиламіно)піридо[2,3-d]піримідин-7(8H)он OMe Me N N O S Me N N H O Згідно методиці описаній в Прикладі 20, використовуючи 6-(6-метоксипіридин-3-іл)-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-он замість 6-бром-8-ізопропіл-4-метил-2-(метилтіо)піридо[2,3-d]піримідин-7(8H)-он, вказану в заголовку сполуку використовували як неочищений продукт на наступній стадії. 59 95113 60 + НРМС: 331 (M+H) . Приклад 26. 6-(6-Метоксипіридин-3-іл)-4метил-2-(метилтіо)піридо[2,3-d]піримідин-7(8H)-он Me N O Me OMe Me N N O S Me N N O N Me S N N O H До розчину 6-бром-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-ону ( 50 мг, 0,17 ммоль), 6-метоксипіридин-3-ілборної кислоти (40,1 мг, 1,1 екв.), дихлорбіс(трифенілфосфін)тетракіс(трифенілфосфін)пал адій (II) (6,13 мг, 0,008 ммоль), ДМФА (2 мл) в 5 мл пляшечці для мікрохвильовки додавали карбонат калію (3 M, 1,1 екв.). Розчин дегазували використовуючи N2 10 хв і потім закривали і нагрівали в мікрохвильовому реакторі 1 г при 100 C. Реакцію виливали в 20 мл розсолу і осад збирали фільтруванням. Потім очищали хроматографією (80% етилацетат/гексан). Вказану в заголовку сполуку одержували як тверду речовину (30 мг, 55% вихід). НРМС: 315,0 (ЕС+) 1 H ЯМР (ДМСО-d6, 400 МГц): 12,54 (1H, с), 8,56 (1H, д, J = 2,27 Гц), 8,20 (1H, с), 8,10 (1H, дд, J = 8,72, 2,40 Гц), 6,90 (1H, д, J = 8,59 Гц), 3,90 (3H, с), 2,70 (3H, с), 2,57 (3H, с). Приклад 27. 8-Циклобутил-6-(6метоксипіридин-3-іл)-4-метил-2(метиламіно)піридо[2,3-d]піримідин-7(8H)-он (Сполука 109) OMe Me N N Me N N N O H Згідно методиці описаній в Прикладі 22, використовуючи 8-циклобутил-6-(6-метоксипіридин-3іл)-4-метил-2-(метилсульфініл)піридо[2,3d]піримідин-7(8H)-он замість 6-(6-метоксипіридин3-іл)-4-метил-2-(метилсульфініл)піридо[2,3d]піримідин-7(8H)-ону, одержували вказану в заголовку сполуку з 35% виходом. + НРМС: 352 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,31 (1H, д, J = 2,02 Гц), 7,98 (1H, дд, J = 8,72, 2,40 Гц), 7,71 (1H, с), 6,80 (1H, д, J = 8,59 Гц), 5,76-6,10 (1H, м), 5,41 (1H, с), 3,97 (1H, с), 3,18-3,44 (2H, м), 3,12 (3H, д, J = 5,05 Гц), 2,56 (3H, с), 2,24-2,46 (2H, м), 2,01 (1H, к, J = 10,36 Гц), 1,78-1,93 (1H, м). Приклад 28. 8-Циклобутил-6-(6метоксипіридин-3-іл)-4-метил-2(метилсульфініл)піридо[2,3-d]піримідин-7(8H)-он Згідно методиці описаній в Прикладі 24, використовуючи 8-циклобутил-6-(6-метоксипіридин-3іл)-4-метил-2-(метилтіо)піридо[2,3-d]піримідин7(8H)-он замість 6-бром-8-ізопропіл-4-метил-2(метилтіо)-піридо[2,3-d]піримідин-7(8H)-ону, вказану в заголовку сполуку використовували як неочищений продукт на наступній стадії. + НРМС: 385 (M+H) . Приклад 29. 8-Циклобутил-6-(6метоксипіридин-3-іл)-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-он OMe Me N N S Me N N O Згідно методиці описаній в Прикладі 12, використовуючи 6-бром-8-циклобутил-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-он замість 6-бром-8-циклопентил-2-(2-гідрокси-2метилпропіламіно)-4-метилпіридо[2,3-d]піримідин7(8H)-ону, одержували вказану в заголовку сполуку з 78% виходом. + НРМС: 369 (M+H) . 1 H ЯМР (CDCl3, 400 МГц): 8,35 (1H, д, J = 2,53 Гц), 7,99 (1H, дд, J = 8,59, 2,53 Гц), 7,79 (1H, с), 6,82 (1H, д, J = 8,59 Гц), 5,80-6,13 (1H, м), 3,98 (3H, с), 3,07-3,41 (2H, м), 2,69 (3H, с), 2,68 (3H, с), 2,292,52 (2H, м), 1,78-2,11 (2H, м). Приклад 30. 6-Бром-8-циклобутил-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-он (Сполука 100); 6-бром-7-циклобутокси-4-метил-2(метилтіо)піридо[2,3-d]піримідин (Сполука 99) Me Me Br Br N N S Me N N O S Me N N O 100 99 До розчину 6-бром-4-метил-2(метилтіо)піридо[2,3-d]піримідин-7(8H)-ону (500 мг, 1,75 ммоль) і циклобутанолу (164 мг, 2,27 ммоль) в ТГФ (40 мл) додавали трифенілфосфін (917 мг, 3,49 ммоль) і DEAD (852 мг, 4,89 ммоль). Через 2 г, суміш виливали в розсіл, екстрагували етилацетатом, сушили (безводний Na2SO4) і упарювали. Суміш очищали хроматографією одержуючи Сполуку 100 (97 мг, 16%) і Сполуку 99 (180 мг, 30%). + НРМС: 340, 342 (M+H) . Сполука 100: 1 H ЯМР (CDCl3, 400 МГц): 8,18 (1H, с), 5,78
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrido (2,3-d) pyrimidin0ne compounds and their use as pi3 inhibitors
Автори англійськоюCheng, Hengmiao, Bhumralkar, Dilip, Dress, Klaus, Ruprecht, Hoffman Jacqui Elizabeth, Johnson,Mary Catherine, Kania, Robert, Steven, Le, Phuong, Thi, Quy, Nambu, Mitchell, David, Pairish, Mason, Alan, Plewe, Michael, Bruno, Tran, Khanh, Tuan
Назва патенту російськоюПиридо[2,3-d]пиримидиноны и их применение как ингибиторов pi3
Автори російськоюЧенг Хенгмяо, Бхумралкар Дилип, Дресс Клаус Рупрехт, Хоффман Джакуи Элизабет, Джонсон Мери Кетрин, Каня Роберт Стивен, Ле Фуонг Ти Куй, Намбу Митчелл Девид, Периш Мейсон Алан, Плеве Михаэль Бруно, Тран Ханг Туан
МПК / Мітки
МПК: A61P 35/00, A61K 31/519, C07D 471/04
Мітки: інгібіторів, застосування, піридо[2,3-d]піримідинони
Код посилання
<a href="https://ua.patents.su/90-95113-pirido23-dpirimidinoni-i-kh-zastosuvannya-yak-ingibitoriv-pi3.html" target="_blank" rel="follow" title="База патентів України">Піридо[2,3-d]піримідинони і їх застосування як інгібіторів pі3</a>












