Портативний потенціометричний біосенсор для визначення концентрації сечової кислоти
Номер патенту: 103614
Опубліковано: 25.12.2015
Автори: Зінченко Олена Анатоліївна, Кукла Олександр Леонідович, Зінкіна Ольга Олексіївна, Солдаткін Олексій Петрович, Павлюченко Олексій Сергійович, Шкотова Людмила Василівна
Формула / Реферат
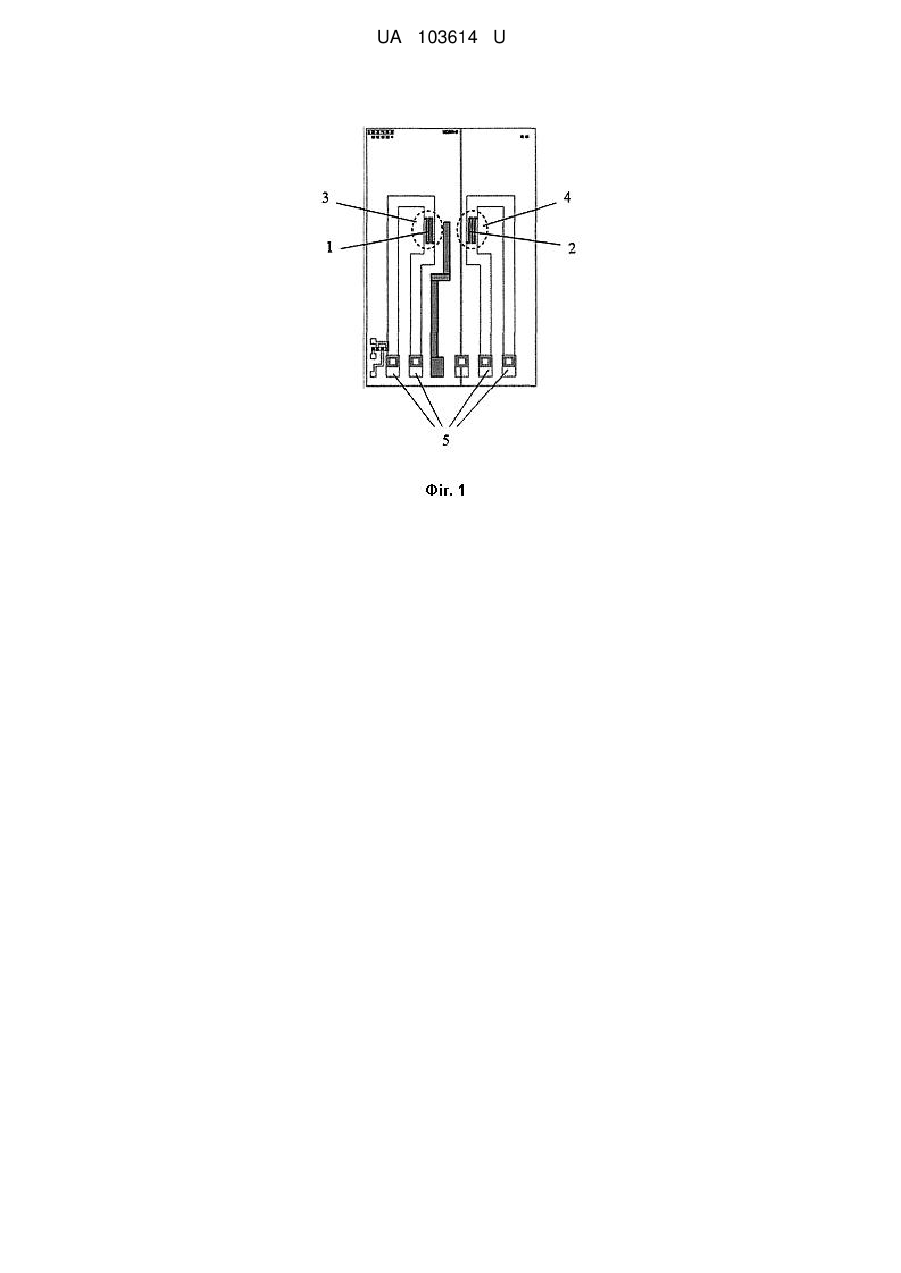
Портативний потенціометричний біосенсор для визначення концентрацій сечової кислоти, який відрізняється тим, що складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі ферменту урикази, яка селективна до сечової кислоти, а на другий нанесена референтна мембрана, вказаний біосенсор призначений для підключення до аналого-цифрового іонно-селективного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера.
Текст
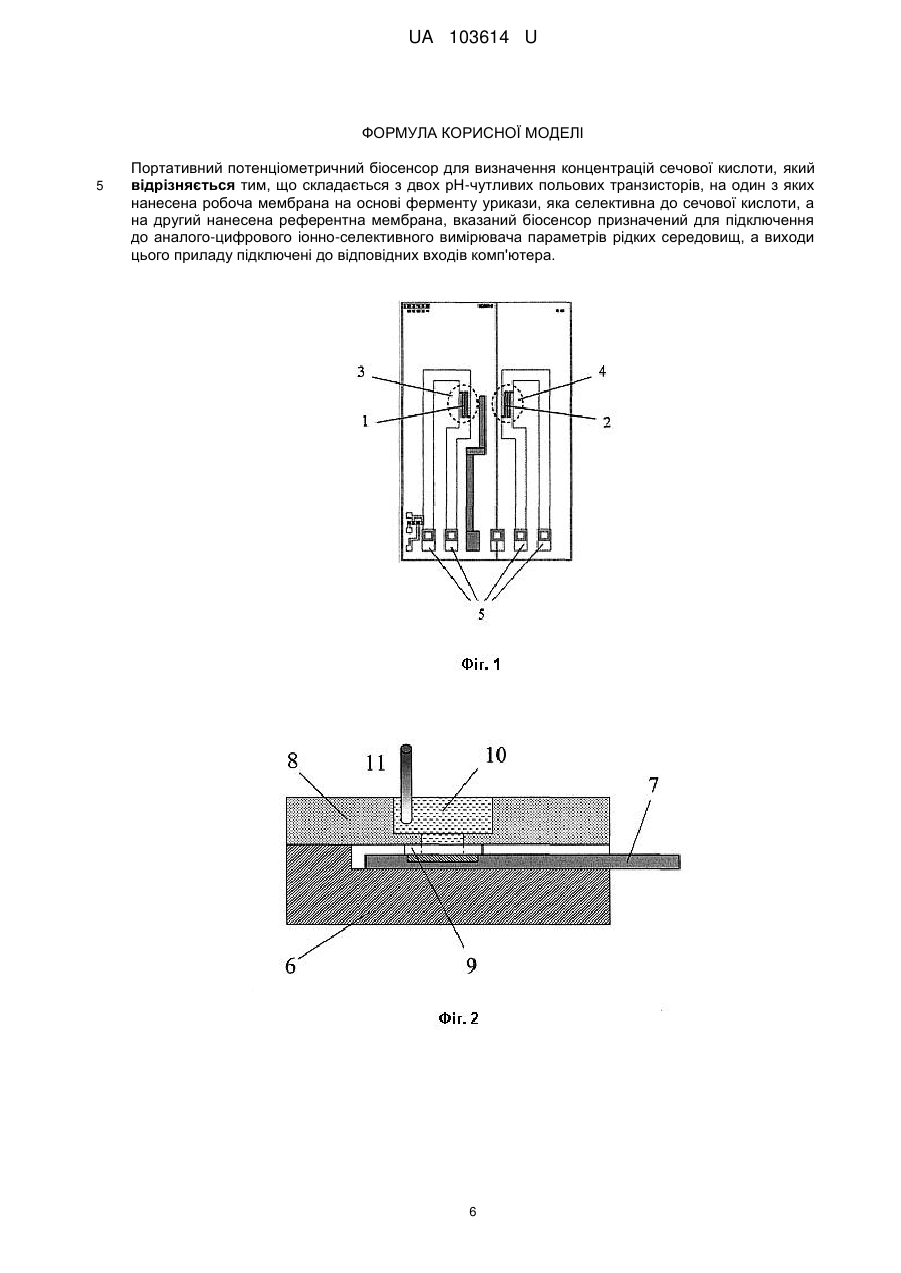
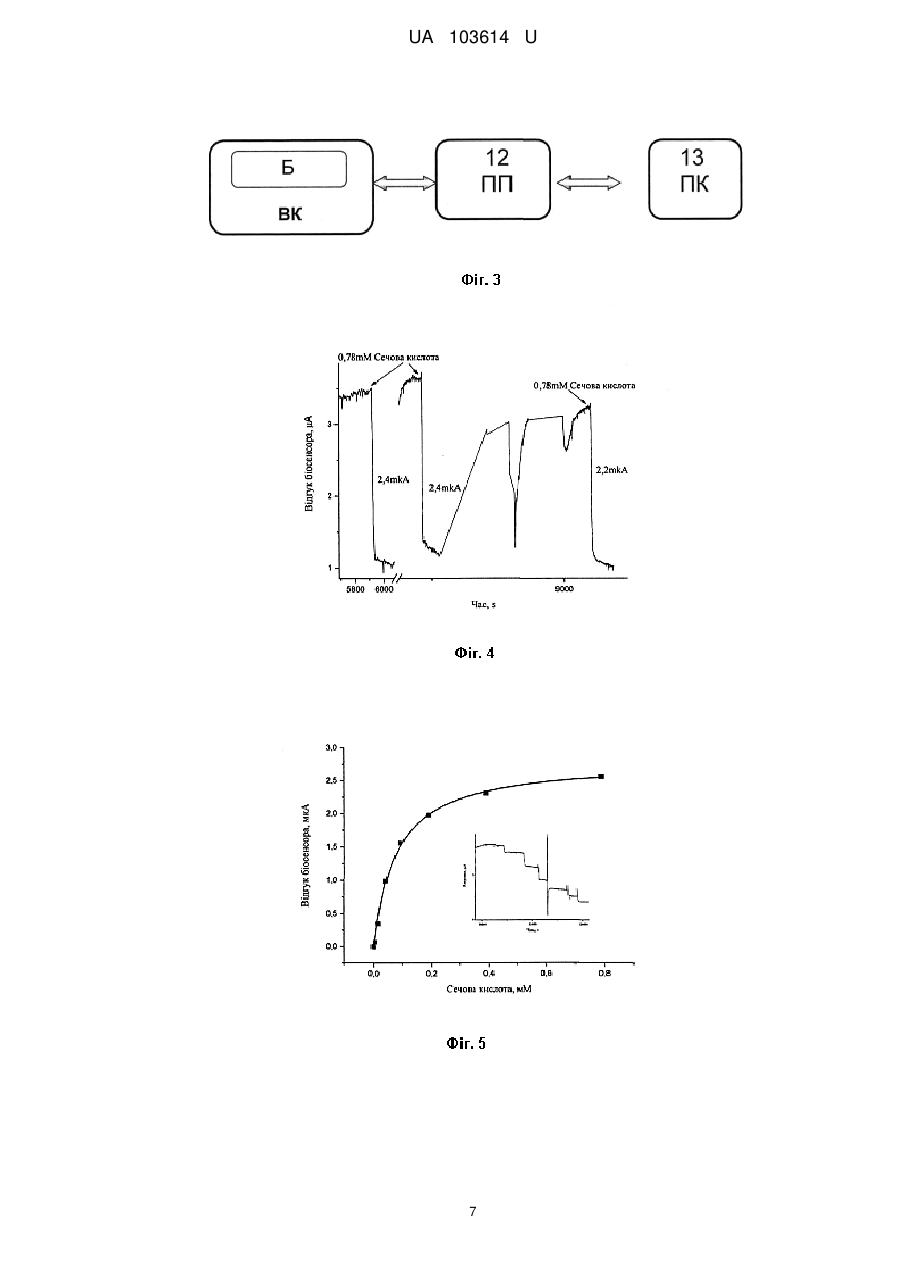
Реферат: Портативний потенціометричний біосенсор для визначення концентрацій сечової кислоти складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі ферменту урикази, яка селективна до сечової кислоти, а на другий нанесена референтна мембрана. Вказаний біосенсор призначений для підключення до аналого-цифрового іонно-селективного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. UA 103614 U (12) UA 103614 U UA 103614 U 5 10 15 20 25 30 35 40 45 50 55 60 Корисна модель належить до галузі біомедичних досліджень та охорони здоров'я і може бути використана для аналізу рідких середовищ організму, а саме до конструкцій аналітичного приладу - потенціометричного біосенсора на основі іон-селективного польового транзистора (ІСПТ) з рН-чутливим шаром для визначення сечової кислоти для діагностики та моніторингу деяких хвороб, а саме визначення вмісту сечової кислоти в досліджуваних зразках хворих в першу чергу на подагру та гіперурикемію, а більш конкретно, до портативного потенціометричного біосенсора для визначення концентрацій сечової кислоти. Для медицини інтерес до контролю сечової кислоти (СК) пов'язаний з тим, що сечова кислота є кінцевим продуктом деградації пуринів. Аденін та гуанін окислюються спочатку до гіпоксантину, який далі послідовно окислюється до ксантину та сечової кислоти під дією ксантиноксидази. У більшості ссавців СК далі окиснюється до алантоїну під дією уратоксидази. У людини та вищих приматів відсутня уратоксидаза, тому СК не піддається подальшим перетворенням і виводиться нирками та травною системою [1, 2, 3]. У медичній практиці відома низка захворювань, іноді дуже серйозних, які зачіпають обмін нуклеопротеїдів та пуринів. При таких порушеннях, як правило, значно підвищується вміст сечової кислоти у крові та, як наслідок, розвиток гіперурикемії та подагри. Крім цього, підвищення рівня СК пов'язане із захворюваннями нирок, синдрому Леша-Найяна, гіпертензією та захворюваннями серцевосудинної системи [2]. Гіперурикемія призводить до відкладення кристалів натрієвої солі СК у суглобах та навколо суглобових структурах, а також до утворення каменів СК у сечовивідних шляхах. Для чоловіків рівень СК при гіперурикемії становить від 7,0 мг/дл, для жінок - від 6,0 мг/дл. Концентрація СК при гіпоурикемії становить менше 2,0 мг/дл [4, 5]. Знижений рівень СК пов'язаний з такими неврологічними хворобами як розсіяний склероз, хвороба Паркінсона, хвороба Альцгеймера. Це обумовлене антиоксидантними властивостями СК [6, 7]. Нормальна концентрація СК в сироватці крові людини лежить в діапазоні від 240 до 520 мкМ та від 1,4 до 4,4 мМ у сечі [2]. За день утворюється 350 мг сечової кислоти ендогенно і 300 мг в день надходить у організм з їжею. Вміст СК у крові та сечі регулюється балансом утворення та екскреції СК. Підвищення рівня СК у сироватці крові обумовлене або посиленою генерацією СК (наприклад, споживання великої кількості алкоголю, синдром лізису пухлини (ускладнення після хіміотерапії раку і вживання продуктів з високим вмістом пуринів або білків), або - зниженням екскреції СК. Зниження швидкості клубочкової фільтрації збільшує вміст СК у сироватці крові, але це частково компенсується збільшенням екскреції у шлунково-кишковому тракті [4, 8]. Крім того, гіперурикемія може бути результатом підвищення канальцевої реабсорбції нирок. Після фільтрації СК зазнає реабсорбції та секреції у проксимальних канальцях нирок, цей процес забезпечується урат-аніонним транспортером та потенціалзалежним урат-селективним каналом. Органічні аніони, такі як лактат, зменшують екскрецію СК за рахунок конкуренції за проходження через транспортер. Гіпоурикемія, як правило, викликана послабленою реабсорбцією урату у нирках. З усього вище згаданого можна зробити висновок, що існує нагальна потреба у розробці методу для моніторингу концентрацій сечової кислоти у біологічних рідинах людини. Для визначення концентрацій сечової кислоти у біологічних рідинах людини при різних захворюваннях та терапії необхідні швидкі, прості, селективні методи визначення. Існуючі на сьогоднішній день методи визначення можна поділити на ензиматичні та неензиматичні. Для неензиматичного визначення СК застосовують спектрофотометричні, хроматографічні та електрохімічні методи. Для спектрофотометричного визначення СК застосовують різноманітні хромофори. Найпоширенішими з них є сполуки вольфраму синього кольору, які утворюються в результаті відновлення вольфрамофосфат-аніону. Проте у біологічних рідинах існують інші сполуки, які здійснюють аналогічне відновлення (наприклад, аскорбінова кислота), що зменшує точність визначення концентрації сечової кислоти [2, 10]. Більш чутливим методом є високоефективна рідинна хроматографія (ВЕРХ), яка дозволяє визначати одночасно сечову кислоту, ксантин та гіпоксантин [11]. Але цей метод є досить складним, потребує коштовного та складного обладнання. СК може бути легко окиснена на електродах у водному розчині, чим обумовлена низка електрохімічних неензиматичних методів визначення СК, найпопулярнішим з яких є вольтамперометрія. Розроблено різні вольтамперометричні методи із застосуванням модифікованих електродів: скловуглецевого електрода [12], вуглецевого електроду вкритого шаром нонтроніту [13], вуглецевого електрода, модифікованого полі(L-аргінін)/графеновою композитною плівкою [14], скловуглецевого електрода вкритого плівкою з бромкрезолового пурпурового [15]. Вони дозволяють селективно визначати СК, ксантин та гіпоксантин, але не розрізняють СК та аскорбінову кислоту (АК). Отже, основною проблемою при електрохімічному визначенні є інтерференція АК [8]. Для селективного вольтамперометричного одночасного визначення СК та АК розроблено 1 UA 103614 U 5 10 15 20 25 30 35 40 45 50 55 60 карбоновий електрод, модифікований нанокомпозитом з наночасток Pd та вуглецевих нанониток, для визначення СК, АК та катехоламінів - керамічний карбоновий електрод, виготовлений золь-гель методом [16]. Карбонові склоподібні електроди, оброблені частинками карбіду силіцію, дають можливість розділяти сигнали СК, АК, ксантину, гіпоксантину та дофаміну, а також підсилюють сигнал СК. Використання таких електродів дозволяє вольтамперометрично визначати наномолярні концентрації СК у суміші з іншими речовинами пуринового метаболізму [17]. Перелічені електроди дозволяють визначати концентрацію СК у межах від 0,05-10 мкмоль/л. Недоліки вольтамперометричного визначення полягають у інтерференції сигналів СК та аскорбінової кислоти, ксантину, гіпоксантину та інших компонентів біологічних рідин, а також у тому, що виготовлення модифікованих електродів є складним процесом. Всі сучасні ензиматичні методи визначення концентрації СК ґрунтуються на використанні ферменту урикази (уратоксидаза). Вони поділяються на прямі методи (визначення безпосередньо кількості СК) та непрямі (визначення продукту ензиматичної реакції - пероксиду водню). До прямих методів належить спектрофотометричний метод. СК має інтенсивний пік поглинання при 293 нм, а продукт ензиматичного окиснення СК (алантоїн) - не поглинає на цій довжині хвилі. Тому визначити концентрацію СК можна зі зменшення абсорбції при 293 нм в результаті окиснення. Цей метод дозволяє визначати концентрацію СК у присутності аскорбатіону та глутатіону, але існує проблема інтерференції ксантину при визначенні СК [18]. Непрямий метод базується на визначенні пероксиду водню, який можна здійснити двома способами: вимірювання поглинання хромофорів, які змінюють своє забарвлення при взаємодії з пероксидом водню, та електрохімічні методи, які реєструють електрохімічний відгук пероксиду водню (як правило, на електродах з іммобілізованою уриказою). Спектрофотометричні методи в свою чергу поділяються на два підтипи: з використанням каталази та з використанням пероксидази [19]. При використанні каталази спектрофотометрично реєструють зміну концентрації NADH, яка пропорційна концентрації СК [20, 21]. Пероксидаза каталізує окиснення різних речовин пероксидом водню. Косубстрат для пероксидази обирають таким чином, щоб продукт окиснення мав інтенсивне забарвлення або був люмінісцентним. Найчастіше використовують пероксидазу хріну (HRP), оскільки цей фермент є відносно дешевим та стабільним. Такі непрямі методи характеризуються значною чутливістю, а верхня межа лінійного діапазону досягає 1,2 мМ, проте ці методи також чутливі до більшості інтерферуючих речовин (АК, ксантин, глутатіон та каталітично активні іони перехідних металів) [19]. Отже, основною проблемою при визначенні концентрації СК є інтерференція інтермедіатів пуринового метаболізму та інших речовин, зокрема АК. Більшість існуючих ферментативних методів є специфічними і чутливими, але їх застосування для визначення СК обмежене низкою недоліків цих методів: нестійкістю ферментів при зберіганні та експлуатацї, складністю методики аналізу, високою вартістю обладнання і витратних матеріалів, складною процедурою пробопідготовки та, як зазначено вище, інтерференцією різноманітних речовин. Вирішення цих проблем полягає у створенні нових приладів - біосенсорів, які значно покращують та спрощують методику визначення концентрації СК. Зокрема, підбір правильного методу іммобілізації ферменту може підвищити експлуатаційну стабільність ферменту та його стабільність при зберіганні. Використання дуже малих кількостей ферменту та відсутність спеціального додаткового обладнання для визначення концентрації СК значно знижують вартість біосенсорів та значно спрощують методику визначення СК, оскільки не потребується додаткових знань та навичок. Створення ж зокрема потенціометричних біосенсорів дозволяє вирішити одну з головних проблем інтерференції, оскільки визначення СК потенціометричними біосенсорами не залежить від впливу будь-яких інтерферентів. Відомий потенціометричний рН-чутливий біосенсор на основі SnО2. Пероксид водню, що утворився в результаті ензиматичного окиснення СК, під дією каталази та фероценової кислоти відновлюється до води. Фероценова кислота в даному випадку є переносником електронів. Відновлення Н2О2 призводить до зменшення концентрації іонів водню, тобто зміна рН, яку реєструє біосенсор корелює з концентрацією СК. Останнім часом набувають поширення біосенсори на низьковимірних об'єктах (нанонитки, наночастинки). Наприклад, уриказа іммобілізована на нанонитці з оксиду цинку (II). Утворений в результаті уриказної реакції алантоїн акцептує протон з середовища, утворюється алантоїн-катіон, який в свою чергу може взаємодіяти з ZnO і змінювати потенціал на електроді [22]. Недоліками цього методу є складний процес іммобілізації ферменту та низька стабільність ферменту [23]. В основу корисної моделі поставлено задачу створення портативного потенціометричного біосенсора для визначення концентрації сечової кислоти, який би дозволив спростити процес 2 UA 103614 U 5 10 15 20 25 30 35 40 45 50 55 іммобілізації ферменту, без попередньої підготовки проби отримати більш високу точність вимірювання та селективність при визначенні концентрацій сечової кислоти. Поставлена задача вирішується запропонованим портативним потенціометричним біосенсором для визначення концентрацій сечової кислоти, який, згідно з корисною моделлю, складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі ферменту урикази, яка селективна до сечової кислоти, а на другий нанесена референтна мембрана, вказаний біосенсор призначений для підключення до аналогоцифрового іонно-селективного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. Використання в роботі рН-чутливих польових транзисторів (рН-ПТ), дозволило проводити аналіз біозразків без попередньої обробки проби. Використання портативного приладу дало можливість розробити портативний біосенсор. Крім того, потенціометричний біосенсор на основі урикази, іммобілізованої в насичених парах ГА, характеризується широким лінійним діапазоном роботи, що збільшує точність аналізу. Даний метод іммобілізації значно спрощує процес виготовлення біосенсора, оскільки ця процедура є простою, не потребує спеціальних умов проведення та характеризується малим часом, необхідним для іммобілізації. В основі роботи біосенсора для визначення концентрації сечової кислоти лежить ферментативна реакція, що протікає у ферментативній мембрані і реєструється рН-чутливими польовими транзисторами біосенсора: Сечова кислота + О2 + Н2О ⇒ Алантоїн + СО2 + Н2О2. В ході протікання реакції змінюється концентрація протонів (відповідно має місце локальна зміна рН розчину в мембранах). Це дозволяє використовувати рН-чутливі польові транзистори як перетворювачі. Суть корисної моделі пояснюється кресленнями, де показано: Фіг. 1 схематичний вигляд потенціометричного біосенсора для визначення концентрації сечової кислоти. Фіг. 2 конструкція вимірювальної кювети для ІСПТ-перетворювача. Фіг. 3 показано блок-схему портативного потенціометричного біосенсора для визначення концентрації сечової кислоти. Фіг. 4 показано відгуки потенціометричного біосенсора на додавання субстрату. Фіг. 5 наведено графік залежності величини відгуку портативного потенціометричного біосенсора для визначення концентрації сечової кислоти. Запропонований портативний потенціометричний біосенсор для визначення концентрації сечової кислоти складається з двох рН-чутливих польових транзисторів 1 та 2 (фіг. 1), на один з яких нанесено робочу мембрану 3 на основі ферменту уриказа, що є чутливою до сечової кислоти, на другий нанесено референтну мембрану (4), наприклад, з сироватковим альбуміном бика та контактних виводів 5; вимірювальної кювети (ВК) з буферним розчином (фіг. 2), що містить металеву основу 6, на яку встановлюється монтажна плата 7 з перетворювачем на основі ІСПТ з нанесеними мембранами, фторопластової кришки 8 з силоксановим ущільненням 9, пробоприймача 10 та електродом порівняння 11. Також система складається з потенціометричного приладу (ПП) 12 (фіг. 3), та персонального комп'ютера (ПК) 13 [24]. Перетворювач на основі ІСПТ (рН-чутливі польові транзистори) 1 та 2 з нанесеними ферментною - 3 та референтною - 4 мембранами змонтований на друкованій монтажній платі 7 та розташований у вимірювальній кюветі 6, за допомогою вихідних контактів 5 підключений до відповідних входів потенціометричного приладу 12, до якого також підключений електрод порівняння 11. Виходи приладу підключені до комп'ютера 13, який призначений для керування процесом вимірювання сигналів ІСПТ приладу та перерахунку отриманих даних у значення концентрацій сечової кислоти. Необхідна чутливість визначення сечової кислоти забезпечується застосуванням диференційного методу вимірювання та можливістю підключення до портативного потенціометричного приладу, розробленого та виготовленого в Інституті фізики напівпровідників ім. В.Є. Лашкарьова НАН України [24], що працює за схемою прямого вимірювання струму в каналі польового транзистора з активним навантаженням. До входу приладу підключається двохелементний потенціометричний ферментний біосенсор, а також електрод порівняння. Вихід приладу підключається до комп'ютера через послідовний порт. Застосування потенціометричного методу вимірювання з використанням пари диференційних рН-чутливих польових транзисторів та створення оптимальних умов для визначення сечової кислоти за рахунок використання ферменту уриказа в складі біосенсора дозволило проводити більш точну оцінку вмісту сечової кислоти у досліджуваному зразку 3 UA 103614 U 5 10 15 20 25 30 35 40 45 50 55 60 завдяки відсутності впливу інтерферуючих речовин аналізованих розчинів, що мали місце при визначенні сечової кислоти за допомогою існуючих амперметричних біосенсорів. Визначення сечової кислоти за допомогою рН-чутливих польових транзисторів базується на факті, що при розщепленні сечової кислоти продукуються алантоїн, діоксид вуглецю та пероксид водню. Завдяки присутності води алантоїн акцептує протон з води та перетворюється у алантоїн-іон, що супроводжується зсувом рН, що може чітко реєструватись ІСПТ. Потенціометричні перетворювачі з іммобілізованим ферментом уриказа детектують зсув рН біля підзатворного діелектрика, внаслідок ензиматичного гідролізу. Зсув рН, індукований вказаною реакцією, є пропорційним до концентрації субстрату - сечової кислоти в аналізованому розчині і реєструється відповідними ІСПТ з високою чутливістю і точністю. Запропонований портативний потенціометричний біосенсор для визначення концентрації сечової кислоти працює наступним чином. Виготовлення ферментної та референтної мембран на поверхні перетворювачів проводили наступним чином: готували суміш для ферментної мембрани - 10 мг ферменту уриказа та 10 мг сироваткового альбуміна бика (БСА) розчиняли у 100 мкл 20 мМ фосфатного буфера, рН 8,5 з додаванням 10 % гліцерину. Референтну мембрану готували додаванням до 20 мг БСА 100 мкл 20 мМ фосфатного буфера, рН 8,5 з додаванням 10 % гліцерину. Співвідношення компонентів біоселективної мембрани біосенсора було отримано експериментально. Його підібрали для покращення аналітичних характеристик біосенсора, таких як селективність, чутливість, операційна стабільність та ін. Потім проводили іммобілізацію: ферментні (3) та референтні (4) мембрани формували на зигзагоподібних областях затворів ІСПТ (1, 2) крапельним методом. Біосенсор з нанесеними розчинами розташовували у ексикаторі з насиченими парами глутарового альдегіду (ГА) на 15 хвилин. Після інкубації в парах ГА мембрани ретельно висушували на повітрі впродовж 15-20 хв. Вимірювання проводили за допомогою портативного вимірювального приладу, розробленого та виготовленого в Інституті фізики напівпровідників ім. В.Є. Лашкарьова НАН України [24], що працює по схемі прямого вимірювання струму в каналі польового транзистора з активним навантаженням. Чутливість приладу становила близько 25 мкА/рН. До входу приладу підключали двоелементний потенціометричний ферментний біосенсор, а також електрод порівняння. Вихід приладу підключали до комп'ютера через послідовний СОМ або USB порт. Біосенсор, заздалегідь під'єднаний до портативного потенціометричного приладу, поміщали до вимірювальної комірки 1,5 мл, заповненої 5 мМ боратним буфером, рН 8,5, та витримували 20 хвилин для отримання стабільних базових ліній. Потім додавали певну аліквоту концентрованого модельного розчину сечової кислоти, отримували сигнал біосенсора на основі урикази. Сигнали від біосенсора автоматично оброблялися комп'ютером і виводилися у графічному вигляді. Графічне зображення відгуків біосенсорної системи на додавання сечової кислоти наведено на фіг. 3. Приклад аналізу вмісту сечової кислоти в розчині. Визначення концентрації сечової кислоти проводили в 5 мМ боратному буферному розчині, рН 8,5 за кімнатної температури. Використовувалась робоча комірка відкритого типу об'ємом 1,5 мл з інтенсивним перемішуванням. Перед початком роботи датчики з іммобілізованими мембранами деякий час (приблизно 20 хв.) відмивали від надлишків незв'язаного ГА до стабілізації базової лінії. Концентрацію субстратів змінювали, додаючи певні аліквоти вихідного концентрованого розчину сечової кислоти. Після отримання кожного відгуку біосенсор відмивали від продукту, змінюючи робочий буфер мінімум тричі кожні 2 хв. Шляхом додавання різної кількості модельного розчину сечової кислоти було побудовано калібрувальні криві для визначення концентрацій сечової кислоти. Таким чином, отримана калібрувальна крива демонструє, що запропонований ферментний біосенсор для визначення сечової кислоти є функціонально придатним і дозволяє одержувати більш точні результати із визначення сечової кислоти у досліджуваних зразках у порівнянні з відомими пристроями. Джерела інформації: 1. К. L Rock., Η. Kataoka., J. J. Lai, Uric acid as a danger signal in gout and its comorbidities // National Review Rheumatol. - 2013. - Vol. 9. - P. 13-23. 2. P. Ε Erden, E. Kilic, A review of enzymatic uric acid biosensors based on amperometric detection // Talanta-2013. - Vol. 107. - P. 312-323. 3. E. Oksanen, M. P. Blakeley, M. El-Hajji, U. Ryde, M. Budayova-Spano, the neutron structure of urate oxidase // Plos One-2014. - Vol. 9. - P. 1-10. 4. R.J. Johnson, J. J. Richard, D. Kang, D. Feig, S. Kivlighn, J. Kanellis, S. Watanabe, R. T. Katherine, B. Rodriguez-Iturbe, J. Herrera-Acosta, M. Mazzali. Is there a pathogenetic role for uric 4 UA 103614 U 5 10 15 20 25 30 35 40 45 50 55 60 acid in hypertension and cardiovascular and renal disease? // Hypertension. - 2003. - Vol. 41. - P. 1183-1190. 5. M. Kanbay, M. Segal, B. Afsar, D.-H. Kang, B. Rodriguez-Iturbe, R. J Johnson, The role of UA in the pathogenesis of human cardiovascular disease // Heart. - 2013. - Vol. 99. - P. 759-766. 6. D. Lakshmi, M. J. Whitcombe, F. Davis, P. S. Sharma, В. В. Prasad, Electrochemical detection of uric acid in mixed and clinical samples: a review // Electroanalysis. - 2011. - Vol. 23. - P. 305-320. 7. D. Dinour, N. K. Gray, S. Campbell, X. Shu, L. Sawyer, W. Richardson, G. Rechavi, N. Amariglio, L. Ganon, B.-A. Sela, H. Bahat, M. Goldman, J. Weissgarten, M. R. Millar, A. F. Wright, E. J. Holtzman, Homozygous SLC2A9 mutations cause severe renal hypouricemia // Journal of the American Society of Nephrology. - 2010. - Vol. 21. - P. 64-72. 8. M.R. Sherman, M.G.P. Saifer, F. Perez-Ruiz, PEG-uricase in the management of treatmentresistant gout and hyperuricemia // Advanced Drug Delivery Reviews. - 2008. - Vol. 60. - P. 59-68. 9. T. Chiba, H. Matsuo, S. Nagamori, A. Nakayama, Y. Kawamura, S. Shimizu, M. Sakiyama, M. Hosoyamada, S. Kawai, R. Okada, N. Hamajima, Y. Kanai, N. Shinomiya, Identification of a hypouricemia patient with SLC2A9 R380W, a pathogenic mutation for renal hypouricemia type 2 // Nucleosides, Nucleotides and Nucleic Acids. - 2014. - Vol. 33. - P. 261-265. 10. J. Galban, Υ Andreu, M.J. Almenara, S. de Marcos, J. R. Castillo, Direct determination of uric acid in serum by a fluorometric-enzymatic method based on uricase // Talanta. - 2001. - Vol. 54..p. 547-854. 11. J. Perello, P. Sanchis, F. Grases, Determination of uric acid in urine, saliva and calcium oxalate renal calculi by high-performance liquid chromatography/mass spectrometry // Journal of Chromotography B. - 2005. - Vol. 824. - P. 175-180. 12. Т. Yao, Y. Taniguchi, T. Wasa, S. Musha, Anodic voltammetry and its analytical application to the detection and simultaneous determination of hypoxanthine, xanthine, and uric acid // Bulletin of the Chemical Society of Japan. - 1978. - Vol. 51. - P. 2937-2941. 13. J.-M. Zen, Y.-Y. Lai, H.-H. Yang, A. S. Kumar, Multianalyte sensor for the simultaneous determination of hypoxanthine, xanthine and uric acid based on a preanodized nontronite-coated screen-printed electrode // Sensors and Actuators B. - 2002. - Vol. 84. - P. 237-244. 14. F. Zhang, Z. Wang, Y. Zhang, Z. Zheng, С Wang, Y. Du, W. Ye, Simultaneous electrochemical determination of uric acid, xanthine and hypoxanthine based on poly (1arginine)/graphene composite film modified electrode // Talanta. - 2012. - Vol. 93. - P. 320-325. 15. Y. Wang, L.-L. Tong, Electrochemical sensor for simultaneous determination of uric acid, xanthine and hypoxanthine based on poly (bromocresol purple) modified glassy carbon electrode // Sensors and Actuators B. - 2010. - Vol. 150. - P. 43-49. 16. A. Salimi, H. MamKhezri, R. Hallaj, Simultaneous determination of ascorbic acid, uric acid and neurotransmitters with a carbon ceramic electrode prepared by sol-gel technique // Talanta. - 2006. Vol. 70. - P. 823-832. 17. S. Hason, V. Vetted, F. Jelen, M. Fojta, Improved sensitivity and selectivity of uric acid voltammetric sensing with mechanically grinded carbon/graphite electrodes // Electrochimica Acta. 2009. - Vol. 54. - P. 1864-1873. 18. P. H. Duncan, N. Gochman, T. Cooper, E. Smith, D. Bayse, A candidate reference method for uric acid in serum. I. Optimization and evaluation // Clinical Chemistry. - 1982. - Vol. 28. - P. 284-290. 19. Y. Zhao, X. Yang, W. Lu, H. Liao, F. Liao, Uricase based methods for determination of uric acid in serum // Microchim Acta. - 2009. - Vol. 164. - P. 1-6. 20. Y. Kayamori, Y. Katayama, T. Matsuyama, T. Urata, enzymatic method for assaying uric acid in serum with a new tetrazolium salt produces water-soluble formazan dye // Clinical Biochemistry. 1997. - Vol. 30. - P. 595-599. 21. Y. Kayamori, Y. Kikatayama, A sensitive determination of uric acid in serum using uricase/catalase/formaldehyde dehydrogenase coupled with formate dehydrogenase // Clinical Biochemistry. - 1994. - Vol. 27. - P. 93-97. 22. S. M. U. Ali, N.H. Alvi, Z. Ibupoto, O. Nur, M. Willander, B. Danielsson, Selective potentiometric determination of uric acid with uricase immobilized on ZnO nanowires // Sensors and Actuators. - 2011. - Vol. 152. - P. 241-247. 23. R. Rawal, S. Chawla, N. Chauhan, T. Dahiya, C.S. Pundir, Construction of amperometric uric acid biosensor based on uricase immobilized on PBNPs/cMWCNT/PANI/Au composite // International Journal of Biological Macromolecules. - 2012. - Vol. 50. - P. 112-118. 24. Кукла О.Л., Павлюченко О.С., Бушма О.В., Голтвянський Ю.В., Дзядевич СВ., Солдаткін О.П. Патент України на корисну модель "Аналого-цифровий іонно-сенсорний вимірювач параметрів рідких середовищ", UA № 48359 МПК G01N 27/26, 27/27, заявл. 26.10.2009, опубл. 10.03.2010, Бюл. № 5. 5 UA 103614 U ФОРМУЛА КОРИСНОЇ МОДЕЛІ 5 Портативний потенціометричний біосенсор для визначення концентрацій сечової кислоти, який відрізняється тим, що складається з двох рН-чутливих польових транзисторів, на один з яких нанесена робоча мембрана на основі ферменту урикази, яка селективна до сечової кислоти, а на другий нанесена референтна мембрана, вказаний біосенсор призначений для підключення до аналого-цифрового іонно-селективного вимірювача параметрів рідких середовищ, а виходи цього приладу підключені до відповідних входів комп'ютера. 6 UA 103614 U 7 UA 103614 U Комп’ютерна верстка О. Гергіль Державна служба інтелектуальної власності України, вул. Василя Липківського, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут інтелектуальної власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
МПК / Мітки
МПК: G01N 33/48, G01N 27/00
Мітки: кислоти, біосенсор, сечової, портативний, потенціометричний, визначення, концентрації
Код посилання
<a href="https://ua.patents.su/10-103614-portativnijj-potenciometrichnijj-biosensor-dlya-viznachennya-koncentraci-sechovo-kisloti.html" target="_blank" rel="follow" title="База патентів України">Портативний потенціометричний біосенсор для визначення концентрації сечової кислоти</a>
Попередній патент: Опалювальний пристрій
Наступний патент: Пристрій для розрізання
Випадковий патент: Пристрій для стимуляції м'язової тканини за допомогою хвиль двофазної форми