Потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах
Номер патенту: 101077
Опубліковано: 25.08.2015
Автори: Дзядевич Сергій Вікторович, Буржу Аката Курч, Солдаткін Олексій Петрович, Солдаткін Олександр Олексійович, Марченко Світлана Володимирівна, Салих Канн Кірдесілер, Берна Озансой Касап
Формула / Реферат
Потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах, що складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, який відрізняється тим, що на перший транзистор нанесено першу мембрану на основі силікаліту, на яку далі нанесено другу ферментну мембрану на основі рекомбінантної уреази, що є чутливою до сечовини, на другий транзистор також нанесено першу мембрану на основі силікаліту та другу референтну мембрану, а вказаний біосенсор призначений для підключення до приладу для потенціометричних вимірювань, а виходи цього приладу підключені до відповідних входів комп'ютера.
Текст
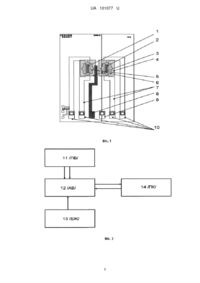
Реферат: Потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах, що складається з потенціометричного датчика на основі двох рНчутливих польових транзисторів, причому на перший транзистор нанесено першу мембрану на основі силікаліту, на яку далі нанесено другу ферментну мембрану на основі рекомбінантної уреази, що є чутливою до сечовини, на другий транзистор також нанесено першу мембрану на основі силікаліту та другу референтну мембрану, а вказаний біосенсор призначений для підключення до приладу для потенціометричних вимірювань, а виходи цього приладу підключені до відповідних входів комп'ютера. UA 101077 U (12) UA 101077 U UA 101077 U 5 10 15 20 25 30 35 40 45 50 55 Пропонована корисна модель належить до галузі медицини та охорони здоров'я, і може бути використана з метою контролю процедури очищення крові від токсинів (гемодіаліз) [1], а саме для визначення концентрації сечовини, а більш конкретно до потенціометричного біосенсора на основі рекомбінантної уреази для визначення концентрацій сечовини у водних розчинах. Сечовина належить до одного з кінцевих продуктів білкового обміну [2]. Вона формує основну частину залишкового азоту сироватки крові. Загальноприйнятим є положення, що сечовина малотоксична сполука, більше того, вона використовується нирками для підтримання осмотичного діурезу, а в лейкоцитах виконує роль бактерицидного агента. Однак, надлишкове накопичення карбаміду як компонента продукційної, чи ретенційної гіперазотемії вносить свій вклад в патогенез багатьох станів, що супроводжуються уремією (гостра і хронічна ниркова недостатність, печінкова недостатність, гепаторенальний синдром, спадкові гіперазотемії) [3-5]. Сечовина виконує роль важливого маркера при встановленні діагнозу гострої чи хронічної форм ниркової недостатності, а також використовується для контролю перебігу даної патології [6]. На сьогоднішній день біохімічний тест на рівень сечовини в крові є одним з найважливіших в клінічній лабораторній діагностиці. Сучасні запропоновані методи аналізу концентрації сечовини є певною мірою недосконалі, наприклад це стосується спектрофотометричного аналізу на основі діацетилмонооксимної реакції [7]. Основним недоліком даного методу є світлочутливість комплексу і швидке зниження забарвлення, а також висока токсичність реактивів для проведення даної реакції. Крім того, в реакцію з діацетилмонооксимом з утворенням забарвлених комплексів вступають також похідні сечовини, що знижують селективність визначення аналіту. Більш чутливі методи ґрунтуються на використанні ферменту уреаза, проте потребують додаткових індикаторних реакцій, що деякою мірою ускладнюють аналіз та роблять його більш дорогим [8-12]. Інша частина методів пов'язана з біосенсорним напрямом розвитку. Варто зазначити, що всі біосенсори, які розроблені на основі уреази з бобів сої характеризуються вузьким лінійним діапазоном визначення сечовини [13-14]. Дана умова є значною перешкодою при кількісному аналізі сечовини в сироватці крові хворих на ниркову недостатність при мінімальному розведенні або ж визначенні в цільній крові. Для подолання даного недоліку запропоновано при розробці уреазних біосенсорів використовувати замість звичайної уреази з бобів сої рекомбінантну з Е.соіі, оскільки рекомбінантний фермент має Км 200 мМ, а розроблений на основі вище зазначеного ензиму біосенсор характеризується розширеним лінійним діапазоном визначення до 20 мМ. Відома розробка потенціометричних біосенсорів на основі рН-чутливих польових транзисторів та рекомбінантної уреази [15-17]. Для розробки даного типу біосенсорів було використано фотополімер PVA/SbQ, який полімеризується та захоплює ензим в сітку, формуючи робочу біоселективну мембрану лише при дії жорсткого ультрафіолетового випромінення. Як відомо, ультрафіолетові промені досить негативно впливають на сітківку ока людини. Тим паче, фотополімер PVA/SbQ має нетривалий термін зберігання, що робить його не зовсім вдалим іммобілізуючим агентом. Крім того, з використанням даного типу іммобілізації отримані біосенсори також характеризуються не найкращою чутливістю та швидкістю сигналу (1-2 хв.) з лінійним діапазоном визначення сечовини -0,1-10мМ. В основу запропонованої корисної моделі поставлено задачу створення такого потенціометричного біосенсора на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах, який би характеризувався кращою чутливістю до сечовини (лінійний діапазон визначення сечовини - 0,05-15 мМ) та був більш перспективним і дешевим для подальшого масового виробництва. Поставлена задача вирішується запропонованим потенціометричним біосенсором на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах, що складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, а відповідно до пропозиції, на перший транзистор нанесено першу мембрану на основі силікаліту, на яку далі нанесено другу ферментну мембрану на основі рекомбінантної уреази, що є чутливою до сечовини, на другий транзистор також нанесено першу мембрану на основі силікаліту та другу референтну мембрану, а вказаний біосенсор призначений для підключення до приладу для потенціометричних вимірювань, а виходи цього приладу підключені до відповідних входів комп'ютера. Поставлена задача вирішується за рахунок безпечної, простої та швидкої процедури іммобілізації, на основі адсорбції рекомбінантної уреази на поверхні силікалітної мемебрани. Суть пропонованої корисної моделі пояснюється кресленнями, де 1 UA 101077 U 5 10 15 20 25 30 35 40 45 50 55 на фіг. 1 схематично представлено пропонований ферментний біосенсор на основі рН-ПТ для визначення концентрації сечовини у водних розчинах; на фіг. 2 показано блок-схему портативної потенціометричної біосенсорної системи для визначення концентрації сечовини; на фіг. 3 наведено калібрувальні графіки залежності величини відгуків біосенсорів на основі рекомбінантної уреази адсорбованої на силікаліті та іммобілізованої в фотополімері PVA/SbQ від концентрації сечовини; на фіг. 4 продемонстровано таблицю порівняння основних робочих характеристик біосенсорів на основі рекомбінантної уреази адсорбованої на силікаліті та іммобілізованої в фотополімері PVA/SbQ. Прилад для потенціометричних вимірювань, розроблений та виготовлений в Інституті фізики напівпровідників ім. В.Є. Лашкарьова НАН України [18]. В основі роботи потенціометричниого біосенсора на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах лежить наступна ферментативна реакція [19]: Рекомбінантна уреаза + + NH2CONH2 + Н + 2Н2О 2NH4 +HCO3 В процесі проходження ферментативної реакції рекомбінантна уреаза розщеплює сечовину при цьому змінюється концентрація протонів у ферментній мембрані, відповідно, відбувається зміна рН, яку і можна реєструвати за допомогою рН-чутливого польового транзистора. Пропонований потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах (Фіг.1) складається з двох рН-ПТ (зигзагоподібні області затворів) - 1, 2, на які спочатку наносяться перші ідентичні мембрани на основі силікаліту - 3 та 4, відповідно. Далі на перший транзистор (1) з мембраною на основі силікаліту (3) наносять другу робочу мембрану з рекомбінантної уреази селективної до сечовини (5), а на другий транзистор (2) з першою мембраною на основі силікаліту (4) наносять другу референтну мембрану з сироваткового альбуміну бика (6). Зигзагоподібна геометрія затворних областей транзисторів має відношення довжини каналу до його ширини рівним 100, + що забезпечує достатній рівень крутизни перехідної характеристики. р -дифузійні шини (7) з контактами до стоку і витоку кожного з транзисторів виведені на край чипу, як і виводи до вбудованих мікроелектродів порівняння - 8. В центрі транзисторів розташовані контакти до nпідкладок - 9. Алюмінієві контактні площини до усіх транзисторних виходів, виведені на край кожного з чипів - 10. Вказаний потенціометричний біосенсор 11 /ПБ/ (Фіг. 2) підключений до відповідних входів портативного потенціометричного приладу 12 /ПП/. Виходи приладу 12 /ПП/ підключені до відповідних входів блоку живлення 13 /БЖ/ та комп'ютера 14 /ПК/. Пропонований потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах працює наступним чином. Попередньо виготовляли біоселективні мембрани. Для створення гелю для першої мембрани готували розчин з вмістом 10 % силікаліту у 5 мМ калій-фосфатному буфері рН 7,4. Отриманий розчин силікаліту поміщали в ультразвукову баню на дві години для гомогенізації розчину. Далі, на робочі поверхні обох рН-чутливих польових транзисторів, наносили 0,2 мкл гомогенного розчину силікаліту. Для фіксації силікаліту на поверхні транзисторів, датчик розміщували у сухо-жаровій шафі на 20-25 хв. за температури 80-100 °C. Для створення гелю для другої ферментної мембрани готували розчин з вмістом 10 % рекомбінантної уреази, 10 % БСА, 10 % гліцерину у 20 мМ фосфатному буфері, рН 7,4. До складу гелів додавався гліцерин для стабілізації ферменту при іммобілізації та запобігання передчасному підсиханню розчину, нанесеного на поверхню перетворювача. В свою чергу, сироватковий альбумін бика в складі ферментних мембран відігравав роль стабілізуючого агента для ферментів. Гель для створення другої референтної мембрани готувався з вмістом 20 % БСА, 10 % гліцерину у 20 мМ фосфатному буфері, рН 7,4. Далі приготовлені ферментний та референтниий гелі наносили на поверхню транзисторів, вкритих першими мембранами на основі силікаліту (по 0,2 мкл робочого та реферетного) і залишали на відкритому повітрі на 15-20 хв до повного висихання. Таким чином, біоселективна мембрана біосенсора, нанесена на робочу область першого рН-чутливого польового транзистора складалась з 20 мМ фосфатного буфера, рН 7,4, та з наступних інгредієнтів у такому їх співвідношенні (у мас. %): 4-15 силікаліт, 3-11 рекомбінантної уреази, 3-11 БСА, 5-15 гліцерин. 2 UA 101077 U 5 10 15 20 25 30 35 40 45 50 55 Ідентична референтна мембрана наносилась на робочі області обох біосенсорів, і складалась з 20 мМ фосфатного буфера, рН 7,4 та з наступних інгредієнтів у такому їх співвідношенні (у мас. %): 2-10 силікаліт, 10-30 БСА, 5-15 гліцерин. Співвідношення компонентів біоселективних мембран біосенсорної системи було отримано експериментально. Його підібрали для покращення аналітичних характеристик біосенсорів, таких як час відгуку, селективність, чутливість, операційна стабільність та ін. Після процесу іммобілізації біосенсори висушували 15 хв. на повітрі за кімнатної температури. Перед початком роботи, для видалення надлишку незв'язаних силікаліту, ферменту та інших компонентів мембран, біосенсори відмивали протягом 20 хв. у буфері, в якому і проводили подальші досліди. Приклад аналізу вмісту сечовини в розчині. Біосенсор заздалегідь під'єднаний до приладу для потенціометричних вимірювань поміщали до вимірювальної комірки 1,5 мл, заповненої 5 мМ фосфатним буфером, рН 7,4, та витримували декілька хвилин для отримання стабільної базової лінії. Потім додавали певну аліквоту модельного розчину сечовини, отримували сигнал. Сигнал від біосенсора автоматично оброблявся комп'ютером і виводився у графічному вигляді на екран монітора. Шляхом додавання різної кількості певних аліквот модельних розчинів сечовини було побудовано калібрувальну криву для визначення концентрації сечовини (Фіг.3) та встановлено лінійні діапазони визначення сечовини. Після отримання кожного відгуку біосенсор відмивали від продукту, змінюючи робочий буфер мінімум 3 рази кожні 15-30 с, до виходу сигналу на базову лінію. Лінійний діапазон визначення сечовини становив -0,05-15 мМ, що є ширшим ніж у найбільш близького за технічною суттю біосенсора з діапазоном визначення сечовини 0,1-10 мМ. Визначення концентрації сечовини в аналізованих зразках діалізату та крові здійснювали за калібрувальною кривою. Спочатку додавали аліквоту проби до вимірювальної комірки, та отримували відгук біосенсора. Далі за калібрувальною кривою вираховували концентрацію сечовини в невідомій пробі. Основні робочі характеристики запропонованого потенціометричного біосенсора на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах та найбільш близького до нього за технічною суттю біосенсора на основі рекомбінантної уреази іммобілізованої в фотополімері PVA/SbQ дуже відрізнялись (Фіг.4). Наприклад, час відгуку запропонованого потенціометричного біосенсора на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах складав - 3060 с, що щонайменше в два рази швидше, ніж у біосенсорі на основі фермента, іммобілізованого в фотополімері PVA/SbQ. Також, запропонований біосенсор характеризувався ширшим лінійним діапазоном, кращою чутливістю до субстрату. Визначення сечовини запропонованим потенціометричним біосенсором на основі рекомбінантної уреази для визначення концентрацій сечовини у водних розчинах, дозволило проводити більш швидкий та точний аналіз біозразків, а сам біосенсор став більш перспективним для подальшого виробництва, за рахунок відмови в процесі іммобілізації від шкідливого УФ випромінювання. В іншу чергу, застосування при створенні біосенсору методу адсорбції рекомбінантної уреази на силікаліті розширило лінійний діапазон визначення сечовини. Джерела інформації:: 1. J. Himmelfarb, Т.A. Ikizler, Hemodialysis // The New England Journal of Medicine-2010.-Vol. 363.-P. 1833-1845. 2. U.B. Trivedi, D. Lakshminarayana, I.L. Kothari et al., Potentiometric biosensor for urea determination in milk // Sensors and Actuators B: Chemical. - 2009. - Vol. 140. - P. 260-266. 3. D. Chirizzi, С Malitesta, Potentiometric urea biosensor based on urease immobilized by an electrosynthesized poly(o-phenylenediamine) film with buffering capability // Sensors and Actuators B: Chemical. -2011. -Vol. 157. -P. 211-215. 4. M. Tyagi, M. Tomar, V. Gupta, NiO nanoparticle-based urea biosensor // Biosensors and Bioelectronics. - 2013. - Vol. 41. - P. 110-115. 5. G. Sumana, M. Das, S. Srivastava, B.D. Malhotra, A novel urea biosensor based on zirconia // Thin Solid Films. - 2010. - Vol. 519. - P. 1187-1191. 6. M. Swati, N.K. Hase, R. Srivastava, Nanoengineered optical urea biosensor for estimating hemodialysis parameters in spent dialysate // Analytica Chimica Acta. - 2010. - Vol. 676. -P. 68-74. 3 UA 101077 U 5 10 15 20 25 30 7. W.R. Fearon, The carbamide diacetyl reaction: a test for citrulline / W.R. Fearon // Biochemical Journal-1939. - Vol. 33. - P. 902-907. 8. E. Gyorgy, F. Sima, I.N. Mihailescu, Biomolecular urease thin films grown by laser techniques for blood diagnostic application // Materials Science and Engineering С -2010.-Vol. 30.-P. 537-541. 9. F. Lespinas, G. Dupuy, F. Revol et al., Enzyme urea assay: A new colorimetric method based on hydrogen peroxide measurement // Clinical Chemistry. - 1989. - Vol. 35. - № 4.-P. 654-658. 10. Y. Morishita, K. Nakane, T. Fukatsu et al., Kinetic assay of serum and urine for urea with use of urease and leucine dehydrogenas // Clinical Chemistry. - 1997. - Vol. 43.- № 10. -P. 1932-1936. 11. Y. Gourmelin, B. Gouget, A. Truchaud Electrode measurement of glucose and urea in undiluted samples // Clinical Chemistry. - 1990. - Vol. 36.- № 9. - P. 1646-1649. 12. Т. Mockel, D. Morrison, R. Yatscoff, Evaluation of the i-STAT™ system: a portable chemistry analyser for the measurement of sodium, potassium, chloride, urea, glucose, and hematocrit // Clinical Biochemistry. - 1995. - Vol. 28. - P. 187-192. 13. O.L. Kukla, S.V. Marchenko, O.A. Zinchenko et al., Biosensor measurement of urea concentration in human blood serum // World Academy of Science, Engineering and Technology. 2012. - Vol. 68. - P. 147-151. 14. O.O. Soldatkin, I.S. Kucherenko, S.V. Marchenko et al., Application of enzyme/zeolite sensor for urea analysis in serum // Material Science and Engineering С - 2014. - Vol. 42.-P. 155-160. 15. A.P. Soldatkin, J. Montoriol, W. Sant et al., A novel urea sensitive biosensor with extended dynamic range based on recombinant urease and ISFETs // Biosensors and Bioelectronics. - 2003. Vol. 19.-P. 131-135. 16. СВ. Марченко, О.П. Солдаткін, Потенціометричний біосенсор на основі рекомбінантної уреази для контролю вмісту сечовини в реальних біологічних зразках // Сенсорна електроніка і мікросистемні технології. - 2009. - Т. 3(9), № 4 -С 40-48. 17. S.V.Marchenko, I.S.Kucherenko, A.N.Hereshko et. al., Application of potentiometric biosensor based on recombinant urease for urea determination in blood serum and hemodialyzate // Sensor and Actuators B. - 2015. - Vol. 207.- P. 981-986. 18. О.Л.Кукла, O.C.Павлюченко, O.B.Бушма, Ю.В.Голтвянський, С.В.Дзядевич, О.П.Солдаткін, Патент України на корисну модель "Аналого-цифровий іонно-сенсорний вимірювач параметрів рідких середовищ", UA №48359 МПК G01N27/26, заявл. 26.10.2009, опубл. 10.03.2010, Бюл. №5. 18. S.K. Jha, A. Topkar, S.F. D'Souza, Development of potentiometric urea biosensor based on urease immobilizedin PVA-PAA composite matrix for estimation of blood urea nitrogen (BUN) // Journal of Biochemical and Biophysical Methods. - 2008. - Vol. 70. -P.1145-1150. 35 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 40 45 Потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах, що складається з потенціометричного датчика на основі двох рНчутливих польових транзисторів, який відрізняється тим, що на перший транзистор нанесено першу мембрану на основі силікаліту, на яку далі нанесено другу ферментну мембрану на основі рекомбінантної уреази, що є чутливою до сечовини, на другий транзистор також нанесено першу мембрану на основі силікаліту та другу референтну мембрану, а вказаний біосенсор призначений для підключення до приладу для потенціометричних вимірювань, а виходи цього приладу підключені до відповідних входів комп'ютера. 4 UA 101077 U 5 UA 101077 U Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Автори російськоюBerna Ozansoy Kasap, Salih Kaan Kirdeciler, Burcu Akata Kurc
МПК / Мітки
МПК: G01N 33/00, G01N 33/48, G01N 33/487
Мітки: сечовини, біосенсор, концентрації, потенціометричний, визначення, водних, уреази, розчинах, рекомбінантної, основі
Код посилання
<a href="https://ua.patents.su/8-101077-potenciometrichnijj-biosensor-na-osnovi-rekombinantno-ureazi-dlya-viznachennya-koncentraci-sechovini-u-vodnikh-rozchinakh.html" target="_blank" rel="follow" title="База патентів України">Потенціометричний біосенсор на основі рекомбінантної уреази для визначення концентрації сечовини у водних розчинах</a>
Попередній патент: Стенд імітації фоно-цільової обстановки з атмосферним фільтром
Наступний патент: Потенціометричний біосенсор на основі креатиніндеімінази для визначення концентрацій креатиніну у водних розчинах
Випадковий патент: Спосіб вирощування винограду іn vітrо