Ферментний потенціометричний біосенсор для визначення концентрації l-аргініну у водних розчинах
Номер патенту: 78736
Опубліковано: 25.03.2013
Автори: Дзядевич Сергій Вікторович, Архіпова Валентина Миколаївна, Солдаткін Олександр Олексійович, Шелякіна Маргарита Костянтинівна
Формула / Реферат
Ферментний потенціометричний біосенсор для визначення концентрації L-аргініну у водних розчинах, який складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, на один з яких нанесена робоча ферментна мембрана на основі уреази, що є чутливою до L-аргініну, на другий нанесена мембрана порівняння на основі сироваткового альбуміну білка, вказаний біосенсор інтегрований до вимірювальної комірки, в яку встановлений і електрод порівняння, виходи датчиків призначені для підключення до відповідних входів аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ для вимірювання сигналів потенціометричних датчиків на основі іон-селективних польових транзисторів, а виходи згаданого приладу призначені для підключення до відповідних входів комп'ютера.
Текст
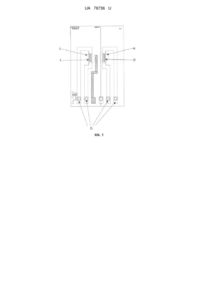
Реферат: Ферментний потенціометричний біосенсор для визначення концентрації L-аргініну у водних розчинах, який складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, на один з яких нанесена робоча ферментна мембрана на основі уреази, що є чутливою до L-аргініну, на другий нанесена мембрана порівняння на основі сироваткового альбуміну білка, вказаний біосенсор інтегрований до вимірювальної комірки, в яку встановлений і електрод порівняння, виходи датчиків призначені для підключення до відповідних входів аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ для вимірювання сигналів потенціометричних датчиків на основі іон-селективних польових транзисторів, а виходи згаданого приладу призначені для підключення до відповідних входів комп'ютера. UA 78736 U (12) UA 78736 U UA 78736 U 5 10 15 20 25 30 35 40 45 50 55 60 Пропонована корисна модель належить до галузі охорони здоров'я, тваринництва та харчової промисловості і може бути застосована, зокрема, для визначення концентрації Lаргініну в розчинах з метою вивчення функціонального стану ферментативної системи людини і тварин, визначення якості харчових продуктів, та може бути використана, як конструктивний елемент аналітичної системи, призначеної для біохімічного аналізу сироватки крові та витяжок з м'яса та м'ясопродуктів з метою діагностики порушень білкового обміну та викликаних ними патологічних змін у роботі органів і систем організму, а саме, до ферментного потенціометричного біосенсору для визначення концентрації L-аргініну у водних розчинах. Амінокислота L-аргінін (-аміно--гуанідино-валеріанова кислота) - попередник орнітину, цитруліну, глутутамату, глутатіону, гамма-аміномасляної кислоти, спермітину та інших сполук одна з найбільш поляризованих, позитивно заряджених амінокислот [1]. Будучи умовно замінною для дорослих і незамінною для дітей амінокислотою, аргінін стимулює продукцію соматотропного гормону, і дефіцит аргініну в харчуванні сповільнює ріст організму. Фізіологічна потреба тканин та органів більшості ссавців та людини у аргініні задовольняється його ендогенним синтезом та/чи надходженням з їжею. Однак, для молодих особин та дорослих в умовах стресу чи хвороби ця амінокислота стає есенціальною. L-аргінін слугує необхідним попередником для синтезу білків та інших біологічно важливих молекул, таких як орнітин, поліаміни, креатин та агматин. Одна із головних ролей аргініну в організмі людини - бути субстратом для синтезу оксиду азота, який має важливішу роль у фізіології серцево-судинної та дихальної систем, травного та урогенітального трактів, центральної та периферічної нервових систем, ендокринної та імунної системах, а також в системі гомеостазу. Імуномодулююча функція L-аргініну полягає у здатності підвищувати активність Т-клітинного імунітету, усуваючи імунодефіцитні стани. Введення аргініну значно зменшує втрати азоту та маси тіла в посттравматичний і післяопераційний періоди, та сповільнює розвиток пухлин. Дефіцит L-аргініну підвищує також ризик розвитку діабету другого типу. Дефіцит азоту є ключовим ланцюгом у виникненні ендотеліальної дисфункції, яка може призвести до різних патологічних станів - артеріальної гіпертензії, атеросклерозу, діабетичної ангіопатії, ішемічної хвороби, стенокардії, розвитку нефросклерозу. Нормальний вміст L-аргініну в крові здорової людини близько 25 мг/л. При ускладненнях вагітності вміст L-аргініну може знижуватись в 1,5-2 разу. Такі зміни відбуваються при вегетативній дисфункції, гестаційній гіпертензії, при гестозі середнього ступеня важкості, при затримці розвитку плоду, гіпоксії плоду та при загрозі передчасних родів. Визначення концентрації L-аргініну в сироватці крові дозволяє діагностувати та вивчати особливості перебігу таких складних захворювань, як туберкульоз легенів [2], колоректальний рак [3]. Зокрема встановлено, що у хворих на туберкульоз легенів спостерігається зниження загального рівня вільних амінокислот у сироватці крові. При діагностиці колоректального раку Lаргінін виконує роль додаткового маркера до аргінази сироватки крові на початковій та метастатичній стадіях колоректального раку. Необхідність визначення концентрації L-аргініну під час діагностики та терапії колоректального раку пояснюється тим, що карциноембріонний антиген, який на сьогодні є найбільш розповсюдженим маркером на початковій і метастатичних стадіях раку, є недостатню чутливим. Однак при спільному використанні карциноембріонного антигену та L-аргініну чутливість комбінованих тестів підвищується до 100 % [3]. Вимірювання концентрації аргініну в сечі дозволяє відрізняти гомозиготну цистинурію від інших її типів [4]. У харчовій промисловості визначення вмісту L-аргініну в амінокислотному складі сировини проводиться з метою порівняння біохімічної цінності різних сортів м'яса та м'ясопродуктів [5]. На сьогодні визначення концентрації L-аргініну в розчинах проводиться методами іонообмінної та тонкошарової хроматографії, спектрофотометрії, колориметрії, радіометрії, ензиматичним методом за кінцевою точкою титрування [4, 5, 6-10]. Основним недоліком більшості з цих методів є їх невисока специфічність до L-аргініну. Крім того, застосування цих методів вимагає залучення великої кількості досліджуваного матеріалу. Визначення аргініну на основі аргіназної реакції проводять з використанням уреази або методом спектрофотометрії, але при цьому аналізувати можна лише білкові гідролізати, які не містять сечовину. А тому ці методи непридатні для специфічного визначення L-аргініну в зразках плазми та сечі, де спостерігається високе співвідношення сечовини та аргініну. Застосування колориметричного методу визначення аргініну обмежується тим, що на точність вимірювань можуть впливати відносно високі концентрації інших хромогенних амінокислот, присутніх у плазмі та сечі (лізин, пролін, цитрулін). Аналізуючи існуючі на сьогодні традиційні методи визначення концентрації L-аргініну, можна зробити висновок, що переважна їх кількість потребує значних витрат часу, додаткової пробопідготовки, високої кваліфікації персоналу та, в цілому, ці методи є дорогими. Створення 1 UA 78736 U 5 10 15 20 25 30 35 40 45 50 55 60 біосенсорів для визначення L-аргініну може спростити та покращити систему моніторингу концентрації L-аргініну в галузі охорони здоров'я, тваринництва та харчової промисловості. На основі проведення патентно-інформаційних досліджень авторами роботи було встановлено, що на сьогодні в галузі біосенсорики існує обмежена кількість даних щодо розробки біосенсорів для визначення L-аргініну. Зокрема, у роботі [11] повідомляється про розробку інтегральних амперометричних біосенсорів для визначення L-амінокислот. Конструктивно кожний з таких біосенсорів складався з кисневого електрода та газопроникної мембрани, і зокрема, біоселективним елементом сенсора для визначення L-аргініну була декарбоксилаза аргініну. У праці [12] повідомляється про розробку амонійчутливого біосенсора для визначення L-аргініну, у якому аргіназа та уреаза були ковалентно іммобілізовані на поверхні карбоксильованої полівінілхлоридної іон-селективної мембрани за допомогою карбодііміду та глутарового альдегіду. Принцип роботи такого біосенсора полягав у послідовному розщепленні L-аргініну до іонів амонію за участю двоферментної системи. У роботі [13] описано ферментний біосенсор, у якому аргіназа та уреаза були включені в желатинову мембрану та іммобілізовані на поверхні рН-електроду за допомогою глутарового альдегіду. Також існують дані про вимірювання L-аргініну за допомогою сенсорної системи на основі явищ поверхневих акустичних хвиль і змін провідності [14]. Принцип роботи такої системи полягав у гідролізі L-аргініну за участю аргінази та уреази з подальшим вимірюванням частотного зсуву, який відбувався в результаті генерування іонів у ході ензиматичних реакцій. Недоліком вище перерахованих систем є використання двох ферментів, кожен з яких функціонує в своїх умовах, що ускладнює як методику іммобілізації, так і процедуру визначення L-аргініну. Також собівартість такої системи досить висока із-за вартості ферменту аргінази. Відомий також кондуктометричний ферментний біосенсор для визначення концентрації Lаргініну у водних розчинах, який має дві пари кондуктометричних електродів, на одну з яких нанесено ферменти аргіназа та уреаза [15]. В описаному пристрої застосовують кондуктометричний метод вимірювання, який часто є більш чутливим за інші методи, але менш селективним за рахунок того, що до зміни фонової провідності водних розчинів може призводити велика кількість неспецифічних сторонніх факторів (зміна температури, щільності, концентрації солей та інших речовин в розчині). Це призводить до відносного зменшення корисного сигналу. Потенціометричний метод реєстрації менш чутливий до фонової провідності розчинів, відповідно, більш селективний до специфічних змін. Авторами під час проведення патентно-інформаційних досліджень і підготовки заявки не виявлені конструкції ферментного потенціометричного біосенсору для визначення концентрації L-аргініну у водних розчинах на основі рН-чутливих польових транзисторів (рН-ПТ) та ефекту інгібування уреази. В основу пропонованої корисної моделі поставлено задачу створення ферментного потенціометричного біосенсору для визначення концентрації L-аргініну у водних розчинах, який би був більш селективним. Поставлена задача вирішується пропонованим ферментним потенціометричним біосенсором для визначення концентрації L-аргініну у водних розчинах, який складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, на один з яких нанесена робоча ферментна мембрана на основі уреази, що є чутливою до L-аргініну, на другий нанесена мембрана порівняння на основі сироваткового альбуміну білка, вказаний біосенсор інтегрований до вимірювальної комірки, в яку встановлений і електрод порівняння, виходи датчиків призначені для підключення до відповідних входів аналого-цифрового іонносенсорного вимірювача параметрів рідких середовищ для вимірювання сигналів потенціометричних датчиків на основі іон-селективних польових транзисторів, а виходи згаданого приладу призначені для підключення до відповідних входів комп'ютера. Суть пропонованої корисної моделі пояснюється графічними матеріалами, де: на фіг. 1 схематично представлено пропонований ферментний потенціометричний біосенсор на основі рН-ПТ для визначення концентрації L-аргініну у водних розчинах; на фіг. 2 показана блок-схема портативного приладу для роботи з потенціометричними датчиками на основі іон-селективних польових транзисторів; на фіг. 3 продемонстровано відгуки біосенсора на основі рН-ПТ на додавання субстрату та L- аргініну на реальному прикладі проведення експерименту; на фіг. 4 наведено калібрувальний графік визначення концентрації L-аргініну. Ферментний потенціометричний біосенсор для визначення концентрації L-аргініну у водних розчинах складається: з двох рН-чутливих р-канальних польових транзисторів 1 та 2 (ПТ) як перетворювачів (фіг. 1). На поверхню транзистора 1 нанесена робоча мембрана 3 (РМ), яка містить у собі фермент 2 UA 78736 U 5 10 15 уреазу, селективний до L-аргініну, на поверхню транзистора 2 (ПТ) нанесена референтна мембрана 4 (РфМ) на основі сироваткового альбуміну білка; портативної системи на основі іон-селективних польових транзисторів (фіг. 2), що складається з зовнішніх контактів до виходів датчиків - 5 (ЗК), вимірювальної комірки з досліджуваним розчином - 6 (ВК). блока реєстрації вимірювального приладу - 7 (БР), блока керування та інтерфейсу - 8 (БК), інформаційних входів блока реєстрації - 9 (IB), загальної шини пристрою - 10 (ЗШ), електрода порівняння - 11 (ЕП), виходів блока керування та інтерфейсу - 12 (ВБ), комп'ютера - 13 (К). Поверхні обох вказаних транзисторів безпосередньо контактують з досліджуваною рідиною, що міститься у вимірювальній комірці 6 (ВК) (фіг. 2). Датчики 1 та 2 (ПТ) підключаються за допомогою зовнішніх контактів 5 (ЗК) до інформаційних входів 9 (IB) блока реєстрації 7 (БР) вимірювального приладу для роботи з потенціометричними датчиками. Виходи блока реєстрації підключені до входів блока керування та інтерфейсу 8 (БК), виходи якого 12 (ВБ) підключаються через послідовний порт до комп'ютера 13 (К). Електрод порівняння 11 (ЕП) підключений до вимірювальної комірки 6 (ВК) по рідинному з'єднанню та до загальної шини пристрою 10 (ЗШ) по електричному з'єднанню. В основі роботи ферментного потенціометричного біосенсора на основі рН-ПТ для визначення L-аргініну лежить ефект інгібування фермента уреази L-аргініном. Реакція розщеплення субстрату під каталітичною дією ферменту має наступний вигляд: Уреаза 20 25 30 35 40 45 50 55 Сечовина + 2Н2О+H+ 2NH4+ + HCO3 В процесі ферментативної реакції уреаза розщеплює сечовину, при цьому зменшується концентрація протонів в робочій мембрані, відповідно, відбувається зміна рН, яку і можна реєструвати за допомогою рН-ПТ [16]. За допомогою ІСПТ з рН-чутливим шаром відбувається перетворення біохімічного сигналу в електричний, що дозволяє реєструвати відгуки біосенсора на додавання субстрату. Для аналізу концентрації L-аргініну необхідно додати досліджуваний зразок у кювету з ІСПТ, на який нанесено фермент, при цьому в ході контакту з L-аргініном відбувається інгібування ферменту. В процесі ферментативної реакції при наявності L-аргініну розщеплюється менше сечовини, що призводить до зміни рН в мембрані щонайменше ніж без L-аргініну. В залежності від цієї різниці і визначали наявність L-аргініну в досліджуваному зразку. Оптимальне співвідношення компонентів у ферментній мембрані було отримано авторами експериментально за умов оцінки оптимальних аналітичних характеристик. Пропонований ферментний потенціометричний біосенсор для визначення L-аргініну у водних розчинах працює наступним чином. На робочу поверхню рН-ПТ 1 (ПТ) потенціометричного біосенсора наносили вихідну суміш для створення робочої мембрани 3 (РМ) (об'єм 50 нл), яку вносили в насичені пари глутарового альдегіду (ГА) на 20-30 хвилин. Цю робочу мембрану готували із 20 мМ фосфатного буфера, рН 6.5, і наступних інгредієнтів у такому їх співвідношенні (у мас. %): 5 уреази, 5 сироватковий альбумін бика (БСА), 10 гліцерин. На інший рН-ПТ 2 (ПТ) наносили вихідну суміш для створення референтної мембрани 4 (РФ) (50 нл), яку вносили в ГА на 20-30 хвилин, цю мембрану формували з 20 мМ фосфатного буфера, рН 6.5, і наступних інгредієнтів у такому їх співвідношенні (у мас %): 10 БСА, 10 гліцерин. Вимірювання проводили за допомогою аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ, розробленого та виготовленого в Інституті фізики напівпровідників ім. В.Є. Лашкарьова НАН України [17], що працює по схемі прямого вимірювання струму в каналі польового транзистора з активним навантаженням. Чутливість приладу становила близько 25 мкА/рН. До входу приладу підключався двоелементний потенціометричний ферментний біосенсор, а також електрод порівняння. Вихід приладу підключався до комп'ютера через послідовний СОМ або USB порт. Пропоновану систему використовували наступним чином. Попередньо виготовляли біоселективні мембрани. Створення ферментного біосенсора: виготовляли робочу мембрану 3 (РМ). Для цього готували розчин з вмістом 5 % уреази, 5 % БСА та 10 % гліцерину у 20 мМ фосфатному буфері, рН 6.5. Референтну мембрану 4 (РфМ) виготовляли таким же чином, але замість наважки фермента брали лише 10 % БСА. Гліцерин у складі мембран 3 (РМ), 4 (РфМ) використовувався для стабілізації ферменту при іммобілізації та запобігання передчасному підсиханню розчину, нанесеного на поверхню перетворювача до 3 UA 78736 U 5 10 15 20 25 30 35 40 45 50 55 60 його внесення в ексикатор для ковалентної зшивки. В свою чергу, БСА в складі робочої мембрани 3 (РМ) відігравав роль стабілізуючого агента для фермента. Для створення мембран біосенсора, відповідно, 3 (РМ) та 4 (РфМ), краплю суміші уреазаБСА (50 нл) наносили на затворну область поверхні перетворювача 1 (ПТ), а на іншу 2 (ПТ) розчин БСА без ферменту (це був датчик порівняння). Для іммобілізації мембран датчики розміщували в атмосфері насичених парів глутарового альдегіду (ГА) на 20-30 хв і потім підсушували на повітрі й відмивали від надлишку ГА у буферному розчині протягом 10-20 хв. Перед початком вимірювань з нанесеними мембранами біосенсор встановлювали у вимірювальній комірці (Фіг. 2) та додавали 1 мл 5 мМ буферного розчину, рН 7.4, витримували півгодини для отримання стабільного базового сигналу. Далі в комірку додавали 1 мМ сечовини і отримували сигнал (Фіг. 3), величину відгуку якого приймали за 100 %. Потім додавали модельний розчин L-аргініну певної концентрації та отримували зменшення відгуку сенсора. Рівень інгібування визначали по співвідношенню відгуків біосенсора до та після інгібування. Після цього отримували залежність рівня інгібування іммобілізованої уреази при додаванні в розчин різних концентрацій L-аргініну - одержували калібрувальний графік (фіг. 4), за допомогою якого визначали концентрацію L-аргініну в досліджуваних зразках. Таким чином, отримана калібрувальна крива демонструє, що запропонований ферментний потенціометричний біосенсор для визначення L-аргініну у водних розчинах є функціонально придатним та може бути використаний в селективному та точному експрес-аналізі концентрації L-аргініну в біологічних рідинах організму людини та тварин, зразках сільськогосподарської сировини. Він дозволяє селективно вимірювати аргінін в діапазоні концентрацій 0,1-10 мМ. Джерела інформації: 1. Степанов Ю.М., Кононов И.Н., Журбина А.И., Филиппова А.Ю. Аргинин в медицинской практике // Журн. АМН України. - 2004. - Т. 10. - № 1. - С. 340-352. 2. Сиренко И.А., Шматько С.А. Особенности L-аргининзависимого синтеза оксида азота у детей и подростков, больных туберкулезом органов дыхания // Український пульмонологічний журнал. - 2006. - № 1. - С. 63-65. 3. Graboń W., Mielczarek-Puta M, Chrzanowska A., Barańczyk-Kuźma A. L-arginine as a factor increasing arginase significance in diagnosis of primary and metastatic colorectal cancer // Clinical Biochemistry. - 2009. - 42. - P. 353-357. 4. Gopalakrishna R., Nagarajan B. A simplified procedure for the estimation of arginine in plasma and urine using arginase // Clin. Chim. Acta. - 1980. - 106. - P. 333-337. 5. Губанов Д.Г. Аминокислотный состав мяса различных поставщиков // Актуальные проблемы животноводства, ветеринарной медицины, переработки сельскохозяйственной продукции и товароведения: Материалы международной научно-практической конференции, Воронеж: ФГОУ ВПО ВГАУ, 2010. - С. 143-144. 6. Kaspara Н., Dettmera К., Chanb Q., Danielsc S., Nimkard S., Davigluse M.L., Stamlere J., Elliott P., Oefhera P.J. Urinary amino acid analysis: A comparison of iTRAQ-LC-MS/MS, GC-MS, and amino acid analyzer // Journal of Chromatography B. - 2009. - 877. - P. 1838-1846. 7. Hanko V.P., Heckenberg A., Rohrer J.S. Determination of amino acids in cell culture and fermentation broth media using anion-exchange chromatography with integrated pulsed amperometric detection // Journal of Biomolecular Techniques. - 2004. - 15 (4). - P. 317-324. 8. Spector E.B., Rice S.C., Cederbaum S.D. Immunologic studies of arginase in tissues of normal human adult and arginase-deficient patients // Pediatr. Res. - 1983. - 17 (12). - P. 941-944. 9. Gange M.E., Francis P.S., Costin J.W., Barnett N.W., Lewis S.W. Determination of arginine in dietary supplements // Journal of the Science of Food and Agriculture. - 2005. - 85 (7). - P. 12171221. 10. Ramón Mira de Orduña. Quantitative determination of L-arginine by enzymatic end-point analysis // J. Agric. Food Chem. - 2001. - 49 (2). - P. 549-552. 11. Suzuki H., Tamiya E., Karube I. Integrated amino acid sensors for detection of L-glutamate, Llysine, L-arginine, and L-histidine // Electroanalysis. - 1994. - 6 (4). - P. 299-304. 12. Koncki R., Wałcerz I, Ruckruh F., Głab S. Bienzymatic potentiometric electrodes for creatine and L-arginine determination // Anal. Chim. Acta. - 1996. - 333 (3). - P. 215-222. 13. Karacaoğlu S., Timur S., Telefoncu A. Arginine selective biosensor based on arginase-urease immobilized in gelatin // Artif. Cells Blood Substit. Immobil. Biotechnol. - 2003. - 31 (3). - P. 357-363. 14. Dezhong L., Aifeng Y., Kai G., Kang C, Lihua N., Shouzhuo Y. Enzymatic analysis of arginine with the SAW/conductance sensor system // Enzyme and Microbial Technology. - 1995. - 17 (9). - P. 856-863. 15. О.Я. Саяпіна, С.В. Дзядевич, О.П. Солдаткін, Н.Є. Стасюк, Г.З. Гайда, М.В. Гончар. Кондуктометрична біосенсорна система для визначення концентрації L-аргініну в розчині. // 4 UA 78736 U 5 Патент України на корисну модель № 64025. - Подано: 08.04.2011. - Опубліковано: 25.10.2011, бюл. № 20. 16. 6. S.V. Dzyadevych, A.P. Soldatkin, A.V. El'skaya, C. Martelet, N. Jaffrezic-Renault. Enzyme biosensors based on ion-selective field-effect transistors // Analytica Chimica Acta. - 2006, 568. - P. 248-258. 17. Кукла О.Л., Павлюченко О.С, Бушма О.В., Голтвянський Ю.В., Дзядевич С.В., Солдаткін О.П. Патент України на корисну модель "Аналого-цифровий іонно-сенсорний вимірювач параметрів рідких середовищ", UA № 48359 МПК G01N 27/26, 27/27, заявл. 26.10.2009, опубл. 10.03.2010, Бюл. № 5. 10 ФОРМУЛА КОРИСНОЇ МОДЕЛІ 15 20 Ферментний потенціометричний біосенсор для визначення концентрації L-аргініну у водних розчинах, який складається з потенціометричного датчика на основі двох рН-чутливих польових транзисторів, на один з яких нанесена робоча ферментна мембрана на основі уреази, що є чутливою до L-аргініну, на другий нанесена мембрана порівняння на основі сироваткового альбуміну білка, вказаний біосенсор інтегрований до вимірювальної комірки, в яку встановлений і електрод порівняння, виходи датчиків призначені для підключення до відповідних входів аналого-цифрового іонно-сенсорного вимірювача параметрів рідких середовищ для вимірювання сигналів потенціометричних датчиків на основі іон-селективних польових транзисторів, а виходи згаданого приладу призначені для підключення до відповідних входів комп'ютера. 5 UA 78736 U Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 6
ДивитисяДодаткова інформація
Назва патенту англійськоюFerment potentiometric bio-sensor for determination of concentration of l-arginine in water solutions
Автори англійськоюArkhypova Valentyna Mykolaivna, Sheliakina Marharyta Kostiantynivna, Soldatkin Oleksandr Oleksiiovych, Dziadevych Serhii Viktorovych
Назва патенту російськоюФерментный потенциометрический биосенсор для определения концентрации l-аргинина в водных растворах
Автори російськоюАрхипова Валентина Николаевна, Шелякина Маргарита Константиновна, Солдаткин Александр Алексеевич, Дзядевич Сергей Викторович
МПК / Мітки
МПК: G01N 33/02
Мітки: концентрації, водних, ферментний, визначення, розчинах, потенціометричний, l-аргініну, біосенсор
Код посилання
<a href="https://ua.patents.su/8-78736-fermentnijj-potenciometrichnijj-biosensor-dlya-viznachennya-koncentraci-l-argininu-u-vodnikh-rozchinakh.html" target="_blank" rel="follow" title="База патентів України">Ферментний потенціометричний біосенсор для визначення концентрації l-аргініну у водних розчинах</a>
Попередній патент: Спосіб визначення раціональних конструктивно-технологічних параметрів системи охолодження екструзійної лінії для перероблення термопластичних матеріалів
Наступний патент: Шахово-шашкова гра “81”
Випадковий патент: Стенд калібрування лічильників витрати струму рідини