Стійка ін’єктована фармацевтична композиція ацеклофенаку і спосіб її одержання
Номер патенту: 103955
Опубліковано: 10.12.2013
Автори: Діпті Пхадтаре, Ратнакар Мехендре, Ашок Рампал, Соумен Сантра
Формула / Реферат
1. Стійка ін'єктована фармацевтична композиція, що містить водний розчин аргініну і ацеклофенаку, в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, рН якого становить від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований.
2. Стійка ін'єктована фармацевтична композиція за п. 1, де водний розчин аргініну і ацеклофенаку має рН від приблизно 6,5 до приблизно 7,5, і де вказаний водний розчин ліофілізований.
3. Спосіб одержання стійкої ін'єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має рН від приблизно 6,5 до приблизно 8,7, що включає:
(a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами,
(b) розчинення ацеклофенаку в розчині аргініну (а) з утворенням водного розчину аргініну і ацеклофенаку,
(c) регулювання рН розчину (b),
(d) ліофілізацію розчину (с),
і де вказаний розчин ліофілізується.
4. Спосіб за п. 3, де стійка ін'єктована фармацевтична композиція, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має рН від приблизно 6,5 до приблизно 7,5, і де вказаний водний розчин ліофілізований.
Текст
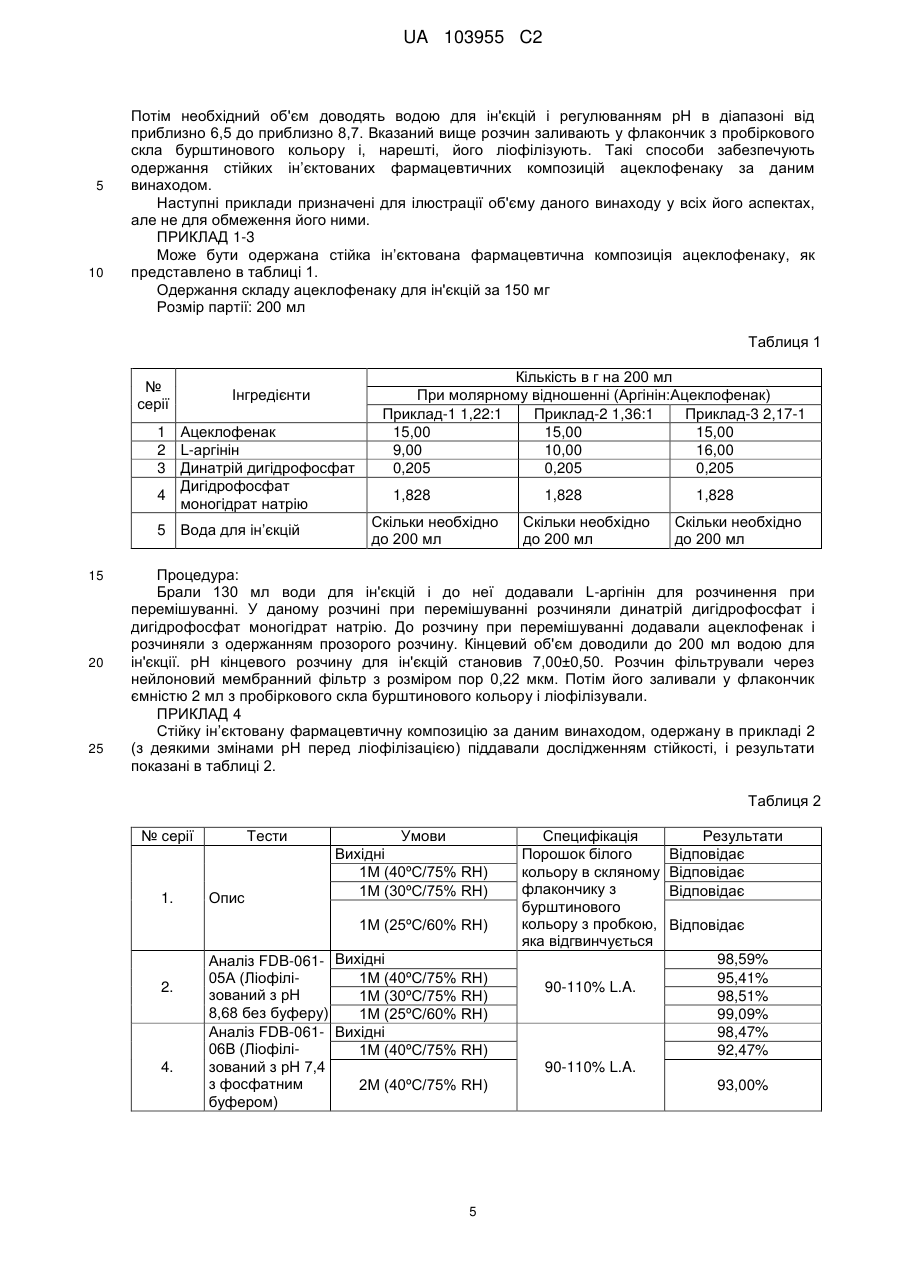
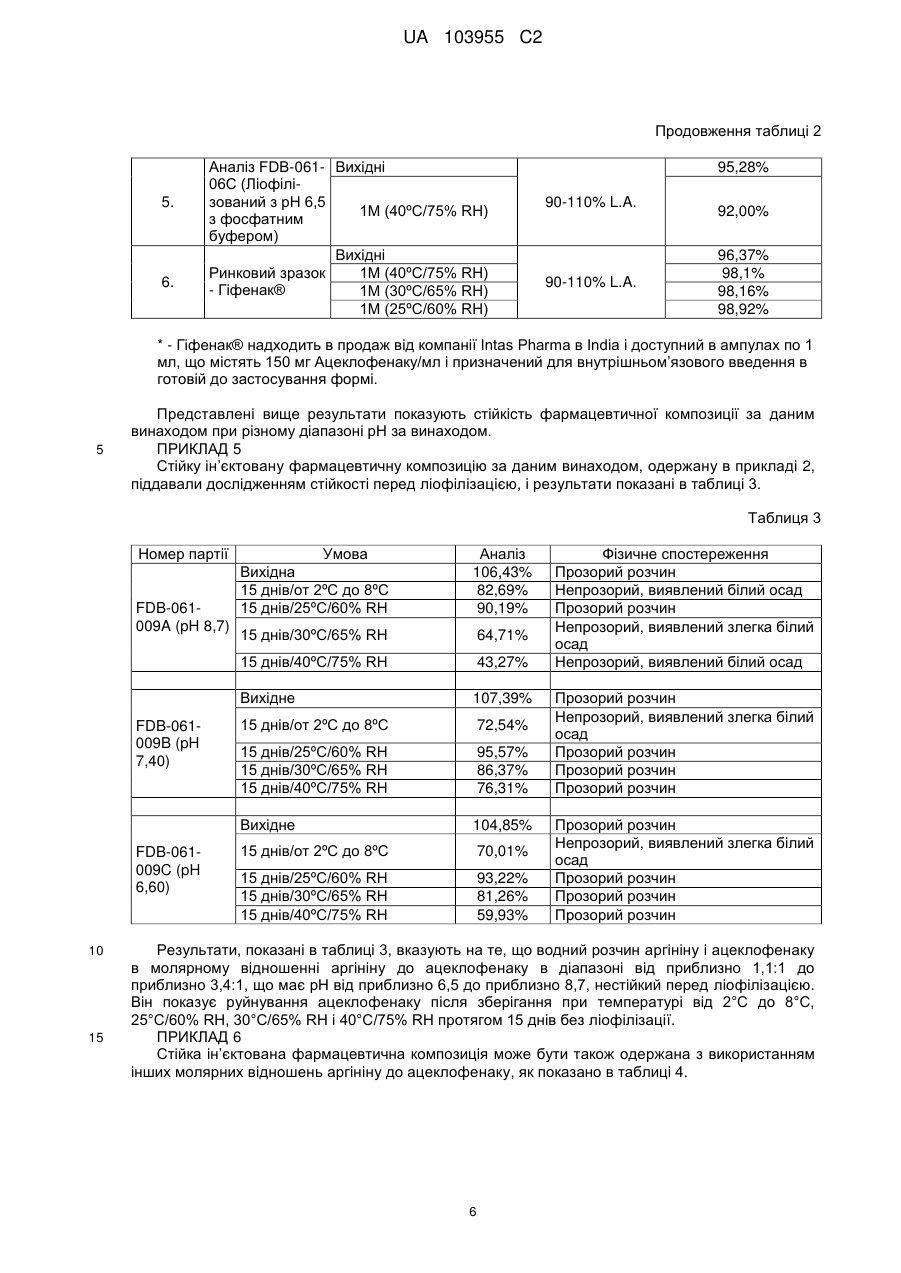
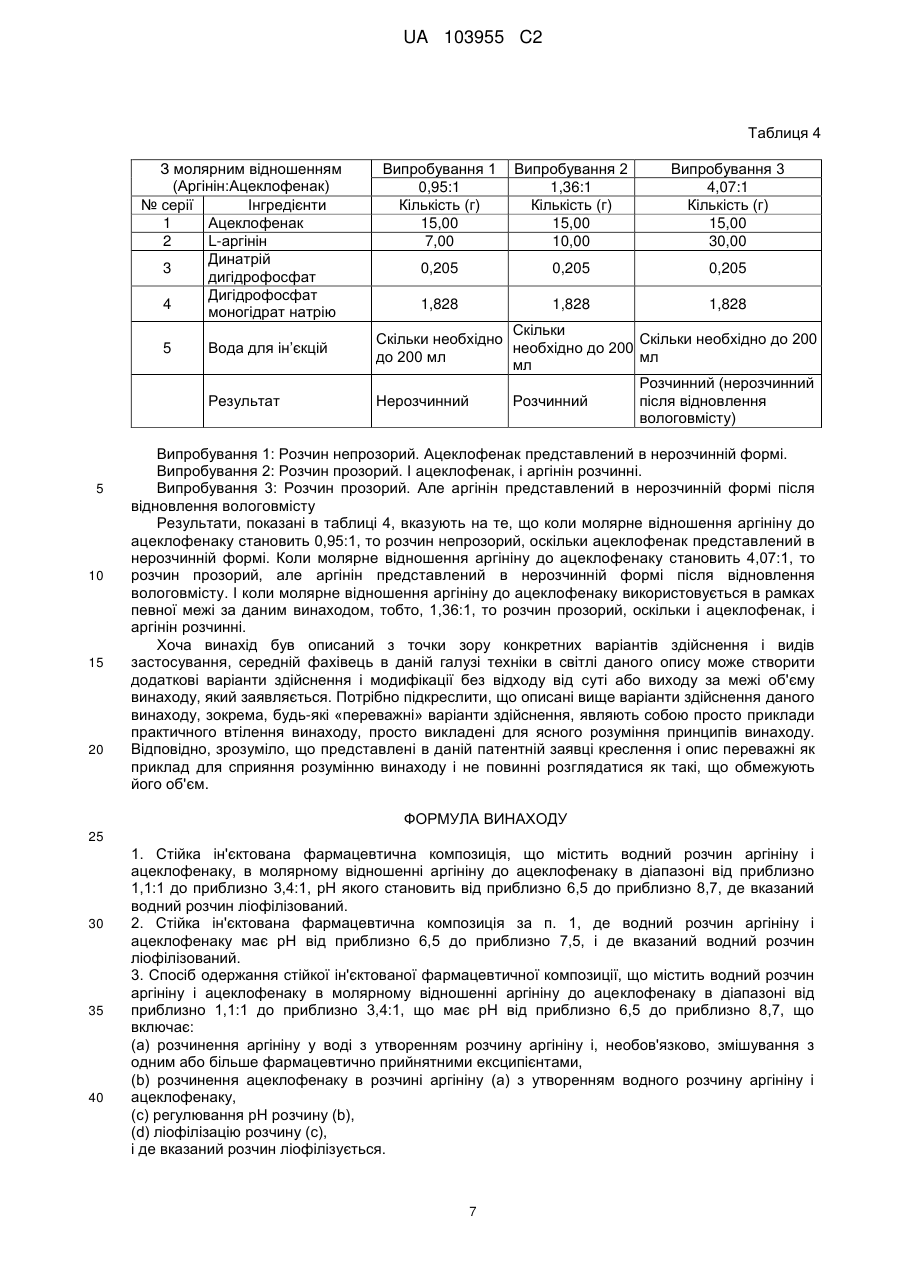
Реферат: Винахід стосується стійкої ін'єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку, в молярному відношенні аргініну до ацеклофенку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має рН від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. UA 103955 C2 UA 103955 C2 5 10 15 20 25 30 35 40 45 50 55 60 Опис ГАЛУЗЬ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід стосується стійкої ін’єктованої фармацевтичної композиції ацеклофенаку і способу її одержання. ПЕРЕДУМОВИ ВИНАХОДУ Ацеклофенак являє собою нестероїдний лікарський засіб, який представлений в формі білого або майже білого, кристалічного порошку. Хімічно, ацеклофенак являє собою 2-[2-[2[(2,6-дихлорфеніл)аміно]феніл]ацетил]оксіоцтову кислоту молекулярної формули C16H13Cl2NO4 і молекулярною масою 354,18472 г/моль. Дія ацеклофенаку значною мірою основана на інгібуванні синтезу простагландинів. Ацеклофенак є потужним інгібітором ферменту циклооксигенази, яка бере участь в продукції простагландинів. Вона інгібує синтез запальних цитокінів інтерлейкіну (IL)-1, фактора некрозу пухлин і продукцію простагландину E2 (PGE2). Були також відмічені її впливи на молекули клітинної адгезії з нейтрофілів. Дані in vitro вказують на інгібування циклооксигенази (Cox)-1 і 2 ацеклофенаком в аналізах цільної крові, причому очевидна селективність відносно Cox-2. Ацеклофенак застосовується для полегшення болю і запалення при ревматоїдному артриті, остеоартриті і анкілозуючому спондиліті. Доза становить 100 мг двічі на день. Однак ацеклофенак практично нерозчинний у воді, вільно розчинний в ацетоні й розчинний в спирті. Він виробляється компанією Intas Biopharmaceuticals, під торговою назвою Hifenac® в різних формах (таблетках, гелі, розчинах для ін'єкцій і т. д.). У патенті США № 4548952 зокрема заявлена сполука ацеклофенаку. Заявка на патент США № 20090156670A1 стосується неводної рідкої препаративної форми ацеклофенаку для парентерального застосування, придатної для фармацевтичного застосування, що містить компонент у вигляді ацеклофенаку в формі нерозчинної у воді солі ацеклофенаку, в співлюбілізованій або розчиненій формі в рідині розчинника, де вказана рідина розчинника містить: a) компонент у вигляді неводного солюбілізатора, ефективного для стабілізації ацеклофенаку і диклофенаку, який утворюється перетворенням в нього компонента у вигляді ацеклофенаку, причому вказаний компонент у вигляді неводного солюбілізатора по суті інертний відносно вказаного перетворення; і b) компонент у вигляді стабілізатора солі ацеклофенак, ефективний для інгібування осадження вільної кислоти ацеклофенаку. У ній також розкривається, що представлені фармацевтичні композиції стійкі після зберігання при кімнатній температурі і при знижених температурах. У публікації Nisharani S. Ranpise et al., Pharmaceutical Development and Technology, June 2009 описане утворення комплексів включення ацеклофенаку з β-циклодекстрином методиками розмелювання, мікрохвильової обробки і розпилювального сушіння і забезпечення поліпшення розчинності у воді і швидкості розчинення in vitro ацеклофенаку утворенням комплексів з β-циклодекстрином і гідроксипропіл-β-циклодекстрину. У патенті США № 6727286 представлена фармацевтична композиція, що містить водний розчин аргініну й ібупрофену з молярним відношенням аргініну до ібупрофену, яке становить менше ніж 1:1, а також спосіб її одержання. У ньому також розкритий спосіб лікування стану, вибраного з болю, запалення, фебрілітету і/або інших станів, що полегшуються ібупрофеном, що включає введення вказаної вище фармацевтичної композиції. Наведені вище документи попереднього рівня техніки загалом стосуються неводних композицій ацеклофенаку або утворення комплексів включення ацеклофенаку з βциклодекстрином. Неводні ін’єктовані фармацевтичні композиції ліпофільних нерозчинних у воді лікарських засобів, подібні до ацеклофенаку, часто складаються з сумішей води, органічних спільних розчинників і поверхнево-активних речовин. Обмеження при використанні неводних розчинників для ін’єктованих композицій включають можливе осадження лікарського засобу, запалення і гемоліз після ін'єкції. По суті, в продажу немає водного ін’єктованого препарату ацеклофенаку. Оскільки водний розчин легко пристосовується для включення в склад, а також в зв'язку з нестійкістю ацеклофенаку, існує потреба в забезпеченні промислово застосовного способу одержання стійкої ін’єктованої фармацевтичної композиції ацеклофенаку, в якій використовується водний розчин ацеклофенаку. У попередньому рівні техніки також описана фармацевтична композиція водного розчину аргініну й ібупрофену, що містить молярне відношення аргініну до ібупрофену, яке становить менше ніж 1:1. Однак ібупрофен дуже незначно розчинний у воді і легко розчинний в етанолі. Він також легко розчинний і стійкий при лужному pH. На відміну від ібупрофену, ацеклофенак практично нерозчинний у воді і його розчинність в лужному середовищі становить менше ніж 10 мг/мл. Крім того, ацеклофенак нестійкий в лужному середовищі, оскільки він перетворюється в диклофенак гідролізом. Тому, одержання препаративної форми ацеклофенаку шляхом солюбілізації ацеклофенаку замість ібупрофену з аргініном, відповідно до положень патенту 1 UA 103955 C2 5 10 15 20 25 30 35 40 45 50 55 60 США № 6727286, привело б до декількох проблем. По-перше, ацеклофенак менш розчинний у водному середовищі, в порівнянні з ібупрофеном. Крім того, препаративна форма ацеклофенаку з аргініном забезпечила б одержання препаративної форми з лужним pH, при якому ацеклофенак був би нестійкий, на відміну від ібупрофену, який стійкий при лужному pH. Більше того, заявники спостерігали, що препарати ацеклофенаку у вигляді розчинів дуже нестійкі, на відміну від препаратів у вигляді розчинів ібупрофену, які є стійкими. Крім того, розчини ацеклофенаку схильні до руйнування навіть при кислотному або нейтральному pH. Заявники на подив виявили, що стійка ін’єктована фармацевтична композиція ацеклофенаку може бути одержана солюбілізацією ацеклофенаку в аргініні при pH від приблизно 6,5 до приблизно 8,7 і подальшою ліофілізацією одержаного розчину ацеклофенаку. Стійкість ацеклофенаку у воді може бути збільшена змішуванням його з аргініном в певному молярному відношенні, яке може використовуватися для одержання вказаної фармацевтичної композиції ацеклофенаку. МЕТА ВИНАХОДУ Задачею даного винаходу є одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. Задачею даного винаходу є одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, де вказаний водний розчин ліофілізований. Іншою задачею даного винаходу є надання способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. Ще однією задачею даного винаходу є надання способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, де вказаний водний розчин ліофілізований. Відповідно, задачею даного винаходу є подолання або зменшення щонайменше одного з недоліків попереднього рівня техніки або забезпечення корисної альтернативи. КОРОТКИЙ ВИКЛАД СУТІ ВИНАХОДУ Даний винахід стосується стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку, в молярному відношенні аргініну до ацеклофенку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. Даний винахід стосується стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку, в молярному відношенні аргініну до ацеклофенку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, де вказаний водний розчин ліофілізований. Даний винахід стосується способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, що включає: (a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами, (b) розчинення ацеклофенаку в розчині аргініну (a) з утворенням водного розчину аргініну і ацеклофенаку, (с) регулювання pH розчину (b), (d) ліофілізацію розчину (с), і де вказаний розчин ліофілізується. Даний винахід також стосується способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, що включає: (a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами, (b) розчинення ацеклофенаку в розчині аргініну (a) з утворенням водного розчину аргініну і ацеклофенаку, 2 UA 103955 C2 5 10 15 20 25 30 35 40 45 50 55 60 (с) регулювання pH розчину (b), (d) ліофілізацію розчину (с), і де вказаний розчин ліофілізується. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Перед описом даного способу і методів, потрібно розуміти, що даний винахід не обмежується конкретними описаними сполуками, складами або стадіями, оскільки вони можуть, звичайно, варіюватися. Потрібно також розуміти, що термінологія, яка використовується в даному описі, застосовується тільки з метою опису конкретних варіантів здійснення, і не призначена для обмеження ними, оскільки об'єм даного винаходу обмежується тільки прикладеною формулою винаходу. Коли представляється діапазон величин, то зрозуміло, що доки контекст ясно не диктує інше, то кожна проміжна величина до десятих часток одиниці нижньої межі між верхньою і нижньою межею вказаного діапазону і будь-які інші вказані або проміжні величини у вказаному діапазоні також входять в об'єм винаходу. Верхня і нижня межі цих менших діапазонів, які можуть бути незалежно включені в менші діапазони, також включені в об'єм винаходу з урахуванням будь-якої конкретно виключеної межі у вказаному діапазоні. Коли вказаний діапазон включає одну або обидві межі, то діапазони, що виключають будь-які обидві з цих включених меж, також включені у винахід. Доки немає інших визначень, всі технічні і наукові терміни, що використовуються в даному описі, мають таке ж значення, яке загальнозрозуміло середнім фахівцям в даній галузі техніки, для яких призначений даний винахід. Хоча будь-які способи і матеріали, аналогічні або еквівалентні тим, які описані в даній заявці, можуть також використовуватися при реалізації або тестуванні даного винаходу, тепер описуються переважні способи і матеріали. Всі публікації, згадані в даному описі, включені в нього шляхом посилання для розкриття і опису способів і/або матеріалів, в зв'язку з якими наведені публікації. Потрібно зазначити, що посилання на «сполуку» включає множину таких сполук, а посилання на «стадію» включає посилання на одну або більше стадій і їх еквіваленти, відомі фахівцям в даній галузі техніки, і т. д. Публікації, що обговорюються в даному винаході, представлені виключно для їх розкриття перед датою подачі даної патентної заявки. Ніщо в даному описі не треба розглядати як допущення, що даний винахід не має права передувати такій публікації в зв'язку з раніше створеним винаходом. Крім того, представлені дати публікацій можуть відрізнятися від дійсних дат публікацій, незалежне підтвердження яких може бути необхідним. Термін «стійкий», що використовується в даному описі, стосується хімічної стійкості ацеклофенаку в фармацевтичній композиції, де немає зміни величин аналізу ацеклофенаку після зберігання при 40°С/75% RH (відносної вологості) або 30°С/75% RH або 25°С/60% RH протягом 1 місяця. Заявники на подив виявили, що стійка ін’єктована фармацевтична композиція ацеклофенаку може бути одержана солюбілізацією ацеклофенаку в аргініні при pH від приблизно 6,5 до приблизно 8,7 і подальшою ліофілізацією одержаного розчину ацеклофенаку. Розчинність ацеклофенаку у воді можна збільшити змішуванням його з аргініном в певному молярному відношенні, яке може використовуватися для одержання вказаної фармацевтичної композиції ацеклофенаку. Даний винахід стосується стійкої ін’єктованої фармацевтичної композиції ацеклофенаку, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. Даний винахід стосується стійкої ін’єктованої фармацевтичної композиції ацеклофенаку, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, де вказаний водний розчин ліофілізований. Даний винахід стосується способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, що включає: (a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами, (b) розчинення ацеклофенаку в розчині аргініну (a) з утворенням водного розчину аргініну і ацеклофенаку, (с) регулювання pH розчину (b), 3 UA 103955 C2 5 10 15 20 25 30 35 40 45 50 55 60 (d) ліофілізацію розчину (с), і де вказаний розчин ліофілізується. Даний винахід також стосується способу одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 7,5, що включає: (a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами, (b) розчинення ацеклофенаку в розчині аргініну (a) з утворенням водного розчину аргініну і ацеклофенаку, (с) регулювання pH розчину (b), (d) ліофілізацію розчину (с), і де вказаний розчин ліофілізується. У даному винаході для фармацевтичної композиції ацеклофенаку і способу її одержання терапевтично ефективна кількість ацеклофенаку, яка може використовуватися, знаходиться в діапазоні від приблизно 100 мг до приблизно 300 мг на день. Аргінін представляє собою умовно замінювану амінокислоту, і це означає, що він в основному може вироблятися в організмі людини і не повинен надходити безпосередньо через раціон. L-форма являє собою одну з 20 найбільш поширених природних амінокислот. У даному винаході для солюбілізації використовується аргінін або його фармацевтично прийнятні сольові форми, переважно, L-аргінін або гідрохлорид аргініну, переважніше, L-аргінін. У даному винаході для фармацевтичної композиції ацеклофенаку і способу її одержання, терапевтично ефективна кількість аргініну, яка може використовуватися, знаходиться в діапазоні від приблизно 2 г до приблизно 8 г на день. Один варіант здійснення даного винаходу стосується надання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку, де молярне відношення аргініну до ацеклофенаку становить від приблизно 1,1:1 до приблизно 3,40:1, переважніше, від приблизно 1,22:1 до приблизно 2,04:1. Вказане молярне відношення аргініну до ацеклофенаку забезпечує розчинність ацеклофенаку у водному розчині. Коли молярне відношення аргініну до ацеклофенаку нижче вказаної межі, то ацеклофенак знаходиться в нерозчинній формі, а коли воно вище вказаної межі, то аргінін був би в нерозчинній формі після відновлення вологовмісту. Відповідно, з метою даного винаходу, молярне відношення аргініну до ацеклофенаку становить від приблизно 1,1:1 до приблизно 3,40:1, переважніше, від приблизно 1,22:1 до приблизно 2,04:1. Інший варіант здійснення даного винаходу стосується регулювання pH водного розчину аргініну і ацеклофенаку до діапазону від приблизно 6,5 до приблизно 8,7, переважно, від приблизно 6,5 до приблизно 7,5. При pH менше ніж 6,5, ацеклофенак не утворює розчин з аргініном в результаті нерозчинності при pH менше ніж 6,5 і в лужному середовищі при pH більше ніж приблизно 8,7, ацеклофенак є нестійким в результаті його гідролізу. Дослідження стійкості розчину аргініну і ацеклофенаку перед ліофілізацією регулюванням pH в діапазоні від приблизно 6,5 до приблизно 8,7, показує руйнування ацеклофенаку і нестійку препаративну форму. Таким чином, крім того, ліофілізація являє собою процес дегідратації і звичайно використовується для збереження швидкопсувного матеріалу або одержання матеріалу, зручнішого для транспортування. Заявники виявили, що регулювання pH розчину аргініну і ацеклофенаку в діапазоні від приблизно 6,5 до приблизно 8,7 і його подальша ліофілізація приводить до мінімального руйнування ацеклофенаку під час процесу ліофілізації, а також після відновлення вологовмісту ліофілізованої фармацевтичної композиції. Загалом, даний винахід стосується одержання стійкої ін’єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що мають pH від приблизно 6,5 до приблизно 8,7, де вказаний розчин ліофілізований. Дана фармацевтична композиція ацеклофенаку може включати один або більше фармацевтично прийнятних ексципієнтів, таких як буфери, подібні до дигідрофосфату, дигідрофосфату натрію або їх суміші, солюбілізатори, стабілізатори, антиоксиданти, які очевидні для фахівця в даній галузі техніки. Фармацевтична композиція, описана в даній патентній заявці, може бути одержана різними методиками. Наприклад, один варіант здійснення даного винаходу може стосуватися розчинення L-аргініну у воді для ін'єкцій. Необов'язково, здійснюється змішування динатрію дигідрофосфату, дигідрофосфату моногідрату натрію або їх сумішей з розчином L-аргініну. Виконується додавання ацеклофенаку до даної суміші і розчинення його при перемішуванні. 4 UA 103955 C2 5 10 Потім необхідний об'єм доводять водою для ін'єкцій і регулюванням pH в діапазоні від приблизно 6,5 до приблизно 8,7. Вказаний вище розчин заливають у флакончик з пробіркового скла бурштинового кольору і, нарешті, його ліофілізують. Такі способи забезпечують одержання стійких ін’єктованих фармацевтичних композицій ацеклофенаку за даним винаходом. Наступні приклади призначені для ілюстрації об'єму даного винаходу у всіх його аспектах, але не для обмеження його ними. ПРИКЛАД 1-3 Може бути одержана стійка ін’єктована фармацевтична композиція ацеклофенаку, як представлено в таблиці 1. Одержання складу ацеклофенаку для ін'єкцій за 150 мг Розмір партії: 200 мл Таблиця 1 № серії Інгредієнти 1 Ацеклофенак 2 L-аргінін 3 Динатрій дигідрофосфат Дигідрофосфат 4 моногідрат натрію 5 Вода для ін’єкцій 15 20 25 Кількість в г на 200 мл При молярному відношенні (Аргінін:Ацеклофенак) Приклад-1 1,22:1 Приклад-2 1,36:1 Приклад-3 2,17-1 15,00 15,00 15,00 9,00 10,00 16,00 0,205 0,205 0,205 1,828 1,828 Скільки необхідно до 200 мл Скільки необхідно до 200 мл 1,828 Скільки необхідно до 200 мл Процедура: Брали 130 мл води для ін'єкцій і до неї додавали L-аргінін для розчинення при перемішуванні. У даному розчині при перемішуванні розчиняли динатрій дигідрофосфат і дигідрофосфат моногідрат натрію. До розчину при перемішуванні додавали ацеклофенак і розчиняли з одержанням прозорого розчину. Кінцевий об'єм доводили до 200 мл водою для ін'єкції. pH кінцевого розчину для ін'єкцій становив 7,00±0,50. Розчин фільтрували через нейлоновий мембранний фільтр з розміром пор 0,22 мкм. Потім його заливали у флакончик ємністю 2 мл з пробіркового скла бурштинового кольору і ліофілізували. ПРИКЛАД 4 Стійку ін’єктовану фармацевтичну композицію за даним винаходом, одержану в прикладі 2 (з деякими змінами pH перед ліофілізацією) піддавали дослідженням стійкості, і результати показані в таблиці 2. Таблиця 2 № серії 1. Тести Опис Умови Вихідні 1M (40ºC/75% RH) 1M (30ºC/75% RH) 1M (25ºC/60% RH) 2. 4. Аналіз FDB-061- Вихідні 1M (40ºC/75% RH) 05A (Ліофілізований з pH 1M (30ºC/75% RH) 8,68 без буферу) 1M (25ºC/60% RH) Аналіз FDB-061- Вихідні 06B (Ліофілі1M (40ºC/75% RH) зований з pH 7,4 з фосфатним 2M (40ºC/75% RH) буфером) 5 Специфікація Порошок білого кольору в скляному флакончику з бурштинового кольору з пробкою, яка відгвинчується 90-110% L.A. Результати Відповідає Відповідає Відповідає Відповідає 98,59% 95,41% 98,51% 99,09% 98,47% 92,47% 90-110% L.A. 93,00% UA 103955 C2 Продовження таблиці 2 5. 6. Аналіз FDB-061- Вихідні 06C (Ліофілізований з pH 6,5 1M (40ºC/75% RH) з фосфатним буфером) Вихідні 1M (40ºC/75% RH) Ринковий зразок - Гіфенак® 1M (30ºC/65% RH) 1M (25ºC/60% RH) 95,28% 90-110% L.A. 90-110% L.A. 92,00% 96,37% 98,1% 98,16% 98,92% * - Гіфенак® надходить в продаж від компанії Intas Pharma в India і доступний в ампулах по 1 мл, що містять 150 мг Ацеклофенаку/мл і призначений для внутрішньом’язового введення в готовій до застосування формі. 5 Представлені вище результати показують стійкість фармацевтичної композиції за даним винаходом при різному діапазоні pH за винаходом. ПРИКЛАД 5 Стійку ін’єктовану фармацевтичну композицію за даним винаходом, одержану в прикладі 2, піддавали дослідженням стійкості перед ліофілізацією, і результати показані в таблиці 3. Таблиця 3 Номер партії 10 15 64,71% 43,27% 107,39% 15 днів/от 2ºC до 8ºC 72,54% 15 днів/25ºC/60% RH 15 днів/30ºC/65% RH 15 днів/40ºC/75% RH 95,57% 86,37% 76,31% Вихідне FDB-061009C (pH 6,60) 15 днів/30ºC/65% RH Вихідне FDB-061009B (pH 7,40) Аналіз 106,43% 82,69% 90,19% 15 днів/40ºC/75% RH FDB-061009A (pH 8,7) Умова Вихідна 15 днів/от 2ºC до 8ºC 15 днів/25ºC/60% RH 104,85% 15 днів/от 2ºC до 8ºC 70,01% 15 днів/25ºC/60% RH 15 днів/30ºC/65% RH 15 днів/40ºC/75% RH 93,22% 81,26% 59,93% Фізичне спостереження Прозорий розчин Непрозорий, виявлений білий осад Прозорий розчин Непрозорий, виявлений злегка білий осад Непрозорий, виявлений білий осад Прозорий розчин Непрозорий, виявлений злегка білий осад Прозорий розчин Прозорий розчин Прозорий розчин Прозорий розчин Непрозорий, виявлений злегка білий осад Прозорий розчин Прозорий розчин Прозорий розчин Результати, показані в таблиці 3, вказують на те, що водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має pH від приблизно 6,5 до приблизно 8,7, нестійкий перед ліофілізацією. Він показує руйнування ацеклофенаку після зберігання при температурі від 2°С до 8°С, 25°С/60% RH, 30°С/65% RH і 40°С/75% RH протягом 15 днів без ліофілізації. ПРИКЛАД 6 Стійка ін’єктована фармацевтична композиція може бути також одержана з використанням інших молярних відношень аргініну до ацеклофенаку, як показано в таблиці 4. 6 UA 103955 C2 Таблиця 4 З молярним відношенням (Аргінін:Ацеклофенак) № серії Інгредієнти 1 Ацеклофенак 2 L-аргінін Динатрій 3 дигідрофосфат Дигідрофосфат 4 моногідрат натрію 5 Вода для ін’єкцій Результат 5 10 15 20 Випробування 1 0,95:1 Кількість (г) 15,00 7,00 Випробування 2 1,36:1 Кількість (г) 15,00 10,00 Випробування 3 4,07:1 Кількість (г) 15,00 30,00 0,205 0,205 0,205 1,828 1,828 1,828 Скільки Скільки необхідно Скільки необхідно до 200 необхідно до 200 до 200 мл мл мл Розчинний (нерозчинний Нерозчинний Розчинний після відновлення вологовмісту) Випробування 1: Розчин непрозорий. Ацеклофенак представлений в нерозчинній формі. Випробування 2: Розчин прозорий. І ацеклофенак, і аргінін розчинні. Випробування 3: Розчин прозорий. Але аргінін представлений в нерозчинній формі після відновлення вологовмісту Результати, показані в таблиці 4, вказують на те, що коли молярне відношення аргініну до ацеклофенаку становить 0,95:1, то розчин непрозорий, оскільки ацеклофенак представлений в нерозчинній формі. Коли молярне відношення аргініну до ацеклофенаку становить 4,07:1, то розчин прозорий, але аргінін представлений в нерозчинній формі після відновлення вологовмісту. І коли молярне відношення аргініну до ацеклофенаку використовується в рамках певної межі за даним винаходом, тобто, 1,36:1, то розчин прозорий, оскільки і ацеклофенак, і аргінін розчинні. Хоча винахід був описаний з точки зору конкретних варіантів здійснення і видів застосування, середній фахівець в даній галузі техніки в світлі даного опису може створити додаткові варіанти здійснення і модифікації без відходу від суті або виходу за межі об'єму винаходу, який заявляється. Потрібно підкреслити, що описані вище варіанти здійснення даного винаходу, зокрема, будь-які «переважні» варіанти здійснення, являють собою просто приклади практичного втілення винаходу, просто викладені для ясного розуміння принципів винаходу. Відповідно, зрозуміло, що представлені в даній патентній заявці креслення і опис переважні як приклад для сприяння розумінню винаходу і не повинні розглядатися як такі, що обмежують його об'єм. ФОРМУЛА ВИНАХОДУ 25 30 35 40 1. Стійка ін'єктована фармацевтична композиція, що містить водний розчин аргініну і ацеклофенаку, в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, рН якого становить від приблизно 6,5 до приблизно 8,7, де вказаний водний розчин ліофілізований. 2. Стійка ін'єктована фармацевтична композиція за п. 1, де водний розчин аргініну і ацеклофенаку має рН від приблизно 6,5 до приблизно 7,5, і де вказаний водний розчин ліофілізований. 3. Спосіб одержання стійкої ін'єктованої фармацевтичної композиції, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має рН від приблизно 6,5 до приблизно 8,7, що включає: (a) розчинення аргініну у воді з утворенням розчину аргініну і, необов'язково, змішування з одним або більше фармацевтично прийнятними ексципієнтами, (b) розчинення ацеклофенаку в розчині аргініну (а) з утворенням водного розчину аргініну і ацеклофенаку, (c) регулювання рН розчину (b), (d) ліофілізацію розчину (с), і де вказаний розчин ліофілізується. 7 UA 103955 C2 4. Спосіб за п. 3, де стійка ін'єктована фармацевтична композиція, що містить водний розчин аргініну і ацеклофенаку в молярному відношенні аргініну до ацеклофенаку в діапазоні від приблизно 1,1:1 до приблизно 3,4:1, що має рН від приблизно 6,5 до приблизно 7,5, і де вказаний водний розчин ліофілізований. 5 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюAshok, Rampal, Ratnakar, Mehendre, Dipti, Phadtare, Soumen, Santra
Автори російськоюАшок Рампал, Ратнакар Мехендре, Дипти Пхадтаре, Соумен Сантра
МПК / Мітки
МПК: A61K 31/216, A61P 29/00, A61K 31/136, A61K 9/19, A61K 31/155
Мітки: фармацевтична, одержання, ацеклофенаку, стійка, спосіб, композиція, ін'єктована
Код посилання
<a href="https://ua.patents.su/10-103955-stijjka-inehktovana-farmacevtichna-kompoziciya-aceklofenaku-i-sposib-oderzhannya.html" target="_blank" rel="follow" title="База патентів України">Стійка ін’єктована фармацевтична композиція ацеклофенаку і спосіб її одержання</a>
Попередній патент: Спосіб одержання олії криля, збагаченої фосфоліпідами та нейтральними ліпідами, без застосування розчинника
Наступний патент: Вертикальний ківшовий елеватор
Випадковий патент: Формувач періодичної послідовності багатофазних серій з програмованою кількістю фаз і тривалістю імпульсів в серії