Фармацевтична композиція, яка має активність, що зменшує патологічну гіперактивність еозинофільних гранулоцитів, та похідні ксантину
Номер патенту: 39136
Опубліковано: 15.06.2001
Автори: Крьогель Клаус, Анагностопулос Хірісто, Капп Александер, Геберт Ульріх
Формула / Реферат
1. Фармацевтическая композиция, обладающая уменьшающей патологическую гиперактивность эозинофильных гранулоцитов активностью, содержащая активное вещество на основе производных ксантина и по меньшей мере одну целевую добавку, отличающаяся тем, что в качестве активного вещества она содержит по меньшей мере одно соединение общей формулы (1)
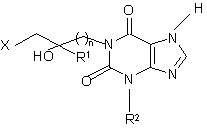 (1)
(1)
где:
R1- метил или этил,
R2 - алкил с 1 - 4 атомами углерода,
Х - атом водорода или гидроксил,
n - целое число от 1 до 5,
и/или его стереоизомер, и/или его физиологически переносимую соль в эффективном количестве.
2. Производные ксантина общей формулы (1):
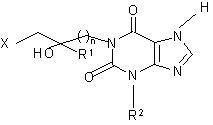 (1)
(1)
где:
R1 - метил или этил,
R2 - алкил с 1 - 4 атомами углерода,
X - атом водорода или гидроксил,
n - целое число от 1 до 5,
причем соединение, у которого и R1 и R2 означают метил, Х означает атом
водорода и n означает число 4, исключено,
его стереоизомер и физиологически переносимые соли.
3. Производные ксантина общей формулы (1) по п. 2, отличающиеся тем, что R2 означает метил или этил.
4. Производные ксантина общей формулы (1) по п. 2, отличающиеся тем, что остаток Х означает атом водорода.
5. Производные ксантина общей формулы (1) по п. 2, отличающиеся тем, что R1 - метил, R2-метил или этил, Х - атом водорода, n - целое число от 1 до 5.
Текст
1. Фармацевтическая композиция, обладающая уменьшающей патологическую гиперактивность эозинофильных гранулоцитов активностью, содержащая активное вещество на основе производных ксантина и по меньшей мере одну целевую добавку, отличающаяся тем, что в качестве активного вещества она содержит по меньшей мере одно соединение общей формулы (І) 39136 зинофильных гранулятов активностью (см. заявку ЕР № 0 544 391, А1, А 61 К 31/52, 02.06.1993 г.). Задачей изобретения является расширение ассортимента, производных ксантина, обладающи х биологической активностью, в частности уменьшающей патологическую гиперактивность эозинофильных грануло цитов активностью. Поставленная задача решается предлагаемыми производными ксантина общей формулы (I) а) с алкилирующим средством формулы (III), (III) в которой R , Х и n имеют вышеназванные значения, a Z означает галоген, предпочти тельно хлор, бром или иод, либо группировку эфира сульфо новой кислоты или эфира фосфорной кислоты, до получе ния 1,3,7 - тризамещённого ксантина формулы IV, 1 (I) где R1 - метил или этил, R2 - алкил с 1 - 4 атомами углерода, Х - атом водорода или гидроксил, n - целое число от 1 до 5, причем при R1 - метил, R2 - метил, Х -атом водорода, n означает число 1, 2, 3, 5, их сте реоизомерами и физиологически переносимыми солями. В первую гр уппу предпочтительных производных ксанти на общей формулы (I) входят соединения, у которых R2 означает метил или этил. Во вто рую гр уппу предпочтительных производных ксанти на общей формулы (I) входят соединения, у которых Х означает атом водорода. В третью группу предпочтительных произ-водных ксантина общей формулы (I) входят соединения, у которых R1 - метил, R2 - метил или этил, Х - атом водорода, n - целое число от 1 до 5. Новые производные ксантина общей формулы (I) можно получать известными способами. Преимущественно поступают таким образом, что 3,7-дизамещенное производное ксантина формулы (II), (IV) причём R1, R2, Rа , Х и n имеют вы шеопределённые значения или альтернативно для случая, когда Х оз начает водород, б) с кето-соединением формулы V, Н3С - СО - (СН2)n - Z (V) в которой n и Z имеют вышеназванные значения, до получе ния 1,3,7 - тризамещённого ксантина формулы VI, (VI) который затем с помощью метил-/ или этилметаллосоединения (R1 -М), предпочтительно в виде метил- или этиллития (R1-Li) или соответствующих соединений Гриньяра (R1-MgHal) в условиях восстановительного алкилирования карбонильной груп пы переводят в 1,3,7 - тризамещённый ксантин формулы VII, (II) в которой R 2 оз начает алкильную гр уп пу, со держащую от одного до че тыре х атомов углерода, a Ra оз начает легко удаляе мую гр уп пу, например, гидролити чески отщеп ляемый метильный, этиль ный, пропильный или бутокси метильный оста ток или удаляе мую восста новлением бензильную или ди фенилметильную гр уп пу с незамещён ными или замещён ными, фенильными кольцами, целесообразно в присутствии основного аген та конденсации или его со ли подвергают взаи модействию (VII) в которой R1, R2, Rа и n имеют вышеназванные значения, или альтернативно для случая, когда Х означает во дород, а R1 означает метил, 2 39136 w-галогеналкановых кислот (Наl-(СН2)n-СОО-алкил) с двумя эквивалента ми метилметаллосоединения, причём эфир реагирует че рез кетон с последующим образованием третичного спирта путём введения двух метильных остатков. Подобным образом эфиры w-гидроксикарбоновой кислоты с незащищён ной или защи щённой гидроксильной группой, например, в виде тетрагидропиран-2илового или метоксиметилового эфиров или, в случае необхо димости, в ви де лактона как циклического сложного эфира, действием метилметаллосоединений могут быть превращены в диолы, из которых путём селективной этерификации первичной гидроксильной функции галогенидами или ангидридами сульфо новой кислоты или фосфорной кислоты могут быть получе ны активные алкилирующие средства формулы III. Реакция взаимодействия дизамещённых производных ксанти на формулы II с упомянутыми алкилирующими средствами формул III, V или VIII обычно осуществляется в инертном по отношению к реагентам растворителе или диспергирующем агенте. В качестве таковых, прежде всего, подходят диполярные, апротонные растворители, например, формамид, диметилформамид, диметилацетамид, N-метилпирролидон, тетраметилмочевина, гексаметилфосфотриамид, диметилсульфоксид, ацетон или бутанон; также могут применяться спирты, такие, как метанол, этиленгликоль и его моно- или диалкиловые эфиры, содержащие от одного до четырех атомов углерода в алкильной группе, этанол, пропанол, изопропанол и различные бутанолы; углеводороды, такие, как бензол, толуол или ксилол; галогенированные углеводороды, такие, как дихлорметан или хлороформ; пиридин, а также смеси названных растворителей с водой. Реакции алкилирования целесообразно осуществлять в присутствии щелочного агента конденсации средства. Для этого подходят, например, гидроокиси, карбонаты, гидриды, алкоголяты ще лочных или щё лочноземельных металлов и органические основания, такие, как триалкиламин, триэтил- или трибутиламин, четвертичные гидроокиси аммония или фосфо ния и сшитые смолы с фиксированными в случае необхо димости замещёнными группами аммония или фосфония. Однако производные ксантина могут применяться непосредственно в форме их отдельно полученных солей, например, солей щелочных, щё лочноземельных металлов или в случае необхо димости замещенных аммониевых или фосфо ниевых солей. Кроме того, дизамещённые соединения ксантина можно удобно алкилировать как в присутствии вышеназванных неорганических конденсирующи х средств, так и в фор ме их солей с щелочными или щелочноземельными металлами при помощи так называемых катализаторов переноса фазы, например, третичных аминов, четвертичных аммониевых или фосфо ниевых со лей или также краунэфиров, предпочтительно в двухфазной системе в условиях катализа с переносом фазы. Подходящими, чаще все го, товарными катализаторами переноса фазы являются, в частности, соли тетраалкил- (содержащие от одного до четырех атомов углерода в алкильной группе) и метилтриоктиламмония и фосфо ния, метил-, миристил-, фе нил в) со сложным эфиром карбоновой кислоты формулы VIII, (С1 - C4) алкил - О - СО - (СН2)n , - Z (VIII) в которой n и Z имеют вышеназванные значения, до получе ния 1,3,7 - тризамещённого ксантина формулы IX, (IX) в которой Rа, R2 и n имеют вышеуказанные значения, который затем действием двух эквивалентов метилметаллосоединения, предпочтительно СНз-Li или СНз-МgНаl при двукратном восста новительном алкилировании сложноэфир ной функции превращают в 1,3,7-тризамещённый ксантин формулы X, (X) в которой R2, Ra и n имеют вышеназванные значения, и наконец путём удаления группы Ra из промежуточного соединения формулы IV, VII или Х получают ксантин фор мулы I согласно изобретению. Применяемые здесь в качестве исходных соединений 3,7 - дизамещён ные ксантины формулы II и алкилирующие средства фор мулы III, V и VIII большей частью известны или могут быть легко получе ны известными в литературе методами. Так, третичные спирты фор мулы III могут быть, например, получе ны металлоорга ническим синтезом, с помощью которого сте рически не затруднённые галоидокетоны формулы Наl-(СН2)n-СО-СН2X преобразовывают так называемой реакцией построения с использованием восстановительного алкилирования карбонильной группы алкилметаллосоединениями R1-M, в которых М означает металл, главным образом, магний, цинк или литий, иногда в форме алкилмагнийга логенидов R1MgHal (соединения Гриньяра) или алкиллитийсоединений R1-Li в обычных условиях. Аналогичное преобразование галоидокетонов фор мулы Hal-(CH 2)n-CO-R1 метилмагнийгалогенидами или метиллитием также приводит к соединениям формулы III, в которой Х означает водород. Удобный подход к соединениям формулы III, в которой R1 представляет собой метил, а Х означает атом водорода, даёт также реакция алкиловых эфиров 3 39136 и бензил-триалкил-(содержащие от одного до четырех атомов углерода в алкильной группе) и цетилтриметиламмония, а также алкил-(содержащий от одного до двенадцати атомов углерода) и бензилтрифенилфосфониевые соли, причём, как правило, те соединения, которые имеют более объёмный и более симметрично построенный катион, оказываются более эффективными. В общем, в вы шеописанных способах процесс проводится при температуре реакции между 0°С и точкой кипения, используемой в каждом случае реакционной среды, предпочтительно между 20 и 130°С, в случае необходимости при повышенном или пониженном давлении, но обычно при атмосферном давлении, причём время реакции может составлять от менее одного часа до нескольких часов. При взаимодействии ксантинов VI и IX, имеющих в положении 1 функциональные группы, с металлоорганическим соединением процесс происходит та ким же образом, как и при получении используемых в качестве алкилирующих средств третичных спиртов согласно формуле III. Так, восста новительное алкилирование кетонов VI или эфиров IX может осуществляться, например, алкилкалий-, алкилнатрий-, алкилитий-, алкилмагний-, алкилцинк-, алкилкадмий-, алкилалюминийи алкилоловосоединениями. Также применимы рекомендованные в последнее время алкилтитановые и алкилциркониевые соединения. Так как, однако, алкилметаллосоединения натрия и калия вследствие их высокой реакционной способности склонны к побочным реакциям, а аналогичные соединения цинка и кадмия относительно инертны, обычно предпочитают соединения алкиллития и алкилмагния (соединения Гриньяра). Сильно нуклеофильные металлорганические соединения очень чувствительны к гидролизу и окислению. Их использование требует работы в безводной среде, в случае необходимости - в атмосфере защитного газа. Обычными растворителями или диспергаторами являются, прежде всего, те, которые также подхо дят и для получе ния алкилметаллосоединений. В качестве таковых речь прежде всего идёт о просты х эфирах с одним или несколькими эфирными атомами кислорода, например, диэтиловом, дипропиловом, дибутиловом или диизоамиловом эфирах, 1,2-диметоксиэтане, тетрагидрофуране, диоксане, тетрагидропиране, фуране и анизоле и алифатических или ароматических углеводородах, та ких, как петролейный эфир, циклогексан, бензол, толуол, ксилол, диэтилбензол и тетрагидронафталин; также могут быть с успехом использованы третичные амины, такие как триэтиламин, или диполярные апротонные растворители типа гексаметилфосфотриамида, а также смеси названных растворителей. При взаимодействии карбонильных соединений VI или IX с соединениями Гриньяра формулы R1-MgHal можно также успешно проводить процесс таким образом, что металлоорга ническое соединение помещают в простой эфир и прибавляют к нему по каплям кетон или сложный эфир в виде раствора в дихлорметане или 1,2- дихлорэтане. Часто целесообразна добавка бромистого магния, который из-за своего участия в комплексообразном циклическом переходном состоянии мог бы повышать нук леофильность металлоорганического соединения. Присоединение кетона или сложного эфира к металлоорганическому соединению происхо дит, как правило, при температурах между -20°С и 100°С, предпочти тельно между 0°С и 60°С или при комнатной температуре без внешнего охлаждения, причём алкилметаллосоединение обычно применяют в незначительном избытке. Затем замещение обычно завершается кратковременным нагреванием с обратным холодильником, для чего, как правило, бывает достаточно промежутка времени от нескольких минут до нескольких часов. Разложение образовавше гося алкоголята осуществляют предпочтительно водным раствором хлористо го аммония или разбавленной уксусной кислотой. Снятие отщепляемой группы R1 из соединений формул IV, VII и Х при образовании ксантинов формулы I согласно изобретению осуществляют в стандартных условиях, которые прежде всего были разработаны в рамках те хнологии защитных групп в синтезах алкалоидов и пептидов и, следовательно, могут быть в значительной степени известны заранее. Затем при необхо димости, предпочтительно редуктивно, отщепляется замещающая в фенильном кольце бензильная или дифенилметильная группа. Наряду с хи мическим способом восстановления, в частности, бензильного соемнения натрием в жидком аммиаке, преимущественно осуществляют элии нирование обеих вышеназванных аралкильных гр упп путём каталитического гидрогенолиза с помощью катали затора из благородного металла, причём часто заменителем молекулярного во дорода оказывается фор миат аммония как донор водорода. При этом реакционной средой служит обычно низший спирт, в случае необхо димости, с добавлением муравьиной кислоты или даже аммиака; апротонный растворитель, та кой, как диметилфор мамид или особенно ледяная уксусная кислота; но также могут применяться их смеси с во дой. Подходящи ми катализаторами гидрирования, прежде всего, являются палладиевая чернь и палладий на активированном угле или сульфа те бария, в то время, как другие благородные металлы, такие, как платина, родий и рутений из-за конкурирующей реакции гидрирования кольца часто предpасполагают к побочным реакциям и поэтому используются только в крайнем случае. На практике гидрогенолиз проводится при температурах между 20°С и 100°С при атмосферном давлении или предпочти тельно при слегка повышен ном давлении до примерно 10 бар, причём, как правило, для реакции требуе тся время от нескольких минут до нескольких ча сов. 1,3,7-Tризамещённые ксанти ны формул IV, VII и X, содержащие в качестве Ra алкоксиметильную гр уппу, представляют собой O,N- ацетали и вследствие этого легко расщепляются в обычных условиях кислого гидролиза. Предпочтительными остатками являются, например, метоксигруппа, этоксигруппа, пропоксигруппа и бутоксиметильная груп па. Реакция преимущественно проводится при нагревании в разбавленных минеральных кислотах, та ких, как соляная или серная кислота, в слу 4 39136 чае необхо димости, с добавлением ледяной уксусной кислоты, диоксана, тетрагидрофура на или низшего спирта в качестве агента растворения. Иногда используют также перхлорную кислоту или органические кислоты, такие как трихлоруксусная, муравьиная и уксусная кислоты, в со четании с каталитическими количествами минеральных кислот. Расщепление эфирной группы может быть в принципе проведено также с помощью кислот Льюиса, таких, как бромистый цинк и тетрахлористый титан, в безводной среде, предпочтительно в дихлорметане или хлороформе. При расщеплении в растворе минеральной кислоты температура реакции должна быть выбрана так, чтобы не происходило никакой заметной дегидратации находящейся в положении 1 третичной гидроксиалкильной группы; поэтому она не должна, как правило, превышать 60°С. Соединения формулы I депротонируются в положении 7 и поэтому с веществами основного ха рактера образуют со ли и сольваты. Под ними подразумеваются фармацевтически приемлемые соли щелочных и щёлочноземельных металлов и соли и сольваты с органическими основаниями, например, этилендиамином, или основными аминокислотами: лизином, орнитином и аргинином. Таким образом, изобретение касается также фармакологически переносимых солей и/или сольватов 1,3 -диалкилксантинов согласно формуле (I). Третичные 1-(гидроксиалкил)-3-алкилксантины формулы (I) содержат один асимметрический атом углерода, когда Х означает гидроксил или Х означает во дород, a R1 означает этил. Та ким образом, эти соединения могут существовать в стереоизомерных формах. Как уже указывалось выше, предлагаемые производные ксантина общей фор мулы (I) обладают уменьшающей паталогическую ги перактивность эозинофильных гранулоцитов активностью и поэтому они могут представлять собой активное вещество фар мацевти ческой композиции соответствующего назначения. Таким образом, вторым объектом изобретения является фармацевтическая композиция, обладающая уменьшающей патологическую гиперактивность эозинофильных гранулоцитов активностью, которая помимо, по меньшей мере, одной целевой добавки содержит, по меньшей мере, одно производное ксантина вышеприведенной общей формулы (I) и/или его стереоизомер и/или его фи зиологически переносимую соль в эффективном количестве. Предлагаемая фармацевтическая композиция может иметься в виде стандартных жидких или твердых ле карственных форм для орального, ректального, локального, парентерального или ингаляционного применения при заболеваниях с патологически повышенной активностью эозинофильных гранулоцитов. Подхо дящими твёрдыми или жидкими лекарственными формами являются, например, грануляты, порошки, таблетки, драже, (микро)капсулы, свечи, сиропы, эмульсии, суспензии, лосьоны, кремы, мази, гели, аэрозоли, капли или инъекционные растворы в ампулированной форме, а также препараты с замедленным высвобождением биологически активного вещества, при изго товлении которых обычно используются вспомогательные средства, такие, как носители, разрыхлители, связующие вещества для покрытий, для набуха ния, для смазки, вкусовые вещества, подсластители или вещества, способствующие растворению. В качестве часто применяемых вспомогательных ве ществ сле дует назвать карбонат магния, диоксид титана, лактозу, маннит и другие сахара, тальк, молочный белок, желатин, крахмал, витамины, целлюлозу и её производные, животные и растительные масла полиэтиленгликоль и растворители, как, например, дистиллированная вода, спирты, гли церин и многоатомные спирты. Препараты предпочтительно изготавливаются и назначаются в дозированных единицах, причём каждая единица содержит в качестве активного компонента определённую дозу соединения формулы (I). В твёр дых ле карственных формах, та ких, как таблетки, капсулы и суппозитории, эти дозировки могут составлять вплоть до 1000 мг, однако предпочтительно от 100 до 600 мг, а у инъекционных растворов в ампулированной форме вплоть до 300 мг, но предпочтительно от 20 до 200 мг. Для лечения взрослых пациентов определены - по эффективности воздействия соединений формулы (I) на людей - суточные дозы от 100 до 2000 мг биологически активного вещества, предпочти тельно от 300 до 900 мг, при оральном применении и от 10 до 500 мг, предпочтительно от 20 до 200 мг, при внутривенном введении. Однако при некоторых обстоятельствах, могут быть уста новлены более высокие или более низкие суточные дозы. Получение суточной дозы может дости гаться как путём однократного приёма в ви де одной единственной дозировочной единицы, так и несколькими, но более мелкими дозировками, а также путём многократного приёма раздробленных доз через определённые интервалы времени. И наконец, при производстве вышеупомянуты х галеновых го товых форм производные ксантина формулы I, если потребуется, могут использоваться вместе с другими подходящими биологически активными веществами, например, антигистаминными, антихолинэргическими и b 2-миметическими средствами, ингибиторами фосфодиэстеразы, фосфолипазы А2 и ли поксигеназы, антагониста ми ФАТ и лейкотриена, кортикостероидами, хромоглицином, недокромилом, а также циклоспорином А. Получение производных ксанти на общей формулы (I) поясняется следующими примерами. Пример 1. 1-(2-гидрокси-2-метилпропил)-3-метилксантин а) 1 -хлор-2-гидрокси-З-метилпропан К 44,9 г (0.6 моль) хлористого метилмагния в виде 20 % -ного раствора в тетрагидрофура не и 200 мл сухого диэтилового эфира прибавляли по каплям при перемешивании при температуре от 0 до 5°С раствор 46,3 г (0,5 моль) 1-хлор-2-пропанона в 50 мл безводного диэтилового эфира. Затем перемешивали сначала 1 час при комнатной температуре и потом ещё 1 час при кипячении с обратным холодильником, образовавшийся третичный алкоголят разлагали добавлением 50%-ного водно 5 39136 го раствора хлористого аммония, эфирный слой отделяли, а водный слой экстрагировали эфиром. Объединённые эфирные экстракты последовательно промывали водными растворами бисульфи та натрия и бикарбоната натрия, а также небольшим количеством воды, высуши вали над сульфа том натрия, фильтровали, концентрировали при пониженном давлении и жидкий остаток подвергали фракционной перегонке. Выход: 31,1 г (57,3 % от теор.) Т. кип.: 125-127°С С4Н9СlO (М.в. 108,6) Соединение может быть также получе но аналогичным образом из метилового или этилового эфиров хлоруксусной кислоты и двукратного молярного количества метилмагнийхлорида с выходами около 60% от теор. б) 7-бензил-1 -(2-гидрокси-2-метилпропил)3-метилксантин Смесь из 25,6 г (0,1 моль) карбоната калия и 11,9 г (0,11 моль) третичного спирта со стадии а) в 500 мл диметилформамида нагревали 8 часов при перемешива нии и температуре от 110°С до 120°С, затем в горячем виде фильтровали и упаривали при пониженном давлении. Оста ток извлекали хло роформом, промывали сначала 1н. раствором едкого натра, затем водой до нейтральной реакции, высуши вали, отгоняли растворитель в вакууме и твёрдый остаток перекристализовывали из этилацетата с добавлением петролейного эфира. Выход: 26,6 г ( 81,0% от теор.) Т.пл. 115-117°С С17Н20N4 O3 (М.в. 328,4) Анализ: Вычислено: С 62,18% Н 6,14% N 17,06% Найдено: С 62,60% Н 6,18% N 17,00%. Соединение было также получе но способом, по которому 7-бензил-З-метилксантин сначала в вышеописанных условиях взаимодействием с 1хлор-2-пропаноном либо метиловым или этиловым эфиром хлоруксусной кислоты превращали в 7-бензил-3-метил-1-(2-оксопропил)-ксантин или 7бензил-1-мет (или эт)оксикарбонилметил-3-метилксантин и затем оксопропильную или алкоксикарбонилметильную боковую цепь восстановительно метилировали метилмагнийхлоридом в безводном диэтиловом эфире аналогично описанному в стадии а) в) 1-(2-гидрокси-2-метилпропил)-3-метилксантин 13,1 г (0,04 моль) 7-бензилксантина со стадии б) в 200 мл ледяной уксусной кислоты гидрировали при встряхи вании над 1,5 г палладия (10%) на активированном угле при 60°С и 3,5 бар в течение 100 часов. После охлаждения продували азотом, отфильтровывали катализатор, концентрировали при пониженном давлении и твёрдый оста ток перекристализовывали из этилацетата. Выход: 7,8 г (81,8 % от теор.) Т.пл.: 215-217°С С10Н14N4 О3 (М.в. 238,3) Анализ: Вычислено: С 50,41% Н 5,92% N 23,52% Найдено: С 50,10% Н 5,90% N23,40%. Пример 2. 3-Этил-1-(2-гидрокси-2-метилпропил)-ксантин а) 7-бензил-З-этилксантин К суспензии 90 г (0,5 моль) 3-этилксантина в 500 мл метанола добавляли 20 г (0,5 моль) растворенного в 200 мл воды едкого натра и перемешивали 1 час при 70°С, прибавляли по каплям при той же температуре 69,6 г (0,55 моль) бензилхлорида и выдерживали реакционную смесь 3 часа при температуре между 70° и 80°С. Затем охлаждали, в хо лодном виде отфильтровывали на нутчфильтре, промывали продукт на нутч-фильтре водой, растворяли в 1000 мл горячего 1 н. едкого натра, фильтровали и с помощью 4 н. соляной кислоты медленно, при перемешива нии доводили до рН 9,5. Продукт кристаллизации отфильтровывали от ещё тёплого раствора, промывали безхлоридной водой и сушили в вакууме. Выход: 131 г (96,9 % от теор.) Т.пл.: 217-218°С С14Н14N4 O2 (М.в. 270,3) б) З-этил-1 -(2-гидрокси-2-метилпропил)ксантин Реакцией взаимодействия 7-бензил-З-этилксанти на со стадии а) с 1-хлор-2-гидрокси-2-метилпропаном из примера 1а) с образованием 7бензил-З-этил-1-(2-гидрокси-2-метилпропил)-ксантина C18H22N4O3 (М.в. 342,4); выход: 46,1% от теор.) и его последующим гидрогенолитическим дебензилированием (выход:97,9 % от теор.) в соответствии с примером 1в) был получен сырой конечный продукт, очищен ный перекристаллизацией из этанола. Т.пл.: 217-219°С C11H16N4 O3 (М.в. 252, 3) Анализ: Вычислено: С 52,37% Н 6,39% N 22,21% Найдено: С 52,19% Н 6,29% N 21,75%. Пример 3. 1-(3-гидрокси-3-метилбутил)-3-метилксантин а) 1-хлор-З-гидрокси-метилбутан. Соединение было получе но из метилмагниййодида и 1-хлор-З-бутанона (который может быть получен присоединением хлористого водорода к метилвинилкетону в диэтиловом эфире) или из метилмагнийхлорида и этилового эфира 3хлорпропионовой кислоты в дихлорметане как реакционной среде аналогично примеру 1а). Выход: 60 - 70 % от теор. Т. кип (18 мбар): 66 - 68°С С5Н11СIO (М.в. 122,6). б) 7-бензил-1 -(З-гидрокси-З-метилбутил)-Зметилксантин получен аналогично примеру 16) из 7-бензил-Зметилксантина и третичного спирта со ста дии а). Выход: 70 % от теор. Т. пл. 92 - 94°С С18H22 N 4О3 (М.в. 342,4) Анализ: Вычислено: С 63,14% Н 6,48% N 16,36% Найдено: С 63,10% Н 6,43% N 16,28% в)1-(3-гидрокси-3-метилбутил)-3-метилксантин Получен гидрогенолитическим дебензилированием продукта со стадии б) аналогично примеру 1в). Выход: 87,27с от теор. Т. пл.: 203 - 205°С С11Н16N4 О3 (М. в. 252,3) Анализ: Вычислено: С 52,37% Н 6,39% N 22,21% 6 39136 Найдено: С 52,13% Н 6,52% N 22,08% Пример 4. 3-этил-1-(3-гидрокси-3-метилбутил)-ксантин а) 7-бензил-3-этил-1-(З-гидрокси-З-метилбутил)-ксантин Получен аналогично примеру 16 из 7-бензил-З-этилксанти на (пример 2а) и 1-хлор-3-гидрокси-З-метилбутана (пример За). Выход: 71,8% от теории Т.пл.: 133-135°С C19H24N4 O3 (M. в. 356,4) б) 3-этил-1-(3-гидрокси-3-метилбутил)-ксантин Получен в соответствии с примером 1в) путем гидрогенолитического дебензилирования продукта со ста дии а). Выход: 88,2% от теор. Т.пл.: 241-243°С С19Н18N4 О3 (М.в. 266,3) Анализ: Вычислено: С 54,12% Н 68,1% N 21,04% Найдено: С 53,89% Н 6,86% N 21,03%. Пример 5. 1-(гидрокси-4-метилпентил)-3-метилксантин а) 7-бензил-3-метил-1-(4-оксопентил)-ксантин Сначала 38,4 г (0,15 моль) 7-бензил-З-метилксантина, 22,4 г (0,162 моль) карбоната калия и 26,7г (0,162 моль) этиленкеталя 1-хлор-4-пентанона в 600 мл диметилформамида аналогично описанному в примере 1б) были превращены в 7бензил-1-(4,4-этилендиоксипентил)-3-метилксантин, который без дальнейшей очистки подвергали кетальному расщеплению путём 2-часового нагревания с обратным холодильником в 600 мл 1н. соляной кислоты. Образовавшийся кетон после нейтрализации смеси концентрированным раствором едкого натра был извлечён хлороформом и хлороформный экстракт был промыт водой, высушен над сульфатом натрия и упарен досуха под пониженным давлением. Выход: 50,4 г (98,7% от теор.) Т.пл.: 104-105°С C18H20N4 O3 (М.в. 340,4) б) 7-бензил-1-(4 гидрокси-4-метилпентил)-3метилксантин Смесь из 9 г (0,12 моль) метилмагнийхлорида в виде стандартного 20% раствора в тетрагидрофуране и 300 мл дихлорметана была охлаждена до -25°С и затем по каплям добавлена к раствору 34 г (0,1 моль) продукта со стадии а), при этом температура повышалась до 20°С. Перемешивание продолжали ещё один час при комнатной температуре, затем был прибавлен насыщенный раствор хлористого аммония, органический слой был отделён, водный слой несколько раз экстрагирован дихлорметаном, объединённые дихлорметановые экстракты были промыты водой, сушены и упарены, а твёрдый остаток перекристаллизован из этилацетата. Выход: 28,3 г (79,4 % от теор.) Т.пл. 132-133°С С19Н24 N 4О3 (М.в. 356,4) в) 1 -(4-гидрокси-4-метилпентил)-3-метилксантин Получен в соответствии с примером 1в) гидрогенолитическим дебензилированием продукта со стадии б). Выход: 65,9% от теор. Т.пл. 188-189°С тин С12Н18 N 4О3 (М.в. 266,3) Анализ: Вычислено: С 54,12% Н 6,81% N 21,04% Найдено: С 53,86% Н 6,88% N 20,93% Пример 6. 3-этил-1-(4-гидрокси-4-метилпентил)-ксан а) 7-бензил-3-этил-1-(4-оксопентил)-ксантин Получение осуществляют аналогично описанному в примере 5а), с использованием в качестве исходного ве щества 7-бензил-З-этил-ксантина из примера 2а) Выход: 82,4 % от теор. Т.пл.: 139-141°С С19Н22N4 О3 (М.в. 354,4) б) 7-бензил-3-этил-1-(4-гидрокси-4-метилпентил)-ксантин. Продукт реакции стадии а) был введен во взаимодействие с метилмагнийхлоридом аналогично описанному в примере 5б). Выход: 81,1 % от теор. Т.пл.: 155-157°С С20Н26N4 О3 (М.в. 370,5) Анализ: Вычислено: С 64,84% Н 7,07% N 15,12% Найдено: С 64,95% Н 7,18% N 15,10% в) З-этил-1-(4-гидрокси-4-метилпентил)-ксантин. Соединение получе но путём гидрогенолитического дебензилирования продукта реакции стадии б), аналогично примеру 1в). Выход: 71,3 % от теор. Т.пл.:214-216°С C13Н20N4 О3 (М.в. 280,3) Анализ: Вычислено: С 55,70% Н 7,19% N 19,99% Найдено: С 55,50% Н 7,20% N 20,23% Пример 7. 1-(5,6-дигидрокси-5-метилгексил)-3-ме тилксантин а) 1 -хлор-5,6-изопропилиденокси-5-метилгексан К продутой азотом смеси из 264 г (1,2 моль) триметилсульфо ниййодида и 28,8 г (1,2 моль) гидрида натрия прибавляли по каплям в течение 10 минут при перемешивании при 40°С 1000 мл безводного .диметилсульфоксида. По окончании выделения газа (около 2-х часов) прибавляли по каплям раствор 134,6 г (1 моль) 1-хлор-5-гексанона в 30 мл диметилсульфоксида. Перемешива ли два часа при комнатной температуре, при охлаждении льдом медленно смешива ли с 500 мл ледяной воды и образовавшийся 1-хлор-5,6-эпокси-5-метилгексан экстрагировали диэтиловым эфиром (выход: 130,5 г (87,8% от теор.); С7Н13СlO (М. в. 148,6)). Для гидролитического расщепления эпоксигидрина его перемешива ли в смеси из 60 мл воды, 600 мл тетрагидрофурана и 1 мл 70% перхлорной кислоты в те чение 5 дней при комнатной температуре. Затем нейтрализовывали содовым раствором, отгоняли тетрагидрофуран и образовавшийся 1-хлор-5,6-дигидрокси-5-метилгексан экстрагировали хлороформом (выход: 124,8 г (85,3% от теор.); C7H15CIO2 (М.в. 166,6)). Затем обычным образом действием 2,2-диметоксипропана в ацетоне в условиях кислого катализа диол был превращён в диоксолан. Выход: 67,2% от теор. 7 39136 Т. кип. (0,5 бар): 84 - 86°С С10H19СlO2 (М.в. 206,7) б) 1 -(5,6 -ди гидрокси-5-метилгeксил)-3 -метилк сантин Диол со ста дии а) подвер гали взаимодействию с 7-этокси метил-З-ме тилксанти ном аналогично описанному в примере 1б) с количественным образованием 7-этоксиметил-1(5,6-и зопропилидендиокси-5-метилгексил)-3-метилк сантина (С19Н 30N 4O 5, М.в. 394,5), из которого п утём кислого ги дролиза с одновременным раскрытием диоксоланового цик ла и отщеп лением нахо дящей ся в по ложении 7-этоксиметильной гр уп пы получи ли конечный продукт. Для это го 19 ,7 г (0 ,05 моль) сое динения ксантина в смеси из 300 мл 1 н. со ляной кислоты и 30 мл ледяной уксусной кислоты на гревали 15 часов при пе ремеши ва нии до 70°С, после о хлаждения подще лачивали карбонатом натрия и промывали хло роформом, затем нейтрализовыва ли 1 н. соляной кисло той и экстрагировали хлорофор мом. Оста ток от упаривания после фильтрации через колонку с си ликагелем с использованием в качестве подвижной фа зы смеси хлороформ/ме танол (10:1) перекристаллизовы вали из этила цетата . Вы ход: 11 ,5 г (77,6 % о т теор .) Т.пл.: 181 -182°С С13Н 20N4 O 4 (М.в. 296 ,3) Анализ : Вычислено: С 52,69% Н 6 ,80% N 18,91% Найдено: С 52,46% Н 6 ,90% N18 ,66%. Приме р 8 . 1-(5-ги дрокси-5-метилгеп тил)-3-ме тилксантин 7-Бензил-3-метил-1 -(5-ок согексил)-ксантин, полученный из 7-бензил-З-ме тилксанти на и 1-хлор-5-гексанона аналоги чно примеру 1 б), восста новитель но эти лирова ли по кето груп пе этилмагнийхлоридом в соответствии с примером 5б) и образовавший ся при этом 7-бензил1-(5-гидрокси-5-метилгептил)-3-метилксантин дебензилировали в условия х при мера 1 в). Вы ход: 70,2% о т теор. Т.пл.: 169-170°С С14Н 22 N4 О 3 (М. в. 294,4) Анализ : Вычислено: С 57,13% Н 7 ,53% N19 ,03% Найдено: С 56,90% Н 7 ,55% N18 ,96% Приме р 9 . 3-этил-1-(5 -гидрокси-5-метилгексил)-к сантин 7-Бензил-3-этил-1 -(5-гидрокси-5-ме тилгексил)-к сантин, по лучен ный из 7-бен зил-3-этилксанти на (пример 2а) и 1-хлор-5-ги дрокси-5-метилгексана согласно примеру 1б) с выходом 65% от теор . (C 21H 28N 4О 3; М.в. 384,5 ; т.пл.: 112 114°С), гидрогено лити чески дебензилиро вали с использованием фор миата ам мония как источника водорода. Для это го 3,84 г (0 ,01 моль) бензильного произ водного и 1,0 г (0,016 моль) формиата ам мония в 30 мл этано ла перемешива ли несколько дней над 2 г палла дия (10%) на активиро ванном угле при 35°С, при этом дало хороший рез ульта т постепенное внесение дополнительного количества фор миата аммония до обще го его количества 4,4 г (0 ,07 моль). Реакционную смесь филь тровали , фильтрат упари вали, оста ток переводили в раствор карбоната натрия, промывали хло роформом, водный слой доводи ли со ляной кислотой до рН 4 , про дукт встряхива ли с хло рофор мом и после вы сушивания и упари вания перикристаллизовывали из этила цетата. Вы хо д: 2,0 I- (67,9 % о т теор .) Т.пл.: 180-182°С С14Н 22 N4 О 3 (М.в. 294 ,4) Анализ : Вычислено: С 57,12% Н 7 ,53% N 19,04% Найдено: С 56,77% Н 7 ,66% N 18,93% Приме р 10 . З-этил-1 -(5-гидрокси-5-ме тилгептил)-ксантин 7-бензил-З-этилксантин (пример 2а) и 1хлор-5-гексанон аналогично примеру 1б) превращали в 7-бензил-3-этил-1-(5-оксогексил)-ксантин (C20H24N4 О 3; М.в. 368,4; вы ход: 81,7% от теор.; т.пл.: 123-125°С). Восстановительное этили рование кетогруп пы этилмагнийхлоридом согласно примеру 5б) привело к 7-бензил-3-этил-1-(5-гидрокси-5-метилгептил)-ксантину (C22H 30N 4 O3 , M.в. 398,5; вы ход: 86 ,9% от теор .; т.пл.: 93-94°С), который ги дрогенолити чески дебензилировали аналогично примеру 9. Ко нечный продукт пе рекристаллизовы вали из этано ла. Вы хо д: 66 ,5 % от теор. Т.пл.: 165-166°С C15H 24N4 О 3 (М.в. 308 ,4) Анализ : Вычислено: С 58,42% Н 7 ,84% N 18,17% Найдено: С 58,30% Н 8 ,05% N 18,33% Приме р 11 . 1-(6-ги дрокси-6-метилгеп тил)-3-ме тилксантин 7-Бензил-1-(6-гидрокси-6-ме тилгептил)-3метилк сантин (C 21H28N 4О 3 , М.в. 384 ,5; т.пл.: 8385°С, получен ный с вы хо дом 77,5 % из 7-бензил-З-ме тилксанти на и 1-бром-6-гидрокси-6-метилгепта на аналогично примеру 1б), гидрогенолити чески дебензилировали согласно примеру 1в). Вы хо д: 82,2% о т теор. Т.пл.: 166-167°С С14Н 22 N4 О 3 (М.в. 294,4 ) Анализ : Вычислено: С 57,12% Н 7 ,53% N 19,04% Найдено: С 56,82% Н 7 ,74% N 19,01% . Приме р 12 . З-этил-1 -(6-гидрокси-6-ме тилгептил)-ксантин В соответствии с при мером 12 осуществлена после дователь ность реакций с 7-бен зил-3этил-ксанти ном из примера 2а), причём гидрогенолити ческое дебензилирование фор миатом аммония проводи ли аналогично примеру 9. Выход: 72,4 % о т теор . Т.пл. 163 -165°С C15H 24N4 O 3 (М.в. 308 ,4) Анализ : Вычислено: С 58,42% Н 7 ,84% N 18,17% Найдено: С 57,83 % Н 7,64% N 18 ,04% Фармакологические опыты и его результаты 1. Ин гибир ующая ак тивность про тив провоспалительных ме диаторов реакции ранней фа зы Ингибир ующая акти вность соединений согласно фор муле I проти в провоспалительных 8 39136 (концентрация в ванне : 3 х 10-7/мл), в о тсутствие (контрольный опыт) или в присутствии испытуемых ве ществ до водили до сокращения. Лёгкое разрезали вдоль на 2 - 3 по лосы, с которы ми поступали так же, как это описа но выше, однако нагруз ка на растя жение составляла 1 г и сокращение вы зыва лось ФАТ или ЛТД 4 при концентрации в ванне 10-9 или 10-8 г/мл. Каждый опыт включал в се бя параллельное исследова ние 6 за гото вок орга нов (n =6). Оцен ку активности пре парата осуще ствляли с помощью значений ИК50 , т.е. той концентрации, вы раженной в мк/мл, при которой вызванные в контрольном опыте сок ращения ор гана уменьша лись наполовин у. Ре зульта ты обобще ны в таблице 1. медиа торов ран ней фа зы - гиста мина, ФАТ и лейкотриена Д4 (ЛТД4) бы ла иссле дова на на изолированных се гмента х ор ганов ды ха тельных путей морских сви нок-альбиносов, при чём параметром измерения служило инги бирование провоцир уе мых этими медиатора ми сокращений . Для проведения опытов каждый раз использовались све жепрепарированные органы самцов. Тра хею разрезали по кольцам, из которых в каждом случае 5 хря щевы х колец трахеи, соединённых шелковыми нитями в цепочку, подвешива ли под нагрузкой на растя жение 0,5 г в ванну для орга нов с нагретым до 37°С и пробарботированным карбогеном раство ром Тироде и путём добавления дигидрохлорида гиста мина Таблица 1 Ингибирующая активность против провоспалительных медиаторов ранней фазы Соединение из примера Антиконстрикторное действие (ИК50 в мг/мл) Гистамин трахея ФАТ лёгкое 4 10 1-3 5 30 3 10 6 30 3 1-3 7 10-30 6 10 8 10-30 10 10-30 11 3-10 3-6 6-10 12 10-30 1 Пентоксифиллин 1) 30-60 3 30-60 Торбафиллин 2) 60 3-6 10-30 1) производные ксантина, описанные в вышеприведенном ближайшем аналоге пентоксифиллин = 3,7-диметил-1-(5-оксогексил)-ксантин торбафиллин = 3-метил-7-этоксиметил-1-(5гидрокси-5-метилгексил)-ксантин 2) Ингибирование индуцированной антигеном реакции ранней фазы у пресен-сибилизированных морских свинок. Морские свинки - альбиносы обоего пола с ве сом тела от 180 до 220 г были сенсибили зированы путём подкожного вве дения каждый раз по 1 мг оваль бумина (0,1%-ный раствор в фи зиологи ческом раство ре хло ристо го натрия) в течение двух дней подряд. Опы т про води ли че рез 20 дней по методу Kon ze tt и Rossler (Arch . e xp. Path. und Pha rmak. (1940) 195 : 75). Для этого живо тных нар котизи ровали пен тобарбиталом, делали им искусствен ное дыхание , для иск лю ЛТД4 лёгкое чения самопроизволь ного дыхания применяли алькуроний-хлорид и де лили и х на гр уп пы по 6 живо тных в каждой. П утём вн утривенного введения овальбумина в качестве ан ти гена в до зе 1мг/кг вы зыва ли продолжитель ный приступ астмы, как резуль тат острого бронхо спазма, индуцированного медиа торами в рамках астматической ранней реакции, ин тенсивность которо го характе ризовали амплитудой сокращений в торакограмме. Испытуе мые препараты применяли каждый раз внутривенно за 15 минут до провокации антигеном. Вместо него животные контрольной группы получали чистый 0,9%-ный раствор хлористого натрия. Для оценки действия препарата было установлено количество животных соответствующей группы, у которых астматическая реакция контрольных особей была снижена, по крайней мере, на 40%. Результа ты обобще ны в таблице 2. 9 39136 Ингибирование индуцированной анти генами реакции ранней фазы у морских сви нок Таблица 2 Защищённые животные поcле внутривенного введения Соединение из примера 10 мг/кг 25 мг/кг количество доля в % количество доля в % 2 2/6 33 4/6 67 4 1/6 17 3/6 50 7 3/6 50 3/6 50 8 4/6 67 5/6 83 11 3/6 50 4/6 67 Пентоксифиллин 1) 1/6 17 2/6 33 Торбафиллин 1) 0/6 0 0/6 0 1) см. пояснение к таблице 1. Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 10
ДивитисяДодаткова інформація
Назва патенту англійськоюPharmaceutical composition decreasing pathological hyperactivity of eosinophilic granulates
Автори англійськоюHebert Ulrich, Anagnostopulos Hiristo, Kroegel Claus, Capp Alexander
Назва патенту російськоюФармацевтическая композиция, снижающая патологическую гиперактивность эозинофильных гранулятов
Автори російськоюГеберт Ульрих, Анагностопулос Хиристо, Крегель Клаус, Капп Александер
МПК / Мітки
МПК: A61K 31/522, A61P 11/06
Мітки: зменшує, фармацевтична, яка, композиція, гіперактивність, похідні, патологічну, активність, еозинофільних, ксантину, має, гранулоцитів
Код посилання
<a href="https://ua.patents.su/10-39136-farmacevtichna-kompoziciya-yaka-maeh-aktivnist-shho-zmenshueh-patologichnu-giperaktivnist-eozinofilnikh-granulocitiv-ta-pokhidni-ksantinu.html" target="_blank" rel="follow" title="База патентів України">Фармацевтична композиція, яка має активність, що зменшує патологічну гіперактивність еозинофільних гранулоцитів, та похідні ксантину</a>
Попередній патент: Спосіб фракціонування розчину
Наступний патент: Одномодове оптичне волокно (варіанти)
Випадковий патент: Спосіб виробництва гарбуза закусочного замороженого












