Моноклональне антитіло, що інгібує хомінг кровотворних стовбурових клітин і розпізнає поверхневий антіген стромальної клітини селезінки, гібридома, яка його продукує
Формула / Реферат
1. Моноклональное антитело, ингибирующее хоминг кроветворных стволовых клеток и распознающее поверхностный антиген стромальной клетки селезенки, полученное с использованием клеток селезенки млекопитающего в качестве антигена.
2. Моноклональное антитело по п. 1, отличающееся тем, что относится к классу иммуноглобулинов G.
3. Моноклональное антитело по п. 1, отличающееся тем, что оно предназначено для лечения миелоцитной лейкемии.
4. Гибридома, образованная слиянием клетки селезенки крысы Wistar Imamich и клеточной линии миеломы мыши SP2/0-Agl4 и зарегистрированная под регистрационным номером FERM BP-4383 в Национальном институте биологической науки и человеческой технологии Агенства промышленной науки и технологии в Японии, продуцирующая моноклональное антитело по п. 1.
Текст
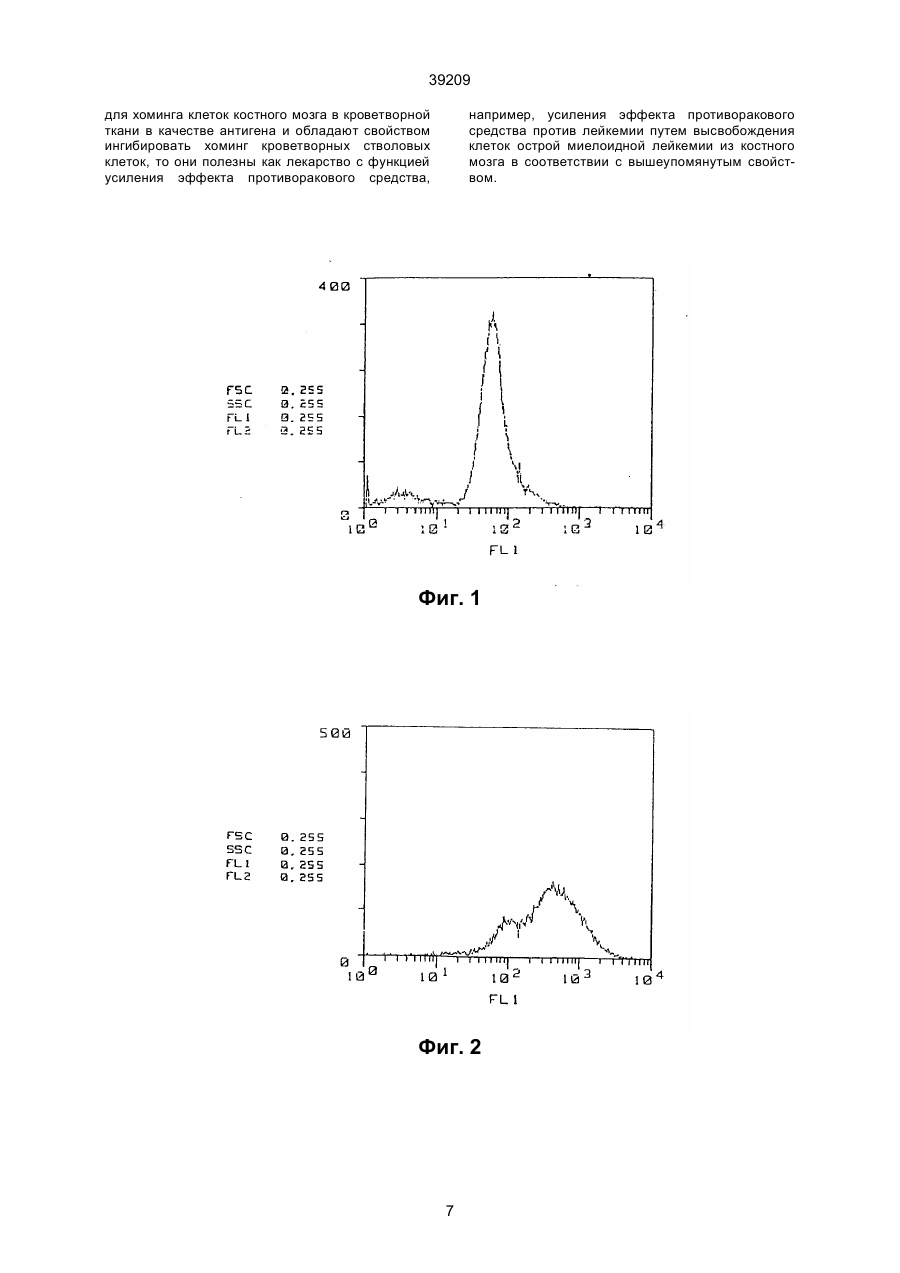
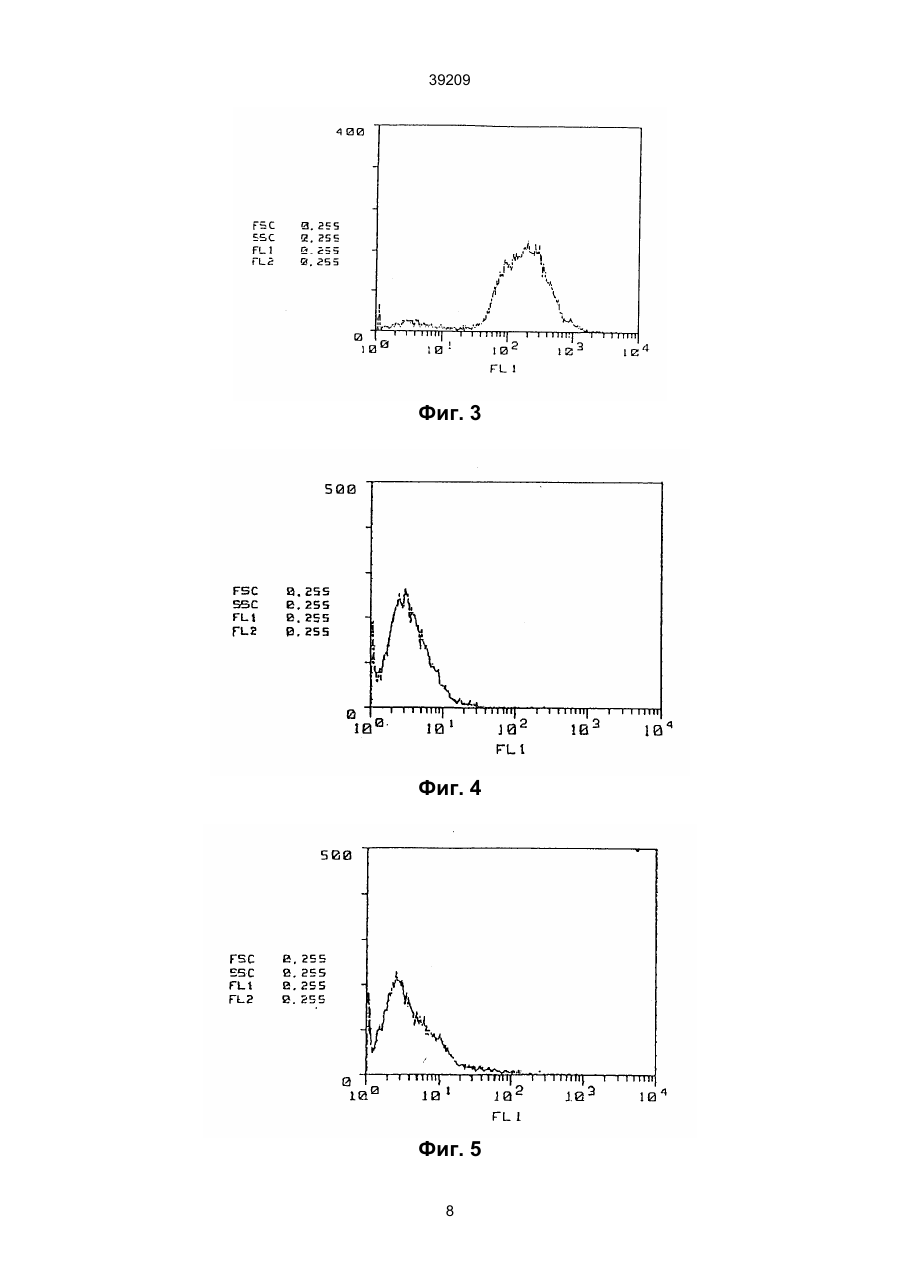
1. Моноклональное антитело, ингибирующее хоминг кроветворных стволовых клеток и распознающее поверхностный антиген стромальной клетки селезенки, полученное с использованием 39209 Поскольку при трансплантации костного мозга in vivo, когда вместе с клетками костного мозга пересаживаются клетки CF-1, обнаруживается поддерживающая возможность кроветворных стволовых клеток, было сделано предположение, что вышеупомянутая линия кроветворных стромальных клеток (клеток CF-1) представляет собой фактор сращивания клеток, позволяющий хоминг кроветворных стволовых клеток в кроветворной ткани. Однако, хотя некоторые стромальные клетки селезенки, обладающие поддерживающей способностью для кроветворных стволовых клеток были выведены в качестве клеточной линия CF-1 и были исследованы их цитологические характеристики, но особых антител, распознающих поверхностные антигены этих клеток, выделено не было, и их характеристики были практически неизвестны. В связи с этим, на основе приведенной выше информации о стромальных клетках селезенки и результатов исследований, авторы настоящего изобретения провели скрупулезное исследование с целью выделения особых антител, способных распознавать стромальные клетки селезенки, обладающие поддерживающей способностью для хоминга кроветворных стволовых клеток и вывели линию стромальных клеток селезенки, обладающих поддерживающей способностью для хоминга кроветворных стволовых клеток и в то же время создали препарат моноклонных антител, используя линию стромальных клеток селезенки в качестве антигена для иммунизации; в результате было получено новое моноклонное антитело, до сих пор не описанное. Кроме того, авторы изобретения обнаружили, что полученное моноклонное антитело распознает поверхностный антиген стромальной клетки селезенки, обладающей поддерживающей способностью для хоминга кроветворных стволовых клеток, и имеет свойство ингибировать хоминг кроветворных стволовых клеток, что завершило работу над данным изобретением. Описание изобретения. Объектом и целью настоящего изобретения является создание нового моноклонного антитела, распознающего поверхностный антиген стромальных клеток селезенки, обладающих поддерживающей способностью для хоминга кроветворных стволовых клеток, и имеющего свойство ингибировать хоминг кроветворных стволовых клеток. Кроме того, еще одной целью данного изобретения является получение гибридомы, вырабатывающей данное моноклонное антитело. Моноклонное антитело по настоящему изобретению является вновь открытым моноклонным антителом к поверхностному антигену стромальных клеток селезенки, обладающих поддерживающей способностью для хоминга кроветворных стволовых клеток; это антитело распознает стромальные клетки селезенки, принимающие участие в повышении кроветворной способности селезенки, и оно в высшей степени полезно в качестве вещества, ингибирующего хоминг кроветворных стволовых клеток. Между прочим, хоминг кроветворных стволовых клеток здесь означает, что сращивание кроветворных стволовых клеток вы зывается стромальными клетками кроветворной ткани, и эти клетки дифференцируются и размножаются как колонии CFU-S. Моноклонное антитело по настоящему изобретению в основном может быть получено как описано ниже. А именно, моноклонное антитело по настоящему изобретению может быть получено, например, путем использования стромальных клеток селезенки, взятых от животного, получавшего rGCSF, такие как клетки CF-1 (стромальные клетки селезенки), выведенные авторами настоящего изобретения в виде клеточной линии, в качестве антигена, иммунизации их обычным способом иммунизации, слияния иммунизированных клеток обычным способом клеточного слияния и клонирования слитых клеток обычным способом клонирования. В качестве способа получения моноклонного антитела по настоящему изобретению может служить предпочтительным примером способ, включающий использование вышеупомянутых клеток CF-1, выведенных авторами настоящего изобретения в виде культуры клеточной линии, как антигена [Blood, т. 80, 1914 (1992)], клеток соединительной плазмы (иммуноцитов) млекопитающего, иммунизированного антигеном, с клетками миеломы млекопитающего, например, мыши, клонирования полученных слитых клеток (гибридом), отбор клонов, вырабатывающих антитело, которое, согласно настоящему изобретению, распознает среди них вышеупомянутую клеточную линию, и культивирование их для извлечения целевых антител. Однако, этот способ является толькопримером, и в этом случае, например, могут использоваться не только упомянутые клетки CF-1, но также и клеточные линии, полученные так же, как в случае клеток CF-1, из стромальных клеток селезенки человека, для получения антител, требуемых для человеческих миелоидных клеток, таким же способом, как в случае вышеупомянутых клеток CF-1. В способе получения таких моноклонных антител виды млекопитающих, которые должны быть иммунизированы вышеупомянутыми антигенами, строго не ограничиваются; предпочтительно делать выбор, принимая в расчет соответствие клеткам миеломы, которые будут использоваться при слиянии клеток, и предпочтительнее использование мышей, крыс и хомяков. Иммунизация выполняется обычным способом, например, введением стромальных клеток селезенки, таких как вышеупомянутые клетки CF1, в брюшную полость млекопитающего путем инъекции. В особом случае, предпочтительно введение животному препарата в разбавленном виде или в виде суспензии в соответствующем количестве физиологического раствора с фосфатным буфером (PBS) или изотоническом растворе хлорида натрия несколько раз каждый месяц. Предпочтительно использовать клетки селезенки, извлеченные после последнего введения вышеупомянутых клеток в качестве иммуноцитов. В качестве клетки миеломы млекопитающих, как другой родительской клетки, сливаемой с вышеупомянутыми иммуноцитами, можно использовать различные наиболее известные клетки, вк 2 39209 лючая P3(P3X63Ag8.653) [J.Immunol., 123, 1548 (1978)], P3-U1 [Current Topics in Micro-biology and Immunology, 81, 1-7 (1978)], NS-1 [Eur. J. Immunol, 6, 511-519 (1976)], MPC-11 [Cell, 8, 405-415 (1976)], Sp2/0-Ag14 [Nature, 276, 269-270 (1978)], FO [J. Immunol. Meth., 35, 1-21 (1980)], S194 [J. Exp. Med., 148, 313-323 (1978)] и R210 [Nature, 277, 131-133 (1979)]. Слияние клеток вышеупомянутого иммуноцита и клетки миеломы может быть в основном выполнено обычным способом, например, способом по Milstein и др. [Methods Enzymol., 73, 3-46 (1981)]. В особом случае, вышеупомянутое слияние клеток может быть выполнено, например, в обычной питательной среде в присутствии ускоряющего слияние агента. В качестве такого агента может добавляться полиэтиленгликоль (PEG) и вирус Sendai (HVJ) и, кроме того, активизирующие вещества, такие как диметилсульфоксид, если требуется для усиления эффекта слияния. Что касается соотношения иммуноцитов и клеток миеломы, предпочтительно использовать первые в количестве в 1-10 раз большем, чем вторые. Примеры среды, используемой при вышеупомянутом слиянии клеток, включают среду RPMI-1640 и среду MEM, подходящие для размножения вышеупомянутых клеток миеломы, и другие среды, обычно используемые для культур такого типа клеток; кроме того, также может использоваться дополнительное количество сыворотки, например, зародышевая бычья сыворотка (FBS). Слияние клеток выполняется смешиванием предписанных количеств вышеуказанных иммуноцитов и клеток миеломы в вышеупомянутой среде, при добавлении в среду раствора PEG, предварительно нагретого до температуры около 37°С, например, PEG со средним молекулярным весом порядка 1000 - 6000, обычно до концентрации около 30-60 % (вес./об.) и их перемешивания. Затем путем повторения операций добавления соответствующих сред друг за другом, центрифугирования реакционной смеси и удаления надосадочных жидкостей могут быть образованы целевые гибридомы. Указанные гибридомы подвергаются отбору путем культивирования в обычной избирательной среде, например, среде HAT (среда с добавлением гипоксантина, аминоптерина и тимидина). Культура продолжает находиться в среде HAT в течение времени, достаточного для гибели гибридом, отличных от целевой (неслитые клетки) обычно от нескольких дней до нескольких недель. Затем согласно обычному анализу предельного разбавления выполняется отсев и моноклонирование гибридом, вырабатывающих целевые антитела. Полученные гибридомы, вырабатывающие моноклонные антитела по настоящему изобретению могут быть субкультивированы в обычной среде и сохранены в жидком азоте на длительное время. Чтобы собрать из гибридом моноклонные антитела по настоящему изобретению, может быть применен способ, включающий культивирование гибридом обычным способом и получение их из надосадочных жидкостей, или способ, вклю чающий введение гибридомы соответствующему млекопитающему для размножения и получение их из его асцита. Первый способ удобен для получения антител высокой степени чистоты, а второй - для массового производства антител. Кроме того, антитела, полученные вышеописанными способами, могут быть очищены до высокой степени с применением обычных средств очистки, таких как высаливание, гель-фильтрация и аффинная хроматография. Поскольку моноклонные антитела по настоящему изобретению обладают потенциалом ингибирования хоминга кроветворных стволовых клеток они могут использоваться как лекарство с функцией усиления эффекта противоракового средства при клиническом лечении лейкемии; например, при использовании этой функции из костного мозга высвобождаются клетки острой миелоидной лейкемии, усиливая эффект от применения противоракового средства от лейкемии. Что касается средств от лейкемии, использующих моноклонные антитела по настоящему изобретению, нет необходимости говорить, что создание особой системы для использования этих антител в качестве лекарства для усиления эффективности противоракового средства от лейкемии, модификация и прикладное применение этих антител включаются в сферу настоящего изобретения в том случае, если они осуществляются на практике обычными способами, известными специалистам. Фиг. 1 показывает исследование (контрольный образец в отсутствие антител, клетка CF-1) методом иммунофлуоресценции. Фиг. 2 показывает исследование связующих свойств антитела GSPST-1 по отношению к клеткам CF-1 методом иммунофлуоресценции. Фиг. 3 показывает исследование связующих свойств антитела ВМАР-1 по отношению к клеткам CF-1 методом иммунофлуоресценции. Фиг. 4 показывает исследование (контрольный образец в отсутствие антител, клетка костного мозга) методом иммунофлуоресценции. Фиг. 5 показывает исследование связующих свойств антитела GSPST-1 по отношению к клеткам костного мозга методом иммунофлуоресценции. Фиг. 6 показывает исследование связующих свойств антитела HMS-1 по отношению к клеткам костного мозга методом иммунофлуоресценции. Фиг. 7 показывает испытание моноклонных антител (GSPST-1) по настоящему изобретению на способность ингибировать трансплантацию костного мозга. Фиг. 8 показывает испытание моноклонных антител (HMS-1) по настоящему изобретению на способность ингибировать трансплантацию костного мозга. Далее настоящее изобретение будет описано подробно на эталонном примере и примере, но настоящее изобретение не ограничивается примером. Эталонный пример. Выявление стромальных клеток селезенки и их характеристик. 1) Выявление стромальных клеток селезенки. 3 39209 Результат для клеток CF-1 был отрицательным на щелочную фосфатазу, фактор VIII-зависимый антиген, macI и фагоцитоз, и положительным на коллаген типа I, коллаген типа III и фибронектин. Клетки CF-1 не превращались в адипоциты в течение 4 недель в слитой культуре в 10-6 моль/л гидрокортизона, хотя клетки CF-1 содержали лишь следы липидов. Из этих данных следует, что клетки CF-1 не имеют характеристик преадипоцитов, макрофагов и эндотелиальных клеток, и поэтому стало очевидным, что они получены из стромальных клеток, отличных от них. 3) Обработка кроветворных стволовых клеток клетками CF-1. Чтобы проверить, действуют ли клетки CF-1 на кроветворных стволовых клеток были взяты образцы CFU-S (образцы образующих колонии клеток селезенки) по методике Till и McCulloch. 10 мышей на группу были облучены 900 сГр (MBR1520R; Hitachi, Tokyo) и получили внутривенно одноядерные клетки костного мозга (клетки ВМ) (1,0 х 105/ocoбь, 5,0 х 104/особь или 2,5 х 104/особь) и клетки CF-1 (1,0 х 105/особь), и на 12-й день были подсчитаны колонии в селезенке как клоны CFU-S (колонии селезенки). В результате, когда одноядерные клетки костного мозга (ВМ-клетки) и клетки CF-1 были трансплантированы облученным мышам, количество колоний селезенки в каждой группе ВМклеток значительно увеличилось (в 1,4-1,8 раза) по сравнению с мышами без клеток CF-1, и, на 12й день после трансплантации, коэффициент выживания мышей с трансплантированными ВМклетками и клетками CF-1 был выше, чем у мышей только с клетками ВМ, причем при низкой скорости умирания; следовательно, стало очевидно, что на кроветворных стволовых клеток оказали действие клетки CF-1. Оптимальный режим для осуществления изобретения. Вариант реализации изобретения будет описан в деталях ниже. Пример. Получение моноклонных антител. 1) Антигены и иммунизация. Иммунизация была выполнена с использованием клеток CF-1, полученных в вышеописанном Эталонном пpимepe в качестве антигенов. Эти клетки культивировали в термостате в условиях 5% СО2 и 37°С, используя среду Dulbecco, модифицированную Isocove (IMDM) (BoehringerMannheim Co.) с 10% зародышевой бычьей сывороткой (FBS; Sanko Junyaku). Клетки обработали 1 мМ EDTA/PBS и пипетированием извлекли из колбы для культивирования. Из клеток приготовили суспензию в 1 мМ EDTA/PBS, где количество клеток составило около 1 х 107/мл, и ввели крысе Wistar Imamich (возраст 7 недель, самка; Animal Breeding Research Laboratory). Один мл клеток, содержащий их около 1 х x 108/мл, ввели в качестве окончательной иммунизации в брюшную полость крысы в виде первичной иммунизации, и 1 мл клеток, содержащий их около 1 х x 107/мл, были введены дополнительно через месяц. Позднее 1 мл клеток, содержащий их около 1 х x 107/мл, были введены дополнительно несколько раз с интервалом один месяц, и после того, как было ус Линия стромальных клеток селезенки, имеющих способность поддерживать кроветворных стволовых клеток, была выведена из первичной культуры клеток селезенки мыши C57BL/6J, получавшей rG-CSF в количестве 100 мкг/кг в течение 5 дней. А именно, эта селезенка была удалена после применения rG-CSF в стерильных условиях, культивирована в 25-см2 пластиковой колбе (Corning Со.) в течение 6 недель и в среде Dulbecco, модифицированной Isocove (IMDM) (BoehringerMannheim Co.) с 10% тепло-инактивированной зародышевой бычьей сывороткой (FBS) (Sanko Junyaku, Tokyo), 100 ед/мл пенициллина и 100 мкг/мл стрептомицина в термостате в условиях 37°С и 5% СO2, среда сменялась свежей питательной средой дважды в неделю. В полученной культуре сросшиеся популяции клеток (стромальные клетки) были собраны из колбы с использованием 0,05% трипсина плюс 0,02% EDTA (Sigma Chemical Со.) в PBS, не содержащем кальция и магния, и пересажены в новые колбы. Такие пересадки повторялись приблизительно один или два раза в неделю. На ранних пересадках (1-10 пересадки) коэффициент деления клеток составлял от 1/4 до 1/8, а далее коэффициент составил 1/16-1/32. Стромальные клетки стали гомогенными и фибробластообразными приблизительно после 10-й пересадки. На 20-й пересадке эти стромальные клетки были собраны, как описано выше, и подвергнуты клеточному клонированию с использованием технологии предельного разбавления; клеточное клонирование повторялось дважды для выведения стромальной клеточной линии (клеточная линия CF-1). Затем эти клетки были обработаны в 5 мл среды IMDM, дополненной 10 % тепло-инактивированного FBS в 25-см2 пластиковой колбе (Corning Co.), и субкультивированы раз в 5 дней при коэффициенте деления 1/32. Линии стромальных клеток селезенки могут быть выведены от других животных, кроме мыши; например линии стромальных клеток селезенки человека могут быть выведены при использовании того же метода, описанного выше, путем трансформирования клеток аденовирусным вектором SV-40 [J. Cell. Physiol., 148, 245 (1991)]. 2) Характеристики клеток CF-1. Клетки CF-1, выведенные в виде клеточной линии, как описано выше, были исследованы на щелочную фосфатазу, кислую фосфатазу, b-глюкуронидазу, a-нафтилацетатэфиразу и олеин О с использованием стандартных цитохимических методик. Клетки CF-1 были также исследованы на иммуноэнзимную гистохимию с использованием следующих моноклонных и поликлонных антител: macI (Sero Tec.); фактор VIII-зависимый антиген (Dakopatts); коллаген типа I, коллаген типа III и фибронектин (Chtmicon International Inc.). Анализ на фагоцитоз был проведен методом поглощения латексных капель (диаметр частиц 1,09 мкм; Sigma), а склонность клеток CF-1 превращаться в адипоциты была проверена экспозицией в 10-6 моль/л гидрокортизонфосфате (Sigma) в 25 см2 колбе в течение 4 недель после получения слитой культуры. 4 39209 тановлено взаимодействие между антителами иммунизированной крысы и клетками CF-1, 1 мл клеток, содержащий их около 1 х 108/мл, было введено в качестве окончательной иммунизации. Через три дня после окончательной иммунизации крысу умертвили для извлечения селезенки. 2) Слияние клеток. После того как селезенка, извлеченная из крысы, была измельчена, отделенные клетки селезенки центрифугировали, суспендировали в среде IMDM (Boehringer-Mannheim Co.) и тщательно промыли. С другой стороны, клетки, полученные культивированием клеточной линии миеломы мыши Sp2/0-Ag14 [Nature, 276, 269-270 (1978)] в IMDM (Boehringer-Mannheim Co.), с добавкой 10% зародышевой бычьей сыворотки (FBS; Sanko Junyaku), промыли в вышеупомянутой среде IMDM тем же способом и затем 1 х 108 этих клеток и 2 х x 108 вышеупомянутых клеток селезенки поместили в центрифугу и перемешивали для слияния клеток в полиэтиленгликоле 4000 (Nakarai Kagaku) в соответствии с обычной методикой [Clin. Exp. Immunol., 42, 458-462 (1980)]. Далее, полученные слитые клетки распределили по пластине с 96 отсеками в среде IMDM с 20% FBS и культивировали в термостате в условиях 37°С и 5% СО2. Затем постепенно, со следующего дня, их перенесли в избирательную среду HAT и продолжили культивирование. После начала культивирования надосадочные жидкости переносили в новую среду HAT дважды в неделю для продолжения культивирования и размножения. Далее, полученные слитые клетки клонировали по обычной методике, используя анализ методом предельного разбавления. А именно, только клоны, обладающие сильными связующими свойствами по отношению к антигенам, были клонированы по обычной методике, включающей метод предельного разбавления, путем исследования их связующих свойств по отношению к антигенам, используя антитела в надосадочных жидкостях вышеупомянутых слитых клеток. 3) Отсев. Отсев слитых клеток (гибридом) выполнялся в соответствии с косвенной флуоресцентной методикой исследования антител с использованием проточной цитометрии. Отсев клонов, вырабатывающих целевые антитела, выполнялся с использованием клеток CF-1 как клеток-мишеней. А именно, суспензию клеток в реакционной буферной среде (PBS с 2% FBS и 0,02% NаN3) центрифугировали и извлекли в виде шариков, затем превратили в суспензию в 100 мкл надосадочных жидкостей культуры гибридомы (около 1 х 106/100 мкл) и проводили реакцию в течение 1 часа при 4°С. После этого их промыли один раз вышеупомянутым буферным раствором, добавили козье (FITC-маркированное) антикрысиное IgG (FC) антитело (Chemicon) и выдерживали в термостате в течение 1 часа. После однократного промывания их проанализировали методом проточной цитометрии (FACScan, Becton Dickinson). 4) Очистка антител. Слитые клетки, отсеянные вышеописанным способом 3), культивировали в по обычной ме тодике, а антитела, полученные в надосадочных жидкостях, отделили по обычной методике и подвергли очистке. А именно, гибридомы извлекли из отсеков с высокими титрами антител по отношению к антигенам, распределили по пластиковому блюдцу для тканевых культур (Corning Co.), культивировали в условиях 37°С и 5% СО2, размножили и очистили по обычной методике, получив моноклонные антитела GSPST-1 и HMS-1. В этом случае что касается антитела HMS-1 и антитела GSPST-1, полученные клетки были введены в брюшную полость бесшерстной мыши BALB/cAJcl-nu (возраст 8 недель, самец, Nippon Kurea) и ее асцит был выработан через 10-14 дней, высолен 33%-сульфатом аммония и подвержен диализу PBS. Между прочим, в вышеописанном примере был описан случай, в котором в качестве антигенов для иммунизации использовались клетки CF-1; однако, тем же способом можно вывести моноклонное антитело также и в случае использования других стромальных клеток, включая кроветворных стволовых клеток, выделенных из стромальных клеток селезенки человека и настоящее изобретение не ограничивается вышеупомянутыми моноклонными антителами, но включает также все моноклонные антитела, имеющие такие же характеристики, полученные таким же образом, и все гибридомы, вырабатывающие такие моноклонные антитела. Гибридома, вырабатывающая моноклонное антитело HMS-1 по настоящему изобретению, представляет собой новую, неизвестную ранее, слитую клетку, полученную из клетки селезенки крысы Wistar Imamich и клеточной линии миеломы мыши SP2/0-Ag14 в качестве родительских клеток, и зарегистрирована 9 августа 1993 г. под названием HMS-1 (крысино-мышиная гибридома) под регистрационным номером FERM ВР-4383 в Национальном институте биологической науки и человеческой технологии, Агентстве промышленной науки и технологии в Японии [адрес: 1-3, Higashi 1chome, Tsukuba-shi, Ibaraki 305, Japan], полномочным международным депозитарием по Будапештскому договору о международном признании депозитов на микроорганизмы для целей патентных процедур. 5) Свойства антител. (і) Реакционная способность антител (Реакционная способность по отношению к клеткам CF-1) Результаты исследования реакционной способности полученных моноклонных антител GSPST-1 и HMS-1 по отношению к клеткам CF-1, полученные иммунофлуоресцентным анализом, показаны на фиг. 1-3. Фиг. 1 показывает результаты анализа контрольного образца в отсутствие антител; фиг. 2 - результаты анализа связующих свойств GSPST-1 по отношению к клеткам CF-1 и фиг. 3 - результаты анализа связующих свойств HMS-1 по отношению к клеткам CF-1. На фигурах вертикальные оси показывают относительное число клеток, а горизонтальные оси - интенсивность флуоресценции. Как хорошо видно на фиг. 1-3, было выяснено, что моноклонные антитела GSPST-1 и HMS-1 5 39209 по отношению к клеткам CF-1 обладают связующими свойствами и распознают поверхностные антигены клеток CF-1. (Реакционная способность по отношению к клеткам костного мозга) Результаты анализа реакционной способности GSPST-1 и HMS-1 по отношению к нормальным клеткам костного мозга, полученные проточной цитометрией (FACScan, Becton Dickinson), показаны на фиг. 4-6. Фиг. 4 показывает результаты анализа контрольного образца в отсутствие антител; фиг. 5 - результаты анализа связующих свойств GSPST-1 по отношению к клеткам костного мозга; фиг. 6 - результаты анализа связующих свойств HMS-1 по отношению к клеткам костного мозга. На фигурах вертикальные оси показывают относительное число клеток, а горизонтальные оси - интенсивность флуоресценции. Как показано на фиг. 4-6, было выяснено, что GSPST-1 вообще не обладает связующим свойством по отношению к клеткам костного мозга, a HMS-1 обладает связующим свойством к некоторым клеткам костного мозга. (ii) Определение типа антител Далее, в результате определения подкласса IgG полученных моноклонных антител [с использованием набора крыс Mono Ab-ID-Sp (Zymed)], стало очевидно, что GSPST относится к типу IgG2a, а HMS-1 - к типу IgG2b. (iii) Возможности ингибирования трансплантации костного мозга Далее, был проведен тест на ингибирование трансплантации костного мозга с использованием данных антител для исследования их характеристик. Результаты показаны на фиг. 7 и 8. Как видно из фиг. 7 и 8, в то время как HMS-1 обладает эффектом ингибирования трансплантации костного мозга, для GSPST-1 этот эффект не был обнаружен. А именно, вышеупомянутые результаты были получены путем введения 1,0 х 105/особь клеток костного мозга и моноклонных антител мышам C57BL/6J, облученным смертельной дозой радиации (900 сГр), в вены хвостов и наблюдения за образованием колоний селезенки. Вариант "Необработанные" на фиг. 8 показывает опыт без введения клеток костного мозга. Следовательно, поскольку моноклонное антитело HMS-1 по настоящему изобретению признано проявляющим эффект ингибирования трансплантации костного мозга в соответствии с вышеупомянутым экспериментом, то очевидно, что это антитело ингибирует также хоминг кроветворных стволовых клеток и образование колоний CFU-S. Для специалистов в данной области очевидно, что способность моноклонного антитела ингибировать трансплантацию костного мозга соответствует способности ингибировать хоминг кроветворных стволовых клеток и образование колоний CFU-S. Например, моноклонное антитело (антитело АСК-2, одно из С-набора антител), выведенное при использовании известного мастоцита в качестве антигена, описано как обладающее функцией ингибирования трансплантации костного мозга в мыши подобно моноклонным антителам по настоящему изобретению [Blood, 78, 1706 (1991)]; в описании делается вывод в соответствии с результатами эксперимента по инги бированию трансплантации костного мозга, что антитело ингибирует хоминг кроветворных стволовых клеток и образование колоний CFU-S. Вышеупомянутое известное антитело АСК-2 получают при использовании в качестве антигена мастоцита, а мастоцит является кроветворной клеткой, дифференцированной и размноженной от кроветворной стволовой клетки. С другой стороны, стромальная клетка кроветворной ткани, используемая в настоящем изобретении, является не кроветворной клеткой, а клеткой, поддерживающей дифференциацию и размножение кроветворной клетки, и следовательно, эти клетки имеют существенное различие. Далее, когда гибридому, вырабатывающую HMS-1, ввели в брюшную полость бесшерстной мыши, было обнаружено, что мышь не погибла от накопления асцита. Следовательно, предполагается, что свойство HMS-1 ингибировать трансплантацию костного мозга представляет собой явление, отличное от так называемого апоптоза [называемый также саморазрушением клеток - явление, при котором ядерный хроматин ДНК превращается в некоторое ядерное образование (так называемое ступенчатое образование), что приводит к гибели клеток], и вызванное взаимодействием моноклонного антитела с молекулой, приводящим к хомингу кроветворных стволовых клеток в кроветворной ткани. Таким образом, ясно что антиген распознаваемый HMS-1 является важным веществом для хоминга кроветворных стволовых клеток в кроветворной ткани. Как выявлено в вышеупомянутом эксперименте, моноклонное антитело HMS-1 по настоящему изобретению распознает поверхностный антиген стромальных клеток селезенки, поддерживающих хоминг кроветворных стволовых клеток, и имеет свойство ингибировать хоминг кроветворных стволовых клеток. Таким образом, HMS-1 обладает возможностью ингибировать хоминг кроветворных стволовых клеток в кроветворной ткани; в литературе описано, что лейкемические клетки высвобождаются из костного мозга в соответствии с сокращением участков VLA4 и VLA5 молекул сращивания кроветворных клеток, уже описанных в литературе [участок молекулы VLA может участвовать в высвобождении клеток острой миелоидной лейкемии из костного мозга, Leuk Res., 16 (5), 469-474 (1992)], и предполагается, что моноклонное антитело к VLA4 и VLA5 усиливает эффект лечения лейкемии путем высвобождения лейкемических клеток из костного мозга. Следовательно, вышеупомянутые антитела HMS-1 могут использоваться подобным образом заранее для лечения лейкемии с получением такого же эффекта. Моноклонные антитела по настоящему изобретению подробно описаны в вышеизложенном примере; приведенные выше примеры моноклонных антител не ограничивают это изобретение, которое включает все моноклонные антитела, имеющие такие же характеристики и функции, полученные таким же способом. Промышленное применение. Поскольку моноклонные антитела по настоящему изобретению распознают вещество, важное 6 39209 для хоминга клеток костного мозга в кроветворной ткани в качестве антигена и обладают свойством ингибировать хоминг кроветворных стволовых клеток, то они полезны как лекарство с функцией усиления эффекта противоракового средства, например, усиления эффекта противоракового средства против лейкемии путем высвобождения клеток острой миелоидной лейкемии из костного мозга в соответствии с вышеупомянутым свойством. Фиг. 1 Фиг. 2 7 39209 Фиг. 3 Фиг. 4 Фиг. 5 8 39209 Фиг. 6 Фиг. 7 9 39209 Фиг. 8 Тираж 50 екз. Відкрите акціонерне товариство «Патент» Україна, 88000, м. Ужгород, вул. Гагаріна, 101 (03122) 3 – 72 – 89 (03122) 2 – 57 – 03 10
ДивитисяДодаткова інформація
Назва патенту англійськоюMonoclonal antibody, inhibiting homing of hemopoietic stem cells and identifying surface antigene of stromal cell of spleen, hybridoma producing it
Автори англійськоюFukushima Naoshi
Назва патенту російськоюМоноклональное антитело, ингибирующее хоминг кроветворных стволовых клеток и распознает поверхностный антиген стромальной клетки селезенки, гибридома, которая его продуцирует
Автори російськоюФукушима Наоши
МПК / Мітки
МПК: C07K 16/28, C12N 5/20
Мітки: клітині, гібридома, інгібує, хомінг, стромальної, продукує, яка, антитіло, клітин, поверхневий, стовбурових, селезінки, моноклональне, кровотворних, розпізнає, антиген
Код посилання
<a href="https://ua.patents.su/10-39209-monoklonalne-antitilo-shho-ingibueh-khoming-krovotvornikh-stovburovikh-klitin-i-rozpiznaeh-poverkhnevijj-antigen-stromalno-klitini-selezinki-gibridoma-yaka-jjogo-produkueh.html" target="_blank" rel="follow" title="База патентів України">Моноклональне антитіло, що інгібує хомінг кровотворних стовбурових клітин і розпізнає поверхневий антіген стромальної клітини селезінки, гібридома, яка його продукує</a>
Попередній патент: Електронний мікроскоп для сканування біооб’єктів
Наступний патент: Спосіб визначення моторно-координаційної продуктивності рук та пристрій для його здійснення
Випадковий патент: Спосіб виготовлення реструктурованого м'ясного продукту