Стійка інсулінова лікарська форма та спосіб її одержання (варіанти)
Номер патенту: 61109
Опубліковано: 17.11.2003
Автори: Френк Брюс Хілл, Лі Шан, Дефеліппіс Майкл Розаріо, Доббінз Майкл Аллен, Ребан Дон Марі
Формула / Реферат
Стійка рідка лікарська форма, яка включає:
(і) фізіологічнo прийнятний буфер, вибраний з групи, до складу якої входять тріс-буфер та аргінін;
(іі) мономерний аналог інсуліну, вибраний з групи, до складу якої входять: людський інсулін, де Pro у положенні В28 заміщено Asp, Lys, Leu, Val або Ala, та де Lys у положенні В29 є Lys, або його заміщено Pro;
AlaB26-людський інсулін;
des(B28-B30)-людський інсулін та
des(B27)-людський інсулін;
(ііі) цинк та
(іv) фенольний консервант.
2. Лікарська форма за п. 1, де мономерним аналогом інсуліну є LysB28ProB29-людський інсулін.
3. Лікарська форма за п. 2, де згаданим буфером є тріс-буфер.
4. Лікарська форма за пп. 2 або 3, яка додатково включає до свого складу ізотонічний агент, причому рН згаданої лікарської форми становить від рН 7,0 до рН 8,0 у разі визначення при температурі 22 °С.
5. Лікарська форма за п. 4, де концентрація LysB28ProB29-людського інсуліну становить від приблизно 1,2 мг/мл до приблизно 50 мг/мл.
6. Лікарська форма за п. 5, де концентрація LysB28ProB29-людського інсуліну становить від приблизно 3 мг/мл до приблизно 35 мг/мл.
7. Лікарська форма за п. 6, де фенольним консервантом є суміш m-крезолу та фенолу.
8. Лікарська форма за п. 7, де тріс-буфер присутній у концентрації приблизно 2 мг/мл; гліцерин є ізотонічним агентом і присутній у концентрації приблизно 16 мг/мл; m-крезол присутній у концентрації приблизно 1,76 мг/мл та фенол присутній у концентрації приблизно 0,715 мг/мл.
9. Лікарська форма за п. 1, де мономерним аналогом інсуліну є AspB28-людський інсулін.
10. Лікарська форма за п. 9, де згаданим буфером є тріс-буфер.
11. Лікарська форма за п. 9 або 10, яка додатково містить ізотонічний агент, причому рН згаданої лікарської форми становить від 7,0 до 8,0 у разі визначення при температурі 22 °С.
12. Лікарська форма за п. 11, де концентрація AspB28-людського інсуліну становить від приблизно 1,2 мг/мл до приблизно 50 мг/мл.
13. Лікарська форма за п. 12, де концентрація AspB28-людського інсуліну становить від приблизно 3 мг/мл до приблизно 35 мг/мл.
14. Лікарська форма за п. 1, яка додатково включає протамін.
15. Лікарська форма за п. 14, де аналогом інсуліну є LysB28ProB29-людський інсулін.
16. Лікарська форма за п. 14, де аналогом інсуліну є AspB28людський інсулін.
17. Лікарська форма за будь-яким з пп. 14-16, де згаданим буфером є аргінін.
18. Лікарська форма за будь-яким з пп. 1-13 для використання у системі безперервного вливання.
19. Лікарська форма за будь-яким з пп. 1-17 для використання як засобу для лікування діабету або гіперглікемії.
20. Спосіб одержання лікарської форми мономерного аналогу інсуліну за будь-яким з пп. 1-13, який включає стадію змішування зазначеного буферу з мономерним аналогом інсуліну, цинком та фенольним консервантом.
21. Спосіб одержання лікарської форми мономерного аналогу інсуліну за будь-яким з пп. 14-17, який включає стадію змішування зазначеного буферу з мономерним аналогом інсуліну, цинком, фенольним консервантом та протаміном.
Текст
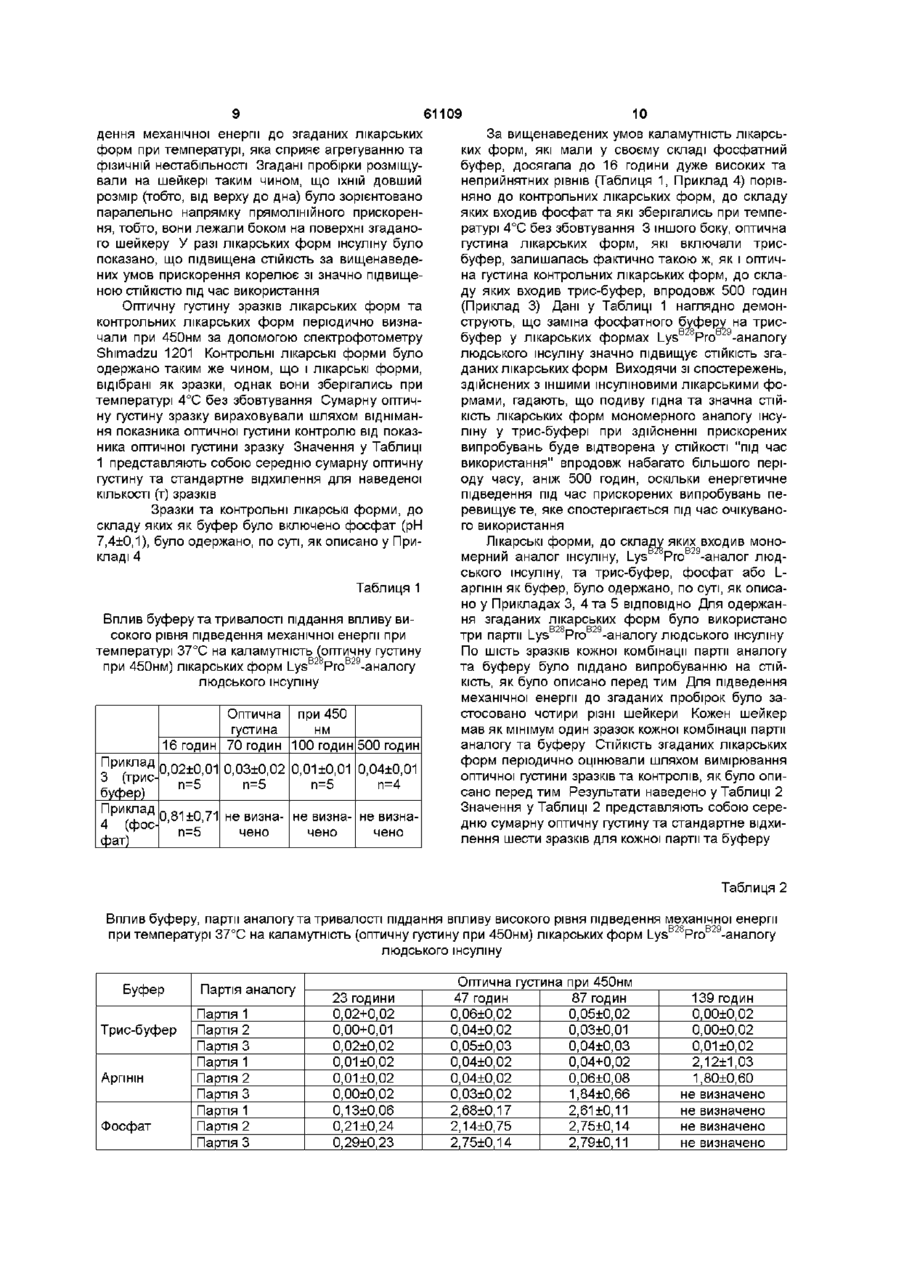
Стійка рідка лікарська форма, яка включає (і) фізіологічно прийнятний буфер, вибраний з групи, до складу якої входять тріс-буфер та аргінін, (м) мономерний аналог інсуліну, вибраний з групи, до складу якої входять людський інсулін, де Pro у положенні В28 заміщено Asp, Lys, Leu, Val або Ala, та де Lys у положенні В29 є Lys, або його заміщено Pro, Ala 2 6 -людський інсулін, Ьеэ(В28-В30)-людський інсулін та Ьеє(В27)-людський інсулін, (їм) цинкта (iv) фенольний консервант 2 Лікарська форма за п 1, де мономерним аналогом інсуліну є Lys B 2 8 Pro B 2 9 -nhDflCb^ інсулін 3 Лікарська форма за п 2, де згаданим буфером є тріс-буфер 4 Лікарська форма за пп 2 або 3, яка додатково включає до свого складу ІЗОТОНІЧНИЙ агент, причому рН згаданої лікарської форми становить від рН 7,0 до рН 8,0 у разі визначення при температурі 22 °С 5 Лікарська форма за п 4, де концентрація Lys B28 Pro B29 -nhDflCbKoro інсуліну становить від приблизно 1,2 мг/мл до приблизно 50 мг/мл 6 Лікарська форма за п 5, де концентрація Lys B28 Pro B29 -nhDflCbKoro інсуліну становить від приблизно 3 мг/мл до приблизно 35 мг/мл 7 Лікарська форма за п 6, де фенольним консервантом є суміш m-крезолута фенолу 8 Лікарська форма за п 7, де тріс-буфер присутній у концентрації приблизно 2 мг/мл, гліцерин є ІЗОТОНІЧНИМ агентом і присутній у концентрації приблизно 16 мг/мл, m-крезол присутній у концентрації приблизно 1,76 мг/мл та фенол присутній у концентрації приблизно 0,715 мг/мл 9 Лікарська форма за п 1, де мономерним аналогом інсуліну є Аєр В 2 8 -людський інсулін 10 Лікарська форма за п 9, де згаданим буфером є тріс-буфер 11 Лікарська форма за п 9 або 10, яка додатково містить ІЗОТОНІЧНИЙ агент, причому рН згаданої лікарської форми становить від 7,0 до 8,0 у разі визначення при температурі 22 °С 12 Лікарська форма за п 1 1 , де концентрація Азр В 2 8 -людського інсуліну становить від приблизно 1,2 мг/мл до приблизно 50 мг/мл 13 Лікарська форма за п 12, де концентрація Азр В 2 8 -людського інсуліну становить від приблизно З мг/мл до приблизно 35 мг/мл 14 Лікарська форма за п 1, яка додатково включає протамін 15 Лікарська форма за п 14, де аналогом інсуліну є Lys B 2 8 Pro B 2 9 -nhDflCb^ інсулін 16 Лікарська форма за п 14, де аналогом інсуліну є Азр В 2 8 людський інсулін 17 Лікарська форма за будь-яким з пп 14-16, де згаданим буфером є аргінін 18 Лікарська форма за будь-яким з пп 1-13 для використання у системі безперервного вливання 19 Лікарська форма за будь-яким з пп 1-17 для використання як засобу для лікування діабету або гіперглікемії 20 Спосіб одержання лікарської форми мономерного аналогу інсуліну за будь-яким з пп 1-13, який включає стадію змішування зазначеного буферу з мономерним аналогом інсуліну, цинком та фенольним консервантом 21 Спосіб одержання лікарської форми мономерного аналогу інсуліну за будь-яким з пп 14-17, який включає стадію змішування зазначеного буферу з мономерним аналогом інсуліну, цинком, фенольним консервантом та протаміном О О (О 61109 Цей винахід має відношення до галузі медицини людини, зокрема, до лікування діабету та гіперглікемії шляхом введення мономерних аналогів інсуліну Зокрема, цей винахід має відношення до лікарських форм мономерних аналогів інсуліну, які демонструють чудову довгострокову фізичну СТІЙКІСТЬ у разі піддання впливу високого рівня підведеної механічної енергії та високої температури СТІЙКІ лікарські форми терапевтичних лікувальних засобів є особливо необхідними для використання у пристроях для доставки препаратів, які піддають згадані лікувальні засоби впливу підвищених температур та/або механічного напруження Наприклад, СТІЙКІ інсулінові лікарські форми є необхідними для використання у системах безперервного вливання та ін'єкторних пристроях для доставки препарату Сучасні лікарські форми демонструють лише обмежену СТІЙКІСТЬ у пристроях для доставки лікарських препаратів згаданого типу У системах для безперервного вливання рідина, до складу якої входить терапевтичний засіб, накачується з поємника, як правило, до підшкірного, штравенозного або внутрішньоочеревинного депо Згаданий поємник, який повинен періодично дозаправлятись, закріплюється до тіла пацієнта або імплантується у тіло пацієнта У будь-якому випадку температура тіла та рухи пацієнта плюс турбулентність у трубопроводі та насосі забезпечують згадану лікарську форму відносно великою КІЛЬКІСТЮ термомеханічної енергії 3 метою зведення частоти дозаправлення згаданого поємника, а також його розмірів до мінімуму, надзвичайно велику перевагу мають лікарські форми з відносно високою концентрацією терапевтичного лікарського засобу У патенті США № 4,839,341 (Eh Lilly and Company, 1989), що його було видано на ім'я Мессі (Massey) та Шеліга (Shehga), обговорюються проблеми, пов'язані з забезпеченням стійких інсулінових лікарських форм для безперервного вливання, і надається докладний огляд стану у цій галузі до приблизно 1984 року Зараз ці проблеми значно зросли, оскільки на сьогоденному етапі існує потреба у інсулінових лікарських формах, які зберігають СТІЙКІСТЬ впродовж 1-3 МІСЯЦІВ Було розроблено ін'єктори, які допомагають діабетикам відмірювати та вводити точну та контрольовану дозу інсуліну У загальних рисах згадані ін'єктори кріпляться до герметичного патрону, який вміщує певну КІЛЬКІСТЬ рідкого лікарського засобу Згаданий патрон споряджено плунжером та механізмом для переміщення згаданого плунжеру у патроні таким чином, що забезпечується впорскування згаданого лікарського засобу Згадані ін'єктори можуть бути придатними для одно- або багаторазового використання У ін'єкторах, придатних для багаторазового використання, користувач може заміняти вичерпаний патрон та зворотно встановлювати гвинт подачі ін'єктора до вихідного положення У ін'єкторах, призначених для одноразового використання, згаданий патрон постійно закріплено у ін'єкторі, від якого позбавляються після того, як вміст згаданого патрону виче рпано Лікарські форми інсуліну, які використовуються у таких ін'єкторах, піддаються впливу фізичного напруження, і вони, як правило, демонструють обмежену СТІЙКІСТЬ З введенням нових мономерних аналогів інсуліну для лікування діабету, виникла необхідність застосування згаданих сполук у схемах лікування, які можуть скомпрометувати СТІЙКІСТЬ, властиву згаданим лікарським формам У цій галузі є широко відомими ШВИДКОДІЮЧІ інсуліни, так звані мономерні аналоги інсуліну, які розкриваються у патенті США № 5,514,646, що його було видано 7 травня 1996 року на ім'я Чанса (Chance), роботі Бремза (Brems) та інших, Protein Engineering, 6 527-533 (1992), публікації патента ЕР № 214826 на ім'я Бренжа (Brange) та інших (публікація від 18 березня 1987 року), та роботі Бренжа (Brange) та інших, Current Opinion in Structural Biology, 1 934-940 (1991) Мономерні аналоги інсуліну абсорбуються набагато швидше, аніж інсулін, і є ідеально придатними для контролювання рівнів глюкози у крові після прийняття їжі у пацієнтів, які цього потребують Крім того, згадані мономерні аналоги інсуліну є особливо придатними для введення шляхом безперервного вливання з метою контролювання як вихідного рівня глюкози у крові, так і контролювання її рівня у крові після прийняття їжі завдяки їхньому швидкому абсорбуванню з місця введення На жаль, лікарські форми мономерних аналогів інсуліну мають схильність до агрегування та перетворення на нестійкі у разі піддання впливу термомеханічної напруги [патент СІЛА № 5,474,978, що його" було видано 12 грудня 1995 року на ім'я Бакайса (Bakaysa) та інших] Агрегування може проявлятись навіть у вигляді випадання до осаду різновидів інсуліну більш високого порядку Таким чином, агрегування може запобігати відтворюваній доставці ефективних терапевтичних доз мономерних аналогів інсуліну, і може також викликати подразнення у МІСЦІ введення або більш системні імунологічні реакції Необхідними є лікарські форми аналогів інсуліну, стабілізовані проти агрегування Лікарські форми мономерних аналогів інсуліну для застосування у системах безперервного вливання повинні залишатись розчинними та по суті вільними від ознак агрегування, навіть у разі піддання впливу рухів та температури тіла пацієнта впродовж періодів часу, тривалість яких становить від декількох днів до декількох МІСЯЦІВ Нестійкість стимулюється підвищеними концентраціями білку, які є бажаними для систем безперервного вливання, та термомеханічною напругою, впливу якої згадані лікарські форми піддаються у системах безперервного вливання Таким чином, поліпшення фізичної та хімічної СТІЙКОСТІ концентрованих лікарських форм аналогів інсуліну є нагальною потребою для забезпечення можливості їхнього успішного використання у системах безперервного вливання Благотворним є також поліпшення СТІЙКОСТІ лікарських форм мономерних аналогів інсуліну для інших варіантів їхнього застосування, окрім безперервного вливання Відомими Є стабілізовані ШВИДКОДІЮЧІ лікарські 61109 форми мономерних аналогів інсуліну У патенті США № 5,474,978, що його було видано на ім'я Бакайса (Bakaysa) та інших, розкривається та заявляється комплексний аналог людського інсуліну, який включає шість молекул аналогу людського інсуліну (гексамерний комплекс), два атоми цинку та як мінімум три молекули фенольного консерванту, причому згадані лікарські форми включають гексамерний комплекс та способи лікування цукрового діабету шляхом введення згаданих лікарських форм Бакайса та ІНШІ також заявили лікарські форми гексамерного комплексу, який додатково включає ІЗОТОНІЧНИЙ агент та фізіологічно прийнятний буфер У описі до патенту США № 5,474,978 розкривається, що згадані комплекси цинку та мономерних аналогів інсуліну можуть вводитись до складу лікарської форми у присутності "фізіологічно прийнятного буферу" Серед буферів, які згадуються у числі придатних для застосування у лікарських формах, знаходяться фосфат натрію, ацетат натрію, цитрат натрію та трис-буфер Серед прикладів у патенті США № 5,474,978 наведено лише опис лікарських форм, де згаданим буфером є фосфат натрію, і у пунктах формули до цього винаходу заявлено лише фосфат натрію (пункт формули винаходу 5) У жодному з прикладів патенту США № 5,474,978, зокрема, не розкривається використання трис-буферу у лікарських формах комплексів цинку-мономерних аналогів інсуліну Було одержано також лікарські форми мономерних аналогів інсуліну, до складу яких входить протамін для забезпечення, у процесі використання, проміжної тривалості дії Опис лікарських форм мономерних аналогів інсуліну з протаміном наведено у патенті США № 5,461,031 У цій галузі є відомими способи кристалізування мономерних аналогів інсуліну з основним пептидом протаміном для одержання нейтральних суспензій протаміну На додаток до цього, можна одержати двофазні суміші, які складаються з розчину мономерного аналогу інсуліну та суспензії мономерного аналогу інсуліну та протаміну Ці суміші мають оптимальні властивості часової дії згаданого аналогу у поєднанні з основною активністю Опис сумішей мономерних аналогів інсуліну також наведено у патенті США №5,461,031 Лікарські форми у вигляді суспензій мономерних аналогів інсуліну та протаміну, та двофазні суміші є придатними для застосування у конструктивних варіантах патронного поємнику Однак оскільки згадані пристрої потребують частого маніпулювання з боку пацієнта, наслідком є підвищена напруга, впливу якої піддаються згадані препарати Лікарські форми солі протаміну, зокрема, мають обмежену СТІЙКІСТЬ у разі піддання впливу термомеханічної напруги Таким чином, існує необхідність розробки стійких лікарських форм мономерних аналогів інсуліну та протаміну проміжної тривалості дії, а також лікарських форм у вигляді двофазних сумішей Автори винаходу відкрили, що у разі, коли у лікарських формах комплексів мономерних аналогів інсуліну та цинку, лікарських формах солі протаміну або двофазних сумішах мономерного аналогу інсуліну застосовуються певні фізіологічне прийн ятні буфери, за виключенням фосфату, фізична стабільність згаданих лікарських форм підвищується неочікувано та у значно більшій мірі, аніж у разі застосування фосфатного буферу Найбільша перевага нашого відкриття полягає утому, що, на відміну від розчинних лікарських форм комплексів мономерних аналогів інсуліну та цинку з фосфатним буфером, опис яких, наприклад, наведено у патенті США № 5,474,978, які не мають достатньої фізичної СТІЙКОСТІ для довгострокового введення за допомогою систем безперервного вливання, розчинні лікарські форми, які забезпечуються цим винаходом, мають достатню СТІЙКІСТЬ ДЛЯ безпечного застосування впродовж тривалих періодів вливання інсуліну Ми також відкрили, що наслідком додання аргініну до лікарських форм солі протаміну мономерних аналогів інсуліну є дуже значне поліпшення як хімічної, так і фізичної СТІЙКОСТІ лікарських форм ВІДПОВІДНИМ ЧИНОМ, цей винахід надає рідку лікарську форму, до складу якої входить фізіологічно прийнятний буфер, який вибирають з групи, до складу якої входять трис-буфер та аргінін, мономерний аналог інсуліну, цинк, та фенольний консервант Об'єм цього винаходу включає також лікарську форму аналогу інсуліну, до складу якої входять мономерний аналог інсуліну, цинк, фенольний консервант, протамін, та буфер, який вибирають з групи, до складу якої входять трис-буфер та аргінін Цей винахід додатково надає способи застосування згаданих лікарських форм аналогу інсуліну для лікування діабету та гіперглікемії у пацієнта, який цього потребує, які включають введення згаданому пацієнту стійкої лікарської форми за цим винаходом Для цілей цього винаходу, які розкрито та заявлено у цьому описі, використано такі терміни, визначення яких наведено далі Згаданий термін "вводити" означає введення лікарської форми за цим винаходом до тіла пацієнта, який цього потребує, для лікування хвороби або стану РІЗНІ згадані форми дієслова "агрегуватись" означають процес, під час якого окремі молекули або комплекси об'єднуються з утворенням агрегатів Агрегат представляє собою полімерну сукупність, яка включає молекули або комплекси мономерного аналогу інсуліну Для цілей цього винаходу, гексамер мономерного аналогу інсуліну не є агрегатом, але комплексом Мономерні аналоги інсуліну та їхні гексамерні комплекси мають схильність до агрегування у разі піддання впливу термомеханічної напруги Агрегування може набувати масштабів утворення видимого осаду Згаданий термін "аргінін" означає амінокислоту та охоплює як D- та L-енантюмери, так і їхні суміші Згаданий термін включає також будь-які їхні фармакологічно прийнятні солі Аргінін у цій галузі є також відомим як 1-амшо-4гуанідинвалеріанова кислота Аргінін легко утворює солі, наприклад, хлористоводневу сіль Згаданий термін "комплекс" означає сполуку, у якій метал перехідного ряду скоординовано як мінімум з одним лігандом До лігандів належать 61109 молекули, які вміщують азот, наприклад, білки, пептиди, амінокислоти та трис-буфер, серед багатьох інших сполук Мономерний аналог інсуліну може бути лігандом двовалентних ІОНІВ цинку Згаданий термін "система для безперервного вливання" означає пристрій для безперервного введення рідини пацієнту парентеральним шляхом впродовж тривалого періоду часу або для періодичного введення рідини пацієнту парентеральним шляхом впродовж тривалого періоду часу без утворення нового місця введення кожного разу, коли вводиться згадана рідина Згадана рідина включає терапевтичний засіб або засоби Згаданий пристрій включає поємник для зберігання згаданої рідини перед її впорскуванням, насос, катетер або ІНШІ трубопроводи для сполучення згаданого поємнику з місцем введення через насос, та контрольні елементи для регулювання згаданого насосу Згаданий пристрій конструктивно може призначатись для імплантування, як правило, підшкірно У такому разі поємник для інсуліну, як правило, пристосовується для черезшкірного дозаправлення Зрозуміло, що у разі імплантування згаданого пристрою, вміст згаданого поємнику буде мати температуру тіла пацієнта та піддаватись впливу рухів пацієнта Термін "ІЗОТОНІЧНИЙ агент" означає сполуку, яка є фізіологічне переносною та надає лікарській формі ВІДПОВІДНИЙ рівень ІЗОТОНІЧНОСТІ для запобігання проходженню сумарного потоку води через КЛІТИННІ мембрани, які контактують зі згаданою лікарською формою Сполуки, наприклад, гліцерин, широко застосовуються з цією метою у відомих концентраціях До інших можливих ІЗОТОНІЧНИХ агентів належать солі, наприклад, хлорид натрію, декстроза та лактоза Терміни "мономерний аналог людського інсуліну", "мономерний аналог інсуліну" та "аналог людського інсуліну" є добре ВІДОМІ у цій галузі і означають, взагалі, ШВИДКОДІЮЧІ аналоги людського інсуліну, до яких належать людський інсулін, де Pro у положенні В28 заміщено Asp, Lys, Leu, Val або Ala, та де у положенні В29 знаходиться Lys або його заміщено Pro, АІаВ26-людський інсулін des(B28-B30) людський інсулін, та des(B27) людський інсулін Такі мономерні інсулінові аналоги розкриваються у патенті США № 5,514,646, що його було видано 7 травня 1996 року на ім'я Чанса (Chance), заявці на патент США № 08/255,297, яку було подано на ім'я Чанса (Chance) та інших, роботі Бремза (Brems) та інших, Protein Engineering, 6 527-533 (1992), публікації ЕР № 214826 на ім'я Бренжа (Brange) та інших (публікація від 18 березня 1987 року), та роботі Бренжа (Brange) та інших, Current Opinion in Structural Biology, 1 934-940 (1991) Згадані мономерні аналоги інсуліну, які застосовуються у цьому винаході, є ВІДПОВІДНИМ ЧИНОМ структуровані ВІДПОВІДНО структурований аналог інсуліну має три дисульфідні містки один між положенням 7 А-ланцюгу та положенням 7 В-ланцюгу, другий між положенням 20 А-ланцюгу та положенням 19 В-ланцюгу, та третій між положеннями 6 та 11 Аланцюгу Згаданий термін "фенольний консервант", 8 який застосовано у цьому описі, означає хлоркрезол, m-крезол, фенол або їхні суміші Згаданий іменник "СТІЙКІСТЬ", ЯКИЙ застосовано у цьому описі, означає фізичну СТІЙКІСТЬ лікарських форм мономерних аналогів інсуліну Фізична нестійкість лікарської форми білку може спричинюватись агрегуванням згаданих білкових молекул з утворенням полімерів більш високого порядку або навіть осадів "Стійкою" лікарською формою є така форма, де ступінь агрегування білків, які входять до її складу, є прийнятно контрольованим і з часом не підвищується до рівня неприйнятності Лікарські форми мономерного аналогу інсуліну мають схильність до агрегування у разі піддання впливу термомеханічної напруги Фізична СТІЙКІСТЬ може оцінюватись за допомогою методів, добре відомих у цій галузі, утому числі, шляхом визначення уявного послаблення світла (спектральна поглинальна здатність або оптична густина) Таке визначення послаблення світла має відношення до каламутності лікарської форми Каламутність викликається агрегуванням або випаданням до осаду білків або комплексів, які входять до складу згаданої лікарської форми Інші методи оцінки фізичної СТІЙКОСТІ є добре відомими у цій галузі Згаданий термін "лікування" означає догляд та піклування про пацієнта, який має діабет або гіперглікемію, або інший стан, у разі якого показаним є введення інсуліну, з метою подолання або полегшення симптомів та ускладнень згаданих станів Лікування включає введення лікарської форми за цим винаходом з метою запобігання появі симптомів або ускладнень, полегшення симптомів або ускладнень, або ліквідування хвороби, стану або розладу Згаданий термін "трис-буфер" означає 2аміно-2-пдроксиметил-1,3-пропандюл, або будьяку його фармакологічно прийнятну сіль Двома поширеними формами трис-буферу є вільна основа та хлористоводнева форма Трис-буфер є також відомим у цій галузі яктриметилоламшометан, трометамш та трис(пдроксиметил)амшометан Те, що цей винахід надає лікарські форми мономерних аналогів інсуліну, які мають значно підвищену фізичну СТІЙКІСТЬ порівняно до відомих у цій галузі, буде легко зрозуміло з наведених далі даних Лікарські форми, до складу яких входять мономерний аналог інсуліну, Lys B28 Pro B29 - аналог людського інсуліну, та трис-буфер, які було одержано, по суті, за описом, який наведено у Прикладі З, було піддано прискореному випробуванню на СТІЙКІСТЬ, як описано далі Зразки одержаних лікарських форм вносили до двох попередньо очищених 2мл скляних пробірок автоматичного пробовідбірнику для високоефективного рідинного хроматографування У кожній пробірці знаходилось три тефлонові (Teflon®) кульки діаметром приблизно 3/16 дюйма (1,5875мм) Повітря зі згаданих пробірок було повністю витіснено згаданими зразками лікарської форми Після герметизування згадані пробірки піддавали безперервному збовтуванню з частотою 40Гц (20дх, середнє прямолінійне прискорення) при повному розмаху коливань, який дорівнював 12мм, та при температурі 37°С, для забезпечення відносно високого рівня підве 61109 дення механічної енергії до згаданих лікарських форм при температурі, яка сприяє агрегуванню та фізичній нестабільності Згадані пробірки розміщували на шейкері таким чином, що їхній довший розмір (тобто, від верху до дна) було зорієнтовано паралельно напрямку прямолінійного прискорення, тобто, вони лежали боком на поверхні згаданого шейкеру У разі лікарських форм інсуліну було показано, що підвищена СТІЙКІСТЬ за вищенаведених умов прискорення корелює зі значно підвищеною СТІЙКІСТЮ під час використання Оптичну густину зразків лікарських форм та контрольних лікарських форм періодично визначали при 450нм за допомогою спектрофотометру Shimadzu 1201 Контрольні лікарські форми було одержано таким же чином, що і лікарські форми, відібрані як зразки, однак вони зберігались при температурі 4°С без збовтування Сумарну оптичну густину зразку вираховували шляхом віднімання показника оптичної густини контролю від показника оптичної густини зразку Значення у Таблиці 1 представляють собою середню сумарну оптичну густину та стандартне відхилення для наведеної КІЛЬКОСТІ (т) зразків Зразки та контрольні лікарські форми, до складу яких як буфер було включено фосфат (рН 7,4±0,1), було одержано, по суті, як описано у Прикладі 4 Таблиця 1 Вплив буферу та тривалості піддання впливу високого рівня підведення механічної енергії при температурі 37°С на каламутність (оптичну густину при 450нм) лікарських форм LysB2 РгоВ29-аналогу людського інсуліну Оптична при 450 густина нм 16 годин 70 годин 100 годин 500 годин Приклад 0,02±0,01 0,03±0,02 0,01 ±0,01 0,04±0,01 3 (трисп=5 п=5 п=5 п=4 буфер) Приклад 0,81±0,71 не визна- не визна- не визна4 (фосп=5 чено чено чено фат) 10 За вищенаведених умов каламутність лікарських форм, які мали у своєму складі фосфатний буфер, досягала до 16 години дуже високих та неприйнятних рівнів (Таблиця 1, Приклад 4) порівняно до контрольних лікарських форм, до складу яких входив фосфат та які зберігались при температурі 4°С без збовтування 3 іншого боку, оптична густина лікарських форм, які включали трисбуфер, залишалась фактично такою ж, як і оптична густина контрольних лікарських форм, до складу яких входив трис-буфер, впродовж 500 годин (Приклад 3) Дані у Таблиці 1 наглядно демонструють, що заміна фосфатного буферу на трисRR F9 v TQ буфер у лікарських формах Lys Pro -аналогу людського інсуліну значно підвищує СТІЙКІСТЬ згаданих лікарських форм Виходячи зі спостережень, здійснених з іншими інсуліновими лікарськими формами, гадають, що подиву гідна та значна СТІЙКІСТЬ лікарських форм мономерного аналогу інсуліну у трис-буфері при здійсненні прискорених випробувань буде відтворена у СТІЙКОСТІ "ПІД час використання" впродовж набагато більшого періоду часу, аніж 500 годин, оскільки енергетичне підведення під час прискорених випробувань перевищуєте, яке спостерігається під час очікуваного використання Лікарські форми, до складу яких входив мономерний аналог інсуліну, Lys РгоВ29-аналог людського інсуліну, та трис-буфер, фосфат або Lарпнін як буфер, було одержано, по суті, як описано у Прикладах 3, 4 та 5 ВІДПОВІДНО ДЛЯ одержання згаданих лікарських форм було використано три партії LysB28ProB29-aHanory людського інсуліну По шість зразків кожної комбінації партії аналогу та буферу було піддано випробуванню на СТІЙКІСТЬ, як було описано перед тим Для підведення механічної енергії до згаданих пробірок було застосовано чотири різні шейкери Кожен шейкер мав як мінімум один зразок кожної комбінації партії аналогу та буферу СТІЙКІСТЬ згаданих лікарських форм періодично оцінювали шляхом вимірювання оптичної густини зразків та контролів, як було описано перед тим Результати наведено у Таблиці 2 Значення у Таблиці 2 представляють собою середню сумарну оптичну густину та стандартне відхилення шести зразків для кожної партії та буферу Таблиця 2 Вплив буферу, партії аналогу та тривалості піддання впливу високого рівня підведення механічної енергії при температурі 37°С на каламутність (оптичну густину при 450нм) лікарських форм LysB28ProB29-aHanory людського інсуліну Буфер Трис-буфер Аргінін Фосфат Партія аналогу Партія Партія Партія Партія Партія Партія Партія Партія Партія 1 2 3 1 2 3 1 2 3 23 години 0,02+0,02 0,00+0,01 0,02±0,02 0,01 ±0,02 0,01 ±0,02 0,00±0,02 0,13±0,06 0,21 ±0,24 0,29±0,23 Оптична густина при 450нм 47 годин 87 годин 0,06±0,02 0,05±0,02 0,04±0,02 0,03±0,01 0,05±0,03 0,04±0,03 0,04±0,02 0,04+0,02 0,04±0,02 0,06±0,08 0,03±0,02 1,84±0,66 2,68±0,17 2,61 ±0,11 2,14±0,75 2,75±0,14 2,75±0,14 2,79±0,11 139 годин 0,00±0,02 0,00±0,02 0,01 ±0,02 2,12±1,03 1,80±0,60 не визначено не визначено не визначено не визначено 11 За вищенаведених умов каламутність лікарських форм, які мали у своєму складі фосфатний буфер, досягала до 23 годин дуже високих та неприйнятних рівнів незалежно від партії аналогу інсуліну, яку було використано (Таблиця 2) У протилежність до цього каламутність лікарських форм, які мали у своєму складі трис-буфер, залишалась, по суті, незмінною впродовж 139 годин незалежно від партії інсуліну, яку було використано Лікарські форми, до складу яких входив Lарпніновий буфер, демонстрували кращу фізичну СТІЙКІСТЬ порівняно до лікарських форм, які включали фосфат, і тривалість їхньої СТІЙКОСТІ у деякій мірі залежала від партії інсулінового аналогу, яку було використано Дані у Таблиці 2 наглядно демонструють, що лікарські форми LysB Pro 9аналогу людського інсуліну, до складу яких входив трис-буфер або L-арпншовий буфер при рН 7,4 зберігали СТІЙКІСТЬ до агрегування впродовж значно триваліших періодів часу, аніж лікарські форми, до складу яких входив фосфатний буфер І, зновтаки, гадають, що подиву гідна та значна СТІЙКІСТЬ лікарських форм мономерного аналогу інсуліну у трис-буфері та L-арпншовому буфері буде відтворена у СТІЙКОСТІ "під час використання" впродовж набагато більшого періоду часу, аніж той, що спостерігається під час здійснення прискорених випробувань, оскільки енергетичне підведення під час прискорених випробувань перевищує те, яке спостерігається під час очікуваного використання Сприйнятливість до змін морфології та зовнішнього вигляду суспензійних лікарських форм B28 Lys Pro B29 оцінювали шляхом випробувань на фізичну СТІЙКІСТЬ під напругою (PSST) ВІДПОВІДНО до цього термомеханічного методу, препарати герметично закривали у поємнику встановленого об'єму зі скляними кульками без вільного простору над продуктом Згадані поємники вміщували до камери при підвищеній температурі (приблизно 37°С), центрифугували при визначеній швидкості (приблизно 30об/хв) впродовж визначеного часу (приблизно 4 години), після чого впродовж 24 годин витримували у нерухомому стані Згадані поємники оцінювали за змінами, які у них відбувались, і видаляли їх з подальшого випробування у тому разі, коли у них відбувалось агрегування (скупчення) Триваліші періоди часу без вилучення з випробування, а також більша КІЛЬКІСТЬ ПОЄМНИКІВ, які залишались для випробування, прирівнювались до підвищеної фізичної СТІЙКОСТІ Випробуванням піддавали дві різні суміші, до складу яких входили LysB28Pro 29 та Lys 2 8 Pro B 2 кристали протаміну Співвідношення Lys Pro до LysB28ProB29-npoTaMmy у бідній суміші становило 25 75, у той час як у збагаченій суміші воно дорівнювало 75 25 Згадані суміші було одержано, як описано у Прикладах 6 та 7 Під час випробувань бідних сумішей за методом PSST, через 18 днів залишались лише поємники, які вміщували лікарські форми, до складу яких входив аргінін До 44 днів залишались лише поємники з двома експериментальними зразками Під час випробувань збагачених сумішей за методом PSST було одержано подібні ж результати з лікарськими формами, до складу яких входив аргінін, через 36 днів випробу 61109 12 вань залишилось приблизно 50% поємників, у той час як з контрольними лікарськими формами, до складу яких входив фосфатний буфер, у випробуваннях після 36 днів залишилось лише від 0% до 5% поємників Переважними мономерними аналогами інсуліну для використання у лікарських формах за цим винаходом є LysB28Pro 29-людський інсулін, Asp 28людський інсулін та АІаВ26-людський інсулін Концентрація мономерного аналогу інсуліну у лікарських формах за цим винаходом коливається у межах від 1,2мг/мл до 50мг/мл Переважний діапазон концентрацій аналогу становить від приблизно 3,0мг/мл до приблизно 35мг/мл Більш переважні концентрації становлять приблизно 3,5 мг/мл, приблизно 7 мг/мл, приблизно 14мг/мл, приблизно 17,5мг/мл та приблизно 35мг/мл, що відповідає лікарським формам, які мають приблизно 100 одиниць, приблизно 200 одиниць, приблизно 300 одиниць, приблизно 500 одиниць та приблизно 1000 одиниць інсулінової активності на мл ВІДПОВІДНО Концентрація цинку у згаданих лікарських формах становить від приблизно 4,5мг/мл до приблизно 370мг/мл, і повинна бути на такому рівні, який забезпечував би доступність як мінімум двох атомів цинку для комплексу з шістьма молекулами інсуліну у кожному гексамері Співвідношення загального цинку (цинк, який входить до комплексу, плюс цинк, який до комплексу не входить) до гексамеру інсулінового аналогу повинно бути у межах від 2 до 4 Перевага надається співвідношенню від приблизно 3 до приблизно 4 атомів загального цинку до комплексу гексамеру інсулінового аналогу Для одержання гексамеру мономерного інсулінового аналогу у цих лікарських формах необхідною є мінімальна концентрація фенольного консерванту Для деяких цілей, наприклад, для задоволення одночасних вимог до ефективності консерванту для універсальних лікарських форм, концентрація фенольного консерванту у лікарських формах за цим винаходом може перевищувати необхідну для одержання гексамерів на таку КІЛЬКІСТЬ, яка є необхідною для збереження ефективності консерванту Концентрація консерванту, яка є необхідною для ефективного консервування, залежить від застосованого консерванту, рН лікарської форми, та присутності або відсутності речовин, які зв'язують або блокують згаданий консервант Взагалі, необхідна КІЛЬКІСТЬ може бути знайдена, наприклад, у роботі Уоллхаузера К Д (Wai I ha use г К DH ), Develop Biol Standard , 24, crop 9-28 (Базель, видавництво S Krager, 1974) У разі введення до складу лікарської форми, комплекс гексамеру інсулінового аналогу, який використовують у лікарській формі за цим винаходом, зв'язує сім фенольних груп, у той час як взагалі зі згаданим гексамером зв'язується лише шість фенольних груп Для одержання гексамеру необхідно як мінімум приблизно три фенольні групи У разі необхідності застосування консерванту для забезпечення протимікробної ефективності, концентрація переважного фенольного консерванту становить від приблизно 23мМ до приблизно 35мМ 14 13 61109 Переважними консервантами, окремо або у сумішньом'язовий та підшкірний шляхи Ще більш пешах, є m-крезол та фенол реважними шляхами введення лікарських форм за цим винаходом є інтравенозний, внутрішньоочеДо складу згаданих лікарських форм факульревинний та підшкірний шляхи тативно може входити ІЗОТОНІЧНИЙ агент До складу згаданих лікарських форм, за переважним варіанВведення певними парентеральними шляхами том, входить ІЗОТОНІЧНИЙ агент, і найпереважнішим може залучати введення лікарських форм за цим ІЗОТОНІЧНИМ агентом є гліцерин Концентрація глівинаходом до тіла пацієнта через голку або катецерину, у разі його використання, знаходиться у тер, з приведенням до руху за допомогою стеримежах, відомих у цій галузі для інсулінових лікарльного шприцу або іншого механічного пристрою, ських форм, і становить, за переважним варіаннаприклад, системи для безперервного вливання том, приблизно 16 мг/мл Лікарська форма, яка надається цим винаходом, може вводитись за допомогою шприцу, ін'єктору, рН згаданих лікарських форм регулюється бунасосу або будь-якого іншого пристрою, який у цій фером, наприклад, трис-буфером або L-арпншом галузі визнається придатним для парентерального Гадають, що концентрація згаданих буферів не введення Лікарська форма за цим винаходом мовідіграє критичної ролі при досягненні ЦІЛІ ЦЬОГО же також вводитись у вигляді аерозолю для абсовинаходу, і повинна бути такою, яка б забезпечурбування у легенях або носовій порожнині Згадані вала підтримку рН під час збереження на рівні лікарські форми можуть також вводитись для абцільового рН±0,1 одиниці рН Переважний рН косорбування через слизові оболонки, наприклад, ливається у межах від приблизно 7 до приблизно 8 шляхом трансбукального введення у разі визначення при температурі приблизно 22°С КІЛЬКІСТЬ лікарської форми за цим винаходом, яка вводиться для лікування діабету або гіпергліДо складу згаданих лікарських форм можуть кемії, залежить від ряду факторів, до яких налефакультативно вводитись ІНШІ додатки, наприжать, без обмеження, стать пацієнту, маса та вік, клад, фармацевтичне прийнятні розчинники типу етіологічні причини стану або хвороби, яка лікуТвін 20 (Tween 20®) (сорбітанмонолаурат полюється, шлях введення та бюдоступність, СТІЙКІСТЬ ксиетилену 20), Твін 40 (Tween 40®) (сорбітанмовведеного мономерного аналогу інсуліну у ТІЛІ, нопальмітат полюксиетилену 20), Твін 80 (Tween лікарська форма та активність згаданого мономе80®) (сорбітанмоноолеат полюксиетилену 20), рного аналогу інсуліну У разі періодичного ввеПлюроник F68 (Pluromc F68®) (блок-співполімери дення при визначенні КІЛЬКОСТІ на введення необполюксиетилену та полюксипропілену) та поліетихідно враховувати інтервал між дозами та ленгліколь (PEG) Згадані додатки не є потрібними бюдоступність згаданого мономерного аналогу для досягнення великої переваги за цим винахоінсуліну зі згаданої лікарської форми Введення дом, однак вони можуть бути придатними у разі, згаданої лікарської форми за цим винаходом поколи згадані лікарські форми будуть контактувати винно бути безперервним Пересічний лікар здатз пластмасами ний відтитрувати дозу та швидкість вливання або До об'єму цього винаходу входять також лічастоту введення згаданої лікарської форми за карські форми протамінової солі з різними пропорцим винаходом для досягнення бажаного КЛІНІЧНОціями розчинних фракцій мономерних аналогів ГО результату інсуліну Для стабілізування лікарської форми з аргініном інсулінова молекула не повинна відповідати ніяким специфічним конформаційним вимогам, хоча наповнювачі, наприклад, цинк, та консерванти, які, як правило, додаються до інсулінових лікарських форм (які було обговорено перед тим), можуть працювати у співдружності з аргініном по підсиленню стабілізації Концентрація аргініну у лікарських формах, до складу яких входить протамін, може коливатись у діапазоні від 1мМ до ЮОмМ Найпереважнішою є концентрація аргініну у межах від 5мМ до 25мМ Аргінін може додаватись як доповнення до розчинів або преципітованих суспензій, до складу яких вже включено іони цинку та фенольні консерванти Мономерні аналоги інсуліну, які використовуються у цьому винаході, можна одержати за допомогою будь-якого з численних визнаних методів синтезування пептидів, у тому числі, за класичними методами синтезування з фази розчину, за твердофазними методами, напівсинтетичними методами та методами рекомбінантних ДНК У патенті США № 5,514,646, що його було видано 7 травня 1996 року на ім'я Чанса (Chance) та інших, розкривають одержання різноманітних мономерних аналогів інсуліну з докладністю, достатньою для того, щоб фахівець у цій галузі зміг одержати будь-який зі згаданих мономерних аналогів інсуліну, які використовуються у цьому винаході Введення може здійснюватись будь-яким шляхом, ефективність якого є відомою пересічному лікарю Перевага надається парентеральному введенню Під парентеральним введенням традиційно розуміють введення будь-яким шляхом, за виключення шлунково-кишкового До переважних парентеральних шляхів для введення лікарських форм за цим винаходом належать штравенозний, внутрішньом'язовий, підшкірний, внутрішньоочеревинний, штраартеріальний, назальний, легеневий та трансбукальний шляхи Найпереважнішими шляхами введення сполук за цим винаходом є Інтравенозний, внутрішньоочеревинний, внутрі Як цинк,так і фенольний консервант є невід'ємними для одержання комплексу, який є стійким та здатним до швидкого розкладення та започаткування дії Згаданий гексамерний комплекс включає два іони цинку на гексамер аналогу людського інсуліну та як мінімум три молекули фенольного консерванту, який вибирають з групи, до складу якої входить хлоркрезол, m-крезол, фенол та їхні суміші Розчинний мономерний аналог інсуліну перетворюють на згаданий гексамерний комплекс шляхом розчинення згаданого мономерного аналогу інсуліну у розріджувачі, який включає згаданий 15 фенольний консервант у ВІДПОВІДНІЙ КІЛЬКОСТІ при рН на рівні від приблизно 7 до приблизно 8, з подальшим доданням цинку Цинк, за переважним варіантом, додають у вигляді солі цинку, наприклад, без обмежень, ацетату цинку, броміду цинку, хлориду цинку, фториду цинку, йодиду цинку та сульфату цинку Досвідченому фахівцю зрозуміло, що існує багато інших солей цинку, які також можуть бути використані для одержання комплексів мономерних аналогів інсуліну, які є частиною цього винаходу За переважним варіантом використовують ацетат цинку, оксид цинку або хлорид цинку, оскільки згадані сполуки не додають нових ХІМІЧНИХ ІОНІВ до промислове прийнятних процесів Розчиненню згаданого мономерного аналогу інсуліну можна сприяти тим, що традиційно називають "кислотним розчиненням" Для кислотного розчинення рН водного розчинника за допомогою фізіологічне прийнятної кислоти, за переважним варіантом НС1, зменшують до рівня від приблизно 3,0 до 3,5 для сприяння розчиненню згаданого мономерного аналогу До інших фізіологічно прийнятних кислот належать, без обмеження, оцтова кислота, лимонна кислота та сірчана кислота Для регулювання рН під час одержання лікарських форм за цим винаходом фосфорну кислоту, за переважним варіантом, не використовують Далі, рН, за допомогою фізіологічно прийнятної основи, за переважним варіантом, гідроксиду натрію, доводять до рівня приблизно 7,3-7,5 До інших фізіологічне прийнятних основ належать, без обмеження, гідроксид калію та гідроксид амонію У подальшому додають фенольний консервант та цинк Парентеральні лікарські форми за цим винаходом можна одержувати за допомогою традиційних процедур розчинення та змішування Для одержання відповідної лікарської форми, наприклад, відміряну КІЛЬКІСТЬ мономерного аналогу інсуліну у воді об'єднують з необхідним консервантом, сполукою цинку та буфером у воді у достатній КІЛЬКОСТІ для одержання згаданого гексамерного комплексу Перед введенням згадану лікарську форму, як правило, піддають стерилізаційному фільтруванню Пересічному фахівцю у цій галузі є зрозумілими варіанти цього процесу Наприклад, порядок додання згаданих компонентів, порядок регулювання рН, у разі його існування, температури та іонної сили, за яких одержують згадану лікарську форму, можуть оптимізуватись у залежності від концентрації та засобів введення, які застосовуються Наведені далі приклади та препарати надано виключно з метою додаткового ілюстрування одержання згаданих лікарських форм за цим винаходом Об'єм цього винаходу не обмежується наведеними далі прикладами Приклад 1 Одержання розчинної лікарської Форми U100, до складу якої входить LysB28ProB29-aHanor людського інсуліну та трис-буфер КІЛЬКІСТЬ Lys Pro -аналогу людського інсуліну-кристалів цинку з розрахунку одержання 100 одиниць інсулінової активності на мілілітр кінцевої лікарської форми суспендували у водному розчині, до складу якого входило 0,715 мг/мл фенолу, 1,76 16 61109 мг/мл т-крезолу, 16 мг/мл гліцерину та оксид цинку До складу згаданої суміші аналогу інсулінукристалів цинку входило приблизно 0,36% (мас) цинку Концентрація оксиду цинку у водному розріджувачі була такою, що забезпечувала кінцеву концентрацію ІОНІВ цинку у згаданій лікарській формі на рівні приблизно 0,025мг/100 одиниць інсулінової активності 10% об'єм хлористоводневої кислоти додавали з метою доведення рН до рівня 2,8-3,0 Після перемішування для розчинення кристалів, для доведення рН до рівня 7,4-7,7 обережно додавали 10% аліквоти розчину гідроксиду натрію До одержаного розчину інсулінового аналогу додавали об'єм концентрованого розчину трисбуферу (50мг/мл, рН 7,4, визначено при температурі довколишнього середовища, тобто при температурі приблизно 22°С) з розрахунку одержання концентрації трис-буферу у кінцевій лікарській формі на рівні 2мг/мл Для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду Одержану лікарську форму піддавали стерилізаційному фільтруванню за допомогою 0,2мкм фільтру Приклад 2 Одержання розчинної лікарської форми U100, до складу якої входить Lys B28 Pro B29 аналог людського інсуліну та L-арпнш Було здійснено процес, опис якого наведено у Прикладі 1, до додання буферу Після цього, замість додання об'єму концентрованого розчину трис-буферу, до одержаного розчину інсулінового аналогу додавали об'єм концентрованого розчину L-арпншу (200 мМ, рН 7,4), з розрахунку одержання концентрації L-арпніну у кінцевій лікарській формі на рівні 20мМ Для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду Одержану лікарську форму піддавали стерилізаційному фільтруванню за допомогою 0,2мкм фільтру Приклад З Одержання розчинної лукарської форми U400, до складу якої входить Lys 28РгоВ29-аналог людського інсуліну та трис-буфер RR RQ 9 v КІЛЬКІСТЬ Lys Pro -аналогу людського інсуліну-кристалів цинку з розрахунку одержання 400 одиниць інсулінової активності на мілілітр кінцевої лікарської форми суспендували у водному розчині, до складу якого входило 0,715мг/мл фенолу, 1,76мг/мл m-крезолу, 16мг/мл гліцерину та оксид цинку До складу згаданої суміші аналогу інсулінукристалів цинку входило приблизно 0,36% (мас) цинку Концентрація оксиду цинку у водному розріджувачі була такою, що забезпечувала кінцеву концентрацію ІОНІВ цинку у згаданій лікарській формі на рівні приблизно 0,025мг/100 одиниць інсулінової активності 10% об'єм хлористоводневої кислоти додавали з метою доведення рН до рівня 2,8-3,0 Після перемішування для розчинення кристалів, для доведення рН до рівня 7,4-7,7 обережно додавали 10% аліквоти розчину гідроксиду натрію До одержаного розчину інсулінового аналогу додавали об'єм концентрованого розчину трисбуферу (50мг/мл, рН 7,4, визначено при температурі довколишнього середовища, тобто при температурі приблизно 22°С) з розрахунку одержання концентрації трис-буферу у кінцевій лікарській фо 17 рмі на рівні 2мг/мл Для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду Одержану лікарську форму піддавали стерилізаційному фільтруванню за допомогою 0,2мкм фільтру Приклад 4 Одержання розчинної лікарської форми U400, до складу якої входить Lys B 2 8 Pro B 2 9 -aHanor людського інсуліну та фосфат poo RC O] КІЛЬКІСТЬ Lys Pro -аналогу людського інсуліну-кристалів цинку з розрахунку одержання 400 одиниць інсулінової активності на мілілітр кінцевої лікарської форми суспендували у водному розчині, до складу якого входило 0,715 мг/мл фенолу, 1,76 мг/мл т-крезолу, 16 мг/мл гліцерину та оксид цинку До складу згаданої суміші аналогу інсулінукристалів цинку входило приблизно 0,36% (мас) цинку Концентрація оксиду цинку у водному розріджувачі була такою, що забезпечувала кінцеву концентрацію ІОНІВ цинку у згаданій лікарській формі на рівні приблизно 0,025мг/100 одиниць інсулінової активності 10% об'єм хлористоводневої кислоти додавали з метою доведення рН до рівня 2,8-3,0 Після перемішування для розчинення кристалів, для доведення рН до рівня 7,4-7,7 обережно додавали 10% аліквоти розчину гідроксиду натрію До одержаного розчину інсулінового аналогу додавали об'єм концентрованого розчину двоосновного фосфату натрію з розрахунку одержання концентрації двоосновного фосфату натрію у кінцевій лікарській формі на рівні 3,78 мг/мл, рН 7,4±0,1 Для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду Одержану лікарську форму піддавали стерилізаційному фільтруванню за допомогою 0,2мкм фільтру Приклад 5 Одержання розчинної лікарської форми U400, до складу якої входить Lys B 2 8 Pro B 2 9 аналог людського інсуліну та L-арпнш Було здійснено процес, опис якого наведено у Прикладі 3, до додання буферу Після цього, замість додання об'єму концентрованого розчину трис-буферу, до одержаного розчину інсулінового аналогу додавали об'єм концентрованого розчину L-арпншу (200 мМ, рН 7,4), з розрахунку одержання концентрації L-арпніну у кінцевій лікарській формі на рівні 20мМ Для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду Одержану лікарську форму піддавали стерилізаційному фільтруванню за допомогою 0,2мкм фільтру Приклад 6 Одержання лікарської Форми U100, у вигляді збагаченої суміші Lys B 2 8 Pro B 2 -аналогу людського інсуліну (75% (у об'ємному відношенні) розчинного, 25% (у об'ємному відношенні) нейтрального протаміну Lys B 2 8 Pro B 2 ), до складу якої входить Lарпнін А Одержання нейтрального розчину протаміну Lys B 2 8 Pro B 2 9 КІЛЬКІСТЬ Lys B 2 8 Pro B -інсулінукристалів цинку з розрахунку вмісту 200 Од/мл суспендували у водному розчині, до складу якого входило 0,715 мг/мл фенолу, 1,76 мг/мл т крезолу, 16 мг/мл гліцерину та оксид цинку, який було підкислено хлористоводневою кислотою з одержанням кінцевої концентрації ІОНІВ цинку на 61109 18 рівні 0,025 мг/100 Од 10% об'єм хлористоводневої кислоти додавали з метою доведення рН до рівня 2,8-3,0 Після перемішування для розчинення кристалів, для доведення рН одержаного розчину до рівня 7,4-7,7 додавали 10% розчин гідроксиду натрію Додавали 75,6 мг/мл розчину двоосновного фосфату натрію, рН 7,2, з розрахунку одержання концентрації у кінцевій лікарській формі на рівні 3,78 мг/мл Після розчинення твердих речовин, які випали до осаду, та титрування з метою підтримання рН на рівні 7,4, для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду, після чого одержаний розчин фільтрували Твердий протамінсульфат, який, за розрахунками, вміщував 0,6 мг/100 Од протамшової основи, розчиняли у водному розчині, який вміщував 0,715 мг/мл фенолу, 1,76 мг/мл m-крезолу та 16 мг/мл гліцерину Твердий двоосновний фосфат натрію додавали таким чином, щоб концентрація у згаданій лікарській формі дорівнювала 3,78 мг/мл 10% об'єм хлористоводневої кислоти додавали з метою доведення рН одержаного розчину до рівня 7,4, розбавляли водою до кінцевого об'єму та фільтрували poo RC O] Розчин Lys Pro (200 одиниць) та розчин протаміну зрівноважували при температурі 15°С Згаданий розчин протаміну додавали до розчину Lys 2 8 P r o B 9 і одержану суспензію шкубували без перемішування при температурі 15°С впродовж 24 годин ото ROQ В Одержання збагаченої суміші Lys Pro КІЛЬКІСТЬ розчину Lys B 2 8 Pro B 2 9 (100 одиниць), до складу якого входив L-арпнш, який було одержано у Прикладі 2, яка відповідала 75% кінцевому об'єму, додавали до розрахованого об'єму 100 Од/мл нейтрального розчину протаміну Lys B 2 8 Pro B 2 9 Одержану суспензію перемішували при температурі довколишнього середовища Приклад 7 Одержання лікарської форми U100 у вигляді бідної суміші Lys B 2 8 Pro B 2 9 -aHanory людського інсуліну (25% (у об'ємному відношенні) розчинного, 75% (у об'ємному відношенні) нейтрального протаміну Lys B 2 8 Pro 2 9 ) , до складу якої входить Lарпнін А Одержання нейтрального розчину протаміB28 ProB29 HyLys R & RQ 9 9 КІЛЬКІСТЬ Lys Pro -інсуліну-кристалів цинку з розрахунку вмісту 200 Од/мл суспендували у водному розчині, до складу якого входило 0,715 мг/мл фенолу, 1,76 мг/мл т-крезолу, 16 мг/мл гліцерину та оксид цинку, який було підкислено хлористоводневою кислотою з одержанням кінцевої концентрації ІОНІВ цинку на рівні 0,025 мг/100 Од 10% об'єм хлористоводневої кислоти додавали з метою доведення рН до рівня 2,8-3,0 Після перемішування для розчинення кристалів, для доведення рН одержаного розчину до рівня 7,4-7,7 додавали 10% розчин гідроксиду натрію Додавали 75,6 мг/мл розчину двоосновного фосфату натрію, рН 7,2, з розрахунку одержання концентрації у кінцевій лікарській формі на рівні 3,78 мг/мл Після розчинення твердих речовин, які випали до осаду, та титрування з метою підтримання рН на рівні 7,4, для розбавлення згаданої лікарської форми до кінцевого об'єму додавали воду, після чого одер 61109 20 19 жаний розчин фільтрували протаміну зрівноважували при температурі 15°С Твердий протамінсульфат, який, за розрахунЗгаданий розчин протаміну додавали до розчину ото RvQ ками, вміщував 0,6 мг/100 Од протамшової основи, Lys Pro і одержану суспензію шкубували без розчиняли у водному розчині, який вміщував 0,715 перемішування при температурі 15°С впродовж 24 мг/мл фенолу, 1,76 мг/мл m-крезолу та 16 мг/мл годин гліцерину Твердий двоосновний фосфат натрію ото ROQ В Одержання бідної суміші Lys Pro додавали таким чином, щоб концентрація у згадаpoo RQ v ній лікарській формі дорівнювала 3,78 мг/мл 10% КІЛЬКІСТЬ розчину Lys Pro (100 одиниць), об'єм хлористоводневої кислоти додавали з медо складу якого входив L-арпнш, який було одертою доведення р Н одержаного розчину до рівня жано у Прикладі 2, яка відповідала 25% кінцевому 7,4, розбавляли водою до кінцевого об'єму та фіоб'єму, додавали до розрахованого об'єму 100 льтрували Од/мл нейтрального розчину протаміну poo R C O] Lys B28 Pro B29 Одержану суспензію перемішували Розчин Lys Pro (200 одиниць) та розчин при температурі довколишнього середовища Комп'ютерна верстка М Клюкш Підписне Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ДП "Український інститут промислової власності", вул Сім'ї Хохлових, 15, м Київ, 04119
ДивитисяДодаткова інформація
Назва патенту англійськоюStabilized insulin formulations
Автори англійськоюFranc Bruce Khill, Li, Shun
Назва патенту російськоюСтабильные лекарственные формы инсулина
Автори російськоюФренк Брюс Хилл
МПК / Мітки
МПК: A61K 38/28, A61P 3/10
Мітки: спосіб, лікарська, стійка, інсулінова, одержання, варіанти, форма
Код посилання
<a href="https://ua.patents.su/10-61109-stijjka-insulinova-likarska-forma-ta-sposib-oderzhannya-varianti.html" target="_blank" rel="follow" title="База патентів України">Стійка інсулінова лікарська форма та спосіб її одержання (варіанти)</a>
Попередній патент: Спосіб лікування розацеа
Наступний патент: Спосіб обезводнення матеріалів
Випадковий патент: Спосіб силуетного перетворення модуля пройми