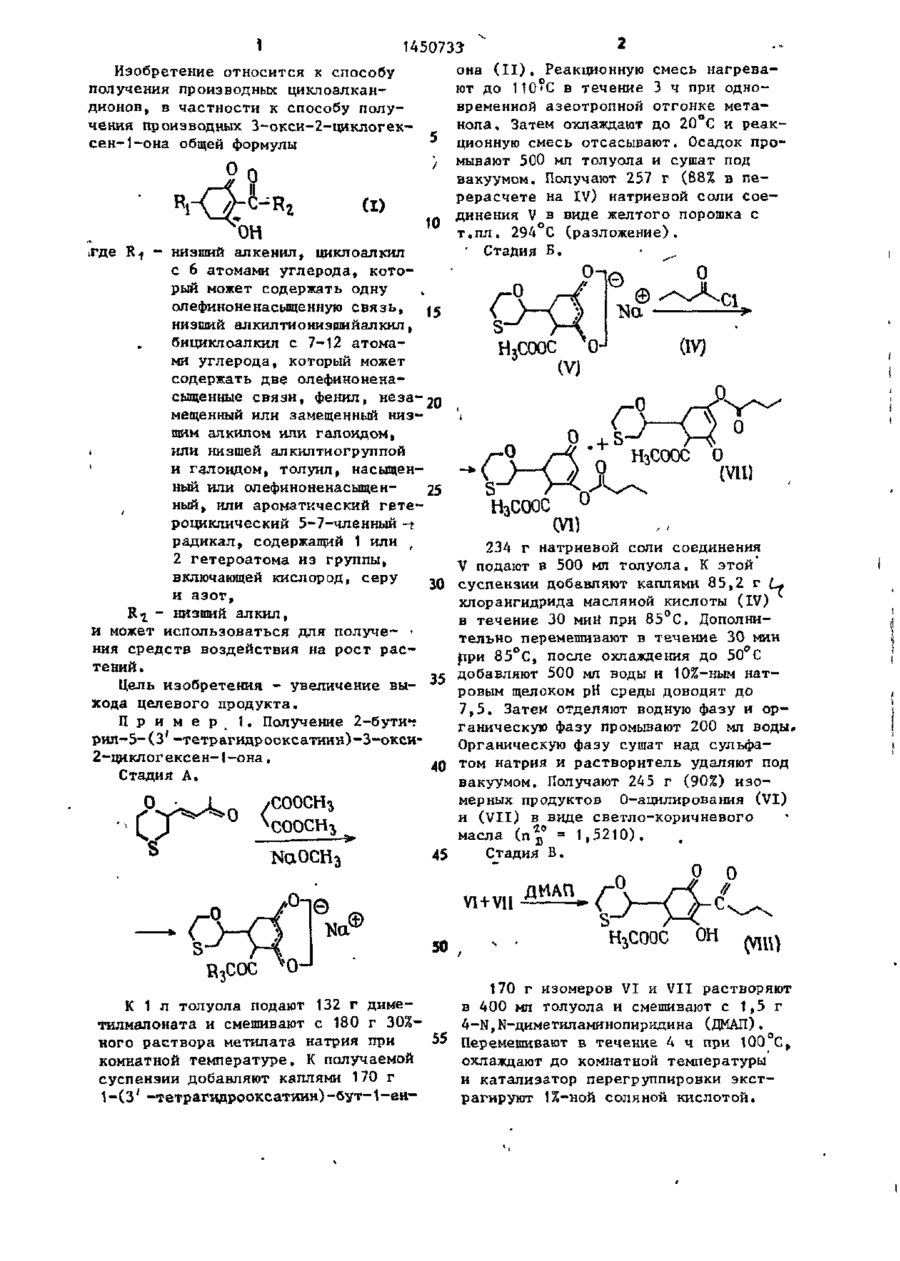
Спосіб отримання похідних 3-оксі-2-ціклогексен-1-она”
Формула / Реферат
Формула изобретения
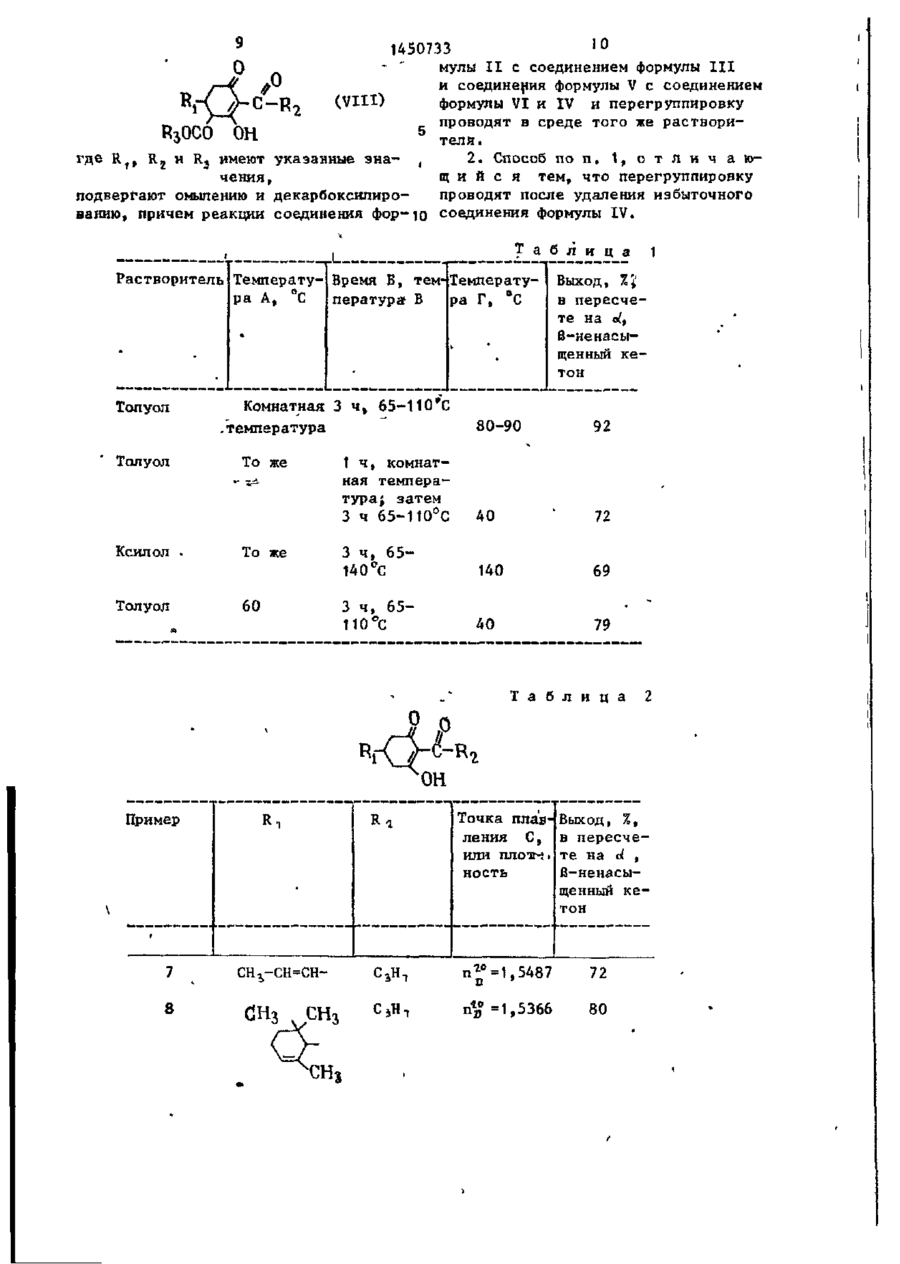
1. Способ получения производных 3-окси-2-циклогексен-1-она общей формулы
где R1 - низший алкенил, циклоалкил с 6 атомами углерода, который может содержать одну олефиноненасыщенную связь, низший алкилтионизшийалкил, бициклоалкил с 7-12 атомами углерода, который мотет содержать две олефиноненасыщенный связи, фенил, незамещенный или замещенный низшим алкилом или галоидом, или низшей алкилтиогруппой и галоидом, толуил, насыщенный или олефиноненасыщенный, или ароматический гетероциклический 5-7-членный радикал, содержащей 1 или 2 гетероатома из группы, включающей кислород, серу и азот,
R2 - низший алкил, путем взаимодействия соединения обшей формулы
где R, имеет указанное значение, со сложным диалкиловым эфиром малоновой кислоты общей формулы
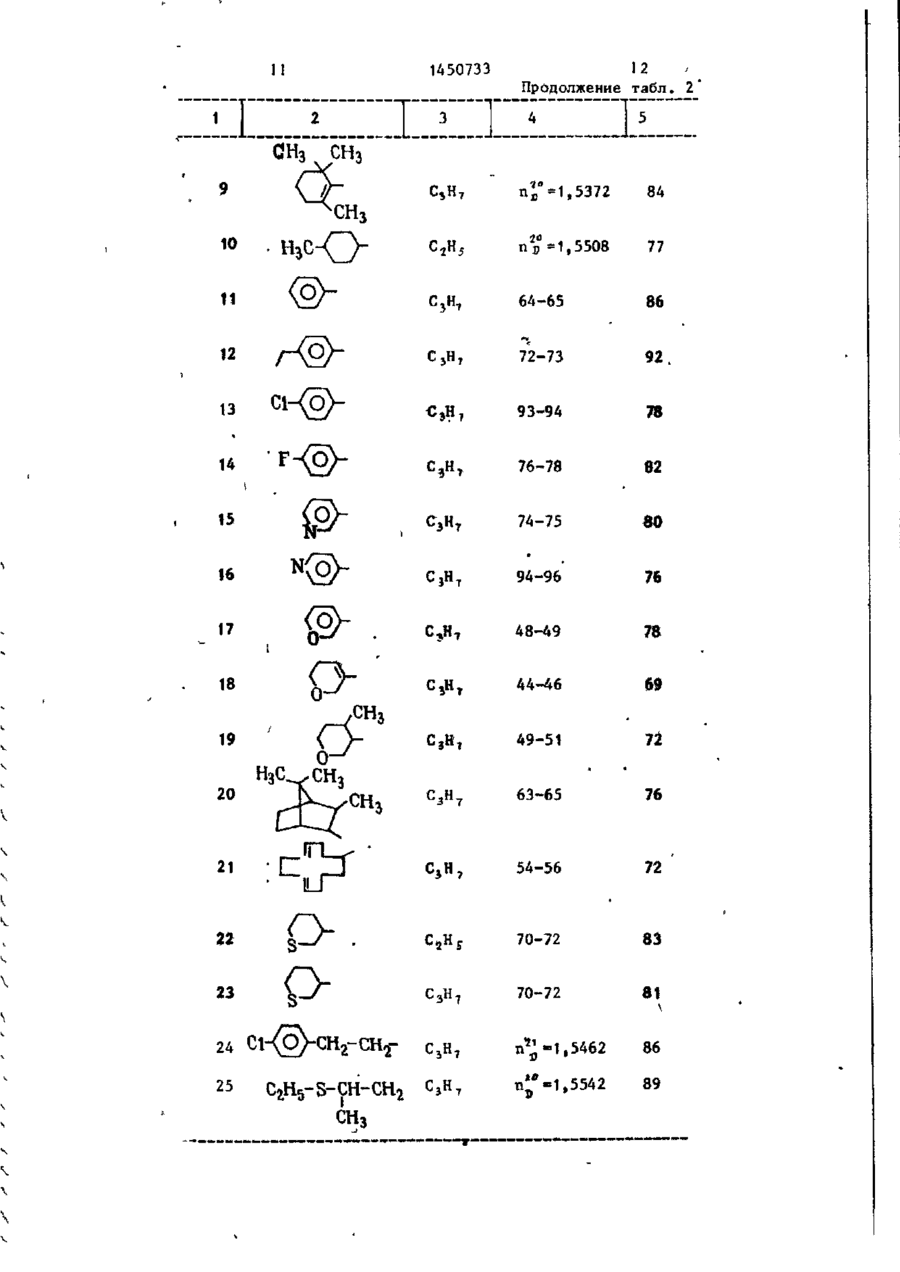
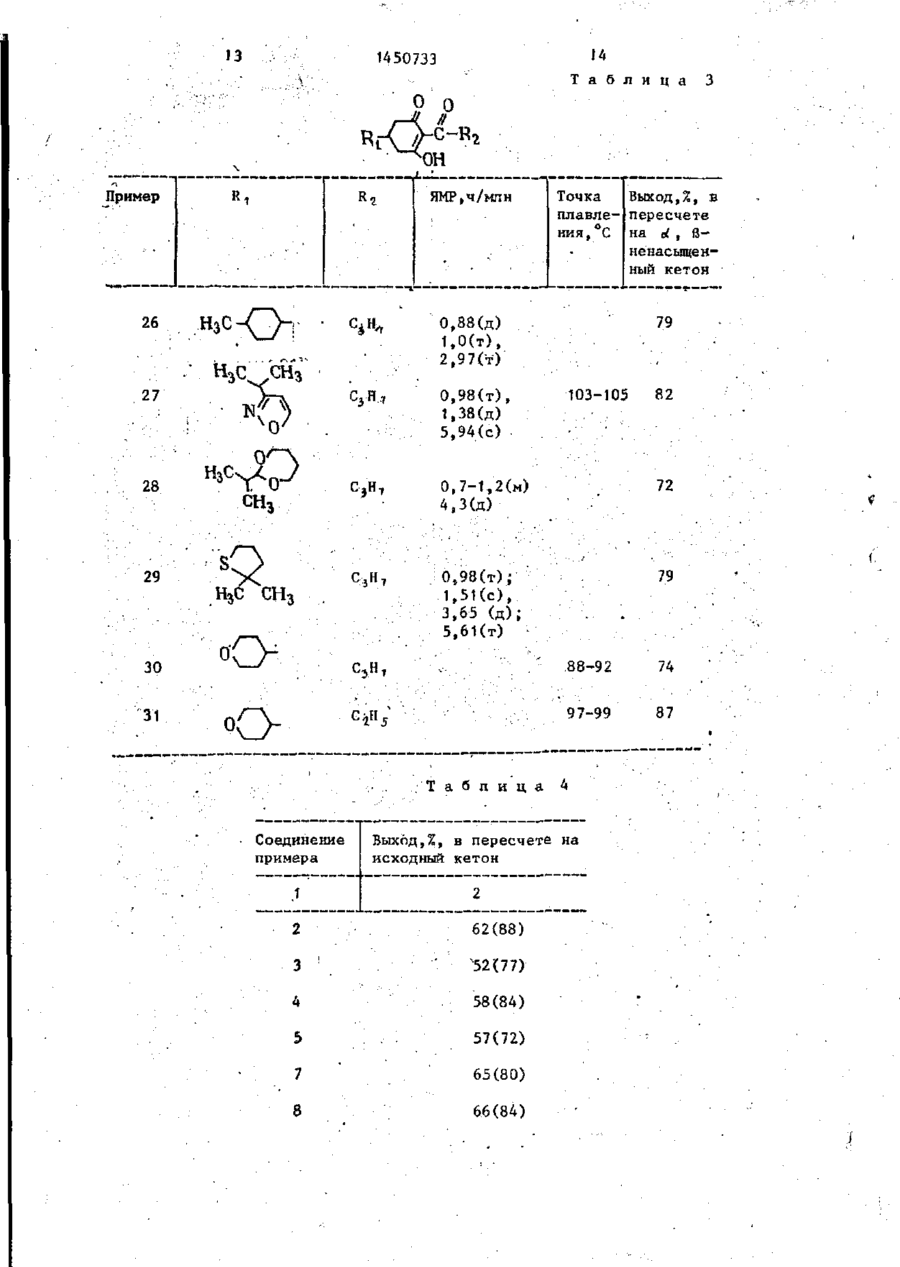
где R3 - низший алкил, в присутствии щелочного основания в среде растворителя с последующей переработкой получаемого при этом соединения с применением омыления, декарбоксилирования и ацилирования соединением общей формулы
где R2 имеет указанное значение,
Hal - галоид
с последующим выделением целевого продукта, отличающийся тем, что, с целью повышения выхода целевого продукта, реакцию соединений II и III проводят при температуре от комнатной до 110°С в среде ароматического растворителя, позволяющего отгонку в виде азеотропа выделившегося спирта, получаемое при этом соединение общей формулы
где R1 и R3 имеют указанные значения,
Me -щелочной металл, подвергают взаимодействию с соединением общей формулы IV при 40-140°C, получаемую при этом смесь сложных эфиров общих формул
где R1, R2 и R3 имеют указанные значения,
подвергают перегруппировке при·100°С в присутствии третичного амина и получаемое при этом соединение формулы
где R1, R2 и R3 имеют указанные значения,
подвергают омылению и декарбоксилированию, причем реакция соединения формулы II с соединением формулы III и соединения формулы V с соединением формулы VI и IV и перегруппировку проводят в среде того же растворителя.
2, Способ по п.1, отличаю-пийся тем, что перегруппировку проводят после удаления избыточного соединения формулы IV.
Текст
Изобретение относится к циклическим кетонам, в частности к получению производных З-окси-2-циклогексен1-она фор-лы СН ^CHR-j-CH r C ( O ) - C -,;=? І [C(O)R*] - С(ОН), где R , - низший / алкенил-, С^ - циклоалкил, который может содержать одну олефиноненасыщенную с в я з ь , низший алкилтионизшийалкил, С 7- ti. "бициклоалкил, который может содержать две олефиноненасыщенные связи, фенил, незамещенный или замещенный низшим алкилом или галоидом, или низшей ал килтиогруппой и галоидом, толукл, насыщенный или олефиноненасьнценный, или ароматический гетероциклический 5-7-членный радикал, содержащий 1 или 2 гетероатома из группы, включающей О, S, N; R^ - низший алкил, которые могут быть использованы для получения средств воздействия на рост растений. Цель— повышение выхода целевого продукта. Получение его эедут ич соединения ф-лы С И* где RT указано выше, и сложного диалкилового эфира малоновой кислоты ф-лы CH2(COOR3) , где R g - низший алкил, в присутствии щелочного основания при температуре от комнатной до 110°С в среде ароматического растворителя,* обеспечивающего отгонку в виде азеотропа выделившегося спирта. Полученное соединение подвергают взаимодействию с соединением ф-лы R-t-C(O) Hal ( I ) , где Кг имеет указанное значение a Hal - г а - ; лоид при 40-140 С, в среде ароматического растворителя. Полученную при этом смесь сложных эфиров подвергают перегруппировке при 100 С в среде ароматического растворителя (предпочтительно после удаления избыточного соединения) в присутствии т р е тичного амина. Полученное при этом соединение ф-лы tH(COORs)=CHR 145073? она (II). Реакционную смесь нагреваИзобретение относится к способу ют до 110 * С в течение 3 ч при однополучения производных циклоалканвременной азеотропной отгонке метадионов, в частности к способу полунола. Затем охлаждают до 20 С и реакчения производных З-окси-2-циклогекционную смесь отсасывают. Осадок просен-1-она общей формулы мывают 500 мл толуола и сушат под О л вакуумом. Получают 257 г (88% в перерасчете на IV) натриевой соли сое(I) динения V в виде желтого порошка с 10 т.пл. 294°С (разложение). ОН ' Стадия Б. • ігде R1 - низший алкенил, циклоалкил с 6 атомами углерода, который может содержать одну олефиноненасыщенную связь, ^е низший алкилтионизшийалкил, бициклоалкил с 7-12 атомами углерода, который может содержать две олефиноненасыщенные связи, фенил, неза-20 мещенный или замещенный низшим алкилом или галоидом, t или низшей алкилтиогруппой ' и галоидом, толуил, насыщенный или олефиноненасыщен25 ный, или ароматический гетео роциклический 5-7-членный -г Н 3 С00С (У1) радикал, содержащий 1 или г 234 г натриевой соли соединения 2 гетероатома из группы, V подают в 500 мл толуола. К этой включающей кислород, серу , 0 суспензии добавляют каплями 85,2 г L+ и азот, хлорангидрида масляной кислоты (IV) R^ - низший алкил, в течение 30 мин при 85°С. Дополнии может использоваться для получе- ' тельно перемешивают в течение 30 мин ния средств воздействия на рост расрри 85°С, после охлаждения до 50 С тений. добавляют 500 мл воды и 10%-ным натЦель изобретения - увеличение вы- J - ровым щелоком рН среды доводят до хода целевого продукта. 7,5. Затем отделяют водную фазу и орП р и м е р 1. Получение 2-6 ути*? ганическую фазу промывают 200 мл воды. рил-5-(3' -тетрагидрооксатиии)-3-оксиОрганическую фазу сушат над сульфа2-циклогексен-1-она. 40 том натрия и растворитель удаляют под Стадия А. вакуумом. Получают 245 г (90%) изомерных продуктов О-ацилирования (VI) и (VII) в виде светло-коричневого масла (пд° = 1,5210). Стадия В. 45 0-& VI + VII 50 ДИАП гЦСООС 170 г изомеров VI и VII растворяют К 1 л толуола подают 132 г димев 400 мл толуола и смешивают с 1,5 г тилмалоната и смешивают с 180 г 30%4-Н,Ы-диметиламинопиридина (ДМАП), 55 Перемешивают в течение 4 ч при 100°С ного раствора метилата натрия при > комнатной температуре. К получаемой охлаждают до комнатной температуры суспензии добавляют каплями 170 г и катализатор перегруппировки экст1-(3' -тетрагидрооксатяин)-бут-1-енрагируют 1%-ной соляной кислотой. 1450733 ной кислоты при 60°С, получаемый После сушки над сульфатом натрия под осадок отсасывают после охлаждения вакуумом из органической фазы удадо комнатной температуры и промывают ляют р а с т в о р и т е л ь . Получают 162 г водой до нейтральной реакции. После (95% теории) продукта V I I I в виде 2 0 сушки получают 239 г (88%), в п е р е светло-коричневого масла (п в =1,5440). счете на с{ t В-ненасыщенный кетон, Стадия Г. 2-бутирил-5-(п-толуил)-3-окси-2-циклогексен-1-она,с т . п л . 76-78°С. 1. N Q O H П р и м е р 3 . Получение 2-про10 2. НС1 пионил-5-(пирид-3' -ил)-3-окси-2-циклогексен-1-она. К раствору 132 г диметилмалоната в 1 л толуола добавляют 180 г 30%15 ного раствора метилата натрия. Затем //-С добавляют по каплям при сильном перемешивании 147 г 1-(пирид-3' - и л ) - б у т ОН 1-ен-З-она. Реакционную смесь подогревают в течение 3 ч , при этом од136 г продукта V I I I растворяют в 20 новременно осуществляют отгонку метанола, пока не будет достигнута п е 480 г 10%-ного натрового щелока и реходная температура 110 С. Затем д о перемешивают в течение 2 ч при 80°С. бавляют 92,5 г хлорангидрида прописЗатем подкисляют при 60 С 108 мл конновой кислоты при 8 0 ° с , в течение центрированной соляной кислоты, о т сасывают осадок после охлаждения до 25 1 ч дополнительно перемешивают при 80°С. После добавления 5 г 4-^,В-дикомнатной температуры и промывают в о іметиламинопиридина перемешивают в т е дой до нейтральной реакции. После чение 4 ч при 100 °С. После охлаждения сушки под вакуумом получают 100,4 г до комнатной температуры реакционную (89% теории)2-бутирил~5(3' - т е т р а г и д смесь дважды экстрагируют 10%-ным рооксатиин)-3-окси-2-циклогексен-130 натровым щелоком, взятым в общем к о она в виде светло-желтых кристаллов личестве 1,2 к г , и получаемый щелочс т . п л . 72-73°С. ной экстракт затем перемешивают в Таким образом, выход целевого продукта составляет примерно 68% в течение 3 ч при 60°С, Затем к р е а к пересчете на о(, В-ненасыщенный кетон. -_ ционной смеси добавляют 365 г 30%, П р и м е р 2. Получение 2-бутиной соляной кислоты и перемешивают в рил-5-(п-толуил)-3-окси-2-циклогектечение 2 ч при 50 С. После охлаждесен-1-она. ния до комнатной температуры выпавК раствору 132 г диметилмалоната в шее твердое вещество отсасывают, ' 1 л.толуола прибавляют 180 г 30%40 промывают водой и сушат. Получают ного раствора метилата натрия при 189 г (77%), в пересчете на d , Вкомнатной температуре, К получаемой ненасыщенный кетон, 2-пропионил-(5смеси» интенсивно перемешивая, припирид-3' - и л ) - 3 - о к с и - 2 - ц и к л о г е к с е н - 1 бавляют по каплям 160 г п-метил-бензона с т . п л . 80-81 °С. алацетона. Реакционную смесь н а г р е 45 П р и м е р 4 . Получение 2-бути-ч вают в течение 3 ч , при этом однорил-5-циклогексил-3-окси-2-циклогек— временно осуществляют азеотропную о т сен-1-она# гонку метанола, пока не Оудет д о с т и г Аналогично примеру \ подвергают нута переходная температура 110°С. взаимодействию раствор 132 г диметил*Затем добавляют 106 г хлорангидрида 50 малоната в 1 л толуола, 180 г 30%масляной кислоты при 80-90 С-и дополного метилата натрия, 152 г 1-цикло- • нительно перемешивают .После добавления гексилГ-ут- 1-ен-З-она и 106,5 г хло5 г4-ї$,М-диметиламинопиридина в т е ч е рангидрида масляной кислоты. К получаемой реакционной смехи добавляют ние 3-4 ч перемешивают при 100 С и затем упаривают растворитель. К получаемому 5 5 г 4 -^» в -ДИметиламинопиридина, д о 5 остатку прибавляют раствор 1 2 0 г г и д р о полнительно перемешивают в течение 4 ч при 100°С и затем охлаждают до окиси натрия в 1,5л воды и в течение 2 ч комнатной температуры. Затем дважды перемешивают при 8 0 ° с . Затем подкисэкстрагируют гидроокисью натрия, взя— ляют 270 мл концентрированной соля** 1450733 той в общем количестве 3,5 моль и новременно осуществляют азеотропную в 1,5 л воды, и объединенные щелочотгонку метанола в пределах темпераные экстракты перемешивают в течение туры Б. Затем добавляют 106 г хлоран2 ч при 80°С. Затем подкисляют 270 мл гидрида масляной кислоты при темпеконцентрированной соляной кислоты ратуре Г и дополнительно перемешивапри 50°С, экстрагируют получаемое ют. После добавления 5 г 4-N,N-n,HMeмасло хлористым метиленом, экстрактиламинопиридина в течение 3-4 ч ты промывают водой я сгущают в ваперемешивают при 100 С и затем упакууме. Получают 222 г (84%), в пере10 ривают растворитель, К получаемому счете на of, а-ненасыщенный кетон, остатку прибавляют раствор 120 г 2-бутирил-5-циклогексил-3-окси-2гидроокиси натрия в 1,5 л воды и в циклогексен-1-она в виде светло-котечение 2 ч перемешивают при 80°С. ричневого масла (п д° = 1,5426). Затем подкисляют 270 мл концентрированной соляной кислоты при 60°С, поПример 5. Получение 2-бу15 лучаемый осадок отсасывают после тирИ1г-5-(п-этилфенил)-3-окси-2-циклоохлаждения до комнатной температуры [гексен-1-она. и промывают водой до нейтральной ре' К раствору 232 г диметилмалоната акции.После сушкиполучают 2-бутирилв 1 л кислоты прибавляют 180 г 30%5-(п-этилфенил)-3-окси-2-циклогексенного раствора метилата натрия при 2о 1-он с т.пл. 72-73°С. комнатной температуре. К получаемой смеси, интенсивно перемешивая, приДанные приведены в табл. 1. бавляют по каплям 160 г п-этилАналогично нримерам 1-6 получают бензалацетона. Реакционную смесь соединения формулы ( I ) , приведенные нагревают в течение 3 ч, при этом од- 25 в табл. 2 и 3. новременно осуществляют азеотропную Пример 32. (сравнительный). отгонку метанола, пока небудет до170 г 1-(3' -тетрагидротиопиранил)стигнута переходная температура 110°С. бут-1-ен-З-она добавляют к 132 г диЗатем добавляют три эквивалента хлометилмалоната при комнатной темперарангидрида масляной кислоты при 80°С, зО туре и смешивают с J80 г 30%-ного медополнительно перемешивают в течение танольного раствора метилата натрия. 15 мин, после чего избыток отгоняют. Перемешивают в течение 4 ч при 60°С После добавления 5 г 4-Ы,Ы-диметили реакционную смесь смешивают с 600 г аминопиридина в течение 3-4 ч пере10%-ного натрового щелока, после чемешивают при 100°С и затем упаривают го дополнительно перемешивают в терастворитель. К получаемому остатку чение 3 ч при 110°С при одновременприбавляют раствор 120 г гидроокиси ной отгонке метанола, Затем реакционнатрия в 1,5 л воды и в течение 2 ч ную смесь смешивают с 200 мл толуола перемешивают при 80°С. Затем подкис-,/ и водную фазу отделяют. Водную фазу ляют 270 мл концентрированной соляподкисляют концентрированной соляной ной кислоты при 60°С, получаемый оса- 40 кислотой при 60 С и после охлаждения док отсасывают после охлаждения до до комнатной температуры выпавший комнатной температуры и промывают осадок отсасывают и промывают водой водой до нейтральной реакции. После до нейтральной реакции. После сушки сушки получают 2-бутирил-5-(п-этилпод вакуумом при 60°С получают 187 фенил)-3-окси-2-циклогексен-1-он с г 5-(3'-тетрагидротиопиранил)-3-окт.пл. 72-73°С, Выход 65% в пересчете сициклогекс-2-ен-1-она (Б) в виде желтоватых кристаллов с т.пл. 166— й-ненасыщенный кетон. на 168°С. Выход 88% в пересчете на исПример 6. Получение 2-бутиходный кетон. рил-5-(п~этилфенил)-3-окси-2-цикло- 50 187 г 5-(3 -тетрагидротиопиранил)гексен-1-она. 3-оксициклогекс-2-ен-1-она растворяК раствору 132 г диметилмалоната ют в 500 мл толуола и при 85 С смев 1 л растворителя прибавляют 180 г шивают с 94,0 г хлорангидрида масля30%—ного раствора метилата натрия ной кислоты. Затем дополнительно пепри температуре А. К получаемой смеремешивают в течение 2 ч при 85°С, (~ си, интенсивно перемешивая, прибавпосле охлаждения до 50 С добавляют' ляют по каплям 160 г п-этилбенэала500 мл воды. Водную фазу отделяют, ,цетона. Реакционную смесь нагревают а органическую фазу экстрагируют в течение времени Б, при этом од~ 1450733 400 мл 10%-ного натрового щелока. С R 2 и Rj имеют указанные знащ и й с я тем, что перегруппировку чения, проводят после удаления избыточного подвергают омылению и декарбоксилированию, причем реакции соединения фор~ю соединения формулы IV. Q Т а б л и ц а I Растворитель Температу- Время Б, тем- Температура А, °С пература В ра Г, °С • • • Толуол Толуол Ксилол Толуол Комнатная 3 ч , 65-110*С .темпер атура Выход э % 1 в пересче те на
ДивитисяДодаткова інформація
МПК / Мітки
МПК: C07C 45/45, C07C 49/703, C07C 313/00, C07C 67/00, C07C 401/00, C07D 335/00, C07C 45/48, C07D 309/22, C07C 49/713, C07C 49/723, C07C 45/00, C07B 41/00, C07C 403/00, C07D 213/50, C07D 309/06, C07C 49/747, C07B 37/00, C07C 45/67, C07C 323/22
Мітки: похідних, отримання, спосіб, 3-оксі-2-ціклогексен-1-она
Код посилання
<a href="https://ua.patents.su/10-7020-sposib-otrimannya-pokhidnikh-3-oksi-2-ciklogeksen-1-ona.html" target="_blank" rel="follow" title="База патентів України">Спосіб отримання похідних 3-оксі-2-ціклогексен-1-она”</a>
Попередній патент: Гербіцидний засіб
Наступний патент: Завантажувальний пристрій шахтної печі
Випадковий патент: Спосіб діагностики стану щитоподібної залози за пауком-лазориком