Кетоліди класу 15-членних лактамів, спосіб їх одержання та фармацевтична композиція з антибактеріальною активністю
Номер патенту: 70941
Опубліковано: 15.11.2004
Автори: Лазаревскі Горяна, Кобрехел Габрієла, Келнеріч Желйко
Формула / Реферат
1. Сполука загальної формули (І)
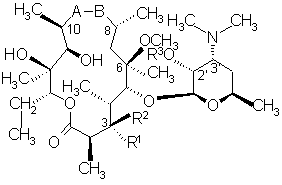 , (І)
, (І)
та її фармацевтично прийнятні адитивні солі з неорганічними та органічними кислотами,
де
А означає групу NH і В, водночас, означає групу С=О
або
А означає групу С=О і В, водночас, означає групу NH,
R1 означає групу ОН, L-кладинозильну групу формули (II)
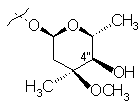 (ІІ)
(ІІ)
або разом з R2 означає кетон,
R2 означає водень або разом з R1 означає кетон,
R3 означає водень або С1-С4алканоїльну групу.
2. Сполука за п. 1, яка відрізняється тим, що А означає групу NH, В означає групу С=О, R1 означає L-кладинозильну групу формули (II), R2 та R3 однакові та означають водень.
3. Сполука за п. 1, яка відрізняється тим, що А означає групу С=О, В означає групу NH, R1 означає L-кладинозильну групу формули (II), R2 та R3 однакові та означають водень.
4. Сполука за п. 1, яка відрізняється тим, що А означає групу NH, В означає групу С=О, R1 означає групу ОН, R2 та R3 однакові та означають водень.
5. Сполука за п. 1, яка відрізняється тим, що А означає групу С=О, В означає групу NH, R1 означає групу ОН, R2 та R3 однакові та означають водень.
6. Сполука за п. 1, яка відрізняється тим, що А означає групу NH, В означає групу С=О, R1 означає групу ОН, R2 є воднем і R3 означає С1-С4алканоїльну групу.
7. Сполука за п. 6, яка відрізняється тим, що R3 означає ацетильну групу.
8. Сполука за п. 1, яка відрізняється тим, що А означає групу С=О, В означає групу NH, R1 означає групу ОН, R2 є воднем і R3 означає С1-С4алканоїльну групу.
9. Сполука за п. 8, яка відрізняється тим, що R3 означає ацетильну групу.
10. Сполука за п. 1, яка відрізняється тим, що А означає групу NH, В означає групу С=О, R1 разом з R2 означають кетон і R3 є воднем.
11. Сполука за п. 1, яка відрізняється тим, що А означає групу С=О, В означає групу NH, R1 разом з R2 означають кетон і R3 є воднем.
12. Спосіб одержання сполуки загальної формули (І)
 (І)
(І)
та її фармацевтично прийнятних адитивних солей з неорганічними й органічними кислотами, де
А означає групу NH і В, водночас, означає групу С=О
або
А означає групу С=О і В, водночас, означає групу NH,
R1 означає групу ОН, L-кладинозильну групу формули (II)
 (ІІ)
(ІІ)
або разом з R2 означає кетон,
R2 означає водень або разом з R1 означає кетон,
R3 означає водень або С1-С4алканоїльну групу,
який відрізняється тим, що 6-О-метилеритроміцин А формули (III)
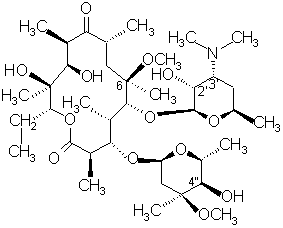 (ІІІ)
(ІІІ)
піддають реакції з солянокислим гідроксиламіном у присутності придатних неорганічних чи органічних основ, одержуючи суміш 6-О-метилеритроміцину А 9(Е)- і 9(Z)-оксимів формули (IV)
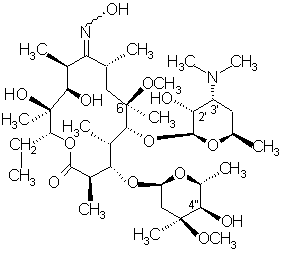 , (IV)
, (IV)
яку потім піддають реакції перегрупування Бекмана з арилсульфонілгалогенідами, більш прийнятно з п-толуолсульфонілхлоридом, у присутності неорганічних основ, більш прийнятно гідрокарбонату натрію, у розчиннику чи суміші розчинників, що інертні до реакції, більш прийнятно в суміші ацетон-вода, одержуючи суміш сполуки загальної формули (І), де А означає групу NH, В означає групу С=О, R1 означає L-кладинозильну групу формули (II), а R2 та R3 однакові і означають водень, і сполуки загальної формули (І), де А означає групу С=О, В означає групу NH, R1 означає L-кладинозильну групу формули (ІІ), а R2 та R3 однакові і означають водень,
яку потім піддають дії розбавлених неорганічних кислот, більш прийнятно 0,25 N соляної кислоти, при кімнатній температурі, одержуючи суміш сполуки загальної формули (І), де А означає групу NH, В означає групу С=О, R1 означає групу ОН, а R2 та R3 однакові і означають водень, і сполуки загальної формули (І), де А означає групу С=О, В означає групу NH, R1 означає групу ОН, а R2 та R3 однакові і означають водень,
яку потім піддають реакції селективного ацилування з ангідридами карбонових кислот, які мають до 4 атомів вуглецю, більш прийнятно з ангідридом оцтової кислоти, в інертному органічному розчиннику, більш прийнятно в метиленхлориді, одержуючи суміш сполуки загальної формули (І), де А означає групу NH, В, водночас, означає групу С=О, R1 означає групу ОН, R2 є воднем, а R3 означає ацетильну групу, і сполуки загальної формули (І), де А означає групу С=О, В, водночас, означає групу NH, R1 означає групу ОН, R2 є воднем, а R3 означає ацетильну групу,
яку далі піддають окисленню діімідами, більш прийнятно N,N-диметиламінопропілетилкарбодіімідом, у присутності диметилсульфоксиду та піридинійтрифторацетату як каталізатора, в інертному органічному розчиннику, більш прийнятно в метиленхлориді, при температурі від 10 °С до кімнатної температури, одержуючи суміш сполуки загальної формули (І), де А означає групу NH, В, водночас, означає групу С=О, R1 та R2 разом означають кетон, а R3 означає ацетильну групу, і сполуки загальної формули (І), де А означає групу С=О, В означає групу NH, R1 та R2 разом означають кетон, а R3 означає ацетильну групу,
яку після цього піддають реакції деацилування в 2'-позиції шляхом сольволізу у нижчих спиртах, більш прийнятно в метанолі, при кімнатній температурі, одержуючи суміш сполуки загальної формули (І), де А означає групу NH, В, водночас, означає групу С=О, R1 та R2 разом означають кетон, а R3 означає водень, і сполуки загальної формули (І), де А означає групу С=О, В означає групу NH, R1 та R2 разом означають кетон, а R3 означає водень,
яку піддають поділу на силікагельній колонці із застосуванням системи метиленхлорид-метанол-конц. гідроксид амонію 60:6:0,1, внаслідок чого одержують хроматографічнооднорідну сполуку формули (І), де А означає групу NH, В, водночас, означає групу С=О, R1 та R2 разом означають кетон, а R3 означає водень, з Rf 0,527 та хроматографічно однорідну сполуку формули (І), де А означає групу С=О, В, водночас, означає групу NH, R1 та R2 разом означають кетон, а R3 означає водень, з Rf 0,482,
яку, у разі необхідності, далі піддають реакції з неорганічними або органічними кислотами, одержуючи їх фармацевтично прийнятні адитивні солі.
13. Фармацевтична композиція, корисна у лікуванні бактеріальних інфекцій у людей та тварин, яка містить антибактеріально ефективну кількість сполуки загальної формули (І) або її фармацевтично прийнятної адитивної солі за п. 1 у поєднанні з фармацевтично прийнятним носієм.
14. Спосіб лікування бактеріальних інфекцій у людей та тварин, який включає введення людям або тваринам, залежно від потреби, антибактеріально ефективної кількості сполуки загальної формули (І) або її фармацевтично прийнятної адитивної солі за п. 1 у поєднанні з фармацевтично прийнятним носієм.
Текст
1. Сполука загальної формули (І) C2 2 (19) 1 3 70941 4 А означає групу С=О і В , водночас, означає групу яку потім піддають реакції селективного ацилуванNH, ня з ангідридами карбонових кислот, які мають до R1 означає групу ОН, L-кладинозильну групу фор4 атомів вуглецю, більш прийнятно з ангідридом мули (II) оцтової кислоти, в інертному органічному розчиннику, більш прийнятно в метиленхлориді, одержуСН3 O O ючи суміш сполуки загальної формули (І), де А 4'' означає групу NH, В, водночас, означає групу OH С=О, R1 означає групу ОН, R2 є воднем, а R3 ознаH3C OCH 3 (ІІ) чає ацетильну груп у, і сполуки загальної формули (І), де А означає групу С=О, В, водночас, означає або разом з R2 означає кетон, груп у NH, R1 означає групу ОН, R2 є воднем, а R3 R2 означає водень або разом з R 1 означає кетон, 3 означає ацетильну гр упу, R означає водень або С1-С4алканоїльну гр упу, який відрізняється тим, що 6-Ояку далі піддають окисленню діімідами, більш прийнятно N,Nметилеритроміцин А формули (III) O диметиламінопропілетилкарбодіімідом, у присутСН3 H3C ності диметилсульфоксиду та піридинійтрифтораH3C СН3 цетату як каталізатора, в інертному органічному N ОСН3 HO розчиннику, більш прийнятно в метиленхлориді, HO OH 6 3' СН 3 2' при температурі від 10 °С до кімнатної температуH3C H 3C ри, одержуючи суміш сполуки загальної формули O O СН 2 O СН 3 (І), де А означає групу NH, В, водночас, означає СН 3 O СН 3 O груп у С =О, R1 та R2 разом означають кетон, а R3 O означає ацетильну груп у, і сполуки загальної фор4'' СН3 OH мули (І), де А означає груп у С=О, В означає групу H3C OCH3 NH, R1 та R2 разом означають кетон, а R3 означає (ІІІ) ацетильну гр упу, піддають реакції з солянокислим гідроксиламіном яку після цього піддають реакції деацилування в у присутності придатних неорганічних чи органіч2'-позиції шляхом сольволізу у нижчих спиртах, них основ, одержуючи суміш 6-Обільш прийнятно в метанолі, при кімнатній темпеметилеритроміцину А 9(Е)- і 9(Z)-оксимів формули ратурі, одержуючи суміш сполуки загальної фор(IV) мули (І), де А означає групу NH, В, водночас, OH означає групу С=О, R1 та R2 разом означають кеN H 3C СН3 тон, а R3 означає водень, і сполуки загальної фоH 3C СН 3 рмули (І), де А означає групу С=О, В означає групу N ОСН3 NH, R1 та R2 разом означають кетон, а R3 означає HO HO OH 6 3' водень, СН3 2' H3C H 3C яку піддають поділу на силікагельній колонці із O СН2 O O СН 3 застосуванням системи метиленхлорид-метанолСН3 O СН 3 O конц. гідроксид амонію 60:6:0,1, внаслідок чого O одержують хроматографічнооднорідну сполуку 4'' СН 3 OH формули (І), де А означає групу NH, В, водночас, H3C OCH3 означає групу С=О, R1 та R2 разом означають ке, (IV) тон, а R3 означає водень, з Rf 0,527 та хроматогяку потім піддають реакції перегрупування Бекмарафічно однорідну сполуку формули (І), де А озна з арилсульфонілгалогенідами, більш прийнятно начає групу С=О, В, водночас, означає групу NH, з п-толуолсульфонілхлоридом, у присутності неорR1 та R2 разом означають кетон, а R3 означає воганічних основ, більш прийнятно гідрокарбонату день, з Rf 0,482, натрію, у розчиннику чи суміші розчинників, що яку, у разі необхідності, далі піддають реакції з інертні до реакції, більш прийнятно в суміші аценеорганічними або органічними кислотами, одертон-вода, одержуючи суміш сполуки загальної фожуючи їх фармацевтично прийнятні адитивні солі. рмули (І), де А означає групу NH, В означає групу 13. Фармацевтична композиція, корисна у лікуванС=О , R1 означає L-кладинозильну груп у формули ні бактеріальних інфекцій у людей та тварин, яка (II), а R2 та R3 однакові і означають водень, і спомістить антибактеріально ефективну кількість сполуки загальної формули (І), де А означає групу луки загальної формули (І) або її фармацевтично С О, В означає групу NH, R1 означає L= 2 3 прийнятної адитивної солі за п.1 у поєднанні з факладинозильну групу формули (ІІ), а R та R однармацевтично прийнятним носієм. кові і означають водень, 14. Спосіб лікування бактеріальних інфекцій у люяку потім піддають дії розбавлених неорганічних дей та тварин, який включає введення людям або кислот, більш прийнятно 0,25 N соляної кислоти, тваринам, залежно від потреби, антибактеріально при кімнатній температурі, одержуючи суміш споефективної кількості сполуки загальної формули луки загальної формули (І), де А означає групу NH, (І) або її фармацевтично прийнятної адитивної В означає групу С=О, R1 означає групу ОН, а R2 та 3 солі за п.1 у поєднанні з фармацевтично прийнятR однакові і означають водень, і сполуки загальним носієм. ної формули (І), де А означає групу С=О, В означає груп у NH, R1 означає групу ОН, а R2 та R3 однакові і означають водень, N 5 70941 Цей винахід стосується нових сполук з класу макролідних антибіотиків еритроміцину А. Зокрема, даний винахід стосується нових 15-членних кетоазалідів з класу 6-О-метил-8а-аза-8а-гомо- та 6-O-метитл-9а-аза-9а-гомоерктроміцину А, проміжних сполук і способу їх одержання, їх фармацевтично прийнятних адитивних солей з неорганічними або органічними кислотами, способу приготування фармацевтичних композицій, а також застосування зазначених фармацевтичних композицій у лікуванні бактеріальних інфекцій. Еритроміцин А є макролідним антибіотиком, структура якого характеризується наявністю 14членного лактонового кільця, що включає С-9 кетон і два цукри, L-кладинозу та D-дезозамін, глікозидно зв'язані в С-3 та С-5 положеннях з агліконовою частиною молекули (McGuire: Antibiot. Chemother., 1952, 2: 281). Еритроміцин А вже понад 40 років вважається безпечним і ефективним протимікробним агентом для лікування респіраторних і генітальних інфекцій, викликаних грампозитивними бактеріями, таких штамів як Legionella, Mycoplasma, Chlamidia та Helicobacler. Зміни у біодоступності, що спостерігаються після прийому оральних препаратів, шлункова непереносимість у багатьох пацієнтів та втрата активності в кислотному середовищі є основними недоліками терапевтичного застосування еритроміцину А, Спіроанелювання агліконового кільця успішно інгібується хімічним перетворенням С-9 кетону або гідроксильних груп у С-6 та/або С-12 положеннях. Таким чином, наприклад, шляхом оксимування С-9 кетону еритроміцину А солянокислим гідроксиламіном, перегрупування Бекмана одержаного 9(Е)оксиму і відновлення отриманого в результаті 6,9імінозаміщеного ефіру (6-деокси-9-деоксо-9а-аза9а-гомоеритроміцин А 6,9-циклічний імінозаміщений ефір) одержують 9-деоксо-9а-аза-9агомоеритроміцин А - перший напівсинтетичний макролідний антибіотик, що має 15-членне азалактонове кільце (Kobrehel G. et al., US 4,328,334; 5/1982). Відновлювальне метилування нововведеної ендомісточкової 9а-аміно групи згідно з процесом Ешвейлера-Кларка веде до синтезу 9деоксо-9а-метил-9а-аза-9а-гомоеритроміцину A (AZITHROMYCIN - азитроміцин) - прототипу нового класу азалідних антибіотиків (Kobrehel G. et al., BE 892 357; 7/1982). Окрім широкого спектру протимікробної дії, що включає також грам-негативні бактерії, азитроміцин також відрізняється довгим періодом біологічного напівперетворення, спеціальним механізмом транспортування до місця застосування та коротким строком терапії. Азитроміцин здатний проникати і накопичуватись всередині фагоцитних клітин людини, що веде до покращеної дії на внутрішньоклітинні патогенні мікроорганізми штамів Legionella, Chlamidia та Helicobacler. Крім того, відомо, що С-6/С-12 спіроанелювання еритроміцину А також інгібується Ометилуванням С-6 гідроксильної групи агліконового кільця (Watanabe Y. et al., US 4,331,803; 5/1982). 6 Реакція еритроміцину А з бензилоксикарбонілхлоридом і подальше метилування одержаної 2'-О,3'N-біс(бензилоксикарбоніл)-похідної, вилучення захисних груп і 3'-N-метилування дає 6-Ометилеритроміцин (CLARITHROMYCIN - кларитроміцин) (Morimoto S. et αϊ., J.Antibiotics, 1984, 37, 187). Порівняно з еритроміцином А кларитроміцин є значно більш стабільним в кислотному середовищі та демонструє кращу іn vitro дію на штами грам-позитивних бактерій (Kirst Η. A. et al., Antimicrobial Agents and Chemoter., 1989, 1419). Недавні дослідження 14-членних макролідів привели до відкриття нового типу макролідних антибіотиків, а саме: кетолідів, які відрізняються 3кетогрупою замість нейтральної цукрової Lкладинози, нестабільність якої у навіть слабкокислотному середовищі добре відома (Agouridas С. et al., ЕР 596802 Al, 5/1994; Le Martret O, FR 2697524 Al, 5/94). Кетоліди демонструють значно кращу in vitro дію проти MLS (макролід, лінкосамід та стрептограмін В), індукованих стійкими організмами (Jamjian C, Anuimxcrob. Agents Chemther.,1997, 41, 485). ΕΡ-Α-0507 595 розкриває 8а-аза-8агомоеритроміцину лактами, які відрізняються від сполук згідно з даним винаходом тим, що не можуть мати метокси групу у положенні 6, що значно змінює хімічні та біологічні властивості молекули. Відповідно до відомого нам та вивченого рівня техніки, 15-членні кетоазаліди з классу 6-О-метил8а-аза-8а-гомоі 6-O-метил-9а-аза-9агомоеритроміцину А та їх фармацевтично прийнятні адитивні солі з органічними або неорганічними кислотами, способи їх одержання і проміжні речовини для їх одержання, а також способи приготування фармацевтичних препаратів і їх застосування досі не описувались. Предмет даного винаходу являє собою перегруп ування Бекмана 9(Е)- та 9(Z)-оксиму 6-Ометилеритроміцину А, гідроліз кладинози в одержаних у такий спосіб 8а- та 9а-лактамах, захист гідроксильних груп у 2'-положенні дезозаміну, окислення 3-гідроксильної групи та вилучення захисних гр уп, внаслідок чого одержують досі не описані 15-членні кетоазаліди з класу 6-O-метил-8а-аза8а-гомо- і 6-O-метил-9а-аза-9а-гомоеритроміцину А. Нові 15-членні кетоазаліди з класу 6-О-метил8а-аза-8а-гомоі 6-O-метил-9а-аза-9атомперитроміцину А загальної формули (І). де 7 70941 А являє собою групу NH, і В, водночас, означає груп у С=О, або А являє собою групу С=O, і В, водночас, означає груп у NH, R1 являє собою групу ОН, L-кладинозильну груп у формули (II) або разом з R2 являє собою кетон, R2 означає водень або разом з R1 являє собою кетон, R3 означає водень або С 1-С4алканоїльну групу, та їх фармацевтично прийнятні адитивні солі з неорганічними й органічними кислотами одержують у такий спосіб. Етап 1: Перший етап відповідно до винаходу включає оксимування С-9 кетону 6-O-метилеритроміцину А (кларитроміцину) формули (III) 8 у співвідношенні приблизно 1:1. Якщо потрібно, поділ ізомерів здійснюють за допомогою хроматографії на силікагельній колонці із застосуванням системи метиленхлорид-метанол-гідроксид амонію 90:9:1,5, внаслідок чого одержують хроматографічно однорідний 6-О-метил-еритроміцину А 9(E)-оксим з Rf 0,446 формули (IVa) та хроматографічно однорідний 6-Oметилеритроміцину А 9(Z)-оксим з Rf 0,355 формули (IVb) на відповідний оксим. Перетворення кетону на оксим є добре відомою реакцією, яку зазвичай здійснюють із застосуванням солянокислого гідроксиламіну в присутності підхожих неорганічних чи органічних основ у придатному протонному або апротонному розчиннику. Солянокислий гідроксиламін використовують у 1-15-еквімолярному надлишку, більш прийнятно, у 10-еквімолярному надлишку щодо кларитроміцину. Підхожими для застосування основами є гідроксиди, карбонати, водень-карбонати і ацетати лужних металів, а розчинниками – С1-С3спирти. Більш прийнятною основою є карбонат натрію або ацетат натрію, а більш прийнятним розчинником - метанол. Взагалі, реакцію здійснюють при температурі від 0 до 80°С, більш прийнятно при 65°с, впродовж бід 2 годин до кількох днів, але в основному закінчується за 820 годин. Обробку проводять у звичайний спосіб, наприклад, шляхом випаровування розчинника під вакуумом, додання суміші води та органічного розчинника з подальшою екстракцією в лужному середовищі, більш прийнятно при рН8,0-10,0. В якості розчинників для екстрагування продукту використовують метиленхлорид, хлороформ, етилацетат, діетиловий ефір та толуол, причому більш прийнятним є хлороформ. Продукт виділяють шляхом відділення органічного шару та випаровування розчинника, що дає суміш 6-Ометилеритроміцину А 9 (E)- і 9(Z)-оксиму формули (IV) Етап 2: Перетворення 6-O-метил-еритроміцину А 9(Z)оксиму формули (IVa) на 6-O-метил-9а-аза-9агомоеритроміцин А загальної формули (І) де А являє собою групу NH, В, водночас, означає груп у С=O, R1 означає L-кладинозильну групу формули (II) 9 70941 10 еквімолярним надлишком п-толуолсульфохлориду і водень-карбонату натрію. Якщо треба, продукт очищають хроматографією на силікагельній колонці із застосуванням системи розчинників метиленхлорид-метанол-гідроксид амонію 90:9:1,5, одержуючи хромотографічно однорідний 6-ОR2 і R3 однакові та означають водень, метил-9а-аза-9а-гомоеритроміцин А. здійснюється шляхом проведення реакції перегруПерегрупування Бекмана 9(Z)-оксиму 6-Опування Бекмана (див. "Comprehensive Organic метилеритроміцину А формули (IVb) на 6-OChemistry", I.O.Sutherland (Ed.), Pergamon Press, метил-8а-аза-8а-гомоеритроміцин А загальної фоNew York, 1979, Vol.2, 398-400 та 967-968). Взагармули (І), де А являє собою груп у С=О , В, у той лі, перегрупування Бекмана кетоксимів дає карбосамий час, означає групу NH, R1 означає Lксамід або, у випадку циклічних систем, лактами. кладинозильну групу формули (II), a R2 та R3 однаМе ханізм перегрупування включає попереднє пекові і являють собою водень, здійснюється аналоретворення гідроксильної групи оксиму на гр упу, гічно до 9(Е)-оксиму (IVa). що легше відходить, яка на другому етапі реакції Етап 3: відщепляється при одночасній міграції атому вуг6-O-метил-9а-аза-9а-гомоеритроміцин А або лецю в анти-положенні відносно групи, що відхо6-O-метил-8а-аза-8а-гомоеритроміцин А Етапу 2 дить. У водному середовищі в якості проміжного загальної формули (І), де А, В, R1 , R2 та R3 мають утворюється іон нітрилію, який реагує з водою з наведені вище значення, піддають, якщо потрібно, утворенням відповідного аміду. дії сильних кислот, більш прийнятно, 0,25-1,5N Реакція перегрупування Бекмана здійснюється соляної кислоти, при кімнатній температурі впров кислотних, нейтральних чи основних умовах. довж 10-30 годин, одержуючи 3-О-декладинозилЗвичайні кислотні реагенти, що каталізують пере3-окси-похідні 6-О-метил-9а-аза-9агруп ування, включають конц. сірчану кислоту, погомоеритроміцину А або 6-O-метил-8а-аза-8аліфосфорну кислоту, тіонілхлорид, фосфорний гомоеритро-міцину А загальної формули (І), де А пентахлорид, діоксид сірки та мурашину кислоту. являє собою групу NH, і В, у той самий час, ознаЧерез чутливість макролідної молекули у кислотчає груп у С=О, або А означає групу С=O, і В, водному середовищі та, особливо, через легкість ночас, являє собою групу NH, R1 означає групу розщеплення нейтральної цукрової L-кладинози ці ОН, a R2 та R3 однакові і являють собою водень. реагенти не підходять для перегрупування оксиму Етап 4: формули (IVa) на 6-O-метил-9а-аза-9а3-O-декладинозил-3-окси-6-O-метил-9а-азагомоеритроміцип А загальної формули (І), де А, В, 1 2 3 9а-гомоеритро-міцин А або 6-O-метил-8а-аза-8аR , R та R мають наведені вище значення. Більш гомоеритроміцин А Етапу 3 загальної формули (І), прийнятно, перегрупування Бекмана оксиму (IVa) де А, В, R1 , R2 та R3 мають наведені вище значенздійснюється шляхом первісного Оня, піддають, якщо потрібно, реакції селективного сульфонування гідроксилу оксиму алкілсульфонілацилування гідроксильної групи в 2'-положенні галогенідами, арилсульфонілгалогенідами або дезозаміну. Ацилування здійснюється із застосуарилсульфонілангідридами. Проміжний оксимсуванням ангідридів карбонових кислот, які мають льфонат відділяють або, як правило, перегрупуаж до 4 атомів вуглецю, більш прийнятно, ангідривання для одержання бажаного продукту здійснюду оцтової кислоти, у присутності неогранічних чи ється in situ. Взагалі, сульфонування та органічних основ у інертному органічному розчинперегрупування проводять у присутності органічнику при температурі від 0 до 30°С, одержуючи 3них чи неорганічних основ. декладинозил-3-окси-6-O-метил-9а-аза-9аБільш прийнятні сульфонувальні реагенти, що гомоеритроміцин А 2'-О-ацетат або 3каталізують перегрупування оксиму (IVa) включадекладинозил-3-окси-6-O-метил-8а-аза-8ають метансульфонілхлорид, бензолсульфонілхлогомоеритроміцин А 2'-О-ацетат загальної формули рид, 4-ацетиламідосульфонілхлорид, п(І), де А являє собою груп у NH, і В, у той самий толуолсульфонілхлорид, ангідриди бензолсульчас, означає групу С=O, або А означає групу C=O, фонової та п-толуолсульфонової кислоти. Реакцію і В, водночас, являє собою групу NH, R 1 означає здійснюють у присутності неорганічних основ, тагруп у ОН, a R2 є воднем, a R3 являє собою ацетил. ких як водень-карбонат натрію чи карбонат калію, В якості підхожих основ можуть використовуватись або у присутності органічних основ, таких як піриводень-карбонат натрію, карбонат натрію, карбодин, 4-диметиламінопіридин, триетиламін і Ν,Νнат калію, триетиламін, піридин, трибутиламін, діізопропіламін. Підхожі розчинники включають більш прийнятно, водень-карбонат натрію. Придаводні суміші, такі як суміш ацетону і води та суміш тними інертними розчинниками є метиленхлорид, діоксану і води, та органічні розчинники, такі як дихлоретан, ацетон, піридин, етилацетат, тетрагіметиленхлорид, хлороформ, етилацетат, діетилодрофуран, більш прийнятним - метиленхлорид. вий ефір, тетрагідрофуран, толуол, ацетонітрил і Етап 5: піридин. Взагалі, реакція проводиться з викорис3-декладинозил-3-окси-6-O-метил-9а-аза-9атанням 1-3 еквімолярного надлишку сульфонувагомоеритро-міцин А-2'-О-ацетат або 3льного реагенту та з такою самою чи більшою екдекладинозил-3-окси-6-O-метил-8а-аза-8авімолярною кількістю основи при температурі від гомоеритроміцин А-2'-О-ацетат Етапу 4 загальної 20 до 50°С. Піридин часто застосовують одночасформули (І), де А, В, R1, R2 та R3 мають наведені но і в якості розчинника і в якості основи. Більш вище значення, піддають, якщо потрібно, окисленприйнятно, перегрупування Бекмана оксиму (IVa) ню гідроксильної групи у С-3 положенні агліконоздійснюється в суміші ацетону і води а подвійним 11 70941 12 вого кільця відповідно до модифікованого способу гомоеритро-міцин А 2'-О-ацетат або 3Мо ффа та-Пфіцнера N,N-диметиламінопропілдекладинозил-3-оксо-6-O-метил-8а-аза-8аетил-карбодіімідом у присутності диметилсульфогомоеритроміцин А 2'-O-ацетат Етапу 5 загальної ксиду та піридиній трифторацетату в якості каталіформули (І), де А, В, R1, R2 та R3 мають наведені затора в інертному органічному розчиннику, більш вище значення, далі піддають сольволізу у нижчих прийнятно, в метиленхлориді, при температурі від спиртах, більш прийнятно, в метанолі, при темпе10°С до кімнатної температури, одержуючи 3ратурі від кімнатної до температури флегми роздекладинуаил-3-оксо-6-O-метил-3а-аза-8ачинника, одержуючи 3-декладинозил-3-оксо-6-Oгомоеритрбміцин А 2'-O-ацетат або 3метил-9а-аза-9а-гомоеритроміцин А або 3декладинозил-3-оксо-6-O-метил-8а-аза-8адекладинозил-3-оксо-6-O-метил-8а-аза-8агомоеритроміцин А 2'-О-ацетат загальної формули гомоеритроміцин А загальної формули (І), де А (І), де А являє собою груп у NH, і В, у той самий являє собою групу NH, і В, у той самий час, означас, означає групу С=О, або А означає групу С=O, чає груп у С=O, або А означає групу С=O, і В, воді В, водночас, являє собою груп у NH, R 1 та R 2 раночас, являє собою групу NH, R1 та R2 разом озназом означають кетон, a R3 являє собою ацетильну чають кетон, a R3 являє собою водень. груп у. Фармацевтично прийнятні адитивні солі, які Етап 6: також є предметом даного винаходу, одержують 3-декладинозил-3-оксо-6-O-метил-9а-аза-9ашляхом реакції нових сполук з класу 6-O-метил8а-аза-8а-гомоеритроміцину А та 6-O-метилприйнятних адитивних солей з неорганічними чи 9а-аза-9а-гомоеритроміцину А загальної формули органічними кислотами визначали на серії станда(І), де А, В, R1, R 2 та R3 мають наведені вище знартних тестови х мікроорганізмів та клінічних ізолячення, з, принаймні, еквімолярною кількістю підхотах у спосіб мікророзведення згідно з рекомендажої неорганічної чи органічної кислоти, такої як ціями NCCLC (The National Committee for Clinical соляна, йодистоводнева, сірчана, фосфорна, оцLaboratory Standards, Document M7-A2, Vol.10, това, пропіонова, трифтороцтова, малеїнова, лиNo.8, 1990 та Document M11-A2, Vol.10, 15, 1991). монна, стеаринова, бурштинова, етилбурштинова, Лабораторний процес контролювали за допомогою метансульфонова, бензолсуль-фонова, пконтрольного штаму Staphyloccocus aureus ATTC толуолсульфонова та лаурилсульфонова кислоти, 29213 (The American Type Culture Collection - Амеу інертному до реакції розчиннику. Ади тивні солі риканська колекція типових культур) відповідно до виділяють шляхом фільтрування, якщо вони непротоколу NCCLS (Document M7-A2, Table 3, розчинні в інертному до реакції розчиннику, осаМ100-S4). дження осаджувачем або випаровуванням розРезультати антибактеріальної in vitro дії 6-Очинника, в основному, у спосіб ліофілізації. метил-8а-аза-8а-гомоеритроміцину А з Прикладу 3 Протибактеріальну і л vitro дію нових сполук на серію стандартних тестови х мікроорганізмів у загальної формули (І), де А, В, R1 , R2 та R3 мають порівнянні з азитроміцином, еритроміцином та наведені вище значення, та їх фармацевтично кларитроміцином подані у Таблиці 1. Таблиця 1 Антибактеріальна in vitro дія (МІК, мг/л) 6-O-метил-8а-аза-8а-гомоеритроміцину А (Приклад 3) у порівнянні з азитроміцином (Az), еритроміцином (Еr) та кларитроміцином (СІ) Тестовий мікроорганізм Listeria monocyto-genes ATCC 7644 Staphylococcus aureus ATCC 25923 Staphylococcus epider-midis ATCC 12228 Enterococcus faecalis ATCC 35550 Streptococcus pneumoniae ATCC 6305 Streptococcus pyogenes ATCC 19615 Clostridium perfrin-gens ATCC 13124 Moraxella catarrhalis ATCC 25238 Campylobacter fetus ATCC 19438 Campylobacter jejuni ATCC 33291 Citroobacter freundii ATCC 8090 Escherichia coli ATCC 25922 Proteus mirabilis ATCC 12453 Proteus mirabilis ATCC 43011 Salmonella choleraesuis ATCC 13076 Shigella flexneri ATCC 12022 Yersinia enterocolitica ATCC 9610 Haemophilus influenzae ATCC 49247 Haemophilus influence ATCC 49766 Pseudomonas aeruginosa ATCC 25619 Az
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel ketolides of the class of 15-membered lactams
Назва патенту російськоюНовые кетолиды из класса 15-членных лактамов
МПК / Мітки
МПК: A61K 31/7042, A61P 31/04, A61K 31/7048, C07H 17/08
Мітки: лактамів, композиція, 15-членних, кетоліди, спосіб, фармацевтична, антибактеріальною, одержання, класу, активністю
Код посилання
<a href="https://ua.patents.su/10-70941-ketolidi-klasu-15-chlennikh-laktamiv-sposib-kh-oderzhannya-ta-farmacevtichna-kompoziciya-z-antibakterialnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Кетоліди класу 15-членних лактамів, спосіб їх одержання та фармацевтична композиція з антибактеріальною активністю</a>
Попередній патент: Привідний пристрій ескалатора з тяговими ланцюгами
Випадковий патент: Спосіб лікування хворих на рак шийки матки іі-ііі стадій












