Застосування n-заміщеного індоліл-3-гліоксиламіду як протипухлинного засобу, спосіб лікування пухлинних захворювань та лікарська композиція для лікування пухлинних захворювань
Номер патенту: 70942
Опубліковано: 15.11.2004
Автори: Райхерт Дітмар, Гюнтер Екхард, Шмідт Юрген, Еміг Петер, Нікель Берндт, Бруне Кай, Селеній Іштван
Формула / Реферат
1. Застосування принаймні однієї зі сполук N-заміщеного індол-3-гліоксиламіду загальної формули І
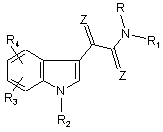 , І
, І
у якій радикали R, R1, R2, R3, R4 та Z мають такі значення:
R являє собою водень, (С1-С6)-алкіл, де алкільна група може бути моно- або полізаміщена фенільним кільцем, і це фенільне кільце, у свою чергу, може бути моно- або полізаміщене галогеном, (С1-С6)-алкільними, (С3-С7)-циклоалкільними, карбоксильними групами, карбоксильними групами естерифікованими (С1-С6)-алканолами, трифторметильними групами, гідроксильними групами, метокси-, етокси-, бензилоксигрупами, а також бензильною групою, яка моно- або полізаміщена у фенільному залишку (С1-С6)-алкільними групами, атомами галогену або трифторметильними групами, і
бензилоксикарбонільну групу, трет-бутоксикарбонільний радикал (ВОС-радикал) та ацетильну групу;
R1 являє собою фенільне кільце, яке моно- або полізаміщене (С1-С6)-алкілом, (С1-С6)-алкоксилом, ціаногрупою, галогеном, трифторметилом, гідроксилом, бензилоксигрупою, нітрогрупою, аміногрупою, (С1-С6)-алкіламіногрупою, (С1-С6)-алкоксикарбоніламіногрупою, а також карбоксильною групою або карбоксильною групою, естерифікованою (С1-С6)-алканолами,
піридинову структуру формули II та її N-оксид
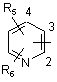 , ІІ
, ІІ
де піридинова структура на вибір зв'язана з 2, 3 та 4 атомами вуглецю кільця і може бути заміщена замісниками R5 та R6, причому R5 та R6 можуть бути однаковими або різними і являють собою (С1-С6)-алкіл і (С3-С7)-циклоалкіл, (С1-С6)-алкокси, нітро, аміно, гідрокси, галоген, трифторметил, етоксикарбоніламіно радикал і карбоксіалкілоксигрупу, у якій алкільна група може мати від 1 до 4 атомів вуглецю,
2- або 4-піримідинільний гетероцикл, причому 2-піримідинільне кільце може бути моно- або полізаміщене метильною групою,
2-, 3- і 4- та 8-хінолілову структуру, заміщену (С1-С6)-алкілом, галогеном, нітрогрупою, аміногрупою та (С1-С6)-алкіламіно радикалом,
2-, 3- та 4-хінолілметильну групу, де вуглеці кільця піридилметильного радикала, хінолілової групи та хінолілметильного радикала можуть бути заміщені (С1-С6)-алкілом, (С1-С6)-алкокси, нітро, аміно та (С1-С6)-алкоксикарбоніламіногрупою, та
аліламінокарбоніл-2-метилпроп-1-ільну групу,
у випадку, якщо R являє собою водень, метил або бензильну групу, бензилоксикарбонільний радикал, трет-бутоксикарбонільний радикал (ВОС-радикал) та ацетильну групу, R1 додатково являє собою такі радикали: -СН2СООН; -СН(СН3)-СООН; -(СН3)2-СН-(СН2)2-СН-СОО-; Н3С-Н2С-СН(СН3)-СН(СООН)-; НО-Н2С-СН(СООН)-; феніл-СН2-СН(СООН)-; (4-імідазоліл)-СН2-СН(СООН)-; HN=С(NH2)-NH-(CH2)3-CH(COOH)-; H2N-(СН2)4-СН(СООН)-; H2N-CO-CH2-CH(COOH)-; HOOC-(CH2)2-CH(COOH)-; та
у випадку, якщо R являє собою водень, бензилоксикарбонільний радикал, ВОС-радикал, ацетильну або бензильну групу, R1 додатково являє собою радикал природної або синтетичної амінокислоти, наприклад a-гліцил, a-саркозил, a-аланіл, a-лейцил, a-ізо-лейцил, a-серил, a-фенілаланіл, a-гістидил, a-проліл, a-аргініл, a-лізил, a-аспарагіл та a-глутаміл радикал, де аміногрупи відповідних амінокислот можуть бути незахищені або захищені, причому переважна захисна група аміногрупи являє собою карбобензокси радикал, трет-бутоксикарбонільний радикал (ВОС-радикал) та ацетильну групу, причому коли R1 являє собою аспарагіловий та глутаміловий радикал, друга, не зв'язана карбоксильна група, присутня як вільна карбоксильна група або у вигляді естеру з (С1-С6)-алканолами, переважно у вигляді метильного, етильного або трет-бутильного естеру;
R та R1 можуть разом з атомом азоту, з яким вони зв'язані, утворювати гомопіперазинове кільце, якщо R1 являє собою аміноалкіленову групу, або піперазинове кільце формули III
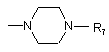 , III
, III
у якій R7 являє собою алкільний радикал, бензгідрильну групу, біс-п-фторбензилгідрильну групу, фенільне кільце, яке може бути моно- або полізаміщене (С1-С6)-алкілом, (С1-С6)-алкоксигрупою, галогеном, нітрогрупою, аміногрупою та (С1-С6)-алкіламіногрупою;
R2 являє собою водень, (С1-С6)-алкільну групу, де алкільна група моно- або полізаміщена галогеном і фенілом, який, у свою чергу, може бути моно-або полізаміщений галогеном, (С1-С6)-алкільними, (С3-С7)-циклоалкільними, карбоксильними групами, карбоксильними групами, естерифікованими (С1-С6)-алканолами, трифторметильними групами, гідрокси-, метокси-, етокси- чи бензилоксигрупами, причому якщо R2 являє собою (С1-С6)-алкільну групу, вона додатково може бути заміщена 2-хінолільною групою та 2-, 3- і 4-піридильною структурою, причому обидва замісники можуть бути у кожному випадку моно- або полізаміщені галогеном, (С1-С4)-алкільними групами або (С1-С4)-алкоксигрупами, та ароїльний радикал, в якому арильний залишок, що є основою цього радикала, являє собою фенільне кільце, яке може бути моно- або полізаміщене галогеном, (С1-С6)-алкілом, (С3-С7)-циклоалкілом, карбоксильними групами, карбоксильними групами, естерифікованими (С1-С6)-алканолами, трифторметильними групами, гідрокси-, метокси-, етокси- або бензилоксигрупами;
R3 та R4 можуть бути однаковими або різними і являють собою водень, (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С1-С6)-алканоїл, (С1-С6)-алкоксигрупу, галоген, бензилоксигрупу, нітрогрупу, аміногрупу, (С1-С4)-моно- або діалкілзаміщену аміногрупу, (С1-С6)-алкоксикарбоніламіно функціональну групу або (С1-С6)-алкоксикарбоніламіно-(С1-С6)-алкільну функціональну групу;
Z являє собою О та S;
або їх фізіологічно прийнятних солей приєднання кислоти, або їх N-оксидів як протипухлинних засобів.
2. Застосування за п. 1, яке відрізняється тим, що радикали R, R1, R2, R3, R4 і Z у сполуці формули І приймають такі значення:
R являє собою водень;
R1 являє собою 4-піридил, 4-фторфеніл;
R2 являє собою бензил, 4-хлорбензил, 4-фторбензил, 3-піридилметил, 4-бромбензил;
R3 та R4 являють собою водень і
Z являє собою кисень.
3. Застосування за п. 1 або п. 2, яке відрізняється тим, що вказану фізіологічнo прийнятну сіль приєднання кислоти вибирають з солей мінеральних кислот, таких як соляна кислота, сірчана кислота, фосфорна кислота, та солей органічних кислот, таких як оцтова кислота, молочна кислота, малонова кислота, малеїнова кислота, фумарова кислота, глюконова кислота, глюкуронова кислота, лимонна кислота, ембонова кислота, метансульфонова кислота, трифтороцтова кислота, бурштинова кислота і 2-гідроксіетансульфонова кислота.
4. Застосування за п. 1, яке відрізняється тим, що вказана сполука формули І є вибраною з:
D 24241 N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3-іл]гліоксиламіду,
D 24843 N-(піридин-4-іл)-(1-бензиліндол-3-іл)-гліоксиламіду,
D 24850 N-(4-фторфеніл)-[1-(3-піридилметил)-індол-3-іл]гліоксиламіду,
D 24851 N-(піридин-4-іл)-[1-(4-хлорбензил)-індол-3-іл]гліоксиламіду і
D 25505 N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3-іл]гліоксиламіду НСl.
5. Спосіб лікування пухлинних захворювань, який відрізняється тим, що вводять принаймні одну з сполук формули І, визначених у будь-якому з пп. 1-4, або їх фізіологічнo прийнятних солей приєднання кислоти або N-оксидів.
6. Спосіб за п. 5, який відрізняється тим, що вказану сполуку вводять перорально, парентерально, внутрішньовеннo, трансдермально або інгаляцією.
7. Спосіб за п. 6, який відрізняється тим, що при пероральному введенні дози застосування знаходяться в діапазоні від 20 мг до 500 мг на добу, або у випадку внутрішньовенного введення у вигляді ін'єкції або інфузії можуть досягати до 250 мг на добу.
8. Лікарська композиція для лікування пухлинних захворювань, яка відрізняється тим, що включає принаймні одну з сполук N-заміщеного індол-3-гліоксиламіду загальної формули I, визначених у будь-якому з пп. 1-4, або їх фізіологічнo прийнятних солей приєднання кислоти або N-оксидів і фармацевтичнo прийнятний наповнювач та/або розріджувач або допоміжний агент.
9. Лікарська композиція за п. 8, яка відрізняється тим, що вказаний N-заміщений індол-3-гліоксиламід є вибраним з сполук, визначених в п. 4 та їх фізіологічнo прийнятних солей приєднання кислоти або N-оксидів.
10. Лікарська композиція за п. 8 або п. 9, яка відрізняється тим, що представлена у формі таблеток, таблеток з покриттям, капсул, розчинів для інфузії або ампул, супозиторіїв, пластирів, порошкових препаратів, придатних для інгаляції, суспензій, кремів та мазей.
Текст
1. Застосування принаймні однієї зі сполук Nзаміщеного індол-3-гліоксиламіду загальної формули І 2 3 70942 4 R являє собою водень; наприклад a-гліцил, a-саркозил, a-аланіл, a-лейR1 являє собою 4-піридил, 4-фторфеніл; цил, a-ізо-лейцил, a-серил, a-фенілаланіл, a-гісR2 являє собою бензил, 4-хлорбензил, 4-фторбентидил, a-проліл, a-аргініл, a-лізил, a-аспарагіл та зил, 3-піридилметил, 4-бромбензил; a-глутаміл радикал, де аміногрупи відповідних R3 та R4 являють собою водень і амінокислот можуть бути незахищені або захиZ являє собою кисень. щені, причому переважна захисна група аміно3. Застосування за п.1 або п.2, яке відрізняється групи являє собою карбобензокси радикал, треттим, що вказану фізіологічнo прийнятну сіль прибутоксикарбонільний радикал (ВОС-радикал) та єднання кислоти вибирають з солей мінеральних ацетильну груп у, причому коли R1 являє собою кислот, таких як соляна кислота, сірчана кислота, аспарагіловий та глутаміловий радикал, друга, не фосфорна кислота, та солей органічних кислот, зв'язана карбоксильна група, присутня як вільна таких як оцтова кислота, молочна кислота, малокарбоксильна група або у вигляді естеру з (С1-С6)нова кислота, малеїнова кислота, фумарова кисалканолами, переважно у вигляді метильного, лота, глюконова кислота, глюкуронова кислота, етильного або трет-бутильного естеру; лимонна кислота, ембонова кислота, метансульR та R1 можуть разом з атомом азоту, з яким вони фонова кислота, трифтороцтова кислота, бурштизв'язані, утворювати гомопіперазинове кільце, якнова кислота і 2-гідроксіетансульфонова кислота. що R1 являє собою аміноалкіленову гр упу, або 4. Застосування за п.1, яке відрізняється тим, що піперазинове кільце формули III вказана сполука формули І є вибраною з: D 24241 N-(піридин-4-іл)-[1-(4-фторбензил)-індолN N R7 3-іл]гліоксиламіду, , III D 24843 N-(піридин-4-іл)-(1-бензиліндол-3-іл)-гліоу якій R7 являє собою алкільний радикал, бензгідксиламіду, рильну гр упу, біс-п-фторбензилгідрильну гр упу, D 24850 N-(4-фторфеніл)-[1-(3-піридилметил)-інфенільне кільце, яке може бути моно- або полізадол-3-іл]гліоксиламіду, міщене (С1-С6)-алкілом, (С1-С6)-алкоксигрупою, D 24851 N-(піридин-4-іл)-[1-(4-хлорбензил)-індолгалогеном, нітрогрупою, аміногрупою та (С1-С6)3-іл]гліоксиламіду і алкіламіногрупою; D 25505 N-(піридин-4-іл)-[1-(4-фторбензил)-індолR2 являє собою водень, (С1-С6)-алкільну групу, де 3-іл]гліоксиламіду НСl. алкільна група моно- або полізаміщена галогеном і 5. Спосіб лікування пухлинних захворювань, який фенілом, який, у свою чергу, може бути моно-або відрізняє ться тим, що вводять принаймні одну з полізаміщений галогеном, (С1-С6)-алкільними, (С3сполук формули І, визначених у будь-якому з пп.1С7)-циклоалкільними, карбоксильними групами, 4, або їх фізіологічнo прийнятних солей приєдкарбоксильними групами, естерифікованими (С1нання кислоти або N-оксидів. С6)-алканолами, трифторметильними групами, 6. Спосіб за п.5, який відрізняється тим, що вкагідрокси-, метокси-, етокси- чи бензилоксигрупами, зану сполуку вводять перорально, парентерально, причому якщо R2 являє собою (С1-С6)-алкільну внутрішньовеннo, трансдермально або інгаляцією. груп у, вона додатково може бути заміщена 2-хіно7. Спосіб за п.6, який відрізняється тим, що при лільною групою та 2-, 3- і 4-піридильною структупероральному введенні дози застосування знахорою, причому обидва замісники можуть бути у кодяться в діапазоні від 20 мг до 500 мг на добу, або жному випадку моно- або полізаміщені галогеном, у випадку вн утрішньовенного введення у вигляді (С1-С4)-алкільними групами або (С1-С4)-алкоксигін'єкції або інфузії можуть досягати до 250 мг на рупами, та ароїльний радикал, в якому арильний добу. залишок, що є основою цього радикала, являє 8. Лікарська композиція для лікування пухлинних собою фенільне кільце, яке може бути моно- або захворювань, яка відрізняється тим, що включає полізаміщене галогеном, (С1-С6)-алкілом, (С3-С7)принаймні одну з сполук N-заміщеного індол-3циклоалкілом, карбоксильними групами, карбоксигліоксиламіду загальної формули I, визначених у льними групами, естерифікованими (С1-С6)-алкабудь-якому з пп.1-4, або їх фізіологічнo прийнятних нолами, трифторметильними групами, гідрокси-, солей приєднання кислоти або N-оксидів і фармаметокси-, етокси- або бензилоксигрупами; цевтичнo прийнятний наповнювач та/або розріR3 та R4 можуть бути однаковими або різними і джувач або допоміжний агент. являють собою водень, (С1-С6)-алкіл, (С3-С7)-цик9. Лікарська композиція за п.8, яка відрізняється лоалкіл, (С1-С6)-алканоїл, (С1-С6)-алкоксигрупу, тим, що вказаний N-заміщений індол-3-гліоксилагалоген, бензилоксигрупу, нітрогруп у, аміногрупу, мід є вибраним з сполук, визначених в п.4 та їх (С1-С4)-моно- або діалкілзаміщену аміногрупу, (С1фізіологічнo прийнятних солей приєднання кисС6)-алкоксикарбоніламіно функціональну груп у або лоти або N-оксидів. (С1-С6)-алкоксикарбоніламіно-(С1-С6)-алкільну фу10. Лікарська композиція за п.8 або п.9, яка відрінкціональну гр упу; зняється тим, що представлена у формі таблеток, Z являє собою О та S; таблеток з покриттям, капсул, розчинів для інфузії або їх фізіологічно прийнятних солей приєднання або ампул, супозиторіїв, пластирів, порошкових кислоти, або їх N-оксидів як протипухлинних засопрепаратів, придатних для інгаляції, суспензій, бів. кремів та мазей. 2. Застосування за п.1, яке відрізняється тим, що радикали R, R1, R2, R3, R4 і Z у сполуці формули І приймають такі значення: 5 70942 Індол-3-гліоксиламіди широко застосовуються як сполуки з високою фармакодинамічною активністю, а також модулі для синтезу речовин у фармацевтичній хімії. У заявці на патент Нідерландів №6502481 описані сполуки знеболюючої дії з протизапальними та жарознижувальними властивостями. Предметом заявки на патент Великобританії GB-PS 1 028 812 є похідні індоліл-3-гліоксилової кислоти та їхні аміди як сполуки знеболюючої, протисудомної та β-адренергічної дії. Г. Домшке та ін. (G. Domschke et al.) (Збірник звітів - Вег. 94, 2353 (1961)) описують 3-інлолилгліоксиламіди без характеристики фармакологічних властивостей. Е. Уолтон (Е. Walton) повідомляє у Журналі медичної хімії (J.Med.Chem.) 11, 1252 (1968) про похідні індоліл-3-гліоксилової кислоти, що діють як інгібітори на гліцерофосфатдегідрогеназу та лактатдегідрогеназу. В описі винаходу до європейського патенту ЕР 675110 описані аміди 1Н-індол-3-гліоксилової кислоти, що використовуються як sPLA2-інгібітори і застосовуються у процесі лікування септичного шоку, панкреатиту, алергічного риніту та ревматичного артриту. Метою цього винаходу є одержання N-заміщених індол-3-гліоксиламідів з протипухлинною активністю для поповнення номенклатури наявних ліків. Зазначені сполуки вже відомі з викладеного опису винаходу до неакцептованої заявки Німеччини DE-OS 196 36 150 А1 як ліки протиастматичної, протиалергійної та імуносупресорної / імуномодулюючої дії. Отже, предметом винаходу є застосування Nзаміщених індол-3-гліоксиламідів загальної формули 1 для виготовлення протипухлинних препаратів, протипухлинні препарати з вмістом діючої речовини згідно з формулою 1 та їхнє застосування для лікування пухлинних захворювань, причому радикали R, R1, R2, R3, R4 та Ζ означають: R =водень, (С1-С6)-алкіл, причому алкільна група може бути заміщена одним або кількома фенільними кільцями, і це фенільне кільце, у свою чергу, може бути заміщено одним чи кількома атомами галогену, (С1-С6)-алкілом, (С3-С7)-циклоалкілом, карбоксильними групами, етерифікованими С1-С6-алканолами карбоксильними групами, трифторметильними групами, гідроксильними групами, метоксигрупами, етоксигрупами, бензилоксигрупами, а також бензильною групою, яка у фенільній частині може бути заміщена однією або кількома (С1-С6)-алкільними групами, атомами галогену чи трифториметильними групами, R може також означати бензилоксикарбоні 6 льну групу (Z-гp yn y), а також третинний бутоксикарбонільний радикал (радикал ВОС) й ацетильну груп у. R1 може означати фенільне кільце, заміщене одним або кількома (С1-С6)-алкілами, однією або кількома (С1-С6)-алкокси-, ціангрупами, атомами галогену, трифторметильними, гідрокси-, бензилокси-, нітро-, аміно-, (С1-С6)-алкіламіно-, (С1-С6)-алкоксикарбоніламіногрупами, а також карбоксильною групою або карбоксильною групою, етерифікованою С1-С6-алканонами, або їхній Nоксид та піридиновий скелет формули 2, а також його N-оксид, причому піридиновий скелет може бути на вибір зв'язаний з 2, 3 та 4 атомами вуглецю кільця і заміщений замісниками R5 та R6. Радикали R5 та R6 можуть бути однаковими або різними і являти собою (С1-С6)-алкіл, а також (С3-С7)-циклоалкіл, (С1-С6)-алкокси-, нітро-, аміно-, гідроксигрупу, атоми галогену та трифторметил, крім того, представляти собою радикал етоксикарбоніламіну, а також карбоксиалкілоксигрупу, у якій алкільна група може налічувати 1-4 атоми вуглецю. R1 крім цього, може представляти собою 2або 4-піримідиніл-гетероцикл, причому 2-піримідинільне кільце може бути заміщено однією або кількома метильними групами; далі, він може бути 2,3-, 4- та 8-хіноліловим скелетом, заміщеним (С1С6)-алкілом, атомами галогену, нітрогрупою, аміногрупою, а також (С1-С6)-алкіл-аміно-радикалом, представляти собою 2-, 3- та 4-хінолілметильну груп у, причому вуглець кільця піридилметил-радикалу хінолільної групи та хінолілметил-радикалу можуть бути заміщені (С1-С6)-алкілом, (С1-С6)-алкокси, нітро-, аміно- та (С1-С6)-алкоксикарбоніламіногрупами. R1 у тому разі, якщо R - водень, метильна або бензильна група, а також бензилоксикарбоніл-радикал (Z-радикал), третинний бутоксикарбонілрадикал (ВОС-радикал) та ацетильна група, може означати такі радикали: -СН2СООН; -СН(СН3)СООН; -(CH3)2-CH-(CH2)2-CH-COO-; Н3С-Н2ССН(СН3)-СН(СООН)-;НО-Н2С-СН(СООН)-;фенілСН2-СН(СООН)-;(4-імідазоліл)-СН2-CH-(COOH)-; HN=C(NH2)-NH-(CH2)3-CH(COOH)-; H2N-(CH2)4CH(COOH)-; H2N-CO-CH2-CH-(COOH)-; HOOC(CH2)2-CH(COOH)-; R1 у тому разі, якщо R - водень, Z-група, den ВОС-радикал, ацетильна або бензильна група, може бути також радикалом природної або неприродної амінокислоти, наприклад a-гліцил-, a-саркосил-, a-аланіл-, a-лейцил-, a-ізо-лейцил-, a-серил-, a-фенілаланіл-, a-гістидил-, a-проліл-, aаргініл-, a-лізил-, a-аспарагіл- та a-глютаміл-радикалом, причому аміногрупи відповідних амінокислот можуть бути незахищеними або захищеними. Групою захисту амінофункції можуть служити кар 7 70942 8 бобензокси-радикал (Z-радикал) і третинний бутотинний бутил. Найменування "циклоалкіл" відповіксикарбоніл-радикал (ВОС-радикал), а також ацедає таким радикалам, як, наприклад, циклопропіл, тильна група. У тому разі, якщо R1 представляє циклобутил, циклопентил, циклогексил або циклособою аспарагіл- та глютаміл-радикал, друга, не гептил. зв'язана карбоксильна група може бути вільною Найменування "галоген" відповідає фтору, карбоксильною групою чи ефіром з С 1-С6-алканохлору, брому чи йоду. "Алкоксильні групи" предлами, наприклад метиловим, етиловим або треставляють собою такі радикали, як, наприклад, тинним бутиловим ефіром. метокси-, етокси-, пропокси-, бутокси-, ізопропоR1, крім того, може означати аліламінокарбокси-, ізобутокси- або пентоксигрупи. ніл-2-метил-проп-1-іл-групу. R та R1 разом з атоСполуки можна застосовувати також як солі, мом азоту, з яким вони зв'язані, можуть утворюутворені шляхом приєднання кислот, наприклад, вати піперазинове кільце формули 3 або як солі мінеральних кислот, тобто соляної, сірчаної гомопіперазинове кільце, якщо R1 є аміноалкіленабо фосфорної кислоти, солі органічних кислот, групою, у якому тобто оцтової, молочної, малонової, малеїнової, фумарової, глюконової, глюкуронової, лимонної, ембонової, метансульфонової, трифтороцтової, бурштинової кислот, а також 2-гідрокси-етансульфонової кислоти. R7 представляє собою алкільний радикал чи Сполуки, структура яких відповідає формулі 1, фенільне кільце, які можуть бути заміщені однією а також їхні солі є біологічно активними. або кількома (С1-С6)-алкільними, (С1-С6)-алкоксиСполуки, що мають структуру формули 1, мольними групами, атомами галогену, нітрогрупами, жна призначати для введення у незв'язаній формі амінофункцією, а також (С1-С6)-алкіламіногрупою. або у вигляді фізіологічно переносимих солей. R7 означає також бензгідрильну групу та Bis-pДозволяється пероральне, парентеральне, фторбензилгідрильну гр упу. внутрішньовенне, трансдермальне введення або R2 може бути атомом водню та (С1-С6)-алкільінгаляції. ною групою, причому алкільна група заміщена одКрім того, винахід стосується фармацевтичних ним або кількома атомами галогену та фенілом, препаратів, до складу яких входить принаймні одякі, у свою чергу, можуть бути заміщені одним або на зі сполук за формулою 1 або їхні солі з фізіокількома атомами галогену, однією або кількома логічно переносимими неорганічними або органіч(С1-С6)-алкільними, (С3-С7)-циклоалкільними, карними кислотами, а також, у разі необхідності, забоксильними групами, етерифікованими С1-С6стосовувані у фармацевтиці наповнювачі та/або алканолами карбоксильними групами, трифтормерозчинники й допоміжні компоненти (домішки). тильними групами, гідроксильними групами, метоВідповідними лікарськими формами є, наприкси-, етокси- або бензилоксигрупами. R2 як (С1-С6)клад, таблетки, драже, капсули, розчини для влиалкільна група, крім того, може бути заміщений 2вань або ампули, супозиторії, пластирі, порошки хіноліл-групою та 2-, 3- й 4-піридил-скелетом, придля інгаляцій, суспензії, креми та мазі. чому обидва вищезгадані замісники можуть бути Способи виготовлення сполук згідно з винаховідповідно заміщені одним або кількома атомами дом пояснюються за допомогою наведених далі галогену, однією чи кількома (С1-С4)-алкільними схем реакцій 1 та 2, а також у загальних інструкгрупами або (С1-С4)-алкоксигрупами. R2 може бути ціях. Усі сполуки можна готува ти, як описано вище, також ароіл-радикалом, причому арильна частина, або аналогічним способом. що є основою цього радикала, представляє собою Сполуки, склад яких відповідає загальній фофенільне кільце, яке може бути заміщене одним рмулі 1, де Ζ =О, R1=арил , аралкіл, гетероарил та або кількома атомами галогену, (С1-С6)-алкілом, гетероаралкіл, а також R2=алкіл , аралкіл та гете(С3-С7)-циклоалкілом, карбоксильними групами з роаралкіл, можна одержати згідно з наведеною етерифікованими С 1-С6-алканолами карбоксильнижче схемою 1: ними, трифторметильними, гідроксильними, метокси-, етокси- або бензилоксигрупами. R3 та R4 можуть бути однаковими або різними і представляти собою атоми водню, (С1-С6)-алкіл, (С3-С7)-циклоалкіл, (С1-С6)-алканоіл, (С1-С6)-алкоксигрупи, атоми галогену та бензилоксигрупи. Крім того, R3 та R4 можуть бути нітро-, аміно-, (С1-С4)моно- чи діалкілзаміщеною аміногрупою, а також (С1-С6)-алкокси-карбоніламіно-функцією або (С1С6)-алкоксикарбоніламіно-(С1-С6)-алкіл-функцією. Ζ представляє собою кисень (О) та сірку (S). Такі найменування радикалів R, R1, R2, R3, R4 , R5, R6, R 7, як алкіл-, алканол-, алкокси-або алкіламіногрупи, зазвичай можуть відповідати як "лінійним", так і "розгалуженим" алкільним групам, приПерша стадія чому "лінійні алкільні групи" можуть означати, Похідну індолу, незаміщену або таку, що може наприклад, такі радикали, як метил, етил, n-пропіл, бути заміщена у позиції С-2 чи фенільному скелеті n-бутил, n-пентил, n-гексил, а "розгалужені алкіоднією або кількома групами, розчиняють у прольні групи" - такі радикали, як ізопропіл або третонному, диполярному апротонному або неполяр 9 70942 10 ному органічному розчиннику, наприклад, ізопроосновний іонообмінник, карбонат натрію, карбонат панолі, тетрагідрофурані, диметилсульфоксиді, калію, пульверизований гідроксид калію, а також диметилформаміді, диметилацетаміді, N-метилпінадлишковий первинний або вторинний амін, що ролідоні, діоксані, толуолі або метиленхлориді та використовується для реакції. Реакція відбувакраплями додають до приготованої у тригорловій ється при температурі від 0°С до 120°С, переваколбі в атмосфері N2 суспензії певної основи у жно при 20-80°С, зокрема від 40°С до 60°С. Після відповідному розчиннику з молярною чи надлиш1-3-годинної реакції та 24-годинного відстоювання ковою концентрацією, наприклад гідриду натрію, при кімнатній температурі гідрохлорид речовини пульверизованого гідроксиду калію, третинного для зв'язування кислоти фільтрують, фільтрат бутилату калію, диметиламінопіридину або аміду концентрують у вакуумі, а залишок перекристалінатрію. Потім додають, наприклад, потрібний алзовують з органічного розчинника або очищують кіл-, аралкіл- або гетероаралкілгалогенід, при нешляхом хроматографії на колонці з використанням обхідності також каталізатор, наприклад мідь, дасилікагелю або оксиду алюмінію. Як розчинник ють певний додатковий час на реакцію, наприклад, використовують, наприклад, суміш дихлорметану від 30 хвилин до 12 годин, підтримуючи температа етанолу (об'ємне співвідношення 95:5). туру у межах діапазону від 0°С до 120°С, переваПриклади реалізації винаходу жно від 30°С до 80°С, зокрема від 50°С до 65°С. Згідно з цією загальною інструкцією для стадій Після закінчення реакції реакційну суміш додають 1 та 2, в основу яких покладена схема синтезу 1, у воду, екстрагують розчин за допомогою, наприсинтезуються наступні сполуки, наведені у табликлад, діетилефіру, дихлорметану, хлороформу, цях із зазначенням відповідної хімічної назви. У третинного метил-бутилефіру або тетрагідрофутаблицях 1а...j на сторінках А...J за загальною форану і одержану таким чином органічну фазу вирмулою 1 із замісниками R1-R4 та Ζ наведені струсушують за допомогою безводного сульфату нактурні схеми цих сполук та їхні точки плавлення: трію. Конденсують органічну фаз у у вакуумі, Приклад 1 кристалізують залишок шляхом розтирання або N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3-іл] очищують маслянистий залишок способом перегліоксиламід (D 24241) кристалізації, дистиляції чи хроматографії на коПерша стадія лонці або флеш-хроматографії на силікагелі чи 1-(4-фторбензил)-індол оксиді алюмінію. Розчинником служить, наприУ суміш 2,64г гідриду натрію (0,11 моль, суклад, суміш дихлоретану з діетилефіром в об'ємспензія у мінеральному маслі) зі 100мл диметилному співвідношенні 8:2 або дихлорметану з етасульфоксиду додається розчин 11,72г (0,1 моль) нолом в об'ємному співвідношенні 9:1. індолу у 50мл диметилсульфоксиду. Після нагріДруга стадія вання протягом 1,5 години до температури 60°С та Одержаний за вищенаведеною схемою першої охолодження краплями додають 15,9г (0,11 моль) стадії N-заміщений індол в атмосфері азоту роз4-фторбензилхлориду. Розчин нагрівають до темчиняють в апротонному або неполярному органічператури 60°С, залишають для відстоювання проному розчиннику, наприклад діетилефірі, третинтягом ночі, а потім, помішуючи, вливають у 400мл ному метил-бутиловому ефірі, тетрагідрофурані, води. Здійснюють кількаразове екстрагування за діоксані, толуолі, ксилолі, метиленхлориді або допомогою 150мл метиленхлориду, висушують хлороформі та додають до приготованого в атмоорганічну фазу за допомогою безводного сульсфері азоту розчину оксалілхлориду в апротонфату натрію, фільтр ують та конденсують фільтрат ному чи неполярному розчиннику, наприклад у у вакуумі. Залишок дистилюють у високому вакудіетилефірі, третинному метил-бутиловому ефірі, умі: 21,0г (96% від теоретичного), точка плавлення тетрагідрофурані, діоксані, толуолі, ксилолі, мети(0,5мм): 140°С ленхлориді з молярною або надлишковою до 60 Друга стадія відсотків концентрацією, причому температура N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3-іл] підтримується у межах від -5°С до 20°С. Потім регліоксиламід (D 24241). акційний розчин підігрівають при температурі від До розчину 2,25мл оксалілхлориду у 25мл 10°С до 130°С, переважно від 20°С до 80°С, зокефіру при температурі 0°С в атмосфері N 2 крапрема від 30°С до 50°С протягом часу від 30 хвилин лями додається розчин 4,75г (21,1ммоль) 1-(4до 5 годин, після чого випаровують розчинник. фторбензил)-індолу в 25мл ефіру. Після нагріЗалишок утвореного таким чином "хлориду індовання протягом 2 годин до утворення зворотного ліл-3-гліоксилової кислоти" розчиняють в апротонпотоку випарюють розчинник. Потім до залишку ному розчиннику, наприклад тетрагідрофурані, додають 50мл тетрагідрофурану, охолоджують діоксані, діетилефірі, толуолі або у диполярному розчин до температури -5°С та краплями змішують апротонному розчиннику, наприклад диметилфоіз розчином 4,66г (49,5ммоль) 4-аміно-піридину у рмаміді, диметилацетаміді або диметилсульфок200мл тетрагідрофурану. Нагрівають протягом 3-х сиді, охолоджують до температури від 10°С до годин до утворення зворотного потоку і залишають 15°С, переважно від -5°С до 0°С, та у присутності протягом ночі для відстоювання при кімнатній теречовини для зв'язування кислоти додають до мпературі. 4-амінопіридин-гідрохлорид відсмоктурозчину первинних чи вторинних амінів у розріють, осад промивають тетрагідрофураном, фільтджувачі. Розріджувачами можуть служити розчинрат концентрують у вакуумі та ники, застосовувані, як зазначено вище, для розперекристалізовують залишок з ефіру оцтової кисчинення хлориду індоліл-3-гліоксилової кислоти. лоти. Вихід: 7,09г (90% від теоретичного) Точка Як речовини для зв'язування кислоти застосовуплавлення: 225-226°С. ються триетиламін, піридин, диметиламінопіридин, Елементарний аналіз: 11 70942 12 за розрахунком С 70,77 Η 4,32 Ν 11,25 фактично С 71,09 Η 4,36 Ν 11,26 Приклад 2. D 24242 N-(піридин-4-іл)-(1-метиліндол-3-іл) гліоксиламід. Приклад 3. D 24834 N-(піридин-3-іл)-[1-(4-фторбензил)-індол-3-іл]-гліоксиламід. Приклад 4. D 24835 N-(піридин-3-іл)-(1-бензиліндол-3-іл)-гліоксиламід. Приклад 5. D 24836 N-(піридин-3-іл)-[1-(2-хлорбензил)-індол-3-іл]-гліоксиламід. Приклад 6. D 24840 N-(4-фторфеніл)-[1-(4фторбензил)-індол-3-іл]-гліоксиламід. Приклад 7. D 24841 N-(4-нітрофеніл)-[1-(4фторбензил)-індол-3-іл]-гліоксиламід. Приклад 8. D 24842 N-(2-хлорпіридин-3-іл)-[1(4-фторбензил)-індол-3-іл]-гліоксиламід. Приклад 9. D 24843 N-(піридин-4-іл)-(1-бензиліндол-3-іл)-гліоксиламід. Приклад 10. D 24848 N-(піридин-4-іл)-[1-(3-піридилметил)-індол-3-іл]-гліоксиламід. Приклад 11. D 24849 Ν-(4-фτοрфеніл)-[1-(2-піридилметил)-індол-3-іл]-гліоксиламід. Приклад 12. D 24850 N-(4-фторфеніл)-[1-(3-піридилметил)-індол-3-іл]-гліоксиламід. Приклад 13. D 24851 N-(піридин-4-іл)-[1-(4хлорбензил)-індол-3-іл]-гліоксиламід. Приклад 14. D 24852 N-(піридин-4-іл)-[1-(2хлорбензил)-індол-3-іл]-гліоксиламід. Приклад 15. D 24853 N-(піридин-2-іл)-[1-(4фторбензил)-індол-3-іл]- гліоксиламід. Приклад 16. D 24847 N-(піридин-4-іл)-[1-(2-пі ридилметил)-індол-3-іл]-гліоксиламід. Приклад 17. D 24858 (4-феніл-піперазин-1-іл)[1-(4-фторбензил)-індол-3-іл]-гліоксиламід. Приклад 18. D 24854 N-(піридин-2-іл)-(1-бензил-індол-3-іл)-гліоксиламід. Приклад 19. D 25421 N-(піридин-4-іл)-[1-(4фторбензил)-6-етоксикарбоніламіноіндол-3-іл]гліоксиламід. Приклад 20. D 25422N-(піридин-4-іл)-[1-(4фторбензил)-5-етоксикарбоніламіно-індол-3-іл]гліоксиламід. Приклад 21. D 25423 N-(піридин-4-іл)-[1-(4фторбензил)-6-циклопентилоксикарбонтаміно-індол-3-іл]-гліоксиламід. Приклад 22. D 25420 4-(піридин-4-іл)-піперазин-1-іл)-[1-(4-фторбензил)-індол-3-іл]-гліоксиламід. Приклад 23. D 24866 N-(3,4,5-триметоксибензил)-N-(аліламінокарбоніл-2-метил-проп-1-іл)-[1-(4фторбензил)-індол-3-іл]-гліоксиламід. Приклад 24. N-(піридин-4-іл)-[1-(4-фторбензил)-5-метокси-індол-3- іл]-гліоксиламід. Приклад 25. N-(піридин-4-іл)-[1-(4-фторбензил)-5-етоксикарбоніламіно-метил-індол-3-іл]-гліоксиламід. Вихідні стадії для сполук, приготованих за схемою синтезу 1 загальної формули 1, наведені у Таблиці 1. Таблиця 1 Для кінцевих стадій синтезу D 24241 D 24836 D 24843 D 24851 D 24858 D 25421 Крім того, сполуки, структура яких відповідає загальній формулі 1, де Ζ=О, R1=арильна , аралкільна, гетероарильна, гетероаралкільна та аліламінокарбоніл-2-метил-проп-1-ільна група, a R2=алкільна , аралкільна та гетероаралкільна група, можна синтезувати також за схемою 2: Схема 2 За наведеною схемою 2 були одержані спо D 24242 D 24840 D 24848 D 24852 D 24854 D 25423 D 24834 D 24835 D 24841 D 24842 D 24849 D 24850 D 24853 D 24847 D 25420 D 25422 усі попередні стадії є у продажу. луки D 24241, D24841, D 24840 та D 24834 (друга стадія схеми реакції 2, див. також Таблицю 1), а також їхні попередники D 24825, D 24831, D 24832 та D 24833 (перша стадія схеми реакції 2, див. також Таблицю 2). N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3іл]гліоксиламід (D 24241) Перша стадія М-(піридин-4-ілМіндол-3-іл)гліоксиламід. До розчину 9мл оксалілхлориду в 100мл безводного ефіру краплями при температурі 0°С додається розчин 10г (85,3ммоль) індолу у 100мл ефіру. С уміш витримують протягом 3 годин до утворення зворотного потоку. Після цього при температурі -5°С краплями додають суспензію з 12г (127,9ммоль) 4-амінопіридину в 500мл тетрагідрофурану, реакційну суміш нагрівають, помішуючи, протягом 3 годин до температури утворення зворотного потоку і залишають протягом ночі для відстоювання при кімнатній температурі. Фільтрують, обробляють осад водою й очищують вису 13 70942 14 шену сполук у за допомогою силікагелевої колонки іл]гліоксиламід (D24241) (силікагель 60, фірма Merck AG, Дармштадт) із Одержаний на першій стадії N-(піридин-4-іл)застосуванням елюенту (розчинника) (індол-3-іл)гліоксиламід перетворюють за "Інструкметиленхлорид/етанол (об'ємне співвідноцією з бензилування" за допомогою 4-фторбензишення 10:1). лхлориду, після чого одержана сполука D 24241 Вихід: 9,8г (43,3% від теоретичного). ізолюється. Точка плинності: від 250 °С. Вихід: 41 % від теоретичного. Друга стадія: Точка плавлення: 224-225°С N-(піридин-4-іл) [1 –[4-фторбензил)-індол-3Елементарний аналіз: за розрахунком фактично Загальне правило представлення сполук загальної формули 1 за схемою 2 Перша стадія: До приготованого в атмосфері азоту розчину оксалілхлориду в апротонному або неполярному розчиннику з концентрацією від звичайної молярної до надлишкової 60% концентрації, наприклад, у діетилефірі, третинному метил-бутилефірі, тетрагідрофурані, діоксані чи дихлорметані, при температурі від -5°С до +5°С краплями додають розчинену у розчиннику, як це описано вище для оксалілхлориду, похідн у індолу, без заміщення або таку, яка може бути заміщеною у позиції С-2 або у фенільному кільці. Потім реакційний розчин протягом 1-5 годин нагрівають до температури від 10°С до 120°С, переважно від 20°С до 80°С, зокрема від 30°С до 60°С, після чого випарюють розчинник. Залишок хлориду (індол-3-іл)гліоксилової кислоти розчиняють або суспендують у апротонному розчиннику, наприклад тетрагідрофурані, діоксані, діетилефірі, толуолі чи у диполярному апротонному розчиннику, наприклад диметилформаміді, диметилацетаміді або диметилсульфоксиді, охолоджують до температури від -10°С до +10°С, переважно від -5°С до 0°С, та у присутності речовини для зв'язування кислоти додається до розчину первинного або вторинного аміну у розріджувачі. Як розріджувачі використовуються розчинники, що застосовуються для розчинення "хлориду індоліл-3-гліоксилової кислоти". Речовинами для зв'язування кислоти служать триетиламін, піридин, диметиламінопіридин, основні іонообмінники, карбонат натрію, карбонат калію, пульверизований гідроксид калію, а також первинний або вторинний амін у надлишковій концентрації, що використовується для реакції. Реакція відбувається при температурі від 0°С до 120°С, переважно при 20-80°С, зокрема від 40°С та 60°С. Після 1-4-годинної реакції та відстоювання протягом 24 годин при кімнатній температурі здійснюють фільтрування, дигерування осаду водою, відсмоктування та висушування у вакуумі. Одержану сполуку очищають шляхом перекристалізації в органічному розчиннику або способом хроматографії на колонці з силікагелем чи оксидом алюмінію. Розчинником служить, наприклад, суміш дихлорметану з етанолом (об'ємне співвідношення 10:1). Друга стадія Одержаний за наведеною вище схемою першої стадії "індол-3-іл-гліоксиламід" розчиняють у протоновмісному, диполярному апротонному або неполярному органічному розчиннику, наприклад в С 70,77 С 70,98 Η 4,32 Η 4,40 N 11,25 N 11,49 ізопропанолі, тетрагідрофурані, диметилсульфоксиді, диметилформаміді, диметилацетаміді, N-метилпірролідоні, діоксані, толуолі або метиленхлориді й краплями додають до приготованої у тригорловій колбі в атмосфері N2 суспензії основи з молярною або надлишковою концентрацією, наприклад гідриду натрію, пульверизованого гідроксиду калію, третинного бутилату калію, диметиламінопіридину або аміду натрію у відповідному розчиннику. Після цього додають потрібний алкіл-, аралкіл- або гетероаралкілгалогенід у нерозрідженому стані чи у розріджувачі, який, наприклад, використовувався також для розчинення "індол-3-ілгліоксиламіду", у разі необхідності із доданням каталізатора, наприклад, міді, і дають прореагувати протягом певного часу, наприклад від 30 хвилин до 12 годин, підтримуючи температур у у діапазоні від 0°С до 120°С, переважно від 30°С до 80°С, зокрема від 50°С до 70°С. Після закінчення реакції реакційну суміш додають у воду, розчин екстрагують за допомогою діетилефіру, дихлорметану, хлороформу, третинного метил-бутилефіру, тетрагідрофурану чи n-бутанолу й одержану таким чином органічну фазу висушують за допомогою безводного сульфату натрію. Органічну фазу конденсують у вакуумі, кристалізують залишок шляхом розтирання чи очищують маслянистий залишок шляхом дистиляції або способом хроматографії на колонці чи флеш-хроматографії з застосуванням силікагелю чи оксиду алюмінію. Як розчинник використовують, наприклад, суміш метиленхлориду з діетилефіром в об'ємному співвідношенні 8:2 чи суміш з метиленхлориду та етанолу в об'ємному співвідношенні 9:1. Згідно з цією загальною інструкцією для стадій 1 та 2, в основу якої покладено схему синтезу 2, синтезуються сполуки D 24241, D 24841, D 24840 та D 24834, що вже були представлені згідно з процесом синтезу схеми реакції 1, та наведені у Таблиці 1, Попередні форми цих сполук наведені у Таблиці 2, Була виявлена посилена протипухлинна активність цих сполук у залежності від дози на таких фармакологічних моделях: Індоли, зокрема D-24851 und D-24241, спочатку проявляють себе у тесті на проліферацію ХТТ / тесті на цитотоксичність (Таблиці 3 та 3а). У цій системі тестів досліджують вплив субстанцій на проліфераційну характеристику ліній пухлинних клітин. При цьому реєструють цитотоксичний потенціал цих субстанцій. Метод тестування описаний у ста тті Scudiero et al. 1988, Cancer Res. 48, 4827. Під час проведення досліджень застосову 15 70942 16 вались такі лінії пухлинних клітин: Крім того, після введення D-24851 не спостерілінія клітин KB епідермальної карциноми рогалась фрагментація дезоксирибонуклеїнової кистової порожнини; лоти (ДНК). Під час дослідження гематопоезу талінія клітин L1210 лімфатичної лейкемії миші; кож жоден з параметрів крові не змінився в лінія клітин LNCAP карциноми простати, а тарезультаті внутрішньочеревинного введення спокож луки D-24851. лінія клітин SK-OV-3 карциноми яєчників. На іншій моделі впливу хіміотерапії на пухлин у В усі х чотирьох лініях пухлинних клітин було Дюннінга (Dunning) пацюка після багаторазового виявлено велику кількість різних індолів. Найефекперорального введення D-24851 можна було спотивнішою виявилась дія D-24851 та D-24241, пристерігати припинення росту пухлини та навіть речому D-24851 був ефективнішим за D-24241 (Табгресію пухлини у деяких тварин. лиці 3 та 4). У дослідженні лінії клітин KB безшерстої миші В інших порівняльних дослідженнях дії сполук також після введення обох індолів D-24851 та D-24241 на порожнисті волокна безшеD-24851 та D-24241 було виявлено протипухрстої миші та на L1210 (миші) виявилось, що ефелинну дію (Таблиці 3, 3а, а також 4). При досліктивність протипухлинної дії обох сполук значною дженнях лінії пухлинних клітин L1210 лімфатичної мірою залежить від їхньої дози (Таблиці 3 та 5). У лейкемії миші після внутрішньочеревинного або дослідженнях дії на порожнисті волокна ефективперорального багаторазового введення D 24851 ність обох сполук була майже однаковою, в той дозою 100 та 147мг/кг було виявлено явне збільчас як у дослідженнях на L1210 дія сполуки Dшення часу виживання тварин у залежності від 24851 після перорального та внутрішньочеревиндози (Фіг.1а та Фіг.1). ного введення була явно ефективнішою за дію DЗавдяки широким можливостям застосування 24241. У порівнянні з протипухлинними речовипри лікуванні, що були підтверджені експерименнами, які є на ринку, дія сполуки D-24851 на мотально, дозу діючої речовини можна призначати дель лейкемії у багатьох випадках виявилась явно вищою, ніж для звичайних протипухлинних препаефективнішою за дію відомих еталонних речовин ратів, що є у продажу. (Таблиця 5). Не обмежуючи масштаб винаходу у зв'язку з Іншою великою перевагою D-24851 у порівнаведеними далі даними, слід зазначити, що деннянні з протипухлинними речовинами, які є на рину дозу препаратів для перорального введення нку, є невелика токсичність цієї сполуки (Таблиці 3 можна призначати у діапазоні від 20мг до 500мг. та 5). Завдяки тому, що значення LD 50 дорівнюПри внутрішньовенному введенні препаратів у ють 1000мг/кг при пероральному введенні та вигляді ін'єкцій або інфузій доза може досягати >1000мг/кг при внутрішньочеревинному введенні, 250мг на день або вище у залежності від маси тіла спектр застосування цієї сполуки виявляється дупацієнта, а також індивідуальної переносимості. же широким. Таблиця 3 Склад D-24851 згідно з Прикладом 13 D-24851 N-(піридин-4-іл)-[1-(4-хлорбензил)-індол-3-іл]-гліоксиламід Модель Результ. ХТТ (мкг/мл) EC50 1´внутрішньо-черевинне ввеDL50 дення (мг/кг) DL50 1´пероральне введення (мг/кг) Порожнинні волокна внутрішньочеревинне введення % INH 4´46мг/кг внутрішньочеревинне введення Порожнинні волокна внутрішньочеревинне введення % INH 4´147мг/кг внутрішньочеревинне введення Порожнинні волокна підшкірне введення 4´46мг/кг внутрішньо- % INH черевинне введення Порожнинні волокна підшкірне введення 4´147мг/кг внутріш- % INH ньочеревинне введення У живому організмі: 1´681мг/кг внутрішньочеревинне введення 1´464мг/кг вну- % ILS трішньочеревинне введення SK-OV-3 ≈0,03 KB ≈0,017 L1210 ≈0,017 LNCaP ≈0,03 MCF-7 Токс. =1000 >1000 не діє 56 38 12 60 68 44 не діє 47 35 67 68 0 18 17 70942 Модель Результ. 4´215мг/кг внутрішньочеревинне введення 4´147мг/кг вну- % ILS трішньочеревинне введення 7´100мг/кг внутрішньочеревинне введення 7´147мг/кг вну- % ILS трішньочеревинне введення 1´681мг/кг пероральне введення 4´215мг/кг перорапьне введення % ILS 7´100мг/кг пероральне введення 7´147мг/кг пероральне введення 7´46мг/кг внутрішньочеревинне введення % WHI 2´215мг/кг пероральне введення SK-OV-3 18 Продовження таблиці 3 KB L1210 LNCaP MCF-7 Токс. 13 94 35 59 22 31 63 75 33 18 Таблиця 3 а Речовина згідно з прикладом (номер D) 1(D 24241) 3(D 24834) 4(D 24835) 6(D 24840) 9(D 24843) 10(D 24848) 11(D 24849) 12(D 24850) 13(D24851) 14(D 24852) 15(D 24853) 16(D 24847) Таблиця 2 (D 24831) Пухлинні клітини ХТТ KB ЕС50 [мкг/мл] 0,020 1,75 17,5 3,100 0,050 4,060 4,590 >31,6 0,017 1,75 >31,6 4,59 L 1210 ЕС50 [мкг/мл] 0,170 1,75 1,750 1,750 0,090 1,75 1,750 0,017 0,017 1,75 3,1 1,75 LNCAP ЕС50 [мкг/мл] >31,600 9,250 >31,6 >31,6 3,240 >31,6 17,500 >31,6 0,030 17,5 >31,6 17,500 SK-OV-3 ЕС50 [мкг/мл] 0,170 1,750 9,200 17,5 1,750 7,220 4,250 >31,6 0,030 2,58 >31,6 4,250 17,5 17,5 17,5 17,5 Результати інших дослідів на тваринах: Під час досліджень дії сполук на пухлину Дюннінга після перорального введення 7´100мг/кг та 7´147мг/кг речовини D-24851 спостерігалось припинення росту пухлини, у деяких тварин - навіть регресія пухлини. При тестуванні кристалічної форми не було виявлено жодних змін у порівнянні з вихідною формою. D-24851 не спричиняє фрагментації ДНК. При дослідженні гематопоезу жоден з параметрів крові не зазнав зміни під впливом внутрішньочеревинного введення D-24851. Таблиця 4 D 24241 N-(піридин-4-іл)-[1-(4-фторбензил)-індол-3-іл]гліоксиламід згідно з прикладом 1 Модель Результ. ХТТ (мкг/мл) ЕС50 1´внутрішньочеревинне DL50 введення (мг/кг) 1´пероральне введення DL50 (мг/кг) SK-OV-3 ≈0,17 KB ≈0,02 U 210 ≈0,17 LNCaP >31,6 МСР-7 Токс. ≈158 >1000 19 70942 20 Продовження таблиці 4 Модель Результ. Порожнинні волокна внутрішньочеревинне введення 4´15,8 мг/кг % INH внутрішньочеревинне введення Порожнинні волокна підшкірне введення % INH 4´15,8мг/кг внутрішньочеревинне введення У живому організмі: 1´14,7мг/кг внутрішньо% ILS черевинне введення 1´30мг/кг пероральне % ILS введення 1´464 мг/кг пероральне % ILS введення 4´30мг/кг пероральне % ILS введення 6´30мг/кг пероральне % ILS введення 14´30мг/кг пероральне % ILS введення 19´50мг/кг пероральне % ILS введення 2´46,4мг/кг внутрішньо- % WHI черевинне введення 4´21,5мг/кг внутрішньо- % WHI черевинне введення 2´215мг/кг пероральне % WHI введення SK-OV-3 KB U 210 LNCaP МСР-7 46 43 не діє 81 68 Токс. 33 не діє не діє 44 не діє не діє не діє 50 22 не діє 47 Таблиця 5 Порівняння протипухлинної дії D-24851 та D-24241 зі стандартними сполуками Токс. мг/кг L1210 мг/кг D-24851 ≈1000 внутрішньочеревинне введення 4´147 внутрішньочеревинне введення 94% ILS D-24241 ≈158 внутрішньочеревинне введення 19´50 пероральне введення 50% ILS Мітоксантрон 1´4,64 16 внутрішньовенне введення внутрішньовенне введення 144% ILS Речовина 5-фторурацил 1´147 внутрішньочеревинне введення72% ILS 4´68,1 внутрішньочеревинне введення 83% ILS Метотрексат 1´53,7 внутрішньочеревинне введення 39% ILS ХТТ ЕС50 (мкг/мл) KB≈0,017 L1210≈0,017 SKOV3≈0,03 LNCAP≈0,03 KB≈0,02 L1210≈0,17 SKOV3≈0,17 LNCAP>31,6 KB≈0,174 L121068,1 внутрішньовенне введення ≈16,0 внутрішньочеревинне введення ≈30,0 внутрішньовенне введення L1210 мг/кг ХТТ ЕС50 (мкг/мл) 1´46,4 внутрішньочеревинне введення 56% ILS 1´1,47 внутрішньочеревинне введення 22% ILS KB
ДивитисяДодаткова інформація
Назва патенту англійськоюApplication of n-substituted indolyl-3-glicoxamide as antitumor drug, a method for treatment of tumor diseases and a medical composition for treatment of tumor diseases
Автори англійськоюSchmidt Juergen, Emig Peter, Reichert Dietmar, Guenther Eckhard
Назва патенту російськоюПрименение n-замещенного индолил-3-глиоксиламида как противоопухолевого средства, способ лечения опухолевых заболеваний и лекарственная композиция для лечения опухолевых заболеваний
Автори російськоюШмидт Юрген, Эмиг Петер, Райхерт Дитмар, Гюнтер Экхард
МПК / Мітки
МПК: C07D 401/06, C07D 209/18, A61K 31/4709, C07D 401/12, A61K 31/4427, A61K 31/444, A61K 31/4545, A61K 31/404, A61K 31/403, A61K 31/454, A61K 31/496, C07D 401/14, A61K 31/4439, A61K 31/4178, A61P 35/00
Мітки: лікування, протипухлинного, лікарська, композиція, захворювань, спосіб, застосування, індоліл-3-гліоксиламіду, засобу, пухлинних, n-заміщеного
Код посилання
<a href="https://ua.patents.su/16-70942-zastosuvannya-n-zamishhenogo-indolil-3-glioksilamidu-yak-protipukhlinnogo-zasobu-sposib-likuvannya-pukhlinnikh-zakhvoryuvan-ta-likarska-kompoziciya-dlya-likuvannya-pukhlinnikh-zakh.html" target="_blank" rel="follow" title="База патентів України">Застосування n-заміщеного індоліл-3-гліоксиламіду як протипухлинного засобу, спосіб лікування пухлинних захворювань та лікарська композиція для лікування пухлинних захворювань</a>












