Похідні 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-ацетаміду, їх одержання та застосування у терапії
Номер патенту: 77273
Опубліковано: 15.11.2006
Автори: Пюш Фредерік, Марґе Франк, ФРУАССАН Жак, МАРАБУ Бенуа
Формула / Реферат
1. Сполука загальної формули (І)
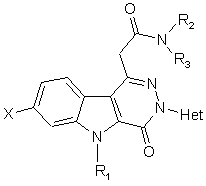 , (I)
, (I)
в якій
Х представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R2 та R3, незалежно, представляють атом гідрогену або (С1-С4)алкіл, або інакше
R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1-С4)алкілпіперазиніл, а
Het представляє гетероароматичну групу, таку як піридиніл, хінолініл, ізохінолініл, піримідиніл, піразиніл або піридазиніл, яка може нести один або більше атомів галогену та/або один або більше (С1-С4)алкілів та/або (С1-С4)алкоксилів у формі основи або кислотно-адитивної солі, або у формі гідрату або сольвату.
2. Сполука за п. 1, де Х представляє атом галогену.
3. Сполука за п. 1 або 2, де R1 представляє (С1-С4)алкіл.
4. Сполука за будь-яким із пп. 1-3, де R2 та R3 незалежно представляють (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони поєднані, складають піролідиніл або 4-(С1-С4)алкілпіперазиніл.
5. Сполука за будь-яким із пп. 1-4, де Het представляє гетероароматичну групу типу піридинілу, яка може нести один або більше атомів галогену та/або один або більше (С1-С4)алкілів та/або (С1-С4)алкоксилів.
6. Сполука за будь-яким з пп. 1-5, де Х представляє атом хлору, а R1 представляє метильну групу.
7. Спосіб одержання сполуки загальної формули (І)
 , (I)
, (I)
в якій
X представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1-С4)алкілпіперазиніл, а
Het представляє гетероароматичну групу типу піридинілу, хінолінілу, ізохінолінілу, піримідинілу, піразинілу або піридазинілу, яка може нести один або більше атомів галогену та/або один або більше (С1-С4)алкілів та/або (С1-С4)алкоксилів,
згідно зі способом сполуку загальної формули (IV)
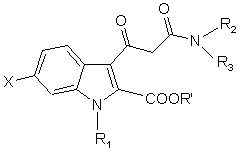 , (IV)
, (IV)
в якій
X, R1, R2 тa R3 визначені у п.7, R' представляє (С1-С4)алкіл, піддають реакції з гетероарилгідразином у полярному розчиннику в присутності кислоти.
8. Спосіб за п. 7, де сполуку загальної формули (ІV)
 , (IV)
, (IV)
в якій X, R1, R2, R3 визначені у п.7, а R' є (С1-С4)алкіл, одержують реакцією сполуки загальної формули (III)
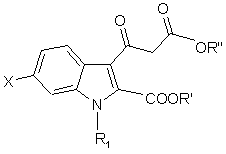 , (III)
, (III)
в якій
X, R1 визначені у п.7, а R' є (С1-С4)алкіл, R'' представляє (С1-С4)алкіл, з аміном загальної формули HNR2R3, в якій R2 та R3 визначені у п.7, у присутності каталізатора - 4-(диметиламіно)піридину.
9. Спосіб одержання сполуки загальної формули (I)
 , (I)
, (I)
в якій
Х представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3 разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1-С4)алкілпіперазиніл, а
Het представляє гетероароматичну групу типу піридинілу, хінолінілу, ізохінолінілу, піримідинілу, піразинілу або піридазинілу, яка може нести один або більше атомів галогену та/або один або більше (С1-С4)алкілів та/або (С1-С4)алкоксилів,
згідно зі способом проводять N-гетероарилування сполуки загальної формули (V)
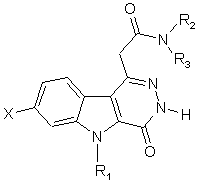 , (V)
, (V)
в якій
X, R1, R2 тa R3 визначені вище, у присутності гетероарилгалогеніду або іншого похідного гетероарилборонової кислоти та солі металу, наприклад солі Cu.
10. Спосіб за п. 9, де сполуку загальної формули (V)
 , (V)
, (V)
в якій X, R1, R2 та R3 визначені у п.9, одержують реакцією сполуки загальної формули (ІV)
 , (IV)
, (IV)
в якій
X, R1, R2, R3 визначені у п.9, R' представляє (С1-С4)алкіл, із гідразином нагріванням у толуолі у присутності каталітичної кількості кислоти.
11. Сполука загальної формули (III)
 , (III)
, (III)
в якій
X представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R' та R'' незалежно представляють (С1-С4)алкіл.
12. Сполука загальної формули (IV)
 , (IV)
, (IV)
в якій
Х представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R' представляє (С1-С4)алкіл,
R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1-С4)алкілпіперазиніл.
13. Сполука загальної формули (V)
 , (V)
, (V)
в якій
Х представляє атом гідрогену або галогену,
R1 представляє атом гідрогену або (С1-С4)алкіл,
R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1-С4)алкілпіперазиніл.
14. Сполука за будь-яким із пп. 1-6 або її фармацевтично прийнятна сіль, або гідрат чи сольват названої сполуки, для її використання як медичного продукту.
15. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну сполуку формули (І) за будь-яким із пп. 1-6 або фармацевтично прийнятну сіль, або гідрат чи сольват цієї сполуки, як варіант, комбіновану з принаймні одним фармацевтично прийнятним наповнювачем.
Текст
1. Сполука загальної формули (І) O R2 N R3 C2 2 UA 1 ЇХ (19) ДЕРЖАВНИЙ ДЕПАРТАМЕНТ ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ 3 77273 4 6. Сполука за будь-яким з пп. 1-5, де Х представX, R1 визначені у п.7, а R' є (С1-С4)алкіл, R'' предляє атом хлору, а R1 представляє метильну групу. ставляє (С1-С4)алкіл, з аміном загальної формули 7. Спосіб одержання сполуки загальної формуHNR2R3, в якій R2 та R3 визначені у п.7, у присутли (І) ності каталізатора - 4-(диметиламіно)піридину. 9. Спосіб одержання сполуки загальної формуO R2 ли (I) N O R2 R3 N N R3 (I) N Het X N (I) N N Het X O R1 N , O в якій R1 X представляє атом гідрогену або галогену, , R1 представляє атом гідрогену або (С1-С4)алкіл, в якій R2 та R3 незалежно представляють атом гідрогену Х представляє атом гідрогену або галогену, або (С1-С4)алкіл, або інакше R2 та R3, разом з атоR1 представляє атом гідрогену або (С1-С4)алкіл, мом нітрогену, до якого вони приєднані, складають R2 та R3 незалежно представляють атом гідрогену піролідиніл, піперидиніл, морфолініл або 4-(С1або (С1-С4)алкіл, або інакше R2 та R3 разом з атоС4)алкілпіперазиніл, а мом нітрогену, до якого вони приєднані, складають Het представляє гетероароматичну групу типу піпіролідиніл, піперидиніл, морфолініл або 4-(С1ридинілу, хінолінілу, ізохінолінілу, піримідинілу, С4)алкілпіперазиніл, а піразинілу або піридазинілу, яка може нести один Het представляє гетероароматичну групу типу піабо більше атомів галогену та/або один або більридинілу, хінолінілу, ізохінолінілу, піримідинілу, ше (С1-С4)алкілів та/або (С1-С4)алкоксилів, піразинілу або піридазинілу, яка може нести один згідно зі способом сполуку загальної формули (IV) або більше атомів галогену та/або один або більше (С1-С4)алкілів та/або (С1-С4)алкоксилів, O O R2 згідно зі способом проводять N-гетероарилування N сполуки загальної формули (V) O R3 R2 (IV) X N COOR' N R3 R1 N , в якій X, R1, R2 тa R3 визначені у п.7, R' представляє (С1С4)алкіл, піддають реакції з гетероарилгідразином у полярному розчиннику в присутності кислоти. 8. Спосіб за п. 7, де сполуку загальної формули (ІV) O O R2 N R3 (IV) X COOR' N N H X N O R1 , в якій X, R1, R2 тa R3 визначені вище, у присутності гетероарилгалогеніду або іншого похідного гетероарилборонової кислоти та солі металу, наприклад солі Cu. 10. Спосіб за п. 9, де сполуку загальної формули (V) O R2 N R1 , в якій X, R1, R2, R3 визначені у п.7, а R' є (С1С4)алкіл, одержують реакцією сполуки загальної формули (III) O O (III) X R1 в якій R3 N N H X N R1 OR'' N (V) COOR' , (V) O , в якій X, R1, R2 та R3 визначені у п.9, одержують реакцією сполуки загальної формули (ІV) 5 O O N 77273 6 R' представляє (С1-С4)алкіл, R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають (IV) піролідиніл, піперидиніл, морфолініл або 4-(С1С4)алкілпіперазиніл. 13. Сполука загальної формули (V) R2 R3 X COOR' N R1 O , в якій X, R1, R2, R3 визначені у п.9, R' представляє (С1С4)алкіл, із гідразином нагріванням у толуолі у присутності каталітичної кількості кислоти. 11. Сполука загальної формули (III) O O (III) COOR' R1 , в якій X представляє атом гідрогену або галогену, R1 представляє атом гідрогену або (С1-С4)алкіл, R' та R'' незалежно представляють (С1-С4)алкіл. 12. Сполука загальної формули (IV) O O N R2 R3 (IV) X N N N H X (V) O R1 X N R3 N OR'' R2 N COOR' R1 , в якій Х представляє атом гідрогену або галогену, R1 представляє атом гідрогену або (С1-С4)алкіл, Винахід стосується похідних 3-гетероарил-3,5дигідро-4-оксо-4Н-піридазин[4,5-b]індол-1ацетаміду. Відомі похідні 3,5-дигідропіридазин[4,5b]індолу, описані у WO-A-9906406 та WO-A0044384, мають спорідненість in vitro до периферійних бензодіазепінових рецепторів (PBR або рділянок). Усе ще існує необхідність шукати та створювати продукти, які демонструють гарну активність in vivo. Винахід відповідає цій цілі забезпеченням новими сполуками, які демонструють спорідненість in vitro та in vivo до периферійних бензодіазепіновий рецепторів. Винахід, по-перше, охоплює сполуки загальної формули (І), наведеної нижче. Винахід також охоплює способи отримання сполук загальної формули (І). Подалі винахід охоплює сполуки, які можна використовувати, особливо як інтермедіати синтезу сполук загальної формули (І). Винахід додатково охоплює застосування сполук загальної формули (І), особливо у медичних продуктах або у фармацевтичних композиціях. , в якій Х представляє атом гідрогену або галогену, R1 представляє атом гідрогену або (С1-С4)алкіл, R2 та R3 незалежно представляють атом гідрогену або (С1-С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл, піперидиніл, морфолініл або 4-(С1С4)алкілпіперазиніл. 14. Сполука за будь-яким із пп. 1-6 або її фармацевтично прийнятна сіль, або гідрат чи сольват названої сполуки, для її використання як медичного продукту. 15. Фармацевтична композиція, яка відрізняється тим, що містить принаймні одну сполуку формули (І) за будь-яким із пп. 1-6 або фармацевтично прийнятну сіль, або гідрат чи сольват цієї сполуки, як варіант, комбіновану з принаймні одним фармацевтично прийнятним наповнювачем. Сполуки винаходу описують загальною формулою (І): в якій X представляє атом гідрогену або галогену, R1 представляє атом гідрогену або (С1С4)алкіл, R2 та R3 кожна незалежно представляють гідроген або (С1-С4)алкіл, або, інакше, R2 та R3 разом з атомом нітрогену, до якого вони приєднані, утворюють піролідиніл, піперидиніл, морфолініл або 4(С1-С4)алкілпіперазиніл, а Het представляє гетероароматичну групу типу 7 77273 8 піридинілу, хінолінілу, ізохінолінілу, піримідинілу, метилпирідин-3-іл)-3,5-дигідро-4Нпіразинілу або піридазинілу, яка може мати один піридазин[4,5b]індол-1-ацетамід або більше атомів галогену та/або одну або біль9: 7-хлор-N,N-діетил-5-метил-4-оксо-3ше (С1-С4)алкіл- та/або (С1-С4)алкокси-груп. (піридин-3-іл)-3,5-дигідро-4Н-піридазин[4,5Сполуки винаходу можуть існувати у вигляді b]індол-1-ацетамід основи або кислотно-адитивних солей Такі адити10. 4-метил-1-[2-[7-хлор-5-метил-3-(піридин-3вні солі складають частину винаходу. Ці солі вигоіл)-4-оксо-3,5-дигідро-4Н-піридазин[4,5-b]індол-1товлені переважно з фармацевтично прийнятних іл]ацет-1-ил]піперазин гідрохлорид (1:1) кислот, хоча солі інших кислот, наприклад, корис11: 1-[2-[7-хлор-5-метил-3-(піридин-3-іл)-4них для очищення або виділення сполук формули оксо-3,5-дигідро-4Н-піридазин[4,5-b]індол-1(І), також складають частину винаходу. іл]ацет-1-іл]піролідин Сполуки формули (І) можуть також існувати у 12: 1-[2-[7-хлор-5-метил-3-(піридин-4-іл)-4вигляді гідратів або сольватів; точніше - у вигляді оксо-3,5-дигідро-4Н-піридазин[4,5-b]індол-1асоціатів або сполук з однією або більше молекуіл]ацет-1-іл]піролідин гідрохлорид (1:1) лами води або розчинником. Такі гідрати та сольСполуки загальної формули (І) можна одержавати також складають частину винаходу. ти за процесами, які ілюстровані тут нижче. На У контексті представленого винаходу завершення опису інтермедіати (II), (III), (IV) та (V) атом галогену представляє флуор, хлор, бром показані у схемі нижче. або йод; (С1-С4)алкільна група представляє лінійну або розгалужену насичену аліфатичну групу, що містить від 1 до 4 атомів карбону, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил та третбутил; (С1-С4)алкокси-група представляє оксигеновий радикал, що містить від 1 до 4 атомів карбону, який є заміщеним алкільною групою, яка описана вище. Серед передбачених винаходом сполук формули (І) переважними сполуками є сполуки, в яких: X представляє атом галогену; та/або R1 представляє (С1-С4)алкіл; та/або R2 та R3, незалежно, представляють (С1С4)алкіл, або інакше R2 та R3, разом з атомом нітрогену, до якого вони приєднані, складають піролідиніл або 4-( С1-С4)алкілпіперазиніл; та/або Het представляє гетероароматичну групу типу піридинілу, яка може нести один або більше атомів галогену та/або одну або більше (С1-С4)-алкіл та/або (С1-С4)алкокси-груп. Сполуки, для яких усі X, R1, R2, R3 та Het є, як визначено вище, у підгрупах переважних сполук, більш конкретно, а серед цих - сполуки, в яких X представляє атом хлору, R1i представляє метил. Серед передбачених винаходом сполук формули (І) є, наприклад, наступні сполуки винаходу: 1: 7-флуор-N,N,5-триметил-4-оксо-3-(піридин2-іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1Сполуку загальної формули (II), у якій X та R1 ацетамд визначені вище, a R’ представляє (С1-С4)алкіл, 2: 7-флуор-N,N,5-триметил-4-оксо-3-(піридинобробляють 3-хлор-3-оксопропаноатом загальної 3-іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1формули CICOCH2CO2R", у якій R" представляє ацетамід гідрохлорид (1:1) (С1-С4)алкіл, у дихлоретані, при навколишній тем3: 7-флуор-N,N,5-триметил-4-оксо-3-(піридинпературі у присутності кислоти Льюіса, наприклад, 4-іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1тетрахлориду титану, і отримують естер двохосноацетамід гідрохлорид (1:1) вної кислоти загальної формули (III). 4: 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-2Щоб одержати сполуку загальної формули іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід (IV), кетоестерну функціональну групу естеру дво5: 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-3хосновної кислоти загальної формули (III) конверіл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамд тують у кетоамідну дією аміну загальної формули 6: 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-3HNR2R3, у якій R2 та R3 визначені вище, у присутіл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід ності каталізатора - 4-(диметиламіно)піридину. гідрохлорид (1:1) Згідно з першим способом отримання сполуку за7: 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-4гальної формули (IV) обробляють у полярному іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід розчиннику в присутності кислоти гетероарилгідгідрохлорид (1:1) разином, що дає амід загальної формули (І). Згід8: 7-хлор-N,N,5-триметил-4-оксо-3-(6но з другим способом отримання сполуку загаль 9 77273 10 ної формули (IV) обробляють гідразином при нагріванні у такому розчиннику, як толуол, у присутності каталітичної кількості кислоти, що утворює піридазиноіндол загальної формули (V). Остаточно реакцію N-арилування виконують на піридазиноіндолі загальної формули (V) у присутності гетероалілгалогеніду, або інакше, похідного гетроалілборонової кислоти та такої солі металу, як сіль міді, що дає сполуку загальної формули (І). Застосовані вище реагенти є у продажу або описані у літературі, або інакше їх можна одержав якій ти способами, які описані тут, або які відомі фахівX представляє атом гідрогену або галогену, R1 цям. Більш детально: похідне боронової кислоти, представляє атом гідрогену або (С1-С4)алкіл, R2 та що має гетероароматичну групу, одержують споR3, кожна незалежно одна від другої, представсобом, що відомий у літературі [Synth. Commun. лять атом гідрогену або (С1-С4)алкіл, або інакше 1996, 26, 3543 та N09803484]. R2 та R3, разом з атомом нітрогену, до якого вони Отримання початкової сполуки загальної фоприєднані, складають піролідиніл, піперидиніл, рмули (II) описано у документі W-A-0044751 у виморфолініл або 4-(С1-С4)-алкілпіперазиніл, які западку, де X є атом хлору. У випадку, де X є атом стосовують, як інтермедіати для отримання сполук флуору, сполуку загальної формули (II) одержують загальної формули (І). аналогічно, починаючи від метил-6-флуороіндолНаступні приклади ілюструють отримання де2-карбоксилату, який описано у літературі [J. Med. яких сполук винаходу. Ці приклади не лімітують, а Chem. 2000, 43, 4701]. тільки ілюструють винахід. Численні сполуки у поВинахід також охоплює сполуки загальної фоєднанні з тими, що надані у таблиці подалі, і прикрмули (III), ладами, ілюструють хімічні структури та фізичні властивості деяких сполук у відповідності з винаходом. Елементний мікроаналіз та спектри ІЧ та ЯМР підтверджують структури отриманих сполук. Приклад 1 (Сполука 1). 7-флуор-N,N,5-триметил-4-оксо-3-(піридин-2іл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід 1.1 Метил 6-флуоро-1-метил-1Н-індол-2карбоксилат 60% суспензія 7,9г (197ммол) гідриду натрію в якій (заздалегідь промитого петролейним ефіром) та X представляє атом гідрогену або галогену, 36,1г (176ммол) метил 6-флуоро-1Н-індол-2R1 представляє атом гідрогену або (С1карбоксилату (що містить від 10 до 20% етил 6С4)алкіл, флуоро-1Н-індол-2-карбоксилату) у 250мл Ν,ΝR' та R", незалежно, представляють (С1диметилформаміду перемішують при навколишній С4)алкіл, температурі 2год. Потім добавляють 12мл які корисні як інтермедіати для отримання (193ммол) йодистого метилу у 50мл Ν,Νсполук загальної формули (І). диметилформаміді та суміш перемішують при наВинахід додатково охоплює сполуки загальної вколишній температурі 12год. формули (IV), Усе виливають у суміш лід/вода. Добавляють дихлорметан та водну фазу нейтралізують соляною кислотою (1N). Органічну фазу відокремлюють, промивають водою, висушують над сульфатом натрію, фільтрують та концентрують під зниженим тиском. Залишок очищають хроматографією на колонці із силікагелем сумішшю розчинників (циклогексан/дихлорметан: 50/50-0/100 потім дихлорметан/етилацетат: 100/0-70/30). Видів якій ляють 32,7г (170ммол) білої сполуки метил 6X представляє атоми гідрогену або галогену флуор-1-метил-1Н-індол-2-карбоксилату, що місR1 представляє атом гідрогену або (С1тить від 10 до 20% етил 6-флуор-1-метил-1НС4)алкіл індол-2-карбоксилату. R' представляє (С1-С4)алкільну групу, 1.2 Метил 3-[6-флуор-2-(метосикарбоніл)-1R2 та R3, кожна незалежно одна від другої, метил-1Н-індол-3-іл]-3-оксопропаноат представляють атом гідрогену або (С1-С4)-алкіл, Порціями 6,5мл (60ммол) метил 3-хлор-3-оксоабо інакше R2 та R3, разом з атомом нітрогену, до пропаноату добавляють до розчину 6,6мл якого вони приєднані, утворюють піролідиніл, піпе(60ммол) тетрахлориду титану у 80мл 1,2ридиніл, морфолініл або 4-(С1-С4)дихлоретану. Суміш перемішують при навколишалкілпіперазиніл, які застосовують як інтермедіати ній температурі 30 хвилин. Добавляють розчин 5г для отримання сполуки загальної формули (І). (24,1ммол) метил 6-флуоро-1-метил-1Н-індол-2Винахід подалі охоплює сполуки загальної карбоксилату (що містить від 10 до 20% етил 6формули (V) флуоро-1-метил-1Н-індол-2-карбоксилату), одер 11 77273 12 жаного у етапі 1.1, і суміш перемішують при 40°С 3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід 20год. гідрохлорид Суміш виливають у льодяну воду та екстрагу2.1 етил 3-[6-хлор-2-(метосикарбоніл)-1-метилють дихлорметаном. Органічну фазу відокремлю1Н-індол-3-іл]-3-оксопропаноат ють, промивають водою, висушують над сульфаРозчин 6,2мл (48,4ммол) етил 3-хлор-3том натрію, фільтрують та концентрують під оксопропаноату в 70мл 1,2-дихлоретану охолозниженим тиском. Залишок очищають хроматогджують до 0°С. Маленькими порціями 5,3мл рафією на колонці із силікагелем (елюент: цикло(48,3ммол) добавляють тетрахлорид титану й сугексан/дихлрометан: 90/10-0/100, потім - дихлорміш перемішують при 0°С 30 хвилин. Добавляють метан/етилацетат 100/0-50/50). Отримують 13г розчин 4,3г (19,2ммол) метил 6-хлор-1-метил-1Нтвердої пасти, що містить початкову сполуку. Це індол-2-карбоксилату у 35мл 1,2-дихлоретану та використовують, як воно є, (У цьому ж вигляді її суміш перемішують при навколишній температурі використовують)??? у залишку синтезів. 12год. Це виливають у лід/воду та екстрагують 1.3 N,N-диметил-3-[6-флуор-2дихлорметаном. Відокремлюють органічну фазу, (метосикарбоніл)-1-метил-1Н-індол-3-іл]-3промивають водою, висушують над сульфатом оксопропанамід натрію, фільтрують та концентрують під зниженим Потік газоподібного диметиламіну пропускатиском. Залишок очищають хроматографією на ють у суміш 13г (44,4ммол) метил 3-[6-флуор-2колонці із силікагелем (елюент: циклогек(метосикарбоніл)-1-метил-1Н-індол-3-іл]-3-оксосан/етилацетат: 90/10-80/20). Отримують тверду пропаноату, одержаного на етапі 1.2, та 0,2г жовту речовину, яку розпорошують у гептані та (1,63ммол) 4-(N,N-диметил)амінопіридину у 80мл потім в ізопро-піловому етері. Одержують 2,84г толуолу. Негайно приладжують конденсатор, увін(8,4мол) твердої кремового кольору сполуки. чаний балонною колбою, і розчин перемішують 2.2 3-[6-хлор-2-(метосикарбоніл)-1-метил-1Нпри 100°С 20год. Суміш охолоджують до навколиіндол-3-іл]-N,N-диметил-3-оксопропанамід шньої температури та концентрують під зниженим Потік газоподібного диметиламіну пропускатиском. Добавляють 200мл дихлорметану, воду та ють у суміш 15г (44,4ммол) етил 3-[6-хлор-2гідрохлоридну кислоту (1Н). Органічну фазу відо(метосикарбоніл)-1-метил-1Н-індол-3-іл]-3-оксокремлюють, промивають водою, висушують над пропаноату, одержаного на етапі 2.1, та 0,2г сульфатом натрію, фільтрують та концентрують (1,63ммол) 4-(N,N-диметил) амінопирідину у 100мл під зниженим тиском. Залишок очищають хроматотолуолу. Негайно приладжують конденсатор, увінграфією на колонці із силікагелем(елюент: циклочаний балонною колбою, і розчин перемішують гексан/дихлрометан: 50/50, потім - дихлормепри 100°С під зниженим тиском 20год. Суміш охотан/етилацетат 100/0 до 0/100). Виділяють 4,6г лоджують до навколишньої температури та конце(14ммол) жовтої твердої речовини, яку використонтрують під зниженим тиском і залишок хроматогвують, як вона є, у залишку синтезів. рафують на колонці із силікагелем (елюент: 1.4 7-флуор-N,N,5-триметил-4-оксо-3-(пирід-2циклогексан/дихлрометан: 50/50, потім дихлормеил)-3,5-дипдро-4Н-піридазин[4,5-b]індол-1тан/етилацетат: 100/0 до 0/100). Отримують 3,8г ацетамід твердого жовтого препарату, який перекристалізоРозчин 1,4г (4,1ммол) N,N-диметил-3-[6вують із суміші дихлорметан/етилацетат. Виділяфлуор-2-(метосикарбоніл)-1-метил-1Н-індол-3-іл]ють 1,8г (5,3ммол) твердої жовто-білої речовини. 3-оксх)пропанаміду, одержаного на етапі 1.3, у 2.3 7-хлор-N,N,5-триметил-4-оксо-3,5-дигідро40мл абсолютного етанолу нагрівають під зворот4Н-піридазин[4,5-b]індол-1-ацетамід ним холодильником 22год. з кількома краплинами Розчин 1,7г (5,2ммол) 3-[6-хлор-2льодяної оцтової кислоти та 1,4г (12,8ммол) 2(метосикарбонт)-1-метил-1Н-індол-3-іл]-N,Nпіридилгідразину. диметил-3-оксопропанаміду, одержаного на етапі Суміш охолоджують та концентрують під зни2.2, у 150мл толуолу нагрівають при 90°С 24год. у женим тиском. Добавляють воду та 200мл дихлоприсутності 1,8мл (36,8ммол) моногідрат гідразину рметану. Розчин гідроксиду натрію добавляють до та каталітичної кількості п-толуолсульфонової кирН>10. Органічну фаза відокремлюють, промиваслоти. Суміш охолоджують, нерозчинний продукт ють водою, висушують над сульфатом натрію, збирають фільтрацією та промивають водою і пофільтрують та концентрують під зниженим тиском. тім діізопропіловим етером та висушують під приЗалишок очищають хроматографією на колонці із веденим тиском. Виділяють 1,70г (5,2ммол) білої силікагелем у суміші розчинників (дихлорметвердої сполуки. Температура плавлення: >300°С. тан/етилацетат: від 100/0 до 0/100, потім - етила2.4 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-3цетат/метанол: від 100/0-90/10). Одержаний проіл)-3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід дукт потім хроматографують на нейтральній гідрохлорид алюмінієвій колонці у суміші розчинників (дихлор0,2г (0,63ммол) 7-хлор-N,N,5-триметил-4-оксометан/етилацетат: від 100/0 до 0/100, потім - ети3,5-дигідро-4Н-піридазин[4,5-b]індол-1-ацетамід, лацетат/метанол: від 100/0 до 90/10). Отримують одержаного на етапі 2.3, розчиняють у 15мл Nтверду речовину, яку промивають діетиловим етеметилпіролідону. При навколишній температурі та ром. Виділяють 0,25г (0,66ммол) білої твердої під атмосферою аргону вводять 0,11мл (1,4ммол) сполуки. піридину, 0,19мл (1,4ммол) триетиламіну, 1г молеТемпература плавлення: 222-223°С; М+Н+: кулярного сита, 0,24г (1,3ммол) ацетату міді та 380. 0,22г (1,4ммол) 2-(піридин-3-іл)-1,3,2Приклад 2 (Сполука 6) діоксоборинану. Після 24год. реакції нерозчинну 7-хлор-N,N,5-триметил-4-оксо-3-(піридин-3-іл)фракцію видаляють фільтрацією та розчин змішу 13 77273 14 ють з 0,11мл (1,4ммол) піридину, або 0,19мл мивають водою, потім - ізопропіловим етером та 1,4ммол) триетиламіну, 1г молекулярного сита, висушують під зниженим тиском. Виділяють 1,43г 0,24г (1,3ммол) ацетату міді та 0,22г (1,4ммол) 2(3,8ммол) білої твердої сполуки. (піридин-3-іл)-1,3,2-діоксоборинану. Подалі реакТемпература плавлення: >300°С. ційну суміш перемішують 24год. Нерозчинну фра3.3 4-метил-1-[2-[7-хлор-5-метил-4-оксо-3кцію видаляють фільтрацією й фільтрат концент(піридин-3-іл)-3,5-дигідро-4Н-піридазино[4,5рують під зниженим тиском, видаляючи розчинник. b]індол-1-іл)ацет-1-ил]піперазин гідрохлорид (1:1) Добавляють дихлорметан та воду. Водну фазу 0,45г (1,2ммол) 4-метил-1-[2-[7-хлор-5-метилекстрагують дихлорметаном. Органічні фази об'є4-оксо-3,5-дигідро-4Н-піридазин[4,5-b]індол-1днують та промивають водою. їх висушують над іл)ацет-1-ил]піперазину, одержаного на етапі 3.2, сульфатом натрію, фільтрують та концентрують розчиняють у 30мл N-метилпіролідону. При навкопід зниженим тиском. Залишок очищають хроматолишній температурі та під атмосферою аргону графією на колонці із силікагелем (елюент: дихловводять 0,2мл (2,4ммол) піридину, 0,34мл рметан, потім етилацетат/метанол: від 100/0 до (2,4ммол) триетиламіну, 0,30г молекулярного сита, 80/20). Одержану тверду речовину розчиняють у 0,44г (2,4ммол) ацетату міді та 0,39г (2,4ммол) 2суміші дихлорметан/метанол. Добавляють етила(піридин-3-іл)-1,3,2-діоксоборинану. Після 24год. цетат і суміш частково концентрують. Тверде виреакції фільтрацією видаляють нерозчинну фракділяють фільтрацією та перекристалізовують із цію та добавляють до розчину 0,2мл (2,4ммол) суміші етанолу та дихлорметану. Одержують піридину, або 0,34мл (2,4ммол) триетиламіну, 110мг білого твердого 7-хлор-N,N,5-триметил-40,30г молекулярного сита, 0,44г (2,4ммол) ацетату оксо-3-(піридин-3-іл)-3,5-дигідро-4Н-піридазин[4,5міді та 0,39г (2,4ммол) 2-(піридин-3-іл)-1,3,2b]індол-1-ацетаміду (Сполука 5). діоксоборинану. Подалі реакційну суміш переміТемпература плавлення: 255-256°С. шують 24год. Нерозчинні фракції видаляють фільГідрохлорид утворюють розчиненням виділетрацією та фільтрат концентрують під зниженим ної вище твердої речовини у суміші метанолу та тиском до видалення розчинника. Добавляють дихлорметану та добавленням 5Η розчину гідрохдихлорметан та воду. Водну фазу екстрагують лоридної кислоти у пропан-2-олі. Після перекрисдихлорметаном. Органічні фази об'єднують та талізації з етанолу виділяють 0,09г (0,20ммол) промивають водою. Їх висушують над сульфатом твердої білої сполуки. натрію та концентрують під зниженим тиском. ЗаТемпература плавлення: 250-252°С: М+Н+: лишок очищають хроматографією на колонці із 396. силікагелем (елюент: дихлорметан/метанол: від Приклад 3 (Сполука 10). 100/0 до 90/10). Отримують білу тверду речовину, 4-метил-1-[2-[7-хлор-5-метил-4-окса-3гідрохлорид якої утворюють її розчиненням у су(піридин-3-іл)-3,5-дигідро-4Н-піридазин[4,5міші пропан-2-олу з метанолом та додаванням b]індол-1-іл]ацет-1-ил]піперазин гідрохлорид (1:1) 0,1N розчину гідрохлоридної кислоти у пропан-23.1 [3-(6-хпор-2-метосикарбоніл)-1-метил-1Нолі. Після перекристалізації із суміші пропан-2-олу індол-3-іл]-3-оксопропіон-1-іл]-4-метилпіперазин та метанолу, виділяють 0,34г (0,70ммол) білої твеРозчин 2,84г (8,4ммол) етил 3-[6-хлор-2рдої сполуки. (метосикарбоніл)-1-метил-1Н-індол-3-іл]-3Температура плавлення: 287°С (розклад); оксопропаноату, одержаного на етапі 2.1 прикладу М+Н+: 451. 2, нагрівають у 160мл толуолу під зворотним хоПриклад 4 (Сполука 8). лодильником 12год. у присутності 3,7мл (34ммол) 7-хлор-Ν,Ν,5-триметил-4-оксо-3-(6-метил)-3,5N-метил піперазину та 110мг (0,9ммол) 4-(N,Nдигідро-4Н-піридазин[4,5-b]індол-1-ацетамід 0,4г диметиламіно)піридину. Суміш охолоджують до (1,25ммол) 7-хлор-N,N,5-триметил-4-оксо-3,5навколишньої температури. Добавляють 100мл дигідро-4Н-піридазин[4,5-b]індол1-ацетаміду одедихлорметану, 80мл води та 10мл 20% водного ржаного на етапі 2.3 у прикладі 2, розчиняють у аміаку. Відокремлюють органічну фазу, водну фа45мл N-метилпіролідону. При навколишній темпезу екстрагують дихлорметаном (2 рази по 100мл) ратурі та під атмосферою аргону вводять 0,2мл та об'єднують органічні фази. їх промивають во(2,5ммол) піридину, 0,35мл (2,5ммол) триетиламідою, висушують над сульфатом натрію, фільтруну, 0,40г молекулярного сита, 0,45г (2,5ммол) ацеють та концентрують під зниженим тиском та затату міді та 0,80г (3,6ммол) 4,4,5,5-тетраметил-2лишок очищають хроматографією на колонці із (6-метилпирідин-3-іл)-1,3,2-діоксоборинану. Після силікагелем (елюент: дихлорметан/метанол: 100/0 24год. протікання реакції до розчину добавляють до 90/10). Отримують 1,68г (4,3ммол) жовтого ма0,2мл (2,5ммол) піридину, 0,35мл (2,5ммол) триесла. тиламін, 0,40г молекулярного сита, 0,45г (2,5ммол) 3.2 4-метил-1-[2-[7-хлор-5-метил-4-оксо-3,5ацетату міді та 0,80г (3,6ммол) 4,4,5,5-тетраметилдигідро-4Н-піридазин[4,5-b]індол-1-іл]ацет-12-(6-метилпирідин-3-іл)-1,3,2-діоксоборинану. Реаил]піперазин кційну суміш подалі перемішують 24год. НерозРозчин 1,68г (4,3ммол) [3-[6-хлор-2чинні фракції видаляють фільтрацією та фільтрат (метосикарбоніл)-1-метил-1Н-індол-3-іл]-3концентрують під зниженим тиском, видаляючи оксопропіон-1-іл]-4-метилпіперазину, одержаного розчинник. Добавляють дихлорметан та воду. Вона етапі 3.1, нагрівають у 80мл толуолу при 90°С дну фазу екстрагують дихлорметаном. Органічні 24год. у присутності 1,7мл (35ммол) гідразин мофази об'єднують та промивають водою. Їх висуногідрату та каталітичної кількості пшують над сульфатом натрію, фільтрують та контолуолсульфонової кислоти. Суміш охолоджують і центрують під зниженим тиском. Залишок очищанерозчинну фракцію збирають фільтрацією, проють хроматографією на колонці із силікагелем 15 77273 16 (елюент: дихлорметан/метанол: від 100/0 до тивність: 70-90Кі/ммол; New England Nuclear) при 80/20). Отримують тверду речовину, яку перекрисконцентрації 0,5нм інкубують у присутності 100мкл талізовують із суміші ізопропанол/метанол. Видігомогенату мембрани у кінцевий об'єм 1мл буфеляють 0,12г (0,29ммол) білої твердої сполуки. ра, що містить тестовану сполуку. Після інкубації Температура плавлення: 253-255°С; М+Н+: при 0°С на 3год. мембрани регенерують фільтра410. цією на фільтрах Whatman GF/B, промивають 2 Таблиця нижче ілюструє хімічні структури та рази 4,5 мл холодного (0°С) інкубаційного буфера. фізичні властивості деяких сполук винаходу. У Розмір радіоактивності, одержаної від фільтра, колонці "Сіль" цієї таблиці "НСІ" представляє гідвизначають рідинною сцинтиграфією. Для кожної рохлорид, "-" представляє сполуку у вигляді осноконцентрації досліджуваної сполуки визначають ви. Молярні співвідношення кислота:основа покапроцент інгібування зв'язування [3Н]Ro5-4864, а зані оберненими. Абревіатура розкл. означає, що потім концентрацію IK50, концентрацію, яка інгібує при даній температурі тверда речовина розкладаспецифічне зв'язування на 50%. Показники ІК5о ється. найкращих сполук винаходу знаходяться у межах від 1нм до 200нм. Таким чином сполуки винаходу є лігандами з афінністю до рецепторів периферійного бензодіазепину. Дослідження нейротропної активності. Тестування виживання мотонейронів після розрізу лицевого нерва у пацюків віком 4 доби. Після ураження лицевого нерва у недорозвинених пацюків мотонейрони лицевих ядер гинуть внаслідок апоптозу. Виживання нейронів визначали шляхом гістологічних і нейрональних розрахунків. Недорозвинених 4 денних пацюків анестезують пентобарбі-талом (3мг/кг інтраперитонально). Правий лицевий нерв відокремлюють і розрізають при його виході із шилососцевидного отвору. Після пробудження молодих пацюків повертають до матері і лікують 7 діб одною або двома дозами від 1 до 10 на добу мг/кг перорально, або інтраперитонально дозами від 1 до 10мг/кг. Через 7 днів після ушкодження, тварин декапітують та головний мозок заморожують в ізопентані при -40°С. Лицеві ядра ріжуть у кріостаті на секції по 10мкм. Мотонейрони фарбують крезил фіолетовим та рахують, використовуючи Histo з програмним забезпеченням (Віосоm). У цій моделі сполуки винаходу підвищують виживання нейронів приблизно від 10 до 30%. Результати тестувань показують що сполуки Сполуки винаходу складають предмет фармавинаходу сприяють регенерації нерву. кологічних тестів, сполуки демонструють свою Тому сполуки згідно з винаходом можна викоперевагу як субстанції з терапевтичною активнісристати для отримання медичних продуктів. тю. Сполуки винаходу також демонструють харакТаким чином, згідно з іншими його аспектами, теристики розчинності у воді, які сприяють ефеквинахід охоплює медичні продукти, які містять тивній активності in vivo. сполуку формули (І) або фармацевтично прийнятДослідження зв'язування [3H1Ro5-4864 з пену кислотно-адитивну сіль або інакше гідрат або риферійними бензодіазепіновими рецепторами сольват сполуки формули (І). (PBR або р-ділянками). Ці медичні продукти знаходять застосування у Визначено афінність сполук винаходу стосовтерапії, особливо для попередження та/або лікуно PBR або р-ділянок (ділянки зв'язування перивання таких периферійних невропатій різних типів, ферійного типу на бензодиіазепінах). Р-ділянки як травматичні або ішемічні невропатії, інфекційні, рецепторів мембран можна селективно мітити та алкогольні, лікарняні або генетичні невропатії, та інкубувати у присутності [3H]Ro5-4864. Сполуки такі стани моторних нейронів, як спінальні аміотвинаходу складають предмет дослідження in vitro рофії та бічний аміотрофічний склероз. Ці медичні відносно їх афінності до цих рецепторів. продукти можуть також знайти застосування у ліВикористовують самців пацюків Spragueкуванні нейродегенеративних хвороб центральної Dawley (Iffa Credo) вагою 180-300мг. Після декапінервової системи, гострого типу, як-то церебральтації видаляють нирку і тканину гомогенізують при ні судинні травми та черепні та медулярні травми, 4°С, використовуючи гомогенізатор Polytron, . або хронічного типу, як-то автоімунні хвороби 2хвил при 6/10 максимальної швидкості у 35 об'є(розсіяний склероз), хвороба Альцгеймера, хворомах 50мМ NaH2PO4 - фосфатного буферу при рН, ба Паркінсона та деякі інші хвороби, в яких застощо відрегульовано NaH2PO4 до 7,5. Гомогенат сування нейротропних факторів, як передбачають, мембран фільтрують через сітку та розбавляють матиме терапевтичний ефект. 3 буфером у 10 разів. [ H]Ro5-4864 (специфічна акСполуки винаходу також можна використати у 17 77273 18 лікуванні гострої або хронічної ниркової недостатвикористати у таких розладах шкіри, як наприклад, ності, гломерулонефриту, діабетичної нефропатії, псоріаз, пруригінозні хвороби, герпес, фотодермаішемії серця та серцевої недостатності, інфаркту тоз, атонічний дерматит, контактний дерматит, міокарду, ішемії нижніх кінцівок, спазму коронарлишаї, свербіж, укуси комах, у фіброзах та інших них судин, стенокардії, патологій, пов'язаніих з колагенових гнійних розладах, у імунологічних клапанами серця, запалювальних хвороб серця, розладах або інакше - у таких дерматологічних побічних ефектів, обумовлених кардіотоксичними станах, як екзема, Сполуки винаходу також можна медікаментами, або наслідків серцевої хірургії, використати для запобігання та лікування хронічатеросклерозів та тромбоемболічних ускладнень, них запалень, особливо ревматоїдних артритів. рестенозів, відторгнення трансплантату або неВідповідно іншим своїм аспектам винахід охоздужань, пов'язаних з некоректною проліферацією плює фармацевтичні композиції, які містять, як або некоректною міграцією клітин гладеньких м'яактивну складову, принаймні одну сполуку загальзів. ної формули (І). Ці фармацевтичні композиції місКрім того, останні дані у літературі показують, тять ефективну дозу принаймні однієї сполуки вищо периферійний бензодіазепіновий рецептор находу у вигляді основи, фармацевтична може грати головну роль у регуляції проліферації прийнятної солі, сольвату або гідрату та, як варіклітини та процесах злоякісного переродження. ант, у комбінації з принаймні одним, фармацевтиВзагалі та у порівнянні з нормальною тканиною, чна прийнятним наповнювачем. Названі наповнюпідвищену концентрацію периферійних бензодіавачі підбирають відповідно до фармацевтичної зепинових рецепторів спостерігають у різних типах форми бажаного способу застосування серед звипухлин та раку. чних наповнювачів, які відомі фахівцям. В астроцитомах людини ступінь експресії пеУ фармацевтичних композиціях винаходу для риферійних бензодіазепинових рецепторів кореперорального, під'язичного, підшкірного, внутрішлює зі ступенем злоякісності пухлини, проліфераньом'язового, внутрішньовенного, місцевого, локаційним індексом та виживаністю пацієнтів. У льного, інтратрахеального, інтраназального, транцеребральних пухлинах людини підвищення чисесдермального, внутрішньоочного або ректального льності периферійних бензодіазепинових рецепзастосування наведену вище активну складову торів використане як діагностична індикація у мезагальної формули (І), або її сіль, сольват або гіддичному відображенні та як терапевтична мішень рат - за відповідністю, можуть застосувати тварини для кон'югатів, утворених з ліганду периферійного та люди для профілактики або лікування наведебензодіазепинового рецептору та цитостатичних них вище розладів та хвороб у вигляді суміші з ліків. Високу концентрацію периферійних бензодіпринаймні одним стандартним фармацевтичним азепинових рецепторів також спостерігають в ованаповнювачем. ріанальних карциномах та при раку молочної заЛіки для застосування можуть бути, наприлози. Щодо останнього, то показано, що ступінь клад, у вигляді таблеток, желатинових капсул, експресії периферійних бензодіазепинових рецепгранул, порошків, пероральних або ін'єкційних роторів стосується агресивного потенціалу пухлини; зчинів або суспензій, трансдермальних пластирів, більше того, присутність агоністу периферійного форм для сублінгвального, внутришньоротового, бензодіазепинового рецептора стимулює ріст лінії інтратрахеального, внутрішньоочного, інтраназараку молочної залози. льного застосування або інгаляційного, місцевого, Сукупність цих результатів, які допускають трансдермального, підшкірного, внутріщньом'язошкідливу функцію периферійних бензодіазепинового внутрішньовенного, ректального застосуванвих рецепторів у процесі злоякісного переродження, або імплантатів. Для місцевого застосування ня, складають відповідну основу для пошуку синможна розглядати креми, гелі, мазі, лосьйони або тетичних лігандів, специфічних до периферійних примочки для очей. Ці фармацевтичні форми одебензодіазепинових рецепторів, які здатні до блоржують способами, що є звичними у рамках прокування їх дії. От же сполуки можна використати блеми. для лікування пухлин та раку. Периферичні бензоНазвані окремі форми є дозовані таким чином, діазепинові рецептори також присутні у шкірі та у щоб забезпечити добове застосування від 0,001 цьому аспекті сполуки, які можна використати згіддо 20мг активної складової на кг ваги тіла, залежно з винаходом, можна також використати для но від фармацевтичної форми. Можуть бути спепрофілактики або лікування стресів шкіри. цифічні випадки, в яких відповідними є вищі чи Під стресами шкіри розуміють різні ситуації, які нижчі дози; таке дозування не є поза рамками виздатні викликати пошкодження, особливо епідернаходу. У відповідності із загальною практикою, ми, незалежно від факторів, що викликають стрес. дозування, прийнятне для кожного пацієнта, виЦей фактор може бути внутрішнім та/або зовнішзначає лікар-клініцист згідно зі способом застосунім відносно тіла, як-то хімічний або вільновання, вагою та реакцією пацієнта. радикальний фактор, або інший зовнішній, як-то Представлений винахід згідно з іншими його ультрафіолетове опромінювання. аспектами також охоплює спосіб лікування навеТаким чином, сполуки, які можна використати дених вище патологій, який містить, згідно з виназгідно з винаходом, призначені для запобігання та ходом, призначення пацієнту ефективних доз спозахисту подразнення шкіри, сухих бляшок, еритем, луки або одної з його фармацевтично прийнятних втрати відчуття, відчуття жару, свербежу шкіри солей або гідратів або сольватів. та/або слизових, або старіння, та їх також можна 19 Комп’ютерна верстка О. Гапоненко 77273 Підписне 20 Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською3-heteroaryl-3,5-dihydro-4oxo-4h-pyridazino[4,5-b]indol-1-acetamide derivatives, their production and therapeutic use
Автори англійськоюMarabout Benoit, Puche Frederic
Назва патенту російськоюПроизводные от 3-гетероарил-3,5-дигидро-4-оксо-4н-пиридазино[4,5-b]индол-1-ацетамиду, их получение и применение в терапии
Автори російськоюМАРАБУ Бенуа, Пюш Фредерик
МПК / Мітки
МПК: A61P 9/04, C07D 209/42, A61P 17/00, A61P 13/12, A61P 35/00, A61P 3/10, C07D 487/04, A61P 9/00, A61P 9/08, A61P 29/00, A61P 17/04, A61P 37/02, A61K 31/5025, A61P 17/06, A61P 9/10, A61P 25/00
Мітки: одержання, терапії, 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-ацетаміду, похідні, застосування
Код посилання
<a href="https://ua.patents.su/10-77273-pokhidni-3-geteroaril-35-digidro-4-okso-4n-piridazino45-bindol-1-acetamidu-kh-oderzhannya-ta-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні 3-гетероарил-3,5-дигідро-4-оксо-4н-піридазино[4,5-b]індол-1-ацетаміду, їх одержання та застосування у терапії</a>












