Похідні n-гетероциклілметилбензамідів, їх отримання і їх застосування в терапії
Номер патенту: 81186
Опубліковано: 10.12.2007
Автори: Даргазанлі Жіад, Мага Паскаль, МАРАБУ Бенуа, Рожер П'єр, Естенн-Буту Женев'єв
Формула / Реферат
1. Сполука загальної формули (І)
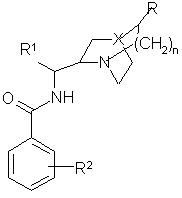 ,(I)
,(I)
в якій
R означає атом водню або вінільну групу;
n означає 0 або 1 або 2, якщо R означає атом водню і n означає 1, якщо R означає вінільну групу;
X означає групу формули СН або атом азоту, якщо R означає атом водню, і X означає групу формули СН, якщо R означає вінільну групу;
R1 означає або фенільну, або нафтильну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену, груп (С1-С6)-алкільної, гідрокси і (С1-С6)-алкоксильної, лінійних або розгалужених, трифторметильної групи або циклогексильної групи, або гетероарильної групи, вибраної з тієнілу, піридинілу, оксазолілу, фуранілу, тіазолілу, хінолеїнілу і ізохінолеїнілу;
R2 означає або атом водню, або один або декілька замісників, вибраних з атомів галогену і груп трифторметильної, (С1-С6)-алкільної, (С1-С6)-алкоксильної, тієнільної, фенілокси, гідрокси, меркапто, тіо(С1-С6)-алкільної, ціано або групи загальної формули -NR4R5, SO2NR4R5, -SO2-(С1-С6)-алкіл, -SО2-феніл, -CONR4R5, -COOR7, -СО-(С1-С6)-алкіл, -CO-феніл, -NHCOR8, -NHSО2-(С1-С6)-алкіл, -NHSО2-феніл і -NHSO2NR4R5, або групи формули OCF2O-, зв'язаної з положеннями 2 і 3 фенільної групи;
причому групи (С1-С6)-алкільна, (С1-С6)-алкоксильна, -SO2-(С1-С6)-алкільна, -СО-(С1-С6)-алкільна і -NНSО2-(С1-С6)-алкільна можливо заміщені однією або декількома групами R3;
групи фенільна, -SО2-фенільна, -СО-фенільна і -NHSО2-фенільна можливо заміщені групою R6;
R3 означає атом галогену, групу фенільну, (С1-С6)-алкоксильну, -NR4R5;
R4 і R5 незалежно один від одного означають атом водню або (С1-С6)-алкільну групу, або R4 і R5 утворюють з атомом азоту, з яким вони зв'язані, піролідиновий цикл, піперидиновий цикл або морфоліновий цикл;
R6 означає атом водню, атом галогену, трифторметильну групу, групу ціано, гідрокси, меркапто, групу (С1-С6)-алкільну або (С1-С6)-алкоксильну,
R7 означає атом водню або (С1-С6)-алкільну групу, можливо заміщену однією або декількома групами R3, або фенільну групу, можливо заміщену групою R6;
R8 означає (С1-С6)-алкільну групу, можливо заміщену однією або декількома групами R3, або (С1-С6)-алкоксильну групу, або фенільну групу, можливо заміщену групою R6,
у вигляді вільної основи або солі приєднання з кислотою, гідрату або сольвату.
2. Сполука за п. 1, яка відрізняється тим, що вона має конфігурацію трео.
3. Сполука за будь-яким з пп. 1 і 2, яка відрізняється тим, що n означає 0 або 1.
4. Сполука за п. 3, яка відрізняється тим, що X означає групу формули СН.
5. Сполука за п. 4, яка відрізняється тим, що R означає атом водню.
6. Сполука за п. 5, яка відрізняється тим, що n означає 1.
7. Сполука за п. 5, яка відрізняється тим, що R1 означає можливо заміщену фенільну групу.
8. Лікарський засіб, який відрізняється тим, що він містить сполуку за будь-яким з пп. 1-7.
9. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку за будь-яким з пп. 1-7, а також щонайменше один фармацевтично прийнятний ексципієнт.
10. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для отримання лікарського засобу, призначеного для лікування порушень поведінки, пов'язаних з деменцією, психозів, різних форм тривожних станів, панічних атак, фобій, обсесивно-компульсивних розладів, різних форм депресії, порушень, пов'язаних зі зловживанням алкоголем або алкогольною залежністю, розладів статевої поведінки, порушень харчування, і для лікування мігрені.
11. Застосування сполуки формули (І) за будь-яким з пп. 1-7 для отримання лікарського засобу, призначеного для лікування судом, болю, хвороби Паркінсона і симптомів Паркінсона, епілепсії, змішаних форм і інших епілептичних симптомів, в поєднанні з іншим протиепілептичним лікуванням або в монотерапії, апное уві сні і для нейрозахисту.
Текст
1. Сполука загальної формули (І) 2 (19) 1 3 81186 4 6. Сполука за п. 5, яка відрізняється тим, форм тривожних станів, панічних атак, фобій, що n означає 1. обсесивно-компульсивних розладів, різних форм 7. Сполука за п. 5, яка відрізняється тим, депресії, порушень, пов'язаних зі зловживанням що R1 означає можливо заміщену фенільну групу. алкоголем або алкогольною залежністю, розладів 8. Лікарський засіб, який відрізняється статевої поведінки, порушень харчування, і для тим, що він містить сполуку за будь-яким з пп. 1-7. лікування мігрені. 9. Фармацевтична композиція, яка 11. Застосування сполуки формули (І) за відрізняється тим, що вона містить сполуку за будь-яким з пп. 1-7 для отримання лікарського будь-яким з пп. 1-7, а також щонайменше один засобу, призначеного для лікування судом, болю, фармацевтично прийнятний ексципієнт. хвороби Паркінсона і симптомів Паркінсона, 10. Застосування сполуки формули (І) за епілепсії, змішаних форм і інших епілептичних будь-яким з пп. 1-7 для отримання лікарського симптомів, в поєднанні з іншим протиепілептичним засобу, призначеного для лікування порушень лікуванням або в монотерапії, апное уві сні і для поведінки, пов'язаних з деменцією, психозів, різних нейрозахисту. Об'єктом даного винаходу є похідні Nгетероциклилметилбензамідів, їх отримання і їх застосування в терапії. Сполуки згідно з винаходом відповідають загальній формулі (І) в якій R означає атом водню або вінільну групу; n означає 0 або 1 або 2, якщо R означає атом водню і n означає 1, якщо R означає вінільну групу; X означає групу формули СН або атом азоту, якщо R означає атом водню, і X означає групу формули СН, якщо R означає вінільну групу; R1 означає або фенільну або нафтильну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену, груп (С1-С6)-алкільної, гідрокси і (С1-С6)-алкоксильної, прямих або розгалужених, трифторметильної групи, або циклогексильну групу, або гетероарильну групу, вибрану з груп тієнілу, піридинілу, оксазолілу, фуранілу, тіазолілу, хінолеїнілу і ізохінолеїнілу; R2 означає або атом водню, або один або декілька замісників, вибраних з атомів галогену і груп трифторметильної, (С1-С6)-алкільної, (С1-С6)алкоксильної, тієнільної, фенілокси, гідрокси, меркапто, тіо(С1-С6)-алкільної, ціано або групи загальної формули -NR4R5, SO2NR4R5, -SО2-(С1С6)-алкіл, -SО2-феніл, -CONR4R5, -COOR7, -СО(С1-С6)-алкіл, -СО-феніл, -NHCOR8, -NHSО2-(С1С6)-алкіл, -NHSО2-феніл і -NHSO2NR4R5 або групи формули OCF2O-, пов'язаної з положеннями 2 і 3 фенільної групи; причому групи (С1-С6)-алкільна, (С1-С6)алкоксильна, -SО2-(С1-С6)-алкільна, -СО-(С1-С6) алкільна і -NНSО2-(С1-С6)-алкільна можливо заміщені однією або декількома групами R3; групи фенільна, -SО2-фенільна, -СО-фенільна і -NHSО2-фенільна можливо заміщені групою R6; R3 означає атом галогену, гру ну фенільну, (С1-С6)-алкоксильну, -NR4R5; R4 і R5 незалежно один від одного означають атом водню або (С1-С6)-алкільну групу або R4 і R5 утворюють з атомом азоту, з яким вони пов'язані, піролідиновий цикл, піперидиновий цикл або морфоліновий цикл; R6 означає атом водню, атом галогену, трифторметильну групу, групу ціано, гідрокси, меркапто, (С1-С6)-алкільну або (С1-С6)алкоксильну, R7 означає атом водню або (С1-С6)-алкільну групу, можливо заміщену однією або декількома групами R3, або фенільну групу, можливо заміщену групою R6; R8 означає (С1-С6)-алкільну групу, можливо заміщену однією або декількома групами R3, або (С1-С6)-алкоксильну групу, або фенільну групу, можливо заміщену групою R6. Із сполук загальної формули (І) виділяють ряд підгруп переважних сполук: Група 1: сполуки конфігурації трео і загальної формули (І), в якій n означає 0 або 1і; Група 2: сполуки групи 1, в формулі яких X означає групу формули СН; Група 3: сполуки групи 2, в формулі яких R означає атом водню; Група 4: сполуки групи 3, в формулі яких n означає 1; Група 5: сполуки групи 4, в формулі яких R1 означає можливо заміщену фенільну групу. Сполуки формули (І) можуть містити декілька асиметричних центрів. Таким чином вони можуть мати форму енантіомерів або діастереоізомерів. Ці енантіомери, діастереоізомери, а також їх суміші, включаючи рацемічні суміші, відносяться до винаходу. Більш конкретно сполуки формули (І), в яких R=H, можуть мати форму діастереоізомерів трео ((1S, 2S) і (1R, 2R)) або еритро ((1S, 2S) і (1R, 2R)) або чистих енантіомерів або суміші таких ізомерів. Сполуки формули (І) можуть бути у вигляді основ або солей приєднання з кислотами. Такі солі приєднання з кислотами відносяться до винаходу. 5 81186 6 Ці солі переважно отримують з використанням Діастереоізомери трео і еритро можна фармацевтично прийнятних кислот, але солі інших розділити відомими фахівцеві методами, такими кислот, що використовуються, наприклад, для як хроматографія на колонці з силікагелем. очищення або отримання сполук формули (І), Інший варіант отримання діамінів загальної також відносяться до винаходу. Сполуки формули формули (II), в якій R і R1 ті ж, які визначені вище, (І) можуть також бути у вигляді гідратів або n дорівнює 1 і X означає СН, показаний на сольватів, а саме у вигляді асоціацій або наступній схемі 3. комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також відносяться до винаходу. Сполуки згідно з винаходом володіють особливою активністю як специфічні інгібітори переносників гліцину glyt1 і/або glyt2. Сполуки формули (І) можна отримати способом, показаним на наступній схемі 1. Згідно з схемою 1 приводять у взаємодію діамін загальної формули (II), в якій n, X, R і R1 ті ж, які визначені вище, і активовану кислоту або хлорид кислоти загальної формули (III), в якій Υ означає групу nucleofuge, таку як атом галогену, і R2 той же, який визначений вище, застосовуючи методи, відомі фахівцеві. Діаміни загальної формули (II), в якій R=H і n, Χ і R1 ті ж, які визначені вище, можна отримати способом, показаним на наступній схемі 2. Приводять у взаємодію кетон загальної формули (IV), в якій n, Χ і R1 ті ж, які визначені вище, і бензилоксигідроксиламінхлоргідрат при температурі кипіння піридину із зворотним холодильником і отримують оксим загальної формули (IV). Обидві форми Ζ і Ε оксиму можна розділити відомими фахівцеві методами, такими як хроматографія на колонці з силікагелем. Оксим (V) переважно в формі Ζ хлоргідрату потім відновлюють при температурі кип'ятіння тетрагідрофурану із зворотним холодильником за допомогою подвійного гідриду алюмінію і літію для отримання діаміну загальної формули (II), головним чином трео. Шляхом відновлення форми Ε оксиму загальної формули (V) отримують суміш діаміну (II) в формі двох діастереоізомерів (трео/еритро). Спирти загальної формули (VI) перетворюють в аміни реакцією Mitsunobu по методу, описаному в [Bull. Soc. Chim. Belg. (106), 1997, 77-84 і в Tetrahedron: Asymmetry, (6), 1995, 1699-1702]. Крім того хиральні сполуки загальної формули (І), відповідні енантіомерам (1R, 2R) або (1S, 2S) діастереоізомера трео і енантіомерам (1R, 2R) або (1S, 2S) діастереоізомера еритро можна також отримати або розділенням рацемічних сполук високоефективною рідинною хроматографією (ВЕРХ) на хиральній колонці, або з хирального аміну, отриманого або розщепленням рацемічного аміну загальної формули (II) з використанням хиральної кислоти, такої як винна кислота, камфоросірчана кислота, дибензоїлвинна кислота, N-ацетиллейцина, шляхом фракційної перекристалізації і переважно солі діастереоізомера в розчині типу спирту, або енантіоселективним синтезом з хирального еритро або трео-спирту з використанням способу, аналогічного представленому на схемі 3. Хиральні спирти можна отримати способом, аналогічним описаному в [Tetrahedron (55), 1999, 2795-2810)]. У випадку, якщо R означає вінільну групу і R1 означає хінолеїнільну групу, діамін загальної формули (II) можна отримати по схемі 3, використовуючи відповідні комерційні хиральні спирти. Рацемічний кетон загальної формули (IV) можна отримати або депротонуванням активованого комплексу циклічних сполучених містечковим зв'язком амінів і взаємодією з електрофілом, таким як складний ефір або амід Вайнреба по методу, аналогічному описаному в [Chem.]Commun., 1999, 1927-1928], або взаємодією органометалічної сполуки зі складним етиловим ефіром 2-хінуклединової кислоти по методу, аналогічному описаному в [J. Med. Chem., 1980, 180-184], або окисленням відповідного спирту, отриманого різними способами, аналогічними описаним в [J. Org. Chem., 50, 1985, 29-31 і Chem. Comm., 1999, 1927-1929], оксидантами, відомими фахівцеві, такими як діоксид магнію або система оксалілхлориддиметилсульфоксид. Спирти загальної формули (VI) можна також отримати відновленням відповідних кетонів 7 81186 8 загальної формули (IV) в умовах, відомих описаних в [Tetrahedron Lett., (2000), 41, 3157фахівцеві. 3160]. Кислоти і хлориди загальної формули (III) є Нарешті, ціано-похідні бензойних кислот типу комерційно доступними або їх отримують біфенілу отримують шляхом нагрівання кислоти способами, аналогічними тим, які відомі фахівцеві. або галогенованого складного бензойного ефіру в Наприклад, 4-аміно-3-хлор-5присутності ціаніду калію, каталізатора типу трифторметилобензойну кислоту можна отримати паліадютетракістрифенілфосфіну в розчиннику хлоруванням 4-аміно-5-трифторметилобензойної типу тетрагідрофурану способом, аналогічним кислоти з сульфурилхлоридом в хлорованому описаному в [J. Org. Chem. (1967) 62, 25, 8634розчині, такому як хлороформ, способом, 8639]. аналогічним описаному в [Arzeim. Forsch., 34, 11а, Інші кислоти і хлориди кислот загальної (1984), 1668-1679]. формули (III) можна отримати способами, 2,6-дихлор-3-трифторметилобензойну кислоту аналогічними описаним в [патентах ЕР-0556672, можна отримати способами, аналогічними US-3801636 і в J. Chem. Soc, (1927), 25, Chem. описаним в [US 3823134]. Pharm. Bull, (1992), 1789-1792, Aust. J. Chem., Бензойні кислоти, що є похідними (1984), 1938-1950 і J.O.C., (1980), 527]. сулфонамідів, можна отримати способами, Нижченаведені приклади ілюструють аналогічними описаним в [патентах DE-2436263, отримання декількох сполук згідно з винаходом. ВЕ-620741, DE-1158957, US-3112337, GB-915259, Елементарні мікроаналізи і спектри I.R. і ЯМР і US-3203987, DE-642758, ЕР-68700, FR-2396757, ВЕРХ на хиральній колонці підтверджують DE-2734270 і в J. Pharm. Pharmacol. (1962), 14, енантіомерні структури і чистоту отриманих 679-685]. сполук. Метахлорсульфонові кислоти можна отримати Номери, вказані в дужках в назвах прикладів способом, аналогічним описаним в [J. Chem. відповідають номерам, вказаним в першій колонці Soc.(3), (1968), 13, і в патентах US-2273444, DEтаблиці, наведеній далі. 19929076, ЕР-0556674]. У назвах сполук дефіс "-" є частиною слова, а Хлорсульфонілування в положенні орто або дефіс "_" служить для скорочення в кінці строчки, пара можна провести, виходячи з солі діазонію, якщо скорочення немає, його не треба замінювати способом, аналогічним описаному в [патенті USні звичайним дефісом, ні пропуском. 3663615] з використанням 4-аміно-3Приклад 1 (Сполука №3) хлорбензойної кислоти. Трео-2-хлор-N-[(1-азабіцикло[2.2.2]окт-2Сульфонаміди отримують взаємодією іл)фенілметил]-3хлорсульфонових похідних в присутності трифторметилбензамідхлоргідрат 1:1. надлишку аміну в розчиннику, такому як 1.1. (Z)-1-азабіцикло[2.2.2]окт-2тетрагідрофуран, при кімнатній температурі або іл(феніл)метанон 0-бензилоксимхлоргідрат. при температурі кип'ятіння із зворотним У колбу об'ємом 100мл, забезпечену холодильником. магнітною мішалкою вводять 2,2г (9,35ммоль) 1Вторинні сульфонаміди можна метилувати азабіцикло[2.2.2]окт-2-іл(феніл)метанону [Chem. способом, аналогічним описаному в [патенті ВЕCommun., 1999, 1927-1928] і 3г (18,69ммоль) 620741]. бензилоксигідроксиламінхлоргідрату в 50мл Первинні сульфонаміди можна приводити у піридину і нагрівають суміш із зворотним взаємодію з ізоціанатом в розчині, такому як холодильником протягом 20 годин. тетрагідрофуран в присутності такої основи, як Після випаровування розчинників при карбонат калію. зниженому тиску залишок розбавляють водою і Деякі сульфоксидні похідні бензойних кислот хлороформом, відділяють водну фазу і описані в [патентах DE-2056912, DE-2901170 і DEекстрагують хлороформом. Промивають об'єднані 3953476] або їх можна отримати способами, органічні фази, сушать на сульфаті натрію і аналогічними описаним в [патенті ВЕ-872585 і в J. випаровують розчинник при зниженому тиску, Org. Chem. (1991), 56(1), 4976-4977]. потім залишок очищають хроматографією на Похідні бензойних кислот загальної формули колонці з силікагелем, елююючи сумішшю (III), в якій R2 означає алкільну розгалужену групу хлороформу і метанолу. можна отримати способами, аналогічними Отримують 0,5г фракції, відповідної (Е)-1описаним в [патенті US-4879426 Syn. Lett.(1996), азабіцикло[2.2.2]окт-2-іл(феніл)метанон 0473-474 і J. Med. Chem.(2001), 44, 1085-1098]. бензилоксиму і 2,25г іншої фракції, відповідна (Z)Похідні бензойних кислот бифенільного типу 1-азабіцикло[2.2.2]окт-2-іл(феніл)метанон 0можна отримати способами, відомими фахівцеві. бензилоксимхлоргідрату Нарешті, карбоніловані бензойні кислоти Точка плавлення 195-197°С. можна синтезувати способами, аналогічними 1.2. Трео-[1-азабіцикло[2.2.2.]окт-2описаним в [патентах US-3725417 і GB-913100 і в іл(феніл)метил]амін. Chem. Pharm.Bull., (1988), 36(9), 3462-3467 і J. У трьохгорлу колбу, об'ємом 250мл, Labelled Comp. Radiopharm., (1997), 39(6), 501забезпечену магнітною мішалкою, в атмосфері 508]. азоту вводять 1,3г (34,32ммоля) подвійного Складні ефіри або аміди можна вводити гідриду алюмінію і літію, суспендованого в 10мл шляхом прямого карбонілювання сильною тетрагідрофурану, додають порціями 2,2г основою в пара-положення кислоти в умовах, (6,16ммоль) (Z)-1-азабіцикло[2.2.2]окт-2іл(феніл)метанон 0-бензилоксимхлоргідрату і 9 81186 10 нагрівають із зворотним холодильником протягом хроматографією на колонці з силікагелем, 2 годин. елююючи сумішшю хлороформу і метанолу. Після охолоджування розчин піддають Отримують 0,37г маслянистого продукту. гідролізу при 0°С, використовуючи послідовно Останній розчиняють в декількох мл пропан-21,3мл води, потім 1,3мл 15%-ного водного розчину олу, додають 20мл розчину 0,1Η-соляної кислоти в гідроксиду натрію і 3,9мл води. Фільтрують пропан-2-олі і концентрують суміш при зниженому тиску для зменшення об'єму розчинника. Після гетерогенну суміш на целітеÒ концентрують подрібнення отримують 0,35г хлоргідрату у вигляді фільтрат при зниженому тиску, потім залишок твердої речовини. розбавляють 1Н-сірчаною кислотою і Точка плавлення: 270-273°С. хлороформом. Відділяють органічну фазу і водну Приклад 3 (Сполука №14) фазу підлуговують аміаком. Двічі екстрагують 2-хлор-N-(8a,9S-цинхонан-9-іл)-3хлороформом. Об'єднані органічні фази промивають, сушать на сульфаті натрію і трифторметилбензамидхлоргідрат2:1 випаровують розчинник при зниженому тиску і 3.1. 8a,9S-цинхонан-9-амін отримують 1,25г трео-[1-азабіцикло[2.2.2.]окт-2У трьохгорлу колбу об'ємом 100мл, іл(феніл)метил]аміну у вигляді масла, яке забезпечену магнітною мішалкою, в атмосфері кристалізується і яке використовують як таке на азоту вводять 0,74г (2,5ммоль) 8a,9S-цинхонан-9наступній стадії. олу (цинхонідин) і 0,79г (3ммоля) Точка плавлення: 120-140°С. трифенілфосфіну, суспендованого в 15мл 1.3. Трео-2-хлор-N-[(1-азабіцикло[2.2.2]окт-2тетрагідрофурану, і додають 3,5мл розчину 0,9Μ іл)фенілметил]-3-трифторметилкислоти hydrazoique в бензолі (3ммоля). У цей бензамидхлоргідрат 1:1 розчин вводять по краплях розчин 0,55мл У колбу об'ємом 100мл, забезпечену (2,75ммоль) діізопропілкарбодіїміду в 1,5мл магнітною мішалкою, вводять 0,51г (2,12ммоль) тетрагідрофурану і нагрівають до 40°С протягом хлориду 2-хлор-3-трифторметилбензойної кислоти 16 годин. в розчині в 5мл хлороформу в присутності 0,29г Додають 0,65г (2,5ммоль) трифенілфосфіну і (2,12ммоль) карбонату калію при 0°С і вливають струшують протягом 30хв., вводять 0,5мл води і розчин 0,42г (1,93ммоль) трео-[1струшують ще протягом 6 годин. азабіцикло[2.2.2.]окт-2-іл(феніл)метил]аміну в Проводять гідроліз за допомогою 1Н-соляної розчині в 5мл хлороформу і суміш струшують кислоти і розбавляють хлороформом. протягом 6 годин при кімнатній температурі. Підлуговують водну фазу аміаком і декілька разів Проводять гідроліз з використанням води, екстрагують її хлороформом. Промивають розбавляють хлороформом, потім відділяють об'єднані органічні фази, сушать на сульфаті водну фазу і екстрагують її хлороформом. натрію і випаровують розчинник при зниженому Промивають об'єднані органічні фази, сушать на тиску, отримують 0,97г оранжевого масла, що сульфаті натрію і випаровують розчинник при містить 8a,9S-цинхонан-9-амін, яке зниженому тиску, потім залишок очищають використовують без обробки на наступній стадії. хроматографією на колонці з силікагелем, 3.2. 2-хлор-N-(8a,9S-цинхонан-9-іл)-3елююючи сумішшю хлороформу і метанолу. трифторметилбензамідхлоргідрат 2:1 Отримують 0,18г маслянистого продукту. Способом, описаним в прикладі 1.3, Останній розчиняють в декількох мл пропан-2використовуючи як вихідні речовини 0,97г олу, додають 6мл розчину 0,1Н-соляної кислоти в (3,3ммоль) 8a,9S-цинхонан-9-аміну, 0,84г пропан-2-олі і концентрують суміш при зниженому (3,4ммоль) 2-хлор-3-трифторметилбензойної тиску для зменшення об'єму розчинника. Після кислоти і 0,5г (3,63ммоль) карбонату калію, подрібнення отримують 0,15г хлоргідрату у вигляді отримують 0,360г масла, яке розчиняють в 30мл твердої речовини. 1Н-соляної кислоти. Водну фазу екстрагують Точка плавлення: 257-262°С. хлороформом, потім випаровують розчинник при Приклад 2 (Сполука №4) зниженому тиску. Таким чином отримують 0,26г Трео-2,6-дихлор-N-[(1-азабіцикло[2.2.2]окт-2хлоргідрату у вигляді білої твердої речовини. іл)фенілметил]-3Точка плавлення: 185-205°С; трифторметилбензамидхлоргідрат 1:1. [a]D25=-5,4 (c=0,986, МеОн). У колбу об'ємом 100мл, забезпечену Приклад 4 (Сполука №17) магнітною мішалкою, вводять 0,36г (1,38ммоль) 2,6-дихлор-N-[(1S)-[(2S)(1-азабіцикло[2.2.2]окт2,6-дихлор-3-трифторметилбензойної кислоти, 2-іл)фенілметил]-30,187г (1,38ммоль) гідроксибензотриазолу, 0,264г (трифторметил)бензамідхлоргідрат 1:1 (1,38ммоль) 1-[3-диметиламіно)пропіл]-34.1 (1S)-[(2S)(1-азабіцикло[2.2.2]окт-2етилкарбодіїмідахлоргідрату в розчині в 5мл іл(феніл)метил]амін-D-тартрат хлороформу і перемішують при кімнатній Розчиняють 9,4г (43,45ммоль) трео-[1температурі протягом ночі. азабіцикло[2.2.2]окт-2-іл(феніл)метил]аміну в Проводять гідроліз з використанням води, 150мл етанолу. Вливають розчин 6,52г розбавляють хлороформом, потім відділяють (43,45ммоль) D-винної кислоти в розчині в 200мл водну фазу і екстрагують її хлороформом. етанолу. Після випаровування розчинника при Промивають об'єднані органічні фази, сушать на зниженому тиску залишок вводять в 500мл сульфаті натрію і випаровують розчинник при розчину етанолу і води (9/1), потім нагрівають до зниженому тиску, потім залишок очищають розчинення. Після 3 послідовних перекристалізацій отримують 5,39г (1S)-[(2S)(1 11 81186 12 азабіцикло[2.2.2]окт-2-іл(феніл)метил]амін-Dпроводять гідроліз з використанням розчину 10%тартрату. ної соляної кислоти. Екстрагують простим ефіром, Точка плавлення: 125-135°С; потім водну фазу обробляють і підлуговують аміаком. Екстрагують хлороформом, потім [a]D25=-46,1 (c=0,616, МеОн). випаровують розчинник при зниженому тиску. 4.2. 2,6-дихлор-N-[(1S)-[(2S)(1-азаЗалишок очищають флеш-хроматографією на біцикло[2.2.2]окт-2-іл)фенілметил]-3колонці з силікагелем, елююючи сумішшю (трифторметил)бензамидхлоргідрат 1:1 хлороформу і метанолу. Таким чином отримують У колбу, об'ємом 100мл, забезпечену 0,53г 1-азабіцикло[2.2.2]окт-2магнітною мішалкою, вводять 3,33г (12,02ммоль) іл(фторфеніл)метанолу у вигляді жовтуватої хлориду 2,6-дихлор-3-(трифторметил)бензойної твердої речовини. кислоти в розчині в 30мл хлороформу в Точка плавлення: 69-70°С. присутності 1,82г (13,22ммоль) карбонату калію 5.2 1-азабіцикло[2.2.2]окт-2при 0°С і вливають розчин 2,6г (12,02ммоль) (1S)іл(фторфеніл)метанон [(2S)(1-азабіцикло[2.2.2]окт-2-іл(феніл)метил]аміну У трьохгорлу колбу об'ємом 250мл в (отриманого шляхом підлуговування солі, описаної атмосфері азоту вводять 1,3мл в 4.1, з подальшим екстрагуванням) в розчині в диметилсульфоксиду в 40мл тетрагідрофурану 40мл хлороформу і струшують суміш при кімнатній при -70°С, додають по краплях 0,9мл температурі протягом 6 годин. оксалілхлориду (11ммоль) і перемішують протягом Проводять гідроліз з використанням води, 30хв. при цій температурі. Вводять по краплях розбавляють хлороформом, потім відділяють розчин 1г (4,6ммоль) 1-азабіцикло[2.2.2]окт-2водну фазу і екстрагують її хлороформом. іл(фторфеніл)метанолу в 40мл тетрагідрофурану. Промивають об'єднані органічні фази, сушать на Через 30хв. вводять 4мл (27,6ммоль) сульфаті натрію і випаровують розчинник при триетиламіну при -70°С. Реакційну суміш потім зниженому тиску, потім залишок очищають струшують при -70°С протягом 30 хвилин, при 0°С хроматографією на колонці з силікагелем, протягом 30 хвилин, потім протягом 1 години при елююючи сумішшю хлороформу і метанолу. кімнатній температурі. Отримують 5,4г маслянистого продукту. Суміш перекидають в розчин аміаку, потім Останній розчиняють в декількох мл екстрагують декілька разів хлороформом. хлороформу, додають 600мл розчину простого Органічні фази сушать на сульфаті натрію і ефіру, насиченого соляною кислотою і випаровують при зниженому тиску. Залишок концентрують суміш при зниженому тиску. очищають хроматографією на колонці з Залишок перекристалізують в етилацетаті. Таким силікагелем, елююючи сумішшю хлороформу і чином отримують 4,7г 2,6-дихлор-N-[(1S)-[(2S)(1метанолу. Таким чином отримують 1г 1аза-біцикло[2.2.2]окт-2-іл)фенілметил]-3азабіцикло[2.2.2]окт-2-іл(4-фторфеніл)метанону. (трифторметил)бензамидхлоргідрату. Точка плавлення: 68-69°С. Точка плавлення: 264-268°С; 5.3. (Z)-1-азабіцикло[2.2.2]окт-іл(4[a]D25=+61,1° (c=0,32, МеОн). фторфеніл)метанон 0-бензилоксимхлоргідрат. Приклад 5 (Сполука №26) По методу, описаному в прикладі 1.1 з 1,17г Трео-N-[(1-азабіцикло[2.2.2]окт-2-іл(4(5ммоль) кетону отримують 1,4г (Z)-1фторфеніл)метил]-2,6-дихлор-3азабіцикло[2.2.2]окт-іл(4-фторфеніл)метанон 0(трифторметил)бензамидхлоргідрат 1:1. бензилоксимхлоргідрату після подрібнення в 5.1 1-азабіцикло[2.2.2]окт-2-іл(4простому ефірі залишку, отриманого після фторфеніл)метанол реакційній обробці. У трьохгорлу колбу об'ємом 100мл в Точка плавлення: 202-203°С. атмосфері аргону вводять 1,11г (10ммоль) 5.4 Трео 1-азабіцикло[2.2.2]окт-іл(4хінуклідину в 40мл сухого тетрагідрофурану при фторфеніл)метанамін. 0°С. Вводять по краплях 1,33мл (10,5ммоль) По методу, описаному в прикладі 1.2 з 1,47г комплексу простий ефір-трифторид бору і (4,54ммоль) (Z)-1-азабіцикло[2.2.2]окт-іл(4струшують при 0°С протягом 30 хвилин (розчин А). фторфеніл)метанон 0-бензилоксимхлоргідрату Паралельно в трьохгорлу колбу об'ємом 250мл в отримують 1г 1-азабіцикло[2.2.2]окт-іл(4атмосфері аргону вводять 2,47г (22ммоль) сухого фторфеніл)метанаміну трео (надлишок терциобутилату калію в 60мл сухого діастереоізомеру, de=90%). терагідрофурану. Охолоджують до -70°С і 5.5 N-[(S)-(2S)(1-азабіцикло[2.2.2]окт-2-іл(4вливають по краплях 22мл 1М розчину вторфторфеніл)метил]-2,6-дихлор-3бутиллітію в суміш циклогексан/гексан (22ммоль), (трифторметил)бензамідхлоргідрат 1:1 підтримуючи температуру нижче за -60°С (розчин По методу, описаному в прикладі 1.3 з 0,39г В). Після закінчення введення розчин А вводять в (1,66ммоль) трео 1-азабіцикло[2.2.2]окт-2-іл(4розчин В, в умовах підтримки температури фторфеніл)метанаміну, 0,5г (1,83ммоль) хлориду приблизно -70°С. Перемішують протягом 2 годин. 2,6-дихлор-3-трифторметилбензойної кислоти, У трьохгорлу колбу об'ємом 50мл в атмосфері 0,25г (1,83ммоль) карбонату калію, отримують аргону вводять 2,36мл (22ммоль) дистильованого після очищення хроматографією 0,79г трео N-[14-фторбензальдегіду в розчині в 20мл азабіцикло[2.2.2]окт-2-іл(4-фторфеніл)метил]-2,6тетрагідрофурану при -70°С. Розчин В вводять в дихлор-3-(трифторметил)бензаміду у вигляді умовах підтримки температури приблизно -70°С. масла, яке перетворюють в сіль за допомогою Отриманий розчин залишають на 30хв. при -70°С, потім температура підіймається до -20°С. Потім 13 81186 розчину газоподібної соляної кислоти в простому етиловому ефірі. Точка плавлення: 290-291°С. Інші сполуки отримують по методах, описаних в прикладах 1, 2 і 5 їх інших функціоналізованих альдегідів. В нижченаведеній таблиці 1 приведені хімічні структури декількох сполук згідно з винаходом. У колонці "R", -СН-СН2 означає вінільну групу, в колонці "R1" C6H5 означає фенільну групу і 4C9H6N означає групу хінолеїн-4-ілу. У колонці «сіль» означає сполуку в основному стані, "HCL" означає хлоргідрат і "tfa" означає трифторацетат. Сполуки 14, 19-23, 24, представлені в таблиці, знаходяться в формі хлоргідрату або дихлоргідрату (див. таблицю), сольватованого однією або декількома молекулами води. Сполуки 15 і 16 в таблиці утворюють пару енантіомерів, які розділені препаративною ВЕРХ з використанням колонки CHIRALCELÒ AD 20мкм і як розчинник суміші ізогексан/пропан-2-ол 95/5, те саме відноситься до сполук 17 і 18. У таблиці 2 приведені фізичні властивості, точки плавлення і ротаційні можливості сполук, представлених в таблиці, "(d)" означає точку плавлення з розкладанням. 14 15 81186 16 інкорпорованої радіоактивної речовини в присутності або за відсутності сполуки, що тестується. Клітини культивували в моношарі протягом 48 годин в планшетах, заздалегідь оброблених 0,02% фібронектином. У день проведення експерименту культуральне середовище видалили і клітини промили буферним розчином Krebs-HEPES ([4-(2гідроксіетил)піперазин-1-етансульфонова кислота) з рН 7,4. Через 10хв. з початку попереднього інкубування при 37°С в присутності буферного розчину (контрольний зразок) або сполука, що тестується, в різних концентраціях або 10мМ гліцину (визначення неспецифічного захоплення), ввели потім 10мкм [І4С]гліцину (специфічна активність 112mCi/ммоль). Інкубування продовжувалося протягом 10хв. при 37°С і реакцію зупинили шляхом 2 промивань буферним розчином Krebs-HEPES з рН 7,4. Інкорпоровану в клітини радіоактивну речовину оцінювали після додання 100мкм рідкої мерехтливої речовини і перемішування протягом 1 години. Обчислення провели за допомогою лічильника Microbeta Tri-lux . Ефективність сполуки визначили з допомогою СІ50, концентрація сполуки, що знижує специфічне захоплення гліцину на 50%, яку визначали по різниці інкорпорованої радіоактивності контрольного зразка і зразка, що отримав гліцин в концентрації 10мМ. У цьому тесті найбільш активні сполуки згідно з винаходом, мають СІ50 близько 0,001-10мкм. Індивідуальні результати по декількох сполуках наступні (СІ50 в мкм): Сполука №3 0,017 Сполука №4 0,004 Сполука №14 0,07 Сполука №17 0,001 Сполука №26 0,07 Дослідження ex vivo інгібіторної активності сполуки відносно захоплення [14С]гліцину гомогенатом клітин кори головного мозку миші. Дози досліджуваної сполуки, що збільшуються, вводять перорально (отримані шляхом подрібнення молекули, що тестується, в ступці в 0,5%-ному розчині Tween/Methocel в дистильованій воді) або інтраперитонеально (розчинення молекули, що тестується, в фізіологічній сироватці або отримання шляхом подрібнення в ступці в 0,5%-ному розчині Tween/MethcelÔ у воді в залежності від розчинності молекули) самцям мишей OF1 Iffa Credo, вагою від 20 до 25г в день експерименту. Контрольну групу обробляють наповнювачем. Дози в мг/кг, спосіб введення і час обробки визначають в залежності від молекули, що Сполуки згідно з винаходом піддали серії досліджується. фармакологічних досліджень, які показали, що Після евтаназії шляхом відсікання голови вони представляють інтерес як речовини, що тварин в певний час після введення, кору володіють терапевтичним ефектом. головного мозку кожної тварини швидко вилучають Дослідження транспорту гліцину в клітинах SKна льоду, зважують і зберігають при 4°С або N-MC з експресією нативного людського заморожують при -80°С (в обох випадках зразки переносника glyt1. зберігають максимум протягом 1 дня). Кожний 14 Захоплення [ С] гліцину досліджували в зразок гомогенізують в буферному розчині Krebsклітинах SK-N-MC (нейроепітеліальні клітини HEPES при рН 7,4 з розрахунку 10мл/г тканини. людини), з експресією нативного людського 20мкм кожного гомогенату інкубують протягом 10 переносника glyt1 шляхом вимірювання хвилин при кімнатній температурі в присутності 17 81186 18 Таким чином, відповідно до іншого аспекту 10мМ L-аланіну і буферного розчину. об'єктом винаходу є лікарські засоби, які містять Неспецифічне захоплення визначають введенням сполуку формули (І) або її сіль приєднання з 10мМ гліцину в контрольну групу. Реакцію фармацевтично прийнятною кислотою або гідрату зупиняють фільтруванням у вакуумі і або сольвату сполуки формули (І). радіоактивність, що залишилася, визначають по Сполуки згідно з винаходом можна твердому мерехтливому матеріалу шляхом використати, зокрема, для лікування порушень підрахунку за допомогою лічильника Microbeta Triповедінки, пов'язаних з деменцією, психозів, luxÔ. зокрема, шизофренії (дефіцитарна форма і Інгібітор захоплення [14С]гліцину знижує продуктивна форма) і гострих або хронічних кількість радіолігандів, інкорпорованих в кожний екстрапірамідальних симптомів, викликаних гомогенат. нейролептиками, для лікування різних форм Активність сполуки оцінюють по її DE50, дозі тривожних станів, панічних атак, фобій, яка інгібує на 50% захоплення [14С]гліцину по обсесивно-компульсивних розладів, для лікування відношенню до контрольної групи. різних форм депресії, включаючи психотичну Володіючі найбільшою активністю сполуки депресію, для лікування порушень, пов'язаних зі згідно з винаходом в цьому тесті мають DE50 від зловживанням алкоголем або алкогольною 0,1 до 5мг/кг при інтраперитонеальному введенні залежністю, розладів статевої поведінки, або при пероральному введенні. порушень харчування, і для лікування мігрені. Дослідження транспорту гліцину в гомогенаті Крім того сполуки згідно з винаходом можна спинного мозку миші використати для лікування хворобливих м'язових Захоплення [14С] гліцину переносником glyt2 судом в ревматології і при гострій спинномозковій досліджують в гомогенаті спинного мозку миші патології, для лікування спастичних судорожних шляхом вимірювання радіоактивності, станів спинномозкового або церебрального інкорпорованої в присутності або за відсутності походження, для симптоматичного лікування сполуки, що досліджується. гострих і підгострих болів від слабкої до помірної Після евтаназії тварин (самці мишей OF1 Iffa інтенсивності, для лікування інтенсивних і/або Credo, вагою від 20 до 25г в день експерименту) хронічних болів, нейрогенних болів і наполегливих спинний мозок кожної тварини швидко вилучають, болів, для лікування хвороби Паркінсона і зважують і зберігають на льоду. Зразки симптомів Паркінсона нейродегенеративного гомогенізують в буферному розчині Krebes-HEPES походження або викликаних нейролептиками, для ([4-(2-гідроксіетил)піперазин-1-етансульфонова лікування генералізованої первинної і вторинної кислота), рН 7,4 з розрахунку 25мл/г тканини. парціальної епілепсії з простою або складною 50мкл гомогенату заздалегідь інкубують протягом симптоматикою, змішаних форм і інших 10хв. при 25°С в присутності буферного розчину епілептичних синдромів в доповнення до іншого Krebes-HEPES, рН 7,4 і сполуку, що антиепілептичного лікування, або в монотерапії досліджується, в різних концентраціях, або 10мМ для лікування апное уві сні і для нейрозахисту. гліцину для визначення неспецифічного Об'єктом даного винаходу є також захоплення. Потім вводять [І4С]гліцин (специфічна фармацевтичні композиції, що містять ефективну активність=112мСі/ммоль) протягом 10хв. при дозу щонайменше однієї сполуки згідно з 25°С з кінцевою концентрацією 10мкм. Реакцію винаходом у вигляді основи або солі або зупиняють шляхом фільтрування у вакуумі і фармацевтично прийнятного сольвату, і в суміші, у радіоактивність визначають по твердому разі необхідності з одним або декількома мерехтливому матеріалу шляхом підрахунку за прийнятними ексципієнтами. допомогою лічильника Microbeta Tri-luxÔ. Вказані ексципієнти вибирають відповідно до Активність сполуки оцінюють по концентрації фармацевтичної форми або бажаного способу СІ50, здатній інгібувати на 50% специфічне введення. захоплення гліцину, що визначається різницею Фармацевтичні композиції згідно з винаходом радіоактивності, інкорпорованою в контрольну можуть також бути призначені для перорального, групу, і групу, що отримала гліцин в концентрації сублінгвального, підшкірного, 10мМ. внутрішньом'язового, внутрішньовенного, Володіючі найбільшою активністю сполуки місцевого застосування, інтратрахеального, згідно з винаходом в цьому тесті мають СІ50 інтраназального, черезшкірного, ректального, близько від 0,02 до 10мкМ. внутрішньоочного введення. СІ50 сполуки №17 становить 0,69мкМ. Лікарські форми можуть, наприклад, являти Результати дослідних випробувань, собою таблетки, желатинові капсули, гранули, проведених по сполуках згідно з винаходом порошки, розчини або суспензії для перорального загальної формули (І) показують, що вони є введення або для ін'єкцій, пластири черезшкірної інгібіторами переносників гліцину glyt1, присутніх дії, супозиторії. Для місцевого застосування можна головним чином в головному мозку, і переносників використати мазі, лосьйони, примочки для очей. гліцину glyt2, присутніх головним чином в Як приклад одинична форма для введення спинному мозку. сполуки згідно з винаходом в формі таблеток може Сполуки згідно з винаходом можна, таким містити наступні компоненти: чином використати для отримання лікарських Сполука згідно з винаходом 50,0мг засобів, зокрема, лікарських засобів, що є Маніт 223,75мг інгібіторами переносників гліцину glyt1 і/або glyt2. Натрієва кроскарамелоза 6,0мг 19 81186 Кукурудзяний крохмаль 15,0мг Гідроксипропілметилцелюлоза 2,25мг Стеарат магнію 3,0 мг Вказані разові форми вводять таким чином, щоб забезпечити добову дозу від 0,01 до 20мг активної речовини на кг маси тіла в залежності від галенової форми. В окремих випадках потрібно зменшити або збільшити дозування; таке дозування не вийде за рамки винаходу. Відповідно до звичайної практики дозування для кожного пацієнта визначає лікар в залежності від способу введення, маси тіла і індивідуальної чутливості вказаного пацієнта. Відповідно до іншого аспекту даний винахід відноситься також до способу лікування вищезгаданих патологій, який включає в себе введення пацієнту ефективної дози сполуки згідно з винаходом або однієї з її фармацевтично прийнятних солей або гідратів або сольватів. 20
ДивитисяДодаткова інформація
Назва патенту англійськоюN-heterocyclylmethyl benzamide derivatives, preparation thereof and use in therapy
Автори англійськоюDargazanli Gihad, Estenne-Bouhtou Genevieve, Magat Pascale, Marabout Benoit, Roger Pierre
Назва патенту російськоюПроизводные n-гетероциклилметилбензамидов, их получение и их применение в терапии
Автори російськоюДаргазанли Жиад, Эстенн-Буту Женевьев, Мага Паскаль, МАРАБУ Бенуа, Рожер Пьер
МПК / Мітки
МПК: A61P 25/00, A61K 31/4748, C07D 471/08
Мітки: отримання, застосування, n-гетероциклілметилбензамідів, похідні, терапії
Код посилання
<a href="https://ua.patents.su/10-81186-pokhidni-n-geterociklilmetilbenzamidiv-kh-otrimannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні n-гетероциклілметилбензамідів, їх отримання і їх застосування в терапії</a>
Попередній патент: Лавино-пролітний діод
Наступний патент: Ортез на колінний суглоб
Випадковий патент: Волоконно-оптичний датчик метану












