3-фенілзаміщені похідні піридоіндолону, їх отримання та застосування у терапії
Номер патенту: 79317
Опубліковано: 11.06.2007
Автори: Чапетті Паола, Дерок Жан-Марі, Каселлас П'єрр, Жегам Самір, Буррі Бернар, Вермют Камілль-Жорж, Мюно Іветт
Формула / Реферат
1. Сполука, що відповідає формулі:
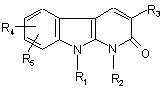 , (I)
, (I)
у котрій:
R1 представляє атом гідрогену, (С1-С4)алкіл або (СН2)nОН, (СН2)n-O-тетрагідропіран-2-іл, (CH2)nNR'6R'7, (CH2)nCN, (СН2)nСO2(С1-С4)Alk або (CH2)nCONR6R7;
R2 представляє атом гідрогену або (С1-С4)алкіл;
або R1 та R2 разом утворюють групу (СH2)3;
R3 представляє феніл, монозаміщений замісником, вибраним з групи: гідроксил, гідроксиметил, карбоксил, (С1-С4)алканоїл, азидо, (С1-С4)алкоксикарбоніл, гідроксіімінометил, (С1-С4)алкілсульфоніл, трифлуорметил, тіол, (С1-С4)алкілтіо або ціаногрупа або (СН2)m NR'7R10, CONR6R8 або O(CH2)nR9; феніл, заміщений 2-5 ідентичними або відмінними замісниками, вибраними з групи: атом галогену, (С1-С4)алкіл, трифлуорметил, гідроксил, гідроксиметил, (С1-С4)алкоксил, карбоксил, (С1-С4)алканоїл, азидо, (С1-С4)-алкоксикарбоніл, гідроксіімінометил, тіол, (С1-С4)алкілтіо або (С1-С4)алкілсульфоніл, або феніл, або ціано, або (CH2)mNR'7R10, CONR6R8 або O(CH2)nR9; або
R3 представляє бензодіоксоліл, котрий незаміщено або заміщено на фенілі атомом галогену;
R4 та R5 є ідентичними або відмінними та кожний незалежно представляють атом гідрогену або галогену або гідроксил, (С1-С4)алкіл, трифлуорметил, феніл, ціано, (С1-С4)алкоксил, (С1-С4)алкоксикарбоніл або (С1-С4)алкілсульфоніл, або O-(CH2)nNR6R7, або (CH2)nCONR6R7;
R6 представляє гідроген або (С1-С4)алкіл;
R7 представляє гідроген або (С1-С4)алкіл;
або R6 та R7, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперидил, морфолініл, піролідиніл, піперазиніл або 4-метилпіперазин-1-іл;
R'6 представляє гідроген або (С1-С4)алкіл;
R'7 представляє гідроген або (С1-С4)алкіл;
або R'6 та R'7, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: морфолініл або піролідиніл;
R8 представляє гідроген, (С1-С4)алкіл або -(CH2)nNR6R7;
або R6 та R8, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперидил, морфолініл, піролідиніл, піперазиніл або 4-метилпіперазин-1-іл;
R9 представляє феніл або аміно, морфолін-4-іл, ціано або (С1-С4)алкоксикарбоніл;
R10 представляє R'6 або феніл, піридил або піримідиніл, або (СН2)nNR'6R'7;
або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперазиніл або 4-метилпіперазин-2-іл;
n представляє 1, 2 або 3;
m представляє 0 або 1;
Alk представляє алкіл;
у формі основи або кислотно-адитивної солі, чи у формі гідрату чи сольвату.
2. Сполука формули (І) за п. 1, яка відрізняється тим, що
R1 представляє атом гідрогену або метил, ціанометил, (С1-С4)алкоксикарбонілметил, амінометил, аміноетил, амінопропіл або піролідиноетил,
та/або R2 представляє метил;
та/або R1 та R2 разом утворюють групу (СH2)3;
та/або R3 представляє феніл, монозаміщений замісником, вибраним з групи: гідроксил, (С1-С4)алкоксикарбоніл, метилсульфоніл, трифлуорметил, метилтіо, ціанометоксил, аміноетоксил, ацетил, гідроксиметил, ціано, аміно, азидо, амінометил або гідроксіімінометил, чи (CH2)mNR'7R10, у котрій R'7 представляє атом гідрогену або метил, R10 представляє атом гідрогену або феніл, піридил або піримідиніл, або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють піперазин-1-іл або 4-метилпіперазин-1-іл, а m дорівнює нулю або одиниці; або
R3 представляє феніл, заміщений 2-3 ідентичними або відмінними замісниками, вибраними з групи: атом галогену, метил, метоксил, метилтіо, трифлуорметил, гідроксил, (С1-С4)алкоксикарбоніл, метилсульфоніл, ціанометоксил, аміноетоксил, ацетил, гідроксиметил, ціано, аміно, азидо, амінометил або гідроксіімінометил, або (CH2)mNR'7R10, у котрій R'7 представляє атом гідрогену або метил, R10 представляє атом гідрогену або феніл, піридил або піримідиніл, або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють піперазин-1-іл або 4-метилпіперазин-1-іл, a m дорівнює нулю або одиниці; або R3 представляє бензодіоксоліл, котрий є незаміщеним або заміщеним на фенілі атомом галогену;
та/або R4 представляє атом галогену або метил, метоксил або (С1-С4)алкоксикарбоніл;
та/або R5 представляє атом гідрогену або метил;
у формі основи або кислотно-адитивної солі, чи у формі гідрату чи сольвату.
3. Сполука формули (І) за п. 1, яку вибрано з групи;
3-(2,4-диметоксифеніл)-1,9-диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбонова кислота;
3-(2,4-диметоксифеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(3-гідроксиметилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(2,4-дихлорфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(1,6-диметил-2-оксо-2,9-дигідро-1 Н-піридо[2,3-b]індол-3-іл)бензонітрил;
3-(4-амінофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(6-хлор-1,3-бензодіоксол-5-іл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
1,6-диметил-1,9-дигідро-3-(феніламінофеніл)-2Н-піридо[2,3-b]індол-2-он;
6-бром-3-(3,5-диметилфеніл)-1-метил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
1,6-диметил-3-(3-(трифлуорметил)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
1,6-диметил-3-(3-(піридин-2-іламіно)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
1,6-диметил-3-(3-(піримідин-2-іламіно)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
3-(3-ацетилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;
2-(2,4-дихлорфеніл)-9-метил-5,6-дигідро-3Н,4Н-3а,6а-діазафлуорантен-3-он;
метил 9-(ціанометил)-3-(2,4-дихлорфеніл)-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбоксилат;
у формі основи або кислотно-адитивної солі, чи у формі гідрату чи сольвату.
4. Спосіб отримання сполуки формули (І) за пп. 1-3, який відрізняється тим, що:
2-аміноіндол формули:
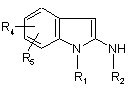 , (II)
, (II)
у котрій R1, R2, R4 та R5 визначено для сполуки формули (І), піддають реакції з естером формули:
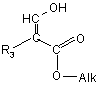 , (III)
, (III)
у котрій R3 визначено для сполуки формули (1), a Alk представляє С1-С4алкіл.
5. Спосіб отримання сполуки формули (І) за пп. 1-3, який відрізняється тим, що:
аміноіндол формули:
 , (II)
, (II)
у котрій R1, R2, R4 та R5 визначено для сполуки формули (І), реагує з естером формули:
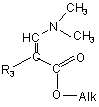 , (IV)
, (IV)
у котрій R3 визначено для сполуки формули (І), а Alk представляє С1-С4алкіл.
6. Медикамент, який відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-3 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І).
7. Фармацевтична композиція, яка відрізняється тим, що містить сполуку формули (І) за будь-яким з пп. 1-3 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки та щонайменше один фармацевтично прийнятний ексципіент.
8. Застосування сполуки формули (І) за будь-яким з пп. 1-3 для отримання медикаменту, призначеного для лікування та попередження хвороб, викликаних або загострених проліферацією клітин пухлин.
Текст
Представлений винахід стосується похідних піридоіндолону, заміщених у 3-позиції фенілом, їх отримання та їх застосування у терапевтичному лікуванні. [Патент Франції №9708409] розкриває сполуки формули: у котрій: x представляє атом гідрогену або хлору чи метил або метоксил; r1 представляє атом гідрогену або метил чи етил; r2 представляє метил або етил; або ще r1 та r2 разом утворюють групу (СН2)3 ; r3 представляє, з одного боку, феніл, як варіант, заміщений атомом галогену, або метил чи метоксил або, з іншого боку, тієніл. В описі цього патенту повідомлено, що сполуки формули (А), котрі мають афінність стосовно омегамодуляторних ділянок, асоційованих з рецепторами GABAA, можна застосовувати у лікуванні станів, пов'язаних з розладами GABA-ергічної трансмісії, асоційованої з підтипами рецепторів GABAA, як-то тривожність, розлади сну, епілепсія, тощо. Предметом представленого винаходу є сполуки, що мають антиракову активність, що відповідають формулі: у котрій: R1 представляє атом гідрогену, (С1-С4)алкіл або (СН2)nОН, (СН2)n-О-тетрагідропіран-2-іл, (CH2)nNR'6R7, (СН2)nCN, (СН2 )nСО2(С1-С4)алкіл або (СН2)nCONR6R7; R2 представляє атом гідрогену або (С1-С4)алкіл; або R1 та R2 разом утворюють групу (СН2)3; R3 представляє феніл, монозаміщений замісником, вибраним з групи: гідроксил, гідроксиметил, карбоксил, (С1-С4)алканоїл, азидо, (С1-С4)алкоксикарбоніл, гідроксіімінометил, (С1-С4)алкілсульфоніл, трифлуорметил, тіол, (С1-С4)алкілтіо або ціаногрупа або (CH2)mNR'7R10, CONR6R8 або O(СН2)nR9; феніл, заміщений 2-5 ідентичними або відмінними замісниками, вибраними з групи: атом галогену, (С1-С4)алкіл, трифлуорметил, гідроксил, гідроксиметил, (С1-С4)алкоксил, карбоксил, (С1-С4)алканоїл, азидо, (С1С4)алкоксикарбоніп, гідроксіімінометил, тіол, (С1-С4)алкілтіо або (С1-С4)акілсульфоніл, або феніл чи ціано, або групою (CH2)mNR'7R10, CONR6R8 або O(CH2)nR9; або; R3 представляє бензодіоксоліл, котрий є незаміщеним або заміщеним на фенілі атомом галогену; R4 та R5 є ідентичними або відмінними та кожний незалежно представляє атом гідрогену або галогену або гідроксил, (С1-С4)алкіл, трифлуорметил, феніл, ціано, (С1-С4)алкоксил, (С1-С4)алкоксикарбоніл або (С1С4)алкілсульсроніл або групу O-(СН2)n NR6R7 чи (СН2)n NR6R7; R6 представляє гідроген або (С1-С4)алкіл; R7 представляє гідроген або (С1-С4)алкіл; або R6 та R7, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперидил, морфолініл, піролідиніл, піперазиніл або 4-метилпіперазин-1-іл; R'6 представляє гідроген або (С1-С4)алкіл; R'7 представляє гідроген або ((С1-С4))алкіл; або R'6 та R'7, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: морфолініл або піролідиніл R8 представляє гідроген, (С1-С4)алкіл або групу- (СН2)n NR6R7; або R6 та R8, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: морфолініл, морфолініл, піролідиніл, піперазиніл або 4-метилпіперазин-1-іл; R9 представляє феніл або аміно, морфолін-4-іл, ціано або (С1-С4)алкоксикарбоніл; R10 представляє R'6 або феніл, піридил чи піримідініл або групу (СН2)nNR'6R'7; або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперазиніл або 4-метилпіперазин-2-іл; n представляє 1, 2 або 3; m представляє 0 або 1; Alk представляє алкіл. Сполуки формули (І) можуть існувати у формі основ або з кислотно-адитивних солей. Такі адитивні солі утворюють частину винаходу. Ці солі переважно отримують з фармацевтично прийнятними кислотами, але солі інших корисних кислот, наприклад для очистки або виділення сполук формули (І), також утворюють частину винаходу. Сполуки формули (І) можуть також існувати у формі гідратів або сольватів, тобто у формі асоціатів або комбінацій з одною або більше молекулами води або з розчинником. Такі гідрати та сольвати також утворюють частину винаходу. У контексті представленого винаходу атом галогену означає: флуор, хлор, бром або йод; (С1-С4)алкіл означає: насичену, лінійну або розгалужену, аліфатичну групу, що містить 1-4 атоми карбону. Як приклад, можна згадати групи: метил, етил, пропіл, ізобутил, бутил, ізобутил та трет-бутил; (С1-С4)алкоксил означає: О-алкіл, де алкіл вищезазначено. Предметом представленого винаходу дуже особливо є сполуки формули (І), у котрій: R10 представляє атом гідрогену, (С1-С4)алкіл або (СН2)nCО2(С1-С4)алкіл або (СН2)nCONR6R7 груп; R2 представляє атом гідрогену або (С1-С4)алкіл; R3 представляє феніл, монозаміщений замісником, вибраним з групи: гідроксил, гідроксиметил, карбоксил, (С1-С4)алкоксикарбоніл, гідроксіімінометил, (С1-С4)алкілсульфоніл, трифлуорметил, тіол, (С1-С4)алкілтіо або ціаногрупа або група (CH2)mNR6R7 або CONR6R8; феніл, заміщений 2-5 ідентичними або відмінними замісниками, вибраними з групи: атом галогену або (С1-С4)алкіл, трифлуорметил, гідроксил, гідроксиметил, (С1-С4)алкоксил, карбоксил, (С1С4)алкоксикарбоніл, гідроксіімінометил, тіол, (С1-С4)алкілтіо, (С1-С4)алкілсульфоніл або ціаногрупа або група (СН2)mNR6R7 або CONR6R8; або R3 представляє бензодіоксоліл;. R4 та R5 є ідентичними або відмінними та, кожний незалежно, представляють атом гідрогену або галогену, або гідроксил, (С1-С4)алкіл, трифлуорметил, ціано, (С1-С4)алкоксил або (С1-С4)алкоксикарбоніл або групу O-(СН2 )nNR6R7; R6 представляє гідроген або (С1-С4)алкіл; R7 представляє гідроген або (С1-С4)алкіл; або R6 та R7, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперидил, морфолініл, піролідиніл, піперазиніл або 4-метилпіперазин-1-іл; R8 представляє гідроген, (С1-С4)алкіл або: -(СН2)n NR6R7 груп; або R6 та R8, разом з атомом нітрогену, до котрого вони приєднані, утворюють гетероциклічний радикал, вибраний з групи: піперидил, морфолініл, піролідиніл, піперазиніл або 4-метил піперазин-1-іл; n представляє 1, 2 або 3; m представляє 0 або 1; Alk представляє алкіл. Серед сполук формули (І) можна згадати ті, котрі є предметом винаходу, кращі сполуки визначено так: R1 представляє атом гідрогену або метил, ціанометил, (С1-С4)алкоксикарбонілметил, амінометил, аміноетил, амінопропіл або піролідиноетил та/або R2 представляє метил та/або R1 та R2 разом утворюють групу (СН2 )3; та/або R3 представляє феніл, монозаміщений замісником, вибраним з групи: гідроксил(С1С4)алкоксикарбоніл, метилсульфоніл, трифлуорметил, метилтіо, ціанометоксил, аміноетоксил, ацетил, гідроксиметил, ціано, аміно, азидо, амінометил або гідроксіімінометил чи (CH2)mNR'7R10, У котрій R'7 представляє атом гідрогену або метил, R10 представляє атом гідрогену або феніл, піридил або піримідініл або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють піперазин-1-іл або 4метилпіперазин-1-іл, a m дорівнює нулю або одному; або R3 представляє феніл, заміщений 2-3 ідентичними або відмінними замісниками, вибраними з групи: атом галогену, метил, метоксил, метилтіо, трифлуорметил, гідроксил, (С1-С4)алкоксикарбоніл, метилсульфоніл, ціанометоксил, аміноетоксил, ацетил, гідроксиметил, ціано, аміно, азидо, амінометил або гідроксіімінометил або (CH2)mNR'7R10, у котрій R'7 представляє атом гідрогену або метил, R10 представляє атом гідрогену або феніл, піридил або піримідініл або R'7 та R10, разом з атомом нітрогену, до котрого вони приєднані, утворюють піпе-разин-1-іл або 4метилпіперазин-1-іл, a m дорівнює нулю або одному; або R3 представляє бензодіоксоліл, котрий є незаміщеним або заміщеним на фенілі атомом галогену; та/або R4 представляє атом галогену або метил, метоксил або (С1-С4)алкоксикарбоніл; та/або R5 представляє атом гідрогену або метил. Наступні сполуки є особливо переважними: 3-(2,4-диметоксифеніл)-1,9-диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбонова кислота; 3-(2,4-диметоксифеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 3-(3-гідроксиметилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 3-(2,4-дихлорфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 3-(1,6-диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-3-іл)бензонітрил; 3-(4-амінофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 3-(6-хлор-1,3-бензодіоксол-5-іл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он;: 1,6-диметил-1,9-дигідро-3-{феніламінофеніл)-2Н-піридо[2,3-b]індол-2-он; 6-бром-3-(3,5-диметилфеніл)-1-метил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 1,6-диметил-3-(3-(трифлуорметил)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 1,6-диметил-3-(3-(піридин-2-іламіно)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 1,6-диметил-3-(3-(піримідин-2-іламіно)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 3-(3-ацетилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он; 2-(2,4-дихлорфеніл)-9-метил-5,6-дигідро-3Н,4Н-3а,6а-діазафлуорантен-3-он; метил 9-(ціанометил)-3-(2,4-дихлорфеніл)-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-6-карбоксилат; та їх адитивні солі, їх сольвати та їх гідрати. Далі, захисна група Gp або G'p означає групу, котра робить можливим, по-перше, захищати реакційну функціональну групу, як-то гідроксил або амін, протягом синтезу, а по-друге, відновити незайману реакційну функціональну групу наприкінці синтезу. Приклади захисних груп та способи захисту та зняття захисту представлено у ["Protective Groups in Organic Synthesis", Green et al., 2nd Edition (John Wiley & Sons Inc., New York)]. Термін "відщеплювана група" означає, групу, котра може бути легко відщепленою від молекули розщепленням гетеролітичного зв'язку, з відхиленням електронної пари. Цю групу можна легко замістити іншою групою протягом, наприклад, реакції заміщення. Такими відщеплюваними групами є, наприклад, галогени або активований гідроксил, як-то мезил, тозил, трифлат, ацетил, тощо. Приклади відщеплюваних груп та посилання для їх отримання представлено у ["Advances in Organic Chemistry", J. March, 3rd * Edition, Wiley Inierscience, p.310-316]. Згідно з винаходом сполуку загальної формули (І) можна отримувати наступним способом. Цей спосіб характеризується тим, що: 2-аміноіндол формули: у котрій R1, R2, R4 та R5 визначено для сполуки формули (І), реагує з естером формули: у котрій R3 визначено для сполуки формули (І), a Alk представляє С1-С4алкіл. Реакцію проводять у полярному та переважно основному розчиннику, наприклад у піридині, при температурі між зовнішньою температурою та температурою кипіння під зворотним холодильником розчиннику. Загалом, її можливо також отримувати, способом винаходу, сполук формули: у котрій замісники R'1, R'2, R'3 R'4 та R'5 є попередниками замісників R1, R2, R3, R4 та R5, які визначені для сполуки формули (І), а тоді, способами, відомими фахівцям, для перетворення цих замісників для отримання R1, R2, R3, R4 та R5 замісників, потрібних для сполуки формули (І). Сполука формули (І), у котрій R1 та/або R2 є алкілом, отримують зі сполуки формули (І), у котрій R1 або R2 є гідрогеном, дією алкілйодиду у присутності NaH. Сполуки формули (І), у котрій замісник R1 є групою -(СН2)nCO2(С1-С4)Alk або -(СН2)nСONR6R7 отримують з відповідних сполук формули (І)', у котрій R1=Н, a R2, R3, R4 та R5 мають те ж значення. Наприклад, сполука формули (І), у котрій R1=Η , може бути заміщеною групою (CH2)2CN реакцією зі сполукою формули Br(CH2 )nCN у присутності натрій гідриду. Крім того, для отримання сполуки формули (І), у котрій R1 представляє групу (СН2)nNR'6R'7, бромована сполука формули Вr(СН2 )nNR'6R'7 може реагувати зі сполукою формули (І), у котрій R1=Н. Більш загально, для отримання сполуки формули (І), у котрій R^ представляє групу (СН2)n NR'6R'7, сполука формули X(СН2 )nNGp, у котрій X представляє відщеплювану групу, як-то, наприклад, атом брому або мезил або тозил, Gp представляє захисну групу для нітрогену, може реагувати зі сполукою формули (І), у котрій R1=Н; після зняття захисту з нітрогену є можливим алкілувати утворений амін способами, відомими фахівцям. Для отримання сполуки формули (І), у котрій R1 представляє групу (СН2 )nОН, сполук формули X (CH2)nO-Gp, у котрій X представляє відщеплювану групу, a G'p є захисною групою для оксигену, може реагувати зі сполукою формули (І), у котрій R1=Η та тоді отриману сполуку можна обробляти для видалення захисної групи способами, відомими фахівцям. Для отримання сполуки формули (і), у котрій замісники R3 та/або R4 та/або R5 містять гідроксиметил, гідроксіімінометил, алкіламінометил або діалкіламінометил, відповідну сполуку формули (І) із замісником R3 та/або R4 та/або R5, що містить ціаногрупу, перетворюють способами, відомими фахівцям. Для отримання сполуки формули (І), у котрій замісники R3 та/або R4 та/або R5 містять гідроксил, можливо також отримувати першу аналогічну сполуку формули (І), у котрій замісники R3 та/або R4 та/або R5 містять захищений гідроксил та тоді, на наступному етапі, для перетворення цих груп до гідроксил способами, відомими фахівцям. Застосування можна робити як захисну групу для гідроксилу, наприклад, бензилу, бензоїлу або (С1-С4)алкілу. Сполуки формули (І), у котрій R4 та/або R5 представляють атом Вr чи замісники на фенілі R3 представляють один (або кілька) атомів брому, можна застосовувати як попередники для отримання інших сполук згідно з винаходом, наприклад сполук, що мають амінозамісники, як-то. (СН2)n NR6R7 або (СН2)mNR'7R10, застосуванням реакції, відомої фахівцям. Сполуки, що мають бромований замісник також застосовують для отримання сполук, що мають алкоксикарбонільний замісник. Аміноіндоли формули (II) можуть бути отримані способами, описаними у [Khim. Geterosikl. Soedin., 1973, 12, 647-652 та у J. Heterocyd. Chem., 1975, 12, 135-138]; Деякі 2-аміноіндольні похідні формули (II) відомі та описані у [Khim. Geterosikl. Soedin., 1973, 4, 511-515; Eur. J. Med. Chem. Chim. Then, 1992, 21 (9), 908-918; Chem. Heterocyd. Compd. (Engl. Transl.), 1970, 6, 338343; Tetrahedron, 1971: 21, 775-785; Pharm. Chem. J. (Engl. Transl.), 1990, 24 (11), 810-812; Tetrahedron Lett., 1996, 31 (28), 4931-4932]. Деякі естери формули (III) відомі та їх можна отримувати способами, описаними у [J. Org. Chem., 1984, А9 (22), 4287-4290; J. Am. Chem. Soc, 1974, 96 (7), 2121; Tetrahedron, 1970, 26 (2), 715719; Synth. Commun., 2000, 30 (8), 1401-1411; Zhongguo Yaowu Huaxue Zazhi, 2000,10 (1), 9-12, 25; JP 19680131, EP 260832, EP 178826, WO 97-46577, DE 3221915]. Сполуки згідно з винаходом можна також отримувати способом, що характеризується тим, що: аміноіндол формули: у котрій R1, R2, F4 та R5 визначено для сполуки формули (І), реагує з естером формули: у котрій R3 визначено для сполуки формули (І), а АІк представляє С1-С4алкіл. Реакцію проводять у протонному та полярному розчиннику, переважно у кислотному середовищі, при температурі між зовнішньою температурою та температурою розчиннику кипіння під зворотним холодильником. Сполуку формули (IV) отримують застосуванням диметокси-N,N-диметилметанаміну (V) способом, подібним описаному у [J. Org. Chem., 1982, 47, 2846-2851] або застосуванням реагенту Бредерека (третбутоксибіс(диметиламіно)метан) згідно з [J. Org. Chem., 1982, 15, 2846-2851] та за наступною схемою реакцій: Якщо не визначено інше, спектри протонного магнітного резонансу (ЯМР) реєструють у d6-ДМСО; стосовно d6-ДМСО, котрий відрізняється на 2,50млн-1 від тетраметилсилану. Сигнали спектроскопи ЯМР виражено так: s: синглет; bs: широкий синглет; d: дублет; sd: розщеплений дублет; t: триплет; st: розщеплений триплет; q: квартет; mt: мультиплет. Отримання деяких сполук згідно з винаходом описано у наступних прикладах. Ці приклади не обмежують, а тільки ілюструють представлений винахід. Ряд сполук у прикладах стосується представлених у таблиці нижче, у котрій ілюстровано хімічні структури та фізичні властивості деяких сполуки згідно з винаходом. В отриманнях та прикладах, котрі представлено далі, застосовано наступні скорочення: TEA: триетиламін ДМА: диметилацетамід ДМФ: диметилформамід ДБУ: 1,8-діазадицикло[5,4,0]ундец-7-ен LAH: LiAIH4: літій алюмогідрид Ν-ΜΠ: N-метилпіролідин-2-он LiN(TMS)2: літій біс(триметилсиліл)амід ДХМ: дихлорметан AcOEt: етилацетат АсОН: оцтова кислота N-БС: N-бромсукцинімід AIBN: 2,2'-азобісізобутиронітрил Ксант-фос:4,5-біс(дифенілфосфіно)-9,9-диметилксантен Рd(dbа)3:трис(дибензиліденацетон)дипаладій БОФ: бензотриазол-1-ілокситрис(диметил-аміно)фосфоній гексафлуорфосфат МТБЕ: метил трет-бутиловий етер МіБК: метил ізобутил кетон Реагент Бредерека: трет-бутоксибіс(диметил-аміно)метан Отримання сполуки формули (II) Сполуки формули (II) можуть існувати у двох таутомерних формах: Отримання 1,1 N,1,5-Триметил-1Н-індол-2-амін гідрохлорид А) N'-(4-Метилфеніл)ацетогідразид 4,8г 1-(4-метилфеніл)гідразину гідрохлориду суспендують у 525мл ізопропілацетату, розчин 104,8г калій карбонату у 300мл води додають та тоді суміш перемішують, доки не зникає твердий продукт. 77,4г оцтового ангідриду додають, тримаючи температур нижче 20°С та тоді суміш перемішують при 20°С. Спостерігають утворення осаду, котрий зникає, коли суміш гріють приблизно при 55-60°С. Органічну фазу промивають двічі 200мл води та тоді охолоджують при 0-5°С протягом ночі. Утворений продукт збирають фільтруванням та тоді промивають двічі 100мл МТБЕ. ЯМР CDCI 3 (300МГц): 2,02млн-1: s: 3Н; 2,29млн-1: s: 3Н; 6,14млн-1: d: 1H; 6,73млн-1: d: 2H; 7,03млн-1: d: 2H; 7,72млн-1: s: 1H. B) N,N'-Диметил-N'-(4-метилфеніл)ацетогідразин 60г гідразину з попереднього етапу та 11,8г тетрабутиламоній броміду суспендують у 240мл толуєну та 292г 50% NaOH у воді та тоді додають 155,6г метилйодиду. 83г гранул натрій гідроксиду тоді додають і реакційне середовище гріють при 80°С протягом 6 годин. Суміш охолоджують до 30-35°С та тоді додають 500мл води. Органічну фазу промивають тричі 100мл води. Органічну фазу сушать азеотропною відгонкою води під зменшеним тиском. ЯМР CDCL3 (300МГц): 2,15млн-1: s: 3Н; 2,31млн-1: s: 3Н; 2,95млн-1: s: 3Н; 3,10млн-1: s: 3Н; 6,63млн-1: d: 2H; 7,13млн-1: d: 2H. C) N,1,5-Триметил-1Н-індол-2-амін гідрохлорид Продукт, отриманий на попередньому етапі розчиняють у толуєні, 61,5г фосфор оксихлориду додають та суміш гріють при 80°С протягом 2 годин. 100мл етилацетату додають при 80°С та тоді середовище охолоджують до зовнішньої температури. Осад відфільтровують та тоді промивають двічі 50мл етилацетату, точк.пл.=222°С. ЯМР d6-ДМСО (200МГц): 2,36млн-1: s: 3Н; 3,11млн-1: s: 3Н; 3,49млн-1: s: 3Н; 4,29млн-1: s: 1H; 7,257,35млн-1: суцільний пік: 3Н; 10,07млн-1: суцільний пік: 1Н. Отримання 1,2 Ν,5-Диметил-1Н-індол-2-амін дигідрохлорид А) N'-(4-метилфеніл)ацетогідразид Інший спосіб отримання цієї сполуки описано нижче. 5г 1-(4-метилфеніл)гідразин гідрохлорид розчиняють у воді та додають триетиламін до нейтралізації солі. Проводять екстракцію AcOEt та тоді екстракт випарюють до сухого стану. Утворений осад розчиняють у 30мл етеру та тоді додають краплями розчин 4,6мл оцтового ангідриду у 30мл етеру. Суміш перемішують при 0°С протягом 15 хвилин та тоді утворений осад відфільтровують, отримуючи 3г очікуваної сполуки. ЯМР CDCI3 (300МГц): 2,02млн-1: s: 3Н; 2,29млн-1: s: 3Н; 6,14млн-1: d: 1H; 6,73млн-1: d: 2H; 7,03млн-1: - d: 2H; 7,72млн-1: s: 1H. B) N-Метил-N'-(4-метилфеніл)ацетогідразид: 0,8г 60% NaH суспендують у 30мл ДМФ. 3,2г отриманого на попередньому етапі гідразину у 20мл ДМФ додають краплями при 0°С. Коли припиняється виділення газу, 1,8мл метилйодиду додають та суміш перемішують при зовнішній температурі протягом одної години. Суміш виливають у насичений розчин амоній хлориду та тоді проводять екстракцію АсОЕt. Проводять промивку кілька разів насиченим розчином хлориду натрію та тоді випарювання проводять до сухого стану. Залишок очищають хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/гептан, (25/75; за об'ємом) тоді (50/50; за об'ємом), отримуючи 1,0г очікуваної сполуки у формі білого порошку. ЯМР CDCL3 (200МГц): 2,21млн-1: s: 3Н; 2,32млн-1: s: 3Н; 3,15млн-1: s: 3Н; 5,88млн-1: s: 1H; 6,64млн-1: d: 2H; 7,12млн-1: d: 2H. C) N,5-Диметил-1Н-індол-2-амін дигідрохлорид. 1,0г сполуки з попереднього етапу розчиняють у 20мл РОСІ 3 та тоді суміш гріють при 100°С протягом двох годин. Реакційну суміш охолоджують та тоді додають етер. Утворений осад відфільтровують та промивають етером, отримуючи 1,3г очікуваної сполуки. ЯМР d6-ДМСО (300МГц): 2,31млн-1: s: 3Н; 3,05млн-1: s: 3Н; 4,14млн-1: s: 2H; 7,07-7,23млн-1: суцільний пік: 3Н; 10,51млн-1: s: 1H; 12,37млн-1: d: 1H. Отримання 1,3 Ν,1-Диметил-5-метокси-1Н-індол-2-амін гідрохлорид А) N'-(4-Метоксифент)ацетонгідразид 10г 4-метоксифенілгідразину гідрохлориду розчиняють у воді та тоді триетиламін додають до нейтралізації солі. Проводять екстракцію AcOEt та тоді екстракт випарюють до сухого стану, отримуючи 8г осаду 4-метоксифеніл-гідразину. Цю сполуку розчиняють у 30мл етеру та тоді додають краплями розчин 13мл оцтового ангідриду у 30мл етеру. Суміш перемішують при 0°С протягом 15 хвилин та тоді білий утворений осад відфільтровують, отримуючи 7,4г очікуваної сполуки. ЯМР CDCI 3 (200МГц): 2,06млн-1: s: 3Н; 3,75млн-1: s: 3Н; 5,65 та 6,03млн-1: 2s: 2H; 6,6-6,9млн-1: суцільний пік: 4Н. В) N,N'-Диметил-N'-(4-метоксифент)ацетогідразид 4,3г 60% NaH суспендують у 30мл ДМА. 7,4г сполуки з попереднього етапу; у 20мл ДМА, додають краплями. Коли припиняється виділення газу, додають 10,0мл йодметану. Суміш перемішують при зовнішній температурі протягом одної години, виливають у насичений розчин амоній хлориду та тоді проводять екстракцію AcQEt. Органічну фазу промивають кілька разів насиченим розчином хлориду натрію та тоді випарюють до сухого стану. Отриманий залишок розтирають у петролейному ефірі, отримуючи 8,0г очікуваної сполуки у формі масла. ЯМР CDCL3 (200МГц): 2,19млн-1: s: 3Н; 2,93млн-1: s: 3H; 3,08млн-1: s: 3Н; 3,80млн-1: s: 3Н; 6,68млн-1: d: 2H; 6,89млн-1: d: 2H. N-Диметил-5-метокси-1Н-індол-2-амін гідрохлорид 8,0г сполуки з попереднього етапу розчиняють у 30мл РОСІ 3 та тоді суміш гріють при 80°С протягом 2 годин. Реакційну суміш охолоджують та тоді додають етер. Коричневий утворений осад відфільтровують та промивають етером, отримуючи 5,3г очікуваної сполуки, точк.пл.=222°С. ЯМР d6-ДМСО (300МГц): 3,06млн-1: s: 3Н; 3,48млн-1: s: 3Н; 3,76млн-1: s: 3Н; 4,26млн-1: s: 2H; 6,967,00млн-1: dd: 1H; 7,14млн-1: d: 1H; 7,24млн-1: d: 1H; 10,08млн-1: s: 1H. Отримання 1,4 Ν,1-диметигь5-хпор-1Н-iндол-2-амін гідрохлорид A) N'-(4-Хлорфеніл)ацетогідразид 12,5г 4-хлорфенілгідразину гідрохлориду розчиняють у 100мл води та тоді додають триетиламін до нейтралізації солі. Проводять екстракцію AcOEt та тоді екстракт випарюють до сухого стану. Основу розчиняють у 100мл етеру, розчин охолоджують до 0°С та тоді додають краплями 15мл оцтового ангідриду. Суміш перемішують при 0°С протягом 15 хвилин. Білий утворений осад відфільтровують та тоді промивають етером, отримуючи 12,8г очікуваної сполуки у формі білого порошку. ЯМР CDCI 3 (200МГц): 2,09млн-1: s: 3Н; 6,68-6,86млн-1: суцільний пік: 2Н; 7,12-7,30млн-1: суцільний пік: 2Н. B) N,N'-Диметил-N'-(4-хлорфеніл)ацетогідразид 7,2г 60% NaH суспендують у 30мл ДМА. 12,8г гідразину з попереднього етапу, у 50мл ДМА, додають краплями та суміш перемішують при зовнішній температурі до припинення виділення газу. 17мл йодметану додають краплями та суміш перемішують при зовнішній температурі протягом одної години. Суміш виливають у насичений розчин NH4CI та тоді проводять екстракцію AcOEt. Органічну фазу промивають насиченим розчином хлориду натрію. Отриманий залишок розтирають у петролейному ефірі, отримуючи 10г очікуваної сполуки у кристалічній формі. ЯМР CDCI 3 (200МГц): 2,10млн-1: s: 3Н; 2,95млн-1: s: 3Н; 3,10млн-1: s: 3Н; 6,62млн-1:d:2H; 7,24млн-1: d: 2H. С) N,1-диметил-5-хпор-1Н-індол-2-амін гідрохлорид 10г сполуки з попереднього етапу розчиняють у 50мл РОСІ 3. Суміш гріють при температурі кипіння під зворотним холодильником протягом двох годин. Реакційне середовище охолоджують, додають етер та тоді отриманий продукт відфільтровують. Осад промивають кілька разів етером, отримуючи 9,6г очікуваної сполуки у формі порошку. ЯМР d6-ДМСО (300МГц): 3,08млн-1: s: 3Н; 3,52млн-1: s: 3Н; 4,31млн-1: s: 2H; 7,34млн-1: d: 1H; 7,48млн-1: d: 1H; 7,60млн-1: s: 1H; 10,61млн-1: s: 1H. Отримання 1,5 Метил 1-метил-2-(метиламіно)-1Н-індол-5-карбоксилат, А): Метил 4-(2-ацетилгідразино)бензоат 5,5г метил 4-гідразинобензоату розчиняють у 38,2мл АсОН, що містить 2,4г натрій ацетату, та суміш гріють при 80°С протягом 18 годин. Неорганічний матеріал відфільтровують, фільтрат тоді випарюють та залишок розчиняють у мінімальній кількості діетилового етеру. Суміш фільтрують, отримуючи 7,97г очікуваної сполуки. B) Метил 4-(2-ацетил-1,2-диметилгідразино)бензоат 2,95г 95% NaH суспендують у 90мл ДМФ, 8,135г сполуки з попереднього етапу, у розчин у мінімальній кількості ДМФ, додають краплями та тоді, через кілька хвилин, додають краплями 9,75мл метилйодиду. Суміш перемішують при зовнішній температурі протягом одної години. Середовище виливають у насиченому розчині амоній хлориду та проводять екстракцію AcOEt. Органічну фазу промивають розчином хлориду натрію, сушать та випарюють, отримуючи 5,4г очікуваної сполуки. C) Метил 1-метил-2-(метиламіно)-1Н-індол-5-карбоксилат 5,4г сполуки з попереднього етапу та 62мл фосфор оксихлориду змішують та суміш гріють при 80°С протягом 2,5 годин. Середовищ випарюють та залишок розчиняють у AcOEt. Утворений твердий продукт відфільтровують, промивають AcOEt та сушать, отримуючи 4г очікуваної сполуки. ЯМР MeOD (250МГц): 3,2млн-1: s: 3Н; 3,6млн-1: s: 3Н; 3,9млн-1: s: 3Н; 7,3-7,4млн-1: суцільний пік: 2Н; 8,18,2млн-1: суцільний пік: 2Н. Сполуки формули (II) у таблиці нижче отримують як описано вище: Отримання 1,17 Етил 2-(метиліміно)індолін-5-карбоксилат гідрохлорид А) Етил 4-гідразинобензоат 5,0г 4-фенілгідразинову кислоту розчиняють у 70мл етанолу та 3мл концентрованої сульфатної кислоти. Суміш гріють при температурі кипіння під зворотним холодильником протягом п'яти годин, етанол випарюють, залишок тоді розчиняють у насиченому розчині калій карбонату та тоді проводять екстракцію AcOEt. 5,9г очікуваної сполуки отримують у формі порошку. ЯМР CDCI 3 (300МГц): 1,38млн-1: t: 3H; 3,65млн-1: s: 2H; 4,34млн-1: q: 2H; 5,57млн-1: s: 1H; 6,80млн-1: d: 2H; 7,93млн-1: d: 2H. B) Етил 4-(N'-ацетилгідразино)бензоат: 5,9г сполуки з попереднього етапу розчиняють у 50мл оцтової кислоти, та 3,0г додають натрій ацетату. Суміш гріють при 80°С протягом 16 годин. Оцтову кислоту випарюють, залишок розчиняють у воді та тоді проводять екстракцію СН2СІ 2. Органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану. 4,2г порошку отримують. ЯМР CDCI 3 (300МГц): 1,36млн-1: t: 3Н; 2,04млн-1: s: 3Н; 4,32млн-1: q: 2H; 6,63млн-1: s: 1H; 6,73млн-1: d (J=8,8): 2H; 7,88млн-1: d: 2H; 8,00млн-1: s: 1H. C) Етил 4-(N'-ацетил-N'-метилгідразино)бензоат 0,72г 60% NaH суспендують у 20мл ДМФ. Суміш охолоджують до 0°С та тоді додають 4,0г сполуки з попереднього етапу у 20мл ДМА,. Суміш перемішують при 0°С протягом 15 хвилин, тоді 1,7мл йодметану додають та суміш перемішують при 0°С протягом 30 хвилин. Це виливають у насичений розчин амоній хлориду та екстрагують AcOEt. Органічну фазу промивають насиченим розчином хлориду натрію, сушать безводним магній сульфатом та тоді абсорбують на діоксиді силіцію. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 50/50). 1,8г масла отримують. ЯМР CDCI 3 (300МГц): 1,38млн-1: t: 3Н; 2,15млн-1: s: 3Н; 3,17млн-1: s: 3Н; 4,35млн-1: q (J=7,1): 2H; 6,10млн-1: s: 1H; 6,71млн-1: d (J=8,8): 2H; 7,99млн-1: d:2H. D) Етил 2-(метиліміно)індолін-5-карбоксилат гідрохлорид 1,5 г сполуки з попереднього етапу розчиняють у 10мл РОСІ 3. Суміш гріють при 80°С протягом двох годин. Реакційне середовище охолоджують, додають етер та утворений осад розтирають та відфільтровують. Це промивають етером. 1,4г порошку отримують. ЯМР CDCI 3 (300МГц): 1,31млн-1: t (J=7,1): 3Н; 3,07млн-1: d (J=4,7): 3Н; 4,25млн-1: s: 2H; 4,31млн-1: q: 2Н; 7,58млн-1: d (J=8,8): 1Н; 7,99млн-1: суцільний пік: 2Н; 10,97млн-1: s: 1H; 12,81млн-1: s: 1H. Отримання 1,18 5-Бром-N-метил-1Н-індол-2-амін гідрохлорид A) N'-(4-Бромфеніл)фoрмогідразид. 10,0г 4-бромфенілгідразину гідрохлориду розчиняють у 30мл води. 6,2г калій карбонату та 36мл метилформіату додають та тоді суміш гріють при температурі кипіння під зворотним холодильником протягом одної години та тоді при зовнішній температурі протягом 12 годин. Утворений осад відфільтровують та промивають сумішшю ізопропанол/петролейний ефір (за об'ємом; 50/50) суміш. 10,5г очікуваного продукту отримують. ЯМР CDCI 3 (300МГц): 6,73-6,77млн-1: суцільний пік: 2Н; 7,34-7,41млн-1: суцільний пік: 2Н; 8,33млн-1: суцільний пік: 1Н. B) N'-(4-Бромфенiл)-N-метилацетоп'дразид Розчин 80мл LAH у ТГФ гріють до температури кипіння під зворотним холодильником. 10,5г сполуки з попереднього етапу, у суспензії у 60мл ТГФ додають. Суміш гріють при температурі кипіння під зворотним холодильником протягом 15 годин. Реакційне середовище охолоджують та тоді 2,3мл води, тоді 9,0мл 1Η NaOH та тоді знов 10мл води додають краплями. Солі відфільтровують через CeliteÒ, проводять промивку AcOEt та тоді проводять випарювання до сухого стану. Залишок розчиняють у 80мл AcOEt, тоді 17г калій карбонату у 80мл води, додають, а потім 4,0 л оцтового ангідриду. Суміш перемішують при зовнішній температурі протягом одної години. Дві фази відокремлюють та органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану. Додають петролейний ефір та тоді утворені кристали відфільтровують. 9,0г очікуваного продукту отримують. ЯМР CDCI 3 (300МГц): 2,15млн-1: s: 3H; 3,13млн-1: s: 3Н; 6,57-6,62млн-1: суцільний пік: 2Н; 7,32-7,40млн-1: суцільний пік: 2Н. C) 5-Бром-N-метил-1Н-індол-2-амін гідрохлорид 9,0г гідразину, отриманого на попередньому етапі, розчиняють у 50мл РОСІ 3 та тоді суміш гріють при 80°С протягом двох годин. Реакційну суміш охолоджують та тоді додають етер. Утворений осад відфільтровують та промивають етером. 8,2г порошку отримують. ЯМР CDCI 3 (300МГц): 4,31млн-1: s: 3Н; 7,14-7,87млн-1: суцільний пік: 4Н; 10,70млн-1: суцільний пік: 1Н; 12,62млн-1: s: 1H. Отримання 1,19 8-Метил-1,2,3,4-тетрагідропіримідо[1,2-а]-індол А) 1-(4-Метилфеніл)піразолідин-3-он 10г п-толілгідразину гідрохлориду розчиняють у 100мл безводного СН2СІ2. Розчин охолоджують до 0°С та додають 19мл ДБУ та тоді 6,5мг 3-бромпропіонілхлорид. Суміш перемішують при зовнішній температурі протягом одної години. Реакційне середовище виливають у воду, проводять екстракцію СН2СІ 2 та тоді проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 50/50). 1,3г кристалів отримують. ЯМР CDCI 3 (300МГц): 2,35млн-1: s: 3Н; 2,54млн-1: t (J=7,9): 2H; 3,89млн-1: q (J=7,9): 2H; 6,93-7,16млн-1: суцільний пік: 4Н; 8,22млн-1: s: 1H. В) 1-ацетил-2-(4-метилфеніл)піразолідин 1,3г сполуки з попереднього етапу, у 20мл безводного ТГФ, додають до 9,6мл 1Μ розчину LAH у ТГФ. Суміш гріють при температурі кипіння під зворотним холодильником протягом 18 годин. Це охолоджують до зовнішньої температури, 2мл води та 7мл 1Η розчину натрій гідроксиду тоді додають, та тоді солі відфільтровують через CeliteÒ. Фільтрат випарюють та залишок розчиняють у 20мл AcOEt. 2,6г калій карбонату та 5мл води додають, а потім 0,6мл оцтового ангідриду. Суміш перемішують при зовнішній температурі протягом одної години. Дві фази відокремлюють та органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану. 1,4г масла отримують. ЯМР CDCI 3 (300МГц): 1,93-2,05млн-1: суцільний пік: 2Н; 2,07млн-1: s: 3Н; 2,30млн-1: s: 3Н; 3,50млн-1: суцільний пік: 4Н; 6,83-7,11млн-1: суцільний пік: 4H. С) 8-Метил-1,2,3,4-тетрагідропіримідо[1,2-а]індол 1,4г сполуки з попереднього етапу розчиняють у 10мл РОСІ3. Суміш гріють при 80°С протягом одної години 30 хвилин. Реакційне середовище охолоджують, додають етер та тоді утворений осад відфільтровують та промивають етером. 1,4г очікуваної сполуки отримують у форм порошку. ЯМР d6-ДМСО (300МГц): 2,06-2,14млн-1: суцільний пік: 2Н; 2,33млн-1: s: 3Н; 3,50млн-1: суцільний пік: 2Н; 3,84-3,88млн-1: суцільний пік: 2Н; 4,15млн-1: s: 2H; 7,15-7,29млн-1: суцільний пік: 3Н; 10,84млн-1: s: 1H. Отримання інтермедіатів формул (III) та (IV) Отримання 2,1 Метил 2-(3,5-дифлуорфеніл)-3-диметил-аміно-2-пропеноат (IV) A) Метил (3,5-дифлуорфеніл)ацетат Розчин, що містить 25мл ацетилхлорид у 250мл метанолу отримують при 0°С, тоді, при зовнішній температурі, 25,5г 3,5-дифлуорфенілоцтової кислоти розчиняють у цьому розчині та розчин перемішують при зовнішній температурі. Реакцію контролюють тонкошаровою хроматографією. Після зникнення вихідного матеріалу середовище випарюють під зменшеним тиском та тоді залишок розчиняють у 250мл МТБЕ. Органічну фазу промивають тричі 100мл води, сушать безводним магній сульфатом та тоді випарюють до сухого стану під зменшеним тиском. 26,9г очікуваної сполуки отримують. B) Метил 2-(3,5-дифлуорфеніл)-3-диметиламіно-2-пропеноат 26,9г сполуки з попереднього етапу розчиняють у 61мл диметокси-Ν,Ν-диметилметанаміну. Суміш гріють при 135-140°С та утворений метанол відганяють (12г). Розчинник випарюють під зменшеним тиском та залишок розчиняють у 250мл МТБЕ. Органічну фазу промивають тричі 50мл води, тоді сушать безводним магній сульфатом та випарюють-до сухого стану. Залишок перекристалізовують з метилциклогексану. Утворений продукт відфільтровують та тоді промивають двічі 25мл метилциклогексану, отримуючи 28г очікуваної сполуки, Точк.пл.=97°С. Отримання 2,2 Етил 2-(3,5-дифлуорфеніл)-3-гідрокси-2-пропеноат (III) A) Етил 3,5-дифлуорфенілацетат 5г 3,5-дифлуорфенілоцтової кислоти розчиняють у 50мл етанолу та 3мл концентрованої сульфатної кислоти, та суміш гріють при температурі кипіння під зворотним холодильником протягом двох годин. Суміш випарюють до сухого стану, тоді проводять нейтралізацію насиченим розчином калій карбонату, тоді проводять екстракцію AcOEt та органічну фазу випарюють, отримуючи 5,0г очікуваної сполуки у формі безбарвної рідини. ЯМР CDCI 3 (200МГц): 1,27млн-1: t: 3H; 3,59млн-1: s: 2H; 4,18млн-1: q: 2H; 6,68-6,85млн-1: суцільний пік: 3Н. B) Етил 2-(3,5-дифлуорфеніл)-3-гідрокси-2-пропеноат 5,0г етил 3,5-дифлуорфенілацетату розчиняють у 50мл етилформіату. 2,0г 60% NaH додають порціями. Суміш виливають у 1Η розчин хлоридної кислоти та тоді проводять екстракцію AcOEt. Залишок розтирають у петролейному ефірі, залишковий білий осад відфільтровують та тоді фільтрат випарюють, отримуючи 3,3г очікуваної сполуки у формі рідини. ЯМР CDCI 3 (200МГц): 1,33млн-1: t: 3Н; 4,34млн-1: q: 2H; 6,69-7,38млн-1: суцільний пік: 4Н; 12,16млн-1: суцільний пік: 1Н. Отримання 2,3 Етип 2-(3,5-диметилфеніл)-3-гідрокси-2-пропеноат (III) 10мл етил 2-(3,5-диметилфеніп) ацетат розчиняють у 80мл етилформіату. 5г 50% NaH додають порціями та тоді суміш перемішують при зовнішній температурі протягом 12 годин. Суміш виливають у 1Η розчин хлоридної кислоти та тоді проводять екстракцію AcOEt. Органічну фазу випарюють, отримуючи очікувану сполуку, що застосовують як є на наступному етапі. Отримання 2,4 Етил 2-(4-метоксифеніл)-3-гідрокси-2-пропеноат (IIІ) 8,9мл етил п-метоксифенілацетату розчиняють у 80мл етилформіату. 4,6г 50% NaH додають порціями та тоді суміш перемішують при зовнішній температурі протягом 12 годин. Це виливають у 1Η розчин хлоридної кислоти та тоді проводять екстракцію AcOEt. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/гептан (05/95; за об'ємом), отримуючи 4,0г очікуваної сполуки у рідкій формі. ЯМР CDCI 3 (200МГц): 1,30млн-1: t: 3Н; 3,83млн-1: s: 3Н; 4,29млн-1: q: 2H; 6,89-7,21млн-1: суцільний пік: 5Н. Отримання 2,5 Метил 2-[4-(бензилокси)феніл]-3-диметил-амінопропеноат (IV) 200мкл тетраметилетилендіаміну додають до 5г метил 2-[4-(бензилокси)феніл]ацетату у 5,2мл диметокси-N,N-диметилметанамiну, та суміш перемішують при 130°С протягом трьох годин. Після охолодження до зовнішньої температури, додають етилацетат та 60мл амоній хлорид, суміш перемішують протягом п'яти хвилин, органічну фазу відокремлюють та водну фазу екстрагують двічі етилацетатом. Після випарювання розчиннику під зменшеним тиском та тоді обробки активованим вугіллям, 4,16г очікуваної сполуки збирають після промивки твердого продукту пентаном. ЯМР CDCI 3 (200МГц): 2,66млн-1: s: 3Н; 3,62млн-1: s: 3Н; 5,45млн-1: s: 2H; 6,91млн-1: d: 2Н; 7,14млн-1: d: 2Н; 7,55млн-1: суцільний пік: 5Н; 7,57млн-1: s: 1H. Отримання 2,6 Етил 2-(3-бромфеніл)-3-гідрокси-2-пропеноат (III) А) Етил 3-бромфенілацетат 5г 3-бромфенілоцтової кислоти розчиняють у 80мл етанолу, 3мл концентрованої сульфатної кислоти додають та тоді суміш гріють при температурі кипіння під зворотним холодильником протягом двох годин. Етанол випарюють, нейтралізацію проводять насиченим розчином калій карбонату та тоді проводять екстракцію AcOEt. Органічну фазу сушать безводним магній сульфатом. 5,2г очікуваної сполуки отримують у рідкій формі. ЯМР CDCI 3 (300МГц): 1,18млн-1: t: 3H; 3,50млн-1: s: 2Н; 4,08млн-1: q: 2H; 7,09-7,37млн-1: суцільний пік: 4Н. В) Етил 2-(3-бромфеніл)-3-гідрокси-2-пропеноат (III) 5,2г сполуки з попереднього етапу розчиняють у 70мл етилформіату, та 1,7г 60% NaH додають порціями. Суміш перемішують при зовнішній температурі протягом п'яти годин. Це виливають у 100мл 1Η водного розчину хлоридної кислоти та тоді проводять екстракцію AcOEt. Органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану. 5,8г очікуваної сполук отримують у формі масла. ЯМР CDCI 3 (300МГц): 1,9млн-1: t: 3H; 4,20млн-1: q: 2H; 7,11-7,42млн-1: суцільний пік: 5Н; 12,06млн-1: d: 1Η. Інтермедіати формули (111) у нижченаведеній таблиці отримують способами згідно з вищеописаними отриманнями: Отримання 2,28 Етил 2-(6-хлор-1,3-бензодіоксол-5-іл)-3-гідроксіакрилат А) 5-Бромметил-6-хлор-1,3-бензодіоксол 2,5г 6-хлорпіпероніловий спирт розчиняють у 80мл етилового етеру. Розчин охолоджують до 0°С та тоді додають 1,9мл РВr3. Суміш перемішують при зовнішній температурі протягом 18 годин. Це виливають на лід та тоді проводять екстракцію AcOEt. Органічну фазу промивають насиченим розчином хлориду натрію. 3,3г порошку отримують. ЯМР CDCI 3 (300МГц): 4,47млн-1: s: 2H; 5,92млн-1: s: 2H; 6,77млн-1: s: 1H; 6,88млн-1: s:1H. B) (6-Хлор-1,3-бензодіоксол-5-іл)ацетонітрил 3,3г сполуки з попереднього етапу розчиняють у 70мл етанолу та 15мл води. 1,8г калій ціаніду додають та тоді суміш гріють при температурі кипіння під зворотним холодильником протягом 5 годин. Етанол випарюють, залишок розчиняють у воді та тоді проводять екстракцію AcOEt. Органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану. 2,4г масла отримують. ЯМР CDCI 3 (300МГц): 3,75млн-1: s: 2H; 6,02млн-1: s: 2H; 6,88млн-1: s: 1H; 6,95млн-1: s: 1H. C) Етил (6-хлор-1,3-бензодіоксол-5-іл)ацетат 2,4г сполуки з попереднього етапу розчиняють у 80мл етанолу та 4мл концентрованої сульфатної кислоти. Суміш гріють при температурі кипіння під зворотним холодильником протягом 48 годин. Етанол випарюють, залишок розчиняють у воді та тоді проводять екстракцію AcOEt. Органічну фазу промивають насиченим розчином хлориду натрію, сушать безводним магній сульфатом та тоді випарюють до сухого стану. 2,9г масла отримують, це масло містить приблизно 20% вихідного матеріалу. ЯМР CDCI 3 (300МГц): 1,26млн-1: t (J=6,9): 3H; 3,68млн-1: s: 2H; 4,15-4,23млн-1: q (J=6,9): 2H; 5,98млн-1: s: 2H; 6,77млн-1: s: 1H; 6,87млн-1: s: 1H. D) Етил 2-(6-хлор-1,3-бензодіоксол-5-іл)-3-гідроксіакрилат 2,9г сполуки з попереднього етапу розчиняють у 60мл етилформіату. 1,0г 60% NaH додають та тоді суміш перемішують при зовнішній температурі протягом 5 годин. Це виливають у 100мл 1Η розчину хлоридної кислоти та тоді проводять екстракцію AcOEt. Органічну фазу сушать безводним магній сульфатом та випарюють до сухого стану. 3,2г масла отримують, це масло застосовують як є для продовження. Отримання 2,29 Етил 2-(3-гідроксифеніл)-3-диметиламіно-акрилат A) Метил (3-гідроксифеніл)ацетат 10г 3-гідроксифенілоцтової кислоти розчиняють у 60мл метанолу та 2,5мл сульфатної кислоти. Розчин гріють при температурі кипіння під зворотним холодильником протягом двох годин. Це доводять назад до зовнішньої температури та метанол випарюють. Залишок розчиняють у насиченому розчині калій карбонату. Проводять екстракцію AcOEt. Органічну фазу сушать безводним магній сульфатом, фільтрують та випарюють до сухого стану. 11,1г масла отримують. ЯМР d6-ДМСО (300МГц): 3,57млн-1: s: 3Н; 3,61млн-1: s: 2H; 6,66млн-1: суцільний пік: 3Н; 7,09млн-1: суцільний пік: 1Н; 9,42млн-1: s: 1H. B) Етил (3-бензилоксифеніл)ацетат 3г сполуки з попереднього етапу розчиняють у 13мл етанолу, додають 3,75г калій карбонату, 3,12мл бензилхлориду та кінчиком шпателя nВu4 NI. Суміш гріють при температурі кипіння під зворотним холодильником протягом 6 годин. Це доводять назад до зовнішньої температури, проводять фільтрування через калій карбонат та проводять випарювання до сухого стану. Залишок розчиняють у AcOEt та органічну фазу промивають водою. 5г масла отримують. ЯМР d6-ДМСО (300МГц): 1,19млн-1: t: 3Н; 3,64млн-1: s: 2H; 5,08млн-1: s: 2H; 6,85-6,98млн-1: суцільний пік: 2Н; 7,22-7,51млн-1: суцільний пік: 7Н. C) Етил 2-(3-гідроксифеніл)-3-диметиламіноакрилат 5г сполуки з попереднього етапу розчиняють у 8мл диметилацеталю диметилформаміду (DMFDMA). Розчин гріють при 135°С протягом 24 годин, додаючи 1мл DMFDMA кожні три години приблизно. Суміш випарюють до сухого стану. 6г масла отримують. Інтермедіати формули (IV) у таблиці нижче отримують згідно з Отриманням 2,1: Отримання 3,13 Етил 2-(4-бром-2-хлорфеніл)-3-диметил-аміноакрилат А) 4-Бром-1-бромметил-2-хлорбензен 5,0г 2-хлор-4-бромтолуєн розчиняють у 120мл ССI 4. 4,3г N-БС та 1,6г А. додають IBN. Суміш гріють при температурі кипіння під зворотним холодильником протягом 15 годин, додають воду, дві фази відокремлюють та тоді проводять екстракцію СН2СI 2. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи у петролейному ефірі. 3,8г рідини отримують. CDCI 3 (300МГц): 4,48млн-1: s: 2H; 7,23-7,36млн-1: суцільний пік: 2Н; 7,51млн-1: s: 1H. В) (4-Бром-2-хлорфеніл)ацетонітрил 3,8г сполуки з попереднього етапу розчиняють у 70мл етанолу та 15мл води. 1,7г калій ціаніду додають та тоді суміш гріють при температурі кипіння під зворотним холодильником протягом 5 годин. Етанол випарюють, залишок розчиняють у воді та тоді проводять екстракцію AcOEt. 2,5г масла отримують CDCI 3 (300МГц): 3,79млн-1: s: 2Н; 7,35-7,49млн-1: суцільний пік: 2Н; 7,59млн-1: s: 1H. С) Етил (4-бром-2-хлорфеніл)ацетат 2,5г сполуки з попереднього етапу розчиняють у 80мл етанолу та 4мл концентрованої сульфатної кислоти. Розчин гріють при температурі кипіння під зворотним холодильником протягом чотирьох діб. Етанол випарюють, залишок розчиняють у насиченому розчині калій карбонату, та органічну фазу сушать безводним магній сульфатом та тоді випарюють до сухого стану 2,5г рідини отримують. CDCI 3 (300МГц): 1,28млн-1: t (J=7,1): 3Н; 3,73млн-1: s: 2H; 4,18млн-1: q (J=7,1): 2H; 7,18млн-1: суцільний пік: 1Н, 7,38млн-1: суцільний пік: 1Н; 7,56млн-1: s: 1H. D) Етил 2-(4-бром-2-хлорфеніл)-3-диметиламіноакрилат 2,8г сполуки з попереднього етапу розчиняють у 3,1г реагенту Бредерека. Розчин гріють при 100°С протягом 15 годин та надлишок реагенту випарюють. 2,9г масла отримують. CDCI 3 (300МГц) 1,18млн-1: t (J=7,1): 3Н; 2,72млн-1: s: 6Н; 4,09млн-1: q (J=7,1): 2H; 7,15млн-1: суцільний пік: 1Н; 7,35млн-1: суцільний пік: 1Н; 7,54млн-1: суцільний пік: 1Н; 7,60млн-1: s: 1Н. Приклад 1: Сполука 6 3-(3,5-Дифлуорфеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он 25г сполуки від Отримання 2,1 та 22,5г сполуки від Отримання 1,1 змішують у 75мл оцтової кислоти та суміш гріють при 40°С протягом 24 годин та тоді при 60-65°С протягом 4 годин. Реакційне середовище охолоджують до зовнішньої температури та тоді виливають у 275мл води. Утворений осад збирають, промивають 50мл води та тоді перекристалізовують з 250мл МіБК. Остаточну воду видаляють азеотропною відгонкою при атмосферному тиску. Продукт, так отриманий, промивають двічі 25мл МіБК та тоді сушать при 40-45°С під зменшеним тиском протягом 24 годин, отримуючи 20,33г очікуваної сполуки після кристалізації з МіБК (20,33г), Точк.пл.=240°С. ЯМР d6-ДМСО (200МГц): 2,51млн-1: s: 3Н; 4,05млн-1: s: 6H; 6,69-8,08млн-1: суцільний пік: 7Н. Приклад 2: Сполука 22 3-(3,5-Дифлуорфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он 1,5г гідрохлориду від Отримання 1,2 розчиняють у 50мл піридину. 19г сполуки від Отримання 2,2 додають та суміш гріють при 70°С протягом 20 годин. Суміш випарюють до сухого стану та залишок тоді розчиняють у воді та екстрагують СН2СІ2. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/гептан (50/50; за об'ємом), отримуючи 300мг очікуваної сполуки у формі порошку, Точк.пл.=189°С (розкладання). ЯМР d6-ДМСО (300МГц): 2,51млн-1: s: 3Н; 3,70млн-1: s: 3H; 7,04-8,68млн-1: суцільний пік: 7Н; 11,98млн-1: s: 1Η; Приклад 3: Сполука 16 1,6-Диметил-3-(3,5-диметилфеніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 0,8г сполуки від Отримання 1,2 розчиняють у 50мл піридину. 0,8г сполуки від Отримання 2,3 додають та суміш гріють при; 80°С протягом 20 годин. Суміш випарюють до сухого стану та тоді залишок розчиняють у воді та екстрагують СН2Сl2. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/гептан (50/50; за об'ємом) суміш, отримуючи 500мг очікуваної сполуки, після перекристалізації з ізопропанолу. ЯМР d6-ДМСО (200МГц): 2,23млн-1: s: 6Н; 2,49млн-1: s: 3Н; 3,73млн-1: s: 3Н; 6,84-8,08млн-1: суцільний пік: 7Н; 9,98млн-1: s: 1H. Приклад 4: Сполука 20 6-Метокси-1,9-диметил-3-(3,5-дифлуорсреніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 2,5г сполуки від Отримання 1,3 розчиняють у 70мл піридину. 3,3г сполуки від Отримання 2,2 додають та суміш гріють при 100°С протягом 20 годин. Суміш випарюють до сухого стану та тоді залишок розчиняють у воді та AcOEt. Залишковий осад відфільтровують. Перекристалізацію проводять з ізопропанолу, отримуючи 1,35г очікуваної сполуки, Точк.пл.=189°С. ЯМР CDCI 3 (200МГц): 3,91млн-1: s: 3Н; 4,04млн-1: s: 6H; 6,68-8,05млн-1: суцільний пік: 7Н. Приклад 5: Сполука 1 3-(3,5-Диметилфеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. Цю сполуку отримують зі сполук з отримань 1,1 та 2,3, Точк.пл.=210°С. ЯМР CDCI 3 (200МГц): 2,42млн-1: s: 6H; 2,54млн-1: s: 3Н; 4,07млн-1: s: 6H; 7,00-8,08млн-1: суцільний пік: 7Н. Приклад 6: Сполука 2 3-(2,4-Дихлорфеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. Цю сполуку отримують зі сполук з отримань 1,1 та 2,7, Точк.пл.=170°С. ЯМР CDCI 3 (300МГц): 2,51млн-1: s: 3Н; 4,09млн-1: s: 3Н; 4,11млн-1: s: 3Н; 7,15-8,00млн-1: суцільний пік: 7Н. Приклад 7: Сполука 21 3-(2,4-Дихлорфеніл)-6-метокси-1,9-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. Цю сполуку отримують зі сполук з отримань 1,3 та 2,7, Точк.пл.=130°С. ЯМР CDCI 3 (300МГц): 3,90млн-1: s: 3Н; 4,07млн-1: s: 3Н; 4,09млн-1: s: 3Н; 6,93-7,98млн-1: суцільний пік: 7Н. Приклад 8: Сполука 32 3-(2,4-Дихлорфеніл)-1,5,7,9-тетраметил-1,9-дигідро-2Н-ліридо[2,3-b]індол-2-он. Цю сполуку отримують зі сполук з отримань 1,11 та 2,7, Точк.пл.=204°С. ЯМР CDCI 3 (300МГц): 2,51млн-1: s: 3Н; 2,68млн-1: s: 3Н; 4,10млн-1: s: 6H; 6,91млн-1: s: 1H; 7,05млн-1: s: 1H; 7,31млн-1: dd: 1H; 7,44млн-1: d: 1H; 7,52млн-1: d: 1H; 8,11млн-1: s: 1H. Приклад 9: Сполука 66 3-(4-Гідроксифеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індолон. A) 3-(4-Метоксифеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індолон 2,0г гідрохлориду, отриманого в Отриманні 1,1, розчиняють у 50мл піридину. 2,1г форміл-естеру, отриманого в Отриманні 2,4 додають та суміш гріють при 80°С протягом 20 годин. Суміш випарюють до сухого стану, тоді проводять екстракцію СН2СІ 2 та проводять промивку водою. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/гептан/CH2CI 2 (50/50/50; за об'ємом), отримуючи 0,5г очікуваної сполуки у формі порошку. ЯМР d6-ДМСО (200МГц): 2,50млн-1: s: 3Н; 3,86млн-1: s: 3Н; 4,05млн-1: s: 6H; 6,96-8,04млн-1: суцільний пік: 8Н. B) 3-(4-Гідроксифеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індолон. 18мл ВВr3, у розчині у ДХМ, додають з перемішуванням при -78°С, до 5,36г сполуки з попереднього етапу у 60мл ДХМ. Суміші дають повернутися до зовнішньої температури. Цю суміш тоді перемішують при цій температурі протягом 24 годин. Реакційне середовище розбавляють сумішшю ДХМ та МеОН. Розчин випарюють під зменшеним тиском. Сирий продукт розчиняють у ДХМ та абсорбують на 16г оксиду силіцію та хроматографують на колонці з діоксидом силіцію (97/3; за об'ємом) тоді (95/5; за об'ємом) до (50/50; за об'ємом) ДХМ/МеОН суміш. Твердий продукт збирають та суспендують у суміші ДХМ/МеОН. Отриману суспензію охолоджують та фільтрують. Осад тоді збирають. 4г очікуваної сполуки збирають, що містить 4% вихідної сполуки, Точк.пл.>280°С. ЯМР d6-ДМСО (200МГц): 2,3млн-1: з: 3Н; 3,9млн-1: s: 3Н; 4млн-1 : s: 3Н; 6,6млн-1: d: 2H; 7млн-1: d: 1H; 7,3млн-1: d: 1H; 7,5млн-1 : d: 2H; 7,6млн-1: s: 1H; 8,1млн-1: s: 1H. Приклад 10: Сполука 68 1,6-Диметил-3-(4-гідроксифеніл)-1,9-дигідро-2Н-піридо[2,3-b]індолон. А). 1,6-Диметил-3-(4-бензилоксифеніл)-1,9-дигідро-2Н-піридо[2,3-b]індолон. 1г Ν, 5-диметил-1Н-індол-2-аміну (Отримання 1,2) змішують з 1,4г сполуки від Отримання 2,5 та 10мл оцтової кислоти, а тоді суміш гріють при 100°С протягом 18 годин. Суміш випарюють до сухого стану під вакуумом та тоді залишок розчиняють у 20мл СН2СІ 2 та 5мл води. рН доводять до 71Η розчином гідроксиду натрію з перемішуванням, два шари тоді відокремлюють відстоюванням та органічну фазу промивають розчином хлориду натрію та тоді сушать та випарюють до сухого стану. Залишок розчиняють у 10мл діетилового етеру, проводять фільтрування та тоді органічну фазу промивають та сушать. В) 1,6-Диметил-3-(4-гідроксифеніл)-1,9-дигідро-2Н-піридо[2,3-b]індолон. 0,800г сполуки з попереднього етапу та 50мл ТФОК змішують. Суміш гріють при 75°С протягом 1 години 30 хвилин. Суміш випарюють до сухого стану під вакуумом та тоді залишок розчиняють у 15мл діетилового етеру та проводять сушку, Точк.пл.=186°С. ЯМР d6-ДМСО (300МГц): 2,6млн-1: s: 3Н; 3,8млн-1: s: 3Н; 6,8млн-1 : d: 2H; 7,1млн-1: d: 1Н; 7,4млн-1: d: 1H; 7,6млн-1: d: 2H; 7,8млн-1 : s: 1H; 8,2млн-1: s: 1Н; 11,9млн-1: s: 1H. Приклад 11: Сполука 52 4-(1,6-, 9-Триметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-3-іл)бензонітрил А) 3-(3-Бромфеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 2,5г сполуки від Отримання 1,1 розчиняють у 40мл оцтової кислоти та 60мл піридину; 3,5г сполуки від Отримання 2,6 додають та тоді суміш гріють при 100°С протягом 15 годин. Реакційне середовище виливають у 200мл води та утворений осад відфільтровують. Останній розчиняють у СН2СІ 2 та тоді промивають насиченим розчином хлориду натрію, сушать безводним магній сульфатом та випарюють до сухого стану. Осад розчиняють у суміші AcOEt/цикпогексан (20/8; за об'ємом) та тоді фільтрують. 20г очікуваної сполуки отримують, Точк.пл.=215-216°С. В) 4-(1,6-, 9-Триметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-3-іл)бензонітрил 3г сполуки, отриманої на попередньому етапі розчиняють у 50мл 1-метил-2-піролідинону, 1,4г CuCN додають та тоді суміш гріють при 200°С протягом 4 годин. Реакційне середовище виливають у 100мл СН2СІ 2 та тоді утворений осад відфільтровують. Фільтрат промивають 1Η розчином хлоридної кислоти та тоді сушать безводним магній сульфатом. Продукт, так отриманий, очищають хроматографією на діоксиді силіцію, елювання проводять AcOEt/CH2CI 2 (50/50; за об'ємом) та тоді AcOEt/MeOH/NH3 (90/10/1; за об'ємом). 2,2г очікуваної сполуки збирають у формі порошку. ЯМР CDCl3 (300МГц): 2,52млн-1: s: 3Н; 4,09млн-1: s: 3Н; 4,12млн-1: s: 3Н; 7,16млн-1: суцільний пік: 8Н. Приклад 12: Сполука 53 3-(4-(Амінометил)феніл)-1,6,9-триметил-1,9-диццро-2Н-піридо[2,3-b]індол-2-он. 50мг натрій гідроксиду розчиняють у 11мл етанолу, 0,2г сполуки, отриманої у попередньому прикладі, додають, а потім приблизно 100мг нікелю Рені, та суміш гідрують протягом 24 годин при 50фунт/кв.дюйм. Каталізатор відфільтровують через CeliteÒ, тоді проводять промивку метанолом та проводять випарювання до сухого стану. Залишок розчиняють у 1Η розчині хлоридної кислоти та тоді забруднення екстрагують AcOEt. Розчин підлужують до рН=9 розчином калій карбонату та тоді проводять екстракцію AcOEt, отримуючи 90мг очікуваної сполуки у формі порошку. ЯМР CDCI 3 (300МГц): 2,51млн-1: s: 3Н; 3,91млн-1: s: 2H; 4,08млн-1: s: 6H; 7,13-8,09млн-1: суцільний пік: >8Н. Приклад 13: Сполука 84 Метил (3-(2,4-дихлорфеніл)-1,6-диметил-2-оксо-1,2-дигідро-9Н-піридо[2,3-b]індол-9-іл)ацетат. 1г 3-(2,4-дихлорфеніл)-1,6-диметил-1,9-дигідро[2,3-b]індол-2-ону (сполука 46) розчиняють у 10мл ДМФ, 0,143г 95% NaH додають та після перемішування протягом 30 хвилин додають 0,4мл метилбромацетат. Після перемішування протягом одної години при зовнішній температурі, реакційну суміш випарюють та тоді залишок розчиняють у СН2СІ 2 та промивають розчином натрій гідрогенкарбонату та тоді розчином хлориду натрію. Органічну фазу сушать та тоді випарюють, отримуючи 0,98г очікуваного продукту. Приклад 14: Сполука 85 2-(3-(2,4-Дихлорфеніл)-1,6-диметил-2-оксо-1,2-дигідро-?Н-піридо[2,3-b]індол-9-іл)-N-метил-ацетамід 0,3г естеру, отриманого у попередньому прикладі, та 30мл 33% метиламіну у EtOH змішують. Після перемішування при зовнішній температурі протягом 5 годин, реакційне середовище випарюють та залишок розчиняють у діетиловому етері та тоді проводять фільтрування та сушку, отримуючи 0,260г очікуваної сполуки. Приклад 15: Сполука 81 3-(3-Гідроксиметилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. A) 3-(1,6-Диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]-індол-3-іл)бензальдегід. 450мг 3-(3-ціанофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-ону, 10мл АсОН, 20мл піридину, 2,6г натрій гіпофосфіту та 434мг нікелю Рені змішують та тоді суміш гріють при 60°С протягом 4 годин. Реакційне середовище фільтрують та фільтрат випарюють; залишок розчиняють у 50мл AcOEt/CH2CI 2 (1/1; за об'ємом) та органічну фазу промивають водою, сушать та випарюють, отримуючи очікувану сполуку, точк.пл.=280°С. B) 3-(3-Гідроксиметилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 280мг сполуки, отриманої у Етап А переносять у 10мл СН2СІ 2 та додають мінімальну кількість АсОН до розчинення сполуки, 375мг NaBH(OAc)3 та тоді суміш перемішують при зовнішній температурі протягом 18 годин. Реакційне середовище випарюють та залишок розчиняють у AcOEt та тоді проводять фільтрування, отримуючи 200мг очікуваної сполуки. Приклад 16: Сполука 80 1,6-Диметил-3-(3-((метиламіно)метил)-феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он 280мг сполуки з етапу А попереднього прикладу переносять у 10мл СН2СІ 2 та додають мінімальну кількість АсОН до розчинення сполуки та тоді 375мг NaBH(OAc)3 та 0,064мл метиламіну. Після перемішування при зовнішній температурі протягом 18 годин, тричі проводять екстракцію 10мл води та тоді водну фазу екстрагують AcOEt. Після випарювання, отримують 15мг очікуваної сполуки. Приклад 17: Сполука 83 3-(1,6-Диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-3-іл)бензальдегід оксим 210мг сполуки з прикладу 15, Етап А, розчиняють у 5мл МеОН, 46мг гідроксил аміну гідрохлорид, у розчин у мінімальній кількості води, додають та суміш перемішують при зовнішній температурі протягом двох годин. Суміш випарюють до сухого стану та тоді .залишок хроматографують на діоксиді силіцію, елювання проводять AcOEt/CH2CI 2 (2/8; за об'ємом). 74мг очікуваної сполуки отримують. Приклад 18: Сполука 110 1,6-Диметил-3-(3-метоксикарбонілфеніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он A) 3-(3-Бромфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он Цю сполуку отримують звичайними способами реакцією N,1,5-триметил-1Н-iндол-2-аміну з етил 2-(3бромфеніл)-3-гідрокси-2-пропeноатом. ЯМР d6-ДМСО (200МГц): 2,42млн-1: s: 3Н; 3,69млн-1: s: 3H; 7,04млн-1: d: 1H; 7,35млн-1: d: 1Н; 7,057,08млн-1: суцільний пік: 5Н; 8,30млн-1 : s: 1H; -11,91млн-1: s: 1H. B) 1,6-Диметил-3-(3-метоксикарбонілфеніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 500мг сполуки з попереднього етапу та 140мг 1,3-біс(дифенілфосфіно)пропану розчиняють у 20мл безводного МеОН. 1,9мл 99,9% триетиламіну, 15мл безводного ДМСО та тоді 60мг Pd(OAc)2 додають. CO продувають у реакційне середовище протягом 20 хвилин та середовище гріють при 75°С протягом ночі в атмосфері CO. Середовищу дають повернутися до зовнішньої температури. Реакційне середовище виливають у 200мл води та тоді екстрагують AcOEt. Органічну фазу сушать безводним магній сульфатом фільтрують та випарюють до сухого стану. Залишок очищають на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 75/25) суміш. Осад, так отриманий розтирають з сумішшю AcOEt/петролейний ефір. 260мг порошку отримують. ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 3,70млн-1: s: 3Н; 3,88млн-1: s: 3Н; 7,05млн-1: суцільний пік: 1Н; 7,35млн-1: d (J=8): 1Н; 7,54млн-1: суцільний пік: 1Н; 7,74млн-1: суцільний пік: 1Н; 7,86млн-1: суцільний пік: 1Н; 8,02млн-1: суцільний пік: 1Н; 8,43млн-1 : суцільний пік: 1Н; 11,94млн-1: s: 1H. Приклад 19: Сполука 111 3-(4-Амінофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. А) 3-(4-Бромфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. Цю сполуку отримують звичайними способами реакцією N,1,5-триметил-1Н-індол-2-аміну з етил 2-(4бромфеніл)-3-гідрокси-2-пропеноатом. ЯМР d6-ДМСО (300МГц): 2,35млн-1: s: 3Н; 3,61млн-1: s: 3Н; 3,97млн-1: d: 1H; 7,03млн-1: d: 1Н; 7,457,80млн-1: суцільний пік: 5Н; 8,32млн-1 : s: 1H; 11,85млн-1: s: 1H. В) 3-(4-Амінофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 10мл ТГФ дегазують протягом 10 хвилин та 9,2мг Рd2(dbа)3, тоді 370мг сполуки з попереднього етапу, тоді 9,4мг ліганду 2-дицикло-гексилфосфіно-2'-(N,N-диметиламіно)дифенілу та, під кінець, 2,2мл 1Μ розчину LiN(TMS)2 у ТГФ додають під аргоном. Суміш перемішують у герметичній тубі при 90°С протягом 20 годин. Реакційне середовище охолоджують, тоді 10мл 1Η розчину хлоридної кислоти додають та тоді суміш перемішують при зовнішній температурі протягом 10 хвилин. Дві фази відокремлюють та водну фазу промивають розчин AcOEt та тоді підлужують насиченим розчином калій карбонату. Утворений осад відфільтровують. 90мг отримують. ЯМР d6-ДМСО (300МГц): 2,40млн-1: s: 3Н; 3,65млн-1: s: 3Н; 4,99млн-1: s: 2H; 6,57млн-1: суцільний пік: 2Н; 6,94млн-1: d (J=8,1): 1H; 7,29млн-1: d (J=8,1): 1H; 7,43млн-1: суцільний пік: 2Н; 7,60млн-1: s: 1H; 8,07млн-1: s: 1H. Приклад 20: Сполука 121 1,6-Диметил-1,9-дигідро-3-(феніламіно-феніл)-2Н-піридо[2,3-b]індол-2-он. 13мг Pd2(dba)3, 500мг сполуки з прикладу 18, Етап А, 11мг ліганду 2-дицикло-гексилфосфіно-2'-(N,Nдиметиламіно)дифеніл, 3мл 1Μ розчину LiN(TMS)2 у ТГФ, 127мг аніліну та тоді 10мл безводного діоксану переносять під аргон. Суміш перемішують у герметичній тубі при 65°С протягом 24 годин. Суміш доводять назад до зовнішньої температури та тоді додають AcOEt. Органічну фазу промивають насиченим розчином хлориду натрію. Проводятьочистку на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 50/50) тоді (за об'ємом; 75/25). Отриманий осад розтирають в етері. 55мг очікуваної сполуки отримують у формі осаду, Точк.пл.=188-190°С. ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,68млн-1: s: 3Н; 6,77-8,28млн-1: суцільний пік: 14Н; 12,00млн1 : s: 1H. Приклад 21: Сполука 147 3-(2,4-Диціанофеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 0,6г 3-(2-хлор-4-бромфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-ону розчиняють у 15мл ΝΜΠ. 0,27г CuCN додають та тоді суміш гріють при температурі кипіння під зворотним холодильником протягом 5 годин. Реакційне середовище виливають у СН2СІ 2 та проводять промивку насиченим розчином хлориду натрію. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 75/25) суміш та тоді чистим AcOEt. Зібрані фракції промивають 1Η розчином хлоридної кислоти для видалення залишку Ν-ΜΠ. 50мг очікуваної сполуки отримують у формі порошку. ЯМР d6-ДМСО (300МГц): 2,27млн-1: s: 3Н; 3,70млн-1: s: 3Н; 7,08млн-1: d (J=8,1): 1H; 7,38млн-1: d(J=8,1): 1H; 7,67млн-1: s: 1H; 7,8 5млн-1: d(J=8,2): 1H; 8,15млн-1: d(J=8,2): 1H; 8,45млн-1: суцільний пік: 2Н; 12,11млн-1: s: 1H. Приклад 22: Сполука 143 3-(3-Ацетилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 400мг сполуки 60 розчиняють у 20мл безводного ТГФ. Реакційне середовище охолоджують до 0°С та тоді додають порціями 9,1мл 1,4М CH3Li у ТГФ. Суміші дають повернутися до зовнішньої температури та тоді перемішують протягом 2 годин. Реакційне середовище виливають у 1Η розчин хлоридної кислоти та тоді проводять промивку AcOEt. Водну фазу підлужують 5Η розчином гідроксиду натрію та тоді продукт екстрагують AcOEt. Органічну фазу сушать безводним магній сульфатом, фільтрують та випарюють до сухого стану. Залишок очищають на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 80/20) та тоді чистим AcOEt. 40мг очікуваної сполуки отримують, Точк.пл.=258-260°С. ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 2,63млн-1: s: 3Н; 3,70млн-1: s: 3Н; 7,03-8,43млн-1: суцільний пік: 8Н; 11,92млн-1: s: 1H. Приклад 23: Сполука 127 1,6-Диметил-3-(3-(піридин-2-іламіно)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 500мг сполуки з прикладу 18, Етап А, 180мг 2-амінопіридину, 315мг NaOtBu, 50мг Pd2(dba)3 та 95мг Ксант-фосу розчиняють у 72-мл діоксану (у герметичній тубі). Реакційне середовище дегазують протягом 30 хвилин та тоді гріють при 100°С протягом ночі. Це доводять назад до зовнішньої температури. Після очистки на колонці з діоксидом силіцію, елюючи етилацетатом, отримують 380мг порошку. Точк.пл.=250252°С. ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,70млн-1: s: 3Н; 6,71-8,27млн-1: суцільний пік: 12Н; 9млн-1: s: 1H; 11,88млн-1: s: 1H. Приклад 24: Сполука 94 (3-(1,6-Диметил-2-оксо-2,9-дигідро-2Н-піридо[2,3-3]індол-3-іл)фенокси)ацетонітрил. 0,1г сполуки 66 (Приклад 9) розчиняють у 10мл ДМФ. 90мл розчину калій карбонату та тоді 0,12мл бромацетонітрил додають. Суміш гріють при 90°С протягом 48 годин. Реакційне середовище виливають у насичений розчин амоній хлориду, суміш підлужують натрій гідроксидом та тоді проводять екстракцію AcOEt. Проводять очистку хроматографією на колонці з діоксидом силіцію, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 75/25). 20мг порошку отримують. Точк.пл.=195-196°С. ЯМР d6-ДМСО (300МГц): 2,73млн-1: s: 3Н; 4,27млн-1: s: 6H; 5,02млн-1: s: 2H; 7,09-8,26млн-1: суцільний пік: Приклад 25: Сполука 133 1,6-Диметил-3-(3-(морфолін-4-ілкарбоніл)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. A) 3-(1,6-Диметил-2-оксо-2,9-дигідро-1Н-піридо[2,3-b]індол-3-іл)бензойна кислота 200мг сполуки з прикладу 18 розчиняють у 10мл МеОН. 2мл води та тоді додають 97мг LiOH·H2O. Суміш гріють при 80°С протягом 20 годин. Цьому дають повернутися до зовнішньої температури. МеОН випарюють, залишок розчиняють у воді та тоді водну фазу промивають AcOEt. Водну фазу підлужують 5Η розчином гідроксиду натрію та тоді екстрагують AcOEt. Органічну фазу сушать безводним магній сульфатом, фільтрують та випарюють до сухого стану. Отриманий осад розтирають у суміші петролейному ефіpi/AcOEt (2%). Осад відфільтровують та сушать. 40мг порошку отримують. ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,70млн-1: s: 3Н; 7,04-8,42млн-1: суцільний пік: 8Н; 11,93млн-1: s: 1Н; 12,87млн-1: суцільний пік: 1Н. B) 1,6-Диметил-3-(3-(морфолін-4-ілкарбоніл)феніл)-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 200мг сполуки з попереднього етапу розчиняють у 20мл СН2СІ 2 0,06мл морфоліну, додають 340мг БОФ та 10мл ДМФ. Реакційну суміш перемішують при зовнішній температурі протягом приблизно 2 годин. Реакційне середовище виливають у насичений розчин амоній хлориду та екстрагують AcOEt. Проводять промивку кислотою/основою та тоді отриманий осад промивають сумішшю іРrOН/петролейний ефір (за об'ємом; 50/50). 90мг порошку отримують. Точк.пл.=296-298°С. ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,38-3,62млн-1: s: 8H; 3,69млн-1: s: 3Н; 7,03-8,42млн-1: суцільний пік: 8Н; 11,92млн-1: s: 1H. Приклад 26: Сполука 123 6-Ціано-3-(3,5-диметилфеніл)-1-метил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. А) 6-Бром-3-(3,5-диметилфеніл)-1-метил-1,9-дигідро-1Н-піридо[2,3-b]індол-2-он. Цю сполуку отримують звичайними способами. ЯМР d6-ДМСО (300МГц): 2,31млн-1: s: 6H; 3,69млн-1: s: 3H; 6,91млн-1: s: 1H; 7,28-7,44млн-1: суцільний пік: 4Н; 8,15млн-1: d: 1H; 8,38млн-1: s: 1H; 12,30млн-1: s: 1H. В)6-Ціано-3-(3,5-диметилфеніл)-1-метил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 2,0г сполуки з попереднього етапу розчиняють у 50мл N-метилпіролідинону. 0,9г CuCN додають та тоді суміш гріють при 200°С протягом 24 годин. Реакційне середовище виливають у СН2СІ 2 та тоді проводять промивку 1Η розчином хлоридної кислоти. Продукт абсорбують на діоксиді силіцію та очищають хроматографією на колонці, елюючи сумішшю AcOEt/петролейний ефір (за об'ємом; 50/50) суміш, тоді чистим AcOEt та тоді AcOEt/MeOH 2%. 1,2г порошку отримують. ЯМР d6-ДМСО (300МГц): 2,31млн-1: s: 6H; 3,70млн-1: s: 3H; 6,93млн-1: s: 1H; 7,33млн-1: s: 2Н; 7,58млн-1: суцільний пік: 2Н; 8,42млн-1: суцільний пік: 2Н; 12,55млн-1: s: 1H. Приклад 27: Сполука 96 (3-(2,4-Дихлорфеніл)-1,6-диметил-2-оксо-1,2-дигідро-9Нпіридо[2,3-b]індол-9-іл)ацетонітрил. 600мг сполуки 46 розчиняють у 10мл ДМФ. 42мг 95% NaH додають. Суміш перемішують при зовнішній температурі протягом 30 хвилин та тоді додають 230мг бромацетонітрилу. Суміш перемішують при зовнішній температурі протягом 18 годин. Це концентрують наполовину та проводять осадження додаванням води. 200мг очікуваного продукту отримують, Точк.пл.=270°С. Приклад 28: Сполука 92 9-(3-Амінопропіл)-3-(2,4-дихлорфеніл)-1,6-диметил-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]-індол-2-он гідрохлорид. А) 2-(3-(3-(2,4-Дихлорфеніл)-1,6-диметил-2-оксо-1,2-дигідро-9Н-піридо[2,3-b]індол-9-іл)пропіл)-1Нізоіндол-1,3(2Н)-діон. 0,5г сполуки 46 розчиняють у 5мл ДМФ, 107мг 95% NaH додають та суміш перемішують при зовнішній температурі протягом 10 хвилин. 1,25г 2-(3-бром-пропіл)-1Н-ізоіндол-1,3(2Н)-діону додають та суміш перемішують при зовнішній температурі протягом 18 годин. Суміш випарюють, залишок розчиняють у СН2СІ 2 та органічну фазу промивають розчином хлориду натрію та тоді водою. Хроматографію проводять на діоксиді силіцію, елювання проводять СНСІ 3/МеОН (за об'ємом; 98/2). 160мг очікуваного продукту отримують, Точк.пл.=249°С. В) 9-(3-Амінопропіл)-3-(2,4-дихлорфеніл)-1,6-диметил-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]-індол-2онхлоргідрид. 180мг сполуки з попереднього етапу, 3,2мл ТГФ, 5мл EtOH та 33мкл гідразину гідрату змішують. Суміш гріють при температурі кипіння під зворотним холодильником протягом 18 годин; проводять фільтрування та фазу хлоридної кислоти випарюють. Проводять сушку. 16мг очікуваного продукту отримують, Точк.пл.=198°С. Приклад 29: Сполука 91 3-(2,4-Дихлорфеніл)-9-(2-гідроксіетил)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. А) 3-(2,4-Дихлорфеніл)-1,6-диметил-9-тетрагідро-2Н-піран-2-ілокси)етил)-1,9-дигідро-2Н-піридо[2,3b]індол-2-он 695мг сполуки 46 розчиняють у 7мл ДМФ. 99мг 95% NaH додають. Суміш перемішують при зовнішній температурі протягом 15 хвилин. 813мг 2-(2-брометокси)тетрагідро-2Н-пірану додають та суміш перемішують при зовнішній температурі протягом 18 годин. Це випарюють до сухого стану, залишок розчиняють у СН2СІ 2 та органічну фазу промивають розчином хлориду натрію та тоді водою. Це сушать та випарюють. Залишок хроматографують СНСІ 3/МеОН (за об'ємом; 98/2). 390мг очікуваного продукту отримують, Точк.пл.=161°С, В) 3-(2,4-Дихлорфеніл)-9-(2-гідроксіетил)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. 295мг продукту з попереднього етапу, 1,21мг п-толуєнсульфонової кислоти та 10мл 95% EtOH змішують. Суміш гріють при температурі кипіння під зворотним холодильником протягом 8 годин та випарюють до сухого стану. Твердий продукт промивають розчином натрій гідрогенкарбонату та тоді водою, та сушать. 198мг очікуваного продукту отримують, Точк.пл.=240°С: Приклад 30: Сполука 102 3-(2,4-Диметилфеніл)-1,6,9-триметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он 400мг 3-(2,4-диметилфеніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-ону (сполука 101) розчиняють у 10мл ДМФ. 31мг 95% NaH додають та суміш перемішують при зовнішній температурі протягом 30 хвилин. 380мкл метилйодиду додають та суміш перемішують при зовнішній температурі протягом 18 годин. Це випарюють до сухого стану. Залишок розчиняють у СН2СІ 2 та органічну фазу промивають розчином хлориду натрію та тоді водою, сушать та випарюють. Залишок розчиняють в етері, проводять фільтрування та проводять сушку. 300мг очікуваного продукту отримують, Точк.пл.=150°С. Приклад 31: Сполука 57 3-(2-Хлор-4-метоксисреніл)-1,6-диметил-1,9-дигідро-2Н-піридо[2,3-b]індол-2-он. Суміш 10мл безводного ДМФ та 0,6мл безводного метанолу отримують та додають до цього 0,5г 60% NaH. Після припинення виділення газу, додають 0,43г сполуки 59 та тоді суміш гріютьпри 80°С протягом 24 годин. Реакційне середовище виливають у насичений розчин амоній хлориду та: тоді утворений осад відфільтровують та промивають сумішшю ізопропанол/петролейний ефір (за об'ємом; 50/50). 0,35г очікуваної сполуки отримують. ЯМР d6-ДМСО (300МГц): 2,46млн-1: s: 3Н; 3,72млн-1: s: 3H; 3,87млн-1: s: 3Н; 6,98-7,15млн-1: суцільний пік: 3Н; 7,3-7,6млн-1: суцільний пік: 2Н; 7,68млн-1: s: 1H; 8,15млн-1:s: 1H; 11,95млн-1: s: 1H. Хімічні структури та фізичні властивості деяких сполук згідно з винаходом ілюстровано у наступній таблиці. У цій таблиці Me представляє метил, Et представляє етил, tBu представляє трет-бутил та Вn представляє бензил. Сполука 16: ЯМР d6-ДМСО (300МГц): 2,3млн-1:з:6Н; 2,4млн-1: s: 3Н; 3,67млн-1: s: 3H; 6,9млн-1: s: 1Н; 7млн-1: d: 1Н; 7,3млн-1: суцільний пік: 3Н; 7,7млн-1 : s: 1Н; 8,26млн-1: s: 1Н; 11,9млн-1: s: 1Η. Сполука 29: ЯМР CDCI 3 (300МГц): 3,93млн-1: s: 3Н, 4,09млн-1: s: 6Н; 6,89млн-1: d: 1Н; 6,92млн-1: dd: 1Н; 7,3млн-1: dd: 1Н; 7,38млн-1: d: 1Н; 7,51млн-1 d: 1Н; -7,62млн-1: d: 1Н; 7,94млн-1: s: 1H. Сполука 31: ЯМР d6-ДМСО (300МГц): 4млн-1: s: 3Н; 4,15млн-1: s: 3Н; 7,23млн-1: dd: 1H; 7,42млн-1: 1Н; 7,47млн-1: dd: 1H; 7,68млн-1: d: 1Н; 7,78млн-1: d: 1Н; 7,88млн-1: d: 1Н; 8,23млн-1: s: 1Н. Сполука 36: ЯМР CDCI 3 (300МГц): 3,83млн-1: s: 3H; 7,29-7,49млн-1: суцільний пік: 6Н; 7,76млн-1: суцільний пік: 1Н; 8,03млн-1: s: 1Н; 8,59млн-1: s: 1Н. Сполука 37: ЯМР d6-ДМСО (300МГц): 2,41млн-1: s: 6Н; 2,63-2,68млн-1: суцільний пік: 4Н; 2,89млн-1: t (J=5,8): 2H; 3,773,82млн-1: суцільний пік: 4Н; 4,08млн-1: суцільний пік: 6Н; 4,24млн-1: t (J=5,8): 2H; 6,95-8,05млн-1: суцільний пік: 7Н; Сполука 42: ЯМР d6-ДМСО (200МГц): 2,41млн-1: s: 3Н; 3,7-4,5млн-1: bs: 1Н; 3,97млн-1: s: 3Н; 4,07млн-1: s: 3Н; 6,65млн1 : d: 1Н; 7-7,3млн-1: суцільний пік: 4Н; 7,4млн-1: 1Н; 7,7млн-1: s: 1Н; 8,25млн-1: s: 1Н. Сполука 46: ЯМР d6-ДМСО (300МГц): 2,5млн-1: s: 3Н; 3,7млн-1: s: 3H; 7,1млн-1 : d: 1Н; 7,3-7,5млн-1: суцільний пік: 3Н; 7,7млн-1: d: 2Н; 8,1млн-1 : s: 1Н; 11,9млн-1: s: 1Н. Сполука 47: ЯМР CDCI 3 (300МГц): 1,45млн-1: s: 9Н; 2,5млн-1: s: 3H; 4,1млн-1: s: 6Н; 6,7млн-1: d: 1Н; 7,2млн-1: d: 1Н; 7,3млн-1: d: 1Н; 7,5млн-1 : d: 1Н; 7,6млн-1: d: 1Н; 8млн-1: s: 1Н. Сполука 50: ЯМР CDCI 3 (300МГц): 1,7млн-1: суцільний пік: 2Н; 2,5млн-1: s: 3Н; 4,1млн-1: s: 6Н; 7,1млн-1: d: 1Н; 7,3млн1 : суцільний пік: 2Н; 7,4млн-1: t: 1Н; 7,6млн-1: суцільний пік: 2Н; 7,7млн-1: s: 1Н; 8,1млн-1: s: 1Н. Сполука 55: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; млн-1: s: 6Н; 3,83млн-1: s: 6Н; 7,03млн-1: d: 1Н; 7,11млн-1: s: 2Н; 7,33млн-1: d: 1Н; 7,71млн-1 : s: 1Н; 8,37млн-1: s: 1Н; 11,86млн-1: s: 1Н. Сполука 58: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; млн-1: s: 3Н; 7,05млн-1: d: 1Н; 7,3млн-1: d: 1Н; 7,73млн-1: s: 1Н; 7,8млн-1: d: 2Н; 8,03млн-1: d: 2Н; 8,54млн-1: s: 1Н; 12млн-1: s: 1Н. Сполука 59: ЯМР d6-ДМСО (300МГц): 2,40млн-1: s: 3Н; 3,67млн-1: s: 3Н; 7,02-7,06млн-1: суцільний пік: 1Н; 7,247,28млн-1: суцільний пік: 1Н; 7,34млн-1: d: 1Н; 7,42-7,47млн-1: суцільний пік: 2Н; 7,63млн-1: s: 1H; 8,1млн-1: s: 1Н; 11,95млн-1: bs: 1Н. Сполука 61: ЯМР d6-ДМСО (300МГц): 2,40млн-1: s: 3Н; 3,25млн-1: s: 6Н; 7,02млн-1: d: 1Н; 7,23-7,36млн-1: суцільний пік: 3Н; 7,61-7,68млн-1: суцільний пік: 3Н [або 7,05млн-1: d(J=8,1): 1H; 7,35млн-1: d(J=8,1): 1H; 7,73млн-1: s: 1H; 7,78 лн-1: суцільний пік: 4Н]; 8,3млн-1 : s: 1Н. Сполука 62: ЯМР d6-ДМСО (300МГц): 2,4 3млн-1: s: 3Н; 3,70млн-1: s: 3Н; 3,88млн-1: s: 3Н; 7,05-8,50млн-1: суцільний пік: 8Н; 11,97млн-1: s: 1Н. Сполука 63: ЯМР d6-ДМСО (300МГц): 2,41млн-1: s: 3Н; 3,66млн-1: s: 3Н; 6,75-9,80млн-1: суцільний пік: 8Н; 11,87млн-1: s: 1Н. Сполука 64: ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,67млн-1: s: 3H; 4,88млн-1: суцільний пік: 2Н; 6,47-8,16млн-1: суцільний пік: 8Н [або 6,49млн-1:d (J=7,5): 1H; 6,84млн-1: d(J=7,5): 1H; 6,92-7,15млн-1: суцільний пік: 3Н; 7,34млн-1: d(J=8,1): 1Н; 7,65млн-1: суцільний пік; 1Н; 8,18млн-1: суцільний пік: 1Н]; 11,82млн-1: суцільний пік: 1Н. Сполука 65: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 3,707млн-1: s: 3Н; 7,04-8,47млн-1: суцільний пік: 8Н; 11,95млн1 : s: 1Н. Сполука 73: ЯМР d6-ДМСО (300МГц): 2,3млн-1: s: 3Н; 4млн-1: s: 3Н; 4,1млн-1: s: 3Н; 6,8 млн-1: d: 1Н; 6,9млн-1: s: 1Н; 7,2млн-1: 1Н; 7,3млн-1: 1Н; 7,5млн-1: d: 1Н; 7,7млн-1: s: 1Н; 8,1млн-1: s: 1Н; 9,9млн-1: bs: 1H. Сполука 77: ЯМР d6-ДМСО (200МГц): 2,4млн-1: s: 3Н; 3,7млн-1: s: 3Н; 3,8млн-1: s: 6Н; 6,9млн-1:1Н; 7млн-1: d: 1Н; 7,27,3млн-1: суцільний пік: 3Н; 7,4млн-1 : s: 1Н; 8,3млн-1: s: 1Η. Сполука 80: ЯМР d6-ДМСО+ТФОК (200МГц): 2,4млн-1: s: 3Н; 2,8млн-1: s: 3Н; 3,8млн-1: s: 3Н; 4,3-4,5млн-1: dd: 2Н; 7,1млн-1: d: 1Н; 7,3-7,6млн-1: суцільний пік: 3Н; 7,7млн-1: s: 1Н; 7,9млн-1: d: 1Н; 8млн-1: s: 1Н; 8,4млн-1: s: 1H. Сполука 81: ЯМР d6-ДМСО (200МГц): 2,3млн-1: s: 3Н; млн-1: s: 3Н; 4,4млн-1 : d: 2Н; 5,1 млн-1: суцільний пік: 1Н; 7млн-1: d: 1Н; 7,15-7,3млн-1: суцільний пік: 3Н; 7,58млн-1: суцільний пік: 3Н; 8,2млн-1: s: 1Н; 11,8-12млн-1: bs: 1Н. Сполука 82: ЯМР d6-ДМСО (200МГц): 2,4млн-1: s: 3Н; 3,6млн-1 : s: 3Н; 3,8млн-1: s: 3Н; 6,95млн-1: d: 1Н; 7,05млн-1: d: 1Н; 7,15млн-1: d: 1Н; 7,6-7,8млн-1: суцільний пік: 2Н; 8млн-1: s: 1Н; 8,3млн-1: s: 1H; 11,8млн-1: s: 1Н. Сполука 85: ЯМР d6-ДМСО (200МГц): 2,3млн-1: s: 3Н; 2,6млн-1: d: 3Н; 3,8млн-1: s: 3Н; 5,2млн-1: s: 2Н; 7млн-1: d: 1Н; 7,3млн-1: d: 1Н; 7,4млн-1 : суцільний пік: 2Н; 7,6млн-1: s: 2H; 8,1млн-1: s: 1Н; 8,4млн-1: d: 1Н. Сполука 87: ЯМР d6-ДМСО/ТФОК (200МГц): 2,4млн-1: s: 3Н; 3,6млн-1: s: 3Н; 3,95млн-1: s: 3Н; 7млн-1: d: 1Н; 7,157,35млн-1: суцільний пік: 2Н; 7,65млн-1 : s: 1Н; 8,05млн-1: s: 1Н; 8,1млн-1: s: 1Н; 8,45млн-1: s: 1Н. Сполука 88: ЯМР d6-ДМСО/ТФОК(200МГц): 4,05млн-1: s: 3Н; 4,25млн-1: s: 3H; 7,6-7,9млн-1: суцільний пік: 4Н; 8,15млн1 : d: 1Н; 8,25млн-1: s: 1Н; 8,5млн-1 : s: 1Н; 8,7млн-1: s: 1Н. Сполука 94: ЯМР d6-ДМСО (300МГц): 2,73млн-1: s: 3Н; 4,27млн-1: s: 6Н; 5,02млн-1: s: 2Н; 7,09-8,26млн-1: суцільний пік: 8Н. Сполука 97: ЯМР d6-ДМСО/ТФОК (200МГц): 2,4млн-1: s: 3H; 2,95млн-1: t: 2Н; 4млн-1 : s: 3Н; 4,6млн-1: t: 2Н; 7,2млн-1: d: 1Н; 7,4-7,7млн-1: суцільний пік: 3Н; 7,75млн-1: s: 2Н; 8,2млн-1: s: 1Н. Сполука 98: ЯМР d6-ДМСО/ТФОК (200МГц): 2,4млн-1: s: 3Н; 3,6млн-1: s: 3Н; 3,7млн-1: s: 3Н; 3,8млн-1: s: 3Н; 6,95млн-1: s: 1Н; 3,7 7-7,1млн-1: суцільний пік: 2Н; 7,35млн-1: d: 1Н; 7,6млн-1: s: 1Н; 8,05млн-1: s: 1Н. Сполука 99: ЯМР d6-ДМСО/ТФОК (200МГц): 2,3млн-1: s: 3Н; 3,8млн-1: s: 3Н; 3,75млн-1: s: 3Н; 3,9млн-1: s: 3Н; 4,05млн1 : s: 3Н; 3,9 6,85млн-1: s: 1Н; 7млн-1: s: 1Н; 7,05млн-1: s: 1Н; 7,4млн-1: d: 1Н; 7,6млн-1: s: 1Н; 8млн-1: s: 1Н. Сполука 100: ЯМР d6-ДМСО/ТФОК (200МГц): 2,4млн-1: s: 3Н; 3,65млн-1: s: 3Н; 3,7млн-1: s: 3Н; 3,8млн-1: s: 3Н; 6,95млн1 : s: 1Н; 7,05млн-1: d: 1Н; 7,2млн-1 : s: 1Н; 7,35млн-1: d: 1Н; 7,65млн-1: s: 1Н; 8,05млн-1: s: 1Н. Сполука 101: ЯМР d6-ДМСО/ТФOК (200МГц): 2,2млн-1: s: 3H; 2,3млн-1: s: 3H; 2,4млн-1 : s: 3H; 3,75млн-1: s: 3Н; 7-7,2млн1 : суцільний пік:4Н; 7,4млн-1: d: 1Н; 7,7млн-1: s: 1Н; 8млн-1:s: 1Η. Сполука 103 d6-ДМСО/ТФОК (200МГц): 2,3млн-1: s: 3Н; 2,45млн-1: s: 3Н; 2,5млн-1: s: 3H; 3,7млн-1: s: 3Н; 7,1млн-1: d: 1Н; 7,2млн-1: d: 1Н; 7,4млн-1: d: 1Н; 7,5млн-1: d: 1Н; 7,6млн-1: s: 1Н; 7,75млн-1: s: 1H; 8,35млн-1: s: 1Η. Сполука 112: ЯМР d6-ДМСО (300МГц): 2,41млн-1: s: 3H; 2,46млн-1: s: 3Н; 2,69-2,72млн-1: суцільний пік: 4Н; 3,193,28млн-1: суцільний пік: 4Н; 3,76млн-1: s: 3H; 6,93млн-1: dd: 1Н; 7,09млн-1: d: 1Н; 7,15млн-1: d: 1Н; 7,28млн-1: d: 1Н; 7,33млн-1: суцільний пік: 2Н; 7,61млн-1: s: 1H; 8,19млн-1: s: 1Н. Сполука 114: ЯМР d6-ДМСО (300МГц): 3,69млн-1: s: 3Н; 7,4млн-1: суцільний пік: 4Н; 7,67млн-1: d: 1Н; 8,09млн-1 : d: 1H; 8,29млн-1: s: 1Н; 12,28млн-1: s: 1H. Сполука 116: ЯМР d6-ДМСО (300МГц): 2,41млн-1: s: 3H; 3,6 млн-1: s: 3H; 6,12млн-1: s: 2Н; 7,02млн-1: s: 1Н; 7,10млн-1: s: 1Н; 7,19млн-1: s: 1H; 7,36млн-1: d: 1Н; 7,63млн-1: s: 1Н; 8,05млн-1: s: 1Н; 11,92млн-1: s: 1H. Сполука 117: ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,68млн-1: s: 3Н; 3,78млн-1: s: 6Н; 6,41-8,37млн-1: суцільний пік: 7Н; 11,89млн-1:s:1H. Сполука 119: ЯМР d6-ДМСО (200МГц): 2,4млн-1: s: 3H; 3,7млн-1: s: 3Н; 7-7,2млн-1:суцільний пік: 3Н; 7,4млн-1: d: 1Н; 7,7млн-1: s: 1Н; 7,8млн-1 : d: 2Н; 8,4млн-1: s: 1H. Сполука 122: ЯМР d6-ДМСО (300МГц): 2,50млн-1: s: 6H; 3,79млн-1: s: 3H; 4,03млн-1: суцільний пік: 2Н; 6,92-8,28млн-1: суцільний пік: 7Н; 12,46млн-1: s: 1H. Сполука 124: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 3,98млн-1: s: 3Н; 4,08млн-1: s: 3Н; 7,06-7,16млн-1: суцільний пік: 8Н. Сполука 125: ЯМР d6-ДМСО (300МГц): 2,31млн-1: s: 6Н; 3,69млн-1: s: 3Н; 6,91млн-1: s: 1Н; 7,28-7,44млн-1: суцільний пік: 4Н; 8,15млн-1: d: 1Н; 8,38млн-1: s: 1Н; 12,30млн-1: s: 1Н. Сполука 126: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 3,70млн-1: s: 3Н; 7,05-8,88млн-1: суцільний пік: 8Н; 11,97млн-1: s: 1Н. Сполука 128: ЯМР d6-ДМСО (300МГц): 3,61млн-1: s: 3Н; 3,78млн-1: s: 3Н; 6,83млн-1: dd: 1Н; 7,33-7,48млн-1 суцільний пік: 4Н; 7,66млн-1:1Н; 8,17млн-1: s: 1Н; 11,91млн-1: s: 1Н. Сполука 129: ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,69млн-1: s: 3Н; 5,15млн-1: s: 2Н; 6,93-8,36млн-1: суцільний пік: 13Н; 11,88млн-1:s: 1Η. Сполука 130: ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,68млн-1: s: 3Н; 6,67млн-1: dd: 1H; 7,02млн-1: 1Н; 7,037,24млн-1: суцільний пік: 3Н; 7,34млн-1: 1Н; 7,68млн-1: s: 1Н; 8,25млн-1: s: 1Н: 9,26млн-1: bs: 1Η: 11,85млн-1: bs: 1Н. Сполука 131: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 7,05-8,61млн-1: суцільний пік: 7Н; 12,00млн-1: s: 1Н. Сполука 134: ЯМР d6-ДМСО (300МГц): 2,43млн-1: s: 3Н; 4,02млн-1: s: 3H; 7,06млн-1: 1Н; 7,29млн-1: bs: 1Н; 7,35млн-1: d: 1H; 7,72млн-1: s: 1Н; 7,84-7,94млн-1: суцільний пік: 5Н; 8,45млн-1: s: 1Н. Сполука 138: ЯМР d6-ДМСО (300МГц): 1,71млн-1: s: 3H; 2,44млн-1: s: 3Н; 2,64млн-1: s: 3Н; 4,02млн-1: s: 3Н; 4,20млн-1: s: 3Н; 7,12млн-1: d: 1H; 7,48-7,56млн-1: суцільний пік: 2Н; 7,76млн-1: суцільний пік: 1Н; 7,87млн-1: 1Н; 8,03млн-1: d: 1Н; 8,35млн-1: суцільний пік: 1Н; 8,46млн-1: s: 1Н. Сполука 140: ЯМР d6-ДМСО (300МГц): 2,79млн-1: s: 3Н; 3,69млн-1: s: 3Н; 6,83млн-1: t: 1Н; 7,03млн-1: dd:1Н; 7,34млн1 :1Н; 7,66-7,80млн-1: суцільний пік: 5Н; 8,27млн-1: s: 1H; 8,49млн-1: d: 1Η; 9,63млн-1: s: 1H; 11,84млн-1: s: 1Η. Сполука 141: ЯМР d6-ДМСО (300МГц): 2,45млн-1: s: 3Н; 4,04млн-1: s: 3H; 5,22млн-1: s: 2Н; 5,87млн-1: s: 2Н; 7,019,31млн-1: суцільний пік: 8Н. Сполука 142: ЯМР d6-ДМСО (300МГц): 2,21млн-1: s: 6Н; 2,43млн-1: s: 3Н; 2,64млн-1: t: 2Н; 3,99млн-1: s: 3Н; 4,62млн-1: t: 2Н; 6,67-8,29млн-1: суцільний пік: 8Н; 9,27млн-1: s: 1Н. Сполука 145: ЯМР d6-ДМСО/ТФОК (200МГц): 2,4млн-1: s: 3Н; 3,7млн-1: s: 3Н; 6,9-7,1млн-1: суцільний пік: 2Н; 7,37,45млн-1: суцільний пік: 3Н; 7,5-7,7млн-1: суцільний пік: 2Н; 8,35млн-1: s: 1Н. Сполука 148: ЯМР d6-ДМСО (300МГц): 2,40млн-1: s: 3Н; 3,67млн-1: s: 3Н; 7,04млн-1: d: 1Н; 7,35млн-1: суцільний пік: 2Н; 7,57млн-1:1Н; 7,63млн-1: s: 1Н; 7,77млн-1: 1Н; 8,12млн-1: s: 1Н; 11,96млн-1: s: 1H. Сполука 150: ЯМР d6-ДМСО (300МГц): 2,43млн-1: суцільний пік: 2Н; 2,51млн-1: s: 3Н; 4,10-4,30млн-1: суцільний пік: 4Н; 7,17-8,20млн-1: суцільний пік: 7Н. Сполука 155: ЯМР d6-ДМСО (300МГц): 1,36млн-1: t(J=7,0): 3Н; 4,02млн-1: s: 3Н; 4,34млн-1: q(J=7,0): 2Н; 5,97млн-1: s: 2Н; 7,48млн-1: суцільний пік: 2Н; 7,70млн-1: s: 1Н; 7,88млн-1: d(J=8,6): 1H; 7,98млн-1: dd (J=1,5; J=8,6): 1H; 8,47млн-1: s: 1Н; 8,61млн-1: s: 1Н. Сполука 156: ЯМР d6-ДМСО (300МГц): 1,33млн-1: t(J=7): 3Н; 3,70млн-1: s: 3Н; 4,32млн-1: q(J=7): 2H; 7,41млн-1 суцільний пік: 2Н; 7,46млн-1: d(J=8,5): 1H; 7,67 млн-1: s: 1Н; 7,8 6млн-1: d(J=8,5): 1H; 8,34млн-1: s: 1Н; 8,53млн1 : s: 1Н; 12,4 6млн-1: s: 1Н. Сполука 159: ЯМР d6-ДМСО (300МГц): 2,42млн-1: s: 3Н; 3,69млн-1: s: 3Н; 7,05млн-1: d(J=7,0): 1H; 7,21млн-1: d(J=7,29): 1H; 7,37 млн-1: d(J=8,15): 2Н; 7,51млн-1: d, (J=2,6): 1H; 7,54млн-1: s: 1Н; 7,64млн-1: s: 1Н; 8,14млн-1: s: 1H; 8,34млн-1: d(J=7,22): 2H; 10,71млн-1: s: 1Н; 12,03млн-1: s: 1Н. Сполука 160: ЯМР d6-ДМСО (300МГц): 2,40млн-1: s: 3Н; 3,17млн-1: суцільний пік: 4Н; 3,66млн-1: s: 3Н; 3,75млн-1: суцільний пік: 4Н; 6,94млн-1: dd(J=2,45; J=8,60): 1H; 7,03млн-1: суцільний пік: 2Н; 7,23млн-1: d(J=8,51): 1H; 7,34млн-1: d(J=8,12): 1H; 7,62млн-1: s: 1Н; 8,02млн-1: s: 1Н; 11,87млн-1: s: 1Н. Сполука 166 d6-ДМСО: 3,73млн-1: s: 3Н; 3,97млн-1: s: 3Н; 7,56млн-1:1Н; 7,63млн-1: d: 1Н; 7,95млн-1: 1Н; 8,07млн-1: суцільний пік: 2Н; 8,73млн-1: s: 1Н; 8,92млн-1: s: 1Н; 12,57 лн-1: s: 1Н. Сполуки згідно з винаходом є об'єктом фармакологічних досліджень, котрі роблять можливим визначення їх антиракової активності. Сполуки формули (І) згідно з представленим винаходом досліджено in vitro на лінії ракових клітин грудної залози людини: MDA-MB-231, лінію отримано з Американської колекції типових культур (посилання НТВ2 6). . Антипроліферативний ефект оцінюють згідно з [J.M. Derocq et al., FEBS Letters, 1998, 425, 419-425]: рівень інкорпорованого [3Н]тимідину у ДНК оброблених клітин вимірюють після інкубування сполук формули (l) протягом 96 годин. Інгібувальну концентрацію (ІК50) визначено як концентрацію, котра інгібує проліферацію клітин на 50%. Сполуки згідно з винаходом виявляють ІК50 загалом менше 10мкМ з огляду на лінію MDA-MB-2 31. Сполуки формули (І) також досліджено на іншій лінії ракових клітин грудної залози людини, "мультирезистентній для ліків" (MDR) лінії, позначеній як MDA-А1. Цю лінію описано [Е. Collomb, С. Dussert та P.M. Martin у Cytometry, 1991, 12_(1), 15-25]. Термін "мультирезистентний", котрий описує цю лінію, означає, що вказана лінія є загалом не: дуже чутливою до хемотерапевтичних звичайно застосованих аналгетиків, а зокрема до антимітотиків природного походження, як-то паклітаксел, вінкристин або вінбластин. Сполуки згідно з винаходом виявляють ІК50 загалом менше 10мкМ з огляду на мультирезистентну лінію MDA-A1i. Сполуки згідно з винаходом також досліджено in vivo у мишачих моделях ксенотра-нсплантатів пухлин людини способами, описаними у літературі: [Mooberry S.L. et al., Int. J. Cancer, 2003, 104 (4), 512-521; Polin L. et al., Invest. New Drugs, 2002, 2_0 (1), 13-22; Corbett T.H et al., Invest. New Drugs, 1999, 1/7 (1), 17-27]. Фрагменти пухлин людини діаметром 2-3мм імплантують підшкірно у мишей породи Balb/C SCID (суворий комбінований імунодефіцит) (Iffa-Credo, Lyons, France). Коли ці пухлини досягають маси 50-60мг, сполуки застосовують перорально або внутрішньовенно кожної доби або кожні дві доби протягом виконання експерименту (20-40 діб) у дозах від 10 до 300мг/кг на застосування. Масу пухлин оцінюють згідно з формулою: W (маса пухлини у мг) = (а´b2)/2, де а та b відповідно представляють довжину та ширину у мм імплантату пухлини. Вимірювання а та b проводять застосуванням масштабного кронциркуля. Антипухлинну ефективність оцінюють порівнянням середньої маси пухлин у групі тварин, яку лікують з тестсполукою (Т) з тваринами контрольної групи, котрі застосовували тільки розчинник (С). Це вимірювання, виражене як % співвідношення Т/С, проводять, коли С досягає приблизно 1000мг. Сполуки згідно з винаходом демонструють in vivo антипухлинну активність (співвідношення Т/С менше 100%), деякі дуже значно зі співвідношенням Т/С не більше 42%. Відтак, згідно з представленим винаходом це свідчить, що сполуки формули (І) інгібують проліферацію клітин пухлин, залучаючи клітини, що виявляють мультирезистентність. Це відтак свідчить, що сполуки згідно з винаходом мають антиракову активність. Відтак, згідно з іншим його аспектом, предметом винаходу є медикаменти, котрі містять сполуку формули (І) або адитивну сіль останньої з фармацевтично прийнятною кислотою, чи також гідрат або сольват сполуки формули (І). Ці медикаменти знаходять застосування у терапевтичному лікуванні, зокрема у лікуванні або захисті від хвороби, викликаної або загостреної проліферацією клітини пухлин. Ці сполуки, як інгібітор проліферації клітин пухлин, застосовують у лікуванні твердих пухлин, як первинних твердих пухлин, так і метастазів твердих пухлин, карцином та видів раку, зокрема: рак грудної залози; рак легенів; рак тонкого кишечнику, рак ободової кишки та прямої кишки; рак респіраторного тракту, ротової частини глотки та задньої частини глотки; рак стравоходу; рак печінки, рак шлунку, рак жовчних каналів, рак жовчного міхура, рак підшлункової залози; види раку сечового тракту, залучаючи нирки, уротелій та сечовий міхур; види раку жіночого генітального тракту, залучаючи рак матки, шийки матки та яєчників, хоріокарциноми та трофобластичного раку; види раку чоловічого генітального тракту, залучаючи рак простати, сім'яних пухирців та яєчок, пухлини зародкових клітин; види раку ендокринних залоз, залучаючи рак щитовидної залози, гіпофізу та надниркової залози; види раку шкіри, залучаючи гемангіоми, меланоми та саркоми, залучаючи саркому Ка-поші; пухлини мозку, нервів, очей та оболонок мозку, залучаючи астроцитоми, гліоми, гліобластоми, ретинобластоми, нейриноми, нейробластоми, шваноми та менінгіоми; тверді пухлини, похідні від гематопоетичних злоякісних пухлин, залучаючи лейкемії, хлороми, плазмацитоми, грибкові мікози, Т-клітиннну лімфому або лейкемію, лімфому не-Ходжкіна, злоякісні гемопатії та мієломи. Згідно з іншим його аспектом, представлений винахід стосується фармацевтичних композицій, що містять як активний інгредієнт сполуку згідно з винаходом. Ці фармацевтичні композиції містять ефективну дозу щонайменше одної сполуки згідно з винаходом, або фармацевтично прийнятної солі, гідрату або сольвату вказаної сполуки, та щонайменше один фармацевтично прийнятний ексципієнт. Вказані ексципієнти вибрано згідно з потрібними фармацевтичною формою та способом застосування зі звичайних ексципієнтів, котрі відомі фахівцям. У фармацевтичних композиціях представленого винаходу для перорального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, місцевого, локального, інтратрахеального, інтраназального, трансдермального або ректального застосування, активний інгредієнт формули (І) вище, або його можливі сіль, сольват або гідрат можна застосовувати в одиничній формі застосування як суміш зі звичайними фармацевтичними ексципієнтами до тварин та людини для профілактики або лікування вищезазначених розладів або хвороб. Підхожі одиничні форми застосування містять форми для перорального уведення, як-то таблетки, м'які або тверді желатинові капсули, порошки, гранули та пероральні: розчини або суспензії, сублінгвальні, букальні, інтратрахеальні, інтраокулярні або інтраназальні, інгаляційні форми застосування, місцеві, трансдермальні, підшкірні, внутрішньом'язові або внутрішньовенні форми застосування, ректальні форми застосування та імплантати. 3а-стосування можна робити для місцевого нанесення сполуки згідно з винаходом у кремах, гелях, мазях чи лосьйонах. Сполуки формули (І) вище можна застосовувати у добових дозах 0,002-2000мг на кілограм маси тіла ссавця, якого лікують, переважно у добових дозах 0,1 до 300мг/кг. У людини доза може переважно бути від 0,02 до 10000мг на добу, більш особливо від 1 до 3000мг, залежно від віку суб'єкту, якового лікують або типу лікування: профілактичного або цілющого. Можуть бути особливі випадки, де є підхожими вищі або нижчі дози; такі дози не відхиляються від рамок винаходу. Згідно зі звичайною практикою дозування, підхоже до кожного пацієнта, визначає лікар згідно зі способом застосування та масою та реакцією вказаного пацієнта. Представлений винахід, згідно з іншим його аспектом, також стосується способу лікування патологій визначених вище, котрий містить застосування пацієнтом ефективної дози сполуки згідно з винаходом, або її фармацевтично прийнятних солей або гідратів або сольватів. Згідно з представленим винаходом, сполуку або сполуки формули (І) можна вживати у комбінації з одним (або більше) антираковими активними інгредієнтами, зокрема анти-пухлинними сполуками, як-то алкілувальними засобами, як-то алкілсульфонати (бусульфан), дакарбазин, прокарбазин, азотні гірчиці (хлорметин, мелфалан, хлорамбуцил), циклофосфамід або іфосфамід; нітрозосечовини, як-то кармустин, ломустин, семустин або стрептозоцин; антинеопластичн алкалоїди, як-то вінкристин або вінбластин; таксани, як-то паклітаксел або таксотер; антинеопластичн антибіотики, як-то актиноміцин; інтеркалювальні засоби, антинеопластичні антиметаболіти, фолатні антагоністи або метотрексат; інгібітори синтезу пурину; аналог пурину, як-то меркаптопурин або 6-тіогуанін; інгібітори синтезу піримідину, інгібітори ароматази, капецитабін або аналог піримідину, як-то флуорурацил, гемцитабін, цитарабін, та цитозин арабінозид; бреквінар; інгібітори топоізомерази, як-то камптотецин або етопозид; антиракові гормональні агоністи та антагоністи, залучаючи тамоксифен; інгібітори кінази, іматиніб; інгібітори фактору росту; антизапальні засоби, як-то пентозан полісульфат, кортикостероїди, преднізон або дексаметазон; антитопоізомерази, якто етопозид, антрацикліни, залучаючи доксорубіцин, блеоміцин, мітоміцин та мітрааміцин; антиракові комплекси металів, комплекси платини, цисплатин, карбоплатин або оксаліплатин; інтерферон-альфа, трифеніл тіофосфорамід або алтретамін; антиангіогенні засоби; талідомід; імунотерапевтичні ад'юванти; або вакцини.
ДивитисяДодаткова інформація
Назва патенту англійською3-phenylsubstituted pyridoindolone derivatives, preparation thereof and use in therapy
Автори англійськоюBourrie Bernard, Gegam Samir, Muneaux Yvette, Wermuth Camille-George
Назва патенту російською3-фенилзамещенные производные пиридоиндолона, их получение и применение в терапии
Автори російськоюБурри Бернар, Жегам Самир, Мюно Иветт, Вермют Камилль-Жорж
МПК / Мітки
МПК: C07D 471/04, A61P 35/00
Мітки: піридоіндолону, 3-фенілзаміщені, похідні, терапії, отримання, застосування
Код посилання
<a href="https://ua.patents.su/29-79317-3-fenilzamishheni-pokhidni-piridoindolonu-kh-otrimannya-ta-zastosuvannya-u-terapi.html" target="_blank" rel="follow" title="База патентів України">3-фенілзаміщені похідні піридоіндолону, їх отримання та застосування у терапії</a>
Попередній патент: Спосіб одержання оцтової кислоти та застосування індію, кадмію, ртуті, галію, цинку як стабілізатора в цьому способі
Наступний патент: Спосіб сухої магнітної сепарації слабомагнітних матеріалів з електричним зніманням магнітного продукту і пристрій для його здійснення
Випадковий патент: Гідроксиметилпіролідини як агоністи адренергічних рецепторів b3












