Система підшкірної доставки інгібітора холінестерази у формі твердого імплантату, спосіб її одержання та її застосування для лікування холінергічних дефіцитних розладів
Номер патенту: 82226
Опубліковано: 25.03.2008
Автори: Мовернай Ролланд-Йвес, Хеймгартнер Фредерік, Скалфаро П'єтро, Мк Кормік Марк, Поршет Херве, Дьюкрей Бертранд, Капансьоні Серж, Фефферль Франкуас
Формула / Реферат
1. Система підшкірної доставки у формі твердого імплантату, яка містить матрикс із біодеградуючого полімерного матеріалу та щонайменше одну фармакологічно активну речовину загальної формули (І):
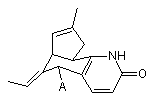 (I),
(I),
де радикал А означає аміногрупу -NH2, або амонійну групу -NН3+, або радикал загальної формули (II):
 (II),
(II),
де кожний з X1-X5 незалежно означає атом водню, лінійну або розгалужену С1-С6-алкільну групу, лінійну або розгалужену С1-С6-алкілоксигрупу, гідроксильну групу -ОН, аміногрупу -NH2, первинну або вторинну С1-С6-алкіламіногрупу, атом галогену, нітрогрупу -NO2; при цьому зазначена речовина включена в зазначений матрикс.
2. Система доставки за п. 1, яка відрізняється тим, що в загальній формулі (І) радикал А означає аміногрупу -NH2, або амонійну групу -NH3+, або радикал загальної формули (II):
 (II),
(II),
де кожний з X1-X5 незалежно означає атом водню, метильну або етильну групу, метоксигрупу, гідроксильну групу -ОН, аміногрупу -NH2, метиламіногрупу або диметиламіногрупу, атом хлору або брому або нітрогрупу -NO2.
3. Система доставки за п. 1, яка відрізняється тим, що зазначена фармакологічно активна речовина має формулу (III):
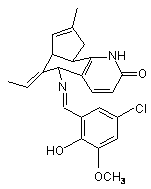 (III).
(III).
4. Система доставки за п. 1, яка відрізняється тим, що біодеградуючий полімерний матеріал зазначеного матриксу вибраний з групи, що включає поліацеталі та складні ефіри поліоксикислот, поліортоефіри, поліангідриди, полілактони або їхні суміші.
5. Система доставки за п. 4, яка відрізняється тим, що зазначені складні ефіри поліоксикислот вибрані з групи, що включає гомополімери та співполімери D-молочної кислоти та/або L-молочної кислоти, та/або гліколевої кислоти та їхні блок-полімери з поліетиленгліколем, зазначені полілактони вибрані з групи, що включає полікапролактон, полі(3-гідроксибутиролактон) та співполімер гідроксибутиролактону та гідроксивалеролактону.
6. Система доставки за п. 4, яка відрізняється тим, що зазначений біодеградуючий полімерний матеріал вибраний з групи, що включає полімолочну кислоту і співполімери D-молочної кислоти та/або L-молочної кислоти, та/або D,L-молочної кислоти, та/або гліколевої кислоти.
7. Система доставки за п. 6, яка відрізняється тим, що зазначений біодеградуючий полімерний матеріал вибраний з групи, що складається з полі(D,L-лактид-когліколіду) та полілактиду, і співвідношення між D,L-лактидом та гліколідом, які утворюють біодеградуючий полімерний матеріал, знаходиться в діапазоні від 25:75 до 100:0 мол. %, краще від 50:50 до 75:25 мол. %, характеристична в'язкість біодеградуючого полімерного матеріалу знаходиться в діапазоні від 0,10 до 0,9 дл/г, краще від 0,15 до 0,6 дл/г.
8. Система доставки за п. 1, яка відрізняється тим, що зазначений твердий імплантат має циліндричну форму.
9. Спосіб одержання системи доставки, охарактеризованої в п. 8, який включає такі стадії:
a) приготування гомогенної суміші відповідної кількості сухого порошку щонайменше однієї фармакологічно активної речовини загальної формули (І) та відповідної кількості сухого порошку біодеградуючого полімерного матеріалу;
b) екструдування суміші, одержаної на стадії (а), з контрольованою швидкістю через штамп із відповідним круглим перерізом при температурі від 70 °С до 100 °С;
c) нарізування екструдату, одержаного на стадії (b), по суті в поперечному напрямку на шматочки відповідної довжини, і
d) стерилізацію імплантатів, одержаних на стадії (с).
10. Застосування системи доставки, охарактеризованої в п. 1, для виготовлення лікарського засобу для лікування суб'єкта, що страждає холінергічними дефіцитними розладами, або для поліпшення функцій, пов'язаних з холінергічною системою.
11. Застосування за п. 10, яке відрізняється тим, що зазначені розлади включають хворобу Альцгеймера, помірні когнітивні розлади, астенічний бульбарний параліч, деменцію, деменцію судинного походження, а зазначені когнітивні функції залучені до процесів, що протікають у людини, вибрані з групи, яка включає сприйняття, увагу, навчання, пам'ять, мислення, утворення понять, читання, рішення проблем і мову.
12. Застосування за п, 10, яке відрізняється тим, що зазначений лікарський засіб призначений для профілактики або лікування суб'єкта, підданого дії агентів з холінестеразною інгібіторною активністю та/або інтоксикованого зазначеними агентами.
13. Застосування за п. 12, яке відрізняється тим, що зазначені агенти вибрані з групи органофосфатів.
14. Застосування за п. 10, яке відрізняється тим, що фармакологічно активна речовина загальної формули (І), що міститься в зазначеній системі доставки, безперервно вивільняється протягом щонайменше одного місяця.
15. Застосування за п. 14, яке відрізняється тим, що лікарський засіб вводять пацієнту з регулярними інтервалами тривалістю щонайменше один місяць.
Текст
1. Система підшкірної доставки у формі твердого імплантату, яка містить матрикс із біодеградуючого полімерного матеріалу та щонайменше одну фармакологічно активну речовину загальної формули (І): 2 3 82226 NH O N Cl HO OCH 3 (III). 4. Система доставки за п. 1, яка відрізняється тим, що біодеградуючий полімерний матеріал зазначеного матриксу вибраний з групи, що включає поліацеталі та складні ефіри поліоксикислот, поліортоефіри, поліангідриди, полілактони або їхні суміші. 5. Система доставки за п. 4, яка відрізняється тим, що зазначені складні ефіри поліоксикислот вибрані з групи, що включає гомополімери та співполімери D-молочної кислоти та/або Lмолочної кислоти, та/або гліколевої кислоти та їхні блок-полімери з поліетиленгліколем, зазначені полілактони вибрані з групи, що включає полікапролактон, полі(3-гідроксибутиролактон) та співполімер гідроксибутиролактону та гідроксивалеролактону. 6. Система доставки за п. 4, яка відрізняється тим, що зазначений біодеградуючий полімерний матеріал вибраний з групи, що включає полімолочну кислоту і співполімери D-молочної кислоти та/або L-молочної кислоти, та/або D,Lмолочної кислоти, та/або гліколевої кислоти. 7. Система доставки за п. 6, яка відрізняється тим, що зазначений біодеградуючий полімерний матеріал вибраний з групи, що складається з полі(D,L-лактид-когліколіду) та полілактиду, і співвідношення між D,L-лактидом та гліколідом, які утворюють біодеградуючий полімерний матеріал, знаходиться в діапазоні від 25:75 до 100:0 мол. %, краще від 50:50 до 75:25 мол. %, характеристична в'язкість біодеградуючого полімерного матеріалу знаходиться в діапазоні від 0,10 до 0,9 дл/г, краще від 0,15 до 0,6 дл/г. 8. Система доставки за п. 1, яка відрізняється тим, що зазначений твердий імплантат має циліндричну форму. Даний винахід стосується системи підшкірної доставки, яка містить інгібітор ацетилхолінестерази. Він стосується також способу одержання зазначеної системи підшкірної доставки та її застосування для лікування нервової дисфункції, більш конкретно, для лікування холінергічних дефіцитних розладів та/або для поліпшення пов'язаних з холінергічною системою функцій. Нейрональна дисфункція включає когнітивне порушення, що характеризується втратою 4 9. Спосіб одержання системи доставки, охарактеризованої в п. 8, який включає такі стадії: a) приготування гомогенної суміші відповідної кількості сухого порошку щонайменше однієї фармакологічно активної речовини загальної формули (І) та відповідної кількості сухого порошку біодеградуючого полімерного матеріалу; b) екструдування суміші, одержаної на стадії (а), з контрольованою швидкістю через штамп із відповідним круглим перерізом при температурі від 70 °С до 100 °С; c) нарізування екструдату, одержаного на стадії (b), по суті в поперечному напрямку на шматочки відповідної довжини, і d) стерилізацію імплантатів, одержаних на стадії (с). 10. Застосування системи доставки, охарактеризованої в п. 1, для виготовлення лікарського засобу для лікування суб'єкта, що страждає холінергічними дефіцитними розладами, або для поліпшення функцій, пов'язаних з холінергічною системою. 11. Застосування за п. 10, яке відрізняється тим, що зазначені розлади включають хворобу Альцгеймера, помірні когнітивні розлади, астенічний бульбарний параліч, деменцію, деменцію судинного походження, а зазначені когнітивні функції залучені до процесів, що протікають у людини, вибрані з групи, яка включає сприйняття, увагу, навчання, пам'ять, мислення, утворення понять, читання, рішення проблем і мову. 12. Застосування за п, 10, яке відрізняється тим, що зазначений лікарський засіб призначений для профілактики або лікування суб'єкта, підданого дії агентів з холінестеразною інгібіторною активністю та/або інтоксикованого зазначеними агентами. 13. Застосування за п. 12, яке відрізняється тим, що зазначені агенти вибрані з групи органофосфатів. 14. Застосування за п. 10, яке відрізняється тим, що фармакологічно активна речовина загальної формули (І), що міститься в зазначеній системі доставки, безперервно вивільняється протягом щонайменше одного місяця. 15. Застосування за п. 14, яке відрізняється тим, що лікарський засіб вводять пацієнту з регулярними інтервалами тривалістю щонайменше один місяць. концентрації, втратою пам'яті та здатності до навчання і втратою навичок зберігання інформації або її відтворення. Нейрональна дисфункція може бути також результатом ушкодження центральної нервової системи, такого як удар, ушкодження спинного мозку та ушкодження периферичних нервів. Когнітивне порушення є симптомом нейрональних розладів, таких як когнітивне порушення, зв'язане зі старінням, і мінімальних когнітивних розладів, а також важких нейродегенеративних розладів, таких як хвороба 5 82226 Альцгеймера. Нейрональна дисфункція також пов'язана з розладами, які приводять до втрати рухових навичок, наприклад, хворобою Паркінсона та аміотрофічним бічним склерозом. Припускають, що дегенерація центральної холінергічної системи сприяє розвитку когнітивного порушення. Хвороба Альцгеймера є найбільш загальною формою деменції, що вражає людей похилого віку, із середньою тривалістю близько 8,5 років від появи клінічних симптомів до смерті. У випадку хвороби Альцгеймера були експериментально доведені неокортикальний дефіцит холінацетилтрансферази ферменту, відповідального за синтез ацетилхоліну (АХ), а також зменшення захоплення холіну та вивільнення АХ і загибель холінергічних нейронів. Зараз ніякого радикального лікування хвороби Альцгеймера не існує, а симптоматичне лікування спрямоване на посилення холінергічної нейротрансмісії. У продажі вже є кілька інгібіторів ацетилхолінестерази для лікування хвороби Альцгеймера. Вони містять оборотні інгібітори, такі як такрин, донепезил, галантамін та псевдооборотні інгібітори, такі як ривастигмін. Всі ці активні агенти потрібно вводити щодня пероральним шляхом. Такий шлях введення ліків є непридатним для регулярного лікування пацієнтів, що страждають втратою пам'яті. Гуперзин A [Huperzine A, C AS 102518-79-6], алкалоїд, виділений з китайської рослини Huperzia Serrata (рід Lycopodium), став багатонадійним агентом відразу ж після першого повідомлення про його антихолінестеразну активність [Wang et al., Zhongguo Yaoli Xuebao, 1986, 7, 110-3]. Зараз показано, що він є оборотним високоселективним інгібітором ацетилхолінестерази та виявляє посилюючі ефекти на пам'я ть літніх пацієнтів та пацієнтів, що страждають хворобою Альцгеймера. Крім того, дані in vitro та in vivo підтверджують, що гуперзин А має, крім того, нейропротекторні властивості. Після повідомлення про фармакологічні властивості гуперзину А був синтезований ряд похідних гуперзину А з метою виявлення більш ефективних продуктів. Zhu із співавт. у патентній заявці ЕР 0806416 описав дуже багатонадійні похідні гуперзину А, зокрема, похідні, які вважаються основами Шифа. Показано, що такі сполуки мають кращий лікувальний ефект і меншу, токсичність, ніж гуперзин А. Зокрема, показано, що похідне гуперзину А формули (III) 6 що має реєстраційний номер CAS 180694-977, виявляє високовибірну активність по відношенню до ацетилхолінестерази порівняно з бутирилхолінестеразою. Одним з недоліків цих похідних гуперзину А є їхня чутливість до води, що перешкоджає будь-якій обробці з використанням неконтрольованих умов при контакті з водою. Одним із запропонованих шля хів введення для лікування гуперзином А є пероральний шлях. Але одним з недоліків такого лікування є часте введення ліків: від двох до чотирьох разів на день або навіть більше, що навряд чи може бути точно дотримано пацієнтом, який страждає хворобою Альцгеймера. Іншим недоліком такого лікування є варіабельність дії, що приводить до менш помітної нейропротекторної дії при дослідженні різних типів церебральних уражень. Така варіабельність, зокрема, залежить від або находиться під впливом поглинання їжі та коливань у рівнях гуперзину А у плазмі крові. Крім перорального, були вивчені й інші шля хи введення. Наприклад, у патентній заявці CN 1383824 Wang із співавт. пропонує для лікування старечого слабоумства та порушення пам'яті або для поліпшення функцій пам'яті вводити гуперзин А через порожнину носа, використовуючи, наприклад, назальні спреї, назальні краплі, мазі, гелі, порошки або мікросфери. Ці автори згадують, що при кожному введенні в організм може доставлятися від 80 до 500 мікрограм гуперзину А. Аналогічні назальні системи доставки ліків запропоновані Zhang у патентній заявці CN 1279065. Такий шлях введення ліків дозволяє їм безпосередньо проникати через слизову оболонку в кров і швидко досягати мозку. Однак дозу, що підлягає введенню, майже неможливо контролювати, і таке введення необхідно повторювати протягом дня. З причин, аналогічних описаним вище, такий шлях є непридатним для регулярного лікування пацієнтів, що страждають втратою концентрації та пам'яті. У патенті US 6352715 Kou із співавт. пропонують використовувати для пацієнтів із хворобою Альцгеймера пристрій для черезшкірної доставки, сконструйований таким чином, що він 7 82226 забезпечує контрольоване вивільнення гуперзину А протягом 7-денного періоду часу з терапевтично ефективною швидкістю не менш ніж від 0,833 до 146мкг/см 2×ч. Загальновизнано, що такі шкірні пластири з контрольованим вивільненням, розроблені для застосування один раз на тиждень, забезпечують терапевтичні переваги для пацієнтів при збереженні всіх їхніх розумових та фізичних здібностей. Однак місцева подразлива дія і той факт, що пацієнти, які страждають втратою пам'яті та мають проблеми з поведінкою, можуть здирати їх, перешкоджають лікуванню. В міжнародній патентній заявці WO 03/04024 Liu із співавт. пропонують лікувати пацієнта, що страждає хворобою Альцгеймера, за допомогою ін'єкції кожні два тижні гуперзину А, інкапсульованого в мікросфери з уповільненим вивільненням, що містять як біодеградуючий полімер поли(лактид-ко-гліколід). Ці мікросфери одержують відповідно до двох класичних способів, перший з яких відомий як спосіб "емульгуванняупарювання" з використанням як розчинників дихлорметану та води, а др угий спосіб відомий як спосіб "сушіння розпилюванням". Беручи до уваги профіль вивільнення ліків, одержаних із цими мікросферами, стає очевидним, що гуперзин А вивільняється протягом щонайменше 17 днів, причому вивільнення включає дві окремі фази. Майже 40% кількості гуперзину А, інкапсульованого в мікросфери, вивільняється протягом перших двох днів, решта ліків вивільняється переважно між восьмим і п'ятнадцятим днем. Такий двофазний профіль вивільнення зі значним викидом при вивільненні ліків відразу після ін'єкції може викликати значні шкідливі побічні ефекти в результаті передозування ацетилхолінестеразного інгібітора протягом дуже короткого періоду часу та з урахуванням незначного терапевтичного індексу таких ліків. З огляду наявного рівня техніки очевидно, що усе ще існує необхідність забезпечення клінічних лікарів галеновим препаратом, який забезпечує поступове та контрольоване вивільнення гуперзину А та/або деяких його фармакологічно активних речовин-аналогів протягом періоду часу, що варіює від декількох тижнів до декількох місяців, при мінімальному контролі медичного працівника та без звертання пацієнта за якоюнебудь допомогою і виключенні самолікування. Несподівано ці цілі були успішно досягнуті за допомогою системи доставки за даним винаходом. Відповідно об'єктом даного винаходу є система підшкірної доставки, яка, включає матрикс із біодеградуючого полімерного матеріалу та щонайменше одну з фармакологічно активних речовин загальної формули (І): 8 де радикал А позначає аміногрупу -NH2, або амонійну груп у -NH3+, або радикал загальної формули (II): де кожний з Х1-Х5 незалежно позначає атом водню, лінійну або розгалужену С 1-36-алкільну груп у, лінійну або розгалужену С 1-С6алкілоксигрупу, гідроксильну групу -ОН, аміногрупу -NH2, первинну або вторинну С 1-С6алкіламіногрупу, атом галогену, нітрогрупу -NO2; при цьому зазначена речовина включена в зазначений матрикс. Оскільки фармакологічно активні речовини загальної формули (І) мають асиметрію, сполуки формули (І) о хоплюють будь-які з можливих оптично чистих ізомерів і будь-які суміші зазначених оптично чистих ізомерів. Краще, асиметричний атом вуглецю, що несе радикал А, має по суті абсолютну конфігурацію R (по відношенню до радикала А, який є аміногрупою NH2). Якщо в загальній формулі (І) радикал А є амонійною групою -NH3+, то відповідна речовина представлена в системі доставки разом з відповідним фармакологічно прийнятним протиіоном, таким як, наприклад, галогенід, краще, аніон хлору. Якщо в загальній формулі (І) радикал А є аміногрупою -NH2, то визначена в такий спосіб фармакологічно активна речовина є гуперзином А, краще, (-)-гуперзином А. (-)-Гуперзин А може бути одержаний рівною мірою або екстракцією з рослин, наприклад з Huperzia Serrata, або повним синтезом чи напівсинтезом. Обидва способи вже відомі з літератури. Якщо в загальній формулі (І) радикал А є радикалом загальної формули (II), то визначені в такий спосіб фармакологічно активні речовини 9 82226 одержують із використанням способів, описаних у патентній заявці ЕР 0806416, або за аналогією з такими способами - шляхом конденсації гуперзину А з придатними залишками, що мають альдегідну груп у, з утворенням відповідної основи Шифа. Краще, радикал А є аміногрупою -NH2, або амонійною групою -NH3+, або радикалом загальної формули (II): де кожний з Х1-Х5 незалежно позначає атом водню, метильну або етильну групу, метоксигрупу, гідроксильну груп у -ОН, аміногрупу -NH 2, метиламіногрупу або диметиламіногрупу, атом хлору або брому, нітрогрупу -NO 2. Ще краще, фармакологічно активна речовина має таку формулу (III): Основним фармакологічним ефектом визначеної вище фармакологічно активної речовини, особливо, сполуки формули (III), є її здатність інгібувати холінестерази. Крім того, сполуки формули (III) є е фективним і селективним інгібітором ацетилхолінестерази (AXE) у різних видів тварин (пацюк, велика рогата худоба та людина). При цьому вона виявляє набагато слабкішу інгібіторну активність по відношенню до бутирилхолінестерази (БуХЕ). Ці ферменти відповідають за розщеплення нейромедіатора ацетилхоліну (АХ). Тому інгібування холінестераз приводить до збільшення концентрації АХ зі збільшенням холінергічної активності в мозку і в меншому ступені також у периферичних органах 10 мішенях (наприклад, м'язах, провідній автономній нервовій системі, шлунково-кишковій системі). Завдяки такому інгібіторному профілю сполуки формули (III) є корисними при холінергічних дефіцитних розладах (наприклад при хворобі Альцгеймера, астенічному бульбарному паралічі (myasthenia gravis), деменції іншого походження, наприклад, судинного, або поліпшує когнітивну функцію у випадку пов'язаних з холінергічною системою функцій (таких як увага, пам'ять, концентрація, сприйняття, навчання) і, отже, є корисним у преморбідних станах (таких як мінімальні когнітивні розлади) або в умовах, коли є корисним постійне поліпшення когнітивної функції (наприклад, у осіб, що управляють кораблями або літаками і т.д.). Крім того, оборотне профілактичне селективне інгібування холінестерази з перевагою центрального інгібування могло б захистити суб'єктів, інтоксикованих, наприклад, органофосфатами. Дані in vitro та in vivo підтверджують, що гуперзин А має, крім того, нейропротекторні властивості. Цей подвійний фармакологічний механізм дії дозволяє фармакологічно активним речовинам загальної формули (І) здійснювати нейропротекцію при різних церебральних розладах. Ці ефекти можуть бути опосередковані через модуляцію рецептора N-метил-D-аспартату (NMDA) та інші механізми. NMDA-рецептори широко поширені в мозку та відіграють важливу роль у розвитку мозку, формуванні пам'яті та навчанні. Крім того, активність NMDA-рецепторів могла б вносити певний вклад в етіологію багатьох нейродегенеративних захворювань через механізми, описані як ексайтотоксичність. Ексайтотоксичність полягає в неконтрольованій синаптичній гіперактивності, що приводить до підвищеного вивільнення збуджувальних нейромедиаторів. Глутамат є основним збуджувальним нейромедиатором у кортикальних та гіпокампальних нейронах. Він запускає сигнальний каскад шляхом активації постсинаптичних NMD A-рецепторів. Після їхньої активації відкриття асоційованих з ними пор іонних каналів приводить до надходження Са 2+ у клітину. Надлишок внутрішньоклітинних гонів Са 2+ потім активує Са2+-залежні шляхи, які можуть приводити до загибелі нервових клітин. Багато досліджень показали, що різні нейропатологічні умови могли б бути поліпшені шляхом блокування NMDA-рецепторів. У мозку пацієнтів, що страждають хворобою Альцгеймера, підвищені рівні глутамату викликають часткову деполяризацію NMDA-рецепторів, що приводить до збільшення припливу Са2+. Тривале та постійне запобігання цього припливу Са 2+ може привести до кращих клінічних результатів при хворобі Альцгеймера (AD) та інших нейродегенеративних захворюваннях, асоційованих з ексайтотоксичністю. Крім того, було показано, що корисний нейропротекторний ефект гуперзину А забезпечує лікувальний ефект на щурячій моделі церебральної гіпоксії-ішемії. Зниження загибелі нервових клітин у значній мірі пов'язане зі зменшенням когнітивного розладу. 11 82226 У системі доставки за даним винаходом матрикс виготовлений з біодеградуючого полімерного матеріалу, і цей матеріал вибраний з групи, що включає: поліацеталі та складні ефіри поліоксикислот, поліортоефіри, поліангідриди, полілактони або їхні суміші. Краще, складні ефіри поліоксикислот вибрані з групи, що включає гомополімери та співполімери D-молочної кислоти та/або L-молочної кислоти, та/або гліколевої кислоти, та їхні блок-полімери з поліетиленгліколем; і полілактони вибрані з групи, що включає полікапролактон, полі(3гідроксибутиролактон) і співполімер гідроксибутиролактону та гідроксивалеролактону. Ще краще, біодеградуючий полімерний матеріал вибраний з групи, що включає полімолочну кислоту та співполімери D-молочної кислоти та/або L-молочної кислоти, та/або D,Lмолочної кислоти, та/або гліколевої кислоти. Ще краще, біодеградуючий полімерний матеріал вибраний з групи, що складається з полі(D,Lлактид-ко-гліколіду) та полілактиду. Співвідношення між D,L-лактидом і гліколідом, що утворюють біодеградуючий полімерний матеріал, знаходиться в діапазоні від 25:75 до 100:0 мол. %, краще, від 50:50 до 75:25 мол. %. Характеристична в'язкість біодеградуючого полімерного матеріалу находиться в діапазоні від 0,10 до 0,9дл/г, краще, від 0,15 до 0,6дл/г. Співвідношення були визначені за результатами реєстрації ЯМР-спектрів зазначеного полімеру, й вказані значення повинні розглядатися як такі, що мають звичайні межі погрішності. Значення характеристичної в'язкості вимірюють при температурі 25°С для розчину полімеру в хлороформі в концентрації 0,5г/дл, і дані значення повинні розглядатися у звичайних межах помилки. Шляхом належного вибору із запропонованих вище інтервалів значень між, з одного боку, співвідношенням D,L-лактиду та гліколіду в полімері полі(D,L-лактид-ко-гліколіду) та, з іншого боку, характеристичною в'язкістю, фахівець в цій області техніки зможе легко вибрати відповідний полімер полі(D,L-лактид-ко-гліколід), придатний для використання як матриксна система доставки за даним винаходом, що забезпечує поступове та контрольоване вивільнення фармакологічно активних речовин загальної формули (І) протягом щонайменше одного місяця. Як правило, вибраний полімер є комерційно доступним. Наприклад, Boehringer Ingelheim (Німеччина) пропонує полімер полі(D,L-лактид-ко-гліколід) під торговою назвою Resomer®, що має молярне співвідношення D,Lлактид/гліколід 75:25 і характеристичну в'язкість в діапазоні від 0,14 до 0,22дл/г, a Mitsui Chemicals (Японія) пропонує полімер полі(D,L-лактид-когліколід) під торговою назвою PLGA 5-50, що має молярне співвідношення D,L-лактид/гліколід 50:50 і характеристичну в'язкість в діапазоні від 0,47 до 0,53дл/г. Краще, система доставки за даним винаходом має форму твердого імплантату. Для цього твердого імплантату може передбачатися будьяка форма. Краще, цей твердий імплантат має циліндричну форму. 12 Ще одним об'єктом даного винаходу є спосіб одержання системи доставки за даним винаходом. Цей спосіб включає такі стадії: a) приготування гомогенної суміші відповідної кількості сухого порошку щонайменше однієї фармакологічно активної речовини загальної формули (І) та відповідної кількості сухого порошку зазначеного біодеградуючого полімерного матеріалу; b) екструдування суміші, одержаної на стадії (а), з контрольованою швидкістю через штамп з відповідним круглим перерізом при температурі від 60°С до 120°С; c) нарізування екструдата, одержаного на стадії (b), по суті в поперечному напрямку на шматочки відповідної довжини з одержанням твердих імплантатів; і d) стерилізація імплантатів, одержаних на стадії (с). Якщо фармакологічно активною речовиною є сполуки формули (III), a полімерний матеріал є полімером полі(D,L-лактид-лактид-ко-гліколідом), то відносне співвідношення цієї активної речовини, в % мас. по відношенню до загальної маси одержаного імплантату, становить від 20 до 60%, краще, від 25 до 35%. Придатний розмір для відповідних порошків може бути легко вибраний фа хівцем. Краще, на стадії (b) даного способу температура становить від 60 до 100°С, ще краще, від 60°С до 90°С. Краще, внутрішній діаметр штампа становить менше 1,6мм, і одержаний екструдат нарізають шматками довжиною від 2 до 6мм. Цей спосіб є особливо зручним для одержання системи доставки за даним винаходом, що включає фармакологічно активну речовину загальної формули (І), у якій А позначає радикал формули (II), тому що на жодній стадії способу не застосовують воду, що фактично запобігає будьякому руйнуванню зазначеної речовини в процесі здійснення способу або вже після одержання системи доставки. Одержана система доставки задовольняє критеріям стабільності відповідно до фармакопеї та може місяцями зберігатися при кімнатній температурі (близько 25°С). Іншим об'єктом даного винаходу є застосування системи доставки, як вона визначена вище, для виготовлення лікарського засобу для лікування суб'єкта, що страждає холінергічними дефіцитними розладами, та/або для поліпшення пов'язаних з холінергічною системою функцій суб'єкта. Такі розлади включають хворобу Альцгеймера, помірні когнітивні розлади, астенічний бульбарний параліч, деменцію, деменцію судинного походження; і когнітивні функції, залучені в процеси, що протікають у людини, вибрані з групи, яка включає сприйняття, увагу, навчання, пам'ять, мислення, формування понять, читання, рішення проблем і мову. У застосуванні за даним винаходом лікарський засіб призначений також для профілактики та/або для лікування суб'єкта, підданого дії агентів з холінестеразною інгібіторною активністю та/або інтоксикованого такими агентами. Більшість 13 82226 зазначених агентів належить до групи органофосфатів. Систему доставки за даним винаходом вводять безпосередньо під шкіру в черевній області або в інших звичайно використовуваних місцях для підшкірного введення лікарських препаратів (наприклад, в рук у, стегно). Медичний працівник зможе зробити складку шкіри на животі, встромити голку під шкіру та увести імплантат. Перед введенням може бути використаний місцевий анестетик для зменшення можливого дискомфорту. Передбачається, що систему доставки за даним винаходом слід вводити з регулярними інтервалами від декількох тижнів до місяця, краще, з інтервалами щонайменше в один місяць і, можливо, 3 місяці або навіть більше, і дозовий діапазон становить від 3мг до 50мг у перерахунку на речовину формули (III). Доза може бути скоригована залежно від реакції пацієнта та може потребувати застосування відповідного пристрою для введення, наприклад, будь-якого комерційно доступного троакара. Цей пристрій дозволяє спростити та проконтролювати введення конкретної дози шляхом введення декількох імплантатів через одну ділянку для ін'єкції. Додаткова перевага підшкірної ін'єкції полягає в тому, що вона, як правило, краще переноситься, ніж внутрішньом'язова ін'єкція, наприклад, з мікросферами, аналогічними відомим з рівня техніки. Крім того, дія фармакологічно активної речовини може бути припинена, якщо потрібно перервати лікування. Підшкірне введення імплантату можна здійснити так саме просто, як внутрішньом'язове введення мікросфер. Підшкірний шлях також дає можливість легко контролювати місцеву переносимість. Імплантат може бути витягнутий за допомогою простої та мінімально інвазивної хірургічної процедури у випадку місцевої або загальної непереносимості. Система доставки за даним винаходом, її одержання та її властивості описані в наступних Прикладах. Ці приклади проілюстровані графічними матеріалами, де: На Фіг.1 представлений фармакокінетичний профіль сполуки формули (III) після однократного підшкірного введення пацюкам препарату з уповільненим вивільненням за Прикладом 1; і На Фіг.2 представлений фармакокінетичний профіль сполуки формули (III) після однократного підшкірного введення пацюкам препарату з уповільненим вивільненням за Прикладом 2. Приклад 1 Наступну процедуру, відому як суха екструзия, використовували для одержання імплантатів, що складаються з полімеру полі(D,L-лактид-когліколіду) та сполуки формули (III). Спочатку наготовлювали суміш шляхом змішування 14,0г здрібненого (500мкм) полі(D,Lлактид-ко-гліколіду) (молярне співвідношення D,Lлактид/гліколід: від 54/51 до 46/49 мол. %; характеристична в'язкість: 0,47-0,53дл/г у хлороформі (0,5г/дл в СНСІ3) при 25°С; відомий під назвою PLGA 5-50, Mitsui Chemicals Inc.) та 6,0г 14 сполуки формули (III) у кульовому млині (400об./хв., 4 хв.). Потім одержану суміш екструдували через розташовані послідовно зони гвинтового екструдера при температурах 70, 80, 90, 90°С через штамп діаметром 1,3мм. Одержаний екструдат, що містить сполуки формули (III) (теоретичне завантаження активної зони 30% мас./мас), розрізали на імплантати (середній діаметр 1,5мм) та стерилізували гаммавипромінюванням (25кГр). Імплантати тестували на пацюках відповідно до такого способу. Групі з шести 10-11-тижневих самців пацюків Sprague-Dawley робили однократне підшкірне введення імплантату (доза приблизно 15мг/кг сполуки формули (III), тобто 37мкмоль/кг) під шкіру шиї за допомогою троакара. За день до введення відбирали контрольний зразок плазми. Зразки плазми для кількісного визначення ліків потім збирали через 2 год., 6 год., 8 год., 10 год. після введення дози, і потім двічі на тиждень від 2 до 35 дня після введення. Рівні в плазмі крові як сполуки формули (III), так і утворюваного in vi vo гуперзину А вимірювали одночасно в зразках плазми пацюків методом РХ/МС/МС, використовуючи відновник, такий як NaBH 4, як інгібітор гідролізу основи Шифа. Для кожного пацюка визначали криві залежності концентрації від часу, які представлені на Фіг.1. Розраховували середні фармакокінетичні профілі [±SEM (стандартна середня погрішність), n=6]. Протягом усього дослідження тварин спостерігали на вияви клінічних ознак. Наприкінці дослідження тварин умертвляли, і ділянку імплантації видаляли для оцінки місцевого запалення та руйнування імплантату. Можна зробити такі висновки. Поступове вивільнення гуперзину А (одержаного шляхом гідролізу in vivo сполуки формули (III)) у плазму спостерігали між 7 та 35 днями, при цьому нульовий день є днем введення. Постійні рівні гуперзину А у плазмі були досягнуті протягом 1місячного періоду, тоді як рівні сполуки формули (III) були нехтовно малими. Розходження між окремими особами були невеликими. Протягом усього дослідження не спостерігали ніяких клінічних ознак і ніяких ознак місцевої непереносимості. Імплантати майже повністю руйнувалися протягом 35 днів після введення. Приклад 2 Наступну процедуру, аналогічну описаній у Прикладі 1, використовували для одержання імплантатів, але з іншим полі(D,L-лактид-когліколідним) полімером. Спочатку суміш наготовлювали шляхом змішування 14,0г здрібненого полі(D,L-лактид-когліколіду) (молярне співвідношення D,Lлактид/гліколід: від 76/74 до 24/26; характеристична в'язкість: 0,16-0,20дл/г, (0,1% у хлороформі при 25°С); відомий під назвою Resomer RG 75:25Н, Boehringer Ingelheim) і 6,0г сполуки формули (III) у кульовому млині (400об./хв., 4 хв.). Потім одержану суміш екструдували через розташовані послідовно зони гвинтового екструдера з температурами 60, 70, 80, 75°С через штамп діаметром 1,3мм. Одержаний 15 82226 екструдат, що містить сполуки формули (ІІІ) (теоретичне завантаження активної зони 30% мас/мас), розрізали на імплантати (середній діаметр 1,3мм) і стерилізували гаммавипромінюванням (25кГр). Імплантати тестували на пацюках відповідно до способу, описаного в Прикладі 1, і визначали відповідні криві залежності концентрації від часу для кожного пацюка, які представлені на Фіг.2. Можна зробити такі ж висновки, що й для Прикладу 1. Препарати з уповільненим вивільненням, приготовлені у відповідності з такими способами, задовольняють всім цілям даного винаходу. Приклад 3 Імплантати, що складаються з полімеру полі(D,L-лактид-ко-гліколіду) й сполуки формули (III), одержували шляхом екструзії плівки у відповідності до такої процедури. Спочатку з етилацетату видаляли воду шляхом суспендування безводного сульфату магнію в розчиннику та наступного видалення осушника фільтрацією. 600мг сполуки формули (III) розчиняли в 10,0г етилацетату. Суспензію полімеру наготовлювали шляхом суспендування 1,40г полімеру полі(D,L-лактид-ко-гліколіду) (50:50) в 80,0г етилацетату. С успензію обробляли ультразвуком протягом 15 хвилин. Розчин сполуки формули (III) і суспензію полімеру поміщали в круглодонну колбу. Цю круглодонну колбу нагрівали до 37°С та обертали при 75об./хв., видаляючи в такий спосіб приблизно 90% розчинника шляхом випаровування. В'язку суспензію виливали на тефлоновий лист, сушили у витяжній шафі, а потім під вакуумом у сушильній печі при кімнатній температурі для формування плівки. Маса одержаної плівки становила 1,64г. Плівку розрізали на шматочки та екструдували при температурі 54°С через штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати мали середній діаметр 1,30мм і містили 24,80% мас. сполуки формули (III). Чистота включеної активної речовини становила 95,06%. Приклад 4 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що складаються з полімеру полі(D,L-лактид-когліколіду) та сполуки формули (III). Спочатку полімер полі(D,L-лактид-ко-гліколід) (50:50) подрібнювали для одержання мікрогранул. Потім готовили фізичну суміш шляхом змішування 1400мг здрібненого полімеру та 600мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 7177°С через штамп 0,8мм, використовуючи прессекструдер. Одержаний екструдат важив 1,3г. Екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати мали середній діаметр 1,3мм і містили 30% мас./мас. сполуки формули (III). Чисто та включеної активної речовини становила 97,56%. Імплантати вводили пацюкам підшкірно. 16 Приклад 5 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що складаються з полімеру полі(D,L-лактид-когліколіду) і сполуки формули (III), Спочатку наготовлювали фізичну суміш шляхом змішування 1400мг полімеру полі(D,Lлактид-ко-гліколіду) (50:50), відомого як Resomer® RG 503Н (D,L-лактид: 48-52 мол. %; гліколід: 48-52 мол. %; характеристична в'язкість: 0,1% в СНСІ3 при 25°С: 0,32-0,44дл/г), і 600мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 74°С через штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат важив 1,320г. Екструдат розрізали на імплантати та стерилізували гаммавипромінюванням. Імплантати мали середній діаметр 1,40мм і містили 27,65% мас. сполуки формули (III). Чисто та включеної активної речовини становила 97,37%. Імплантати вводили пацюкам підшкірно. Приклад 6 Імплантати, що складаються з полімеру полі(D,L-лактид-ко-гліколіду) і сполуки формули (III), одержували шляхом екструзії плівки відповідно до такої процедури. Спочатку з етилацетату видаляли воду шляхом суспендування безводного сульфату магнію в розчиннику та наступного видалення осушника фільтрацією. 900мг сполуки формули (III) розчиняли в 20,0г етилацетату. Розчин полімеру готовили шляхом розчинення 2,10г полімеру полі(D,L-лактид-ко-гліколіду) (50:50) з кінцевими групами лаурилового ефіру в 20,0г етилацетату. Два розчини поміщали в круглодонну колбу, яку обертали при 75об./хв.. Розчин нагрівали до 37°С. Масу розчину зменшували на 33г шляхом випаровування розчинника. В'язкий розчин виливали на лист тефлону. В'язкий розчин сушили у витяжній шафі, а потім під вакуумом у сушильній печі при кімнатній температурі для формування плівки. Маса одержаної плівки становила 2,77г. Плівку розрізали на шматочки та екструдували при температурі 38-49°С через штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат важив 1,18г. Екструдат розрізали на імплантати та стерилізували гаммавипромінюванням. Імплантати мали середній діаметр 1,2мм і містили 26,50% (мас./мас ) сполуки формули (III). Чисто та включеної активної речовини становила 94,74%. Імплантати вводили пацюкам підшкірно. Приклад 7 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що складаються з полімеру полі(лактид-ко-гліколіду) та сполуки формули (III). Спочатку полімер полі(D,L-лактид-ко-гліколід) (50:50) з кінцевими групами лаурилового ефіру подрібнювали для одержання мікрогранул. Фізичну суміш наготовлювали шляхом змішування 1,400г здрібненого полімеру та 600мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 65°С через 17 82226 штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат важив 1,170г. Екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати мали середній діаметр 1,3мм і містили 27,59% мас. сполуки формули (III). Чисто та включеної активної речовини становила 97,43%. Імплантати вводили пацюкам підшкірно. Приклад 8 Імплантати, що складаються з полімеру полі(D,L-лактид-ко-гліколіду) І сполуки формули (III), одержували шляхом екструзії плівки відповідно до такої процедури. Спочатку з етилацетату видаляли воду шляхом суспендування безводного сульфату магнію в розчиннику та наступного видалення осушника фільтрацією. Потім 600мг сполуки формули (III) розчиняли в 14,8г етилацетату. Потім наготовлювали розчин полімеру шляхом розчинення 1,4г полімеру полі(D,L-лактид-когліколіду) (75:25) (відомого як Resomer® RG 75:25Н; молярне співвідношення D,Lлактид/гліколід: від 76/74 до 24/26; характеристична в'язкість: 0.16-0.20дл/г, (0,1% у хлороформі при 25°С) в 15,2 г етилацотпту. Розчин сполуки формули (III) і розчин полімеру поміщали в круглодонну колбу. Цю круглодонну колбу нагрівали до 37°С та обертали при 75об./хв., видаляючи в такий спосіб приблизно 90% розчинника шляхом випаровування. В'язку суспензію виливали на тефлоновий лист, сушили у витяжній шафі, а потім під вакуумом у сушильній печі при кімнатній температурі для формування плівки. Маса одержаної плівки становила 1,56г. Плівку розрізали на шматочки та екструдували при температурі 59°С через штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Діаметр імплантатів становив приблизно 1,3мм. Імплантати містили 24,8% мас. сполуки формули (III). Чистота включеної активної речовини становила.92,59%. Імплантати вводили пацюкам підшкірно. Приклад 9 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що складаються з полімеру полі(D,L-лактид-когліколіду) І сполуки формули (III). Спочатку наготовлювали фізичну суміш шляхом змішування 1400мг полімеру полі(D,Lлактид-ко-гліколіду) (75:25) (відомого як Resomer® RG 75:25Н; молярне співвідношення D,Lлактид/гліколід: від 76/74 до 24/26; характеристична в'язкість: 0,16-0,20дл/г (0,1% у хлороформі при 25°С)) та 600мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 65°С через штамп 0,8мм, використовуючи пресс-екструдер. Одержаний екструдат важив 1,283г. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати мали середній діаметр 1,5мм і містили 27,2% мас. сполуки формули (III). Чисто та включеної активної речовини становила 97,3%. 18 Приклад 10 Імплантати одержували шляхом екструзії мікросфер. 3,5г полімеру полі(D,L-лактид-ко-гліколіду) (50:50), відомого як Resomer RG 503Н (D,L-лактид: 48-52 мол. %; гліколід: 48-52 мол. %; характеристична в'язкість: 0,1% в СНСІ3 при 25°С: 0,32-0,44дл/г), розчиняли в 60г дихлорметану. 1,5г сполуки формули (III) розчиняли в 35г дихлорметану, потім вливали в розчин полімеру. Одержану суміш розпорошували з використанням мініпристрою для сушіння розпилюванням при температурі 45°С, що приводило до утворення мікросфер. Імплантати різних діаметрів формували шляхом екструзії цих мікросфер через штампи діаметром від 1,0 до 2,0мм при температурах від 60 до 95°С. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати вводили підшкірно. Приклад 11 Імплантати одержували шляхом екструзії мікросфер. 3,0г полімеру полі(D,L-лактиду) зі складноефірними кінцевими групами (із характеристичною в'язкістю 0,09-0,10дл/г, вимірюваною при 0,5г/дл в СНСІ3 при 30°С, одержаного від Absorbable Polymer Technologies) розчиняли в 60г дихлорметану. 2,0г сполуки формули (III) розчиняли в 35г дихлорметану, потім вливали в розчин полімеру. Одержану суміш розпорошували з використанням мініпристрою для сушіння розпилюванням при температурі 40°С, що приводило до утворення мікросфер. Імплантати різних діаметрів формували шляхом екструзії цих мікросфер через штампи діаметром від 1,0 до 2,0мм при температурах від 60-95°С. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати вводили підшкірно. Приклад 12 Імплантати одержували шляхом екструзії мікросфер. 3,0г полімеру полі(D,L-лактиду) (не містить СООН, із характеристичною в'язкістю 0,090,10дл/г, вимірюваною при 0,5г/дл в СНСІ3, при 30°С, одержаний від Absorbable Polymer Technologies) розчиняли в 60г дихлорметану. 2,0г сполуки формули (III) розчиняли в 35г дихлорметану, потім вливали в розчин полімеру. Одержану суміш розпорошували з використанням мініпристрою для сушіння розпилюванням при температурі 40°С, що приводило до утворення мікросфер. Імплантати різних діаметрів формували шляхом екструзії цих мікросфер через штампи діаметром від 1,0 до 2,0мм при температурах від 60 до 95°С. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Приклад 13 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що 19 82226 складаються з полімеру полі(D,L-лактиду) і сполуки формули (III). Спочатку готовили фізичну суміш шляхом змішування 2,1г здрібненого полімеру полі(D,Lлактиду) з кінцевими складноефірними групами (із характеристичною в'язкістю 0,09-0,10дл/г, вимірюваною при 0,5г/дл в СНСІ3 при 30°С, одержаний від Absorbable Polymer Technologies) і 900мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 30-50°С через штампи 1,0-2,0мм, використовуючи пресс-екструдер. Одержимий єкструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати вводили підшкірно. Приклад 14 Процедуру, відому як суха екструзія, використовували для одержання імплантатів, що складаються з полімеру полі(D,L-лактиду) і сполуки формули (III). Спочатку готовили фізичну суміш шляхом змішування 2,1г здрібненого полімеру полі(D,Lлактиду) (не містить СООН, із характеристичною в'язкістю 0,09-0,10дл/г, вимірюваною при 0,5г/дл в СНСІ3 при 30°С, одержаний від Absorbable Polymer Technologies) і 900мг сполуки формули (III) з використанням ступки та товкачика. Фізичну суміш екструдували при температурі 30-50°С через штампи 1,0-2,0мм, використовуючи прессекструдер. Одержаний екструдат розрізали на імплантати та стерилізували гамма-випромінюванням. Імплантати вводили підшкірно. 20
ДивитисяДодаткова інформація
Назва патенту англійськоюSubcutaneous delivery system, process for the preparation of the same and use of the same for the treatment of cholinergic deficient disorders
Автори англійськоюMauvernay Rolland-Yves, Porchet Herve, Scalfaro Pietro, Heimgartner Frederic, Ducrey Bertrand, Pfefferle Francois, Capancioni Sergio, Mc Cormick Mark
Назва патенту російськоюСистема подкожной доставки ингибитора холинестеразы в форме твердого имплантата, способ ее получения, и ее применения для лечения холинергических дефицитных расстройств
Автори російськоюМовернай Ролланд-Йвес, Поршет Херве, Скалфаро Пьетро, Хеймгартнер Фредерик, Дьюкрей Бертранд, Фефферль Франкуас, Капансьони Серж, Мк Кормик Марк
МПК / Мітки
МПК: A61P 39/00, A61P 21/00, A61P 25/28, A61K 47/34, A61K 31/465, A61K 9/52
Мітки: спосіб, дефіцитних, розладів, твердого, імплантату, холінестерази, система, форми, лікування, одержання, підшкірної, застосування, холінергічних, доставки, інгібітора
Код посилання
<a href="https://ua.patents.su/10-82226-sistema-pidshkirno-dostavki-ingibitora-kholinesterazi-u-formi-tverdogo-implantatu-sposib-oderzhannya-ta-zastosuvannya-dlya-likuvannya-kholinergichnikh-deficitnikh-rozladiv.html" target="_blank" rel="follow" title="База патентів України">Система підшкірної доставки інгібітора холінестерази у формі твердого імплантату, спосіб її одержання та її застосування для лікування холінергічних дефіцитних розладів</a>
Попередній патент: Електродетонатор
Наступний патент: 7-азаіндоли та їх застосування як терапевтичних засобів, спосіб їх одержання, лікарський засіб на їх основі
Випадковий патент: Спосіб вирощування рослин моркви












