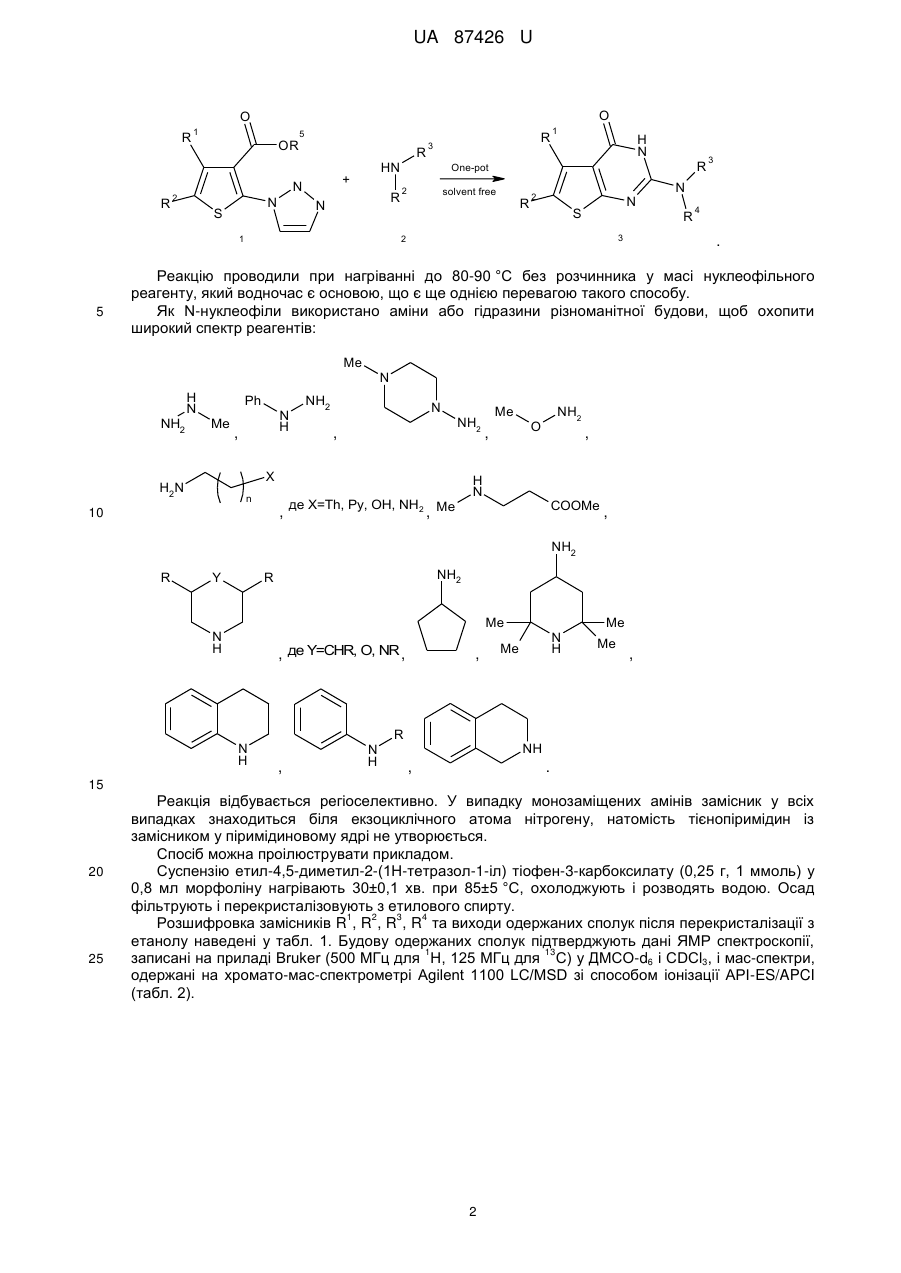
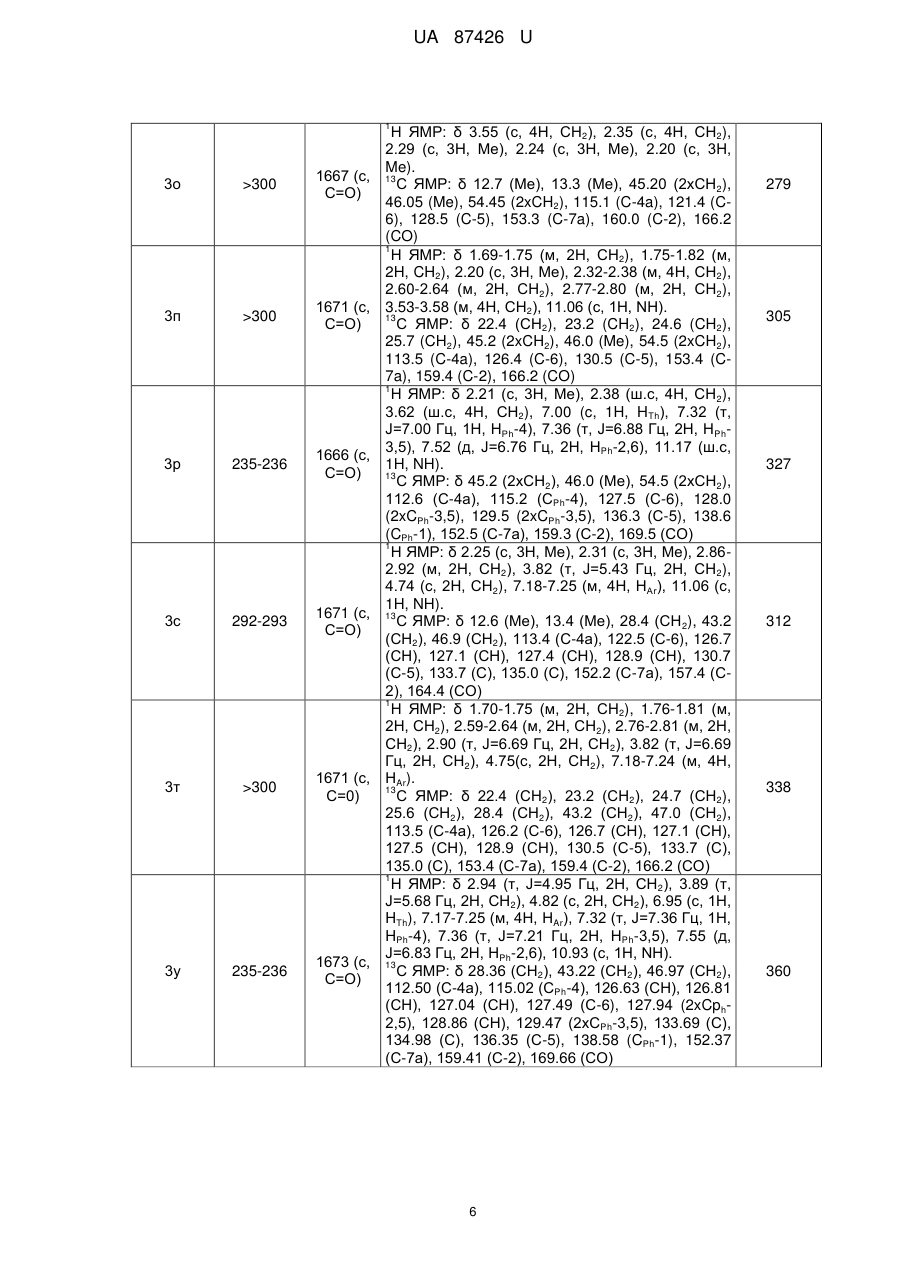
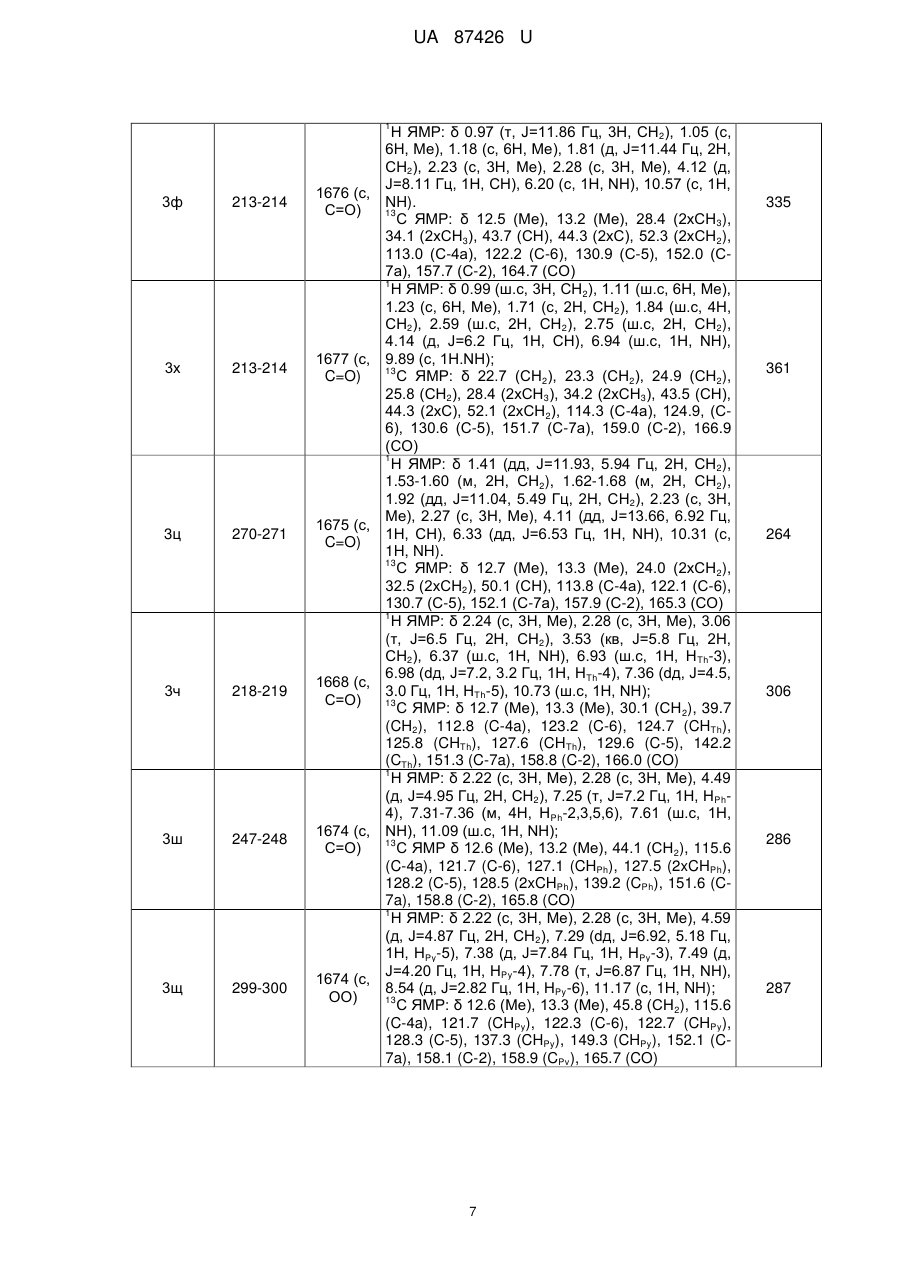
Спосіб одержання 2-r3,r4-аміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів
Номер патенту: 87426
Опубліковано: 10.02.2014
Автори: Шийка Ольга Ярославівна, Походило Назарій Тарасович, Обушак Микола Дмитрович
Формула / Реферат
Спосіб одержання 2-R3,R4-аміно-5-R1-6-R2-тієно[2,3-d]піримідин-4(3H)-онів, що включає взаємодію тієнотетразолів з нуклеофільним реагентом, який відрізняється тим, що як нуклеофільний реагент використовують аміни або гідразини, при цьому суспензію тієнотетразолу і аміну чи гідразину нагрівають 30-60 хв. при 80-90 °C, охолоджують до кімнатної температури, розводять водою до початку утворення осаду, осад відфільтровують, перекристалізовують з етанолу і одержують сполуки загальної формули:
 ,
,
де R1=алкіл, арил;
R2=H, алкіл;
R3, R4=Н, алкіл, арил, гетарил.
Текст
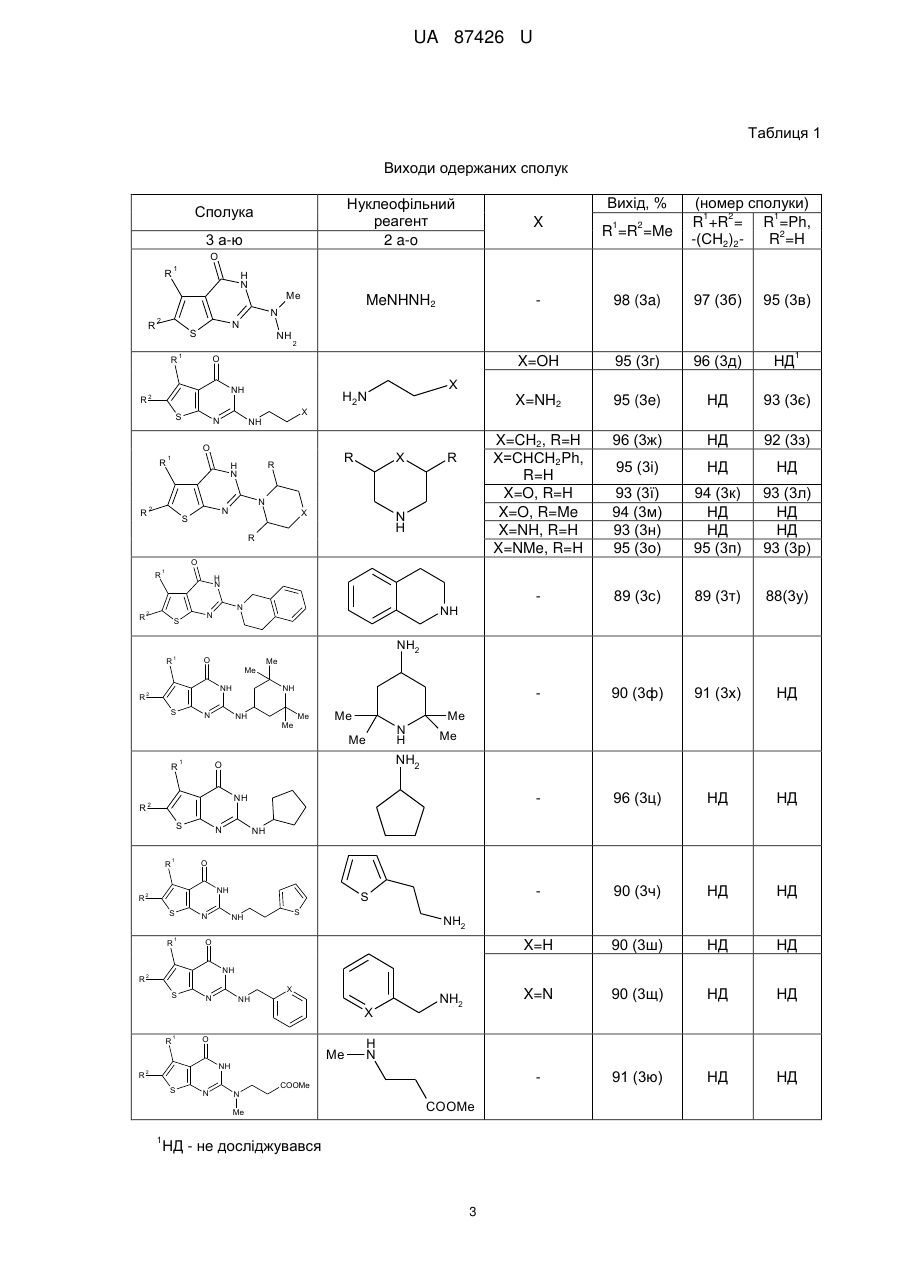
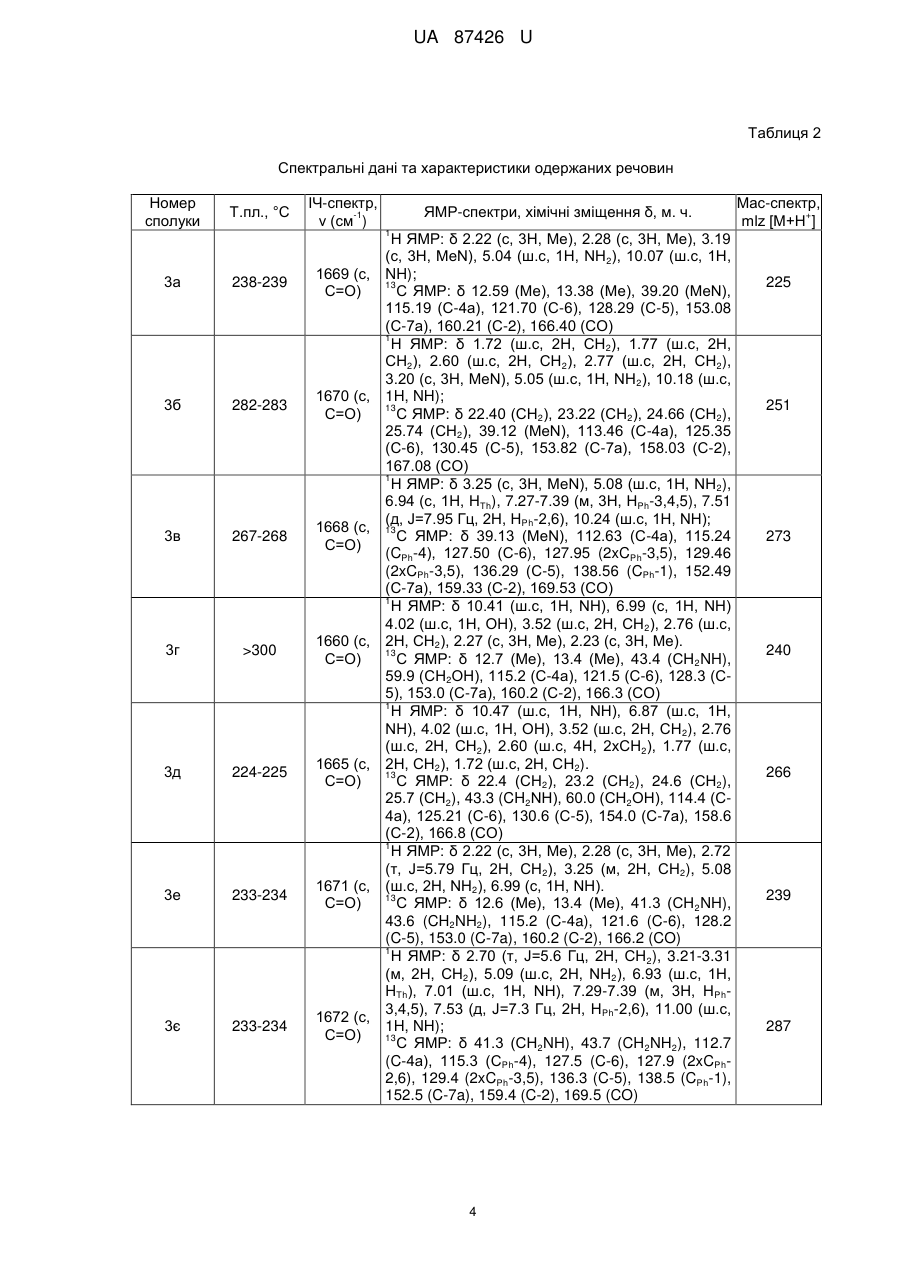
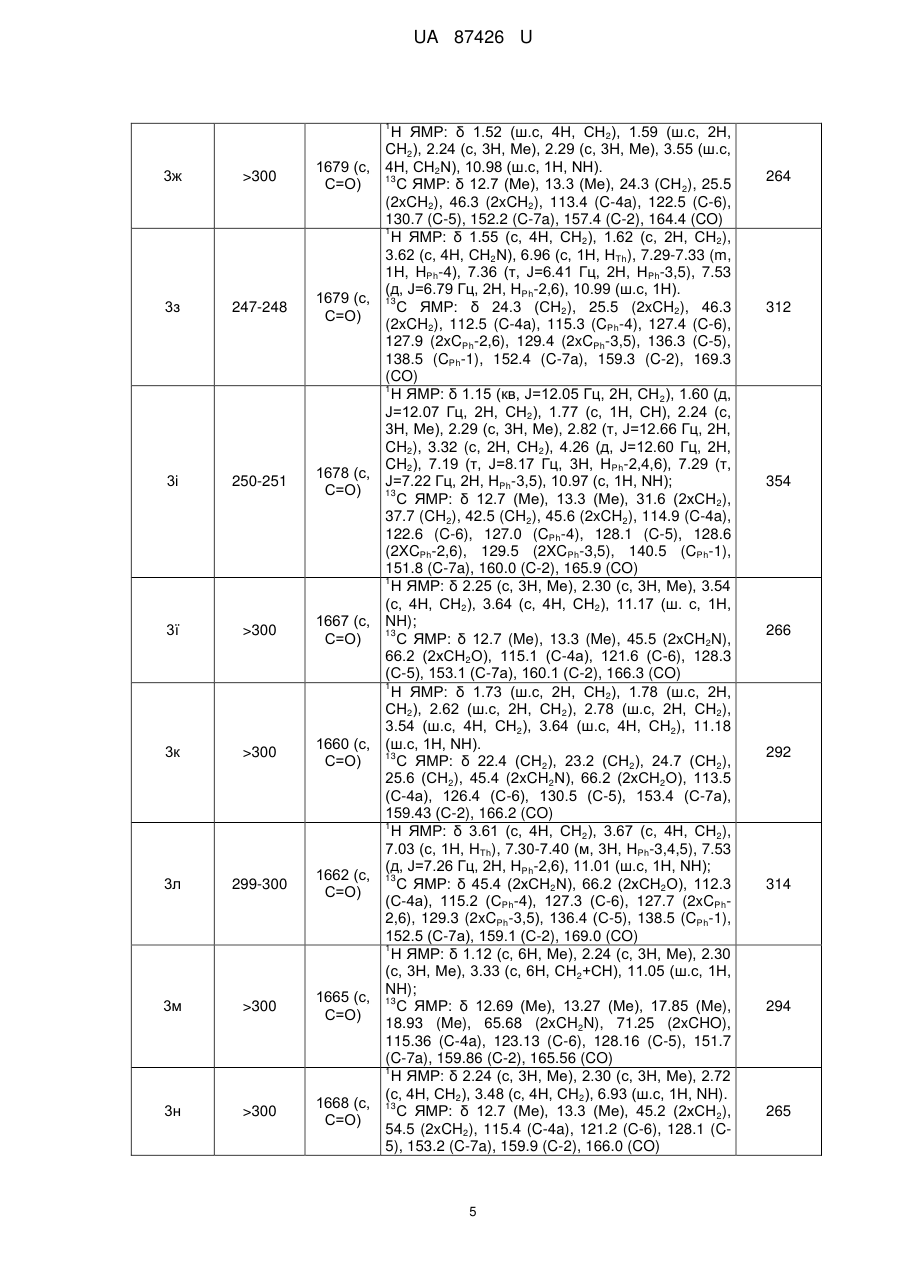
Реферат: 3 4 1 2 Спосіб одержання 2-R ,R -аміно-5-R -6-R -тієно[2,3-d]піримідин-4(3H)-онів включає взаємодію тієнотетразолів з нуклеофільним реагентом. Як нуклеофільний реагент використовують аміни або гідразини. При цьому суспензію тієнотетразолу і аміну чи гідразину нагрівають 30-60 хв. при 80-90 °C, охолоджують до кімнатної температури, розводять водою до початку утворення осаду, осад відфільтровують, перекристалізовують з етанолу і одержують сполуки загальної формули: O R R 1 H N 2 S N R 3 N R 4 , 1 де R =алкіл, арил; 2 R =H, алкіл; 3 4 R , R =Н, алкіл, арил, гетарил. UA 87426 U (12) UA 87426 U UA 87426 U 5 10 15 20 25 30 Корисна модель належить до органічної хімії, а саме способів одержання практично корисних органічних сполук, які можуть бути використані у фармакології як біологічно активні сполуки, зокрема як протиракові агенти. В зв'язку з розвитком методів органічного синтезу в останні роки найбільш популярними і цінними є одностадійні синтези, які дають змогу одержувати складні молекулярні системи з простих доступних реагентів [Dömling, A.; Wang, W.; Wang, K. Chem. Rev., 2012, 112, 3083., Dömling, A. Org. Chem. Highlights, 2005, April 5]. Відомий спосіб синтезу тієно[2,3-d]піримідинонів, в яких вихідними реагентами є амінотіофени Ґевальда [Litvinov V.P. Advances in Heterocyclic Chemistry. 2006, 92, 83]. Спосіб полягає у взаємодії амінотіофенів із заміщеними амідами з утворенням етокскикарбонілтієніламідів, які внаслідок внутрішньомолекулярної циклізації утворюють дизаміщені тієнопіримідинони. Недоліком цього способу є його багатостадійність, що збільшує енерговитрати, трудомісткість процедур, час, необхідний на одержання цільового продукту, і зниження загального виходу кінцевих сполук. 1 2 Найближчим аналогом-прототипом є спосіб синтезу 2,3-діаміно-5-R -6-R -тієно[2,36 d]піримідин-4(3Н)-онів [Пат. 44651 Україна, МПК С07D 405/00, С07D 333/00, С07D 257/00. 1 2 Спосіб одержання 2,3-діаміно-5-R -6-R -тієно[2,3-d]піpимідин-4(3Н)-онів / Походило Н.Т., Обушак М.Д., Матійчук В.С.; заявник і власник Львівський національний університет імені Івана 1 Франка; опубл. 12.10.2009, бюл. № 19], що полягає у взаємодії алкіл 2-(1Н-тетразол-1-іл)-4-R -52 R -тіофен-3-карбоксилатів, одержаних з алкіл-2-аміно-тіофен-3-карбоксилатів реакцією з триетилортоформіатом і натрію азидом, з гідразину гідратом. Проте за цим способом неможливо одержувати функціонально заміщені 2-аміно-тієно[2,3d]піримідини. 3 4 В основу корисної моделі поставлено задачу удосконалити спосіб одержання 2-R ,R -аміно1 2 5-R -6-R -тієно[2,3-d]піримідин-4(3H)-онів шляхом використання комерційно доступних реагентів і реакцій, що дасть змогу одержати широкий спектр цільових важкодоступних функціонально заміщених тієнопіримідинів з високими виходами. 3 4 1 2 Поставлена задача вирішується тим, що у способі одержання 2-R ,R -аміно-5-R -6-R тієно[2,3-d]піримідин-4(3H)-онів, що включає взаємодію тієнотетразолів з нуклеофільним реагентом, де як нуклеофільний реагент використовують аміни або гідразини, при цьому суспензію тієнотетразолу і аміну чи гідразину нагрівають 30-60 хв. при 80-90 °C, охолоджують до кімнатної температури, розводять водою до початку утворення осаду, осад відфільтровують, перекристалізовують з етанолу і одержують сполуки загальної формули: O R R 35 40 45 50 1 H N 2 S N R 3 N R 4 , де R =алкіл, арил; 2 R =H, алкіл; 3 4 R , R =Н, алкіл, арил, гетарил. З літературних джерел відомо, що похідні тієнопіримідинів є привабливими сполуками для фармацевтичних досліджень, які знайшли застосування, зокрема, як протиракові та противірусні агенти [Jordan, A.; Bedford, S.; Burkhard, K.; Yule, I.; Poullennec, K.; US 2010/0298349 A1., McClellan, W. J.; Dai, Y.; Abad-Zapatero, C; Albert, D.H.; Bouska, J.J.; Glaser, K.В.; Magoc, T.J.; Marcotte, P.A.; Osterling, D.J.; Stewart, K.D.; Davidsen, S.K.; Michaelides, M.R. Bioorg. Med. Chem. Lett. 2011, 21, 5620., Heffron, T.P.; Wei, B.Q.; Olivero, A.; Staben, S.Т.; Tsui, V.; Do, S.; Dotson, J.; Folkes, A.J.; Goldsmith, P.; Goldsmith, R.; Gunzner, J.; Lesnick, J.; Lewis, C.; Mathieu, S.; Nonomiya, J.; Shuttleworth, S.; Sutherlin, D.P.; Wan, N.C; Wang, S.; Wiesmann, C.; Zhu, B.-Y. J. Med. Chem. 2011, 54, 7815]. Автори вперше розробили одностадійну, універсальну, просту та ефективну схему синтезу різноманітних важкодоступних заміщених тієно[2,3-d]піримідин-4(3Н)-онів (3) з алкіл-2-(1Н1 2 тетразол-1-іл)-4-R -5-R -тіофен-3-карбоксилатів (1) та амінів чи гідразинів (2): 1 1 UA 87426 U O O R R 1 OR 5 N S HN + N 2 R N 1 5 R R 3 1 H N R One-pot solvent free 2 R 2 N S 3 2 3 N R 4 . Реакцію проводили при нагріванні до 80-90 °C без розчинника у масі нуклеофільного реагенту, який водночас є основою, що є ще однією перевагою такого способу. Як N-нуклеофіли використано аміни або гідразини різноманітної будови, щоб охопити широкий спектр реагентів: Me NH2 H N Ph Me N H , N NH2 N , NH2 X H2N n , 10 де X=Th, Py, OH, NH2 Me , Me , NH2 O , H N COOMe , NH2 R Y NH2 R Me N H , де Y=CHR, O, NR , N H , N H , R N H Me Me Me , NH , . 15 20 25 Реакція відбувається регіоселективно. У випадку монозаміщених амінів замісник у всіх випадках знаходиться біля екзоциклічного атома нітрогену, натомість тієнопіримідин із замісником у піримідиновому ядрі не утворюється. Спосіб можна проілюструвати прикладом. Суспензію етил-4,5-диметил-2-(1Н-тетразол-1-іл) тіофен-3-карбоксилату (0,25 г, 1 ммоль) у 0,8 мл морфоліну нагрівають 30±0,1 хв. при 85±5 °C, охолоджують і розводять водою. Осад фільтрують і перекристалізовують з етилового спирту. 1 2 3 4 Розшифровка замісників R , R , R , R та виходи одержаних сполук після перекристалізації з етанолу наведені у табл. 1. Будову одержаних сполук підтверджують дані ЯМР спектроскопії, 1 13 записані на приладі Bruker (500 МГц для Н, 125 МГц для С) у ДМСО-d6 і CDCl3, і мас-спектри, одержані на хромато-мас-спектрометрі Agilent 1100 LC/MSD зі способом іонізації АРІ-ES/APCI (табл. 2). 2 UA 87426 U Таблиця 1 Виходи одержаних сполук Вихід, % (номер сполуки) 1 2 1 R +R = R =Ph, 2 -(СН2)2R =H Нуклеофільний реагент 2 a-o 98 (3a) 97 (3б) 95 (3в) X=OH 95 (3г) 96 (3д) НД X=NH2 95 (3e) НД 93 (3є) X=CH2, R=H Х=CHCH2Ph, R=H X=O, R=H X=O, R=Me X=NH, R=H X=NMe, R=H 96 (3ж) НД 92 (3з) 95 (3і) НД НД 93 (3ї) 94 (3м) 93 (3н) 95 (3о) 94 (3к) НД НД 95 (3п) 93 (3л) НД НД 93 (3р) 89 (3с) 89 (3т) 88(3у) 90 (3ф) 91 (3х) НД 96 (3ц) НД НД 90 (3ч) НД НД X=H 3 а-ю X MeNHNH2 Сполука 90 (3ш) НД НД X=N 90 (3щ) НД НД 91 (3ю) НД НД 1 2 R =R =Me O 1 R R 2 Me N N S R R H N 1 NH 2 O NH 2 S X N NH O R R X H2N 1 1 R H N 2 R N N S X R X N H R O R R 1 H N 2 S R N N NH NH2 1 O Me NH R2 S Me NH N NH Me Me Me Me R 1 N H Me Me NH2 O NH R2 S 1 R N NH O NH R2 S R 1 N S S NH NH2 O NH R2 S N NH X X R 1 O Me NH2 H N NH R2 S N N COOMe Me COOMe 1 НД - не досліджувався 3 UA 87426 U Таблиця 2 Спектральні дані та характеристики одержаних речовин Номер сполуки Т.пл., °C ІЧ-спектр, -1 ν (cм ) ЯМР-спектри, хімічні зміщення δ, м. ч. Мас-спектр, + mlz [М+Н ] 1 3а 238-239 1669 (с, С=О) 3б 282-283 1670 (с, С=О) 3в 267-268 1668 (с, С=О) 3г >300 1660 (с, С=О) 3д 224-225 1665 (с, С=О) 3е 233-234 1671 (с, С=О) 3є 233-234 1672 (с, С=О) Н ЯМР: δ 2.22 (с, 3Н, Me), 2.28 (с, 3Н, Me), 3.19 (с, 3Н, MeN), 5.04 (ш.с, 1Н, NH2), 10.07 (ш.с, 1H, NH); 13 С ЯМР: δ 12.59 (Me), 13.38 (Me), 39.20 (MeN), 115.19 (С-4а), 121.70 (С-6), 128.29 (С-5), 153.08 (С-7а), 160.21 (С-2), 166.40 (СО) 1 Н ЯМР: δ 1.72 (ш.с, 2Н, СН2), 1.77 (ш.с, 2Н, СН2), 2.60 (ш.с, 2Н, СН2), 2.77 (ш.с, 2Н, СН2), 3.20 (с, 3Н, MeN), 5.05 (ш.с, 1Н, NH2), 10.18 (ш.с, 1H, NH); 13 С ЯМР: δ 22.40 (СН2), 23.22 (СН2), 24.66 (СН2), 25.74 (СН2), 39.12 (MeN), 113.46 (С-4а), 125.35 (С-6), 130.45 (С-5), 153.82 (С-7а), 158.03 (С-2), 167.08 (СО) 1 Н ЯМР: δ 3.25 (с, 3Н, MeN), 5.08 (ш.с, 1Н, NH2), 6.94 (с, 1Н, НТh), 7.27-7.39 (м, 3Н, HPh-3,4,5), 7.51 (д, J=7.95 Гц, 2Н, HPh-2,6), 10.24 (ш.с, 1H, NH); 13 С ЯМР: δ 39.13 (MeN), 112.63 (С-4а), 115.24 (CPh-4), 127.50 (С-6), 127.95 (2xCPh-3,5), 129.46 (2xCPh-3,5), 136.29 (С-5), 138.56 (CPh-1), 152.49 (С-7а), 159.33 (С-2), 169.53 (СО) 1 Н ЯМР: δ 10.41 (ш.с, 1Н, NH), 6.99 (с, 1Н, NH) 4.02 (ш.с, 1H, ОН), 3.52 (ш.с, 2Н, СН2), 2.76 (ш.с, 2Н, СН2), 2.27 (с, 3Н, Me), 2.23 (с, 3Н, Me). 13 С ЯМР: δ 12.7 (Me), 13.4 (Me), 43.4 (CH2NH), 59.9 (СН2ОН), 115.2 (С-4а), 121.5 (С-6), 128.3 (С5), 153.0 (С-7а), 160.2 (С-2), 166.3 (СО) 1 Н ЯМР: δ 10.47 (ш.с, 1H, NH), 6.87 (ш.с, 1H, NH), 4.02 (ш.с, 1H, ОН), 3.52 (ш.с, 2Н, СН 2), 2.76 (ш.с, 2Н, СН2), 2.60 (ш.с, 4Н, 2хСН2), 1.77 (ш.с, 2Н, СН2), 1.72 (ш.с, 2Н, СН2). 13 С ЯМР: δ 22.4 (СН2), 23.2 (СН2), 24.6 (СН2), 25.7 (СН2), 43.3 (CH2NH), 60.0 (СН2ОН), 114.4 (С4а), 125.21 (С-6), 130.6 (С-5), 154.0 (С-7а), 158.6 (С-2), 166.8 (СО) 1 Н ЯМР: δ 2.22 (с, 3Н, Me), 2.28 (с, 3Н, Me), 2.72 (т, J=5.79 Гц, 2Н, СН2), 3.25 (м, 2Н, СН2), 5.08 (ш.с, 2Н, NH2), 6.99 (с, 1H, NH). 13 С ЯМР: δ 12.6 (Me), 13.4 (Me), 41.3 (CH2NH), 43.6 (CH2NH2), 115.2 (C-4a), 121.6 (C-6), 128.2 (C-5), 153.0 (C-7a), 160.2 (C-2), 166.2 (CO) 1 H ЯМР: δ 2.70 (т, J=5.6 Гц, 2Н, CH2), 3.21-3.31 (м, 2Н, CH2), 5.09 (ш.с, 2Н, NH2), 6.93 (ш.с, 1H, HTh), 7.01 (ш.с, 1Н, NH), 7.29-7.39 (м, 3Н, HPh3,4,5), 7.53 (д, J=7.3 Гц, 2Н, HPh-2,6), 11.00 (ш.с, 1H, NH); 13 C ЯМР: δ 41.3 (CH2NH), 43.7 (CH2NH2), 112.7 (C-4a), 115.3 (СPh-4), 127.5 (C-6), 127.9 (2xCPh2,6), 129.4 (2xCPh-3,5), 136.3 (C-5), 138.5 (CPh-1), 152.5 (C-7a), 159.4 (C-2), 169.5 (CO) 4 225 251 273 240 266 239 287 UA 87426 U 1 3ж >300 1679 (с, С=О) 3з 247-248 1679 (с, С=О) 3і 250-251 1678 (с, C=О) 3ї >300 1667 (с, С=О) 3к >300 1660 (с, С=О) 3л 299-300 1662 (с, С=О) 3м >300 1665 (с, С=О) 3н >300 1668 (с, С=О) H ЯМР: δ 1.52 (ш.с, 4Н, CH2), 1.59 (ш.с, 2Н, CH2), 2.24 (с, 3Н, Me), 2.29 (с, 3Н, Me), 3.55 (ш.с, 4Н, CH2N), 10.98 (ш.с, 1Н, NH). 13 C ЯМР: δ 12.7 (Me), 13.3 (Me), 24.3 (CH 2), 25.5 (2xCH2), 46.3 (2xCH2), 113.4 (C-4a), 122.5 (C-6), 130.7 (C-5), 152.2 (C-7a), 157.4 (C-2), 164.4 (CO) 1 H ЯМР: δ 1.55 (с, 4Н, CH2), 1.62 (с, 2Н, CH2), 3.62 (с, 4Н, CH2N), 6.96 (с, 1Н, HTh), 7.29-7.33 (m, 1H, HPh-4), 7.36 (т, J=6.41 Гц, 2Н, HPh-3,5), 7.53 (д, J=6.79 Гц, 2Н, HPh-2,6), 10.99 (ш.с, 1Н). 13 C ЯМР: δ 24.3 (CH2), 25.5 (2xCH2), 46.3 (2xCH2), 112.5 (C-4a), 115.3 (CPh-4), 127.4 (C-6), 127.9 (2xCPh-2,6), 129.4 (2xCPh-3,5), 136.3 (C-5), 138.5 (CPh-1), 152.4 (C-7a), 159.3 (C-2), 169.3 (CO) 1 H ЯМР: δ 1.15 (кв, J=12.05 Гц, 2Н, CH 2), 1.60 (д, J=12.07 Гц, 2Н, CH2), 1.77 (с, 1Н, CH), 2.24 (с, 3Н, Me), 2.29 (с, 3Н, Me), 2.82 (т, J=12.66 Гц, 2Н, CH2), 3.32 (с, 2Н, CH2), 4.26 (д, J=12.60 Гц, 2Н, CH2), 7.19 (т, J=8.17 Гц, 3Н, HPh-2,4,6), 7.29 (т, J=7.22 Гц, 2Н, HPh-3,5), 10.97 (с, 1Н, NH); 13 C ЯМР: δ 12.7 (Me), 13.3 (Me), 31.6 (2xCH 2), 37.7 (CH2), 42.5 (CH2), 45.6 (2xCH2), 114.9 (C-4a), 122.6 (C-6), 127.0 (CPh-4), 128.1 (C-5), 128.6 (2XCPh-2,6), 129.5 (2XCPh-3,5), 140.5 (CPh-1), 151.8 (C-7a), 160.0 (C-2), 165.9 (CO) 1 Н ЯМР: δ 2.25 (с, 3Н, Me), 2.30 (с, 3Н, Me), 3.54 (с, 4Н, СН2), 3.64 (с, 4Н, СН2), 11.17 (ш. с, 1Н, NH); 13 С ЯМР: δ 12.7 (Me), 13.3 (Me), 45.5 (2xCH2N), 66.2 (2хСН2О), 115.1 (С-4а), 121.6 (С-6), 128.3 (С-5), 153.1 (С-7а), 160.1 (С-2), 166.3 (CO) 1 Н ЯМР: δ 1.73 (ш.с, 2Н, СН2), 1.78 (ш.с, 2Н, СН2), 2.62 (ш.с, 2Н, СН2), 2.78 (ш.с, 2Н, СН2), 3.54 (ш.с, 4Н, СН2), 3.64 (ш.с, 4Н, СН2), 11.18 (ш.с, 1H, NH). 13 С ЯМР: δ 22.4 (СН2), 23.2 (СН2), 24.7 (СН2), 25.6 (СН2), 45.4 (2xCH2N), 66.2 (2хСН2О), 113.5 (С-4а), 126.4 (С-6), 130.5 (С-5), 153.4 (С-7а), 159.43 (С-2), 166.2 (CO) 1 Н ЯМР: δ 3.61 (с, 4Н, СН2), 3.67 (с, 4Н, СН2), 7.03 (с, 1Н, НТh), 7.30-7.40 (м, 3Н, HPh-3,4,5), 7.53 (д, J=7.26 Гц, 2Н, HPh-2,6), 11.01 (ш.с, 1H, NH); 13 С ЯМР: δ 45.4 (2xCH2N), 66.2 (2хСН2О), 112.3 (С-4а), 115.2 (СPh-4), 127.3 (С-6), 127.7 (2xCPh2,6), 129.3 (2xCPh-3,5), 136.4 (С-5), 138.5 (CPh-1), 152.5 (С-7а),159.1 (С-2), 169.0 (CO) 1 Н ЯМР: δ 1.12 (с, 6Н, Me), 2.24 (с, 3Н, Me), 2.30 (с, 3Н, Me), 3.33 (с, 6Н, СН2+СН), 11.05 (ш.с, 1H, NH); 13 С ЯМР: δ 12.69 (Me), 13.27 (Me), 17.85 (Me), 18.93 (Me), 65.68 (2xCH2N), 71.25 (2xCHO), 115.36 (C-4a), 123.13 (C-6), 128.16 (C-5), 151.7 (C-7a), 159.86 (C-2), 165.56 (CO) 1 H ЯМР: δ 2.24 (с, 3Н, Me), 2.30 (с, 3Н, Me), 2.72 (с, 4Н, CH2), 3.48 (с, 4Н, CH2), 6.93 (ш.с, 1Н, NH). 13 C ЯМР: δ 12.7 (Me), 13.3 (Me), 45.2 (2xCH 2), 54.5 (2xCH2), 115.4 (C-4a), 121.2 (C-6), 128.1 (C5), 153.2 (C-7a), 159.9 (C-2), 166.0 (CO) 5 264 312 354 266 292 314 294 265 UA 87426 U 1 3о >300 1667 (с, С=О) 3п >300 1671 (с, С=О) 3р 235-236 1666 (с, С=О) 3с 292-293 1671 (с, С=O) 3т >300 1671 (с, С=0) 3у 235-236 1673 (с, С=O) H ЯМР: δ 3.55 (с, 4Н, CH2), 2.35 (с, 4Н, CH2), 2.29 (с, 3Н, Me), 2.24 (с, 3Н, Me), 2.20 (с, 3Н, Me). 13 C ЯМР: δ 12.7 (Me), 13.3 (Me), 45.20 (2xCH2), 46.05 (Me), 54.45 (2xCH2), 115.1 (C-4a), 121.4 (C6), 128.5 (C-5), 153.3 (C-7a), 160.0 (C-2), 166.2 (CO) 1 H ЯМР: δ 1.69-1.75 (м, 2H, CH2), 1.75-1.82 (м, 2H, CH2), 2.20 (с, 3Н, Me), 2.32-2.38 (м, 4Н, CH2), 2.60-2.64 (м, 2Н, CH2), 2.77-2.80 (м, 2Н, CH2), 3.53-3.58 (м, 4H, CH2), 11.06 (с, 1Н, NH). 13 C ЯМР: δ 22.4 (CH2), 23.2 (CH2), 24.6 (CH2), 25.7 (CH2), 45.2 (2xCH2), 46.0 (Me), 54.5 (2xCH2), 113.5 (C-4a), 126.4 (C-6), 130.5 (C-5), 153.4 (C7a), 159.4 (C-2), 166.2 (CO) 1 H ЯМР: δ 2.21 (с, 3Н, Me), 2.38 (ш.с, 4Н, CH2), 3.62 (ш.с, 4H, CH2), 7.00 (c, 1H, HTh), 7.32 (т, J=7.00 Гц, 1Н, НРh-4), 7.36 (т, J=6.88 Гц, 2Н, HPh3,5), 7.52 (д, J=6.76 Гц, 2Н, HPh-2,6), 11.17 (ш.с, 1H, NH). 13 С ЯМР: δ 45.2 (2хСН2), 46.0 (Me), 54.5 (2хСН2), 112.6 (С-4а), 115.2 (CPh-4), 127.5 (С-6), 128.0 (2xCPh-3,5), 129.5 (2xCPh-3,5), 136.3 (С-5), 138.6 (CPh-1), 152.5 (С-7а), 159.3 (С-2), 169.5 (СО) 1 Н ЯМР: δ 2.25 (с, 3Н, Me), 2.31 (с, 3Н, Me), 2.862.92 (м, 2Н, СН2), 3.82 (т, J=5.43 Гц, 2Н, СН 2), 4.74 (с, 2Н, СН2), 7.18-7.25 (м, 4Н, НАr), 11.06 (с, 1H, NH). 13 С ЯМР: δ 12.6 (Me), 13.4 (Me), 28.4 (СН 2), 43.2 (СН2), 46.9 (СН2), 113.4 (С-4а), 122.5 (С-6), 126.7 (СН), 127.1 (СН), 127.4 (СН), 128.9 (СН), 130.7 (С-5), 133.7 (С), 135.0 (С), 152.2 (С-7а), 157.4 (С2), 164.4 (СО) 1 Н ЯМР: δ 1.70-1.75 (м, 2Н, СН2), 1.76-1.81 (м, 2Н, СН2), 2.59-2.64 (м, 2Н, СН2), 2.76-2.81 (м, 2Н, СН2), 2.90 (т, J=6.69 Гц, 2Н, СН2), 3.82 (т, J=6.69 Гц, 2Н, СН2), 4.75(с, 2Н, СН2), 7.18-7.24 (м, 4Н, НAr). 13 С ЯМР: δ 22.4 (СН2), 23.2 (СН2), 24.7 (СН2), 25.6 (СН2), 28.4 (СН2), 43.2 (СН2), 47.0 (СН2), 113.5 (С-4а), 126.2 (С-6), 126.7 (СН), 127.1 (СН), 127.5 (СН), 128.9 (СН), 130.5 (С-5), 133.7 (С), 135.0 (С), 153.4 (С-7а), 159.4 (С-2), 166.2 (СО) 1 Н ЯМР: δ 2.94 (т, J=4.95 Гц, 2Н, СН2), 3.89 (т, J=5.68 Гц, 2Н, СН2), 4.82 (с, 2Н, СН2), 6.95 (с, 1H, HTh), 7.17-7.25 (м, 4Н, НAr), 7.32 (т, J=7.36 Гц, 1H, HPh-4), 7.36 (т, J=7.21 Гц, 2Н, HPh-3,5), 7.55 (д, J=6.83 Гц, 2Н, HPh-2,6), 10.93 (с, 1Н, NH). 13 С ЯМР: δ 28.36 (СН2), 43.22 (СН2), 46.97 (СН2), 112.50 (С-4а), 115.02 (CPh-4), 126.63 (СН), 126.81 (СН), 127.04 (СН), 127.49 (С-6), 127.94 (2xCph2,5), 128.86 (СН), 129.47 (2xCPh-3,5), 133.69 (С), 134.98 (С), 136.35 (С-5), 138.58 (CPh-1), 152.37 (С-7а), 159.41 (С-2), 169.66 (СО) 6 279 305 327 312 338 360 UA 87426 U 1 3ф 213-214 1676 (с, С=O) 3х 213-214 1677 (с, C=O) 3ц 270-271 1675 (с, C=O) 3ч 218-219 1668 (с, С=О) 3ш 247-248 1674 (с, С=О) 3щ 299-300 1674 (с, ОО) Н ЯМР: δ 0.97 (т, J=11.86 Гц, 3Н, СН2), 1.05 (с, 6Н, Me), 1.18 (с, 6Н, Me), 1.81 (д, J=11.44 Гц, 2Н, СН2), 2.23 (с, 3Н, Me), 2.28 (с, 3Н, Me), 4.12 (д, J=8.11 Гц, 1H, СН), 6.20 (с, 1Н, NH), 10.57 (с, 1H, NH). 13 С ЯМР: δ 12.5 (Me), 13.2 (Me), 28.4 (2хСН 3), 34.1 (2хСН3), 43.7 (СН), 44.3 (2хС), 52.3 (2хСН2), 113.0 (С-4а), 122.2 (С-6), 130.9 (С-5), 152.0 (С7а), 157.7 (С-2), 164.7 (СО) 1 Н ЯМР: δ 0.99 (ш.с, 3Н, СН2), 1.11 (ш.с, 6Н, Me), 1.23 (с, 6Н, Me), 1.71 (с, 2Н, СН2), 1.84 (ш.с, 4Н, СН2), 2.59 (ш.с, 2Н, СН2), 2.75 (ш.с, 2Н, СН2), 4.14 (д, J=6.2 Гц, 1H, СН), 6.94 (ш.с, 1H, NH), 9.89 (с, 1H.NH); 13 С ЯМР: δ 22.7 (СН2), 23.3 (СН2), 24.9 (СН2), 25.8 (СН2), 28.4 (2хСН3), 34.2 (2хСН3), 43.5 (СН), 44.3 (2хС), 52.1 (2хСН2), 114.3 (С-4а), 124.9, (С6), 130.6 (С-5), 151.7 (С-7а), 159.0 (С-2), 166.9 (СО) 1 Н ЯМР: δ 1.41 (дд, J=11.93, 5.94 Гц, 2Н, СН2), 1.53-1.60 (м, 2Н, СН2), 1.62-1.68 (м, 2Н, СН2), 1.92 (дд, J=11.04, 5.49 Гц, 2Н, СН2), 2.23 (с, 3Н, Me), 2.27 (с, 3Н, Me), 4.11 (дд, J=13.66, 6.92 Гц, 1H, СН), 6.33 (дд, J=6.53 Гц, 1Н, NH), 10.31 (с, 1H, NH). 13 С ЯМР: δ 12.7 (Me), 13.3 (Me), 24.0 (2хСН 2), 32.5 (2хСН2), 50.1 (СН), 113.8 (С-4а), 122.1 (С-6), 130.7 (С-5), 152.1 (С-7а), 157.9 (С-2), 165.3 (СО) 1 Н ЯМР: δ 2.24 (с, 3Н, Me), 2.28 (с, 3Н, Me), 3.06 (т, J=6.5 Гц, 2Н, СН2), 3.53 (кв, J=5.8 Гц, 2Н, СН2), 6.37 (ш.с, 1H, NH), 6.93 (ш.с, 1H, HTh-3), 6.98 (dд, J=7.2, 3.2 Гц, 1Н, HTh-4), 7.36 (dд, J=4.5, 3.0 Гц, 1H, НТh-5), 10.73 (ш.с, 1H, NH); 13 C ЯМР: δ 12.7 (Me), 13.3 (Me), 30.1 (CH 2), 39.7 (CH2), 112.8 (C-4a), 123.2 (C-6), 124.7 (CHTh), 125.8 (CHTh), 127.6 (CHTh), 129.6 (C-5), 142.2 (CTh), 151.3 (C-7a), 158.8 (C-2), 166.0 (CO) 1 H ЯМР: δ 2.22 (с, 3Н, Me), 2.28 (с, 3Н, Me), 4.49 (д, J=4.95 Гц, 2Н, CH2), 7.25 (т, J=7.2 Гц, 1Н, HPh4), 7.31-7.36 (м, 4H, НPh-2,3,5,6), 7.61 (ш.с, 1H, NH), 11.09 (ш.с, 1H, NH); 13 C ЯМР δ 12.6 (Me), 13.2 (Me), 44.1 (CH2), 115.6 (C-4a), 121.7 (C-6), 127.1 (CHPh), 127.5 (2xCHPh), 128.2 (C-5), 128.5 (2xCHPh), 139.2 (CPh), 151.6 (C7a), 158.8 (C-2), 165.8 (CO) 1 H ЯМР: δ 2.22 (с, 3Н, Me), 2.28 (с, 3Н, Me), 4.59 (д, J=4.87 Гц, 2Н, CH2), 7.29 (dд, J=6.92, 5.18 Гц, 1Н, HPy-5), 7.38 (д, J=7.84 Гц, 1Н, HPy-3), 7.49 (д, J=4.20 Гц, 1Н, HPy-4), 7.78 (т, J=6.87 Гц, 1Н, NH), 8.54 (д, J=2.82 Гц, 1Н, HPy-6), 11.17 (c, 1H, NH); 13 C ЯМР: δ 12.6 (Me), 13.3 (Me), 45.8 (CH2), 115.6 (C-4a), 121.7 (CHPy), 122.3 (C-6), 122.7 (CHPy), 128.3 (C-5), 137.3 (CHPy), 149.3 (CHPy), 152.1 (C7a), 158.1 (C-2), 158.9 (CPv), 165.7 (CO) 7 335 361 264 306 286 287 UA 87426 U 1 3ю 1775 (с, С=О), 1672 (с, С=О) 245-246 H ЯМР: δ 2.23 (с, 3Н, Me), 2.29 (с, 3Н, Me), 2.50 (с, 2Н, CH2), 3.55 (с, 6Н, MeO+MeN), 4.62 (c, 2H, CH2N), 11.21 (c, 1H, NH); 13 C ЯМР: δ 12.68 (Me), 13.33 (Me), 20.39 (CH2), 34.57 (MeN), 37.83 (CH2N), 47.45 (OMe), 114.87 (C-4a), 122.24 (C-6), 127.97 (C-5), 151.34 (C-7a), 160.07 (C-2), 166.12 (CO), 173.59 (CO2Me) 3 5 4 1 296 2 Спосіб дає змогу одержувати 2-R ,R -aміно-5-R 6-R -тiєнo[2,3-d]піримідин-4(3H)-они за одну стадію, з високими виходами і високої чистоти з комерційно доступних вихідних речовин, що вигідно відрізняє його від відомого способу і підтверджує передбачуваний технічний результат. ФОРМУЛА КОРИСНОЇ МОДЕЛІ 3 10 4 1 2 Спосіб одержання 2-R ,R -аміно-5-R -6-R -тієно[2,3-d]піримідин-4(3H)-онів, що включає взаємодію тієнотетразолів з нуклеофільним реагентом, який відрізняється тим, що як нуклеофільний реагент використовують аміни або гідразини, при цьому суспензію тієнотетразолу і аміну чи гідразину нагрівають 30-60 хв. при 80-90 °C, охолоджують до кімнатної температури, розводять водою до початку утворення осаду, осад відфільтровують, перекристалізовують з етанолу і одержують сполуки загальної формули: O R R 15 1 H N 2 S N R 3 N R 4 , 1 де R =алкіл, арил; 2 R =H, алкіл; 3 4 R , R =Н, алкіл, арил, гетарил. Комп’ютерна верстка М. Ломалова Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Автори англійськоюPokhodylo Nazarii Tarasovych, Shyika Olha Yaroslavivna, Obushak Mykola Dmytrovych
Автори російськоюПоходило Назарий Тарасович, Шийка Ольга Ярославовна, Обушак Николай Дмитриевич
МПК / Мітки
МПК: C07D 249/06, C07D 401/12, C07D 417/12, C07D 409/12, C07D 403/12, C07D 413/12, C07D 405/12
Мітки: спосіб, 2-r3,r4-аміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів, одержання
Код посилання
<a href="https://ua.patents.su/10-87426-sposib-oderzhannya-2-r3r4-amino-5-r1-6-r2-tiehno23-dpirimidin-43n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2-r3,r4-аміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів</a>
Попередній патент: Пристрій для бісегментарної міжтілової динамічної фіксації хребців
Наступний патент: Кісточковиштовхувач для абрикоси та сливи
Випадковий патент: Спосіб доопераційної діагностики медулярного раку щитоподібної залози