Спосіб одержання 2,3-діаміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів
Номер патенту: 44651
Опубліковано: 12.10.2009
Автори: Матійчук Василь Степанович, Походило Назарій Тарасович, Обушак Микола Дмитрович
Формула / Реферат
Спосіб одержання заміщених 2,3-діаміно-5-R1-6-R2-тієно[2,3-d]піримідин-4(3H)-онів, що включає використання заміщених 2-амінотіофенів як вихідних сполук, який відрізняється тим, що до них додають натрій азид, етилортоформіат і нагрівають 3-4 год. при 95-100 °С в розчині ацетатної кислоти, охолоджують до кімнатної температури, додають концентрованої хлоридної кислоти, фільтрують, фільтрат упарюють, залишок перекристалізовують із 2-пропанолу і одержують алкіл[4-R1-5-R2-2-(1H-тетразол-1-іл)]-3-тіофенкарбоксилати, які нагрівають протягом 3-4 год. в гідразингідраті, охолоджують і розводять водою, осад відфільтровують, перекристалізовують з етилового спирту і одержують сполуки загальної формули:
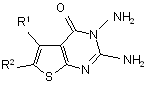 ,
,
де R1= алкіл, арил;
R2=H, алкіл.
Текст
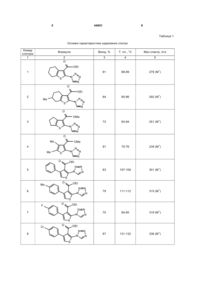
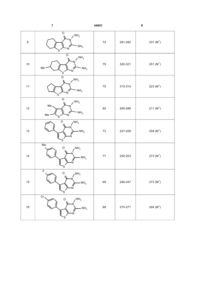
Спосіб одержання заміщених 2,3-діаміно-5-R16-R2-тієно[2,3-d]піримідин-4(3H)-онів, що включає використання заміщених 2-амінотіофенів як вихідних сполук, який відрізняється тим, що до них додають натрій азид, етилортоформіат і нагрівають 3-4 год. при 95-100 °С в розчині ацетатної кислоти, охолоджують до кімнатної температури, додають концентрованої хлоридної кислоти, фільтрують, фільтрат упарюють, залишок перекристалізовують із 2-пропанолу і одержують алкіл[4-R1-5-R2-2-(1H-тетразол-1-іл)]-3тіофенкарбоксилати, які нагрівають протягом 3-4 год. в гідразингідраті, охолоджують і розводять водою, осад відфільтровують, перекристалізовують з етилового спирту і одержують сполуки загальної формули: O NH2 R1 N Корисна модель стосується органічної хімії, а саме способів одержання практично корисних органічних сполук, які можуть бути використані у фармакології як біологічно активні сполуки. 2,3-Діамінопіримідин-4(3H)-они є попередниками пуринових основ, природних гетероциклічних сполук, які беруть участь у важливих фізіологічних процесах. Практично всі агоністи цих рецепторів, що синтезовані дотепер, структурно пов'язані з пуриновими основами. Препарати на їх основі займають значний сегмент лікарських засобів з різноманітною, зокрема антиВІЛ, активністю [Pharmaceutical substances: syntheses, patents, applications (5th ed.) / Kleemann A., Engel J., Kutscher В., Reichert. D. - Stuttgart, New York: Thieme, 2009. - 1800 pp.]. Ведуться широкомасштабні дослідження біологічної активності тієнопіримідинів [Phoujdar M. S., Microwave-based synthesis of novel thienopyrimidine bioisosteres of gefitinib / Phoujdar M. S., Kathiravan M. K., Bariwal J. В., Shah A. K., Jain K. S. II Tetrahedron Lett. - 2008. -Vol. 49. № 7. - P. 12691273., Hafez H. N. Design and synthesis of 3pyrazolyl-thiophene, thieno[2,3-d]pyrimidines as new bioactive and pharmacological activities / Hafez H. N. , El-Gazzar A. B. A. II Bioorg. Med. Chem. Lett. 2008. -Vol. 18. № 19. - P. 5222-5227., Wang K., Structure-activity relationship analysis of a novel necroptosis inhibitor, Necrostatin-5 / WangK., Li J., Degterev A., Hsu E., Yuan J., Yuan С II Bioorg. Med. Chem. Lett. - 2007. -Vol. 17. № 5. - P. 1455-1465., Alagarsamy V., Synthesis of 2-mercapto-3substituted-5,6-dimethylthieno[2,3-d]pyrimidin-4(3H)ones as new analgesic, anti-inflammatory agents / Alagarsamy V., Vijayakumar S., Raja Solomon V. II Biomed. & Pharmacotherapy. - 2007. -Vol. 61. № 5. P. 285-291]. Відомий патент на застосування тієнопіримідинів для профілактики і лікування хвороб пов'язаних з порушенням роботи протеїнкіназ [Пат. 1124181 WO. Thieno-[2,3d]pyrimidine and thieno-pyridazine compounds and methods of use / Hong F.-T. Falsey J. R., Rzasa R. M., Tadesse S., Tasker A.; Amgen Inc. - № 010093; Заявл. 21.04.06; Опубл. 01.11.07; - 111 с]. Відомий патент на застосування інгібіторів циклооксигенази-2 на основі тієнопіримідинів для поліпшення тваринної репродукції [Пат. 129169 А2 WO. Veterinary method and composition / Goetze L. R2 S N , (19) UA (11) 44651 (13) U де R1= алкіл, арил; R2=H, алкіл. NH2 3 F., Ricketts A. P.; Pfizer Limited. -№001082; Заявл. 04.05.06; Опубл. 15.11.07;-38 с]. Відомий патент на застосування похідних тієнопіримідину для лікування сечостатевих та шлунково-кишкових захворювань [Пат. 120445 А1 WO. Soluble salts of thieno [2,3-dl pyrimidine derivatives / Cooper M.I.; Dynogen Pharmaceuticals, Inc. - № 007633; Заявл. 31.03.06; Опубл. 25.10.07; 80 с]. Найбільш близьким за технічною суттю прототипом є спосіб синтезу 2,3-діамінотієно[2,3d]піримідин-4(3H)-онів /Modica М., Synthesis of new thienotriazolopyrimidine and thienopyrimidotetrazine derivatives from bifunctional intermediates /Modica M., Santagati M., Santagati A. II J. Heterocycl. Chem. -2001. - Vol. 38. - P. 973-978.], який полягає у взаємодії етил 2-ізотіоціанато-4,5-диметилтіофен3-карбоксилату (синтезованого з етил 2-аміно-4,5диметилтіофен-3-карбоксилату) із аміаком або метоксикарбонілгідразином та наступною взаємодією одержаного продукту з гідразином. Недоліком способу є те, що вихідні реагенти необхідно синтезувати окремо у кілька стадій і невисокі виходи кінцевих сполук (18-27%). В основу корисної моделі поставлено задачу удосконалити спосіб одержання заміщених 2,3діамінотієно[2,3d]піримідин-4(3H)-онів шляхом використання доступних реагентів і реакцій з високими виходами, що дозволить одержати здешевлені цільові сполуки та спростити процес їх одержання. Поставлена задача досягається тим, що у спосіб одержання заміщених 2,3-діаміно-5-R1-6-R2тієно[2,3d]піримідин-4(3H)-онів, що включає використання заміщених 2-амінотіофенів, як вихідних сполук, до яких додають натрій азид, етилортоформіат і нагрівають 3-4 год. при 95100°С в розчині ацетатної кислоти, охолоджують до кімнатної температури, додають концентрованої хлоридної кислоти, фільтрують, фільтрат упарюють, залишок перекристалізовують із 2-пропанолу і одержують алкіл[4-R1-5-R2-2-(1Hтетразол-1-іл)]-3-тіофенкарбоксилати, які нагрівають протягом 3-4 год. в гідразингідраті, охолоджують і розводять водою, осад відфільтровують, перекристалізовують з етилового спирту і одержують сполуки загальної формули: O NH2 R1 N NH2 N S де R1= алкіл, арил; R2=H, алкіл. R2 44651 4 Авторами вперше розроблено двостадійну схему перетворень: встановлено, що доступні 2амінотіофени, синтезовані реакцією Гевальда [Gewald К., 2-Aminothiophene aus methylenaktiven nitrilen, carbonylverbindungen und schwefel / Gewald K., Schinke E., Bottcher H. II Chem. Ber. - 1966. -Vol. 99, № 1. P. 94-100], реагують з етилортоформіатом і азидом натрію при нагріванні в оцтовій кислоті і з високими виходами утворюють тієнілтетразоли 1-8 (табл. 1). Досліджуючи гідразиноліз цих естерів, знайдено нову реакцію, що призводить до утворення цільових 2,3діамінопіримідинів (сполуки 9-16). З'ясовано, що під час кип'ятіння реагентів 1-8 з гідразингідратом розкривається тетразольний цикл з елімінуванням азоту і, внаслідок атаки утвореної ціанамідної групи на гідразидну групу, замикається піримідиновий цикл: O R1 R2 R3 O S NH2 O NaN3 R1 CH(OEt)3 AcOH R2 R3 O S 1-8 N N N N O H4N2 NH2 R1 R2 N S N NH2 9-16 У цьому перетворенні тетразольний цикл розкривається у м'яких умовах (розчин гідразину), на відміну від відомих прикладів (NaOH в ДМСО [Гапоник П.Н., Синтез и свойства фениленбис-1Hтетразолов /Гапоник П.Н., Каравай В.П., Давшко И.Е., Богатиков А.Н. II Химия гетероцикл. соедин. 1990. -№11. -С. 1528-1532.]). Розшифровка замісників R1, R2, R3 та приклади сполук, одержаних цим способом наведено у таблиці 1, де виходи вказано після перекристалізації з етанолу. Наведену вище схему реакції підтверджують дані ЯМР спектроскопії записані на приладі Varian Unity +400 (400 МГц для 1Н, 125 МГц для 13С) у ДМСО-d6 (табл. 2), та мас-спектри одержані на хромато-масспектрометрі Agilent 1100 LC/MSD зі способом іонізації API-ES/APCI (табл. 1). Приклад. До суспензії 11,3 г (50 ммоль) етил 2аміно-4,5,6,7-тетрагідро-1-бензотіофен-3карбоксилатуі і 3,9 г натрій азиду в 25 мл етилортоформіату додають при перемішуванні 40 мл ацетатної кислоти і нагрівають 3-4 год. при 95100°С. Після охолодження додають 7 мл концентрованої хлоридної кислоти, фільтрують. Фільтрат упарюють, залишок перекристалізовують із 2-пропанолу. Суспензію 2,8 г (0,01 моль) етил 2(1H-тетразол-1-іл)-4,5,6,7-тетрагідро-1бензотіофен-3-карбоксилат 1 в 15 мл гідразингідрату нагрівають протягом 3-4 год. Потім суміш охолоджують і розводять водою (50 мл). 2,3Діаміно-5,6,7,8-тетрагідро[1]бензотієно[2,3d]піримідин-4(3H)-он 9 відфільтровують і перекристалізовують з етилового спирту. 5 44651 6 Таблиця 1 Основні характеристики одержаних сполук Номер сполуки 1 Формула Вихід, % Т. пл., °С Мас-спектр, m/z 2 O 3 4 5 81 88-89 279 (М+) 84 85-86 292 (М+) 72 83-84 251 (М+) 91 75-76 239 (М+) 83 107-108 301 (M+) 79 111-112 315 (M+) 70 84-85 319 (M+) 87 131-132 336 (M+) OEt 1 N N S N N O OEt 2 Me N N S N N O OMe 3 N N S N N O Me OMe 4 Me N N S N N O OEt N 5 N N N S Me O OEt N 6 N N N S F O OEt N 7 N N N S Cl O OEt N 8 N S N N 7 44651 O 8 NH2 N 74 237 (M+) 79 320-321 251 (M+) 75 313-314 223 (M+) 85 285-286 211 (M+) 73 227-228 259 (M+) 77 252-253 273 (M+) NH2 69 246-247 273 (M+) 88 270-271 294 (M+) NH2 N S 281-282 NH2 9 O NH2 N 10 Me NH2 N S O NH2 N 11 NH2 N S O Me 12 Me NH2 N NH2 N S O NH2 N NH2 13 N S Me O NH2 N 14 N S F O NH2 N 15 N S Cl NH2 O N 16 NH2 N S 9 44651 10 Таблиця 2 Спектри ЯМР 1Н та 13С одержаних сполук Номер сполуки 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 Хімічні зміщення, d , м.ч. ЯМР 1Н (400 МГц, ДМСО-d6) ЯМР 13С (125 МГц, CDCl3) 2 3 1.05 т (3Н, 3J 7.2, Et), 1.86 м (4Н, СН2), 2.83 м (4Н, 14.0, 22.2, 22.6, 24.9, 26.0, 61.2, 127.7, 133.4, СН2), 4.06 к (2Н, 3J 7.2,Е1),9.70с(1Н, Нтетразол) 135.5, 137.8, 146.6, 161.1 1.05 т (3Н, 3J 7.6, Et), 1.11 д (3Н, 3J 6.8, СН3), 1.38- 14.0, 21.4, 25.7, 28.9, 30.3, 32.7, 61.2, 127.5, 1.49 м (1Н, СН), 1.90-2.02 м (2Н, СН2), 2.39-2.45 м 133.5, 135.2, 137.4, 146.6, 161.1 (1Н, СН2), 2.68-2.78 м (1Н, СН2), 2.89-3.03м (2Н, СН2), 4.07 к (2Н, 3J 6.8, Et), 9.68 с (1H, Нтетразол) 2.42-2.49 м (2Н, СН2), 2.97-3.05 м (4Н, СН2), 3.69 с 25.4, 29.5, 32.9, 52.1, 127.4, 132.2, 133.4. (3Н, СН3), 9.70 с(1H, Нтетразол) 135.3, 146.4, 162.0 2.32 с (3Н, СН3), 2.45 с (3Н, СН3), 3.62 с (3Н, СН3О), 13.3, 13.8, 52.5, 128.4, 132.2, 133.5. 135.0, 9.70 с (1Н, Нтетразол) 146.3, 162.0 0.86 т (3Н, 3J 6.8, Et), 3.99 к (2Н, 3J 6.8, Et), 7.34-7.51 13.7, 61.7, 111.8, 115.1, 126.5, 127.5, 129.3, м (5Н, HPh), 7.85 с (1H, Hтіофен), 9.96с (1H, Нтетразол) 132.2, 136.7, 141.1, 146.7, 161.6 0.94 т (3Н, 3J6.8, Et), 2.39 с (3Н, СН3), 4.02 к (2Н, 3J 13.8, 21.2, 61.7, 125.0, 128.7, 129.4, 132.3; 6.8, Et), 7.20 д (2Н, 3J 8.0, НAr -3,5), 7.25 д (2Н, 3J 8.0, 137.9, 141.5, 146.3, 161.8 НAr,-2,6), 7.66 с (1Н, Нтіофен), 9.80 с (1H, Нтетразол) 0.91 т (3Н, 3J 7.8, Et), 4.01 к (2Н, 3J 7.8, Et), 7.09 д 13.7, 61,7, 115.5, 115.7, 125.7, 128.6, 131.1, (2Н, 3J 7.8, НAr -3,5), 7.15 д (2Н, 3J 8.0, НAr -2,6), 7.72 131.8, 136.3, 140.5, 146.4, 162.5 (d, 1JCF = с (1H, Hтіофен) 9.78 с (1Н, Нтетпазол) 241.2, 4-СAr) 0.94 т (3Н, 3J 6.8, Et), 4.02 к (2Н, 3J 6.8, Et), 7.38 д 13.7, 61.7, 126.1, 128.4, 128.7, 130.8, 133.3, (2Н, 3J 8.8, НAr -3,5), 7.42 д (2Н, 3J 8.8, НAr -2,6), 7.75 134.2, 136.5, 140.3, 146.4, 161.4 с (1H, Hтіофен) 9.79c (1H, Нтетразол) 1.76-1.89 м (4Н, СН2), 2.62 т (2Н, 3J 5.9, СН2), 2.83 т 22.4,23.8,24.8,25.9, 113.2, 125.1, 130.4, (2Н, 3J5.9, CH2), 5,25 с (2Н, NNH2), 6,86 с (2Н, CNH2) 153.6, 158.1, 164.3 21.8, 25.4, 29.5, 30.7, 32.8, 1.09 д (3Н, 3J 5.9, СН3), 1.32-1.44 м (1Н, СН), 1.82- 113.1, 124.7, 130.0, 153.7, 158.1,164.4 1.96 м (2Н, СН2), 2.22-2.28 м (1Н, СН2), 2.61-2.69 м 25.4, 29.5, 32.9, 113.2, (2Н, СН2), 2.97-3.06 м (Ш, СН2), 5.24 с (2Н, NNH2), 6.86 с (2Н, CNH2) 2.30-2.40 м (2Н, СН2), 2.80 т (2Н, 3J 6.8, СН2), 2.86 т 124.9, 130.1, 153.4, 158.1, 164.3 (2Н, 3J 6.8, СН2), 5.27 с (2Н, NNH2), 6.86 с (2Н, CNH2) 2.26 с (3Н, СН3), 2.34 с (3Н, СН3), 5.24 с (2Н, NNH2), 12.7, 13.2, 114.2, 122.0, 125,7, 128.1, 153.8, 6.83 с (2Н, CNH2) 158.4, 163.7 5.23 с (2Н, NNH2), 6.79 с (1H, Hтіофен), 7.27-7.37 м 111.8, 115.1, 127.5, 127.9, 129.5, 136.2, (ЗН, HPh), 7.49 д (2Н, 3J 6.8, HPh-3,5) 138.7, 154.1, 157.7, 167.0 2.35 с (3Н, СН3), 5.29 ш.с (2Н, NNH2), 6.67 с (1Н, 21.3, 111.9, 114.3, 128.4, 129.2, 133.7, 137.2, Нтіофен), 7.03 ш.с (2Н, CNH2), 7.11 д (2Н, 3J 7.2, НAr - 139.0, 154.4, 158.8, 167.8 2,6), 7.37д(2Н, 3J 7.2, НAr -3,5) 5.28 с (2Н, NNH2), 6.73 с (1H, Hтіофен), 7.02-7.11 м 111.6, 114.7, 131.4, 131.5, 132.6, 137.4, (4Н, CNH2+ НAr -2,6), 7.51 д.д(2Н, 3J 5.9, 3J 8.8, НAr - 154.1, 157.9, 162.0 (d, 1JCF 242.5, 4-СAR), 3,5) 167.3 5.29 ш.с (2Н, NNH2), 6.77 с (1Н, Нтіофен), 7.07 ш.с 111.5, 115.0, 127.8, 131.2, 132.3, 135.0, (2Н, CNH2), 7.33 д (2Н, 1/7.6, Нд,), 7.50 д (2Н, 3J7.6, 137.1, 154.1, 157.9, 167.4 НAr) Запропонований спосіб дозволяє за дві стадії одержувати заміщені 2,3-діамінотієно[2,3d]тримідин-4(3H)-они з комерційно доступних вихідних речовин, що вигідно відрізняє його від відомого способу і підтверджує передбачуваний технічний результат. 11 Комп’ютерна верстка Д. Шеверун 44651 Підписне 12 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Автори англійськоюPokhodylo Nazarii Tarasovych, Obushak Mykola Dmytrovych, Matiichuk Vasyl Stepanovych
Автори російськоюПоходило Назарий Тарасович, Обушак Николай Дмитриевич, Матийчук Василий Степанович
МПК / Мітки
МПК: C07D 405/00, C07D 333/00, C07D 257/00
Мітки: спосіб, одержання, 2,3-діаміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів
Код посилання
<a href="https://ua.patents.su/6-44651-sposib-oderzhannya-23-diamino-5-r1-6-r2-tiehno23-dpirimidin-43n-oniv.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання 2,3-діаміно-5-r1-6-r2-тієно[2,3-d]піримідин-4(3н)-онів</a>
Попередній патент: Матеріал для термопар та термоелементів
Наступний патент: Активатор суспензій та рідин
Випадковий патент: Портативний пристрій для визначення кількісних показників вестибулярного ністагму