Антагоністи мускаринових ацетилхолінових рецепторів
Номер патенту: 89734
Опубліковано: 25.02.2010
Автори: Паловіч Майкл Р., Буш-Петерсен Якоб, Жу Чонгджі, Ян Хонгксінг, Ван Зехонг
Формула / Реферат
1. Сполука формули І:
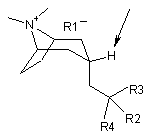 , (І)
, (І)
де:
позначений атом Н знаходиться в екзоположенні;
R1- являє собою аніон, зв'язаний із позитивним зарядом атома N;
R2 і R3 незалежно вибрані з групи, що включає групи нижчого алкілу (що мають 1-6 атомів вуглецю) з прямим або розгалуженим ланцюгом, циклоалкільні групи (що мають 5-6 атомів вуглецю), арил та гетероарил,
R4 означає -CN.
2. Сполука за п. 1, яка відрізняється тим, що R1- означає хлорид, бромід, йодид, сульфат, бензолсульфонат або толуолсульфонат.
3. Сполука за п. 1, яка відрізняється тим, що R2 та R3 незалежно вибрані з групи, яка включає арил та гетероарил.
4. Сполука за п. 3, яка відрізняється тим, що R2 та R3, обидва, означають арил.
5. Сполука за п. 3, яка відрізняється тим, що R2 та R3, обидва, означають феніл.
6. Сполука за п. 3, яка відрізняється тим, що R2 та R3, обидва, означають гетероарил.
7. Сполука за п. 6, яка відрізняється тим, що R2 та R3, обидва, означають тієніл.
8. Сполука за п. 3, яка відрізняється тим, що R1- означає хлорид, бромід, йодид, сульфат, бензолсульфонат або толуолсульфонат.
9. Сполука за п. 8, яка відрізняється тим, що R1- означає бромід або йодид.
10. Сполука за п. 5, яка відрізняється тим, що R1- означає хлорид, бромід, йодид, сульфат, бензолсульфонат або толуолсульфонат.
11. Сполука за п. 1, яка вибрана з групи:
(ендо)-3-(2-ціано-2,2-дитіофен-2-ілетил)-8,8-диметил-8-азоніабіцикло[3.2.1]октан йодид та (ендо)-3-{2,2-дифеніл-3-[(1-фенілметаноїл)-аміно]-пропіл}-8,8-диметил-8-азоніабіцикло[3.2.1]октан бромід.
12. Фармацевтична композиція, що містить сполуку за п. 1 та фармацевтично прийнятний носій або розріджувач.
13. Фармацевтична композиція для застосування шляхом інгаляції, яка містить сполуку за п. 1 та фармацевтично прийнятний носій або розріджувач, придатний для назальної або оральної інгаляції.
14. Фармацевтична композиція, що містить сполуку за п. 11 та фармацевтично прийнятний носій або розріджувач.
15. Фармацевтична композиція для застосування шляхом інгаляції, яка містить сполуку за п. 11 та фармацевтично прийнятний носій або розріджувач, придатний для назальної або оральної інгаляції.
16. Сполука, яка являє собою (ендо)-3-(2-ціано-2,2-дифенілетил)-8,8-диметил-8-азоніабіцикло[3.2.1]октан бромід.
17. Фармацевтична композиція, яка містить сполуку за п. 16 та фармацевтично прийнятний носій або розріджувач.
18. Сполука
 ,
,
де атом Н знаходиться у екзоположенні;
R1- означає аніон, сполучений з позитивним зарядом атома N.
19. Сполука за п. 18, де R1- означає хлорид, бромід, йодид, сульфат, бензолсульфонат або толуолсульфонат.
Текст
1. Сполука формули І: 2 (19) 1 3 + N R1 89734 4 де атом Н знаходиться у екзоположенні; R1 означає аніон, сполучений з позитивним зарядом атома N. 19. Сполука за п. 18, де R1 означає хлорид, бромід, йодид, сульфат, бензолсульфонат або толуолсульфонат. _ H NC , Цей винахід стосується нових похідних сполук 8-азоніабіцикло[3,2,1]октанів, фармацевтичних композицій, способів їх виготовлення та їх застосування для лікування захворювань, опосередкованих М3 мускариновими ацетилхоліновими рецепторами. Холінергічні нейрони периферійної та центральної нервової системи вивільнюють ацетилхолін, який впливає на безліч різних біологічних процесів шляхом взаємодії з двома головними класами ацетилхолінових рецепторів, представлених нікотиновими і мускариновими ацетилхоліновими рецепторами. Мускаринові ацетилхолінові рецептори (mAChRs) належать до суперсімейства рецепторів з іммобілізованим G-білком, що має сім трансмембранних доменів. Існує п'ять підтипів mAChRs, які позначають М1-М5, і кожний з підтипів являє собою продукт окремого гену. В кожного з цих п'яти підтипів виявляються унікальні фармакологічні властивості. Мускаринові ацетилхолінові рецептори широко розповсюджені в органах хребетних тварин, і ці рецептори можуть бути медіаторами або гальмування, або збудження. Наприклад, у гладкій мускулатурі дихальних шляхів, сечового міхура та шлунково-кишкового тракту М3 mAChRs викликають реакції скорочення. Огляд цих даних можна прочитати в (Brown 1989 247). При деяких різних патофізіологічних станах відзначається дисфункція мускаринових ацетилхолінових рецепторів. Наприклад, стан запалення при астмі та хронічній обструктивній хворобі легенів (COPD) веде до втрати у М2 мускаринових ацетилхолінових ауторецепторів функції гальмування парасимпатичних нервів, які іннервують гладкі м'язи легенів, що викликає збільшення вивільнення ацетилхоліну з подальшою вагусною стимуляцією. Така дисфункція mAChRs призводить до підвищеної реактивності дихальних шляхів, викликаної посиленням стимуляції М3 mAChRs (Costello, Evans, et al. 1999 72) (Minette, Lammers, et al. 1989 248). Аналогічно, стан запалення шлунково-кишкового тракту при запальній хворобі кишечнику (IBD) призводить до М3 mAChRsопосередкованої гіперкінезії (Oprins, Meijer, et al. 2000 245). Також виявлялося нетримання сечі внаслідок гіперскорочуваності, викликаної посиленням стимуляції М3 mAChRs (Hegde & Eglen 1999 251). Таким чином, ідентифікація підтипселективних антагоністів mAChRs може бути корисною для лікування цих mAChRs-опосередкованих хвороб. Попри велику кількість доказів на підтримку використання антимускаринових рецепторів для лікування низки клінічних станів, у клініці застосовують відносно мало антимускаринових сполук. Таким чином, існує потреба в нових сполуках, здатних викликати блокаду М3 mAChRs. Сполуки, що є інгібіторами зв'язування mAChRs, можуть мати ефект при станах, пов'язаних із посиленням стимуляції М3 mAChRs, таких як астма, COPD, IBD і нетримання сечі. Цей винахід стосується способу лікування захворювання, опосередкованого мускариновими ацетилхоліновими рецепторами (mAChRs), у якому ацетилхолін зв'язується з М3 mAChRs, при цьому спосіб містить введення ефективної кількості сполуки формули (І) або формули (II) [крім сполуки формули (II), де R2 і R3 являють собою 2тіофен, і R4 являє собою -ОС(О)СН3] або їх фармацевтично прийнятної солі. Цей винахід також відноситься до способу інгібування зв'язування ацетилхоліну його рецепторами у ссавців, що потребують такого лікування, який вміщує в себе введення вищезгаданому ссавцеві ефективної кількості сполуки формули (І) або формули (II). Цей винахід також стосується нових сполук формули (І) або формули (II), і фармацевтичних композицій, які містять сполуки формули (І) або формули (II), і фармацевтичний носій або розріджувач. Сполуки формули (І) або формули (II), які використовують згідно з винаходом, представлені такою структурою: в яких: позначений атом водню Η перебуває в екзоположенні; R1- являє собою аніон, пов'язаний з позитивним зарядом атому N. R1 може являти собою хлорид, бромід, йодид, сульфат, бензолсульфонат і толуолсульфонат, але не обмежується переліченим вище; R2 і R3 незалежно вибрані з групи, яка складається з прямого або розгалуженого ланцюга груп нижчих алкілів (переважно від 1 до 6 атомів вуглецю), циклоалкільних груп (що мають від 5 до 6 атомів вуглецю), циклоалкіл-алкілу (що має 6-10 5 атомів вуглецю), гетероциклоалкілу (що має 5-6 атомів вуглецю) і N або О як гетероатому, гетероциклоалкіл-алкілу (що має 6-10 атомів вуглецю) і N або О як гетероатому, арилу, необов'язково заміщеного арилу, гетероарилу, і необов'язково заміщеного гетероарилу; R4 вибраний з групи, яка складається з (С1С6)алкілу, (С3-С12)циклоалкілу, (С3С7)гетероциклоалкілу, (С1-С6)алкіл(С3С12)циклоалкілу, (С1-С6)алкіл(С3-С7)гетероциклоалкілу, арилу, гетероарилу, (С1-С6)алкіларилу, (С1-С6)алкіл-гетероарилу, -OR5, -CH2OR5, CH2OH, -CN, -CF3, -CH2O(CO)R6, -CO2R7, CH2NH2, -CH2N(R7)SO2R5, -SO2N(R7)(R8), CON(R7)(R8), -CH2N(R8)CO(R6), CH2N(R8)SO2(R6), -CH2N(R8)CO2(R5), CH2N(R8)CONH(R7); R5 вибраний з групи, яка складається з (С1С6)алкіл, (С1-С6)алкіл(С3-С12)циклоалкілу, (С1С6)алкіл(С3-С7)гетероциклоалкілу, (С1-С6)алкіларилу, (С1-С6)алкіл-гетероарилу; R6 вибраний з групи, яка складається з (С1С6)алкілу, (С3-С12)циклоалкілу, (С3С7)гетероциклоалкілу, (С1-С6)алкіл(С3С12)циклоалкілу, (С1-С6)алкіл(С3-С7)гетероциклоалкілу, арилу, гетероарилу, (С1-С6)алкіларилу, (С1-С6)алкіл-гетероарилу; R7 і R8 незалежно вибрані з групи, яка складається з Н, (С1-С6)алкілу, (С3-С12)циклоалкілу, (С3-С7)гетероциклоалкілу, (С1-С6)алкіл(С3С12)циклоалкілу, (С1-С6)алкіл(С3С7)гетероциклоалкілу, (С1-С6)алкіл-арилу та (С1С6)алкіл-гетероарилу. Придатні фармацевтично прийнятні солі відомі спеціалістам у даній галузі техніки і містять основні солі неорганічних та органічних кислот, таких як соляна кислота, бромисто-воднева кислота, сірчана кислота, фосфорна кислота, метансульфокислота, етансульфокислота, оцтова кислота, яблучна кислота, винна кислота, лимонна кислота, молочна кислота, щавлева кислота, бурштинова кислота, фумарова кислота, малеїнова кислота, бензойна кислота, саліцилова кислота, фенілоцтова кислота і мигдальна кислота. Крім того, фармацевтично прийнятні солі сполук формули (І) або формули (II) можуть також утворюватись з фармацевтично прийнятним катіоном. Придатні фармацевтично прийнятні катіони відомі спеціалістам у даній галузі техніки і містять лужні, лужноземельні, амонієві та четвертинні амонієві катіони. Наступні терміни, використані в цьому винаході, позначають: - "галогени" являють собою всі галогени, в тому числі хлор, фтор, бром і йод. - "С1-10алкіл" або "алкіл" являє собою функціональну групу у вигляді як прямого, так і розгалуженого ланцюга, що має від 1 до 10 атомів вуглецю, якщо довжина ланцюга не обмежена інакше, який уміщує в себе метил, етил, н-пропіл, ізо-пропіл, нбутил, сек-бутил, ізо-бутил, трет-бутил, н-пентил тощо, але не обмежений цим. - "циклоалкіл" наведений у цьому винаході на позначення циклічної функціональної групи, що переважно має від 3 до 8 атомів вуглецю, яка вмі 89734 6 щує в себе циклопропіл, циклопентил, циклогексил тощо, але не обмежується цим. - "алкеніл" наведений у цьому винаході на позначення функціональної групи прямого або розгалуженого ланцюга, що має від 2 до 10 атомів вуглецю, якщо довжина ланцюга не обмежена інакше, яка вміщує в себе етеніл, 1-пропеніл, 2пропеніл, 2-метил-1-пропеніл, 1-бутеніл, 2-бутеніл тощо, але не обмежується цим. - "арил" являє собою феніл і нафтил; - "гетероарил" (самостійно або в будь-якій комбінації, такій як "гетероарилокси" або "гетероарилалкіл") являє собою 5-10-членну систему ароматичних кілець, у якій одне або більше кілець містить один або більше гетероатомів, вибраних з групи, яка складається з Ν, Ο або S, таких як пірол, піразол, фуран, тіофен, хінолін, ізохінолін, хіназолініл, піридин, піримідин, оксазол, тетразол, тіазол, тіадіазол, триазол, імідазол або бензимідазол тощо, але не обмежується цим, - "гетероциклічний" (самостійно або в будь-якій комбінації, такій як "гетероциклоалкіл") являють собою насичені або частково ненасичені 4-10членні кільцеві системи, в яких одне або більше кілець містить один або більше гетероатомів, вибраних з групи, яка складається з Ν, Ο або S; таких як піролідин, піперидин, піперазин, морфолін, тетрагідропіран, тіоморфолін або імідазолідин тощо, але не обмежується цим. Крім цього, сірка може бути необов'язково окислена до сульфону або сульфоксиду, - "арилалкіл" або "гетероарилалкіл" або "гетероциклоалкіл" наведені в цьому винаході на позначення С1-10алкілу, як указано вище, приєднаного до арильної, гетероарильної або гетероциклічної функціональної групи, якщо не вказано інше, -"сульфініл" являє собою оксид S(O) відповідного сульфіду, термін "тіо" стосується сульфіду, і термін "сульфоніл" стосується повністю окисленої функціональної групи S(O)2, - "у якій дві функціональної групи R1 (або дві функціональної групи Y) можуть разом утворювати насичене або ненасичене 5- або 6-членне кільце" наведене в цьому винаході на позначення ароматичної кільцевої системи, такої як нафталін, або позначає фенільну функціональну групу, приєднану до 6-членного частково насиченого або ненасиченого кільця, таку як С6-циклоалкенільну функціональну групу, тобто гексен, або С5циклоалкенільну функціональну групу, таку як циклопентен. Кращими сполуками, корисними для цього винаходу, є: (Ендо)-3-(2-метокси-2,2-ди-тіофен-2-іл-етил)8,8-диметил-8-азоній-біцикло[3,2,1]октан йодид; 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)2,2-дифеніл-пропіонітрил; (Ендо)-8-метил-3-(2,2,2-трифеніл-етил)-8-азабіцикло[3,2,1]октан; 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)2,2-дифеніл-пропіонамід; 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)2,2-дифеніл-пропіонову кислоту; (Ендо)-3-(2-ціано-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан йодид; 7 (Ендо)-3-(2-ціано-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан бромід; 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-іл)2,2-дифеніл-пропан-1-ол; N-Бензил-3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонамід; (Ендо)-3-(2-карбамоїл-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло [3,2,1]октан йодид; 1-Бензил-3-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифенілпропіл]сечовину; 1-Етил-3-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіл]сечовину; N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-ацетамід; N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-бензамід; 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-ди-тіофен-2-іл-пропіонітрил; (Ендо)-3-(2-ціано-2,2-ди-тіофен-2-іл-етил)-8,8диметил-8-азоній-біцикло [3,2,1]октан йодид; N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-бензолсульфонамід; [3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-сечовину; N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3іл)-2,2-дифеніл-пропіл]-метансульфонамід; та (Ендо)-3-{2,2-дифеніл-3-[(1-феніл-метаноїл)аміно]-пропіл}-8,8-диметил-8-азонійбіцикло[3,2,1]октан бромід. До найкращих сполук цього винаходу належать: (Ендо)-3-(2-метокси-2,2-ди-тіофен-2-іл-етил)8,8-диметил-8-азоній-6іцикло [3,2,1]октан йодид; (Ендо)-3-(2-ціано-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан йодид; (Ендо)-3-(2-ціано-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан бромід; (Ендо)-3-(2-карбамоїл-2,2-дифеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан йодид; (Ендо)-3-(2-ціано-2,2-ди-тіофен-2-іл-етил)-8,8диметил-8-азоній-біцикло [3,2,1]октан йодид; та (Ендо)-3-{2,2-дифеніл-3-[(1-феніл-метаноїл)аміно]-пропіл}-8,8-диметил-8-азонійбіцикло[3,2,1]октан бромід. Способи одержання Одержання Одержання сполук формули (І) і формули (II) можна здійснювати із застосуванням способів синтезу, деякі з яких показані далі на схемах. Синтез, здійснений за цими схемами, застосовують для одержання сполук формули (І) і формули (II), що мають низку різних R1, R2, R3 і R4, що вступають у реакцію із замісниками, відповідним чином захищеними, для досягнення сумісності з реакціями цього винаходу. В цьому разі подальше зняття захисних груп надає сполукам можливість у цілому розкрити їхню природу. Низка показаних схем містять сполуки тільки формули (II), проте вони наведені лише для ілюстрування. Схема І зображує загальний спосіб одержання. Синтез починають зі сполуки 1. Відновлення з алюмогідридом літію (LAH) дає спирт 2. Заміщення йодом дає сполуку 3. Реакція зв'язування з ані 89734 8 оном, одержана з HCR2(R3)(R4), дає потім сполуку 4, яка легко перетворюється на амонієву сіль 5. Більш конкретний спосіб одержання, що призводить до сполуки з формулою (II), наведений на схемі II. Алкілування складного ефіру HC(Ph)2CO2CH3 сполукою 3 дає сполуку 6. Гідроліз сполуки 6 призводить до утворення кислоти 7. Опосередкована 1,3-дициклогексилкарбодиімідом (DCC) конденсація кислоти зі спиртом (R7)OH призводить до утворення потім складного ефіру 8. Конденсацією кислоти 7 з аміном (R7)(R8)NH у придатних умовах для зв'язування аміду, які добре відомі спеціалістам у даній галузі техніки, одержують амід 9, такий як 1-(3-диметиламінопропіл)-3етилкарбодиімід гідрохлорид (EDC.HCI) і 1гідроксибензотріазол гідрат (HOBt). Відновленням одержаного спирту 6 одержують сполуку 10. Реакція сполуки 10 з хлорангідридом кислоти (R6)COCI або кислотою (R6)CО2H призводить до утворення складного ефіру 11. Алкілування сполуки 10 з придатними реагентами, такими як (R5)Br, дає потім сполуку 12. Сполуки зі структурами, подібними до сполук 6, 7, 8, 9, 10, 11 і 12, перетворювали на відповідні амонієві солі шляхом реакції з придатними реагентами, такими як МеВr і Mel (не показані на схемі). В деяких способах одержання використовували способи введення і зняття захисних груп. Більш конкретний спосіб одержання сполук формули (II) наведений на схемі III. Алкілування HC(Ph)2CN зі сполукою 3 дає нітрил 13. Гідроліз сполуки 13 як за наявності основ (наприклад, NaOH і Н2О2), так і за наявності кислот (наприклад, H2SO4), дає амід 14. Відновлення сполуки 13 призводить до одержання аміну 15, що перетворюєть 9 ся на амід 16, карбамід 17, сульфонамід 18 і сечовину 19. Конденсацією сполуки 15 з альдегідом (R8)CH(O) з подальшим відновленням за допомогою NaВН(ОАс)з одержують амін 20, що легко перетворюється на амід 21, карбамід 22, сечовину 23 і сульфонамід 24. Сполуки зі структурами, подібними до сполук 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 і 24, перетворювали на відповідні амонієві солі шляхом реакції з придатними реагентами, такими як МеВr і Mel (не показані на схемі). В деяких способах одержання використовували придатні способи введення і зняття захисних груп. Більш конкретний спосіб одержання сполук формули (II) наведений на схемі IV. Алкілування сполуки 25 за допомогою (R5)Br призводить до одержання сполуки 26. Реакція 25 з реагентом Лоуссона (Lawesson's reagent) дає сполуку 27. Окислення сполуки 27 за допомогою SO2CI2 і KNО3 дає сполуку 28, що перетворюється або на сполуку 29, або на сульфонамід 30. Сполуки зі структурами, подібними до сполук 26, 27, 29 і 30, легко перетворювали на відповідні амонієві солі шляхом реакції з придатними реагентами, такими як МеВr і Mel (не показані на схемі). В деяких способах одержання використовували придатні способи введення і зняття захисних груп. Приклади синтезу 89734 10 Наведені нижче приклади ілюструють цей винахід, але жодним чином не обмежують його обсягу. Приклад 1 (Ендо)-3-(2-метокси-2,2-ди-тіофен-2-іл-етил)8,8-диметил-8-азоній-біцикло [3,2,1]октан йодид До розчину 2-(8-метил-8-азабіцикло[3,2,1]окт3-ил)-1,1-дитіофен-2-іл-етанолу (одержаного відповідно до US 2800481) (212мг, 0,64ммоль) у 5мл метиленхлориду і йодметану (0,40мл, 6,4ммоль) додавали 50%-ний водний гідроксид калію (0,25мл, 3,2ммоль) і тетрабутиламонію хлорид (5мг, 3% у молях). Реакційну суміш нагрівали зі зворотним холодильником упродовж 5 днів. Кожного дня додавали додаткову кількість 0,2мл йодметану і 0,1мл гідроксиду калію. Після цього реакційну суміш охолоджували до кімнатної температури, розводили метиленхлоридом і промивали водою. Водний шар екстрагували з метиленхлоридом, і об'єднані органічні шари промивали із сольовим розчином, збезводненим MgSO4, і концентрували у вакуумі. Сирий продукт перекристалізували з метиленхлориду/етилацетату до одержання 109мг вказаної у заголовку сполуки з такими показниками: LCMS (ES) рідинна хроматографія - мас-спектрометрія, відношення маси до заряду m/z 362 (М)+. Приклад 2 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіонітрил; 2а) Одержання ((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-метанолу Суміш 1,1-диметилетил(ендо)-3(гідроксиметил)-8-азабіцикло[3,2,1]октан-8карбоксилату (0,50г, 2,05ммоль) і LiAlH4 (6,16мл, 1,0Μ у тетрагідрофурані (ТГФ), 6,16ммоль) нагрівали при 80°С у мікрохвильовому реакторі впродовж 60 хвилин. Потім розчин змішували з насиченим розчином Na2SO4, фільтрували крізь целіт і концентрували до одержання вказаної у заголовку сполуки (0,31г, 97%) з такими показниками: LCMS + 1 (ES) m/z 156 (М+Н) ; Н-ЯМР (CDCI3) δ 1,28 (с, 1Н), 1,59 (м, 4Н), 1,90 (м, 1Н), 2,13 (м, 4Н), 2,32 (с, 3Н), 3,17 (с, 2Н), 3,59 (д, 2Н). 2b) Одержання (ендо)-3-йодметил-8-метил-8аза-біцикло[3,2,1]октану Розчин йоду (6,67г, 25,8ммоль) і ((ендо)-8метил-8-аза-біцикло[3,2,1]окт-3-ил)-метанолу (2,0г, 12,9ммоль) у СН2СІ2 (120мл) змішували з PPh3 (на смолі, 8,6г, 3ммоль/г, 25,8ммоль). Одержану суміш перемішували впродовж 17 годин, фільтрували й 11 концентрували до одержання вказаної у заголовку сполуки (2,63г, 77%) з такими показниками: LCMS (ES) m/z 266 (М+Н)+; 1Н-ЯМР (CDCI3) δ 2,05 (м, 4Н), 2,39 (м, 3Н), 2,79 (д, 3Н), 2,98 (м, 2Н), 3,45 (д, 2Н), 3,81 (с, 2Н). 2с) Одержання 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонітрил Розчин (ендо)-3-йодометил-8-метил-8-азабіцикло[3,2,1]октану (1,06г, 4,0ммоль) і Ph2CHCN (2,32г, 12,0ммоль) у диметилформаміді (ДМФ) (20мл) змішували з NaH (0,288г, 12,0ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 60 хвилин. Фільтрацію й очищення здійснювали шляхом обернуто-фазової рідинної хроматографії високої роздільної здатності РХВР (Gilson), з одержанням вказаної у заголовку сполуки (1,16г, 93%) з такими показниками: LCMS (ES) m/z 331 (М+Н)+; 1Н-ЯМР (CDCI3) 1,64 (м, 2Н), 2,14 (м, 1Н), 2,26 (м, 2Н), 2,34 (м, 2Н), 2,52 (м, 2Н), 2,75 (м, 5Н), 3,83 (с, 2Н), 7,39 (д, 10Н). Приклад 3 (Ендо)-8-метил-3-(2,2,2-трифеніл-етил)-8-азабіцикло[3,2,1]октан; Розчин трифенілметану (0,276г, 1,13ммоль) у ТГФ (0,5мл) змішували з н-BuLi (0,706мл, 1,6Μ у гексані, 1,13ммоль). Розчин перемішували впродовж 10 хвилин і додавали розчином (ендо)-3йодметил-8-метил-8-аза-біцикло[3,2,1]октану (100мг, 0,377ммоль) у ДМФ (1,0мл). Суміш перемішували при кімнатній температурі впродовж 60 хвилин, змішували з Н2О (0,1мл), концентрували й фільтрували. Потім здійснювали очищення шляхом обернуто-фазової РХВР (Gilson), з одержанням вказаної у заголовку сполуки (23,8мг, 17%) з + такими показниками: LCMS (ES) m/z 382 (М+Н) ; 1 Н-ЯМР (CDCI3) δ 1,07 (д, 2Н), 2,12 (м, 1Н), 2,22 (м, 4Н), 2,31 (м, 2Н), 2,65 (д, 3Н), 2,97 (д, 2Н), 3,63 (с, 2Н), 7,21 (м, 3Н), 7,30 (д, 12Н). Приклад 4 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіонамід Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонітрилу (53мг, 0,16ммоль) у СН2СІ2 (0,25мл) змішували з H2SO4 (0,28мл, 96%) і перемішували при 40°С впродовж 30 годин. Потім суміш виливали на лід, нейтралізували ΝΗ3.Η2Ο, виділяли за допомогою ЕtOАс і концентрували. Одержаний залишок розчиняли у диметилсульфоксиді (ДМСО) і фільтрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (17,2мг, 30%) з такими показ 89734 12 никами: мас-спектрометрія MS (ES) m/z 347 + 1 (М+Н) ; Н-ЯМР (CDCI3) δ 1,31 (д, 2Н), 1,98 (м, 1Н), 2,28 (м, 4Н), 2,39 (м, 2Н), 2,67 (д, 3Н), 2,79 (д, 2Н), 3,66 (с, 2Н), 5,82 (с, шир., 1Н), 6.88 (с, шир., 1Н),7,37(м, 10Н). Приклад 5 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіонова кислота До розчину 2-[(3-ендо)-8-метил-8азабіцикло[3,2,1]окт-3-ил]-1,1-дифенілетанолу (100мг, 1,56ммоль) у НСООН (0,25мл) швидко додавали H2SO4 (2,73мл, 90%) при 0°С. Реакційну пробірку негайно закупорювали і зберігали в холодильнику при -20°С впродовж 7 днів. Розчин виливали на лід, нейтралізували з NH3.H2O, відокремлювали за допомогою ЕtOАс і концентрували. Одержаний залишок розчиняли у ДМСО й фільтрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (52мг, 48%) з такими показни+ 1 ками: LCMS (ES) m/z 350 (М+Н) ; Н-ЯМР (MeOD) δ 1,39 (д, 2Н), 1,86 (м, 1Н), 1,97 (м, 2Н), 2,30 (м, 4Н), 2,69 (с, 3Н), 2,84 (д, 2Н), 3,69 (с, 2Н), 7,28 (м,2Н), 7,36 (м, 8Н). Приклад 6 (Ендо)-3-(2-ціано-2,2-диФеніл-етил)-8,8диметил-8-азоній-біцикло[3,2,1]октан бромід Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил]-2,2-дифеніл-пропіонітрилу (310мг, 0,938ммоль) в ацетоні (6,0мл) змішували з МеВr (4,69мл, 2,ОМ в t-ВuОМе, 0,938ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 60 хвилин і фільтрували. Твердий залишок промивали з ацетоном (2x3мл) до одержання вказаної у заголовку сполуки (333мг, 83%) з + 1 такими показниками: LCMS (ES) m/z 345 (М) ; НЯМР (MeOD) δ 1,82 (д, 2Н), 2,17 (м, 1Н), 2,35 (м, 2Н), 2,49 (м, 4Н), 3,01 (д, 2Н), 3,07 (с, 3Н), 3,10 (с, 3Н), 3,79 (с, 2Н), 7,36 (м, 2Н), 7,43 (м, 4Н), 7,49 (м, 4Н). Приклад 7 (Ендо)-3-(2-ціано-2,2-диФеніл-етил)-8.8диметил-8-азоній-біцикло[3,2,1]октан йодид 13 Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонітрилу (26,5мг, 0,080ммоль) у СН2СІ2 (0,5мл) і MeCN (0,5мл) перемішували з Mel (0,125мл, 2,00ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 3 годин, розводили ДМСО (0,3мл) і концентрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (22,9мг, 60%) з такими показниками: LCMS (ES) m/z 345 (М)+; 1Н-ЯМР (CDCI3) δ 1,83 (д, 2Н), 2,17 (м, 1Н), 2,35 (м, 2Н), 2,49 (м, 4Н), 3,01 (д, 2Н), 3,07 (с, 3Н), 3,10 (с, 3Н), 3,79 (с, 2Н), 7,36 (м, 2Н), 7,43 (м,4Н), 7,49 (м,4Н). Приклад 8 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропан-1-ол Суміш 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонової кислоти (42,5мг, 0,122ммоль) і LiAIH4, (0,488мл, 1,0Μ у ТГФ, 0,488ммоль) нагрівали у мікрохвильовому реакторі при 100°С впродовж 1 години. Суміш розводили насиченим розчином Na2SO4, фільтрували крізь целіт і концентрували. Одержаний залишок розчиняли у ДМСО і фільтрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (29,1мг, 71%) з такими показниками: LCMS (ES) m/z 336 (М+Н)+; 1Н-ЯМР (CDCI3) δ 1,40 (д, 2Н), 1,92 (м, 1Н), 2,29 (м, 6Н), 2,59 (м, 2Н), 2,68 (д, 3Н), 3,72 (с, 2Н), 4,16 (с, 2Н), 7,13 (м, 3Н), 7,30 (м, 7Н). Приклад 9 N-Бензил-3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонамід Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-іл)-2,2-дифеніл-пропіонової кислоти (82,0мг, 0,235ммоль) у СН2Сl2 (3,0мл) змішували з PhCH2NH2 (28,2мкл, 0,258ммоль), хлористим етиленом (EDC) (49,5мг, 0,258ммоль), HOBt (3,2мг, 0,024ммоль) і (СН3СН2)3N (0,232мл, 1,65ммоль). Суміш перемішували при кімнатній температурі впродовж 60 годин і концентрували. Одержаний залишок розчиняли у ДМСО і фільтрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (29,8мг, 30%) з такими показ+ 1 никами: LCMS (ES) m/z 439 (М+Н) ; Н-ЯМР (CDCI3) δ 1,34 (д, 2Н), 1,96 (м, 1Н), 2,23 (м, 2Н), 2,38 (м, 4Н), 2,63 (д, 3Н), 2,83 (д, 2Н), 3,66 (с, 2Н), 4,41 (д, 2Н), 6,93 (м, 2Н), 7,22 (м, 3Н), 7,38 (м, 10Н). Приклад 10 89734 14 (Ендо)-3-(2-карбамоїл-2,2-дифеніл-етил)8,8диметил-8-азоній-біцикло[3,2,1] октан йодид Вказану у заголовку сполуку виготовляли з 3((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-2,2дифеніл-пропіонаміду згідно зі способом прикладу 7 (33% виходу) з такими показниками: LCMS (ES) m/z 363 (М)+; 1Н-ЯМР (CDCI3) δ 1,49 (д, 2Н), 1,95 (м, 1Н), 2,25 (м, 2Н), 2,42 (м, 4Н), 2,84 (д, 2Н), 3,17 (с, 3Н), 3,23 (с, 3Н), 3,93 (с, 2Н), 5,65 (с, 1Н), 5,91 (с, 1Н), 7,39 (м, 10Н). Приклад 11 1-Бензил-3-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіл]сечовина 11а)3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт3-ил)-2,2-диФеніл-пропіламін Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіонітрилу (250мг, 0,758ммоль) у ТГФ (2,5мл) змішували з ВН3 (2,53мл, 1,5Μ у ТГФ, 3,79ммоль) при 0°С. Суміш перемішували при кімнатній температурі впродовж 20 годин і розводили Н2О (1,0мл). Потім розчин змішували з К2СО3 (0,1г) і перемішували при кімнатній температурі впродовж 1 години. Відокремлювали органічні шари, і водну частину екстрагували з ЕtOАс (2x3мл). Органічні шари об'єднували, збезводнювали з Na2SO4 і концентрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (159мг, 63%) з такими показ+ 1 никами: LCMS (ES) m/z 335 (М+Н) ; Н-ЯМР (MeOD) δ 1,35 (д, 2Н), 2,01 (м, 3Н), 2,34 (с, 4Н), 2,55 (с, 2Н), 2,68 (с, 3Н), 3,73 (м, 5Н), 7,26 (м, 4Н), 7,33 (м, 2Н), 7,43 (м, 4Н). 11b) 1-Бензил-3-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропілісечовина Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіламіну (50,0мг, 0,149ммоль) у СН2СІ2 (2,0мл) змішували з PhCH2NCO (20,4мкл, 0,164ммоль) і (CH3CH2)3N (62,8мкл, 0,447ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 1 години й концентрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (13,0мг, 19%) з такими показниками: LCMS (ES) m/z 468 (М+Н)+; 1Н-ЯМР (MeOD) δ 1,24 (д, 2Н), 1,94 (м, 3Н), 2,25 (м, 4Н), 2,49 (д, 2Н), 2,67 (с, 3Н), 3,62 (с, 2Н), 3,97 (с, 2Н), 4,23 (с, 2Н), 7,22 (м, 6Н), 7,33 (м, 4Н). Приклад 12 15 1-Етил-3-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дисфеніл-пропіл]сечовина Титульну сполуку виготовляли з 3-((ендо)-8метил-8-аза-біцикло[3,2,1]окт-3-ил)-2,2-дифенілпропіламіну і CH3CH2NCO згідно зі способом прик+ ладу 11 (45% виходу): LCMS (ES) m/z 406 (М+Н) ; 1 Н-ЯМР (MeOD) δ 1,03 (т, 3Н), 1,33 (д, 2Н), 1,94 (м, 3Н), 2,25 (м, 4Н), 2,55 (д, 2Н), 2,67 (с, 3Н), 3,07 (кв, 2Н), 3,68 (с, 2Н), 3,94 (с, 2Н), 7,24 (м, 6Н), 7,34 (м, 4Н). Приклад 13 N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-ацетамід Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіламіну (33,4мг, 0,10ммоль) у СН2СІ2 (0,5мл) змішували з Ас2О (18,9мкл, 0,20ммоль) і піридином (16,2мкл, 0,20ммоль). Суміш перемішували при кімнатній температурі впродовж 1 години й концентрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (10,7мг, 29%) з такими показниками: LCMS (ES) m/z 377 (М+Н)+; 1Н-ЯМР (MeOD) δ 1,26 (д, 2Н), 1,82 (с, 3Н), 1,96 (м, 3Н), 2,26 (с, 4Н), 2,53 (д, 2Н), 2,67 (с, 3Н), 3,66 (с, 2Н), 4,00 (с, 2Н), 7,24 (м, 6Н), 7,33 (м, 4Н). Приклад 14 N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-бензамід Вказану у заголовку сполуку виготовляли з 3((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-2,2дифеніл-пропіламіну і (РhСО)2О згідно зі способом прикладу 13 (8% виходу) з такими показниками: LCMS (ES) m/z 439 (М+Н)+; 1Н-ЯМР (MeOD) δ 1,28 (д, 2Н), 2,00 (м, 3Н), 2,24 (с, 4Н), 2,59 (д, 2Н), 2,67 (с, 3Н), 3,65 (с, 2Н), 4,21 (с, 2Н), 7,31 (м, 6Н), 7,39 (м, 6Н), 7,50 (м, 3Н). Приклад 15 3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-ди-тіофен-2-іл-пропіонітрил 89734 16 Вказану в заголовку сполуку виготовляли з (ендо)-3-йодометил-8-метил-8-азабіцикло[3,2,1]октану і 2,2-ди-тіофен-2-ілацетонітрилу згідно зі способом прикладу 2С (34% виходу) з такими показниками: LCMS (ES) m/z 343 (М+Н)+; 1Н-ЯМР (CDCI3) δ 1,79 (м, 2Н), 2,21 (м, 2Н), 2,33 (м, 2Н), 2,62 (м, 2Н), 2,73 (м, 4Н), 3,80 (м, 2Н), 4,35 (с, 2Н), 7,02 (м, 2Н), 7,23 (м, 2Н), 7,37 (м, 2Н). Приклад 16 (Ендо)-3-(2-ціано-2,2-ди-тіофен-2-іл-етил)-8-8диметил-8-азоній-біцикло[3,2,1]-октан йодид Вказану в заголовку сполуку виготовляли з 3((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-2,2ди-тіофен-2-іл-пропіонітрилу згідно зі способом прикладу 7 (43%) з такими показниками: LCMS (ES) m/z 345 (М)+; 1Н-ЯМР (CDCI3) 1,82 (д, 2Н), 2,35 (м, 2Н), 2,23 (м, 3Н), 2,58 (м, 4Н), 2,82 (м, 2Н), 3,37 (с, 6Н), 4,25 (с, 2Н), 7,02 (м, 2Н), 7,24 (м, 2Н), 7,36 (м, 2Н). Приклад 17 N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-диФеніл-пропіл]-бензолсульфонамід Розчин 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіламіну (67,0мг, 0,20ммоль) у СН2СІ2 (2,0мл) змішували з PhSO2CI (28,2мкл, 0,22ммоль) і (СН3СН2)3N (84,3мкл, 0,60ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 1 години й концентрували. Подальше очищення обернутофазовою РХВР (Gilson) забезпечувало одержання вказаної в заголовку сполуки (51,5мг, 54%) з таки+ 1 ми показниками: LCMS (ES) m/z 475 (М+Н) ; НЯМР (MeOD) δ 1,39 (д, 2Н), 2,01 (м, 3Н), 2,30 (с, 4Н), 2,69 (с, 5Н), 3,60 (с, 2Н), 3,68 (с, 2Н), 7,12 (м, 4Н), 7,27 (м, 6Н), 7,55 (м, 2Н), 7,63 (м, 1Н), 7,78 (м, 2Н). Приклад 18 [3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-сечовина До розчину 3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіламіну (50,0мг, 0,149ммоль) у СН2СІ2 (4,0мл) додавали CISO2NCO (31,2мкл, 0,358ммоль). Суміш перемішували при кімнатній температурі впродовж 2 днів і концентрували. Подальше очищення обернутофазовою РХВР (Gilson) забезпечувало одержання вказаної в заголовку сполуки (21,6мг, 38%) з таки 17 89734 + 1 ми показниками: LCMS (ES) m/z 378 (М+Н) ; НЯМР (MeOD) δ 1,33 (д, 2Н), 2,01 (м, 3Н), 2,29 (с, 4Н), 2,57 (м, 2Н), 2,68 (с, 3Н), 3,69 (с, 2Н), 4,01 (с, 2Н), 7,25 (м, 6Н), 7,34 (м, 4Н). Приклад 19 N-[3-((Ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3ил)-2,2-дифеніл-пропіл]-метансульфонамід Вказану в заголовку сполуку виготовляли з 3((ендо)-8-метил-8-аза-біцикло[3,2,1]окт-3-ил)-2,2дифеніл-пропіламіну і MeSO2CI згідно зі способом прикладу 17 (28% виходу) з такими показниками: LCMS (ES) m/z 413 (М+Н)+; 1Н-ЯМР (MeOD) δ 1,39 (д, 2Н), 1,97 (м, 3Н), 2,30 (с, 4Н), 2,68 (с, 3Н), 2,76 (с, 3Н), 3,68 (с, 2Н), 3,84 (с, 2Н), 7,23 (с, 6Н), 7,33 (с, 4Н). Приклад 20 (Ендо-3-{2,2-дифеніл-3-[(1-феніл-метаноїл)аміно]-пропіл}-8,8-диметил-8-азонійбіцикло[3,2,1]октан бромід Розчин N-[3-((ендо)-8-метил-8-азабіцикло[3,2,1]окт-3-ил)-2,2-дифеніл-пропіл]бензаміду (29мг, 0,0683ммоль) у СН2СІ2 (0,5мл) і ацетоні (0,5мл) змішували з МеВr (0,342мл, 2,0Μ у f-бутилметиловому ефірі, 0,683ммоль). Одержану суміш перемішували при кімнатній температурі впродовж 3 годин і концентрували. Подальше очищення обернуто-фазовою РХВР (Gilson) забезпечувало одержання вказаної у заголовку сполуки (19,6мг, 64%) з такими показниками: LCMS (ES) m/z 453 (М)+; 1Н-ЯМР (MeOD) δ 1,20 (д, 2Н), 2,32 (м, 7Н), 2,65 (д, 2Н), 2,98 (с, 3Н), 3,02 (с, 3Н), 3,60 (с, 2Н), 4,22 (с, 2Н), 7,30 (м, 6Н), 7,39 (м, 6Н), 7,50 (с, 3Н). Біологічні приклади Інгібувальну дію сполук М3 mAChRs цього винаходу визначали в наступних дослідженнях in vitro та in vivo: Аналіз інгібування активації рецептора мобілізацією кальцію Проводили моніторинг активованої рецептором мобілізації кальцію, як раніше описано10, для аналізу експресованої у клітинах СНО (клітинах яєчника китайського хом'ячка) стимуляції mAChRs. Клітини СНО зі стійкою експресією М3 mAChRs клали у 96-лункові планшети з чорними стінками і прозорим дном. Через проміжок часу від 18 до 24 годин середовище видаляли і заміняли 100мкл завантажувального середовища (ЕМЕМ із солями 18 Ерла, 0,1% бичачий сироватковий альбумін (BSA) для радіоімуноаналізу (Sigma, St. Louis МО), і 4мкл фтор-3-ацетоксиметилового складно-ефірного флуоресцентного індикаторного барвника (Fluo-3 AM, Molecular Probes, Eugene, OR) і клали в інкубатор на 1 годину при 37°С. Потім середовище, що містило барвник, видаляли й заміняли свіжим середовищем (без Fluo-3 AM), і клітини клали в інкубатор на 10 хвилин при 37°С. Після цього клітини промивали 3 рази і клали в інкубатор на 10 хвилин при 37°С у 100мкл оціночного буфера (0,1% желатин (Sigma), 120ммоль NaCI, 4,6ммоль КСІ, 1ммоль КН2РО4, 25ммоль NaHCO3, 1,0ммоль СаСІ2, 1,1ммоль МgСІ2, 1,1ммоль глюкози, 20ммоль HEPES (рН 7,4)). Додавали 50мкл сполу-11 -5 ки (1х10 - 1x10 Μ на кінець аналізу), і планшети клали в інкубатор на 10 хвилин при 37°С. Потім планшети клали у планшет-зчитувач інтенсивності флуоресцентного випромінювання (FLIPR, Molecular Probes), де клітини, які містили барвник, піддавали збудженню світлом (488 нм) за допомогою аргонового лазера потужністю у 6 Ватт. Клітини активували додаванням 50мкл ацетилхоліну зі швидкістю 50мкл/сек (0,1-10нМ на кінець аналізу), приготованого у буфері, що містив 0,1% BSA. Мобілізацію кальцію, яку відстежують за зміною цитозольної концентрації кальцію, вимірювали за зміною інтенсивності емісії у 566нм. Зміна в інтенсивності емісії безпосередньо залежить від рівня вмісту цитозольного кальцію11. В усіх 96 лунках випромінювання флуоресценції вимірювали одночасно, використовуючи охолоджену камеру приладу із зарядовим зв'язком (ПЗС-камеру). Одержані дані відмічали точками щосекунди. Ці дані наносили на схему й аналізували з використанням програмного статку GraphPad PRISM. Бронхоспазм, індукований метахоліном Реакцію-відповідь дихальних шляхів на метахолін визначали в активних і таких, що вільно пересуваються, мишей ВаІbС у кількості (n=6 у кожній групі). Для вимірювання збільшеної паузи (Penh) використовували барометричну плетизмографію, що являє собою безрозмірний вимір, який показав залежність від змін у реактивності дихальних шляхів, що виникає під час метахолінової провокації бронхів12. Попередньо мишам інтраназально вводили 50мкл сполуки (0,003-10мкл на мишу) у 50мкл носія (10% ДМСО), і після цього їх клали у плетизмографічну камеру. Впродовж 10 хвилин мишам у камері давали заспокоїтись перед початком вихідного Penh вимірювання, що триває впродовж 5 хвилин. Потім впродовж 2 хвилин мишам уводили аерозоль метахоліну (10мг/мл). Збільшену паузу Penh починали безперервно реєструвати впродовж 7 хвилин від початку введення аерозолю і продовжували ще впродовж 5 хвилин після введення. Дані по кожній миші наносили на схему й аналізували з використанням програмного статку GraphPad PRISM. 19 Комп’ютерна верстка Л. Купенко 89734 Підписне 20 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntagonists of muscarinic acetylcholine receptors
Автори англійськоюBusch-Petersen Jacob, Palovich Michael R., Wan Zehong, Yan Hongxing, Zhu Chongjie
Назва патенту російськоюАнтагонисты мускариновых ацетилхолиновых рецепторов
Автори російськоюБуш-Петерсен Якоб, Палович Майкл Р., Ван Зехонг, Ян Хонгксинг, Жу Ченгджи
МПК / Мітки
МПК: C07D 451/00, A61K 31/46
Мітки: мускаринових, ацетилхолінових, антагоністи, рецепторів
Код посилання
<a href="https://ua.patents.su/10-89734-antagonisti-muskarinovikh-acetilkholinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Антагоністи мускаринових ацетилхолінових рецепторів</a>
Попередній патент: Індуктивний масштабний перетворювач напруги
Наступний патент: Спосіб одержання рутилу
Випадковий патент: Універсальний суперміцний клей












