Азабіциклічні, азатрициклічні і азаспіроциклічні похідні аміноциклогексану як антагоністи рецепторів nmda, 5ht і нейронних нікотинових рецепторів
Номер патенту: 77778
Опубліковано: 15.01.2007
Автори: Каусс Валерьянс, Калвіньш Іварс, Йіргенсонс Айгарс, Ванейєвс Максімс, Гольд Маркус, Даниш Войцех, Хенріх Маркус, Парсонс Крістофер Грахам Рафаель
Формула / Реферат
1. Сполуки формули (1)
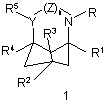 ,
,
де R і R1-R5, кожний незалежно, вибраний з С1-6-алкільних груп, С2-6-алкенільних груп, С2-6-алкінільних груп, С6-12-арил-С1-4-алкільних груп, необов'язково заміщених С6-12-арильних груп і у випадку R і R2-R5 - з атомів водню, за умови, що щонайменше один з R2 і R3 і щонайменше один з R4 і R5 не є воднем, або R і R1 разом являють собою С3-5-алкіленову або алкеніленову групу, причому R2-R5 мають вказані вище значення;
Y являє собою СН, і
Z являє собою валентний зв'язок або метиленову групу або, у випадку, коли R і R1 разом являють собою вказану алкіленову або алкеніленову групу, Z може додатково являти собою атоми водню, приєднані до Y і N, відповідно;
та їх оптичні ізомери і фармацевтично прийнятні кислотно- і основно-адитивні солі.
2. Сполука за п. 1, що являє собою:
1,екзо-3,5-триметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
5-етил-1,екзо-3-диметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
екзо-3-етил-1,5-диметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
1,3,3,5-тетраметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
1,3,3,5,6-пентаметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
5-етил-1,3,3-триметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
1,екзо-3,5-екзо,ендо-7-тетраметил-6-азабіцикло[3.2.1]октан і його гідрохлорид;
1,екзо-3,5-триметил-екзо,ендо-7-феніл-6-азабіцикло[3.2.1]октан і його гідрохлорид;
1,5,екзо-7-триметил-2-азабіцикло[3.3.1]нонан і його гідрохлорид;
7,7,9,9-тетраметил-1-азаспіро[4.5]декан і його гідрохлорид;
8,8,10,10-тетраметил-1-азаспіро[5.5]ундекан і його гідрохлорид і
8,10,10-триметил-6-азатрицикло[6.3.1.01,6]додекан і його гідрохлорид.
3. Фармацевтична композиція, що містить сполуку за п. 1 або п. 2, у комбінації з одним або декількома фармацевтично прийнятними розріджувачами, ексципієнтами або носіями.
4. Застосування сполуки за п. 1, але без умови, що щонайменше один з R2 і R3 і щонайменше один з R4 і R5 не є воднем, як при виготовленні або імуномодуляторного, антималярійного, антивірусного (проти вірусу Воrnа), антигепатитного (проти гепатиту С), антитрипаносомного або анти-HSV (проти вірусу простого герпесу) лікарського засобу, або лікарського засобу для полегшення стану, який можна лікувати антагоністом рецепторів NMDA, 5НТ3 або нейронного нікотинового рецептора.
5. Застосування за п. 4, де вказаним станом, який можна лікувати антагоністом рецептора NMDA є ексцитотоксичність, вибрана з ішемії під час удару, травми, гіпоксії, гіпоглікемії, глаукоми і печінкової енцефалопатії; хронічне нейродегенеративне захворювання, вибране з хвороби Альцгеймера, васкулярної деменції, хвороби Паркінсона, хвороби Хантінгтона, розсіяного склерозу, аміотрофічного бічного склерозу, СНІД-нейродегенерації, олівопонто-церебральної атрофії, синдрому Турета, моторного нейронного захворювання, мітохондріальної дисфункції, корсаковського синдрому і хвороби Крейтцфельда-Якоба; порушення, що належить до тривалих пластичних змін у центральній нервовій системі, вибране з хронічного болю, толерантності до лікарського засобу, залежності від лікарського засобу і звикання до лікарського засобу; епілепсія; пізня дискінезія; L-DOPA-індукована дискінезія; шизофренія; тривога; депресія; гострий біль; м'язова еластичність або шум у вухах.
6. Застосування за п. 4, де вказаний стан, який можна лікувати антагоністом рецептора 5НТ3, вибраний з порушень, що виявляються у почутті тривоги, депресивних порушень, шизофренії і психозу, пов'язаного з лікуванням, порушень, що виявляються у зловживаннях лікарськими засобами і алкоголем, порушень пізнавальної здатності, хвороби Альцгеймера, хвороби Паркінсона, церебрального тремору, мігрені, порушень апетиту, синдрому запаленого кишечнику і блювання.
7. Застосування за п. 4, де вказаний стан, який можна лікувати антагоністом нейронного, нікотинового рецептора, вибраний з синдрому Турета, порушень, що виявляються у почутті тривоги, шизофренії, зловживання лікарським засобом, зловживання нікотином, зловживання кокаїном, дискінезії Morbus Huntington, L-DOPA-індукованої дискінезії, порушення гіперактивності дефіциту уваги, хвороби Альцгеймера, хвороби Паркінсона та болю.
8. Спосіб лікування людини-суб'єкта або тварини, що не є людиною, для імуномодуляторних, антималярійних, антивірусних (проти вірусу Воrnа) або анти-HSV (проти вірусу гепатиту С) цілей або полегшення стану, який можна лікувати антагоністами рецепторів NMDA, 5НТ3 або нейронного нікотинового рецептора, що включає стадію введення вказаному суб'єкту ефективної кількості сполуки за п. 1, але без умови, що щонайменше один з R2 і R3 і щонайменше один з R4 і R5 не є воднем.
Текст
1. Сполуки формули (1) 5. Застосування за п. 4, де вказаним станом, який (Z)n R5 можна лікувати антагоністом рецептора NMDA є R Y N ексцитотоксичність, вибрана з ішемії під час удару, R3 R4 травми, гіпоксії, гіпоглікемії, глаукоми і печінкової R1 енцефалопатії; хронічне нейродегенеративне заR2 хворювання, вибране з хвороби Альцгеймера, ва1 , скулярної деменції, хвороби Паркінсона, хвороби 1 5 де R і R -R , кожний незалежно, вибраний з С1-6Хантінгтона, розсіяного склерозу, аміотрофічного алкільних груп, С2-6-алкенільних груп, С2-6бічного склерозу, СНІД-нейродегенерації, олівопоалкінільних груп, С6-12-арил-С 1-4-алкільних груп, нто-церебральної атрофії, синдрому Турета, монеобов'язково заміщених С 6-12-арильних груп і у торного нейронного захворювання, мітохондріаль2 5 випадку R і R -R - з атомів водню, за умови, що ної дисфункції, корсаковського синдрому і хвороби 2 3 щонайменше один з R і R і щонайменше один з Крейтцфельда-Якоба; порушення, що належить до 4 5 1 R і R не є воднем, або R і R разом являють сотривалих пластичних змін у центральній нервовій бою С3-5-алкіленову або алкеніленову групу, присистемі, вибране з хронічного болю, толерантності 2 5 чому R -R мають вказані вище значення; до лікарського засобу, залежності від лікарського Y являє собою СН, і засобу і звикання до лікарського засобу; епілепсія; Z являє собою валентний зв'язок або метиленову пізня дискінезія; L-DOPA-індукована дискінезія; 1 груп у або, у випадку, коли R і R разом являють шизофренія; тривога; депресія; гострий біль; м'я собою вказану алкіленову або алкеніленову гр упу, зова еластичність або шум у вуха х. Z може додатково являти собою атоми водню, 6. Застосування за п. 4, де вказаний стан, який приєднані до Y і N, відповідно; можна лікувати антагоністом рецептора 5НТ3, вита їх оптичні ізомери і фармацевтично прийнятні браний з порушень, що виявляються у почутті трикислотно- і основно-адитивні солі. воги, депресивних порушень, шизофренії і психо2. Сполука за п. 1, що являє собою: зу, пов'язаного з лікуванням, порушень, що 1,екзо-3,5-триметил-6-азабіцикло[3.2.1]октан і його виявляються у зловживаннях лікарськими засобагідрохлорид; ми і алкоголем, порушень пізнавальної здатності, 5-етил-1,екзо-3-диметил-6-азабіцикло[3.2.1]октан і хвороби Альцгеймера, хвороби Паркінсона, церейого гідрохлорид; брального тремору, мігрені, порушень апетиту, екзо-3-етил-1,5-диметил-6-азабіцикло[3.2.1]октан і синдрому запаленого кишечнику і блювання. його гідрохлорид; 7. Застосування за п. 4, де вказаний стан, який 1,3,3,5-тетраметил-6-азабіцикло[3.2.1]октан і його можна лікувати антагоністом нейронного, нікотигідрохлорид; нового рецептора, вибраний з синдрому Турета, 1,3,3,5,6-пентаметил-6-азабіцикло[3.2.1]октан і порушень, що виявляються у почутті тривоги, шийого гідрохлорид; зофренії, зловживання лікарським засобом, зло5-етил-1,3,3-триметил-6-азабіцикло[3.2.1]октан і вживання нікотином, зловживання кокаїном, дискійого гідрохлорид; незії Morbus Huntington, L-DOPA-індукованої 1,екзо-3,5-екзо,ендо-7-тетраметил-6дискінезії, порушення гіперактивності дефіциту азабіцикло[3.2.1]октан і його гідрохлорид; уваги, хвороби Альцгеймера, хвороби Паркінсона 1,екзо-3,5-триметил-екзо,ендо-7-феніл-6та болю. азабіцикло[3.2.1]октан і його гідрохлорид; 8. Спосіб лікування людини-суб'єкта або тварини, 1,5,екзо-7-триметил-2-азабіцикло[3.3.1]нонан і що не є людиною, для імуномодуляторних, антийого гідрохлорид; малярійних, антивірусних (проти вірусу Воrnа) або 7,7,9,9-тетраметил-1-азаспіро[4.5]декан і його гіданти-HSV (проти вірусу гепатиту С) цілей або порохлорид; легшення стану, який можна лікувати антагоніста8,8,10,10-тетраметил-1-азаспіро[5.5]ундекан і його ми рецепторів NMDA, 5НТ3 або нейронного нікотигідрохлорид і нового рецептора, що включає стадію введення 1,6 8,10,10-триметил-6-азатрицикло[6.3.1.0 ]додекан вказаному суб'єкту ефективної кількості сполуки за і його гідрохлорид. п. 1, але без умови, що щонайменше один з R2 і R3 і щонайменше один з R4 і R5 не є воднем. 5 77778 Запропоновані азабіциклічні, азатрициклічні і азаспіроциклічні похідні аміноциклогексанів, які є системно діючими як антагоністи рецепторів NMDA, 5НТ і нікотинових рецепторів, фармацевтичні композиції, що містять їх, спосіб їх одержання і спосіб лікування порушень ЦНС, які включають порушення глутаматергічної, серотонінергічної та нікотинової трансмісії, і лікування імуномодуляторних порушень та лікування інфекційних захворювань. Антагоністи NMD A Антагонізм глутаматних рецепторів типу Nметил-D-аспартату (N MD A) має потенційно широкий діапазон терапевтичних застосувань [1.9]. Функціональне інгібування рецепторів NMDA може бути досягнуте за допомогою дій при різних сайтах пізнавання, таких як сайт первинного трансмітера, не чутливий до стрихніну сайт гліцину (гліцинув), сайт поліаміну і сайт фенілциклідину, розташований всередині катіонного каналу. Блокатори каналів рецептора NMDA діють неконкурентним, «залежним від використання» способом, це означає, що вони звичайно блокують канали тільки у відкритому стані. Дана залежність від використання інтерпретується багатьма так, що більш сильна активація рецептора повинна привести до більш високого ступеня антагонізму. Такий тип дії додатково приймається для позначення того, що цей клас антагоністів може бути особливо корисним, коли може очікуватися надактивація рецепторів NMDA, наприклад, при епілепсії, ішемії і травмі. Однак, первинний клінічний дослід з селективним, таким, що має високу афінність, сильно залежним від використання, неконкурентним антагоністом рецептора NMDA, малеатом (+)-5-метил-10,11дигідро-5Н-дибензоциклогептен-5,10-іміну ((+)-МК801), розчарував. А саме, терапевтична ефективність його при епілепсії була слабкою, тоді як при застосуванні його у терапевтичних дозах очевидними були деякі психотропні побічні дії. Дані спостереження разом з тим фактом, що суб'єкти, які зловживають фенциклідином, відчувають схожі психотропні симптоми, привели до висновку, що неконкурентний антагонізм рецептора NMDA не може бути перспективним терапевтичним підходом. Однак, застосування більш ретельно розроблених електрофізіологічних способів показує, що немає рівності між різними неконкурентними антагоністами, оскільки такі фактори, як швидкість блокування рецептора (кінетика за принципом увімкнено-вимкнено) і залежність цього ефекту від напруги, можуть визначати фармакодинамічні характеристики in vivo, тобто також терапевтичну безпеку. Парадоксально, що можуть бути бажані агенти з афінністю від низької до помірної, а не агенти з високою афінністю. Такі дані викликають перегляд концепції неконкурентного антагонізму рецепторів NMDA при розробці лікарських засобів [19,22]. Неконкурентні антагоністи рецепторів NMDA, такі як амантадин і мемантин, - які задовольняють вказані вище критерії - використовували клінічно протягом декількох років при лікуванні хвороби Паркінсона і деменції, відповідно, і, дійсно, вони рідко викликали побічні дії при терапевти 6 чних дозах, що використовуються при їх відповідних показаннях. Зважаючи на вказані вище дані авторами був розроблений ряд нових неконкурентних антагоністів рецепторів NMDA на основі сполук з азабіциклічною, азатрициклічною і азаспіроциклічною структурою. Антагоністи рецепторів 5-НТ3 Рецептори 5-НТ3 є іонотропними рецепторами, що відкриваються лігандами, які є проникними для катіонів. В організмі людини рецептори 5-НТ3 виявляють найвищу щільність на ентерохромафінних клітинах у шлунково-кишковій слизовій оболонці, які іннервуються вагусними аферентами, і в area postrema стовбура мозку, яка утворює тригерну (пускову) зону хеморецепторів. Оскільки рецептори 5-НТ3 мають високу щільність не лише в area postrema. але також у ділянці гіпокампу та мигдалика лімбічної системи, було зроблено припущення, що селективні антагоністи 5-НТ3 можуть мати психотропні дії (Greenshaw & Silverstone, 1997). Дійсно, ранні дослідження на тваринах дозволили припустити, що антагоністи рецептора 5-НТ3, крім їх добре визнаного протиблювотного використання, можуть бути цілком клінічно корисними у ряді галузей застосування. Вони включають порушення, що виявляються у почутті тривоги, шизофренію, порушення, що виявляються у зловживаннях лікарськими засобами і алкоголем, депресивні порушення, порушення пізнавальної здатності, хворобу Альцгеймера, церебральний тремор, психоз, пов'язаний з лікуванням хвороби Паркінсона, біль (мігрень і синдром подразненої товстої кишки) та порушення апетиту. Антагоністи нейронного нікотинового рецептора У наш час відомі десять альфа-субодиниць (альфа 1-10) і чотири бета-субодиниці (бета 1-4) нікотинових рецепторів. Рецептори α4β2 є, ймовірно, найбільш поширеними у ЦНС, особливо у гіпокампі і смугастому тілі. Вони утворюють неселективні катіонні канали з повільно, неповністю десенсибілізуючими струмами (тип II). Гомомерні рецептори α7 є як до-, так і післясинаптичними, їх виявляють у гіпокампі, руховій ділянці кори головного мозку та лімбічній системі, а також у периферичній нервовій автономній системі. Дані рецептори характеризуються їх високою Са 2+проникністю і швидкими, сильно десенсибілізуючими реакціями (тип 1А). Зміни у нікотинових рецепторах мають місце при ряді захворювань. Вони включають хворобу Альцгеймера. хворобу Паркінсона, синдром Турета, шизофренію, зловживання лікарським засобом, зловживання нікотином і біль. На основі спостереження того, що, як виявилося, нікотиновий агоніст самого нікотину володіє корисними діями, розробка лікарського засобу досі здійснюється при виявленні селективних нікотинових агоністів. З іншого боку, незрозуміло, чи зумовлені дії нікотинових агоністів, наприклад, при синдромі Турета і шизофренії, активацією або інактивацією/десенсибілізацією нейронних нікотинових рецепторів. 7 77778 8 Вплив агоністів на нейронні нікотинові рецепгруп), С2- 6-алкінільних груп з нерозгалуженим або тори сильно залежить від періоду експозиції. Швирозгалуженим ланцюгом (наприклад, етинільних дка оборотна десенсибілізація протікає за мілісеабо пропінільних груп), С6-12-арильних груп (наприкунди, зниження відбувається за секунди, клад, фенільних або нафтильних груп), заміщених безповоротна інактивація рецепторів, що містять С6-12-арильних груп (наприклад таких, що мають α4β і α7, протікає за години і їх позитивна регуляодин або декілька замісників, вибраних з С1-6ція відбувається через декілька днів. алкілу, такого як метил або етил, С1-6-алкокси, таІншими словами, дії нікотинових «агоністів» кого як метокси або етокси, гідрокси і галогену, можуть фактично бути зумовлені частковим агонітакого як хлор або бром), С1-12-арил-С 1-4-алкільних змом, інактивацією і/або десенсибілізацією нейгруп (наприклад, бензильних або фенетильних ронних нікотинових рецепторів. У свою чергу, погруп), і у випадку R і R2-R5 - також з атомів водню; мірні концентрації блокаторів каналів нейронних Ζ являє собою СН 2; нікотинових рецепторів можуть викликати такі ж n дорівнює 0 або 1; дії, які вказувалися для нікотинових агоністів у згаΥ являє собою СН; даних вище показаннях. і за умови, що, щонайменше, один з R 2 і R3 не Тепер виявлено, що деякі азабіциклічні, азатє воднем і, щонайменше, один з R4 і R5 не є водрициклічні і азаспіроциклічні похідні аміноциклогенем; ксанів володіють різко вираженою і непередбачуабо з тих сполук, в яких R і R1 з'єдн уються з ваною антагоністичною активністю для рецепторів утворенням С 3-С5-алкіленового або алкеніленовоNMDA, 5HT і нікотинових рецепторів. Завдяки згаго містка U-V-W-X, що приводить до утворення даній вище властивості такі сполуки є придатними структури, представленої формулою 2 для лікування широкого діапазону порушень ЦНС, які включають порушення глутаматергічної, серо2 тонінергічної і нікотинової трансмісії, імуномодуляторного захворювання та інфекційних захворюде X являє собою СН 2; вань. Дані сполуки знаходяться, переважно, у m дорівнює 0, 1 або 2; формі їх фармацевтичної композиції, в якій вони або з тих сполук, в яких R і R1 з'єдн уються з присутні разом з одним або декількома фармацевутворенням С3-С5-алкіленового або тично прийнятними розріджувачами, носіями або алкеніленового містка U-V-W-X і члени кільця ексципієнтами. N і Υ не з'єднуються з утворенням містка, що приМетою даного винаходу є пропонування нових водить до утворення основної структури, предстафармацевтичних сполук, які являють собою азабівленої формулою 3 циклічні, азатрициклічні і азаспіроциклічні похідні аміноциклогексану і є антагоністами рецепторів 3 NMDA, 5НТ3 і нікотинових рецепторів, та їх фармацевтичних композицій. Наступною метою винаде член кільця N є насиченим і член кільця Υ є ходу є пропонування нового способу лікування, насиченим або може з'єднуватися разом з R5 з усунення, ослаблення, тимчасового полегшення утворенням вуглець-водневого зв'язку з атомом або зменшення інтенсивності симптомів небажавуглецю кільця, до якого він приєднаний; них порушень ЦНС, які включають порушення глуїх оптичних ізомерів та їх фармацевтично притаматергічної, серотонінергічної та нікотинової йнятних кислотно- або основно-адитивних солей; трансмісії, лікування імуномодуляторних порушень такий спосіб лікування тварини для полегшені лікування інфекційних захворювань за допомогою ня стану, в якому сполука вибрана за її імуномовикористання сполуки винаходу або фармацевтидуляторною, антималярійною, антивірусною (вірус чної композиції, що містить її. Додатковою метою Воrnа), антигепатитною (гепатит С), антитрипановинаходу є пропонування способу одержання азасомною активністю і активністю проти вірусу гербіціклічних, азатрициклічних і азаспіроциклічних песу простого, що включає стадію введення твапохідних аміноциклогексану, що є активними спорині кількості сполуки, вибраної зі сполук луками. Додаткові цілі стануть очевидними після формули 1 даного опису, інші цілі будуть також очевидними фа хівцеві у даній галузі. 1 Таким чином, автори вважають, що даний винахід може бути підсумований, inter alia, наступним чином. де Сполука, вибрана зі сполук формули 1 R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим 1 ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, де заміщеного арилу і арилалкілу; 1 5 R і R -R , кожний незалежно, вибраний з С1-6R1 вибраний з групи, що складається з алкілу алкільних груп з нерозгалуженим або розгалуже(С1-С6) з нерозгалуженим або розгалуженим ланним ланцюгом (наприклад, метильних, етильних, цюгом, алкенілу (С2-С6) з нерозгалуженим або розпропільних або бутильних груп), С2-6-алкенільних галуженим ланцюгом, алкінілу (С2-С6) з нерозгагруп з нерозгалуженим або розгалуженим ланцюлуженим або розгалуженим ланцюгом, арилу, гом (наприклад, етенільних або пропенільних заміщеного арилу і арилалкілу; 9 77778 10 радикали від R2 до R5 незалежно вибрані з де групи, що складається з водню, алкілу (С1-С6) з R вибраний з групи, що складається з водню, нерозгалуженим або розгалуженим ланцюгом, алкілу (С1-С6) з нерозгалуженим або розгалуженим алкенілу (C2-С6) з нерозгалуженим або розгалужеланцюгом, алкенілу (С2-С6) з нерозгалуженим або ним ланцюгом, алкінілу (С2-С6) з нерозгалуженим розгалуженим ланцюгом, алкінілу (С2-С6) з нерозабо розгалуженим ланцюгом, арилу, заміщеного галуженим або розгалуженим ланцюгом, арилу, арилу і арилалкілу; заміщеного арилу і арилалкілу; Ζ являє собою СН 2; R1 вибраний з групи, що складається з алкілу n дорівнює 0 або 1; (С1-С6) з нерозгалуженим або розгалуженим ланΥ являє собою СН; цюгом, алкенілу (С2-С6) з нерозгалуженим або розабо з тих сполук, в яких R і R1 з'єдн уються з галуженим ланцюгом, алкінілу (С2-С6) з нерозгаутворенням С 3-С5-алкіленового або алкеніленоволуженим або розгалуженим ланцюгом, арилу, го містка U-V-W-X, що приводить до утворення заміщеного арилу і арилалкілу; структури, представленої формулою 2 радикали від R2 до R5 незалежно вибрані з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, 2 алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим де X являє собою СН 2; або розгалуженим ланцюгом, арилу, заміщеного m дорівнює 0, 1, 2; арилу і арилалкілу; або з тих сполук, в яких R і R1 з'єдн уються з Ζ являє собою СН 2; утворенням С 3-С5-алкіленового або алкеніленовоn дорівнює 0 або 1; го містка U-V-W-X і члени кільця N і Υ не з'єднуΥ являє собою СН; ються з утворенням містка, що приводить до утвоабо з тих сполук, в яких R і R1 з'єдн уються з рення основної структури, представленої утворенням С 3-С5-алкіленового або алкеніленовоформулою 3 го містка U-V-W-X, що приводить до утворення структури, представленої формулою 2 3 де член кільця N є насиченим і член кільця Υ є насиченим або може з'єднуватися разом з R5 з утворенням вуглець-водневого зв'язку з атомом вуглецю кільця, до якого він приєднаний; її оптичних ізомерів та їх фармацевтично прийнятних кислотно- або основно-адитивних солей; яка є ефективною для полегшення вказаного стану; такий спосіб лікування тварини для полегшення стану, який можна лікувати антагоністом NBDA, і який вибраний з групи, що складається з ексцитотоксичності, вибраної з ішемії під час удару, травми, гіпоксії, гіпоглікемії, глаукоми і печінкової енцефалопатії, хронічних нейродегенеративних захворювань, вибраних з хвороби Альцгеймера, васкулярної деменції, хвороби Паркінсона, хвороби Гентінгтона. розсіяного склерозу, бічного аміотрофічного склерозу, СНІД-нейродегенерації, олівопонтоцеребелярної атрофії, хвороби Турета, моторного нейронного захворювання, мітохондріальної дисфункції, корсаковського синдрому і хвороби Крейтцфельда-Якоба, інших порушень, які відносяться до тривалих пластичних змін у центральній нервовій системі і вибрані з хронічного болю, толерантності до лікарського засобу. залежності від лікарського засобу і звикання до лікарського засобу (наприклад, опіоїдів, кокаїну, бензодіазепіну, нікотину і алкоголю), і епілепсії, пізньої дискінезії, L-DOPAіндукованої дискінезії, шизофренії, тривоги, депресії, гострого болю, м'язової спастичності і шуму у вуха х, що включає стадію введення тварині кількості сполуки, вибраної зі сполук формули 1 1 2 де X являє собою СН 2; m дорівнює 0, 1, 2; або з тих сполук, в яких R і R1 з'єдн уються з утворенням С 3-С5-алкіленового або алкеніленового містка U-V-W-X і члени кільця N і Υ не з'єднуються з утворенням містка, що приводить до утворення основної структури, представленої формулою 3 3 де член кільця N є насиченим і член кільця Υ є насиченим або може з'єднуватися разом з R5 з утворенням вуглець-водневого зв'язку з атомом вуглецю кільця, до якого він приєднаний; її оптичних ізомерів та їх фармацевтично прийнятних кислотно- або основно-адитивних солей; яка є ефективною для полегшення вказаного стану; такий спосіб лікування тварини для полегшення стану, який можна лікувати антагоністом рецептора 5НТ3, що включає стадію введення тварині кількості сполуки, вибраної зі сполук формули 1 1 де R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; R1 вибраний з групи, що складається з алкілу 11 77778 12 (С1-С6) з нерозгалуженим або розгалуженим ланнерозгалуженим або розгалуженим ланцюгом, цюгом, алкенілу (С2-С6) з нерозгалуженим або розалкенілу (С2-С6) з нерозгалуженим або розгалужегалуженим ланцюгом, алкінілу (С2-С6) з нерозганим ланцюгом, алкінілу (С2-С6) з нерозгалуженим луженим або розгалуженим ланцюгом, арилу, або розгалуженим ланцюгом, арилу, заміщеного заміщеного арилу і арилалкілу; арилу і арилалкілу; радикали від R2 до R5 незалежно вибрані з Ζ являє собою СН 2; групи, що складається з водню, алкілу (С1-С6) з η дорівнює 0 або 1; нерозгалуженим або розгалуженим ланцюгом, Υ являє собою СН; алкенілу (С2-С6) з нерозгалуженим або розгалужеабо з тих сполук, в яких R і R1 з'єдн уються з ним ланцюгом, алкінілу (С2-С6) з нерозгалуженим утворенням С 3-С5-алкіленового або алкеніленовоабо розгалуженим ланцюгом, арилу, заміщеного го містка U-V-W-X, що приводить до утворення арилу і арилалкілу; структури, представленої формулою 2 Ζ являє собою СН 2; n дорівнює 0 або 1; 2 Υ являє собою СН; 1 або з тих сполук, в яких R і R з'єдн уються з де X являє собою СН 2; утворенням С 3-С5-алкіленового або алкеніленовоm дорівнює 0, 1,2; го містка U-V-W-X, що приводить до структури, або з тих сполук, в яких R і R1 з'єдн уються з представленої формулою 2 утворенням С 3-С5-алкіленового або алкеніленового містка U-V-W-X і члени кільця N і Υ не з'єдну2 ються з утворенням містка, що приводить до утворення основної структури, представленої де X являє собою СН 2; формулою 3 m дорівнює 0, 1,2; або з тих сполук, в яких R і R1 з'єдн уються з 3 утворенням С 3-С5-алкіленового або алкеніленового містка U-V-W-X і члени кільця N і Υ не з'єднуде член кільця N є насиченим і член кільця Υ є ються з утворенням містка, що приводить до утвонасиченим або може з'єднуватися разом з R5 з рення основної структури, представленої утворенням вуглець-водневого зв'язку з атомом формулою 3 вуглецю кільця, до якого він приєднаний; її оптичних ізомерів та їх фармацевтично при3 йнятних кислотно- або основно-адитивних солей; яка є ефективною для полегшення вказаного стаде член кільця N є насиченим і член кільця Υ є ну; насиченим або може з'єднуватися разом з R з такий спосіб лікування тварини для полегшенутворенням вуглець-водневого зв'язку з атомом ня стану, який можна лікувати антагоністом 5НТ3 і вуглецю кільця, до якого він приєднаний; який вибраний з групи, що складається з поруїї оптичних ізомерів та їх фармацевтично пришень, які виявляються у почутті тривоги, депресийнятних кислотно- або основно-адитивних солей; вних порушень, шизофренії і психозу, пов'язаного яка є ефективною для полегшення вказаного стаз лікуванням порушень через зловживання лікарну; ським засобом і алкоголем, порушень пізнавальної такий спосіб лікування живої тварини для поздатності, хвороби Альцгеймера, хвороби Паркінлегшення стану, який можна лікувати антагоністом сона, церебрального тремору, мігрені, порушень нейронного нікотинового рецептора, що включає апетиту, синдрому запаленого кишечнику (IBS) і стадію введення тварині кількості сполуки, вибраблювання, що включає стадію введення тварині ної зі сполук формули 1 кількості сполуки, вибраної зі сполук формули 1 1 1 де R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; R1 вибраний з групи, що складається з алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; радикали від R2 до R5 незалежно вибрані з групи, що складається з водню, алкілу (С1-С6) з де R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; R1 вибраний з групи, що складається з алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; радикали від R2 до R5 незалежно вибрані з групи, що складається з водню, алкілу (С1-С6) з 13 77778 14 нерозгалуженим або розгалуженим ланцюгом, групи, що складається з водню, алкілу (С1-С6) з алкенілу (С2-С6) з нерозгалуженим або розгалуженерозгалуженим або розгалуженим ланцюгом, ним ланцюгом, алкінілу (С2-С6) з нерозгалуженим алкенілу (С2-С6) з нерозгалуженим або розгалужеабо розгалуженим ланцюгом, арилу, заміщеного ним ланцюгом, алкінілу (С2-С6) з нерозгалуженим арилу і арилалкілу; або розгалуженим ланцюгом, арилу, заміщеного Ζ являє собою СН 2; арилу і арилалкілу; n дорівнює 0 або 1; Ζ являє собою СН 2; Υ являє собою СН; n дорівнює 0 або 1; або з тих сполук, в яких R і R1 з'єдн уються з Υ являє собою СН; утворенням С 3-С5-алкіленового або алкеніленовоабо з тих сполук, в яких R і R1 з'єдн уються з го містка U-V-W-X, що приводить до утворення утворенням С 3-С5-алкіленового або алкеніленовоструктури. представленої формулою 2 го містка U-V-W-X, що приводить до утворення структури, представленої формулою 2 2 2 де X являє собою СН 2; де X являє собою СН 2; m дорівнює 0, 1, 2; m дорівнює 0, 1, 2; або з тих сполук, в яких R і R1 з'єдн уються з або з тих сполук, в яких R і R1 з'єдн уються з утворенням С 3-С5-алкіленового або алкеніленовоутворенням С 3-С5-алкіленового або алкеніленового містка U-V-W-X і члени кільця N і Υ не з'єднуго містка U-V-W-X і члени кільця N і Υ не з'єднуються з утворенням містка, що приводить до утвоються з утворенням містка, що приводить до утворення основної структури, представленої рення основної структури, представленої формулою 3 формулою 3 3 3 де член кільця N є насиченим і член кільця Υ є насиченим або може з'єднуватися разом з R5 з утворенням вуглець-водневого зв'язку з атомом вуглецю кільця, до якого він приєднаний; її оптичних ізомерів та їх фармацевтично прийнятних кислотно- або основно-адитивних солей; яка є ефективною для полегшення вказаного стану; такий спосіб лікування тварини для полегшення стану, який можна лікувати антагоністом нейронного нікотинового рецептора і який вибраний з групи, що складається з синдрому Турета, порушень, що виявляються у почутті тривоги. шизофренії, порушень через зловживання лікарським засобом, порушень через зловживання нікотином, порушень через зловживання кокаїном, дискінезії (Morbus Huntinton, викликаної L-DOPA), порушення гіперфункції дефіциту уваги (ADHD), хвороби Альцгеймера, хвороби Паркінсона і болю, що включає стадію введення тварині кількості сполуки, вибраної зі сполук формули 1 1 де R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; R1 вибраний з групи, що складається з алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; радикали від R2 до R5 незалежно вибрані з де член кільця N є насиченим і член кільця Υ є насиченим або може з'єднуватися разом з R5 з утворенням вуглець-водневого зв'язку з атомом вуглецю кільця, до якого він приєднаний; її оптичних ізомерів та їх фармацевтично прийнятних кислотно- або основно-адитивних солей; яка є ефективною для полегшення вказаного стану; і така фармацевтична композиція, яка складається зі сполуки, вибраної зі сполук формули 1 1 де R вибраний з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; R1 вибраний з групи, що складається з алкілу (C1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; радикали від R2 до R5 незалежно вибрані з групи, що складається з водню, алкілу (С1-С6) з нерозгалуженим або розгалуженим ланцюгом, алкенілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, алкінілу (С2-С6) з нерозгалуженим або розгалуженим ланцюгом, арилу, заміщеного арилу і арилалкілу; Ζ являє собою СН 2; n дорівнює 0 або 1; Υ являє собою СН; або з тих сполук, в яких R і R1 з'єдн уються з утворенням С 3-С5-алкіленового або алкеніленово 15 77778 16 го містка U-V-W-X, що приводить до утворення Приклад 1 структури, представленої формулою 2 Гідрохлорид 1,екзо-3,5-триметил-6азабіцикло[3.2.1]октану (1-1) a) 1,екзо-3,5-Триметил-6-азабіцикло[3.2.1]окт2 6-ен (5-1) Суміш 1,3,3,транс-5де X являє собою СН 2; тетраметилциклогексанаміну (4-1) (3,88г, 25моль). m дорівнює 0, 1,2; K2СО3 (28г, 0,2моль) і тетраацетату свинцю (22,2г, або з тих сполук, в яких R і R1 з'єдн уються з 50моль) у сухому бензолі (125мл) перемішують утворенням С 3-С5-алкіленового або алкеніленовопротягом 3 годин при кип'ятінні зі зворотним холого містка U-V-W-X і члени кільця N і Υ не з'єднудильником. Потім її охолоджують льодяною водою ються з утворенням містка, що приводить до утвоі фільтрують. Осад промивають діетиловим ефірення основної структури, представленої ром і фільтрат упарюють при зниженому тиску. формулою 3 Маслянистий залишок розділяють колонковою хроматографією на силікагелі (дихлорметан3 ізопропіловий спирт, 20:1, 10:1). Фракцію з Rf 0,7 (ЕtOАс) збирають, одержуючи при цьому після де член кільця N є насиченим і член кільця Υ є концентрування при зниженому тиску 1,0г (26%) 5 насиченим або може з'єднуватися разом з R з іміну 5-1 у вигляді бур штинового масла. 1 утворенням вуглець-водневого зв'язку з атомом H ЯМР (CDCІ3, ТМС) δ: 0,86 (3Н, д, 6Гц, 3вуглецю кільця, до якого він приєднаний; СН3), 0,90-1,80 (7Н, м, СН кільця); 1,12 (3Н, с, 1її оптичних ізомерів та їх фармацевтично приСН3); 1,34 (3Н, с, 5-СН3) і 7,36 м.ч. (1Н, с, НС=). йнятних кислотно- або основно-адитивних солей; b) Гідрохлорид 1,екзо-3.5-триметил-6у комбінації з одним або декількома фармацеазабіцикло[3.2.1]октану (1-1) втично прийнятними розріджувачами, ексципієнРозчин іміну 5-1 (0,8г, 5,3моль) у МеОН (2мл) тами або носіями. додають по краплях до суспензії боргідриду натрію Викладені нижче подробиці та докладні при(0,4г, 10,6моль) в МеОН (6мл). Суміш перемішуклади наводяться тільки з метою ілюстрації і не ють при кімнатній температурі протягом 24 годин, повинні тлумачитися як обмеження. потім додають 10мл 5% водного NaOH. Суміш Нижче наводиться загальна синтетична схема екстрагують діетиловим ефіром. Органічну фазу і таблиця для 6-азабіцикло[3.2.1]октанів (що віднопромивають водним NaCl і сушать над гранулами сяться до структури формули 1 короткого викладу NaOH. Фільтрований розчин обробляють сухим винаходу): розчином НСl у діетиловому ефірі, упарюють при зниженому тиску і залишок перекристалізовують з сухого CH3CN, одержуючи при цьому сполуку 1-1 у вигляді безбарвної твердої речовини (0,33г, 35%). 1 Η ЯМР (CDCІ3, TMC) δ: 0,96 (3Н, д, 6Гц, 3СН3), 0,95-1,15 (1H, м, 2-СН): 1,11 (3Н, с, 1-СН3); 1,41 (1H, д, 12,4Гц, 8-СН); 1,55-1,70 (1Н, м, 2-СН); 1,57 (3Н, с, 5-СН3); 1,70-1,90 (2Н, м, 4-СН і 8-СН); 2,00-2,30 (2Н, м, 3-СН і 4-СН); 3,00-3,25 (2Н, м, 7СН2) і 9,30-9,85 м.ч. (2Н, уш.с, ΝΗ2+). Приклад 2 Гідрохлорид 5-етил-1,екзо-3-диметил-6азабіцикло[3.2,1]октану (1-2) a) 1-Азидо-1-етил-3,3,транс-5триметилциклогексан (7) Охолоджену (~0°С) суміш 1-етил-3,3,транс-5триметилциклогексанолу (6) (3,3г, 18,1моль), азиду натрію (2,36г, 36,3моль) і трифтороцтової кислоти (10,7мл) у хлороформі (50мл) перемішують протягом 24 годин. Потім її роблять основною додаванням розбавленого водного аміаку. Органічну фазу відділяють, промивають водою і сушать над Таблиця 1 K2СО3. Фільтрування і випарювання розчинника 6-Азабі цик ло[3.2.1]октани в ід 1-1 до 1-8 при зниженому тиску дають маслянистий залишок, який розділяють флеш-хроматографією на силікаНомер у синНомер 1 2 3 4 5 гелі при елююванні легким петролейним ефіром, тетично му R R R R R R Υ n MZR одержуючи при цьому азид 7 (2,0г, 56%) у вигляді описі 2011 1-1 Η Me Me Η Me Η CH 0 легкого безбарвного масла. 1 2023 1-2 Η Et Me Η Me Η CH 0 H ЯМР (CDCІ3, TMC) δ: 0,64 (1H, д, 14Гц, СН 2007 1-3 Η Me Et Η Me Η CH 0 кільця); 0,85-2,15 (8Н, м, СН кільця і Et-CH 2); 0,90 2/1010 1-4 Η Me Me Me Me Η CH 0 (3Н, д, 7Гц, 5-СН3); 0,92 (3Н, с, 3-СН3екв.); 0,97 (3Н, 2/1003 1-5 Me Me Me Me Me Η CH 0 т, 7,5Гц, Et-СН3) і 1,10 м.ч. (3Н, с, 3-СН3акс.). 2022 1-6 Η Et Me Me Me Η CH 0 2029 1-7 Η Me Me Η Me Me CH 0 b) 1-Етил-3,3,транс-52028 1-8 Η Me Me Η Me Ph CH 0 триметилциклогексанамін (4-2) 17 77778 18 Розчин азиду 7 (1,97г, 10моль) у діетиловому йоду (1,95г, 7,7моль) у сухому бензолі (35мл) доефірі (10мл) додають по краплях до суспензії лідають тетраацетат свинцю (3,92г, 8,85моль) у витійалюмінійгідриду (1,13г, 30моль) у діетиловому гляді однієї порції. Суміш перемішують при кип'я ефірі (30мл). Суміш перемішують протягом 20 готінні зі зворотним холодильником протягом 4 дин при кімнатній температурі. Потім її обережно годин, потім охолоджують льодяною водою і фільгасять 10% водним NaOH. Органічну фаз у віддітрують. Осад промивають діетиловим ефіром і ляють і водну фазу екстрагують діетиловим ефіфільтрат обережно промивають насиченим водром. Об'єднані органічні фази промивають насиним метабісульфітом калію, потім насиченим водченим водним NaCl і сушать над NaOH. ним NaHCO3. Органічну фазу промивають насичеФільтрування і випарювання розчинника при зниним водним NaCl, сушать над MgSO4 та упарюють. женому тиску дає амін 4-2 (1,36г, 80%) у вигляді Залишок очищають флеш-хроматографією на симасла. лікагелі (легкий петролейний ефір-етилацетат, 1 H ЯМР (CDCІ3, TMC) δ: 0,55-2,15 (9Н, м, СН 20:1), одержуючи при цьому сполуку 9-1 (0,76г, кільця і Et-CH2); 0,88 (3Н, с, 3-СН3екв.); 0,89 (3Н, д, 73%) у вигляді безбарвного масла. 1 6,5Гц, 5-СН3); 0,89 (3Н, т, 7Гц, Et-CH 3) і 1,12 м.ч. H ЯМР (CDCІ3, ТМС) δ: 0,86 (3Н, т, 6,5Гц, (3Н, с, 3-СН3акс.). CH3-Et); 1,00 (3Н, с, 1-СН3); 1,00-1,80 (7Н, м, CH2c) Гідрохлорид 5-етил-1,екзо-3-диметил-6Et і СН кільця); 1,46 (12Н, с, t-Bu і 5-СН3); 1,95-2,45 азабіцикло[3.2.1]октану (1-2) (2Н, м, СН кільця); 3,06 і 3,36 м.ч. (обидва 1Н, д, Одержують з виходом 30% з іміну 5-2 за про11Гц, 7-СН2). цедурою;" описаною у прикладі 1b. Безбарвна с) Гідрохлорид екзо-3-етил-1,5-диметил-6тверда речовина. азабіцикло[3.2.1]октану (1-3) 1 H ЯМР (CDCІ3, TMC) δ: 0,95-1,15 (7Η, м, СН Карбамат 9-1 (0,73г, 2,7моль) додають до розкільця, 3-СН3 і CH3-Et); 1,12 (3Н, с, 1-СН3); 1,48 чину три фтороцтової кислоти (3мл) у дихлормета(1Н, д, 13,6Гц, 8-СН); 1,55-1,76 (3Н, м, СН кільця і ні (15мл) і суміш перемішують при кімнатній темCH2-Et); 1,84-2,04 (2Н, м, СН кільця) і 2,04-2,28 пературі протягом 10 годин. Розчин упарюють при (2Н, м, 4,8-СН); 3,14 (2Н, м, 7-СН2) і 9,40 м.ч. зниженому тиску і залишок обробляють 10% вод(2H,yш.c,NH2+). ним NaOH (5мл) та екстрагують діетиловим ефіd) 5-Етил-1,екзо-3-диметил-6ром. Екстракт промивають насиченим водним азабщикло[3.2.1]окт-6-ен (5-2) NaCl і сушать над NaOH. Відфільтрований розчин Одержаний з виходом 32% з аміну 4-2 за прообробляють сухим розчином НСl у діетиловому цедурою, описаною у прикладі 1а. Масло. ефірі. Розчинник випарюють при зниженому тиску і 1 H ЯМР (CDCІ3, TMC) δ: 0,82-0,95 (1H, м, СН залишок обробляють сухим ацетонітрилом, одеркільця); 0,91 (3Н, д, 6Гц, 3-СН3), 0,94 (3Н, т, 7,5Гц, жуючи при цьому гідрохлорид аміну 1-3 у вигляді Et-CH3); 1,15-1,75 (6Н, м, СН кільця); 1,15 (3Н, с, 1безбарвної твердої речовини (0,34г, 62%). 1 СH3); 1,71 (2Н, кв, 7,5Гц, Et-CH 2) і 7,38 м.ч. (1Н, с, H ЯМР (CDCІ3 , ТМС) δ: 0,85-2,45 (9Н, м, 2, 4, НС=). 8-СН2, 3-СН і CH2-Et); 0,90 (3Н, т, 7Гц, СН3-Et); 1,12 Приклад 3 (3Н, с, 1-СН3); 1,59 (3Н, с, 5-СН3); 3,13 (2Н, т, 6Гц, Гідрохлорид екзо-3-етил-1,5-диметил-67-СН2) і 9,55 м.ч. (2Н, уш.с, NH 2+). азабіцикло[3.2.1]октану (1-3) Приклад 4 а)трет-Бутил-транс-5-етил-1,3,3Гідрохлорид 1,3,3,5-тетраметил-6триметилциклогексилкарбамат (8-1) азабіцикло[3.2.1]октану (1-4) До розчину гідрохлориду 1,3,3-триметилa) трет-Бутил-1,3,3,5,5транс-5-етилциклогексанаміну (4-3) (1,54г, пентаметилциклогексилкарбамат (8-2) 7,5моль) у ТГФ (20мл) додають Na2CO3 (3,18г, Одержують з виходом 70% з гідрохлориду 30моль) і суміш перемішують протягом 30хв. Потім 1,3,3,5,5-пентаметил-циклогексанаміну (4-4) за її о холоджують льодяною водою, додають ди-третпроцедурою, описаною у прикладі 3а. Очищають бутилдикарбонат (1,7г, 7,65моль) і перемішування флеш-хроматографією на силікагелі (легкий петпродовжують протягом 20 годин. Додають воду і ролейний ефір-етилацетат, 20:1). Безбарвне массуміш двічі екстрагують діетиловим ефіром. Об'ло. 1 єднані екстракти промивають насиченим водним H ЯМР (CDCІ3, ТМС) δ: 0,87 (6Н, с, 3, 5NaCl, сушать над MgSO4 та упарюють. Твердий СН3екв.); 0,90-1,45 (4Н, м, 4-СН2 і 2,6-СНакс.); 1,12 залишок обробляють гексаном, фільтрують і про(6Н, с, 3,5-СН3акс.); 1,27 (3Н, с, 1-СН3); 1,42 (9Н, с, tмивають гексаном, одержуючи при цьому карбаBu); 2,24 (2Н, д, 15Гц, 2,6-СНекв.) і 4,30 м.ч. (1Н, мат 8-1. Додаткову кількість 8-1 виділяють після уш.с, NH). того, як фільтрат упарюють і обробляють ацетоніb) трет-Бутил-1,3,3,5-тетраметил-6трилом. Карбамат 8-1 (1,18г, 57%) одержують у азабіцикло[3.2.1]октан-6-карбоксилат (9-2) вигляді безбарвної твердої речовини з т.пл. 70Одержують з виходом 48% з карбамату 8-2 за 71°С. процедурою, описаною у прикладі 3b. Безбарвне 1 H ЯМР (CDCІ3, TMC) δ: 0,65-1,65 (7Н, м, CH2масло. 1 Et і СН кільця); 0,88 (3Н, т, 6,5Гц, СНз-Et); 0,88 і H ЯМР (CDCІ3, ТМС) δ: 0,91, 0,94 і 0,99 (зага0,99 (обидва 3Н, с, 3,3-СН3); 1,42 (9Н, с, t-Bu); 1,85 льний 9Н, всі с, 1,3,3-СН3); 0,80-1,75 (5Н, м, СН (1Н, д кв, 13,5 і 2,5Гц, 6-СНекв.); 2,24 (1H, д, 14Гц, кільця); 1,34 і 1,52 (загальний 3Н, обидва с, 5-СН3); 2-СНекв.) і 4,30 м.ч. (1Н, уш.с, NH). 1,41 і 1,44 (загальний 9Н, обидва с, t-Bu); 1,91 і b) трет-Бутил-екзо-3-етил-1,5-диметил-62,09 (загальний 1Н, обидва д, 14,5Гц, 6-СН); 3,00 і азабіцикло[3.2.1]октан-6-карбоксилат(9-1) 3,28 (один ротамер); і 3,03 і 3,33 (інший ротамер; До суміші карбамату 8-1 (1,05г, 3,85моль) та загальний 2Н, всі дд, 11 і 2Гц, 7-СН2). 19 77778 20 с) Гідрохлорид 1,3,3,5-тетраметил-6b) Гідрохлорид 5-етил-1,3,3-триметил-6азабіцикло[3.2.1]октану (1-4) азабіцикло[3.2.1]октану (1-6) Одержують з виходом 68% з карбамату 9-2 за Одержують звиходом 33% з іміну 5-3 за пропроцедурою, описаною у прикладі 3с. Безбарвна цедурою, описаною у прикладі 1b. Безбарвна тветверда речовина. рда речовина. 1 1 Н ЯМР (CDCІ3, ТМС) δ: 1,00, 1,13 і 1,29 (загаH ЯМР (CDCІ3, ТМС) δ: 1,01 (3Н, с, 3-СН3); льний 9Н, с, 1,3,3-СН3); 1,25-1,65 (4Н, м, 2-СН2 і 1,03 (3Н, т, 7,5Гц, CH3-Et); 1.13 і 1,31 (обидва 3Н, 4,8-СН); 1,64 (3Н, с, 5-СН3); 1,81 (1Н, дт, 12,4 і с, 1,3-СН3); 1,25-1,35 (1Н, м, СН кільця); 1,35-1,65 2,3Гц, 4-СН); 2,21 (1H, д, 14,5Гц, 8-СН); 3,10-3,40 (4Н, м, CH2-Et і СН кільця); 1,69 (1Н, д, 12Гц, 2(2Н, м, 7-СН2); 9,10 і 9,90 м.ч. (загальний 2Н, обиСН); 1,92-2,12 (2Н, м, 4,8-СН); 3,05-3,45 (2Н, м, 7два уш.с, ΝΗ2+). СН2); 9,05 і 9,65 м.ч. (обидва 1H, уш.с, NH 2+). Приклад 5 Приклад 7 Гідрохлорид 1,3,3,5,6-пентаметил-6Гідрохлорид 1,екзо-3,5-екзо,ендо-7азабіцикло[3.2.1]октану (1-5) тетраметил-6-азабіцикло[3.2.1]октану (1-7) a) Метил-1,3,3,5-тетраметил-6а) трет-Бутил-цис-3-етил-1,3,транс-5азабіцикло[3.2.1]октан-6-карбоксилат (11) триметилциклогексилкарбамат (8-3) Одержують з виходом 50% з метил-1,3,3,5,5Одержують з виходом 81% з гідрохлориду пентаметилциклогексил-карбамату (10) за проце1,3,5-триметил-цис-3-етилциклогексанаміну (4-6) дурою, описаною у прикладі 3b. Безбарвне масло. за процедурою, описаною у прикладі 3а. Очища1 H ЯМР (CDCІ3, ТМС) δ: 0,87 і 0,96 (загальний ють флеш-хроматографією на силікагелі (легкий 9Н, обидва с, 1,3,3-СН3); 1,00-1,70 (4Н, м, 2-СН2 і петролейний ефір-етилацетат, 20:1). Безбарвне 4,8-СН); 1,33 і 1,46 (загальний 3Н, обидва с, 1масло. 1 СН3); 1,70-1,20 (2Н, м, 4,8-СН); 3,04 і 3,34 (основНЯМР (CDCІ3, ТМС) δ: 0,63 (1Н, д, 12,5Гц, СН ний ротамер) і 3,10 і 3,39 (неосновний ротамер; кільця); 0,70-0,90 (1Н, м, СН кільця); 0,79 (3Н, т, загальний 2Н, всі дд, 11,5 і 1,5Гц, 7-СН2); 3,59 (ос7,5Гц, CH3-Et); 0,86 (3Н, д, 6,4Гц, 5-СН3); 1,28 (3Н, новний) і 3,64 (загальний 3Н, обидва с, ОСН3). с, 3-СН3); 1,25-1,85 (6Н, м, СН кільця і CH2-Et); 1,41 b) Гідрохлорид 1,3,3,5,6-пентаметил-6(9Н, с, t-Bu); 1,52 (3Н, с, 1-СН3); 2,35 (1Н, д, 12,5Гц, азабіцикло[3.2.1]октану (1-5) 2-СН) і 4,31 м.ч. (1Н, уш.с, NH). Розчин карбамату 11 (1,0г, 4,44моль) у діетиb) тгрет-Бутил-1,екзо-3,5,екзо,ендо-7ловому ефірі (10мл) додають до суспензії літійатетраметил-6-азабіцикло[3.2.1]октан-6люмінійгідриду (0,34г, 9моль) у діетиловому ефірі карбоксилат (9-3) (25мл). Суміш перемішують протягом 20 годин при Одержують з виходом 57% з карбамату 8-3 за кімнатній температурі. Потім її охолоджують льопроцедурою, описаною у прикладі 3b. Безбарвне дяною водою і обережно гасять 10% водним масло. 1 NaOH. Органічну фаз у відділяють і водну фазу H ЯМР (CDCІ3, ТМС) δ: 0,60-1,85 (6Н, м, СН екстрагують діетиловим ефіром. Об'єднані органікільця); 0,85-1,15 (6Н, м, 1,3-СН3); 1,35-1,55 (6Н, м, чні фази промивають насиченим водним NaCl і 5,7-СН3); 1,45 (9Н, с, t-Bu); 2,06 і 2,27 (загальний сушать над NaOH. Відфільтрований розчин обро1Н, м, СН кільця); 3,36 і 3,51 м.ч. (загальний 1H, м, бляють надмірною кількістю сухого розчину НСl у 7-СН). діетиловому ефірі. Розчинник випарюють при зниc) Гідрохлорид 1,екзо-3,5,екзо,ендо-7женому тиску і залишок обробляють сухим ацетотетраметил-6-азабіцикло[3.2.1]октану (1-7) нітрилом і діетиловим ефіром (2:1) та охолоджуОдержують з виходом 70% з карбамату 9-3 за ють у холодильнику протягом 24 годин. Осад процедурою, описаною у прикладі 3с. Безбарвна відфільтровують і промивають діетиловим ефіром, тверда речовина. 1 одержуючи при цьому гідрохлорид аміну 1-5 (0,25г, H ЯМР (CDCІ3, ТМС) δ: 0,96 (3Н, д, 5,8Гц, 326%) у вигляді безбарвної твердої речовини. СН3); 1,00 (3Н, с, 1-СН3); 1,00-1,15 (1H, м, 2-СН); 1 Н ЯМР (CDCІ3, ТМС) δ: 1,03, 1,09, 1,16 і 1,22 1,36 (1Н, д, 12Гц, 8-СН); 1,43 (3Н, д, 7,4Гц, 7-СН3); (загальний 9Н, всі с 1, 3,3-СН3); 1,44 (3Н, с, 5-СН3); 1,55-1,75 (2Н, м, 2-СН і 4-СН); 1,62 (3Н, с, 5-СН3); 1,50-2,50 (6Н, м, 2, 4, 8-СН2); 2,73 (д, 5Гц) і 2,80 1,90 (1H, д, 12,6Гц, 8-СН); 2,15-2,35 (2Н. м, 3-СН і (загальний 3Н, д, 5,5Гц, N-CH 3); 2,55 (м) і 2,94 (за4-СН); 3,65 (1Н, м, 7-СН); 9,00 і 9,95 м.ч. (загальгальний 1Н, дд, 12 і 6Гц, 7-СН); 3,73 (дд, 12 і 8,5Гц) ний 2Н, обидва уш.с, ΝΗ2+). і 4,07 (загальний 1Н, дд, 13 і 7Гц, 7-СН); 9,50 і Приклад 8 10,80 м.ч. (загальний Ш, уш.с, NH2+). Гідрохлорид 1,екзо-3,5-триметил-екзо,ендо-7Приклад 6 феніл-6-азабіцикло[3.2.1]октану (1-8) Гідрохлорид 5-етил-1,3,3-триметил-6а) 3-Бензил-3,5-диметилциклогексанон (13) азабіцикло[3.2.1]октану (1-6) До охолодженого (-20°С) 1Μ розчину бензилa) 5-Етил-1,3,3-триметил-6магнійброміду у діетиловому ефірі (50мл) в атмоазабіцикло[3.2.1]окт-6-ен (5-3) сфері аргону додають CuCl (0,52г, 5,3моль) і суміш Одержують з виходом 28% з 1-етил-3,3,5,5перемішують протягом 5хв. Потім по краплях дотетраметилциклогексанаміну (4-5) за процедурою, дають розчин 3,5-диметил-2-циклогексен-1-ону описаною у прикладі 1а. Масло. (12) (4,4г, 35,1моль) у діетиловому ефірі (15мл), 1 H ЯМР (CDCІ3, ТМС) δ: 0,93 (3Н, с, 3-СН3); підтримуючи при цьому температуру нижче -10°С. 0,94 (3Н, т, 7,4Гц, Et-CH 3); 0,98 (3Н, с, 3-СН3); 1,15 Суміш перемішують протягом 2 годин і гасять 10% (3Н, с, 1-СН3); 1,20-1,50 (5Н, м, СН кільця); 1,57 водною оцтовою кислотою (40мл). Органічний шар (1Н, дт, 12,4 і 2Гц, СН кільця); 1,69 (2Н, д кв, 7,5 і відділяють, промивають водою, насиченим водним 2,8Гц, Et-CH 2) і 7,47 м.ч. (1H, с, НС=). NaHCO3 і насиченим водним NaCl і сушать над 21 77778 22 MgSO4 . Фільтрування і концентрування у вакуумі лишок обробляють сухим діетиловим ефіром, дає маслянистий залишок, який розділяють флешодержуючи при цьому гідрохлорид аміну 4-7 (0,33г, хроматографією на силікагелі (легкий петролейний 35%) у вигляді безбарвної твердої речовини. 1 ефір-етилацетат, 10:1). Циклогексанон 13 (4,0г, H ЯМР (CDCІ3, ТМС) δ: 0,68 (3Н, д, 6,5Гц, 553%) одержують у вигляді безбарвного масла. СН3); 0,70-1,30 (3Н, м, СН кільця); 0,73 (3Н, с, 31 Н ЯМР (CDCІ3, ТМС) δ: 0,92 (3Н, с, 3-СН3); СН3); 1,28 (3Н, с, 1-СН3); 1,50 (1Н, д, 15,4Гц, СН 1,06 (3Н, д, 6Гц, 5-СН3), 1,10-2,45 (7Н, м, СН кількільця); 1,60-1,85 (1Н, м, СН кільця); 2,05 (1Н, д, ця); 2,42 і 2,56 (загальний 2Н, обидва д, 13Гц, 16Гц, СН кільця); 2,15-2,50 (1Н, м, 5-СН); 2,47 і CH2Ph) і 7,05-7,35 м.ч. (5Н, м, Ph). 3,33 (обидва 1H, д, 12,8Гц, CH2Ph); 7,00-7,35 (5Н, b) цис-3-Бензил-1,3,транс-5м, СН арилу) і 8,42 м.ч. (3Н, уш.с, NH3+). триметилциклогексанол (14) e) 1,екзо-3,5-Триметил-7-феніл-6Розчин кетону 13 (3,9г, 18,1моль) у діетиловоазабіцикло[3.2.1]окт-6-ен (5-4) му ефірі (10мл) додають по краплях до 1Μ Me Mgl Одержують з виходом 40% з вільного аміну 4у діетиловому ефірі (40мл) Суміш перемішують 7 за процедурою, описаною у прикладі 1а. Масло. 1 протягом 1 години при кімнатній температурі. ЕфіН ЯМР (CDCІ3, ТМС) δ: 0,94 (3Н, д, 6,6Гц, 3рний екстракт, одержаний після традиційної оброСН3); 0,90-1,15 (2Н, м, СН кільця); 1,26 (3Н, с, 1бки продукту реакції Гріньяра, сушать над Na 2SO4, СН3); 1,30-1,90 (5Н, м, СН кільця); 1,43 (3Н, с, 5фільтрують та упарюють, одержуючи при цьому СН3) і 7,30-7,65 м.ч. (5Н, м, СН арилу). маслянистий залишок, який очищають флешf) Гідрохлорид 1,екзо-3,5-триметил-екзо,ендохроматографією на силікагелі (легкий петролейний 7-феніл-6-азабіцикло[3.2,1] октану (1-8) ефір-етилацетат). Циклогексанол 14 (3,2г, 76%) Одержують з виходом 33% з іміну 5-4 за проодержують у вигляді безбарвного масла. цедурою, описаною у прикладі 1b. Безбарвна тве1 Н ЯМР (CDCІ3, ТМС) δ: 0,75 (3Н, с, 3-СН3); рда речовина. 1 0,95-1,25 (3Н, м, СН кільця); 0,92 (3Н, д, 6,6Гц, 5H ЯМР (CDCІ3, ТМС) δ: 0,75-1,95 (4Н, м, СН СН3), 1,23 (3Н, с, 1-СН3); 1,45-1,75 (3Н, м, СН кількільця); 0,86 (3Н, д, 5,8Гц, 3-СН3); 1,20 (3Н, с, 1ця); 2,05-2,25 (1H, м, 5-СН); 2,77 і 3,04 (обидва 1Н, СН3); 1,56 (3Н, с, 5-СН3); 1,99 (1H, д, 14,4Гц, 8-СН); д, 13Гц, CH2Ph) і 7,05-7,35 м.ч. (5Н, м, СН арилу). 2,05-2,15 (1Н, м, СН кільця); 2,20-2,30 (1H, м, СН c) N-(цис-3-Бензил-1,3,транс-5кільця); 4,57 (1H, м, 7-СН); 7,24 і 7;65 (загальний триметилциклогексил)-2-хлорацетамід (15) 5Н, обидва уш.с, Ph); 9,15 і 10,40 м.ч. (загальний Сірчану кислоту (2,1мл, 3,83г, 39моль) дода2Н, обидва уш.с, NH2+). ють по краплях до перемішуваного розчину циклоНижче наводиться загальна синтетична схема гексанолу 14 (3,0г, 13моль) і хлорацетонітрилу і таблиця для 5-азабіцикло[3.2.1]нонанів (що від(4,0г, 52моль) в оцтовій кислоті (2,1мл) при охолоносяться до структури формули 1). джуванні льодяною водою. Суміш перемішують протягом 24 годин при кімнатній температурі, потім виливають у льодяну воду (10мл). Суміш нейтралізують 20% водним NaOH і екстрагують діетиловим ефіром (3´15мл). Об'єднані органічні фази промивають насиченим водним NaCl і сушать над MgSO4 . Екстракт фільтрують і розчинник випарюють. Залишок очищають флеш-хроматографією на силікагелі при елююванні сумішшю легкого петролейного ефіру і етилацетату (10:1), одержуючи при цьому амід 15 (1,32г, 33%) у вигляді безбарвного масла. 1 H ЯМР (CDCІ3, ТМС) δ: 0,73 (3Н, с, 3-СН3); 0,90-1,40 (3Н, м, СН кільця); 0,98 (3Н, д, 6,6Гц, 5СН3), 1,42 (3Н, с, 1-СН3); 1,63 (1Н, м, СН кільця); 1,80-2,05 (1Н, м, 5-CH); 2,12 (1Н, д кв, 13,8 і 3Гц, 6СН); 2,33 (1H, д, 12,7Гц, CH2Ph); 2,51 (1H, дт, 15 і 2,2Гц, 2-СН); 3,17 (1H, д, 12,7Гц, CH2Ph); 3,95 і 3,96 (загальний 2Н, обидва с, СН2СО); 6,52 (1Н, уш.с, NH) і 7,00-7,35 м.ч. (5Н, м, СН арилу). Таблиця 2 d) Гідрохлорид цис-3-бензил-1,3,транс-56-Азабі цик ло[3.3.1]нонан 1-9 триметилциклогексанаміну (4-7) Розчин аміду 15 (0,62г, 2моль) і тіосечовини Номер Номер при 1 2 3 4 5 R R R R R R Υ n MZR описі синтезу (0,18г, 2,4моль) у суміші етанолу (5мл) і оцтової 2046 1-9 Η Me Me Η Me Η СН I кислоти (1мл) кип'ятять зі зворотним холодильником протягом 10 годин. Реакційну суміш охолоПриклад 9 джують до кімнатної температури і при перемішуГідрохлорид 1,5,екзо-7-триметил-2ванні додають 20мл 10% водного NaOH. Утворену азабіцикло[3.3.1]нонану (1-9) суміш екстрагують діетиловим ефіром (3´10мл). а) 2-{цис-3-[(2-Хлорацетил)аміно]-1,3,транс-5Об'єднані екстракти промивають насиченим водтриметилциклогексил}оцтова кислота(16) ним NaCl, сушать над NaOH, фільтрують і обробДо розчину 1,5г (4,9моль) N-(цис-3-бензилляють сухим розчином НСl у діетиловому ефірі. 1,3,транс-5-триметилцикло-гексил)-2Розчинник випарюють при зниженому тиску і за 23 77778 24 хлорацетаміду (одержаний з фракції з Rf 0,7-0,8 2моль) додають до розчину лактаму 18 (0,07г, (гексани-ЕtOАс, 2:1), виділеної після синтезу спо0,385моль) у тетрагідрофурані (2мл) і кип'ятять зі луки 15, приклад 8с) у суміші ацетонітрилу (16мл), зворотним холодильником протягом 15 годин. Сутетрахлорметану (16мл) і води (23мл) додають міш охолоджують до кімнатної температури і робперіодат натрію (10,5г, 49моль) та діоксид рутенію лять кислотною додаванням конц. водної НСl. (7мг, 0,06моль). Суміш перемішують при кімнатній Розчинники випарюють при зниженому тиску і до температурі протягом 72 годин, потім її фільтрузалишку додають гексан (10мл) і 20% водний ють і корж на фільтрі промивають дихлорметаном. NaOH (10мл). Органічну фазу відділяють і водну Органічну фазу фільтрату відділяють і водну фазу фазу екстрагують гексаном (2´5мл). Об'єднані екстрагують дихлорметаном. Об'єднані органічні органічні фази промивають насиченим водним фази сушать над СаСl2, фільтрують та упарюють. NaCl (10мл) і сушать над NaOH. Екстракт фільтЗалишок очищають флеш-хроматографією на сирують і додають розчин сухого НСl у діетиловому лікагелі при елююванні хлороформом, одержуючи ефірі. Розчинник випарюють і залишок обробляпри цьому кислоту 16 (0,55г, 41%) у вигляді масла. ють діетиловим ефіром (5мл). Осад збирають на 1 Н ЯМР (ДМСО-d6 , ТМС) δ: 0,8-2,6 (7Н, м, СН фільтрі, одержуючи при цьому гідрохлорид аміну кільця); 0,84 і 0,85 (загальний 3Н, д, 6Гц, 5-СН3); 1-9 (0,02г, 25%) у вигляді безбарвної твердої ре0,92 і 1,01 (загальний 3Н, с, 1-СН3); 1,21 і 1,22 (зачовини. 1 гальний 3Н, с 3-СН3); 2,19 і 2,39 (загальний 2Н, Н ЯМР (CDCІ3, ТМС) 5: 0,80-1,85 (7Н, м, СН обидва д, 13,5Гц, СН2СО); 3,97 м.ч. (2Н. с, СН2Сl); кільця); 0,88 (3Н, д, 6,5Гц, 7-СН3); 0,96 (3Н, с, 57,57 і 7,70 (загальний 1H, обидва уш.с, ΝΗ) і 12,05 СН3); 1,50 (3Н, с, 1-СН3); 2,10-2,40 (2Н, м, 7-СН і 8м.ч. (1Н, уш.с, СООН). СН); 3,15-3,35 і 3,30-3,55 (обидва 1Н, м, 3-СН2); b) Етил-2-{цис-3-[(2-хлорацетил)аміно]9,15 і 9,55 м.ч. (обидва 1Н, уш.с, ΝΗ2+). 1,3,транс-5-триметилциклогексил} ацетат (17) Нижче наводиться загальна синтетична схема Тіонілхлорид (0,73мл, 10моль) додають по і таблиця для 1-азаспіросполук (що відносяться до краплях до розчину кислоти 16 (0,55г, 1,99моль) у структури формули 3). сухому етанолі (5мл) при охолоджуванні льодяною водою. Утворений розчин перемішують протягом 15 годин при кімнатній температурі, потім упарюють при зниженому тиску. Залишок очищають флеш-хроматографією на силікагелі при елююванні сумішшю легкого петролейного ефіру та етилацетату (6:1), одержуючи при цьому етиловий складний ефір 17 (0,32г, 54%) у вигляді масла. 1 Н ЯМР (CDCІ3, ТМС) δ: 0,7-1,6 (4Н, м, СН кільця); 0,88-0,94 (3Н, м, 5-СН3); 1,04 і 1,14 (загальний 3Н, с, 1-СН3); 1,25 (2Н, т, 7Гц, СН3-етил); 1,35 і 1,36 (загальний 3Н, с, 3-СН3); 1,6-1,8 (1Н, м, 5-СН); 2,05-2,35 (2Н, м, СН кільця); 2.16 і 2,79 (загальний 2Н, д, 13Гц, СН2СО); 3,92 і 3,95 (загальний 2Н, с, Таблиця 3 СН2Сl); 4,12 (2Н. кв, 7Гц, СН2О); 6,42 і 7,28 м.ч. (загальний 1Н, уш.с, NH). Номер Номер 1 2 3 4 5 R R R R R R Υ n при описі c) 1,5,екзо-7-Триметил-2MZR синтезу азабіцикло[3.3.1]нонан-3-он (18) 2/1004 3-1 -(CH 2)3- (m=0) Me Me Me Η CH 2 Розчин етилового складного ефіру 17 (0,32г, 2/1013 3-2 -(CH 2)4- (m=1) Me Me Me Η СH 2 1,07моль) і тіосечовини (0,098г, 1,3моль) у суміші етанолу (5мл) і оцтової кислоти (1,2мл) кип'ятять зі Приклад 10 зворотним холодильником протягом 20 годин. РеГідрохлорид 7,7,9,9-тетраметил-1акційну суміш охолоджують до кімнатної темпераазаспіро[4.5]декану (3-1) тури і розчинники випарюють. Додають 10% вода) 3,3,5,5-Тетраметил-1-(2ний NaOH і суміш екстрагують хлороформом фенілетил)циклогексанол (20-1) (3´10мл). Об'єднані органічні екстракти сушать Розчин 3,3,5,5-пентаметилциклогексанону (19) над СаСl2, фільтрують та упарюють. Залишок (1,54г, 10моль) у діетиловому ефірі (10мл) додаочищають флеш-хроматографією на силікагелі ють до 0,85Μ розчину фенілетилмагнійброміду у при елююванні сумішшю легкого петролейного діетиловому ефірі (25мл, 20моль) при охолоджуефіру і етилацетату (6:1, 3:1). Фракцію з Rf 0,4 (геванні льодяною банею. Утворену суміш переміксан-ЕtOАс, 2:1) збирають, одержуючи при цьому шують протягом 0,5 години і обережно додають лактам 18 (0,12г, 39%) у вигляді безбарвної твернасичений водний NH 4Cl (30мл). Органічну фазу дої речовини з т.пл. 176-177°С. відділяють і водну фазу промивають діетиловим 1 H ЯМР (СОСІ3, ТМС) δ: 0,89 (3Н, д, 5,8Гц, 7ефіром (2´20мл). Об'єднані органічні фази промиСН3); 0,75-1,05 (3Н, м, СН кільця); 0,99 (3Н, с, 5вають насиченим водним розчином NaCl (20мл) і СН3); 1,20 (3Н, с, 1-СН3); 1,24-1,36 (1Н, м, СН кільсушать над MgSO4. Фільтрування та упарювання ця); 1,45-1,60 (2Н, м, СН кільця); 1,60-1,84 (1H, м, розчину дає залишок, який очищають флеш7-СН); 2,14 (2Н, с, 4-СН2) і 5,40 м.ч. (1H, уш.с, ΝΗ). хроматографією на силікагелі при елююванні суd) Гідрохлорид 1,5,7-триметил-2мішшю легкого петролейного ефіру та етилацетаазабіцикло[3.3.1]нонану (1-9) ту (10:1), одержуючи при цьому циклогексанол 201Μ Розчин борану у тетрагідрофурані (2мл, 1 (2,1г, 82%) у вигляді масла. 25 77778 26 H ЯМР (CDCІ3, ТМС) δ: 0,91 (6Н, с, 3,5-СН3); 20-2 за процедурою, описаною у прикладі 8с. Без1,23 (6Н, с, 3,5-СН3); 1,0-1,6 (7Н, м, кільце протона барвна тверда речовина з т.пл. 83-85°С. 1 і ОН); 1,6-1,8 (2Н, м, РhСН2CH2); 2,6-2,8 (2Н, м, H ЯМР (CDCІ3, ТМС) δ: 0,89 (6Н, с, 3,5-СН3); PhCH2CH2) і 7,0-7,4 м.ч., (5Н, м, Ph). 1,13 (6Н, с, 3,5-СН3); 0,9-1,9 (8Н, м, 4-СН2, 2,6-СН і b) 2-Хлор-N-[3,3,5,5-тетраметил-1-(2РhСН2СН2СН2); 2,15 (2Н, д, 14,5Гц, 2,6-СН); 2,56 фенілетил)циклогексил]ацетамід (21-1) (2Н, т, 8Гц, PhCH2CH2CH2); 3,93 (2Н, с, СН2Сl); 6,5 Одержують з виходом 96% з циклогексанолу (1H, уш.с, NH) і 7,1-7,4 м.ч., (5Н, м, Ph). 20-1 за процедурою, описаною у прикладі 8с. Безc) 4-{1-[(2-Хлорацетил)аміно]-3,3,5,5барвне масло. тетраметилциклогексил}бутанова кислота (22-2) 1 H ЯМР (CDCІ3, ТМС) 5: 0,93 (6Н, с, 3,5-СН3); Одержують з виходом 74% з аміду 21-2 за 1,17 (6Н, с, 3,5-СН3); 1,0-1,5 (4Н, м, 4-СН2, 2,6-СН); процедурою, описаною у прикладі 9а. Безбарвна 2,0-2,2 (2Н, м, PhCH2CH2; 2,24 (2Н, д, 14Гц, 2,6тверда речовина з т.пл. 140-141°С. 1 СН); 2,5-2,6 (2Н, м, PhCH 2CH2); 3,90 (2Н, с, СН2Сl); H ЯМР (CDCІ3, ТМС) δ: 0,91 (6Н, с, 3,5-СН3); 6,60 (1Н, уш.с, NH) і 7,1-7,3 м.ч. (5Н. м, Ph). 1,15 (6Н, с, 3,5-СН3); 0,9-1,8 (8Н, м, 4-СН2, 2,6-СН, c) 3-І 1-[(2-Хлорацетил)аміно]-3,3,5,5ОССН2СН2СН2); 2,17 (2Н, д, 14,2Гц, 2,6-СН); 2,33 тетраметилциклогексил} пропанова кислота(22-1) (2Н, т, 7,2Гц, ОССН2СН2СН2); 3,97 (2Н, с, СН2Сl) і Одержують з виходом 53% з аміду 21-1 за 6,6 м.ч. (1Н, уш.с, ΝΗ). процедурою, описаною у прикладі 9а. Безбарвні d) Етил-4-{1-[(2-хлорацетил)аміно]-3,3,5,5кристали з т.пл. 130-131°С. тетраметилциклогексил}бутаноат (23-2) 1 H ЯМР (CDCІ3, ТМС) δ: 0,92 (6Н, с, 3,5-СН3); Одержують з виходом 98% з кислоти 22-2 за 1,17 (6Н, с, 3,5-СН3); 1,0-1,5 (4Н, м, 4-СН2, 2,6-СН); процедурою, описаною у прикладі 9b. Безбарвне 2,0-2,4 (6Н, м, ОССН2СН2, 2,6-СН); 3,97 (2Н, с, масло. 1 СН2Сl) і 6,6 м.ч. (1Н, уш.с, ΝΗ). H ЯМР (CDCІ3, ТМС) δ: 0,91 (6Н, с, 3,5-СН3); d) Етил-3-{1-[(2-хлорацетил)аміно1-3,3,5,51,14 (6Н, с, 3,5-СН3); 1,25 (3H, т, 7Гц, СН3СН2О); тетраметилциклогексил}пропаноат (23-1) 0,9-1,8 (4Н, м, 4-СН2, 2,6-СН, ОССН2СН2СН2); 2,18 Одержують з виходом 82% з кислоти 22-1 за (2Н, д, 15Гц, 2,6-СН); 2,26 (2Н, т, 8,4Гц, процедурою, описаною у прикладі 9b. Масло. ОССН2СН2СН2); 3,95 (2Н, с, СН2Сl); 4,13 (2Н, кв, 1 НЯМР (CDCІ3, ТМС) δ: 0,91 (6Н, с, 3,5-СН3); 7Гц, СН3СН2О) і 6,52 м.ч. (1H, уш.с, NH). 1,14 (6Н, с, 3,5-СН3); 1,25 (3Н, т, 7Гц, СН3СН2О); e) 8,8,10,10-Тетраметил-10,8-1,6 (4Н, м, 4-СН2, 2,6-СН); 2,0-2,4 (6Н, м, азаспіро[5.5]ундекан-2-он (24-2) ОССН2СН2, 2,6-СН); 3,95 (2Н, с, СН2Сl); 4,11 (2Н, Одержують з виходом 76% зі складного ефіру кв, 7Гц, СН3СН2О) і 6,50 м.ч. (1H, уш.с, ΝΗ). 23-2 за процедурою, описаною у прикладі 9с. Безe) 7,7,9,9-Тетраметил-1-азаспіро[4,5]декан-2барвна тверда речовина з т.пл. 126-128°С. 1 он (24-1) НЯМР (CDCІ3, ТМС) δ: 1,01 (6Н, с, 8,10-СН3); Одержують з виходом 54% зі складного ефіру 1,09 (6Н, с, 8,10-СН3); 1,19 і 1,30 (обидва 1Н, д, 23-1 за процедурою, описаною у прикладі 9с. Без14Гц, 9-СН2); 1,39 і 1,46 (обидва 2Н, д, 14Гц, 7,11барвна тверда речовина з т.пл.158-160°С. СН2); 1,63-1,90 (4Н, м, 4,5-СН2); 2,33 (2Н, т, 6Гц, 31 H ЯМР (CDCІ3, ТМС) δ: 1,01 (12Н, с, 7,9-СН3); СН2) і 5,8 м.ч. (1H, уш.с, ΝΗ). 1,19 (1Н, д, 14Гц, 8-СН); 1,27 (1Н, д, 14Гц, 8-СН); f) Гідрохлорид 8,8,10,10-тетраметил-11,45 (4Н, с, 6,10-СН2); 2,02 (2Н, т, 7,5Гц, 4-СН2); азаспіро[5.5]ундекану (3-2) 2,36 (2Н, т, 7,5Гц, 3-СН2) і 5,8 м.ч. (1H, уш.с, ΝΗ). Одержують з виходом 45% зі спіролактаму 24f) Гідрохлорид 7,7,9,9-тетраметил-12 за процедурою, описаною у прикладі 9d. Безбаразаспіро[4.5]декану (3-1) вна тверда речовина. 1 Одержують з виходом 76% зі спіролактаму 24Н ЯМР (CDCІ3, ТМС) δ: 1,01 (6Н, с, 8,10-СН3); 1 за процедурою, описаною у прикладі 9d. Безбар1,09 (6Н, с, 8,10-СН3); 1,0-2,1 (12Н, м, 3,4,5,7,9,11вна тверда речовина. СН2); 3,1 (2Н, уш.с, 2-СН2) і 9,1 м.ч. (2Н, уш.с, 1 H ЯМР (CDCІ3, ТМС) δ: 1,01 (6Н, с, 7,9-СН3); ΝΗ2+). 1,08 (6Н, с, 7,9-СН3); 1,23 (1Н. д, 14Гц, 8-СН); 1,35 Нижче наводиться загальна синтетична схема (1Н, д, 14Гц, 8-СН); 1,8 (4Н, уш.с, 6,10-СН2); 2,0-2,2 і таблиця для 6-азатрицикло[6.3.1.01,6] додеканів (4Н,-м, 3,4-СН2); 3,3 (2Н, уш.с, 2-СН2) і 9,4 м.ч. (2Н, (що відносяться до структури формули 2). уш.с, ΝΗ2+). Приклад 11 Гідрохлорид 8,8,10,10-тетраметил-1азаспіро[5.5]ундекану (3-2) a) 3,3,5,5-Тетраметил-1-(3фенілпропіл)циклогексанол (20-2) Одержують з виходом 90% з кетону 19 за процедурою, описаною у прикладі 10а. Безбарвне масло. 1 H ЯМР (CDCІ3, ТМС) δ: 0,86 (6Н, с, 3,5-СН3); 1,19 (6Н, с, 3,5-СН3); 1,0-1,8 (11Н, м, кільце протону, ОН і РhСН2CH2СН2); 2,60 (2Н, т, 7,5Гц, PhCH2CH2CH2) і 7,1-7,4 м.ч. (5Н, м, Ph). b) 2-Хлор-N-[3,3,5,5-тетраметил-1-(3фенілпропіл)циклогексил]ацетамід (21-2) Одержують з виходом 37% з циклогексанолу 1 27 77778 Таблиця 4 Номер Номер при 1 2 3 4 5 R R R R R R Υ n MZR описі синтезу 2047 2 -(СН 2)4- (m=1) Me Me Me Η CH Приклад 12 Гідрохлорид 8,10,10-триметил-6азатрицикло[6.3.1.01,6]додекану (2) a) 8,10,10-Триметил-6азатрицикло[6.3.1.01,6]додекан-5-он (25) Одержують з виходом 20% зі спіролактаму 242 за процедурою, описаною у прикладі 3b. Масло. 1 НЯМР (CDCІ3, ТМС) δ: 0,95 (3Н, с, 10-СН3); 1,00 (3Н, с, 10-СН3); 1,08 (3Н, с 8-СН3); 1,20 (1H, д, 12Гц) і 1,25-1,70 (5Н, м, 9,11,12 СН2); 1,75-1,90 (4Н, м, 2,3-СН2); 2,25-2,40 (2Н, м, 4-СН2); 3,14 і 3,43 м.ч. (обидва 1H, д, 12,0Гц, 7-СН2). b) Гідрохлорид 8,10,10-триметил-6азатрицикло[6.3.1.01,6]додекану (2) Одержують з виходом 36% з лактаму 25 за процедурою, наведеною у прикладі 9d. Безбарвна тверда речовина. 1 H ЯМР (CDCІ3, ТМС) 5: 0,85-2,45 (12Н, м, 2,3,4,9,11,12-СН2); 0,99 (3Н, с, 10-СН3); 1,05 (3Н, с, 10-СН3); 1,19 (3Н, с, 8-СН3); 3,12 (2Н, м, 5-СН2); 3,20-3,75 (2Н, м. 7-СН2) і 9,05 м.ч. (1H, уш.с, ΝΗ+). Фармацевтичні композиції Активні інгредієнти винаходу разом з одним або декількома загальноприйнятими ад'ювантами, носіями або розріджувачами можуть бути перетворені у форму фармацевтичних композицій та їх одиничних доз і в такій формі вони можуть бути використані у твердому вигляді, такому як таблетки з покриттям або без покриття або заповнені капсули, або у вигляді рідин, таких як розчини, суспензії, емульсії, еліксири або капсули, заповнені ними, всі такі композиції та їх одиничні дози використовують для перорального введення, у формі супозиторіїв або капсул їх застосовують для ректального введення, у формі стерильних розчинів, що ін'єктуються - для парентерального (включаючи внутрішньовенне або підшкірне) введення. Такі фармацевтичні композиції та їх одиничні дозовані форми можуть містити загальноприйняті або нові інгредієнти у загальноприйнятих або спеціальних пропорціях, з додатковими активними сполуками або" інгредієнтами або без них, такі одиничні дозовані форми можуть містити будь-яку придатну ефективну кількість активного інгредієнта, пропорційну до заданої застосовуваної добової дози. Таблетки, що містять від двадцяти (20) до ста (100) міліграмів активного інгредієнта або, у більш широкому діапазоні, від десяти (10) до двохсот п'ятдесяти (250) міліграмів на таблетку, є відповідно придатними репрезентативними одиничними дозованими формами. Спосіб лікування Внаслідок їх високого ступеня активності і низької токсичності, що разом являють собою найбільш сприятливий терапевтичний індекс, активні інгредієнти винаходу можуть бути введені в ефективній кількості суб'єкту, наприклад, тварині (включаючи людину), яка потребує цього, для лікування, ослаблення або поліпшення стану, тим 28 часового полегшення або усунення симптомів або стану, сприйнятливого до них, або, відповідно, симптомів або стану, викладеного де-небудь ще для такого застосування, переважно, сумісно, одночасно, або разом з одним або декількома фармацевтично прийнятними ексципієнтами, носіями або розріджувачами, особливо і переважно, у формі їх фармацевтичної композиції, незалежно від того, чи вводять їх пероральним, ректальним або парентеральним (у тому числі внутрішньовенним або підшкірним) або у деяких випадках навіть місцевим шляхом. Придатні дози знаходяться у діапазоні 1-1000 міліграмів на день, переважно, 10500 міліграмів на день і, особливо, 50-500 міліграмів на день, в залежності, як звичайно, від визначеного способу введення, форми, в якій їх вводять, показання, для лікування якого направлено введення, суб'єкта, який піддається лікуванню, і маси тіла даного суб'єкта і того, чому віддається перевага, і кваліфікації лікаря або ветеринара. Приклади репрезентативних фармацевтичних композицій. За допомогою звичайно використовуваних розчинників, допоміжних агентів і носіїв продукти реакції можуть бути перетворені у таблетки, таблетки з покриттям, капсули, розчини для закапування, супозиторії, препарати для ін'єкції та інфузії і тому подібне і можуть бути терапевтично використані пероральним, ректальним, парентеральним і додатковими шляхами введення. Нижче наведені репрезентативні фармацевтичні композиції. (a) Таблетки, придатні для перорального введення, які містять активний інгредієнт, можуть бути Одержані загальноприйнятими способами таблетування. (b) Для супозиторіїв може бути використана звичайна основа для супозиторіїв з метою включення в неї звичайною процедурою активного інгредієнта, така як поліетиленгліколь, який є твердим при нормальній кімнатній температурі, але який плавиться при температурі тіла або близько такої температури. (с) Для парентеральних (у тому числі внутрішньовенних і підшкірних) стерильних розчинів активний інгредієнт використовують разом із загальноприйнятими інгредієнтами у звичайних кількостях, такими як, наприклад, хлорид натрію і бідистильована вода (до балансу), розчини одержують за загальноприйнятою процедурою, такою як фільтрація, асептичне наповнення в ампули або посудини для краплинного внутрішньовенного вливання і обробка в автоклаві для стерилізації. Інші придатні фармацевтичні композиції повинні бути відразу ж очевидні фа хівцеві у даній галузі. Наступні приклади знову наводяться тільки з метою ілюстрації і не повинні тлумачитися як такі, що обмежують винахід. Приклад 1 Композиція у формі таблеток Придатна композиція у формі таблетки, що містить 10 міліграмів активного інгредієнта, має наступний склад: 29 77778 Мг Активний інгредієнт 10 Лактоза 63 Мікрокристалічна целюлоза 21 Тальк 4 Стеарат магнію 1 Колоїдальний діоксид кремнію 1 Приклад 2 Композиція у формі таблеток Інша придатна композиція у формі таблетки, що містить 100мг активного інгредієнта, має наступний склад: Мг Активний інгредієнт 100 Картопляний крохмаль 20 Полівінілпіролідон 10 Плівкоподібне, забарвлене покриття, що складається з: Лактози 100 Мікрокристалічної целюлози 80 Желатину 10 Полівінілпіролідону, зшитого 10 Тальку 10 Стеарату магнію 2 Колоїдального діоксиду кремнію 3 Забарвлювальних пігментів 5 Приклад 3 Композиція у формі капсул Придатна композиція для наповнення капсули, що містить 50 міліграмів активного інгредієнта, має наступний склад: Мг Активний інгредієнт 50 Кукур удзяний крохмаль 20 Моногідрофосфат кальцію 50 Тальк 2 Колоїдальний діоксид кремнію 2 Такою композицією наповнюють желатинову капсулу. Приклад 4 Розчин для ін'єкції Придатна композиція у вигляді розчину, що ін'єктується, яка містить один процент активного інгредієнта, має наступний склад: Активний інгредієнт, мг 12 Хлорид натрію, мг 8 Стерильна вода для одержання загального об'єму, мл 1 Приклад 5 Рідка пероральна композиція Придатна композиція у вигляді 1л рідкої суміші, що містить 2 міліграми активного інгредієнта в одному мілілітрі суміші, має наступний склад: Грам Активний інгредієнт, мг 2 Сахароза 250 Глюкоза 300 Сорбіт 150 Апельсиновий коригент 10 Світлостійкий жовтий барвник Очищена вода до одержання загального об'єму 1000мл Приклад 6 Рідка пероральна композиція Інша придатна композиція у вигляді 1 літра рі 30 дкої суміші, що містить 20 міліграмів активного інгредієнта в одному мілілітрі суміші, має наступний склад: Грам Активний інгредієнт 20,00 Трагакант 7,00 Гліцерин 50,00 Сахароза 400,00 Метилпарабен 0,50 Пропілпарабен 0,05 Коригент типу чорної смородини 10,00 Розчинний червоний барвник 0,02 Очищена вода до одержання загального об'єму 1000мл Приклад 7 Рідка пероральна композиція Інша придатна композиція у вигляді 1 літра рідкої суміші, що містить 2 міліграми активного інгредієнта в одному мілілітрі суміші, має наступний склад: Грам Активний інгредієнт 2 Сахароза 400 Барвник з гіркої апельсинової шкірки 20 Барвник з солодкої апельсинової шкірки 15 Очищена вода до одержання загального об'єму 1000мл Приклад 8 Аерозольна композиція 180г аерозольного розчину містять: Грам Активний інгредієнт 10 Олеїнова кислота 5 Етанол 81 Очищена вода 9 Тетрафторетан 75 15мл розчину вміщують в алюмінієві аерозольні контейнери, що закриті дозувальним клапаном і діють під тиском 3,0 бара. Приклад 9 Композиція TDS 100г розчину містять: Грам Активний інгредієнт 10,0 Етанол 57,5 Пропіленгліколь 7,5 Диметилсульфоксид 5,0 Гідроксіетилцелюлоза 0,4 Очищена вода 19,6 1,8г розчину вміщують на ворсисту тканину, покриту клейкою фольгою, що є підкладкою. Систему закривають захисним матеріалом, який видаляють перед використанням. Приклад 10 Композиція з наночастинками 10г композиції з наночастинками полібутилціаноакрилату містять: Грам Активний інгредієнт 1,00 Полоксамер 0,10 Полібутилціаноакрилат 8,75 Маніт 0,10 Хлорид натрію 0,05 Наночастинки полібутилціаноакрилату одержують емульсійною полімеризацією у суміші вода/0,1 н НСІ/етанол як середовища для полімери 31 77778 32 зації. Наночастинки у суспензії на закінчення ліо(10 концентрацій у двох повторностях). Інкубацію філізують у вакуумі. продовжували при кімнатній температурі протягом Фармакологія - короткий виклад 120хв. (при використовуваних умовах досягали Активні інгредієнти даного винаходу та їх фарівноваги). Неспецифічне зв'язування визначали рмацевтичні композиції і спосіб лікування з їх задодаванням неміченого (+)-МК-801 (10мкМ). Інкустосуванням характеризуються унікальними корибації завершували з використанням системи фільсними і непередбачуваними властивостями, що трування Мilliроrе. Зразки двічі споліскували 4мл роблять «предмет, що розглядається, в цілому», охолодженого льодом буфера для аналізу з викоякий заявляється тут, неочевидним. Сполуки та їх ристанням фільтрів зі скляних волокон (Schleicher фармацевтичні композиції виявляють у стандарт& Schuell) при постійному вакуумі. Після відділенних загальноприйнятих надійних процедурах виня і споліскування фільтри вміщували у сцинтиляпробовування наступні цінні властивості і характеційну рідину (5мл; Ultima Gold) і радіоактивність, ристики. що залишилася на фільтрах, визначали загальноВони є системно активними неконкурентними прийнятим сцинтиляційним лічильником (Hewlett антагоністами NMDA-рецептора з швидкою кінетиPackard, Liquid Scintillation Analyser). Kd [3H]-(+)кою блокування/деблокування і сильною залежнісMK-801 4,6нМ визначали аналізом Scatchard і витю від напруження, відповідно до цього, їх викорикористовували відповідно до залежності Cheng стовують при лікуванні, ослабленні або зменшенні Prussoff для обчислення афінності «витісників» як інтенсивності симптомів, тимчасовому полегшенні величини Kd. Більшість антагоністів випробовуваабо усуненні сприйнятливих станів нанесенням ли у 3-7 окремих експериментах. або введенням тварині-хазяїну для лікування шиЕкспресія підтипу рецептора NMDA і нейронрокого діапазону порушень ЦНС, які полягають у ного нікотинового рецептора в ооцитах Xenopus порушенні глутаматергічної трансмісії. Зрілих самок Xenopus laevis анестезували в Дані сполуки є також системно активними, не0,2% трикаїні на льоду протягом 15хв. перед хір урконкурентними антагоністами рецептора 5НТ3 і гічною операцією. Ооцити видаляли та інкубували нейронних нікотинових рецепторів і, відповідно до у 2мг/мл колагенази (тип II) у розчині Рінгера без цього, мають застосування при лікуванні, ослабСа2+ для ооцитів (82,5мМ NaCl, 2мМ KСl, 2мМ ленні або зменшенні інтенсивності симптомів, MgCb, 5мМ HEPES, рН7,5) протягом 30хв. при тимчасовому полегшенні або усуненні сприйняткімнатній температурі і ретельно промивали OR-2 ливих станів нанесенням або введенням тварині(100мМ NaCl, 2мМ KСl, 1мМ MgCl2, 2мМ СаСl2, хазяїну для лікування широкого діапазону пору5мМ HEPES, рН7,5). Клітинний шар фолікул, що шень ЦНС, які полягають у порушенні трансмісії залишився, видаляли ручним способом чистими серотоніну або нікотинової трансмісії. пінцетами і ооцити зберігали в OR-2. РНК розчиСпособи няли у DEPC-обробленій, стерильній дистильоваВивчення зв'язування рецепторів ній воді. РНК для субодиниці NR1a NMDA змішуСамців щурів Sprague-Dawley (200-250г) обезвали при 1:1 з РНК для субодиниці NR2A. головлювали і їх мозок швидко діставали. Кору Подібним чином РНК нейронної нікотинової a4 головного мозку розтинали і гомогенізували у 20 змішували при 1:1 з РНК для субодиниці β2. Від об'ємах охолодженої льодом 0,32Μ сахарози з п'ятдесяти до ста нанолітрів кожної суміші РНК використанням гомогенізатора зі скла і тефлону. ін'єктували у цитоплазму ооцитів з використанням Гомогенат центрифугували при 1000´g протягом нанолітрового шприца (World Precision 10хв. Осад після центрифугування вивантажували Instruments). Ооцити інкубували при 19°С в OR-2 протягом наступних 3-6 днів. і супернатант центрифугували при 20000´g протяЕлектрофізіологічні реакції одержували з вигом 20хв. Утворений осад знову суспендували у 20 користанням стандартного вольт-кламп-способу з об'ємах дистильованої води і центрифугували двома електродами (GeneClamp 500 amplifier) чепротягом 20хв. при 8000´g. Потім супернатант і рез 2-6 днів після ін'єкції. Електроди мали опір між світлий шар кров'яного згустк у центрифугували 0,2 і 0,4 ΜΩ і були заповнені 3 Μ KСl. Реєстрації при 48000´g протягом 20хв. у присутності 50мМ проводили у виготовленій на замовлення камері з трис-НСІ, рН8,0. Осад потім знову суспендували і часами обміну 2-3 секунди. Розчин бані готували центрифугували два або три рази при 48000´g без Са 2+, щоб уникнути Са2+-індукованого струму протягом 20хв. у присутності 50мМ трис-НСІ, Сl- (100мМ NaCl, 2мМ KСl, 5мМ HEPES, 2мМ рН8,0. Всі стадії центрифугування проводили при ВаСl2, рН7,35). Рецептори NMDA активували сумі4°С. Після ресуспендування у 5 об'ємах 50мМ сним нанесенням ручним способом 1мМ глутамату трис-НСІ, рН8,0, суспензію мембран швидко замоі 10мкМ гліцину протягом 30-40сек. кожні 2-3хв. на рожували при -80°С. ооцити з фіксацією напруги при -70мВ. Нейронні У день аналізу мембрани розморожували і нікотинові рецептори активували нанесенням промивали чотири рази ресуспендуванням у 50мМ 100мкМ ацетилхоліну протягом 20-30сек. кожні 2трис-НСІ, рН8,0, і центрифугували при 48000´g 3хв. на ооцити з фіксацією напруги при -70мВ. Піспротягом 20хв. і, нарешті, ресуспендували у 50мМ ля одержання стабільних контрольних реакцій трис-НСІ, рН7,4. Кількість білка у кінцевому препаодержували повні криві концентрація-реакція з раті мембран (250-500мкг/мл) визначали за спосоантагоністами за допомогою попередньої інкубації бом Lowry et al. (1951). Інкубації починали дода3 при 6-7 різних концентраціях при log 3-інтервалах. ванням [ Н]-(+)-МК-801 (23,9Кі/моль, 5нМ, Dupont Для включення у кінцевий аналіз були придатNEN) у пробірки з гліцином (10мкМ), глутаматом ні тільки результати від стабільних клітин, тобто (10мкМ) і 125-250мкг білка (загальний об'єм 0,5мл) такі, що показують, щонайменше, 50% повернення і різними концентраціями випробовуваних агентів 33 77778 34 реакцій на NDMA після видалення випробовуваномітозу цитозин-D-арабінофуранозидом (20М го антагоніста. Незважаючи на це, повернення від Sigma) після приблизно 7 днів витримування in дій лікарського засобу не завжди було 100% через vitro. Після цього середовище замінювали частконевелике зменшення або збільшення у деяких во двічі на тиждень. клітинах. У випадку присутності такий факт завжди Петч-кламп-реєстрацію даних нейронів провокомпенсувався за допомогою базування % антагодили полірованими скляними електродами (4-6м) нізму при кожній концентрації як на контролі, так і способом цілих клітин при кімнатній температурі поверненні, і допускання лінійного ходу часу для (20-22°С) за допомогою підсилювача ЕРС-7 (List). даного зниження. Всі антагоністи оцінювали при Випробовувані речовини застосовували за допоблокаді у стаціонарному стані з 6 або 7 концентмогою перемикання каналів виготовленої на замораціями, щонайменше, на 4 клітинах. Рівноважної влення системи швидкого суперзлиття зі звичайблокади досягали із застосуванням 1-3 агоністів, в ним потоком, що ви ходить (час заміни 10-20мс). залежності від концентрації антагоніста. Внутрішньоклітинний розчин мав наступний склад Кінетичні експерименти проводили за допомо(мМ): CsCl (120), ТЕАСІ (20), ЕГТУ (EGTA) (10), гою застосування різних концентрацій ненасичеMgCl2 (1), СаСl2 (0,2), глюкоза (10), АТФ (АТР) (2), них аміноалкілциклогексанів (звичайно 5 у log 3цАМФ (сАМР) (0,25); рН регулювали до 7,3 за дорежимі дозування) протягом 10-20 секунд при безпомогою CsOH або НСl. Позаклітинні розчини маперервній присутності глутамату (100мкМ) і гліцили наступний основний склад (мМ): NaCl (140), KСl ну (10мкМ) протягом 90-180 секунд в ооцитах (3), СаСl2 (0,2), глюкоза (10), HEPES (10), сахароза Xenopus, що експресують рецептори NR1a/2A. (4,5), тетродотоксин (ТТХ 3* 10-4). Гліцин (1М) був Використовувана система перфузії для ци х експеприсутнім у всі х розчинах: концентрація була дориментів була модифікованою ооцитною карусестатньою для індукування приблизно 80-85% актильною системою, яка дозволяє швидко промивати вації рецепторів гліцинув. Тільки результати від в агоністі та антагоністі або відмивати від них зі стабільних клітин були придатними для включення зміною часу менше, ніж одна секунда. Експоненту кінцевий аналіз, тобто після відновлення реакцій ний підбір проводили з використанням програми на NMDA, щонайменше, на 75% їх пригнічення TIDA для Windows і більшість реакцій добре апровипробовуваними антагоністами. ксимувалася єдиним експонентом. Таку ж систему Петч-кламп для 5-НТ3 використовували для оцінки залежного від напруКлітини ΝΙΕ-115 придбавали з Європейської ження блокування, а розчин бані, що містить флуколекції клітинних культур (ЕСАСС, Salisbury, UK) і фенамову кислоту (100мкМ), використовували для зберігали при -80°С до подальшого їх використанблокування ендогенних активованих напруженням ня. Клітини висівали при щільності 100000клітині Са2+-активованих струмів Сl-1. Крім того, Ва2+ см -2 на пластикових чашках Петрі (Falcon) і виро2+ (2мМ) замінювали низькими концентраціями Са щували на NаНСО3/НЕРЕБ-забуференому мініма(0,2мМ). Після рівноважного блокування при більш льному есенційному середовищі, доповненому високих концентраціях антагоніста (звичайно при(MEM) 15% фе тальною бичачою сироваткою близно у 10 разів вище ІС50) п'ять лінійних змін (Gibco), та інкубували при 37°С з 5% СО2 при возбуджувалося від -70 В до +30мВ протягом двох лості 95%. Середовище повністю замінювали щосекунд. Подібні зміни збуджувалися у розчинах дня. Один раз кожні три дні клітини знову засівали бані і для глутамату без антагоніста, як перед нана свіжих чашках Петрі з подальшою обробкою несенням антагоніста, так і після відновлення реасумішшю трипсин-ЕДТУ (EDTA) (1% у PBS), рекцій. Струми витоку за відсутності глутамату були суспендуванням у MEM і центрифугуванням при відняті з кривих для глутамату і для глутамату + 1000об./хв. протягом чотирьох хвилин. антагоніст. Залежність від напруження потім виПетч-кламп-реєстрації при -70мВ проводили з значали порівнянням кривих для глутамату і для клітинами, що сплили, через 2-3 дні після засіванглутамату плюс антагоніст. ня з використанням полірованих скляних електроПетч-кламп для NMDA і нікотину дів (2-6 ΜΩ) способом цілих клітин при кімнатній Гіпокампи одержували з щурячих ембріонів температурі (20-22°С) з підсилювачем ЕРС-7 (List). (Е20 і Е21) і потім переносили у вільний від кальВнутрішньоклітинний розчин мав наступний склад цію і магнію буферний сольовий розчин Ханка (мМ): CsCl (130), HEPES (10), ЕГТУ (EGTA) (10), (Gibco) на льоду. Клітини механічно дисоціювали у MgCl2 (2), СаСl2 (2), K-АТР (K-АТФ) (2), трис-ГТФ суміші 0,05% ДНКаза/0,3% овомукоїд (Sigma) з (трис-GTP) (0,2), D-глюкоза (10); рН регулювали до подальшою попередньою 8-хвилинною інкубацією 7,3 за допомогою CsOH або НСl. Позаклітинний із сумішшю 0,66% трипсин/0,1% ДНКаза (Sigma). розчин мав наступний основний склад (мМ): NaCl Дисоційовані клітини потім центрифугували при (124), KСl (2,8), HEPES (10), рН регулювали до 7,3 за допомогою NaOH або НСl. 18´ g протягом 10 хвилин, ресуспендували у мініПісля встановлення конфігурації цілих клітин мальному есенційному середовищі (Gibco) і висіклітини підіймали зі скляного субстрату і наносили вали при щільності 150000клітин×см -2 на заздалесеротонін (10мкМ), мемантин і ненасичені похідні гідь покритих полі-L-лізином (Sigma) пластикових аміноалкілциклогексану при різних концентраціях з чашках Петрі (Falcon). Клітини вирощували на використанням пристрою швидкого суперзлиття. NaНСO3/НЕРЕS-забуференному мінімальному Для впливу на підняті клітини або розчину без сеесенційному середовищі, доповненому 5% фетаротоніну, або розчину, що містить серотонін, викольною бичачою сироваткою і 5% кінською сироватристовували для нанесення двоканальну, перемікою (Gibco) та інкубували при 37°С з 5% СО2 при щуван у п'єзотранслятором піпетку. Двосекундний вологості 95%. Середовище повністю замінювали імпульс серотоніну подавали кожні 60 секунд. Пез наступним інгібуванням подальшого гліального 35 77778 36 редбачувані антагоністи розчиняли у бідистильограми Grafit (Erithacus Software, England). Величиваній воді і розчин розводили розчином бані до ну Кі для досліджень зв'язування потім визначали необхідної концентрації. Тільки результати від за Cheng і Prusoff. Наведені величини зв'язування стабільних клітин були прийнятні для включення у є середніми значеннями ± SEM (середня похибка кінцевий аналіз, тобто клітини, які виявляють, щосереднього) 3-5 визначень (кожне проводили у найменше, 50% відновлення реакцій на серотонін двох повторностях). після видалення сполук. Незважаючи на це, відно4-7 доз антагоністів випробовували у кожному влення через дії лікарських засобів не завжди буз випробувань in vivo (5-8 тварин на дозу), щоб ло 100% через зниження у деяких клітинах (
ДивитисяДодаткова інформація
Назва патенту англійськоюAzabicyclic, azatricyclic and azaspirocyclic derivatives of aminocyclohexanes as nmda, 5нт3, and nicotinic receptor antagonists
Автори англійськоюParsons Christopher Graham Raphael, Henrich Markus, Danysz Wojciech, Kalvinsh, Ivars, Jirgensons Aigars, Vanejevs Maksims
Назва патенту російськоюАзабициклические, азатрициклические и азаспироциклические производные аминоциклогексанов в качестве антагонистов рецепторов nmda, 5ht3 и никотиновых рецепторов
Автори російськоюПарсонс Кристофер Грахам Рафаэль, Хенрих Маркус, Даниш Войцех, Калвиньш Иварс, Йиргенсонс Айгарс, Ванейевс Максимс
МПК / Мітки
МПК: A61P 27/16, A61P 31/14, A61P 25/24, A61P 21/02, A61P 25/16, A61P 25/34, A61P 25/36, C07D 209/54, A61P 25/04, A61K 31/437, A61K 31/439, A61P 21/00, C07D 221/22, C07D 221/20, A61P 1/08, A61K 31/403, A61P 25/00, A61P 25/32, A61P 25/14, A61K 31/438, A61P 25/30, A61P 37/02, A61P 33/06, A61P 9/10, A61P 9/00, A61P 27/06, A61P 1/04, A61P 25/28, C07D 471/08, A61P 43/00, A61P 25/22, A61P 25/02, C07D 487/08, A61P 31/18, A61P 31/12, C07D 209/02, A61P 25/08, A61P 25/06, A61P 25/18
Мітки: nmda, нейронних, нікотинових, аміноциклогексану, азабіциклічні, рецепторів, похідні, антагоністи, азатрициклічні, азаспіроциклічні
Код посилання
<a href="https://ua.patents.su/20-77778-azabiciklichni-azatriciklichni-i-azaspirociklichni-pokhidni-aminociklogeksanu-yak-antagonisti-receptoriv-nmda-5ht-i-nejjronnikh-nikotinovikh-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Азабіциклічні, азатрициклічні і азаспіроциклічні похідні аміноциклогексану як антагоністи рецепторів nmda, 5ht і нейронних нікотинових рецепторів</a>
Попередній патент: Портативний пристрій для виміру температури в теплообмінниках
Наступний патент: Ручна косарка
Випадковий патент: Композиція для місцевого догляду за шкірою, що містить сполуки гліцерину ди- та моносаліцилату












