Похідні бензотіазинону і їх застосування як протибактеріальних агентів
Номер патенту: 93251
Опубліковано: 25.01.2011
Автори: Коул Стюарт Т., Макаров Вадім А., Мьолльманн Уте
Формула / Реферат
1. Сполука формули (І)
 (I)
(I)
або її сіль,
де R1 і R2 є, незалежно один від одного, NO2, CN, CONR7R8, COOR9, СНО, галоген, NR7R8, SO2NR7R8, SR9, OCF3, моно -, ди- або трифторметил;
R3 і R4 є, незалежно один від одного, Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, бензил, SR9, OR9;
R5 і R6 є, незалежно один від одного, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-8 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, феніл, або
R5 і R6 разом представляють бівалентний радикал -(CR92)m-, або
R5 і R6 разом представляють бівалентні радикали:
 або
або 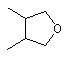 ,
,
де m є 1-4, або представляють бівалентні радикали - насичені або ненасичені моно- або полігетероцикли з гетероатомами N, S, О і заміщені (R10)x, де х є 1-4;
R7, R8 і R9 є, незалежно один від одного, Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, моно -, ди- або трифторметил, галоген, феніл;
R10 є Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, NO2, NR7R8, CN, CONR7R8, COOR9, СНО, галоген, SO2NR7R8, SR9, OR9, OCF3, моно -, ди- або трифторметил, бензил або феніл.
2. Сполука 2-(2,3-R5R6-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он формули (І) за пунктом 1, де R1 представляє NO2, R2 є CF3, R3 і R4 є Н, і R5 і R6 мають значення, наведені в пункті 1.
3. Сполука 2-(2,3-R5R6-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-4-оксо-1,3-бензотіазин-6-карбонітрил формули (І) за пунктом 1, де R1 представляє NO2, R2 є CN, R3 і R4 є Н, і R5 і R6 мають значення, наведені в пункті 1.
4. Сполука 2-(2,3-R5R6-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8-динітро-4-оксо-1,3-бензотіазин формули (І) за пунктом 1, де R1 і R2 представляють NO2, R3 і R4 є Н, і R5 і R6 мають значення, наведені в пункті 1.
5. Сполука 2-(2,3-R5R6-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-4-оксо-1,3-бензотіазин-6-карбамід формули (І) за пунктом 1, де R1 представляє NO2, R2 є CONH2, R3 і R4 є Н, і R5 і R6 мають значення, наведені в пункті 1.
6. Сполука формули (І) за пунктом 1, яку вибирають з групи що містить
2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8-динітро-1,3-бензотіазин-4-он,
2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8-динітро-1,3-бензотіазин-4-он,
2-(4,4-діетоксипіперидин-1-іл)-6,8-динітро-1,3-бензотіазин-4-он,
7-метил-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8-динітро-1,3-бензотіазин-4-он,
2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он,
2-(2,3-диметил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он,
2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он,
2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8-нітро-4-оксо-1,3-бензотіазин-6-карбонітрил,
2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-4-оксо-1,3-бензотіазин-6-карбонітрил,
8-аміно-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-4-оксо-1,3-бензотіазин-6-карбонітрил і
8-аміно-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6-(трифторметил)-1,3-бензотіазин-4-он.
7. Сполука формули (І) за пунктом 1, яку вибирають з групи, що містить сполуки, в яких R5 і R6 є алкіл.
8. Застосування сполуки формули (І) або її солі за пунктом 1 для одержання фармацевтичної композиції.
9. Сполука формули (І)
 , (I)
, (I)
де R1 і R2 є, незалежно один від одного, NO2, CN, CONR7R8, COOR9, СНО, галоген, NR7R8, SO2NR7R8, SR9, OCF3, моно -, ди- або трифторметил;
R3 і R4 є, незалежно один від одного, Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, бензил, SR9, OR9;
R5 і R6 є, незалежно один від одного, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-8 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, феніл, або
R5 і R6 разом представляють бівалентний радикал -(CR92)m-, або
R5 і R6 разом представляють бівалентні радикали:
 або
або  ,
,
де m є 1-4, або представляють бівалентні радикали - насичені або ненасичені моно- або полігетероцикли з гетероатомами N, S, О і заміщені (R10)x, де х є 1-4;
R7, R8 і R9 є, незалежно один від одного, Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, моно -, ди- або трифторметил, галоген, феніл, або
R3 і R4 разом представляють бівалентний радикал -(СН2)n-, де n є 2-7;
R10 є Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, NO2, NR7R8, CN, CONR7R8, COOR9, СНО, галоген, SO2NR7R8, SR9, OR9, OCF3, моно -, ди- або трифторметил, бензил або феніл,
для застосування в способі терапевтичного або профілактичного лікування туберкульозу або прокази у ссавців.
Текст
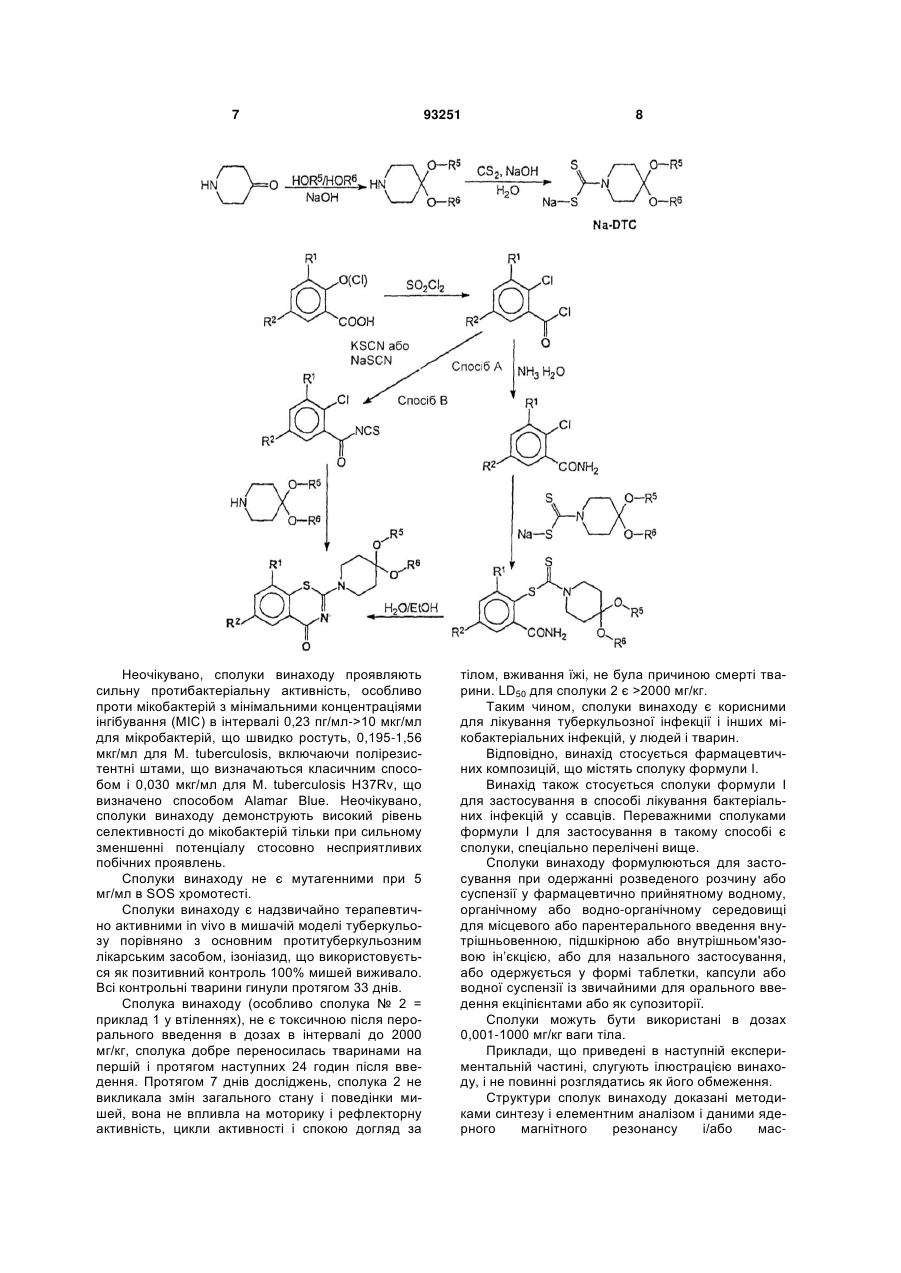
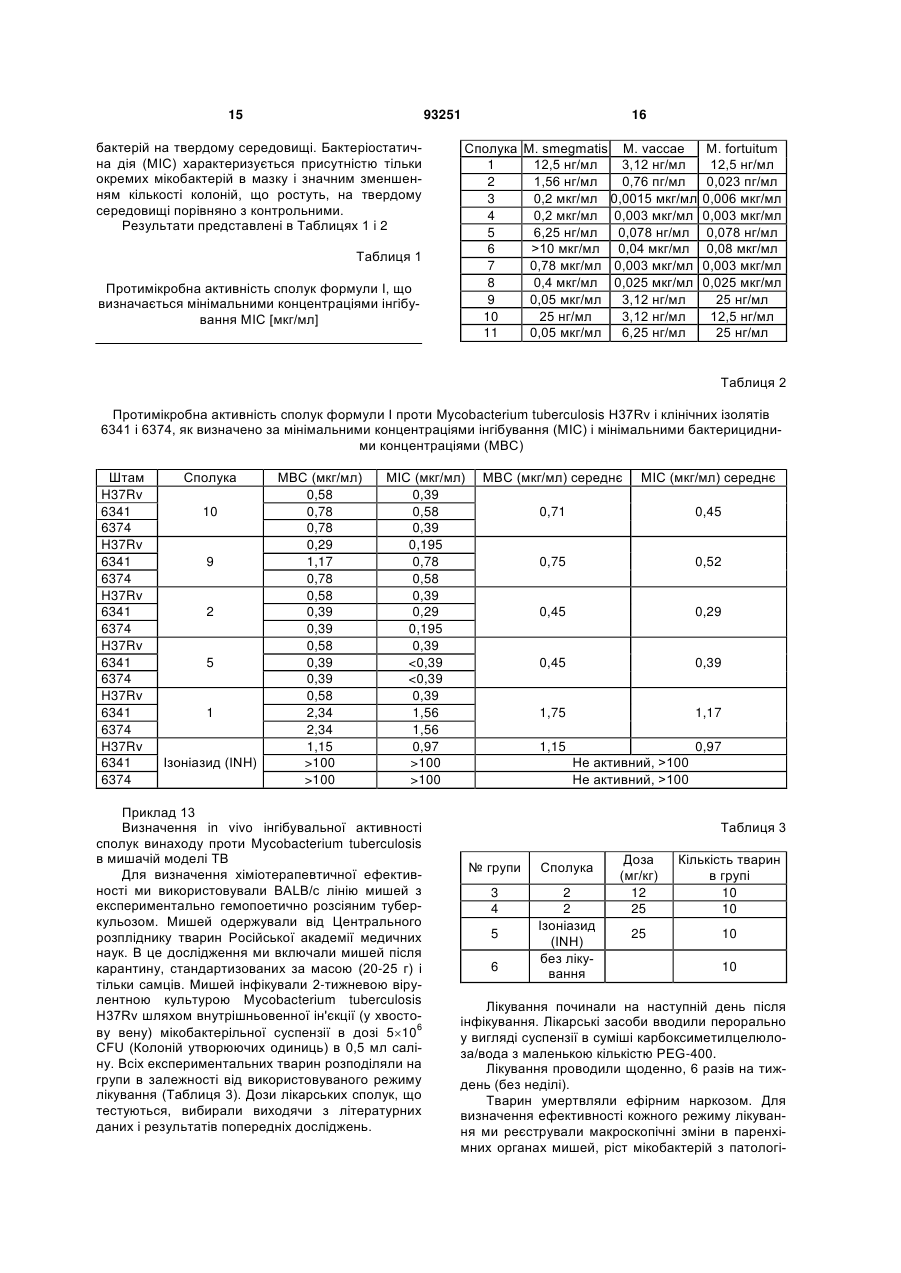
1. Сполука формули (І) R5 3 93251 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8динітро-1,3-бензотіазин-4-он, 2-(4,4-діетоксипіперидин-1-іл)-6,8-динітро-1,3бензотіазин-4-он, 7-метил-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец8-ил)-6,8-динітро-1,3-бензотіазин-4-он, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8нітро-6-(трифторметил)-1,3-бензотіазин-4-он, 2-(2,3-диметил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он, 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8-нітро-6(трифторметил)-1,3-бензотіазин-4-он, 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8-нітро-4оксо-1,3-бензотіазин-6-карбонітрил, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8нітро-4-оксо-1,3-бензотіазин-6-карбонітрил, 8-аміно-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8ил)-4-оксо-1,3-бензотіазин-6-карбонітрил і 8-аміно-2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8ил)-6-(трифторметил)-1,3-бензотіазин-4-он. 7. Сполука формули (І) за пунктом 1, яку вибирають з групи, що містить сполуки, в яких R5 і R6 є алкіл. 8. Застосування сполуки формули (І) або її солі за пунктом 1 для одержання фармацевтичної композиції. 9. Сполука формули (І) R5 4 SO2NR7R8, SR9, OCF3, моно -, ди- або трифторметил; R3 і R4 є, незалежно один від одного, Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, бензил, SR9, OR9; R5 і R6 є, незалежно один від одного, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-8 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, феніл, або R5 і R6 разом представляють бівалентний радикал -(CR92)m-, або R5 і R6 разом представляють бівалентні радикали: R10 O m , (I) де R1 і R2 є, незалежно один від одного, NO2, CN, CONR7R8, COOR9, СНО, галоген, NR7R8, або , де m є 1-4, або представляють бівалентні радикали - насичені або ненасичені моно- або полігетероцикли з гетероатомами N, S, О і заміщені (R10)x, де х є 1-4; R7, R8 і R9 є, незалежно один від одного, Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, моно -, ди- або трифторметил, галоген, феніл, або R3 і R4 разом представляють бівалентний радикал -(СН2)n-, де n є 2-7; R10 є Н або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, NO2, NR7R8, CN, CONR7R8, COOR9, СНО, галоген, SO2NR7R8, SR9, OR9, OCF3, моно -, диабо трифторметил, бензил або феніл, для застосування в способі терапевтичного або профілактичного лікування туберкульозу або прокази у ссавців. Представлений винахід стосується нових похідних бензотіазину i їх застосування як протибактеріальних агентів при інфекційних захворюваннях ссавців (людей i тварин), викликаних бактерією, особливо захворювань подібних туберкульозу (ТВ) i проказі, викликаних мікобактерією. Триазинон, його похідні і їх застосування як протибактеріальних агентів, особливо проти мікобактерії (ТВ) розкрито, наприклад, в публікаціях AR 242567 А1, AU 3704400 А1, СА 1322551 С1 або ЕР 0245901 В1. Як відомо, у світі збільшується розповсюдження туберкульозу, викликане мікобактерією, яка є стійкою до наявних терапевтичних засобів (В.R. Bloom, J.L. Murray, tuberculosis: commentary on a reemergent killer. Science 257, 1992, 1055-1064). Особливо небезпечним є розвиток стійкості мікобактерії до декількох лікарських засобів (MDR). Ці мікобактерії є стійкими, принаймні, стосовно двох найбільш активних протитуберкульозних лікарських засобів, ізоніазиду i ріфампіцину, але також проти стрептоміцину, піранзінаміду i етамбутолу. Розповсюдження MDR-TB в деяких країнах вже сягає більше ніж 20%. Разом із збільшенням кількості захворювання на ТВ, вона є причиною приблизно 3000000 смертей на рік. Для лікування таких захворювань, як (ТВ) або проказа, негайно необхідні нові лікарські засоби з новими механізмами дії, особливо, що подолають стійкість до лікарського засобу i не будуть мати значні побічні ефекти, як відомі доступні лікарські засоби. Ціль винаходу Представлений винахід направлений на створення нових сполук з активністю проти мікобактерії, які є сильними новими протитуберкульозними лікарськими засобами, що вирішать проблеми стійкості до лікарського засобу i непереносимості лікарського засобу. Вирішення технічної проблеми. Ця ціль вирішується одержанням сполук формули І O R1 R3 O S R6 N N R2 R4 O 5 де R1 i R2 є, незалежно один від одного, NO2, CN, CONR7R8, COOR9, СНО, галоген, NR7R8, SO2NR7R8, SR9, OCF3, моно-, ди- або трифторметил; R3 i R4 є, незалежно один від одного, Н, насичений або ненасичений, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, циклоалкіл що має 3-6 атомів вуглецю, бензил, SR9, OR9; R5 i R6 є, незалежно один від одного, насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-8 членів в ланцюзі, циклоалкіл, що має 3-6 атомів вуглецю, феніл або R5 i R6 разом представляють бівалентний радикал -(CR92)m-, або R5 i R6 разом представляють бівалентні радикали: де m є 1-4, або представляють бівалентні радикали - насичені або ненасичені моно або полігетероцикли з гетероатомами N, S, О i заміщені (R10)x, де x є 1-4; R7, R8 i R9 є, незалежно один від одного, Η або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, моно-, ди- або трифторметил, галоген, феніл, або R3 i R4 разом представляють бівалентний радикал -(СН2)n-, де n є 2-7; R10 є Η або насичений або ненасичений, галогенований або негалогенований, лінійний або розгалужений аліфатичний радикал, що має 1-7 членів в ланцюзі, ΝΟ2, NR7R8, CN, CONR7R8, COOR9, CHO, галоген, SO2NR7R8, SR9, OR9, OCF3, моно-, ди- або трифторметил, бензил або феніл. В переважному втіленні, винахід стосується сполук формули (І), що вибирають з групи, яка містить 93251 6 2-(4-R5-4-R6-піперидин-1-іл)-8-нітро-6трифторметил-1,3-бензотіазин-4-он, 6-ціано-2-(4-R5-4-R6-піперидин-1-іл)-8-нітро1,3-бензотіазин-4-он, 5 6 6-амідо-2-(4-R -4-R -піперидин-1-іл)-8-нітро1,3-бензотіазин-4-он, 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-R1-62 R -1,3-бензотіазин-4-он, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-R1-6-R2-1,3-бензотіазин-4-он, 2-[(2R)-2-метил-1,4-діокса-8-азаспіро[4.5]дец8-ил]-8-R1-6-R2-1,3-бензотіазин-4-он, 2-[(2S)-2-метил-1,4-діокса-8-азаспіро[4.5]дец8-ил]-8-R1-6-R2-1,3-бензотіазин-4-он, 2-(2,3-диметил-1,4-діокса-8-азаспіро[4.5]дец-8ил)-8-R1-6-R2-1,3-бензотіазин-4-он, 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8-R1-62 R -1,3-бензотіазин-4-он, де R1, R2, R51 R6 мають вказані вище значення. Представлений винахід, навіть більш переважно, стосується принаймні однієї сполуки, що вибирають з групи, яка містить 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8динітро-1,3-бензотіазин-4-он, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)6,8-динітро-1,3-бензотіазин-4-он, 2-(4,4-діетоксипіперидин-1-іл)-6,8-динітро-1,3бензотіазин-4-он, 7-метил-2-(2-метил-1,4-діокса-8азаспіро[4.5]дец-8-ил)-6,8-динітро-1,3-бензотіазин4-он, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он, 2-(2,3-диметил-1,4-діокса-8-азаспіро[4.5]дец-8ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он, 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8нітро-6-(трифторметил)-1,3-бензотіазин-4-он, 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8нітро-4-оксо-1,3-бензотіазин-6-карбонітрил, 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-нітро-4-оксо-1,3-бензотіазин-6-карбонітрил, 8-аміно-2-(2-метил-1,4-діокса-8азаспіро[4.5]дец-8-ил)-4-оксо-1,3-бензотіазин-6карбонітрил і 8-аміно-2-(2-метил-1,4-діокса-8азаспіро[4.5]дец-8-ил)-6-(трифторметил)-1,3бензотіазин-4-он. Для синтезу цільових сполук ми розробили наш оригінальний спосіб синтезу 1,3-бензотіазин4-ону використовуючи дитіокарбаматне похідне, як проміжну сполуку (спосіб А). Також придатний для застосування класичний спосіб синтезу 1,3бензотіазин-4-ону, використовуючи тіоціанатні солі (спосіб В). Обидва показані на схемі, приведеній далі. 7 Неочікувано, сполуки винаходу проявляють сильну протибактеріальну активність, особливо проти мікобактерій з мінімальними концентраціями інгібування (МІС) в інтервалі 0,23 пг/мл->10 мкг/мл для мікробактерій, що швидко ростуть, 0,195-1,56 мкг/мл для М. tuberculosis, включаючи полірезистентні штами, що визначаються класичним способом і 0,030 мкг/мл для М. tuberculosis H37Rv, що визначено способом Alamar Blue. Неочікувано, сполуки винаходу демонструють високий рівень селективності до мікобактерій тільки при сильному зменшенні потенціалу стосовно несприятливих побічних проявлень. Сполуки винаходу не є мутагенними при 5 мг/мл в SOS хромотесті. Сполуки винаходу є надзвичайно терапевтично активними in vivo в мишачій моделі туберкульозу порівняно з основним протитуберкульозним лікарським засобом, ізоніазид, що використовується як позитивний контроль 100% мишей виживало. Всі контрольні тварини гинули протягом 33 днів. Сполука винаходу (особливо сполука № 2 = приклад 1 у втіленнях), не є токсичною після перорального введення в дозах в інтервалі до 2000 мг/кг, сполука добре переносилась тваринами на першій і протягом наступних 24 годин після введення. Протягом 7 днів досліджень, сполука 2 не викликала змін загального стану i поведінки мишей, вона не впливла на моторику i рефлекторну активність, цикли активності і спокою догляд за 93251 8 тілом, вживання їжі, не була причиною смерті тварини. LD50 для сполуки 2 є >2000 мг/кг. Таким чином, сполуки винаходу є корисними для лікування туберкульозної інфекції i інших мікобактеріальних інфекцій, у людей i тварин. Відповідно, винахід стосується фармацевтичних композицій, що містять сполуку формули І. Винахід також стосується сполуки формули І для застосування в способі лікування бактеріальних інфекцій у ссавців. Переважними сполуками формули І для застосування в такому способі є сполуки, спеціально перелічені вище. Сполуки винаходу формулюються для застосування при одержанні розведеного розчину або суспензії у фармацевтично прийнятному водному, органічному або водно-органічному середовищі для місцевого або парентерального введення внутрішньовенною, підшкірною або внутрішньом'язовою ін’єкцією, або для назального застосування, або одержується у формі таблетки, капсули або водної суспензії із звичайними для орального введення екціпієнтами або як супозиторії. Сполуки можуть бути використані в дозах 0,001-1000 мг/кг ваги тіла. Приклади, що приведені в наступній експериментальній частині, слугують ілюстрацією винаходу, i не повинні розглядатись як його обмеження. Структури сполук винаходу доказані методиками синтезу i елементним аналізом i даними ядерного магнітного резонансу і/або мас 9 спектрометрами, також як i рентгеноструктурним аналізом. Втілення Вихідні матеріали Реагенти i розчинники одержували від Lancaster Synthesis (Lancashire, England) або від Aldnch (Sigma-Aldnch Company, St-Louis, US) i використовували в синтезі без додаткового очищення. Температури плавлення визначали згідно з методикою ВР i не коригували (Electrothermal 9001, GB). Якщо аналізи приведені тільки символами елементів, аналітичні результати знаходяться в межах ±0,3% теоретичних значень (Сагіо-Erba 5500, Italy). Спектр ЯМР знімали на Vanan Unity Plus 400 (USA). Зсуви для 1Н ЯМР приведені в м.ч. відносно ТМС (). Мас-спектр знімали використовуючи пристрій Finnigan SSQ-700 (USA) з безпосереднім впорскуванням. Реакції i чистоту сполук Аналіз розраховано для C8H4CIF3N2O3: Знайдено: 0,5 г 2,2-хлор-3-нітро-5(трифторметил)бензаміду розчиняли в 25 мл етанолу. Реакційну суміш обробляли 0,5 г дигідрату натрієвої солі 1,4-діокса-8-азаспіро[4.5]декан-8карбодітioновоі кислоти (Z. Ge, R. Li, T. Cheng, Synth. Commun., 29, 18, 1999, 3191-3196) i витримували 18 г при кімнатній температурі. Потім виливали в 50 мл охолодженої води i одержаний Аналіз розраховано для C11H12N4O2S2: Знайдено: 0,4 г 2-(амінокарбоніл)-6-нітро-4(трифторметил)феніл-1,4-діокса-8азаспіро[4.5]декан-8-карбодітіоату розчиняли в 25 мл етанолу. Реакційну суміш обробляли 0,32 г Na2HPO412Η2Ο i кип'ятили із зворотнім холодильником протягом 6 г. Її потім охолоджували i світло-жовтий осад відфільтровували i промивали 30 мл метанолу. Чистий кінцевий продукт одержували після подвійної кристалізації з етанолу 2-(1,4Аналіз розраховано для C16H14F3N3O5S: Знайдено: Спосіб В. Методика в деталях була такою ж самою як описано в J. Imnch, P. Knstian, Coll. Czech. Chem. Commun., 47, 1982, 3268-3282; D. Koscik, Ρ. Knstian, J. Gonda, Ε. Dandarova, Coll. Czech. Chem. Commun., 48, 1983, 3315-3328; D. Koscik, Ρ. Knstian, О. Forgac, Coll. Czech. Chem. Commun., 48, 1983, 3427-3432; Τ.Η. Cronin, Η. - J. Ε. Hess, патент US 3522247. Вихід 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-6-трифторметил)-1,3бензотіазин-4-ону є 0,21%. Сполука є ідентичною за спектроскопічними даними сполуці синтезованій за способом А. Приклад 2 Аналіз розраховано для C17H16N3O5S Знайдено: 93251 10 контролювали ТШХ використовуючи алюмінієві пластинки Silicagel 60 F254 (Merck Co, Germany). Приклад 1 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро6-(трифторметил)-1,3-бензотіазин-4-он (сполука 1) Спосіб А. До 50 мл розчину, що перемішується, 25% водного аміаку додавали по краплям розчин 5 г 2хлор-3-нітро-5-трифторметилбензоілхлориду (D.Ε. Welch, R.R. Baron, В.A. Burton, J. Med. Chem. 12; 2; 1969; 299-303) в ацетонітрилі (10 мл) при -20°С. Через 10 хв, додавали 50 мл етилацетату. Органічну фазу відокремлювали, двічі промивали водою, сушили над Na2SO4, обробляли активованим вугіллям, фільтрували i концентрували у вакуумі. Неочищений продукт очищали кристалізацією з етанолу. Вихід 2-хлор-3-нітро-5(трифторметил)бензаміду був 92%. Тпл. 195197°С (метанол). С, 35,78; Η, 1,50; Ν, 10,43 С, 36,01; Η, 1,53; Ν, 10,39 жовтий осад відфільтровували. Чистий кінцевий продукт одержували після подвійної кристалізації з етанолу. 2-(Амінокарбоніл)-6-нітро-4(трифторметил)феніл-1,4-діокса-8азаспіро[4.5]декан-8-карбодітіоат є світло-жовтою кристалічною речовиною. Вихід 0,47 г %. Тпл. 138140°С. С, 42,57; Η, 3,57; Ν, 9,31; S, 14,21 С, 42,61; Η, 3,67; Ν, 9,22; S, 14,30 Діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро-6трифторметил)-1,3-бензотіазин-4-он є світложовтою кристалічною речовиною. Вихід 0,47 г %. Тпл. 211-212°С. Rf ((гексан-ацетон, 2/1) - 0,35. + MC m/z 417 (M ). 1 H ЯМР (ДМСО-d6) 8,83 i 8,77 (два 1Η, два с, 2СН), 3,80 (8Н, широкий с, N(CH2CH2)2C), 2,02 (4Н, широкий с, ОСН2СН2О) м.ч. С, 46,04; Η, 3,38; Ν, 10,07; S, 7,68 С, 45,94; Η, 3,37; Ν, 10,09; S, 7,76 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он, (сполука 2) Згідно з методикою Прикладу 1. Світло-жовта кристалічна речовина. Вихід 54%. Тпл. 192-3°С. Rf (гексан-ацетон, 2/1) - 0,30. MC m/z 431 (M+). 1 Н ЯМР (ДМСО-d6) 8,81 i 8,77 (два 1Н, два с, 2СН), 4,24 (1Н, м, СН), 4,11 (1Н, м, СН), 4,06 (4Н, широкий с, N(CH2)2), 3,47 (1Н, т, СН), 3,27 (1Н, с, СН), 1,80 (4Н, широкий д, С(СН2)2), 1,23 (3H, д, СН3) м.ч. С, 47,33; Η, 3,74; Ν, 9,74; S, 7,43 С, 47,36; Η, 3,80; Ν, 9,87; S, 7,51 11 Приклад 3 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-6,8динітро-1,3-бензотіазин-4-он, (сполука 4) Згідно з методикою Прикладу 1 використовуючи 2-гідрокси-3,5-динітробензойну кислоту як вихідний матеріал. Світло-жовта кристалічна речовина. Вихід 43%. Тпл. 271-3°С (EtOH/ДМФА). Аналіз розраховано для C15H14N4O7S: Знайдено: Приклад 4 2-(2-метил-1,4-діокса-8-азаспіро[4.5]децил)6,8-динітро-1,3-бензотіазин-4-он, (сполука 4) Згідно з методикою Прикладу 1 використовуючи 2-гідрокси-3,5-динітробензойну кислоту як вихідний матеріал. Жовта кристалічна речовина. Вихід 57%. Тпл. 139-142°С (EtOH/ДМФА). Rf (гексан-ацетон, 2/1) - 0,50. Аналіз розраховано для C16H16N4O7S: Знайдено: Приклад 5 2-(2,3-диметил-1,4-діокса-8-азаспіро[4.5]дец-8ил)-8-нітро-6-(трифторметил)-1,3-бензотіазин-4-он, (сполука 5) Згідно з методикою Прикладу 1 використовуючи 2-гідрокси-3-нітро-5-трифторметилбензойну кислоту як вихідний матеріал. Світло-жовта крисАналіз розраховано для C18H18F3N3O5S: Знайдено: Приклад 6 2-(4,4-діетоксипіперидин-1-іл)-6,8-динітро-1,3бензотіазин-4-он, (сполука 6) Згідно з методикою Прикладу 1 використовуючи як вихідний матеріал 2-гідрокси-3,5динітробензойну кислоту. Жовта кристалічна речовина. Вихід 32%. Тпл. 179-181°С (i-PrOH). Аналіз розраховано для C17H20N4O7S: Знайдено: Приклад 7 2-(7,12-діокса-3-азаспіро[5,6]додец-3-ил)-6,8динітро-1,3-бензотіазин-4-он, (сполука 7) Згідно з методикою Прикладу 1 використовуючи як вихідний матеріал 2-гідрокси-3,5динітробензойну кислоту. Жовта кристалічна речовина. Вихід 51%. Тпл. 193-195°С (i-PrOH/ДМФА). Аналіз розраховано для C17H18N4O7S: Знайдено: Приклад 8 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-7-метил6,8-динітро-1,3-бензотіазин-4-он, (сполука 8) Згідно з методикою Прикладу 1 використовуючи як вихідний матеріал 2-гідрокси-4-метил-3,5динітробензойну кислоту. Жовта кристалічна речовина. Вихід 51%. Тпл. 207-210°С (i-PrOH/ДМФА). 93251 12 Rf (гексан-ацетон, 2/1) - 0,25. МС m/z 394 (М+). 1 Н ЯМР (ДМСО-d6) 9,15 i 9,12 (два 1Н, два с, 2СН), 3,86 (8Н, широкий с N(CH2CH2)2C), 2,97 (4Н, широкий с, ОСН2СН2О) м.ч. С, 45,68; Η, 3,58; Ν, 14,21; S, 8,13 С, 45,34; Η, 3,56; Ν, 14,30; S, 7,98 МС m/z 408 (М+). 1 Н ЯМР (ДМСО-d6) 9,08 i 9,11 (два 1Н, два с, 2СН), 4,23 (1Н, м, СН), 4,10 (1Н, м, СН), 4,06 (4Н, широкий с, N(CH2)2), 3,43 (1Н, т, СН), 3,27 (1Н, с, СН), 1,80 (4Н, широкий д, С(СН2)2), 1,20 (3H,д, СН3) м.ч. С, 47,06 Η; 3,95; Ν, 13,72; S 7,85 С, 46,87; Η, 3,91; Ν, 13,57; S, 7,83 талічна речовина. Вихід 58%. Тпл. 205-207°С (EtOH/ДМФА). Rf (гексан-ацетон, 2/1) - 0,55. МС m/z 44522 (М+). 1 Н ЯМР (ДМСО-d6) 8,82 i 8,77 (два 1Н, два с, 2СН), 3,86 (4Н, широкий с, N(CH2)2) 3,45-3,53 (2Н, м, 2СН), 2,41 (4Н, широкий д, С(СН2)2), 1,13-1,17 (6Н, м, 2СН3) м.ч. С, 48,54; Η, 4,07; Ν 9,43; S, 7,20 С, 48,66; Η, 4,12; Ν 9,32; S, 7,46 Rf (гексан-ацетон, 2/1) - 0,30. МС m/z 424 (М+). 1 Н ЯМР (ДМСО-d6) 9,08 i 9,11 (два 1Н, два с, 2СН), 3,60-3,67 (4Н, м, N(CH2)2) 2,11-2,08 (4Н, м, С(СН2)2), 3,47 i 3,57 (два 2Н, к, 2ОСН2), 1,16 (6Н, т, 2СН3), м.ч. С, 48,11; Η, 4,75; Ν, 13,20; S, 7,56 С 48,12; Η 4,73; Ν, 13,41; S, 7,67 Rf (гексан-ацетон, 2/1) - 0,45. МС m/z 422 (М+). 1 Н ЯМР (ДМСО-d6) 8,97 i 9,16 (два 1Н, два с, 2СН), 3,57-3,74 (8Н, м, 4СН2), 1,93-2,35 (8Н, м, 4СН2) м.ч. С, 48,34; Η, 4,30; Ν, 13,26; S, 7,56 С, 48,21; Η, 4,43; Ν, 13,30; S, 7,66 Rf (гексан-ацетон, 2/1) - 0,30. МС m/z 408 (М+). 1 Н ЯМР (ДМСО-d6) 8,77 (1Н, с, СН), 3,86 (8Н, широкий с, N(CH2CH2)2C), 2,97 (4Н, широкий с, ОСН2СН2О), 2,79 (3H, с, СН3) м.ч. 13 Аналіз розраховано для C16H16N4O7S: Знайдено: Приклад 9 2-(1,4-діокса-8-азаспіро[4.5]дец-8-ил)-8-нітро4-оксо-1,3-бензотіазин-6-карбонітрил, (сполука 9) До розчину, що перемішується, 5 г (19 ммоль) 2-гідрокси-5-йодбензойноі кислоти в 50 мл ДМФА додавали маленькими порціями сухий 2,5 г (22 ммоль) CuCN (І). Реакційну суміш кип'ятили протягом 5 г, додавали 100 мл води i 50 мл етилацетату. Потім дуже обережно при вентилюванні додавали конц. хлорводневу кислоту до рН ~3. Органічну фазу відокремлювали, двічі промивали водою, сушили над Na2SO4, обробляли активоваАналіз розраховано для C16H14N4O5S: Знайдено: Приклад 10 2-(2-метил-1,4-діокса-8-азаспіро[4.5]дец-8-ил)8-нітро-4-оксо-1,3-бензотіазин-6-карбонітрил, (сполука 10) Згідно з методикою Прикладу 9. Жовта кристалічна речовина. Вихід 34%. Тпл. 251-253°С (EtOH/ДМФА). Rf (гексан-ацетон, 2/1) - 0,40. Аналіз розраховано для C17H16N4O5S: Знайдено: Приклад 11 2-(1,5-діокса-9-азаспіро[5.5]ундец-9-ил)-8нітро-4-оксо-1,3-бензотіазин-6-карбонітрил, (сполука 11) Згідно з методикою Прикладу 9. Жовта кристалічна речовина. Вихід 40%. Тпл. 230-232°С (EtOH/ДМФА). Аналіз розраховано для C17H16N4O5S: Знайдено: Приклад 12 Визначення in vitro інпбувальної активності сполук винаходу проти мікобактерій. Досліджували протибактеріальну активність сполук проти Mycobactenum smegmatis SG 987, Μ. aureum SB66, Μ. vaccae IMET 1010670 i Μ. fortuitum В шляхом визначення мінімальних концентрацій інгібування (МІС) в способі мікророзведень бульйону - бульйону Мюллер-Хінтон (Difco) згідно з посібником NCCLS [National Committee for Clinical Laboratory Standards Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically, 5th Ed., Villanova, Ed , Approved standard Document M7-A5 NCCLS, (2000)]. Дослідження активності проти Μ. tuberculosis H37Rv проводили наступним способом для визначення мінімальних концентрацій інгібування (МІС) i мінімальних бактерицидних концентрацій (МВС): Штами інокулювали на тверде середовище Ловенстейна-Єнсена (Lowenstein-Jensen). Через 21 день, вирощену культуру використовують для одержання інокуляційної суспензії, що відповідає 93251 14 С, 47,06; Η, 3,95; Ν, 13,72; S, 7,85 С, 47,12; Η, 4,01; Ν, 13,69; S, 7,94 ним вугіллям, фільтрували i концентрували у вакуумі. Неочищений продукт очищали кристалізацією з води. Вихід 5-ціано-2-гідроксибензойноі кислоти був 71%. Згідно з методикою Прикладу 1. Вихід 44%. Тпл. 217-220°С (EtOH/ДМФА). Rf (гексан-ацетон, 2/1) - 0,50. MC m/z 374 (М+). 1 Н ЯМР (ДМСО-d6) 8,74 i 8,67 (два 1Н, два с, 2СН), 3,41 (8Н, широкий с, N(CH2CH2)2C), 2,93 (4Н, широкий с, ОСН2СН2О) м.ч. С, 51,33; Η, 3,77; Ν, 14,97; S, 8,57 С, 51,30; Η, 3,84; Ν, 14,89; S, 8,62 MC m/z 388 (М+). 1 Н ЯМР (ДМСО-d6) 8,73 i 8,61 (два 1Н, два с, 2СН), 4,23 (1Н, м, СН), 4,11 (1Н, м, СН), 4,07 (4Н, широкий с, N(CH2)2), 3,51 (1Н, т, СН), 3,27 (1Н, с, СН), 1,81 (4Н, широкий д, С(СН2)2), 1,22 (3H, д, СН3) м.ч. С 52,57; Η, 4,15; Ν, 14,43; S, 8,26 С, 52,42; Η, 4,08; Ν, 14,50; S, 8,27 Rf (гексан-ацетон, 2/1) - 0,15. MC m/z 388 (М+). 1 Н ЯМР (ДМСО-d6) 8,74 i 8,61 (два 1Н, два с, 2СН), 3,29-3,65 (6Н, м, 3СН2), 2,38 (4Н, широкий с, 2СН2), 1,82-1,93 (4Н, м, 2СН2) м.ч. С, 52,57; Η, 4,15; Ν, 14,43; S, 8,26 С, 52,52; Η, 4,11; Ν, 14,59; S, 8,13 5108 мікробних клітин/мл). Інокулювали у 2 мл суспензійні пробірки 0,2 мл рідкого середовища Школьнікова, що містить відповідні концентрації сполук для дослідження від 100,0 до 0,195 мг/мл. Через 14 днів інкубування при 37°С пробірки з рідким середовищем центрифугували 15 хв при 3000 об/хв.. Після відкидання надосадкової рідини, осад ресуспендували в 0,8 мл стерильного 0,9% NaCI 0,1 мл суспензії використовували для одержання мазків додатково пофарбованих за способом Жиля-Нільсена. Осад, що залишився, інокулювали в 0,2 мл об'єми в трьох пробірках з твердим середовищем Ловенстейна-Єнсена вільним від лікарського засобу для визначення мінімальних бактерицидних концентрацій (МВС). Результати зчитували через 21-28 днів культивування при 37°С. Контрольні пробірки, що культивували з досліджуваними штамами, не обробляли досліджуваними агентами. Мінімальні бактерицидні концентрації лікарських засобів (МВС) розглядають як концентрація лікарського засобу, що повністю інгібує ріст міко 15 93251 бактерій на твердому середовищі. Бактеріостатична дія (МІС) характеризується присутністю тільки окремих мікобактерій в мазку i значним зменшенням кількості колоній, що ростуть, на твердому середовищі порівняно з контрольними. Результати представлені в Таблицях 1 i 2 Таблиця 1 Протимікробна активність сполук формули І, що визначається мінімальними концентраціями інгібування МІС [мкг/мл] 16 Сполука 1 2 3 4 5 6 7 8 9 10 11 Μ. smegmatis Μ. vaccae 12,5 нг/мл 3,12 нг/мл 1,56 нг/мл 0,76 пг/мл 0,2 мкг/мл 0,0015 мкг/мл 0,2 мкг/мл 0,003 мкг/мл 6,25 нг/мл 0,078 нг/мл >10 мкг/мл 0,04 мкг/мл 0,78 мкг/мл 0,003 мкг/мл 0,4 мкг/мл 0,025 мкг/мл 0,05 мкг/мл 3,12 нг/мл 25 нг/мл 3,12 нг/мл 0,05 мкг/мл 6,25 нг/мл Μ. fortuitum 12,5 нг/мл 0,023 пг/мл 0,006 мкг/мл 0,003 мкг/мл 0,078 нг/мл 0,08 мкг/мл 0,003 мкг/мл 0,025 мкг/мл 25 нг/мл 12,5 нг/мл 25 нг/мл Таблиця 2 Протимікробна активність сполук формули І проти Mycobacterium tuberculosis H37Rv і клінічних ізолятів 6341 і 6374, як визначено за мінімальними концентраціями інгібування (МІС) і мінімальними бактерицидними концентраціями (МВС) Штам H37Rv 6341 6374 H37Rv 6341 6374 H37Rv 6341 6374 H37Rv 6341 6374 H37Rv 6341 6374 H37Rv 6341 6374 Сполука 10 9 2 5 1 Ізоніазид (INH) МВС (мкг/мл) 0,58 0,78 0,78 0,29 1,17 0,78 0,58 0,39 0,39 0,58 0,39 0,39 0,58 2,34 2,34 1,15 >100 >100 МІС (мкг/мл) 0,39 0,58 0,39 0,195 0,78 0,58 0,39 0,29 0,195 0,39 100 Приклад 13 Визначення in vivo інгібувальної активності сполук винаходу проти Mycobacterium tuberculosis в мишачій моделі ТВ Для визначення хіміотерапевтичної ефективності ми використовували BALB/c лінію мишей з експериментально гемопоетично розсіяним туберкульозом. Мишей одержували від Центрального розпліднику тварин Російської академії медичних наук. В це дослідження ми включали мишей після карантину, стандартизованих за масою (20-25 г) і тільки самців. Мишей інфікували 2-тижневою вірулентною культурою Mycobacterium tuberculosis H37Rv шляхом внутрішньовенної ін'єкції (у хвостову вену) мікобактерільної суспензії в дозі 5106 CFU (Колоній утворюючих одиниць) в 0,5 мл саліну. Всіх експериментальних тварин розподіляли на групи в залежності від використовуваного режиму лікування (Таблиця 3). Дози лікарських сполук, що тестуються, вибирали виходячи з літературних даних i результатів попередніх досліджень. МВС (мкг/мл) середнє МІС (мкг/мл) середнє 0,71 0,45 0,75 0,52 0,45 0,29 0,45 0,39 1,75 1,17 1,15 0,97 Не активний, >100 Не активний, >100 Таблиця 3 № групи Сполука 3 4 2 2 Ізоніазид (IΝΗ) без лікування 5 6 Доза (мг/кг) 12 25 Кількість тварин в групі 10 10 25 10 10 Лікування починали на наступній день після інфікування. Лікарські засоби вводили перорально у вигляді суспензії в суміші карбоксиметилцелюлоза/вода з маленькою кількістю PEG-400. Лікування проводили щоденно, 6 разів на тиждень (без неділі). Тварин умертвляли ефірним наркозом. Для визначення ефективності кожного режиму лікування ми реєстрували макроскопічні зміни в паренхімних органах мишей, ріст мікобактерій з патологі 17 93251 чного матеріалу на твердому середовищі, також як i бактеріоскопічний індекс ураження органу. Ми проводили якісний i кількісний аналіз макроскопічних змін в печінці, селезінці i легенях i розраховували індекс ураження (використовуючи чотирикратну шкалу). Індекс ефективності 100% 18 Макроскопічну оцінку ефективності кожного режиму лікування виражали через індекс ефективності, що розраховували використовуючи формулу. Індекс ура ження досліджува ної групи 100 Індекс ура ження контрольно ї групи Мікробіологічне дослідження включало дослідження для визначення CFU в паренхімних органах. З цією ціллю, ми гомогенізували праву легеню i окремо селезінку з 6% сірчаною кислотою, центрифугували, промивали водою i саліном. Продукт (приблизно 0,5 мл) розводили 1,0 мл саліну i гомогенізували. Цю суспензію (0,5 мл) досліджуваних органів розводили 100 i 1000 разів саліном i розподіляли на тверде середовище Finn-2. Культури інкубували при 37°С 1 місяць i щотижнево зчитували починаючи з 10 дня. Через 28 днів визначали CFU. Дані макроскопічного i мікробіологічних досліджень паренхімних органів мишей, які помирали під час експерименту також враховували при загальній оцінці експериментальних результатів, які приведені в таблицях 4-6. Таблиця 4 Індекси ураження органу у мишей і ефективність лікування Група 3 4 5 6 Лікарський засіб Сполука 2 Сполука 2 INH, ізоніазид контроль Доза (мг/кг) 12 25 25 - Індекс ураження 2,1 1,0 1,2 3,8 Індекс ефективності(%) 44,7 78 70,5 Таблиця 5 Результати мікробіологічного дослідження правої легені і селезінки експериментальних мишей (42 дні після інокуляції в культуральне середовище) Група Сполука Доза (мг/кг) 3 4 5 6 2 2 INH, Ізоніазид Контроль 12 25 25 культура правої легені, без роз- культура селезінки, без розведення CFU ведення CFU ~60 ~60 ~35 ~35 ~40 ~40 >120 (загальний ріст) >120 (загальний ріст) Таблиця 6 Тварини, що вижили День лі- Група 3 Група 4 Група 5 Група 6 кування Сполука 2 Сполука 2 INH Контроль 1 10 10 10 10 2 10 10 10 10 3 10 10 10 10 4 10 10 10 10 5 10 10 10 10 6 10 10 10 10 7 10 10 10 10 8 10 10 10 10 9 10 10 10 10 10 10 10 10 10 11 10 10 10 10 12 10 10 10 10 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 10 10 10 10 10 10 10 10 10 10 10 10 10 10 100% 10 10 10 10 10 10 10 10 10 10 10 10 10 10 100% 10 10 10 10 10 10 10 10 10 10 10 10 10 10 100% 9 9 9 9 9 9 9 8 8 8 8 8 5 4 40% Всі контрольні тварини гинули протягом 33 днів. 19 Комп’ютерна верстка О. Гапоненко 93251 Підписне 20 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzothiazine derivatives and use thereof as antibacterial agents
Автори англійськоюMAKAROV VADIM A, COLE STEWART T, MOLLMANN UTE
Назва патенту російськоюПроизводные бензотиазинона и их применение kak противобактериальных агентов
Автори російськоюМакаров Вадим A., Коул Стюарт T., Мьолльманн Уте
МПК / Мітки
МПК: A61P 31/04, A61K 31/5415, C07D 417/04, C07D 491/10
Мітки: бензотіазинону, похідні, протибактеріальних, застосування, агентів
Код посилання
<a href="https://ua.patents.su/10-93251-pokhidni-benzotiazinonu-i-kh-zastosuvannya-yak-protibakterialnikh-agentiv.html" target="_blank" rel="follow" title="База патентів України">Похідні бензотіазинону і їх застосування як протибактеріальних агентів</a>
Наступний патент: Спосіб чистової та зміцнюючої обробки поверхонь тіл обертання складного профілю і пристрій для його здійснення
Випадковий патент: Рюкзак