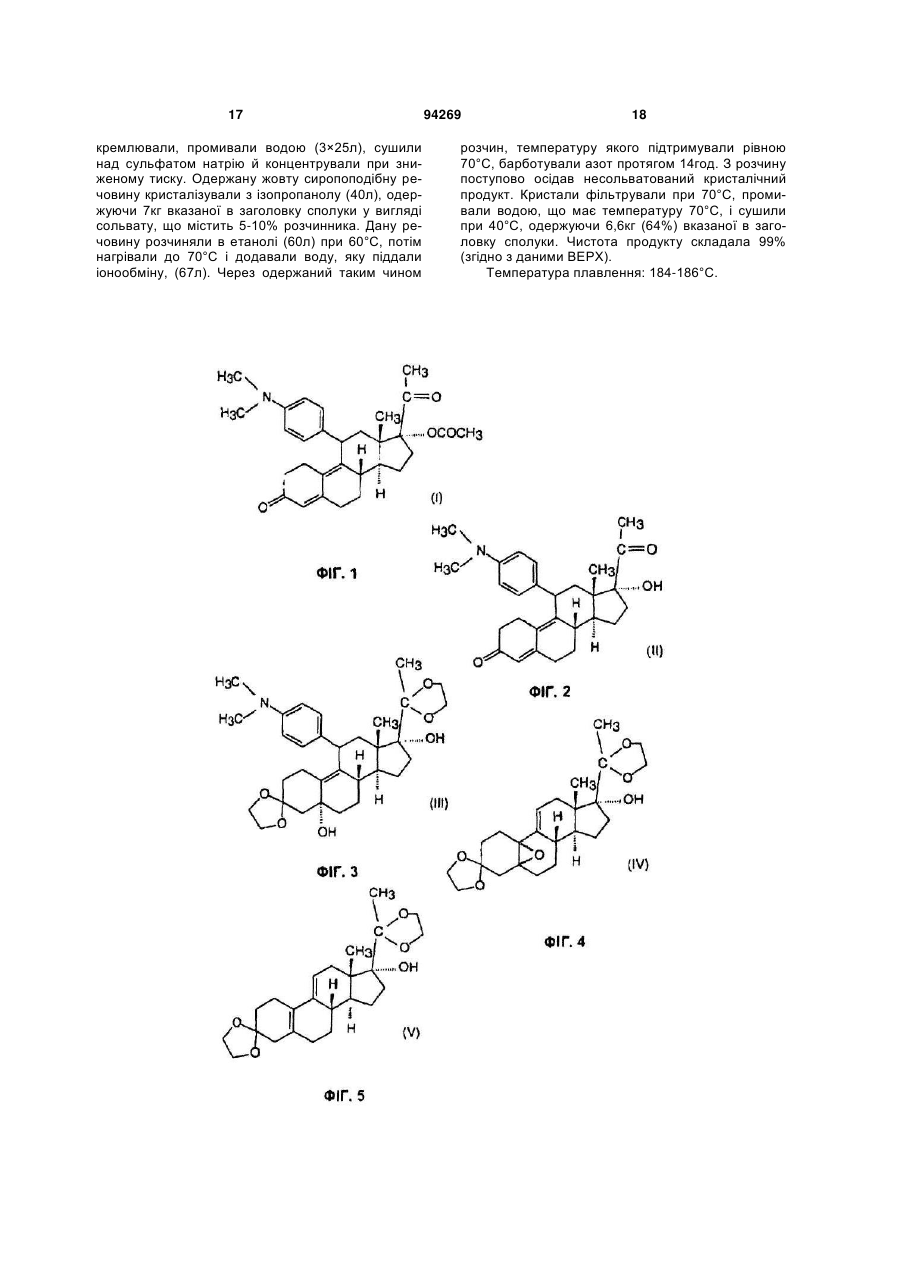
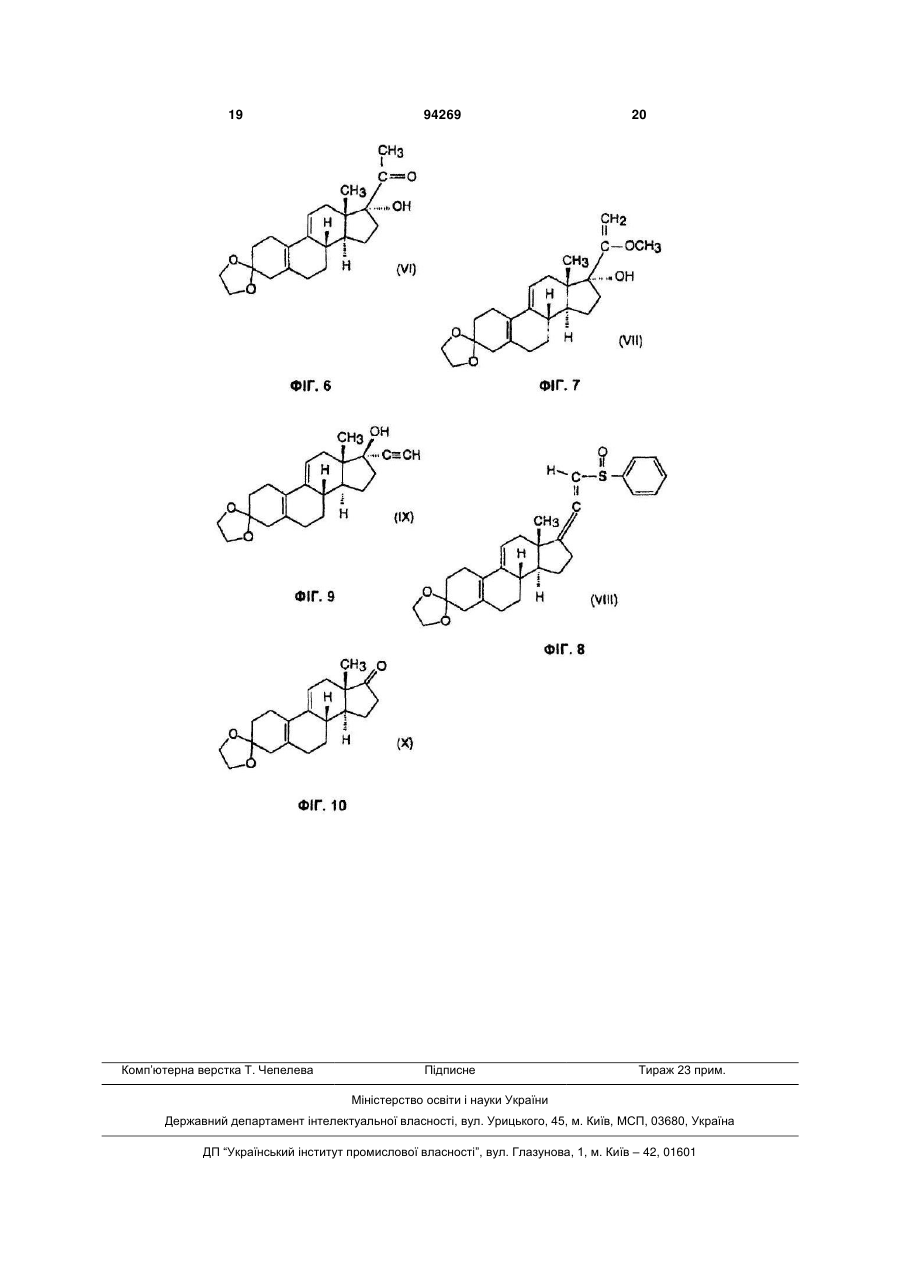
Промисловий спосіб синтезу несольватованого 17a-ацетокси-11b-[4-(n,n-диметиламіно)-феніл]-19-норпрегна-4,9-дієн-3,20-діону й проміжні сполуки за даним способом
Номер патенту: 94269
Опубліковано: 26.04.2011
Автори: Чоргеї Янош, Мад'ярі Ендрене, Данчі Лайошне, Туба Золтан, Мольнар Чаба, Вішкі Дьйордь
Формула / Реферат
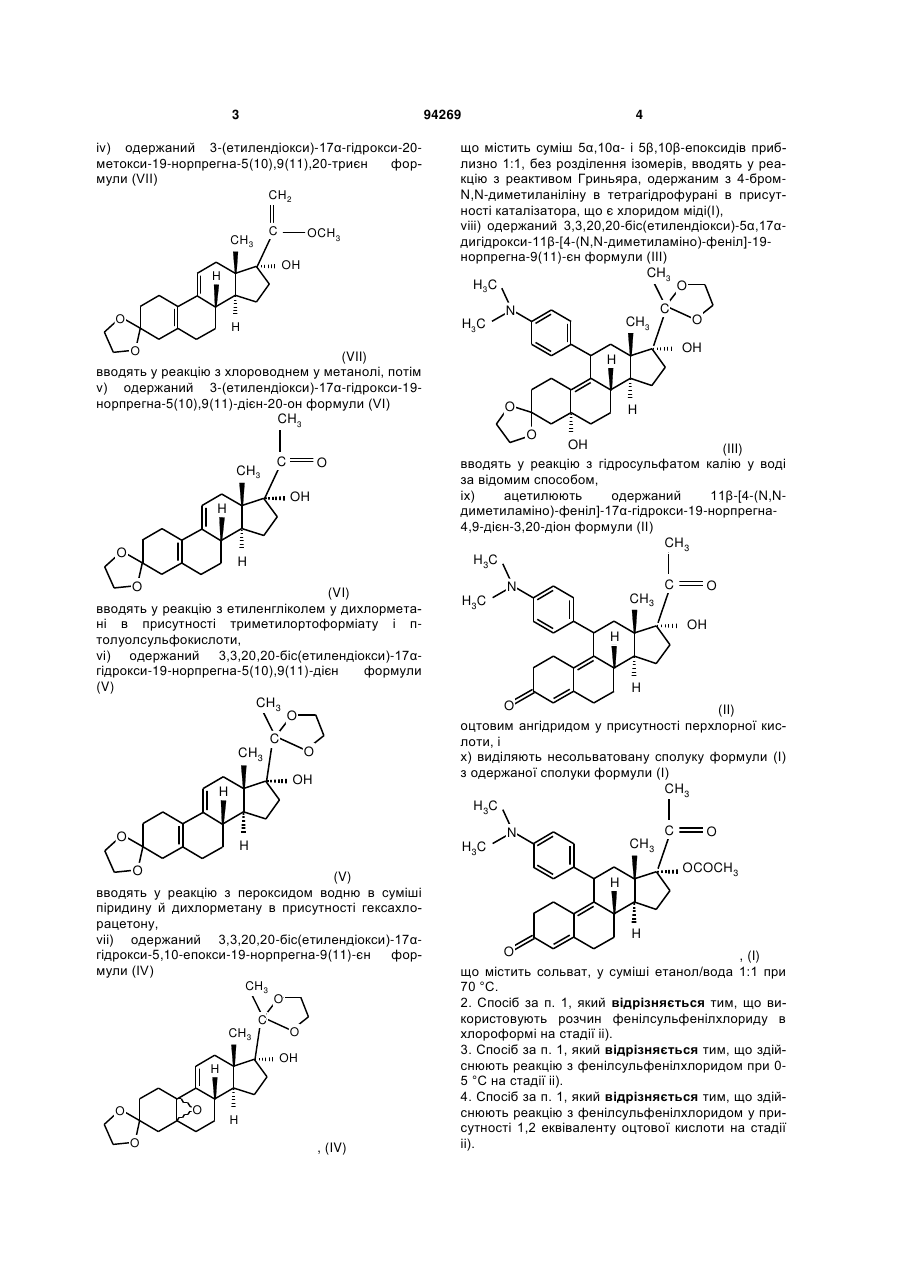
1. Промисловий спосіб синтезу несольватованого 17α-ацетокси-11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегна-4,9-дієн-3,20-діону формули (І), що включає утворення кеталю з 3-(етилендіокси)-17α-гідрокси-19-норпрегна-5(10),9(11)-дієн-20-ону формули (VI), утворення епоксиду в положенні 5,10 одержаного 3,3,20,20-біс(етилендіокси)-17α-гідрокси-19-норпрегна-5(10),9(11)-дієну формули (V), реакцію одержаного 3,3,20,20-біс(етилендіокси)-17α-гідрокси-5,10-епокси-19-норпрегна-9(11)-єну формули (IV) з реактивом Гриньяра, одержаним з бром-N,N-диметиланіліну, зняття захисту з одержаного таким чином 3,3,20,20-біс(етилендіокси)-5α,17α-дигідрокси-11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегна-(11)-єну формули (III), ацетилювання одержаного 11β-[4-(N,N-диметиламіно)-феніл]-17α-гідрокси-19-норпрегна-4,9-дієн-3,20-діону формули (II) і вивільнення несольватованої форми цільового продукту, який відрізняється тим, що
і) 3-(етилендіоксі)-естра-5(10),9(11)-дієн-17-он формули (X)
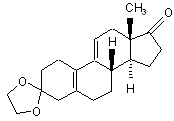 (X)
(X)
вводять у реакцію з ацетилідом калію, одержаним in situ в сухому тетрагідрофурані,
іі) одержаний 3-(етилендіоксі)-17α-етиніл-17β-гідроксі-естра-5(10),9(11)-дієн формули (IX)
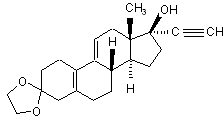 (IX)
(IX)
вводять у реакцію з фенілсульфенілхлоридом у дихлорметані в присутності триетиламіну й оцтової кислоти,
ііі) одержану суміш ізомерів 3-(етилендіокси)-21-(фенілсульфініл)-19-норпрегна-5(10),9(11),17(20),20-тетраєну формули (VIII)
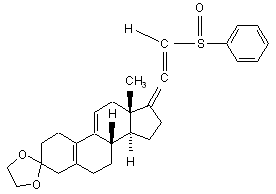 (VIII)
(VIII)
вводять у реакцію спочатку з метоксидом натрію в метанолі, потім з триметилфосфітом,
іv) одержаний 3-(етилендіокси)-17α-гідрокси-20-метокси-19-норпрегна-5(10),9(11),20-триєн формули (VII)
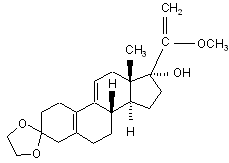 (VII)
(VII)
вводять у реакцію з хлороводнем у метанолі, потім
v) одержаний 3-(етилендіокси)-17α-гідрокси-19-норпрегна-5(10),9(11)-дієн-20-он формули (VI)
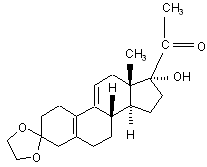 (VI)
(VI)
вводять у реакцію з етиленгліколем у дихлорметані в присутності триметилортоформіату і п-толуолсульфокислоти,
vi) одержаний 3,3,20,20-біс(етилендіокси)-17α-гідрокси-19-норпрегна-5(10),9(11)-дієн формули (V)
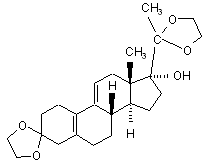 (V)
(V)
вводять у реакцію з пероксидом водню в суміші піридину й дихлорметану в присутності гексахлорацетону,
vii) одержаний 3,3,20,20-біс(етилендіокси)-17α-гідрокси-5,10-епокси-19-норпрегна-9(11)-єн формули (IV)
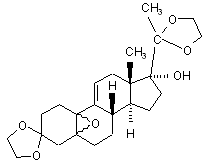 , (IV)
, (IV)
що містить суміш 5α,10α- і 5β,10β-епоксидів приблизно 1:1, без розділення ізомерів, вводять у реакцію з реактивом Гриньяра, одержаним з 4-бром-N,N-диметиланіліну в тетрагідрофурані в присутності каталізатора, що є хлоридом міді(І),
viii) одержаний 3,3,20,20-біс(етилендіокси)-5α,17α-дигідрокси-11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегна-9(11)-єн формули (III)
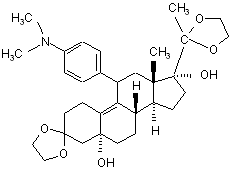 (III)
(III)
вводять у реакцію з гідросульфатом калію у воді за відомим способом,
іх) ацетилюють одержаний 11β-[4-(N,N-диметиламіно)-феніл]-17α-гідрокси-19-норпрегна-4,9-дієн-3,20-діон формули (II)
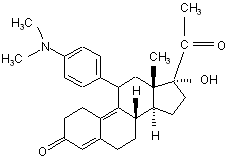 (II)
(II)
оцтовим ангідридом у присутності перхлорної кислоти, і
х) виділяють несольватовану сполуку формули (І) з одержаної сполуки формули (І)
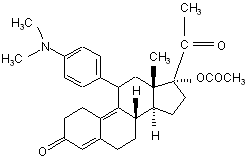 , (I)
, (I)
що містить сольват, у суміші етанол/вода 1:1 при 70 °С.
2. Спосіб за п. 1, який відрізняється тим, що використовують розчин фенілсульфенілхлориду в хлороформі на стадії іі).
3. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з фенілсульфенілхлоридом при 0-5 °С на стадії іі).
4. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з фенілсульфенілхлоридом у присутності 1,2 еквіваленту оцтової кислоти на стадії іі).
5. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з метоксидом натрію і триметилфосфітом при 62-64 °С на стадії ііі).
6. 3-(Етилендіокси)-17α-гідрокси-20-метокси-19-норпрегна-5(10),9(11),20-триєн формули (VII)
 (VII).
(VII).
7. 3-(Етилендіокси)-21-(фенілсульфініл)-19-норпрегна-5(10),9(11),17(20),20-тетраєн формули (VIII)
 (VIII).
(VIII).
Текст
1. Промисловий спосіб синтезу несольватованого 17α-ацетокси-11β-[4-(N,N-диметиламіно)феніл]-19-норпрегна-4,9-дієн-3,20-діону формули (І), що включає утворення кеталю з 3(етилендіокси)-17α-гідрокси-19-норпрегна5(10),9(11)-дієн-20-ону формули (VI), утворення епоксиду в положенні 5,10 одержаного 3,3,20,20біс(етилендіокси)-17α-гідрокси-19-норпрегна5(10),9(11)-дієну формули (V), реакцію одержаного 3,3,20,20-біс(етилендіокси)-17α-гідрокси-5,10епокси-19-норпрегна-9(11)-єну формули (IV) з реактивом Гриньяра, одержаним з бром-N,Nдиметиланіліну, зняття захисту з одержаного таким чином 3,3,20,20-біс(етилендіокси)-5α,17αдигідрокси-11β-[4-(N,N-диметиламіно)-феніл]-19норпрегна-(11)-єну формули (III), ацетилювання одержаного 11β-[4-(N,N-диметиламіно)-феніл]17α-гідрокси-19-норпрегна-4,9-дієн-3,20-діону формули (II) і вивільнення несольватованої форми цільового продукту, який відрізняється тим, що і) 3-(етилендіоксі)-естра-5(10),9(11)-дієн-17-он формули (X) 2 3 94269 іv) одержаний 3-(етилендіокси)-17α-гідрокси-20метокси-19-норпрегна-5(10),9(11),20-триєн формули (VII) CH2 C CH3 OCH3 OH H 4 що містить суміш 5α,10α- і 5β,10β-епоксидів приблизно 1:1, без розділення ізомерів, вводять у реакцію з реактивом Гриньяра, одержаним з 4-бромN,N-диметиланіліну в тетрагідрофурані в присутності каталізатора, що є хлоридом міді(І), viii) одержаний 3,3,20,20-біс(етилендіокси)-5α,17αдигідрокси-11β-[4-(N,N-диметиламіно)-феніл]-19норпрегна-9(11)-єн формули (III) CH3 H3 C O C N O CH3 H3 C H O (VII) вводять у реакцію з хлороводнем у метанолі, потім v) одержаний 3-(етилендіокси)-17α-гідрокси-19норпрегна-5(10),9(11)-дієн-20-он формули (VI) CH3 OH H O O H O CH3 C O OH H O H OH (III) вводять у реакцію з гідросульфатом калію у воді за відомим способом, іх) ацетилюють одержаний 11β-[4-(N,Nдиметиламіно)-феніл]-17α-гідрокси-19-норпрегна4,9-дієн-3,20-діон формули (II) CH3 H3 C O (VI) вводять у реакцію з етиленгліколем у дихлорметані в присутності триметилортоформіату і птолуолсульфокислоти, vi) одержаний 3,3,20,20-біс(етилендіокси)-17αгідрокси-19-норпрегна-5(10),9(11)-дієн формули (V) CH3 O C O CH3 OH H C N CH3 H3 C H H O (II) оцтовим ангідридом у присутності перхлорної кислоти, і х) виділяють несольватовану сполуку формули (І) з одержаної сполуки формули (І) CH3 H3C C (V) вводять у реакцію з пероксидом водню в суміші піридину й дихлорметану в присутності гексахлорацетону, vii) одержаний 3,3,20,20-біс(етилендіокси)-17αгідрокси-5,10-епокси-19-норпрегна-9(11)-єн формули (IV) CH3 C CH3 O O O O O OH H CH3 H3 C O H , (IV) OH H N O O H O OCOCH3 H O , (I) що містить сольват, у суміші етанол/вода 1:1 при 70 °С. 2. Спосіб за п. 1, який відрізняється тим, що використовують розчин фенілсульфенілхлориду в хлороформі на стадії іі). 3. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з фенілсульфенілхлоридом при 05 °С на стадії іі). 4. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з фенілсульфенілхлоридом у присутності 1,2 еквіваленту оцтової кислоти на стадії іі). 5 94269 5. Спосіб за п. 1, який відрізняється тим, що здійснюють реакцію з метоксидом натрію і триметилфосфітом при 62-64 °С на стадії ііі). 6. 3-(Етилендіокси)-17α-гідрокси-20-метокси-19норпрегна-5(10),9(11),20-триєн формули (VII) CH2 CH3 H C OCH3 CH3 S C H O H O 7. 3-(Етилендіокси)-21-(фенілсульфініл)-19норпрегна-5(10),9(11),17(20),20-тетраєн формули (VIII) O OH H O C 6 H O (VII). ( VIII). Даний винахід відноситься до нового промислового способу синтезу несольватованого 17αацетокси-11β-[4-(N,N-диметиламіно)-феніл]-19норпрегна-4,9-дієн-3,20-діону [CDB-2914] формули (І), що є сильним антипрогестогенним і антиглюкокортикоїдним засобом. Даний винахід також стосується сполук формул (VII) і (VIII), використовуваних у вказаному способі як проміжні сполуки. Назви сполук, відповідних формулам, пронумерованим римськими цифрами на доданій схемі, подані в описі способу за даним винаходом. Спосіб за даним винаходом полягає в наступному: і) 3-(етилендіокси)-естра-5(10),9(11)-дієн-17-он формули (X) уводять у реакцію з ацетилідом калію, одержаним in situ в сухому тетрагідрофурані відомим способом, іі) одержаний 3-(етилендіокси)-17α-етиніл-17βгідроксі-естра-5(10),9(11)-дієн формули (IX) уводять у реакцію з фенілсульфенілхлоридом у дихлорметані в присутності триетиламіну й оцтової кислоти, ііі) одержану суміш ізомерів 3-(етилендіокси)21-(фенілсульфініл)-19-норпрегна-5(10),9(11), 17(20),20-тетраену формули (VIII) уводять у реакцію спочатку з метоксидом натрію в метанолі, потім з триметилфосфітом, iv) одержаний 3-(етилендіокси)-17α-гідрокси20-метокси-19-норпрегна-5(10),9(11),20-триєн формули (VII) уводять у реакцію з хлороводнем у метанолі, потім ν) одержаний 3-(етилендіокси)-17α-гідрокси19-норпрегна-5(10),9(11)-дієн-20-он формули (VI) уводять у реакцію з етиленгліколем у дихлорметані в присутності триметилортоформату і птолуолсульфокислоти за відомим способом, vi) одержаний 3,3,20,20-біс(етилендіокси)-17αгідрокси-19-норпрегна-5(10),9(11)-дієн формули (V) уводять у реакцію з пероксидом водню в суміші піридину й дихлорметану в присутності гексахлорацетону за відомим способом, vii) одержаний 3,3,20,20-біс(етилендіокси)-17αгідрокси-5,10-епокси-19-норпрегн-9(11)-ен формули (IV), що містить приблизно 1:1 суміш 5α,10α- і 5β,10β-епоксидів, виділяють з розчину і вводять у реакцію з реактивом Гриньяра, одержаним з 4бром-N,N-диметиланіліну в тетрагідрофурані в присутності каталізатора, що є хлоридом міді(І), без розділення ізомерів за відомим способом, viii) одержаний 3,3,20,20-біс(етилендіокси)5α,17α-дигідрокси-11β-[4-(Ν,Ν-диметиламіно)феніл]-19-норпрегн-9(11)-ен формули (III) вводять у реакцію з гідросульфатом калію у воді за відомим способом, іх) одержаний 11β-[4-(N,N-диметиламіно)феніл]-17α-гідрокси-19-норпрегн-4,9-дієн-3,20-діон формули (II) ацетилюють оцтовим ангідридом у присутності перхлорної кислоти за відомим способом, і нарешті х) несольватовану сполуку формули (І) виділяють з одержаної сполуки формули (І), що містить сольват, у суміші 1:1 етанол/вода при 70°С. Синтез сполуки формули (І) був уперше описаний у патенті US 4,954,490, виходячи з 3метокси-19-норпрегна-1,3,5(10),17(20)-тетраену. Спочатку окисленням 17(20)-подвійного зв'язку тетраоксидом осмію синтезують 17α,20α-діол, який перетворюють на 3-метокси-19-норпрегна-2,5(10)дієн-17α,20α-діол відновленням за Берчем. Потім за допомогою піридиній триброміду формують 4,9дієнову структуру з одержанням 17α,20αдигідрокси-19-норпрегна-4,9-дієн-3-ону, який окислюють оксалілхлоридом, одержуючи 17α-гідрокси19-норпрегна-4,9-дієн-3,20-діон. Потім синтезують 3,3,20,20-біс(етилендіокси)-19-норпрегна5(10),9(11)-дієн-17α-ол за допомогою одержання кеталю, й одержану сполуку вводять у реакцію з мета-хлорпербензойною кислотою, одержуючи 5α,10α-епокси-3,3,20,20-біс(етилендіокси)-19норпрегн-9(11)-ен-17α-ол. Останній перетворюють на 3,3,20,20-біс(етилендіокси)-5α,17α-дигідрокси11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегн9(11)-ен реакцією Гриньяра з п-(N,N 7 диметиламіно)-фенілмагнійбромідом у присутності каталізатора СuСІ, і нарешті одержують сполуку формули (І) за допомогою ацилування сумішшю оцтового ангідриду й фосфорної кислоти. Це 10стадійний синтез, де загальний вихід складає 0,62%, унаслідок чого він непридатний для промислового виробництва вказаного активного інгредієнта. Згідно з патентом US 5,929,262, прегнановий бічний ланцюг синтезують так званим способом SNAP, який описаний у наступній публікації: J. Am. Chem. Soc, 112, 6449-6450 (1990). Вихідною речовиною в даному синтезі є 3,3-(етилендіокси)норандрост-5(10),9(11)-дієн-17-он, який спочатку перетворюють на 17α-гідрокси,17β-ціангідрин. Останній уводять у реакцію з хлор-(хлорметил)диметилсиланом у присутності 4-(N,Nдиметиламіно)-піридину, одержуючи 17β-ціано17α-[(хлорметил)-диметилсиліл]-естра-5(10),9(11)дієн, який перетворюють на 17α-гідрокси-19норпрегн-4,9-дієн-3,20-діон внутрішньомолекулярним приєднанням у присутності літій ди-третбутилбіфенілу з подальшою взаємодією одержаного продукту з соляною кислотою. 17α-Гідрокси19-норпрегн-4,9-дієн-3,20-діон без додаткового очищення перетворюють на 3,3,20,20біс(етилендіокси)-17α-гідрокси-19-норпрегн5(10),9(11)-дієн реакцією з етиленгліколем і триметилортоформатом у присутності каталітичної кількості п-толуолсульфокислоти. Наступною стадією є окислення 5(10)-подвійного зв'язку в епоксид 30% пероксидом водню у присутності гексафторацетону й динатрійфосфату. Потім одержують 3,3,20,20-біс(етилендіокси)-5α,17α-дигідрокси-11β[4-(N,N-диметиламіно)-феніл]-19-норпрегн-9-ен реакцією Гриньяра з п-(N,N-диметиламіно)фенілмагнійбромідом у присутності каталізатора СиСІ, і синтезують сполуку формули (І) ацилуванням трифтороцтовим ангідридом і оцтовою кислотою у присутності каталізатора, що являє собою птолуолсульфокислоту. Реактиви, що використовуються на перших стадіях даного 9-стадійного процесу, є небезпечними з погляду охорони довкілля (для синтезу ціангідрину використовуються ціаніди лужних металів і металевий літій), і температура реакції складає -70°С, що невигідно в промисловому виробництві. Загальний вихід даного синтезу дорівнює 13%. У заявці на патент WO 2004/078709 описана наступна модифікація наведеного вище процесу: з одержаного згаданим вище способом 17αгідрокси-19-норпрегн-4,9-дієну спочатку синтезують 17α-ацетокси похід ну реакцією з сумішшю оцтової кислоти і трифтороцтового ангідриду. Наступна стадія є утворенням кеталю з оксо-групи в положенні 3 реакцією з етиленгліколем і триетилортоформатом у присутності птолуолсульфокислоти з одержанням 3,3(етилендіокси)-17α-ацетокси-19-норпрегна5(10),9(11)-дієн-20-ону. Одержаний продукт перетворюють на 5α,10α-епоксидну похідну взаємодією з 30% пероксидом водню у присутності гексафторацетону й динатрійгідрофосфату, й одержують 5α-гідрокси-17α-ацетокси-3,3-(етилендіокси)-11β[4-(N,N-диметиламіно)-феніл]-19-норпрегн-9(10) 94269 8 ен-20-он реакцією Гриньяра з використанням лише 2 еквівалентів реагенту, на відміну від згаданих вище процесів Кінцевий продукт формули (І) одержують гідролізом з використанням розбавленої оцтової кислоти. Синтез 13-етильного аналога сполуки формули (І) описаний у наступній публікації: Steroids 63, 50-57 (1998). Вихідною речовиною для даного синтезу служить левоноргестрел (17α-етиніл-17βгідрокси-13-етил-гон-4-ен-3-он), і послідовність реакцій наступна: спочатку утворюється 3,3(етилендіокси)-кеталь, з якого синтезують 17αетиніл-17β-гідрокси-13-етил-гон-4,9-діен-3-он реакцією з піридиній трибромідом через Δ5(10)-похідну. Потім одержують 17β-нітроксипохідну, після чого здійснюють її реакцію з сумішшю мурашиної кислоти й диметилформаміду в присутності ацетату ртуті, одержуючи 17α-формілокси-13-етил-18,19динорпрегн-4,9-дієн-3,20-діон, який гідролізують гідрокарбонатом калію з одержанням 17α-гідрокси13-етил-18,19-динорпрегна-4,9-дієн-3,20-діону, й останній перетворюють на 3,3,20,20біс(етилендіокси)похідну. Подальші стадії синтезу сполуки формули (І) такі самі, як описані вище (утворення епоксиду, реакція Гриньяра, гідроліз кеталю й ацилування). Вихід у синтезі 17β-нітрокси похідної й утворенні бічного ланцюга складає 29%, загальний вихід синтезу дорівнює 3,5%. Додатковим недоліком даного способу є те, що проміжні сполуки даного синтезу очищають колонковою хроматографією, що дуже дорого в промисловому масштабі. У наступній публікації: Bioorg. Med. Chem. Lett., 1997, 2229-2234, - описаний синтез 17αетиніл похідної й 5α,10α-епоксиду з нього, виходячи з 3,3-(етилендіокси)-19-норандроста5(10),9(11)-дієн-17-ону - який також використовується як вихідна речовина у способі за даним винаходом. Спосіб синтезу прегнанового бічного ланцюга в серії кортикоїдів - описаний у патенті US 4,041,055, згідно з яким 21-(фенілсульфініл)прегнанову похідну одержують з 17α-етиніландростанової похідної взаємодією з фенілсульфеніл-хлоридом у присутності триетиламіну, з подальшим приєднанням за Міхаелем, одержуючи 20-метокси-21-(фенілсульфініл)похідну. Останню вводять у реакцію з триметилфосфітом, одержуючи похідну 17α-гідрокси-20-кето-прегнану, й одержують 17α-гідрокси-20-кето-прегнан гідролізом у кислому середовищі. Відомо, що 3-(етилендioкси)-17α-етиніл-17βгідрокси-естра-5(10),9(11)-дієн формули (IX) можна синтезувати з 3-(етилендіокси)-естра5(10),9(11)-дієн-17-ону формули (X), який є промисловим продуктом, легко доступним у великих кількостях. Основою даного винаходу є виявлення того, що новий 3-(етилендіокси)-21(фенілсульфініл)-19-норпрегна5(10),9(11),17(20),20-тетраен формули (VIII) можна синтезувати, виходячи з 3-(етилендіокси)-17αетиніл-17β-гідрокси-естра-5(10),9(11)-дієну формули (IX) реакцією з фенілсульфінілхлоридом у присутності триетиламіну й оцтової кислоти з хорошим виходом і при вищій температурі, ніж опи 9 сано в патенті US 4,041,055 (-70°С). Новий 3(етилендіокси)-17α-гідрокси-20-метокси-19норпрегна-5(10),9(11),20-триєн формули (VII) можна одержати зі сполуки формули (VIII) додаванням метанолу з подальшою реакцією з триметилфосфітом. Новий 3-(етилендіокси)-17α-гідрокси-19норпрегна-5(10),9(11)-дієн-20-он формули (VI) синтезують з 20-метоксипохідної гідролізом із застосуванням соляної кислоти. Відомий 3,3,20,20біс(етилендіокси)-17α-гідрокси-19-норпрегна5(10),9(11)-дієн формули (V) одержують зі сполуки формули (VI) по реакції утворення кеталю з етиленгліколем у присутності триметилортоформату й п-толуолсульфокислоти. Цільовий продукт формули (І) синтезують зі сполуки формули (V) у 4 стадії, але потрібне виділення лише 2 проміжних сполук. Спочатку синтезують 5α,10α-епоксид формули (IV), потім його перетворюють на 5α-гідрокси11-[4-(N,N-диметиламіно)-феніл]похідну формули (III) реакцією Гриньяра у присутності каталізатора СuСІ. Після гідролізу в кислому середовищі одержують 17α-гідрокси-11β-[4-(N,N-диметиламіно)феніл]-прегна-4,9-дієн-3,20-діон формули (II), і останній ацилюють сумішшю оцтового ангідриду і перхлорної кислоти, одержуючи цільову сполуку формули (І), яку переводять у несольватовану форму. Спосіб за даним винаходом можна переважно здійснювати за допомогою взаємодії 3(етилендіокси)-естра-5(10),9(11)-дієн-17-ону формули (X) з ацетилідом калію - одержаним in situ з трет-бутоксиду калію й ацетилену - в сухому тетрагідрофурані при температурі між -5 і +5°С, переважно між 0 і -2°С. Одержаний 3-(етилендіокси)17α-етиніл-17β-гідрокси-естра-5(10),9(11)-дієн формули (IX) уводять у реакцію в дихлорметановому розчині з розчином 1,3 еквіваленту фенілсульфенілхлориду в хлороформі при температурі між -10 і +5°С, переважно між 0 і -5°С, у присутності 1,3 еквіваленту триетиламіну і 1,2 еквіваленту оцтової кислоти. Одержаний 3-(етилендіокси)-21(фенілсульфініл)-19-норпрегн5(10),9(11),17(20),20-тетраен формули (VIII) уводять у реакцію спочатку з 0,5 еквіваленту метоксиду натрію в метанолі, потім з 1,1 еквіваленту триметилфосфату при температурі між 50 і 60°С, переважно між 62 і 64°С. Одержаний 3(етилендіокси)-17α-гідрокси-20-метокси-19норпрегн-5(10),9(11),20-триєн формули (VII) гідролізують з використанням 0,08 еквіваленту хлороводню в метанолі при температурі між 20 і 25°С. Одержаний 3-(етилендіокси)-17α-гідрокси-19норпрегн-5(10),9(11)-дієн-20-он формули (VI) уводять у реакцію з 10 еквівалентами етиленгліколю й 6 еквівалентами триметилортоформату в дихлорметані у присутності п-толуолсульфокислоти при температурі між 20 і 25°С. Одержаний 3,3,20,20біс(етилендіокси)-17α-гідрокси-19-норпрегн5(10),9(11)-дієн формули (V) уводять у реакцію з 5 еквівалентами 50% розчину пероксиду водню в суміші піридину й дихлорметану у присутності 0,25 еквіваленту гексахлорацетону при температурі між -10 і +10сС, переважно між 0 і -2°С. Одержаний 3,3,20,20-біс(етилендіокси)-17α-гідрокси-5,10епокси-19-норпрегн-9(11)-ен формули (IV), що міс 94269 10 тить 55:45 суміш 5α, 10α- і 5β,10β-епоксидів, уводять у реакцію на наступній стадії без очищення й розділення ізомерів. Суміш епоксидів формули (IV) уводять у реакцію з 5 еквівалентами 4-(N,Nдиметиламіно)-фенілмагнійброміду - одержаного з 4-бром-N,N-диметиланіліну й магнію - в тетрагідрофурані у присутності каталізатора СuСІ при температурі між 15 і 20°С. Одержаний 3,3,20,20біс(етилендіокси)-5α,17α-дигідрокси-11β-[4-(N,Nдиметиламіно)-феніл]-19-норпрегн-9(11)-ен формули (III) вводять у реакцію з 2,5 еквівалентами гідросульфату калію у воді при температурі між 0 і 5°С, потім реакційну суміш екстрагують дихлорметаном. Одержаний розчин 11β-[4-(N,Nдиметиламіно)-феніл]-17α-гідрокси-19-норпрегн4,9-дієн-3,20-діону формули (II) в дихлорметані використовують безпосередньо на останній стадії синтезу, при ацилуванні 17-гідрокси групи. Розчин сполуки формули (II) вводять у реакцію з 10 еквівалентами оцтового ангідриду у присутності 1,5 еквіваленту 70% перхлорної кислоти при температурі між -10 і -40°С, переважно між -25 і -30°С протягом 1год. Одержаний сирий 17α-ацетокси-11β-[4(N,N-диметиламіно)-феніл]-19-норпрегн-4,9-дієн3,20-діон формули (І) перекристалізують з ізопропанолу, потім несольватовану сполуку виділяють з одержаної сполуки формули (І), що містить сольват, у 1:1 суміші етанолу й води. Переваги даного винаходу полягають у наступному: 1) Спосіб можна здійснювати в промисловому масштабі, використовуючи комерційно доступну вихідну речовину. 2) Спосіб включає 9 стадій, але потрібне виділення всього 7 проміжних сполук. 3) Для серії норстероїдів застосований новий спосіб з використанням фенілсульфенілхлориду в синтезі бічного ланцюга. З погляду вживання в промисловості, перевага цього полягає в тому, що дану реакцію проводять через нові проміжні сполуки формул (VIII) і (VII) при температурі між 0 і 5°С, замість температури -70°С, яка застосовувалася для синтезу аналогічних сполук згідно з літературними даними. 4) Розділення суміші ізомерів 5α, 10α- і 5β,10βепоксидів сполуки формули (IV) не є необхідним, оскільки побічні продукти, що утворюються при синтезі, можна легко відокремити на наступній стадії. 5) Несольватований продукт одержують у менш небезпечному розчиннику, а саме в суміші етанолу й води 1:1 при 70°С, в порівнянні з легкозаймистим, вибухонебезпечним, непридатним у промисловості діетиловим ефіром, вживання якого описане в літературі. На Фіг.1 подана формула (І). На Фіг.2 подана формула (II). На Фіг.3 подана формула (III). На Фіг.4 подана формула (IV). На Фіг.5 подана формула (V). На Фіг.6 подана формула (VI). На Фіг.7 подана формула (VII). На Фіг.8 подана формула (VIII). На Фіг.9 подана формула (IX). На Фіг.10 подана формула (X). 11 Спосіб за даним винаходом проілюстрований наступними необмежуючими прикладами. Приклад 1 3-(Етилендіокси)-17α-етиніл-17β-гідроксиестра-5(10),9(11)-дієн (IX) Tpeт-бутоксид калію (60г) розчиняли в сухому тетрагідрофурані (1500мл) в атмосфері азоту, і через суміш барботували ацетилен при 20°С протягом 30хвил., потім розчин охолоджували до 0-(2)°С і продовжували барботувати ацетилен протягом ще 30хвил. Потім додавали сполуку формули (X) (119,4г, 0,38моль), продовжуючи барботувати ацетилен. Одержану реакційну суміш перемішували 1год., і через суміш барботували азот для видалення надлишку ацетилену. Додавали насичений розчин хлориду амонію (750мл), і реакційну суміш перемішували 10хвил. Органічний шар відокремлювали й водну фазу екстрагували тетрагідрофураном (300мл). Об'єднані органічні шари промивали насиченим розчином хлориду амонію (150мл), концентрували до об'єму 600мл і виливали в суміш води й льоду (4л). Одержану суміш перемішували 30хвил., кристалічний продукт, що випав у осад, фільтрували й сушили при 40°С, одержуючи 122,8г (95%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Приклад 2 3-(Етилендіокси)-21-(фенілсульфініл)-19норпрегна-5(10),9(11),17(20),20-тетраен (VIII) До суспензії сполуки формули (IX) (122,5г, 0,36моль), триетиламіну (151мл) і оцтової кислоти (24,6мл) у дихлорметані (2200мл) додавали по краплях розчин фенілсульфенілхлориду (67,9г, 0,47моль) у хлороформі (170мл), підтримуючи температуру між 0 і -5°С. Реакційну суміш перемішували 10хвил., потім додавали воду (250мл) і метанол (100мл). Органічний шар відокремлювали, промивали 1Н соляною кислотою й водою, сушили над сульфатом натрію й концентрували до об'єму 185мл. До залишку додавали діізопропіловий ефір (120мл) і суміш охолоджували до 5°С. Кристали, що випали в осад, фільтрували й сушили при температурі, нижчій за 60°С, одержуючи 144г (88%) указаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Температура плавлення: 176-180°С. Приклад 3 3-(Етилендіокси)-17α-гідрокси-20-метокси-19норпрегна-5(10),9(11),20-триен (VII) До розчину метоксиду натрію (8,67г, 0,16моль) у метанолі (4320мл) додавали сполуку формули (VIII) (144г, 0,321моль). Реакційну суміш перемішували при 62-64°С протягом 3год., потім додавали триметилфосфіт (42мл, 0,35моль), і перемішування продовжували при 62-64°С протягом 2год. Реакційну суміш охолоджували до 20°С і виливали в розчин хлориду натрію (288г) у воді (14л). Кристалічний продукт, що випав в осад, фільтрували, промивали водою й сушили при 40°С, одержуючи 80,2г (67%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Температура плавлення: 128-132°С. 94269 12 Приклад 4 3-(Етилендіокси)-17α-гідрокси-19-норпрегна5(10),9(11)-дієн-20-он (VI) Суспензію сполуки формули (VII) (80г, 0,27моль) у суміші 1Н соляної кислоти (18мл) і метанолу (800мл) перемішували при 20-25°С протягом 40хвил., потім додавали воду (800мл), що має температуру 10°С, і реакційну суміш перемішували 30хвил. Кристалічний продукт, що випав в осад, фільтрували, промивали водою й сушили при 60°С, одержуючи 73г (95%) вказаної в заголовку сполуки. Чистота продукту складала 98% (згідно з даними ВЕРХ). Температура плавлення: 140-140°С. Приклад 5 3,3,20,20-Біс(етилендіокси)-17α-гідрокси-19норпрегна-5(10),9(11)-дієн (V) До розчину сполуки формули (VI) (73г, 0,2моль) у дихлорметані (580мл) додавали етиленгліколь (126мл, 2,26моль), триметилортоформат (132мл, 1,21моль) і п-толуолсульфокислоту (4,85г). Реакційну суміш перемішували при 2025°С протягом 2год., потім додавали насичений розчин гідрокарбонату натрію (380мл), і перемішування продовжували протягом 30хвил. Органічний шар відокремлювали, промивали водою (400мл), сушили над сульфатом натрію й концентрували до об'єму 175мл. Додавали метанол (230мл), що містить 0,5% піридину, й розчин концентрували до об'єму 175мл для видалення дихлорметану. Одержану суспензію кристалічної речовини охолоджували до 0-2°С, перемішували 2год., продукт, що випав в осад, фільтрували й сушили при 50°С, одержуючи 71,5г (87%) вказаної в заголовку сполуки. Чистота продукту складала 98% (згідно з даними ВЕРХ). Температура плавлення: 172-174°С. Приклад 6 3,3,20,20-Біс(етилендіокси)-17α-гідрокси5α,10α-епокси-19-норпрегн-9(11)-ен (IV) В атмосфері азоту до розчину сполуки формули (V) (71г, 0,176моль) в дихлорметані (360мл) і піридині (1,8мл) додавали гексахлорацетон (6,5мл, 0,043моль) і 50% розчин пероксиду водню (51,5мл, 0,9моль) при 0-(-2)°С, і реакційну суміш перемішували при 0-2°С протягом 3год. Потім додавали дихлорметан (1800мл) і крижану воду (1440мл), що містить тіосульфат натрію (160г), й одержану суміш перемішували при 0-10°С протягом 30хвил. Органічний шар відокремлювали, промивали водою (300мл), сушили над сульфатом натрію й концентрували при зниженому тиску, одержуючи 83г продукту, що є сумішшю 5α, 10α- і 5β,10βепоксидів 55:45. Одержану сиру суміш епоксидів використовували в наступній стадії без подальшого очищення. Приклад 7 3,3,20,20-Біс(етилендіокси)-5α,17α-дигідрокси11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегн9(11)-ен (III) Суміш магнієвих стружок (23,3г, 0,97моль) і 1,2-диброметану (0,35мл) у тетрагідрофурані (44мл) перемішували при 40-50°С протягом 5хвил., потім реакційну суміш охолоджували до 15°С і додавали розчин 4-бром-N,N 13 диметиланіліну (176г, 0,88моль) у тетрагідрофурані (1050мл) з такою швидкістю, щоб температура не піднімалася вище 15°С. Потім реакційну суміш перемішували при 16-18°С протягом 2 год для одержання розчину реактиву Гриньяра. Суміш епоксидів (74г, 0,176моль) - одержану на попередній стадії - розчиняли в дихлорметані (300мл) і додавали хлорид міді(І) (4г). Реакційну суміш перемішували при 20-25°С протягом 15хвил., потім охолоджували до 15°С і додавали розчин реактиву Гриньяра протягом 45хвил. Реакційну суміш перемішували при 20-25°С протягом 2год., потім виливали у воду (1400мл), що містить хлорид амонію (170г). Органічний шар відокремлювали, водну фазу екстрагували дихлорметаном (2×200мл), об'єднані органічні шари промивали водою (5×500мл), сушили над сульфатом натрію й концентрували. Залишок розчиняли в етилацетаті (200мл) при температурі кипіння, розчин охолоджували до -5°С, й одержану суспензію кристалічної речовини витримували при цій температурі протягом 5год. Продукт, що випав в осад, фільтрували й сушили при 60°С, одержуючи 41,7г (46%) указаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно зданими ВЕРХ). Температура плавлення: 228-232°С. Приклад 8 11β-[4-(N,N-Диметиламіно)-феніл]-17αгідрокси-19-норпрегна-4,9-дієн-3,20-діон (II) До розчину гідросульфату калію (27,5г, 0,2моль) у воді (230мл) додавали сполуку формули (III) (41,7г, 0,077моль) при +5°С, і реакційну суміш перемішували при тій же температурі протягом 4год. Потім додавали дихлорметан (230мл) і розчин гідроксиду калію (4,3г) у воді (40мл), органічний шар відокремлювали й сушили над сульфатом натрію. Додавали силікагель (7,5г) і перемішували дихлорметановий розчин при 20-25°С протягом 30хвил., потім фільтрували. Фільтрат концентрували до об'єму 100мл й одержаний таким чином розчин - що містить 11β-[4-(N,Nдиметиламіно)-феніл]-17α-гідрокси-19-норпрегна4,9-дієн-3,20-діон - використовували на наступній стадії. Приклад 9 17α-Ацетокси-11В-[4-(N,N-диметиламіно)феніл]-9-норпрегна-4,9-дієн-3,20-діон (І) Оцтовий ангідрид (73мл, 0,77моль) охолоджували до -10°С і додавали 70% перхлорну кислоту (10,8мл, 0,124моль). Одержаний таким чином розчин охолоджували до -30°С і додавали розчин сполуки формули (II) в дихлорметані (100мл) одержаний на попередній стадії - з такою швидкістю, щоб температура підтримувалася в діапазоні від -20 до -30°С, потім реакційну суміш перемішували при тій же температурі протягом 1год. Одержану суміш розбавляли дихлорметаном, охолодженим до 0°С (300мл) і виливали у воду (400мл), що містить ацетат натрію (10,25г, 0,125моль). Органічний шар відокремлювали, промивали водою (3x100мл), сушили над сульфатом натрію й концентрували при зниженому тиску. Одержану жовту сиропоподібну речовину кристалізували з ізопропанолу (150мл), одержуючи 27г вказаної в заголовку сполуки у вигляді сольвату, що містить 5-10% 94269 14 розчинника. Дану речовину розчиняли в етанолі (230мл) при 60°С, потім нагрівали до 70°С і додавали воду, яку піддали іонообміну, (260мл). Через одержаний таким чином розчин, температуру якого підтримували рівною 70°С, барботували азот протягом 14год. З розчину поступово осідав несольватований кристалічний продукт. Кристали фільтрували при 70°С, промивали водою, що має температуру 70°С, і сушили при 40°С, одержуючи 24г (66%) вказаної в заголовку сполуки. Чистота продукту складала 99% (згідно з даними ВЕРХ). Температура плавлення: 184-186°С. Приклад 10 3-(Етилендіокси)-17α-етиніл-17β-гідроксиестра-5(10),9(11)-дієн (IX) Трет-бутоксид калію (22,6кг) розчиняли в сухому тетрагідрофурані (565л) в атмосфері азоту, і через суміш барботували ацетилен при 20°С протягом 30хвил., потім розчин охолоджували до 0-(2)°С і продовжували барботувати ацетилен протягом ще 30хвил. Потім додавали сполуку формули (X) (45кг, 143моль), продовжуючи барботувати ацетилен. Одержану реакційну суміш перемішували 1год., і через суміш барботували азот для видалення надлишку ацетилену. Додавали насичений розчин хлориду амонію (280л), і реакційну суміш перемішували 20хвил. Органічний шар відокремлювали й водну фазу екстрагували тетрагідрофураном (110л). Об'єднані органічні шари промивали насиченим розчином хлориду амонію (55л), концентрували до об'єму 220л і виливали в суміш води і льоду (1500л). Одержану суміш перемішували 30хвил., кристалічний продукт, що випав в осад, фільтрували й сушили при 40°С, одержуючи 47,4кг (97,2%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Приклад 11 3-(Етилендіокси)-21-(фенілсульфініл)-19норпрегна-5(10),9(11),17(20),20-тетраен (VIII) До суспензії сполуки формули (IX) (40кг, 117моль), триетиламіну (49л) і оцтової кислоти (8л) у дихлорметані (720л) додавали по краплях розчин феніл-сульфенілхлориду (22,1кг, 153моль) у хлороформі (55л), підтримуючи температуру між 0 і -5°С. Реакційну суміш перемішували 10хвил., потім додавали воду (80л) і метанол (32л). Органічний шар відокремлювали, промивали 1Н соляною кислотою і водою, сушили над сульфатом натрію й концентрували до об'єму 28л. Дозалишку додавали діізопропіловий ефір (40л) і суміш охолоджували до 5°С. Кристали, що випали в осад, фільтрували й сушили при температурі нижчій за 60°С, одержуючи 45,8кг (87,3%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Температура плавлення: 176-180°С. Приклад 12 3-(Етилендіокси)-17α-гідрокси-20-метокси-19норпрегна-5(10),9(11),20-триен (VII) До розчину метоксиду натрію (1,2кг, 22,2моль) у метанолі (600л) додавали сполуку формули (VIII) (20кг, 44,6моль). Реакційну суміш перемішували при 62-64°С протягом 3год., потім додавали триметилфосфіт (5,8л, 48,6моль), і перемішування 15 продовжували при 62-64°С протягом 2год. Реакційну суміш охолоджували до 20°С і виливали в розчин хлориду натрію (40кг) у воді (1940л). Кристалічний продукт, що випав в осад, фільтрували, промивали водою й сушили при 40°С, одержуючи 12,5кг (75,3%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Температура плавлення: 128-132°С. Приклад 13 3-(Етилендіокси)-17α-гідрокси-19-норпрегна5(10),9(11)-дієн-20-он (VI) Суспензію сполуки формули (VII) (56кг, 150моль) у суміші 1Н соляної кислоти (12,6л) і метанолу (560л) перемішували при 20-25°С протягом 40хвил., потім додавали воду (560л), що має температуру 10°С, і реакційну суміш перемішували 30хвил. Кристалічний продукт, що випав в осад, фільтрували, промивали водою й сушили при 60°С, одержуючи 51,1кг (95%) вказаної в заголовку сполуки. Чистота продукту складала 98% (згідно з даними ВЕРХ). Температура плавлення: 140-140°С. Приклад 14 3,3,20,20-Біс(етилендіокси)-17α-гідрокси-19норпрегна-5(10),9(11)-дієн (V) До розчину сполуки формули (VI) (49,3кг, 137моль) у дихлорметані (390л) додавали етиленгліколь (85л, 1527моль), триметилортоформат (89л, 818моль) і п-толуолсульфокислоту (3,28кг). Реакційну суміш перемішували при 20-25°С протягом 2год., потім додавали насичений розчин гідрокарбонату натрію (260л), і перемішування продовжували протягом 30хвил. Органічний шар відокремлювали, промивали водою (270л), сушили над сульфатом натрію й концентрували до об'єму 118л. Додавали метанол (150л), що містить 0,5% піридину, й потім упарювали для видалення дихлорметану. Одержану суспензію кристалічної речовини охолоджували до 0-(-2)°С, перемішували 2год., продукт, що випав в осад, фільтрували й сушили при 50°С, одержуючи 48,33кг (87%) вказаної в заголовку сполуки. Чистота продукту складала 98% (згідно з даними ВЕРХ). Температура плавлення: 172-174°С. Приклад 15 3,3,20,20-Біс(етилендіокси)-17α-гідрокси5α,10α-епокси-19-норпрегн-9(11)-ен (IV) В атмосфері азоту до розчину сполуки формули (V) (20кг, 49,7моль) у дихлорметані (100л) і піридині (0,5л) додавали гексахлорацетон (1,8л, 12моль) і 50% розчин пероксиду водню (14,5л, 253моль) при 0-(-2)°С, і реакційну суміш перемішували при 0-2°С протягом 3год. Потім додавали дихлорметан (500л) і крижану воду (400л), що містить тіосульфат натрію (50кг), і одержану суміш перемішували при 0-10°С протягом 30хвил. Органічний шар відокремлювали, промивали водою (85л), сушили над сульфатом натрію й концентрували при зниженому тиску, одержуючи 23,3кг продукту, що є сумішшю 5α, 10α- і 5β,10β-епоксидів 55:45. Одержану сиру суміш епоксидів використовували в наступній стадії без подальшого очищення. 94269 16 Приклад 16 3,3,20,20-Біс(етилендіокси)-5α,17α-дигідрокси11β-[4-(N,N-диметиламіно)-феніл]-19-норпрегн9(11)-ен (III) Суміш магнієвих стружок (6,55кг, 272моль) і 1,2-диброметану (0,1л) у тетрагідрофурані (13л) перемішували при 40-50°С протягом 5хвил., потім реакційну суміш охолоджували до 15°С і додавали розчин 4-бром-N,N-диметиланіліну (49,5кг, 247моль) у тетрагідрофурані (300л) з такою швидкістю, щоб температура не піднімалася вище 15°С. Потім реакційну суміш перемішували при 16-18°С протягом 2 год для одержання розчину реактиву Гриньяра. Суміш епоксидів (20,8кг, 49,7моль) - одержану на попередній стадії - розчиняли в дихлорметані (85л) і додавали хлорид міді(І) (1,12кг). Реакційну суміш перемішували при 20-25°С протягом 15хвил., потім охолоджували до 15°С і додавали розчин реактиву Гриньяра протягом 45хвил. Реакційну суміш перемішували при 20-25°С протягом 2год., потім виливали у воду (400л), що містить хлорид амонію (48кг). Органічний шар відокремлювали, водну фазу екстрагували дихлорметаном (2x60л), об'єднані органічні шари промивали водою (5×140л), сушили над сульфатом натрію й концентрували. Залишок розчиняли в етилацетаті (60л) при температурі кипіння, розчин охолоджували до -5°С, й одержану суспензію кристалічної речовини витримували при цій температурі протягом 5год. Продукт, що випав в осад, фільтрували й сушили при 60°С, одержуючи 12,6кг (47%) вказаної в заголовку сполуки. Чистота продукту складала мінімум 95% (згідно з даними ВЕРХ). Температура плавлення: 228-232°С. Приклад 17 11β-[4-(N,N-Диметиламіно)-феніл]-17αгідрокси-19-норпрегна-4,9-дієн-3,20-діон (II) До розчину гідросульфату калію (7,12кг, 51,8моль) у воді (60л) додавали сполуку формули (III) (11,7кг, 21,7моль) при +5°С, і реакційну суміш перемішували при тій же температурі протягом 4год. Потім додавали дихлорметан (60л) і розчин гідроксиду калію (1,11кг) у воді (10л), органічний шар відокремлювали й сушили над сульфатом натрію. Додавали силікагель (2кг) і перемішували дихлорметановий розчин при 20-25°С протягом 30хвил., потім фільтрували. Фільтрат концентрували до об'єму 26л, і одержаний таким чином розчин використовували на наступній стадії. Приклад 18 17α-Ацетокси-11β-[4-(N,N-диметиламіно)феніл]-19-норпрегна-4,9-дієн-3,20-діон (І) Оцтовий ангідрид (18,9л, 199моль) охолоджували до -10°С і додавали 70% перхлорну кислоту (2,8л, 32,1моль). Одержаний таким чином розчин охолоджували до -30°С і додавали розчин сполуки формули (II) в дихлорметані (26л) - одержаний на попередній стадії - з такою швидкістю, щоб температура підтримувалася в діапазоні від -20 до 30°С, потім реакційну суміш перемішували при тій же температурі протягом 1год. Одержану суміш розбавляли дихлорметаном, охолодженим до 0°С (80л) і виливали у воду (100л), що містить ацетат натрію (2,65кг, 32,4моль). Органічний шар відо 17 кремлювали, промивали водою (3×25л), сушили над сульфатом натрію й концентрували при зниженому тиску. Одержану жовту сиропоподібну речовину кристалізували з ізопропанолу (40л), одержуючи 7кг вказаної в заголовку сполуки у вигляді сольвату, що містить 5-10% розчинника. Дану речовину розчиняли в етанолі (60л) при 60°С, потім нагрівали до 70°С і додавали воду, яку піддали іонообміну, (67л). Через одержаний таким чином 94269 18 розчин, температуру якого підтримували рівною 70°С, барботували азот протягом 14год. З розчину поступово осідав несольватований кристалічний продукт. Кристали фільтрували при 70°С, промивали водою, що має температуру 70°С, і сушили при 40°С, одержуючи 6,6кг (64%) вказаної в заголовку сполуки. Чистота продукту складала 99% (згідно з даними ВЕРХ). Температура плавлення: 184-186°С. 19 Комп’ютерна верстка Т. Чепелева 94269 Підписне 20 Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюIndustrial process for the synthesis of 17b-acetoxy-11b-[4-(n,n-dimethyl-amino)- phenyl]-19-norpregna-4,9-diene-3,20-dione and new intermediates of the process
Автори англійськоюDancsi Lajosne, Visky Gyoergy, Tuba Zoltan, Csoergei Janos, Molnar Csaba, Magyari Endrene
Назва патенту російськоюПромышленный способ синтеза несольватированного 17a-ацетокси-11b-[4-(n,n-диметиламино)-фенил]-19-норпрегна-4,9-диен-3,20-диона и промежуточные соединения по данному способу
Автори російськоюДанчи Лайошне, Вишки Дьйордь, Туба Зольтан, Чоргеи Янош, Мольнар Чаба, Мадьяри Эндрене
МПК / Мітки
МПК: C07J 31/00, C07J 41/00, C07J 71/00, C07J 21/00
Мітки: проміжні, синтезу, способом, даним, несольватованого, 17a-ацетокси-11b-[4-(n,n-диметиламіно)-феніл]-19-норпрегна-4,9-дієн-3,20-діону, сполуки, промисловий, спосіб
Код посилання
<a href="https://ua.patents.su/10-94269-promislovijj-sposib-sintezu-nesolvatovanogo-17a-acetoksi-11b-4-nn-dimetilamino-fenil-19-norpregna-49-diehn-320-dionu-jj-promizhni-spoluki-za-danim-sposobom.html" target="_blank" rel="follow" title="База патентів України">Промисловий спосіб синтезу несольватованого 17a-ацетокси-11b-[4-(n,n-диметиламіно)-феніл]-19-норпрегна-4,9-дієн-3,20-діону й проміжні сполуки за даним способом</a>
Попередній патент: Спосіб лікування запальних захворювань мигдаликів і глотки та фіксуюча пов`язка для його здійснення
Наступний патент: Відцентровий млин
Випадковий патент: Застосування капсул "фітовенол" як лікувально-профілактичного засобу з антитромботичною дією