Твердий фармацевтичний препарат, що містить ірбесартан, та способи його виготовлення
Номер патенту: 95274
Опубліковано: 25.07.2011
Автори: Яксе Рената, Бевеч Франчі, Врбінч Міха, Жупанчіч Сілво
Формула / Реферат
1. Твердий фармацевтичний препарат, що містить як активний інгредієнт ірбесартану гідрохлорид і необов’язково гідрохлоротіазид, а також містить манітол, низькозаміщену гідроксипропілцелюлозу та щонайменше одну змащуючу речовину, вибрану з поліетиленгліколю, тальку та гідрогенізованої касторової oлії.
2. Препарат за п. 1, який відрізняється тим, що ірбесартан гідрохлорид має середній розмір частинок, менший ніж 250 мкм.
3. Препарат за будь-яким із пп. 1, 2, який відрізняється тим, що ірбесартану гідрохлорид має максимальний діаметр 2000 мкм.
4. Препарат за будь-яким із пп. 1-3, який відрізняється тим, що ірбесартану гідрохлорид представлений в кількості 20-77 мас. % від загальної маси препарату.
5. Препарат за будь-яким із пп. 1-4, який відрізняється тим, що низькозаміщена гідроксипропілцелюлоза представлена в кількості 1-30 мас. % від загальної маси препарату.
6. Препарат за будь-яким із пп. 1-5, який відрізняється тим, що не містить сурфактантів.
7. Спосіб виготовлення препарату за будь-яким із пп. 1-6, який є способом вологої грануляції (А), що включає наступні стадії:
(I) отримання ірбесартану гідрохлориду, що має максимальний діаметр частинки не більше 2000 мкм,
(II) виготовлення суміші для пресування з використанням зволожувача, що містить спирт, та можливо додатково води, їхньої суміші або водної, спиртової або водної/спиртової гранулюючої рідини, шляхом
(а1) грануляції суміші одного або більше ексципієнту(ів) і зволожувача з отриманням грануляту, і (а2) додавання ірбесартану гідрохлориду і, можливо додаткового ексципієнту(ів) до грануляту з отриманням суміші для пресування;
(б1) грануляції суміші одного або більше ексцинієнту(ів), ірбесартану гідрохлориду і зволожувача з отриманням грануляту, і (б2) можливого додавання до грануляту додаткового ексципієнту(ів) з отриманням сумішідля пресування; або
(в1) грануляція суміші одного або більше ексципієнту(ів), частини ірбесартану гідрохлориду і зволожувача з отриманням грануляту, і (в2) додавання частини ірбесартану гідрохлориду, що залишилася і, можливо, додаткового екеципієнту(ів) до грануляту з отриманням суміші для пресування; і
(ІІІ) пресування суміші для пресування в бажану форму.
8. Спосіб за п. 7, який відрізняється тим, що як додатковий активний інгредієнт на стадії (ІІ), на будь-якій із стадій (а1) і/або (а2), (б1) і/або (б2), і (в1) і/або (в2) додають гідрохлоротіазид.
9. Спосіб виготовлення препарату за будь-яким із пп. 1-6, який є способом прямої грануляції (Б), що включає наступні стадії:
(І) отримання ірбесартану гідрохлориду, що має максимальний діаметр частинки не більше ніж 2000 мкм,
(ІІ`) змішування ірбесартану гідрохлориду і одного або більше ексципієпту(ів) з отриманням суміші для пресування, і
(ІІІ) пресування суміші для пресування в бажану форму.
10. Спосіб за п. 9, який відрізняється тим, що як додатковий активний інгредієнт на стадії (ІІ`) додають гідрохлоротіазид.
11. Спосіб за будь-яким із пп. 7-10, який додатково включає стадію (IV) нанесення покриття на пресований продукт, одержаний на стадії (ІІІ).
Текст
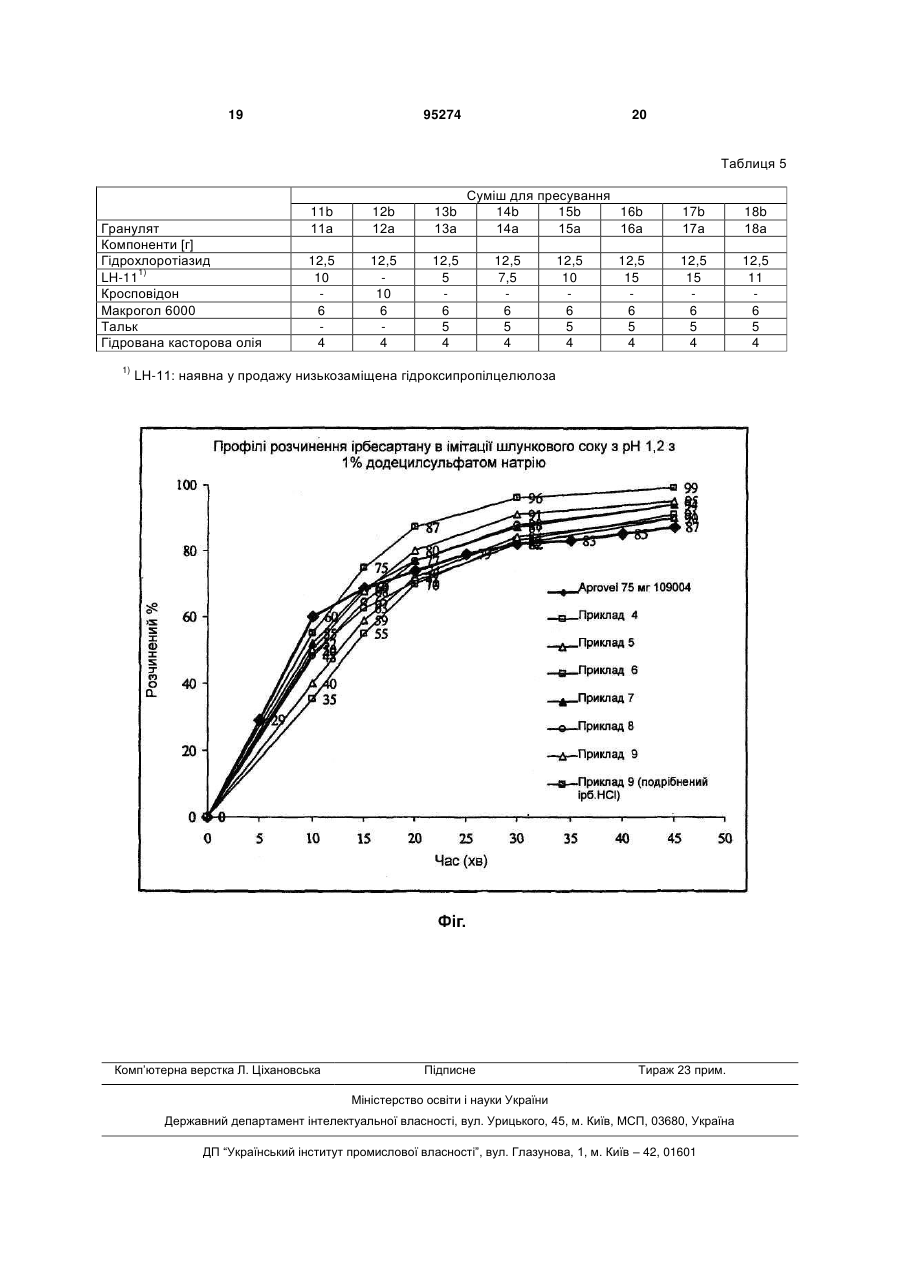
1. Твердий фармацевтичний препарат, що містить як активний інгредієнт ірбесартану гідрохлорид і необов’язково гідрохлоротіазид, а також містить манітол, низькозаміщену гідроксипропілцелюлозу та щонайменше одну змащуючу речовину, вибрану з поліетиленгліколю, тальку та гідрогенізованої касторової oлії. 2. Препарат за п. 1, який відрізняється тим, що ірбесартан гідрохлорид має середній розмір частинок, менший ніж 250 мкм. 3. Препарат за будь-яким із пп. 1, 2, який відрізняється тим, що ірбесартану гідрохлорид має максимальний діаметр 2000 мкм. 4. Препарат за будь-яким із пп. 1-3, який відрізняється тим, що ірбесартану гідрохлорид представлений в кількості 20-77 мас. % від загальної маси препарату. 5. Препарат за будь-яким із пп. 1-4, який відрізняється тим, що низькозаміщена гідроксипропілцелюлоза представлена в кількості 1-30 мас. % від загальної маси препарату. 6. Препарат за будь-яким із пп. 1-5, який відрізняється тим, що не містить сурфактантів. 2 (19) 1 3 95274 4 (ІІ`) змішування ірбесартану гідрохлориду і одного або більше ексципієпту(ів) з отриманням суміші для пресування, і (ІІІ) пресування суміші для пресування в бажану форму. 10. Спосіб за п. 9, який відрізняється тим, що як додатковий активний інгредієнт на стадії (ІІ`) додають гідрохлоротіазид. 11. Спосіб за будь-яким із пп. 7-10, який додатково включає стадію (IV) нанесення покриття на пресований продукт, одержаний на стадії (ІІІ). Область винаходу Винахід відноситься до твердої фармацевтичної композиції, яка містить як активний інгредієнт ірбесартан і/або його фармацевтично прийнятну сіль, зокрема ірбесартану гідрохлорид, один або в комбінації з сечогінним засобом, переважно гідрохлоротіазидом, і до способу її приготування. Зокрема, він (винахід) відноситься до композиції і способу, де активний інгредієнт зберігає свою структуру і стабільність. У переважному аспекті композиція не містить поверхнево-активну речовину. Попередній рівень техніки 2-бутил-3-[[2'-(1Н-тетразол-5-іл)[1,1'-біфеніл]4-іл]метил]-1,3-діазаспіро[4,4]-нон-1-ен-4-он (ірбесартан) є непептидним похідним тетразолу (емпірична формула C25H28N6O, молекулярна маса 428,5 г/моль) представленої нижче формули і володіє антагоністичною активністю відносно рецептора ангіотензину II першого типу (АТ1): чає його фармацевтично прийнятні солі без детального їх визначення. Переважні композиції містять, серед іншого, 20-70 мас. % ірбесартану і 0,26 мас. % поверхнево-активної речовини. Спосіб виготовлення пігулок, описаних в ЕР 0747050 А1, є водною грануляцією. WO 05/025566 відноситься до ірбесартан фармацевтичних препаратів для перорального введення, що мають покращені профілі розчинення, зокрема, 80 % або більше розчинення протягом 15 хвилин після введення дози і 90 % або більше розчинення протягом 30 хвилин після введення дози. Для досягнення цього завдання препарати готують шляхом вологої грануляції композицій, що містять, серед іншого, ірбесартан (який описаний у вигляді білого кристалічного порошку, який слабкорозчиний у спирті і Ch2Cl2 і нерозчинний у воді), спирт як зволожувач й інші інгредієнти, включаючи поверхнево-активну речовину, таку як Полоксамер 188®. У US 2005/0271720 А1 розкриті фармацевтичні композиції, що містять велику відносну кількість ірбесартану (більше 70 мас. %) і щонайменше один ексципієнт, такий як зв'язуюча речовина, поверхнево-активна речовина, розбавлювач, розпушувач, антиадгезивний засіб або змащуюча речовина. У переважному втіленні Полоксамер 188® (поверхнево-активна речовина) представлений в кількості 1,06-2,0 мас. %, і цей компонент також включають конкретні приклади. У WO 97/17064 описаний фармацевтично прийнятний висушений заморожуванням препарат, що складається з кристалічної фази і аморфної фази, і включає, щонайменше, один небілковий лікарський засіб, який додатково містить маніт і аланін в масовому відношенні від 0,1:1 до 1:1. Серед великої різноманітності відповідних небілкових лікарських засобів згадують ірбесартан як приклад класу антагоністів ангіотензину II. CN 1415298 відноситься до капсул ірбесартану, що складаються з ірбесартану, гідрохлоротіазиду, прежелатинізованого кукурудзяного крохмалю, лактози, мікрокристалічної целюлози, поперечно-зшитої карбоксиметилцелюлози натрію SiCb, стеарату магнію і полівінілпіролідону. Як правило, раніше специфічні фізичні й хімічні властивості ірбесартану, зокрема його низька розчинність у водних середовищах, приводили до виникнення проблем при виготовленні його препаратів, відповідних для ефективного перорального введення. Отже, існує необхідність в препаратах ірбесартану для ефективної пероральної доставки, що забезпечують відповідний час розпушування і/або відповідну розчинність, і/або профіль розчинення активного інгредієнта. Способи отримання ірбесартану описані, наприклад, в ЕР 0454511, WO 2004/007482, ЕР 0708103, ЕР 1089994, SI P-200500004, SI P200500132 і WO 03/050110. Отримання ірбесартану гідрохлориду (далі ірбесартан-HCl), наприклад, з вільного ірбесартану може бути легко здійснено фахівцем в даній області техніки, приклад відповідного способу описаний далі. Крім того, відповідні способи описані в заявках на патенти SI P-200400220 і SI P-200400292. У ЕР 0454511 А1 розкрито велику кількість різних N-заміщених гетероциклічних сполук, включаючи ірбесартан, і тверда фармацевтична композиція у формі пігулок, що містять ці сполуки. Ці пігулки також містять такі носії, як желатин, крохмаль, лактозу, стеарат магнію, тальк і аравійську камедь, і можуть бути покриті сахарозою, похідним целюлози або іншими відповідними речовинами. У ЕР 0747050 А1 описаний ірбесартан у вигляді рихлої речовини, що володіє відносно низькою об'ємною щільністю і щільністю утруски, що затрудняє розробку препарату, що містить значну кількість ліків (наприклад, 75-300 міліграм) в невеликій пігулці, порушуючи однорідність маси, твердість й інші бажані властивості пігулки. Визначення ірбесартану, наведене в даному посиланні, вклю 5 Додатково, бажано, щоб ці ефекти могли досягатися відносно препарату, що володіє покращеною властивістю оброблюваності, і/або того, що включає ексципієнти, які легко доступні при низькій вартості, і/або одержуваного економічно кращими технічними способами. Суть винаходу Таким чином, в даному винаході запропонований твердий фармацевтичний препарат, що містить як активний інгредієнт щонайменше один з наступного: ірбесартан і його фармацевтично прийнятні солі, і щонайменше один розпушувач. Добре показано, що в твердих лікарських формах поверхнево-активні речовини збільшують швидкість розчинення ліків. Це може бути слідством зволоження, що виникає в результаті збільшення площі поверхні, впливу на розчинність і коефіцієнт ефективної дифузії, або комбінації цих ефектів. Ці та інші переваги (наприклад, поліпшення розчинності, термодинамічної активності, дифузії і розпаду поверхнево-активної речовини) і їхній вплив на швидкість і ступінь абсорбції ліків, загалом, відомі. Проте, відповідно до кращого аспекту даного винаходу було несподівано виявлено, що застосування поверхнево-активної речовини може бути виключено в тому випадку, якщо присутній розпушувач. Отже, в кращому аспекті завдання даного винаходу полягає в рішенні вищеописаних проблем шляхом створення фармацевтичних препаратів, що не містять поверхнево-активну речовину. Відповідно до ще одного кращого аспекту, препарати за винаходом додатково містять як розбавлювач щонайменше один цукровий спирт. Відповідно до ще одного кращого аспекту препарати за винаходом містять як активний інгредієнт ірбесартан і/або його фармацевтично прийнятні солі, що мають середній розмір частинок активного інгредієнту менше ніж 250 мкм, причому максимальний діаметр складає 2000 мкм. Переважно, активний інгредієнт є щонайменше однією фармацевтично прийнятною сіллю ірбесартану, і найпереважніше ірбесартан-НСІ. Також препарат, можливо, включає сечогінний засіб, переважно гідрохлоротіазід (HCTZ hydrochlorothiazide). Короткий опис графічних матеріалів На Фіг. представлено порівняння профілів розчинення ірбесартану пігулок Aprovel 75 міліграм (лікарська форма, в даний час представлена на ринку) і Прикладів 4-9 (ядра пігулок (4с)-(9с)) за даним винаходом. Докладний опис винаходу У наступному описі, якщо точно не вказано інше, передбачається, що будь-яке посилання на ірбесартан включає його фармацевтично прийнятні солі, і особливо ірбесартан-НСІ. Тверді фармацевтичні препарати за винаходом містять ірбесартан як активний інгредієнт, і щонайменше один розпушувач. Переважно, вони додатково містять як розбавлювач щонайменше один цукровий спирт. Крім того, вони можуть, додатково містити інші ексципієнти і добавки. Пере 95274 6 важно, вони не містять поверхнево-активну речовину. Ірбесартан може бути представлений в кристалічний формі або некристалічній формі. Кристалічні форми включають безводні або гідратовані форми, переважно півторагідрати, такі як ірбесартану-НСІ півторагідрат. Не обмежуючі об'єм винаходу приклади способів отримання кристалічного ірбесартану розкриті в ЕР 0454511 В1, WO 2004/007482, ЕР 0708103 або ЕР 1089994. Некристалічні форми включають, наприклад, аморфний ірбесартан, який може бути одержаний відповідно до будь-якого відповідного відомого способу, наприклад шляхом упарювання, подрібнення, нагрівання, ліофілізації, сушки розпилюванням; конкретним прикладом є спосіб, описаний в WO 03/050110. Особливо переважні препарати містять ірбесартану-НСІ півторагідрат, оскільки виявлено, що такі препарати є дуже стабільними. Приклади фармацевтично прийнятних солей ірбесартану включають гідрогалогеніди, солі малеат, безилат, тартрат і лактат ірбесартану, і особливо переважним є ірбесартан-НСІ. У даному описі і прикладах вміст кристалізаційної води в ірбесартані, визначений за допомогою способу Карла Фішера, здійснюваного відповідно до Європейської Фармакопеї, включено, де це доречно, в приведені загальні кількості. У випадку якщо як активний інгредієнт використовується ірбесартан-НСІ, профіль розчинності і розпушування несподівано додатково поліпшується, і розчинність ірбесартану-НСІ в деяких розчинювальних середовищах, таких як 0,01 М НСІ або імітація шлункового соку (рН=1,2), є вищою в порівнянні з вільним ірбесартаном. Кращий препарат за даним винаходом є твердим фармацевтичним препаратом, що не містить поверхнево-активної речовини. У контексті даного винаходу "поверхнево-активна речовина" це речовина, яка при низьких концентраціях абсорбується на поверхнях або межах розділу фаз системи і змінює вільну енергію поверхні або межі розділу фаз або поверхневе або міжфазне натягнення, і яке за природою є амфіпатичним, тобто має як полярні (гідрофільні), так і неполярні (гідрофобні) області в межах однієї молекули. Зокрема, поверхнево-активні речовини, які не повинні бути присутніми в переважних препаратах за даним винаходом, є наступні речовини, які можуть бути класифіковані на чотири групи на основі природи гідрофільної групи в молекулі: 1. Аніонні поверхнево-активні речовини, в яких гідрофільна група несе негативний заряд, наприклад, карбоніл (RCOO-), сульфонат (RSO3 ) або сульфат (ROSO3 ). Приклади важливих з фармацевтичної точки зору речовин включають лаурат калію і лаурилсульфат натрію. 2. Катіонні поверхнево-активні речовини, де гідрофільна група несе позитивний заряд (напри+ клад, четвертинні амонієві галогеніди R4N CI ). Приклади важливих з фармацевтичної точки зору речовин включають цетримід, суміш, що складається в основному з тетрадецилу (приблизн. 68 %), додецилу (приблизн. 22 %), і гексадецилт 7 риметиламонію бромідів (приблизн. 7 %), а також бензалконію хлорид, що є сумішшю алкілбензилдиметиламонію хлоридів загальної формули + [C6H5CH2N (CH3)2R]Cl-, де R є сумішшю алкілів з С8Н17 по С18Н37. 3. Амфолітичні поверхнево-активні речовини (також звані цвіттер-іоними поверхнево-активними речовинами), де молекула несе або потенційно може нести як негативний, так і позитивний заряд, + такі як сульфобетаїни (RN (CH3)2CH2CH2SO3-). Приклади важливих з фармацевтичної точки зору речовин включають N-додецил-N,N+ диметилбетаїн, C12H25N (СН3)2СН2СОО-. 4. Неіонні поверхнево-активні речовини, де гідрофільна область не несе заряд, але володіє розчинністю у воді унаслідок наявності високополярних груп, таких як гідроксильна або поліоксиетиленова (ОСН2СН2О ) групи. Приклади важливих з фармацевтичної точки зору речовин включають поліоксиетиленові гліколеві моноефіри (наприклад, цетомакрогол), сорбітанові ефіри (Spans®), полісорбати (Tweens®) і полоксамери (неіонні поліоксиетилен-поліоксипропіленові сополімери), що мають хімічно схожі склади і що відрізняються тільки відносними кількостями мономерів, що мають походження з оксиду пропілену і оксиду етилену. Змащувальні речовини, ковзаючі речовини і антиадгезивні речовини, що використовуються в твердих фармацевтичних композиціях за даним винаходом, тут не визначаються як поверхневоактивні агенти (поверхнево-активні речовини). Препарати за даним винаходом, містять ірбесартан, можуть, додатково містити сечогінний засіб, переважно гідрохлоротіазид (HCTZ). Його може бути включено у внутрішньогранулярну фазу грануляту і/або у зовнігранулярну фазу, тобто виступати як добавка до грануляту. Гранулят може бути, наприклад, гранулят для пресування пігулок або гранулят для заповнення капсул. Додатково в оболонку, нанесену на ядро, може бути включено сечогінний засіб. Ядро може бути індивідуальними гранулами грануляту, або ядром, одержаним шляхом пресування грануляту або порошкоподібного матеріалу. Ці способи включення можуть бути використані в комбінації один з одним. Препарати за винаходом можуть знаходитися у формі пігулок, пілюль, порошків, коржиків, саше, м'яких і твердих желатинових капсул, супозиторіїв і т.д. Лікарська форма переважно підходить для перорального застосування. Препарати за винаходом переважно знаходяться в стандартній лікарській формі, де кожна доза містить приблизно 1-300 міліграм, переважніше приблизно 50-200 міліграм, і ще переважніше приблизно 75-150 міліграм (зокрема приблизно 100 міліграм) ірбесартану у вільній формі (наприклад, терапевтична доза 100 міліграм вільного ірбесартану відповідає 114,7 міліграм ірбесартануНСl*1,5 Н2О). Термін "стандартна лікарська форма" відноситься до фізично дискретних одиниць, відповідних як одиничні дози для людей й інших ссавців, де кожна одиниця містить певну кількість ірбесартану, розраховану так, щоб забезпечувати 95274 8 бажану терапевтичну дію, в асоціації з відповідним фармацевтичним ексципієнтом. У ще одному переважному втіленні препаратів за даним винаходом середній розмір частинки ірбесартану складає менше ніж 250 мкм, переважніше менше ніж 200 мкм, найпереважніше менше ніж 150 мкм. Максимальний діаметр частинки переважно складає 2000 мкм або менше, переважніше 1000 мкм або менше. Використаний тут термін "середній розмір частинки" відноситься до об'ємного середнього діаметру частинки, а "максимальний діаметр" відноситься до максимального об'ємного діаметру частинки, те й інше визначають по розсіянню лазерного світла зразком, що містить 100-800 міліграм речовини, диспергованого в 5-8 мл рослинної олії (тобто соняшникової олії) і що не містить якінебудь солюбілізатори або поверхнево-активні речовини, з використанням апарату Malvern Mastersizer MS2000. Ексципієнти Фармацевтичні ексципієнти, використані для отримання фармацевтичних препаратів за даним винаходом, зокрема включають розбавлювачі, зв'язуючі речовини, розпушувачі, змащуючі речовини. Також можуть міститися інші додаткові ексципієнти. Приклади розбавлювачів, виступаючих як ексципієнти, за даним винаходом, включають мікрокристалічну целюлозу, порошкоподібну целюлозу, лактозу (безводну і моногідрат), пресований цукор, фруктозу, декстрати, цукрові спирти, такі як маніт, сорбіт, мальтитол, ксиліт, лактитол, або інші цукри, такі як сахароза, рафіноза, трегалоза, фруктоза або їхня суміш, силіконізована мікрокристалічна целюлоза, гідрофосфат кальцію, карбонат кальцію, лактат кальцію і будь-які їхні суміші. Переважні ексципієнти є мікрокристалічною целюлозою, лактозою і манітом, і будь-якими їхніми сумішами. Приклади зв'язуючих речовин, виступаючих у якості ексципієнтів за даним винаходом, включають полівінілпіролідон, мікрокристалічну целюлозу, гідроксиетилцелюлозу, гідроксипропілцелюлозу, гідроксипропілметилцелюлозу або інші прості ефіри целюлози, крохмаль, прежелатинізований крохмаль, поліметакрилат і будь-які їхні суміші. Переважно, зв'язуюча речовина володіє хорошою розчинністю у воді, і зокрема, кращими є зв'язуючі речовини, що володіють дуже хорошою розчинністю в холодній воді, такі як повідон з різними Квеличинами і гідроксипропілцелюлоза, тобто частково заміщений полі(гідроксипропіловий) ефір целюлози і/або низькозаміщений полі(гідроксипропіловий) ефір целюлози. Приклади розпушувачів, виступаючих в якості ексципієнтів, за даним винаходом, включають кросповідон, прежелатинізований крохмаль, натрію крохмалю гліколят, мікрокристалічну целюлозу, натрію карбоксиметил целюлозу (КМЦ-Na) або кальцію карбоксиметилцелюлозу (КМЦ-Са), поперечно зшиту КМЦ-Na, калію полакрилін, низькозаміщену гідроксипропілцелюлозу і будь-які їхні суміші. Переважно, розпушувач містить поперечнозшиту КМЦ-Na і/або низькозаміщену гідроксипропілцелюлозу. 9 Приклади змащуючих речовин, виступаючих в якості ексципієнтів за даним винаходом, включають стеаринову кислоту або солі стеаринової кислоти, такі як стеарат магнію, пальмітат магнію, олеат магнію, гідровану рослинну олію, гідровану касторову олію, тальк, стеарилфумарат натрію, макроголи і будь-які їхні суміші. Переважно, змащуюча речовина містить щонайменше один компонент, вибраний із стеаринової кислоти, стеарата магнію, гідрованої рослинної олії, гідрованої касторової олії, макроголів і тальку. Композиція Якщо не вказано інакше, всі вказані тут відсотки приведені в мас. %, від загальної маси препарату. Переважно, препарати за даним винаходом містять ірбесартан або його фармацевтично прийнятну сіль в кількості 20-77 %, краще 25-75 %, ще краще 30-70 %; ще краще 30-65 % і найкраще 3060 %. Відповідно до ще кращого втілення фармацевтичні препарати за винаходом містять: ірбесартан: 20-77%, краще 25-75 %, ще краще 30-70 %; ще краще 30-65 % і найкраще30-60 %. розбавлювач: 20-77 %, краще 25-75 %, найкраще 30-70 %; зв'язуючу речовину: 1-20 %, краще 2-16 %, найкраще3-12 % розпушувач: 1-30 %, краще 2-25 %, найкраще 3-20 % змащуючу речовину: 1-25 %, краще 2-20 %, найкраще 3-15 %, і сечогінний засіб: 0-20 %, краще 2-10 %, найкраще 2-8 %. Переважно, ірбесартан у вищенаведених препаратах є ірбесартан-НСІ, переважніше ірбесартану гідрохлориду півторагідрат. Крім того, переважно, щоб у вищенаведених препаратах розбавлювач був щонайменше одним цукровим спиртом, найкраще манітом. Ще більш переважними є препарати, що містять вказані вище переважні ексципієнти. Препарати за винаходом переважно знаходяться у формі пігулки в оболонці або без оболонки, наприклад, у формі пігулки, що швидко розпадається, або пігулки, що перорально розпадається, капсули або у формі гранул. Композиція також може бути представлена у формі порошкоподібної суміші, грануляту або мініпігулок, заповнених в капсули. Переважна композиція з негайним вивільненням. Можливо, ядра/пігулки можуть бути покриті звичайними речовинами, використовуваними для плівкового покриття, тобто як описано в G. Cole (ed.), Pharmaceutical Coating Technology (1995). Препарати для плівкового покриття звичайно містять наступні компоненти: I) щонайменше один полімер II) щонайменше один пластифікатор III) щонайменше один фарбник і/або замутнювач, V) щонайменше один носій (розбавлювач). У суспензіях для плівкового покриття можуть використовувати мінорні кількості коригентів, поверхнево-активні речовини і віск. Велика частина 95274 10 полімерів, використаних в плівковій оболонці, є похідними целюлози, такі як прості ефіри целюлози, або акрилові полімери і співполімери. Іноді використовують високомолекулярні поліетиленгліколі, полівінілпіролідон, полівініловий спирт і воскові матеріали. Звичайно їхня функція полягає в тому, щоб запобігати поганому відчуттю і/або смаку в роті, і в деяких випадках руйнування, наприклад, окислення використовуваних активних інгредієнтів і/або ексципієнтів. Типові прості ефіри целюлози, які можуть використовуватися як оболонки, є гідроксиетилцелюлозою, гідроксипропілцелюлозою, гідроксипропілметилцелюлозою і метилцелюлозою. Акрилові полімери містять групу синтетичних полімерів з різними функціональними характеристиками. Деякі з них додатково можуть бути модифіковані для посилення набухання і проникності шляхом включення таких речовин, як водорозчинні прості ефіри целюлози і крохмалі, для забезпечення повного розпушування/розчинення плівки. Звичайно пластифікатори, які використовуються, можуть бути розділені на поліоли (такі як гліцерин, пропіленгліколь і макроголи), органічні складні ефіри (такі як фталатні ефіри, дибутилсебакат, цитратні ефіри і триацетин), і олії/гліцериди (такі як касторова олія, ацетильовані моногліцериди і фракціонована кокосова олія). Фарбники/замутнювачі включають органічні фарбники і їхні лаки, неорганічні фарбники і природні фарбники, що включають водорозчинні фарбники і нерозчинні у воді фарбники (пігменти). Різні речовини з кожної групи також можуть бути комбіновані в різних співвідношеннях. Суспензії для плівкових покриттів також можуть бути використані у вигляді готових для виготовлення препаратів, які є у продажу. Дисперсія плівкового покриття може бути виготовлена з використанням різних розбавлювачів (розчинників, таких як вода, спирти, кетон, складні ефіри, хлоровані вуглеводні та їхні суміші. Переважний розбавлювач (розчинник) є водою. Особливо кращою є композиція суспензії покриття, що містить з розрахунку на мас. %, на основі сухої речовини 1-99 % (переважно 1-95 %) полімеру, 1-50 % (переважно 1-40 %) пластифікатора і 0,1-20 % (переважно 0,1-10 %) фарбника/замутнювача. Може бути використано звичайне устаткування для нанесення покриття, таке як система нанесення покриття Wurster або звичайні чани для покриття. У особливо переважному втіленні даного винаходу твердий фармацевтичний препарат містить ірбесартан або ірбесартану гідрохлорид (найпереважніше ірбесартану гідрохлориду півторагідрат), маніт, одну або дві гідроксипропілцелюлози (НРС hydroxypropyl cellulose) і кросповідон. НРС може бути незаміщеною, але переважніше вона є заміщеною. Переважним є низький ступінь заміщення (0,5 або менше, переважніше 0,2 або менше). Ці переважні препарати також можуть містити HCTZ як додатково активний інгредієнт. 11 У цих препаратах середній розмір частинок ірбесартану або його гідрохлориду (півторагідрату) переважно менше ніж 250 мкм і кількість активного(их) інгредієнту(ів) переважно складає від 20 до 60 %. Кросповідон використовують в кількості 130 %, маніт в кількості 20-77 %, щонайменше одну змащуючу речовину, вибрану з макроголу, тальку і гідрованої касторової олії, використовують в загальній кількості 1-25 % і одну або дві НРС (переважно використовують два типи НРС) представлені в загальній кількості 1-20 %. Кожна з вищезгаданих кількостей приведена від загальної маси препарату. Препарати переважно можуть бути покритими. Препарати відповідно до цього кращого втілення даного винаходу забезпечують особливо хорошу стабільність і фармакокінетичний профіль і володіють адекватною кінетикою розчинення. Спосіб за винаходом Фармацевтичні препарати за даним винаходом готують за допомогою відомих технологічних способів, наприклад, шляхом пресування або вологої грануляції з використанням добре відомих і легкодоступних ексципієнтів. При приготуванні препаратів, що містять ірбесартан, активний інгредієнт звичайно змішують або розбавляють з одним або більше ексципієнтом(ами). Коли ексципієнт служить як розбавлювач, він може бути твердою або рідкою речовиною, яка діє як носій або середовище для ірбесартанового компоненту. Виявлено, що заявлена тверда лікарська форма для перорального введення, яку готують шляхом вологої грануляції, стабільна в умовах тестування стабільності згідно Міжнародної Конференції з Гармонізації (ІСН - International Conference on Harmonization). Додатково, сушка грануляту, приготованого способом вологої грануляції, в осушувачі в киплячому шарі дає можливість виготовляти круглі частинки грануляту, що складається з ірбесартану і ексципієнту (ів), що дозволяє одержувати препарат, який відтворюється і піддається обробці. Інакше, високий вміст ірбесартану в твердій лікарській формі, наприклад 20-77 % в ядрі, може представляти проблему. Зволоження суміші ірбесартану і ексципієнту(ів) можуть здійснювати з використанням звичайного устаткування для грануляції шляхом приведення в контакт води, спирту, їхньої суміші або водної, спиртової або водно/спиртової гранульованої рідини з одним або більше ексципієнтом(ами) за допомогою звичайних фармацевтичних методик, таких як розпилювання або безпосереднє додавання під час змішування у відповідному пристрої для змішування, наприклад, в мішалці з великими зсувними зусиллями. Переважні розбавлювачі, що використовуються в технологічному способі важливої грануляції, є нижчі спирти, наприклад С1-6-алканоли. Терміни "водна, спиртова або водна/спиртова гранульована рідина" відносяться до суміші, що містить воду (переважно очищену, демінералізовану або дистильовану воду) і/або нижчі спирти (переважно С1-6-алканоли, такі як метанол, етанол або ізопропанол) у якості розбавлювачів, і тверда речовина, яка є диспергованою, суспендованою або розчиненою в них. Тверда речовина може во 95274 12 лодіти відомими функціями ексципієнтів, що використовуються в препаратах за даним винаходом, такими як функції суспендованого агента або зв'язуючого агента, переважно зв'язуючого агента. Змішування ексципієнта(ів) з ірбесартаном можуть здійснювати в звичайному пристрої, що використовується для змішування порошків, наприклад, в нерухомому (пасивному) змішувачі, змішувачі з псевдозрідженим шаром, дифузійному змішувачі, двоконусному дифузійному змішувачі, одноконусному змішувачі, двоконусному змішувачі, турбулярному змішувачі, кубічному змішувачі, планетарному змішувачі, вилкоподібному змішувачі, V-подібному змішувачі або мішалці з великими зсувними зусиллями. Для сушки грануляту можуть використовувати звичайні пристрої для сушки, такі як осушувач з псевдозрідженим шаром або сушильні камери (у вакуумі або при тиску навколишнього середовища). У вищеописаному способі за винаходом пресування, зокрема ядер/пігулок, можуть здійснювати з використанням автоматичної роторної таблетувальної машини, які проводяться різними виробниками устаткування для фармацевтичної промисловості. Для нанесення плівкового покриття можуть використовувати звичайне устаткування, наприклад, псевдозріджений шар (наприклад, система нанесення оболонки Wurster) або звичайні покриваючі чани для застосування у фармацевтичній промисловості. Спосіб виготовлення фармацевтичних препаратів за винаходом можуть здійснювати як спосіб грануляції або прямого пресування. У кожному випадку сполуку ірбесартан спочатку одержують відповідно до відповідного способу синтезу і потім очищають, наприклад, шляхом кристалізації або інших способів. Потім визначають розмір частинок ірбесартану і якщо виявляють, що існують частинки, які мають діаметр більший, ніж 2000 мкм (або більший, ніж 1000 мкм у разі кращого втілення), ірбесартан подрібнюють або перемелюють до меншого розміру.Кращим втіленням винаходу є спосіб вологої грануляції (А), що включає наступні стадії: (I) отримання ірбесартану, що має максимальний діаметр частинки не більше 2000 мкм (II) виготовлення суміші для пресування з використанням зволожувача, що містить спирт, можливо води, їхні суміші або водної, спиртової або водно/спиртової гранульованої рідини, шляхом (а1) грануляція суміші одного або більше ексципієнту(ів) і зволожувача з отриманням грануляту, і (а2) додавання ірбесартану і, можливо, додаткового ексципієнту(ів) до грануляту з отриманням суміші для пресування; (б1) грануляція суміші одного або більше ексципієнту(ів), ірбесартану і зволожувача з отриманням грануляту, і (б2) можливого додавання до грануляту додаткового ексципієнту(ів) з отриманням суміші для пресування; або (в1) грануляція суміші одного або більше ексципієнту(ів), ірбесартану і зволожувача з отриманням грануляту, і (в2) додавання частини ірбесар 13 95274 тану і, можливо, додаткового ексципієнту(ів) до грануляту з отриманням суміші для пресування; і (III) пресування суміші для пресування в бажану форму. У даному способі стадія (II) включає три альтернативи. На стадіях (а1)/(а2) весь ірбесартан додають у вигляді позагранульованої фази після грануляції (а1), на стадіях (б1)/(б2) весь ірбесартан включений в гранулят в (б1), і на стадіях (в1)/(в2) ірбесартан розділяється між гранулятом і позагранульованою фазою. Крім того, препарати ірбесартану за даним винаходом можуть включати гідрохлоротіазід. Таким чином, залежно від альтернативи, вибраної для стадії (II), в даному способі вологої грануляції гідрохлоротіазид можуть, можливо, додавати на будь-якій із стадій (а1) і/або (а2), (б1) і/або (б2), і (в1) і/або (в2). Отже, гідрохлоротіазід, якщо його додають, може знаходитися виключно в грануляті, його можуть додавати виключно у вигляді позагранульованої фази після грануляції, або його можуть розділяти між гранулятом і зовнігранулярною фазою, незалежно від розподілу ірбесартану, що досягається в результаті вибору бажаної альтернативи (а1)/(а2), (б1)/(б2) або (в1)/(в2) стадії (іі). Ще одне переважне втілення способу за винаходом є спосіб прямого пресування (Б), що включає стадії: (І) отримання ірбесартану, що має максимальний діаметр частинки не більше ніж 2000 мкм (II') змішування ірбесартану і одного або більше ексципієнту(ів) з отриманням пресованої суміші, (III) пресування суміші для пресування в бажану форму. Знову ж таки, можуть вносити гідрохлоротіазід. В цьому випадку його додають як додатковий компонент на стадії змішування (II'). На пресований продукт, одержаний на стадії (III) способу вологої грануляції (А) або способу прямого пресування (Б), можуть на подальшій стадії (IV) наносити покриття. Додатково, ексципієнти, представлені в препаратах за винаходом, зв'язуючі речовини, розпушувачі, змащуючі речовини або розбавлювачі, можуть бути розділені між внутрішньогранулярною фазою, позагранулярною фазою і, можливо, покриваючим шаром в способі вологої грануляції (А), і між внутрішньогранулярною фазою і, можливо, покриваючим шаром в способі прямого пресування (Б). Відповідно до переважного втілення, кількість ірбесартану в препаратах за даним винаходом складає 75 міліграм, 150 міліграм або 300 міліграм на одиницю дози (у перерахунку на вільний ірбесартан). Можлива додаткова кількість гідрохлоро 14 тіазіду в цих препаратах переважно складає 12,5 міліграм або 25 міліграм на одиницю дози. Можливі будь-які комбінації цих кількостей, тобто співвідношення ірбесартану (переважно ірбесартану-НСІ) до гідрохлоротіазіду (мг:мг) може переважно складати 75:12,5, 150:12,5, 300:12,5, 75:25, 150:25 або 300:25. ПРИКЛАДИ Наступні Приклади ілюструють винахід, і не передбачається, що вони яким-небудь чином обмежують об'єм винаходу. Втрату при сушці, визначену в прикладах, вимірювали з використанням галогенового аналізатора вологості Mettler Toledo HR73 при 85°C протягом 20 хвилин. Отримання ірбесартану-НСl*1,5 Н2О 160 г неочищеного ірбесартану суспендували в суміші 1600 мл води і 160 мл метанолу при кімнатній температурі. Додавали 400 мл 3М НСІ (рН менше 1) і суміш нагрівали до температури дефлегмації. Розчин, що утворився, фільтрували і охолоджували до кімнатної температури. При необхідності, рН доводили до величини менше 1 шляхом додавання 3М НСІ. Суміш потім охолоджували до 0°C і перемішували при цій температурі протягом 1 год. Продукт фільтрували, промивали водою і сушили при зниженому тиску при 35 °C протягом 3 год. з отриманням 160 г неочищеного ірбесартану-НСІ*1,5 Н2О. Перекристалізація 160 г ірбесартану-НСl*1,5 Н2О розчиняли в 320 мл суміші ізопропанолу і 5М НСІ (10:1; об.:об.) при температурі дефлегмації. Розчин, що утворився, фільтрували, охолоджували до кімнатної температури і перемішували протягом 1 год., потім охолоджували до 0°C і перемішували протягом ще 0,5 год. Продукт фільтрували, промивали водою і сушили при зниженому тиску при 40°C протягом 2 год. з отриманням 144 г перекристалізованого ірбесартан-HCl*1,5 Н2О. Приклади 1-9 Пігулки одержували відповідно до способу вологої грануляції (А) таким чином. 1) Виготовлення гранулятів (1а)-(9а) Відповідні тверді компоненти, представлені в Таблиці 1 нижче, гомогенізували в мішалці з великими зсувними зусиллями, і на суміш розпилювали етанол (96 об. %). Одержаний гранулят сушили в камері для сушки або сушарці з псевдозрідженим шаром при певній температурі. Одержаний гранулят просівали і втрату при сушці визначали, який описано вище. Природа і кількості твердих компонентів і етанолу, пристрій для сушки, температура сушки і втрата при сушці просіяного грануляту представлені в Таблиці 1. Таблиця 1 1а Компоненти [г] 1) ірбесартан-НСІ маніт 2) LH-21 2а 3а 4а 86,11 83,89 10 86,11 83,89 86,11 40,89 7,5 86,11 83,89 5 Гранулят 5а 6а 86,11 81,39 5 86,11 78,89 5 7а 8а 9а 86,11 71,89 7 86,11 69,39 7 86,11 69,39 11 15 95274 16 Продовження таблиці 1 1а 30 3) Klucel-EF кросповідон етанол (96 об. %) Спосіб сушки/втрата 4) Спосіб сушки СК 5) Темп, сушки, [°С] 35-40 Втрата гранулята під час 3,08 сушки [мас. %] 2а 10 30 3а 50 4а 5 42 СК 35-40 СПС 47 СПС 50-55 3,20 3,44 3,42 Гранулят 5а 5 40 6а 5 30 7а 5 30 8а 7,5 30 9а 7,5 30 СПС 50-55 СПС 55 СПС 55 СПС 55 СПС 55 2,76 2,59 2,92 3,06 3,20 1) у вигляді ірбесартану-НСl*1,5 Н2О (86,11 г ірбесартану-НСl*1,5 Н2О відповідають 75 г вільного ірбесартану) 2) LH-21: наявна у продажу низькозаміщена гідроксипропілцелюлоза 3) Klucel-EF: наявна у продажу низькозаміщена гідроксипропілцелюлоза 4) СК: сушильна камера СПС: сушарка з псевдозрідженим шаром 5) температура вхідного повітря 2) Виготовлення сумішей для пресування (1b)(9b) Компоненти, приведені в Таблиці 2 нижче, додавали до відповідних одержаних вище гранулятів (1а) -(9а) і змішували в мішалці з великими зсув ними зусиллями з отриманням суміші для пресування. Втрату при сушці пресованих сумішей визначали, як згадано вище. Кількості доданих компонентів, а також втрата при сушці суміші представлені в Таблиці 2. Таблиця 2 1b 1а Гранулят Компоненти [г] 1) LH-11 10 Кросповідон Макрогол 6000 6 Тальк Гідрована касторова олія 4 Втрата під час сушки гра3,16 нуляту 1) 2b 2а 3b 3а Суміш для пресування 4b 5b 6b 4а 5а 6а 7b 7а 8b 8а 9b 9а 10 6 4 7,5 5 3 5 6 5 4 7,5 6 5 4' 10 6 5 4 15 6 5 4 15 6 5 4 11 6 5 4 3,10 3,82 3,15 2,66 3,05 3,12 3,07 3,07 LH-11: наявна у продажу низькозаміщена гідроксипропілцелюлоза 3) Виготовлення пресованих ядер пігулок Суміші для пресування (1b)-(9b) пресували в овальні ядра пігулок (1с)-(9с) з теоретичною масою 150 або 200 міліграм. Крім того, суміші для пресування (6b)-(9b) пресували в овальні ядра пігулок (6d)-(9d), з теоретичною масою 800 міліг рам. Твердість пресованих ядер пігулок і час їх розпушування (у секундах або хвилинах) в очищеній воді при 37°C вимірювали відповідно до Європейської Фармакопеї. Результати представлені в Таблицях 3А і 3Б. Таблиця 3А Суміш для пресування Маса [мг] Твердість [Н] Час розпушування 1с 1b 200 46-82 35 с 2с 2b 200 50-60 10 с 3с 3b 150 50-66, 1 хв Пресовані ядра пігулок 4с 5с 6с 4b 5b 6b 200 200 200 70-98 85-101 85-105 4-4,5 хв 3,5 хв 2 хв 7с 8с 9с 7b 8b 9b 200 200 200 91-104 91-107 99-113 2-2,5 хв 2-2,5 хв 3-3,5 хв 17 95274 18 Таблиця 3Б 6d 6b 800 159-181 2хв Суміш для пресування Маса [мг] Твердість [Н] Час розпушування Додатково, пресовані ядра пігулок (4с)-(9с) і (6d)-(9d) покривали в автоматичному покриваючому чані з готовою для приготування сумішшю суспензії плівкової оболонки на водній основі, наявній у продажу під назвою Opadry II HP. Теоретична маса покритих пігулок, що містять ядра (4с)-(9с), складала 206 міліграм, і маса покритих пігулок, що містять ядра (6d)-(9d), складала 824 міліграм. Товщина оболонки, що виходить в результаті, достатня для того, щоб приховувати неприємний смак ірбесартану, що відчувається при його розчиненні в слині. Приклад 10 Пігулки готували відповідно до способу прямого пресування (b) таким чином. 86,11 г ірбесартан-НСІ, 40,89 г маніту і 8 г натрію кроскармелози гомогенізували в мішалці з великими зсувними зусиллями. У неї додавали 1,50 г стеарату магнію, 1,5 г безводного діоксиду кремнію і 12 г тальку, одержуючи таким чином суміш для пресування. Його втрата при сушці, визначена, як описано вище, складала 3,1 мас. %. Суміш для пресування пресували в овальні пігулки з теоретичною масою 150 міліграм. Твердість ядер складала 45-60 Н і час розпушування в очищеній воді при 37 °C склав 20 секунд. Порівняння властивостей розчинення ядер пігулок (4с)-(9с) Прикладів 4-9 за даним винаходом, 7d 7b 800 175-199 2,5 хв 8d 8b 800 180-196 2,5-3 хв 9d 9b 800 177-207 3-3,5 хв що містять 75 міліграм вільного ірбесартану (у вигляді ірбесартану-НСІ*1,5 Н2О, 86,11 міліграм) з лікарською формою, в даний час наявною у продажу (пігулки Aprovel 75 міліграм), представлено на Фіг. Як можна бачити, фармацевтичні препарати за винаходом демонструють вищі швидкості розчинення після періоду індукції приблизно 15 хвилин, таким чином, демонструючи покращену поведінку відносно швидкого вивільнення ліків в живому організмі. Швидкості розчинення вимірювали в апараті для тестування розчинення ErwekaDT80 із спектрофотометром на основі діодної матриці Agilent 8453. Приклади 11-16 Пігулки готували відповідно до способу вологої грануляції (А) з додаванням гідрохлоротіазиду таким чином. 1) Виготовлення гранулятів (11а) -(18а) Відповідні тверді компоненти, представлені в Таблиці 4 нижче, гомогенізували в мішалці з великими зсувними зусиллями, і на суміш розпилювали етанол (96 про. %). Одержаний гранулят сушили в сушильній камері або сушарці з псевдозрідженим шаром. Природа і кількості твердих компонентів представлені в Таблиці 4. Таблиця 4 11а Компоненти [г] 1) Ірбесартан-НСІ Маніт 2) LH-21 Кросповідон 3) Етанол (96 об. %) 12а 13а 86,11 71,39 10 д.к. 86,11 71,39 10 д.к. 86,11 71,39 5 д.к. Гранулят 14а 15а 86,11 68,89 5 д.к. 86,11 66,39 5 д.к. 16а 17а 18а 86,11 59,39 7 д.к. 86,11 56,89 7 д.к. 86,11 56,89 11 д.к. 1) у вигляді ірбесартану-HCl*1,5 Н2О (86,11 г ірбесартану-НСl*1,5 Н2О відповідає 75 г вільного ірбесартану) 2) LH-21: наявна у продажу низькозаміщена гідроксипропілцелюлоза 3) д.к.: - достатня кількість 2) Приготування сумішей для пресування (11b)-(18b) Компоненти, представлені в Таблиці 5 нижче, додавали до відповідних гранулятів (11а)-(18а), одержаних, як вказано вище, і змішували в мішалці з великими зсувними зусиллями з отриманням суміші для пресування. Кількості компонентів, що додаються, також представлені в Таблиці 5. 3) Приготування пресованих ядер пігулок Суміші для пресування (11b)-(18b) пресували в ядра пігулок з теоретичною масою 200 міліграм. Додатково, пресовані ядра пігулок покривали в автоматичному покриваючому чані готовою для виготовлення сумішшю суспензії плівкового покриття на водній основі, наявній у продажу як Opadry II HP. Теоретична маса покритих ядер пігулок складала 206 міліграм. 19 95274 20 Таблиця 5 Гранулят Компоненти [г] Гідрохлоротіазид 1) LH-11 Кросповідон Макрогол 6000 Тальк Гідрована касторова олія 1) 11b 11а 12b 12а 13b 13а 12,5 10 6 4 12,5 10 6 4 Суміш для пресування 14b 15b 16b 14а 15а 16а 12,5 5 6 5 4 12,5 7,5 6 5 4 12,5 10 6 5 4 12,5 15 6 5 4 17b 17а 18b 18а 12,5 15 6 5 4 12,5 11 6 5 4 LH-11: наявна у продажу низькозаміщена гідроксипропілцелюлоза Комп’ютерна верстка Л. Ціхановська Підписне Тираж 23 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюSolid pharmaceutical composition comprising irbesartan and processes for the manufacture thereof
Автори англійськоюJakse Renata, Jakse Renata, Bevech Franchi, Zuppancic Silvo
Назва патенту російськоюТвердый фармацевтический препарат, содержащий ирбесартан, и способы его изготовления
Автори російськоюВрбинч Миха, Яксе Рената, Бевеч Франчи, Жупанчич Силво
МПК / Мітки
МПК: A61K 47/34, A61K 47/36, A61P 9/12, A61K 31/4166, A61K 31/4178, A61K 47/38
Мітки: способи, виготовлення, твердий, препарат, фармацевтичний, ірбесартан, містить
Код посилання
<a href="https://ua.patents.su/10-95274-tverdijj-farmacevtichnijj-preparat-shho-mistit-irbesartan-ta-sposobi-jjogo-vigotovlennya.html" target="_blank" rel="follow" title="База патентів України">Твердий фармацевтичний препарат, що містить ірбесартан, та способи його виготовлення</a>
Попередній патент: Кришка банки для зберігання харчових продуктів, спосіб її виготовлення та спосіб стерилізації або пастеризації банки, наповненої харчовим продуктом
Наступний патент: Плавлений литий тугоплавкий продукт з високим вмістом цирконію, спосіб його одержання, склоплавильна піч та електролізна камера, що його містять
Випадковий патент: Антивібраційна компоновка низу бурильної колони