Довгострокове лікування віл-інфекції
Номер патенту: 96436
Опубліковано: 10.11.2011
Автори: Краус Гуентер, Вант Клустер Гербен Альберт Елеузеріус, Баерт Лівєн Ельвір Колетте
Формула / Реферат
1. Застосування парентеральної препаративної форми, що містить ефективну проти вірусу кількість 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; або його фармацевтично прийнятної кислотно-адитивної солі та носій, для виготовлення лікарського засобу для лікування суб'єктів, інфікованих ВІЛ, де препаративну форму вводять
підшкірно або внутрішньом'язово, періодично, з інтервалом часу в діапазоні від двох тижнів до шести місяців.
2. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від двох тижнів до одного місяця.
3. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від одного місяця до трьох місяців.
4. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від трьох місяців до шести місяців.
5. Застосування за п. 1, де препаративна форма повинна бути введена один раз кожні два тижні.
6. Застосування за п. 1, де препаративна форма повинна бути введена один раз на місяць.
7. Застосування за п. 1, де препаративна форма повинна бути введена один раз кожні три місяці.
8. Застосування за п. 1, де ефективна кількість 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; у парентеральній препаративній формі вибрана таким чином, що концентрація 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми у крові плазми підтримується протягом тривалого періоду часу вище мінімального рівня в плазмі крові, що є найменшим рівнем у крові плазми, при якому інгібітор ВІЛ ефективний при придушенні ВІЛ.
9. Застосування за п. 8, де рівень у крові плазми підтримується на рівні, що дорівнює або перевищує приблизно 20 нг/мл.
10. Застосування за п. 8, де рівень у крові плазми підтримують на рівні вище приблизно 40 нг/мл.
11. Застосування за п. 8, де рівень у крові плазми підтримують у межах від приблизно 5 нг/мл до приблизно 200 нг/мл.
12. Застосування за п. 1, де дозу 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; або його фармацевтично прийнятної кислотно-адитивної солі у препараті розраховують на основі від приблизно 0,5 мг/день до приблизно 50 мг/день.
13. Застосування за будь-яким з пп. 1-12, де препарат містить поверхнево-активну речовину, вибрану з-поміж полоксамерів, сукцинатів α-токсоферилполіетиленгліколю, естерів поліоксіетиленсорбітанової жирної кислоти та поліетиленгліколів.
14. Застосування за будь-яким з пп. 1-13, де 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил, його Е-ізомерна форма або його Z-ізомерна форма, знаходиться у формі основи.
15. Застосування за будь-яким з пп. 1-14, де 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрил, його Е-ізомерна форма або його Z-ізомерна форма, знаходиться в своїй Е-ізомерній формі.
16. Спосіб лікування суб'єктів, інфікованих ВІЛ, який включає введення парентеральної препаративної форми, що містить ефективну проти вірусу кількість 4-[[4-[[4-(2-ціаноетеніл)-2,6-диметилфеніл]аміно]-2-піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; або його фармацевтично прийнятної кислотно-адитивної солі та носій, де препаративну форму вводять підшкірно або внутрішньом'язово, періодично, з інтервалом часу в діапазоні від двох тижнів до шести місяців.
Текст
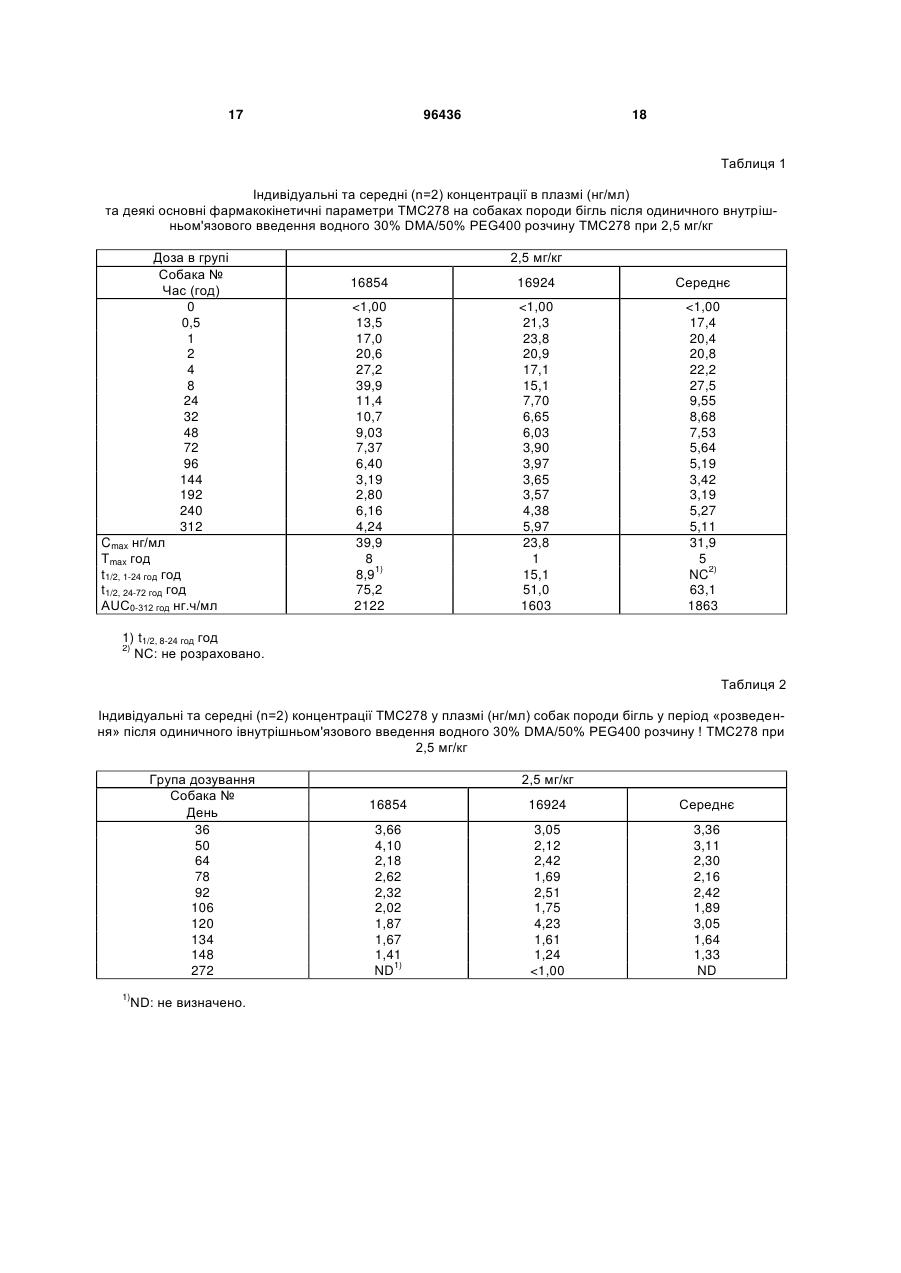
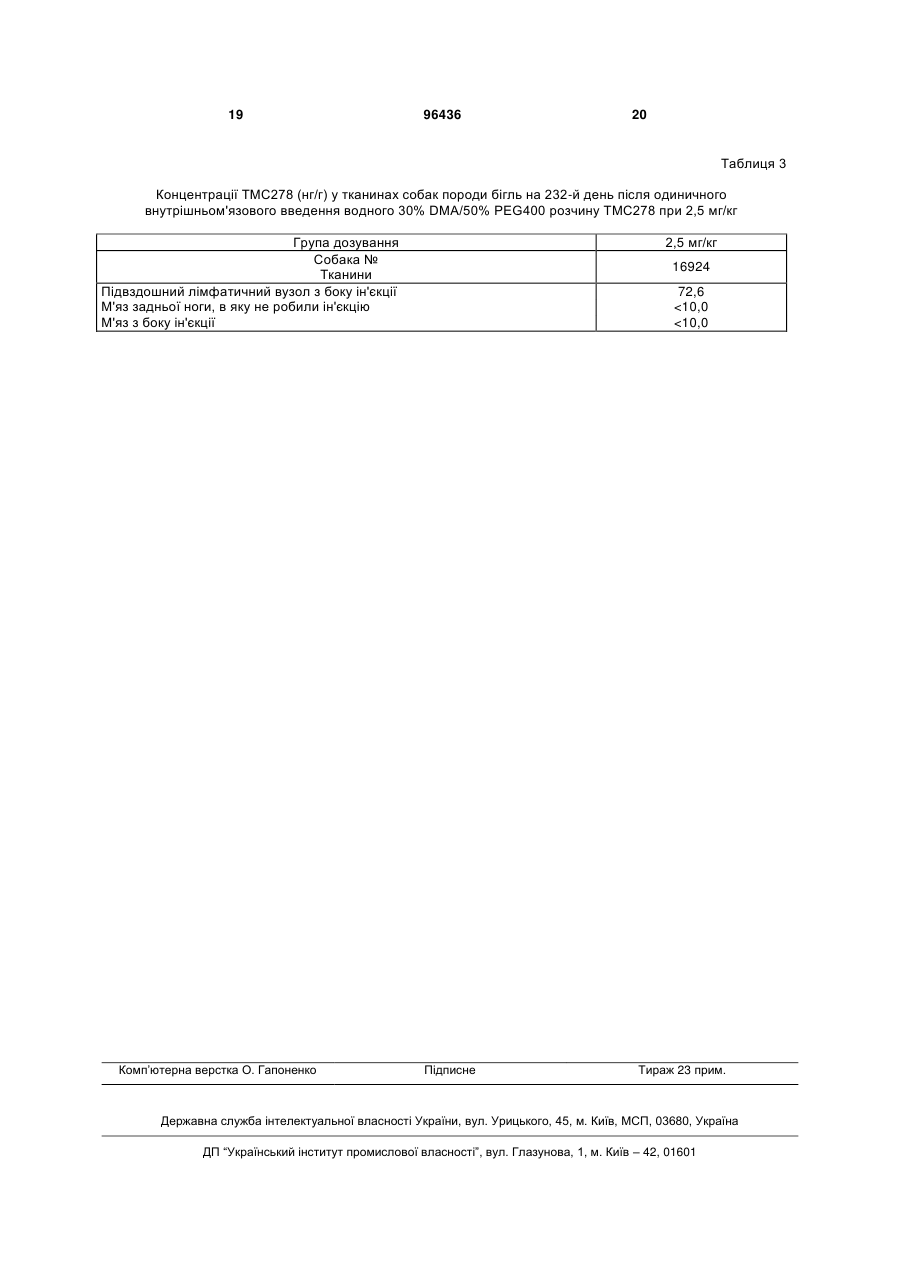
1. Застосування парентеральної препаративної форми, що містить ефективну проти вірусу кількість 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; або його фармацевтично прийнятної кислотно-адитивної солі та носій, для виготовлення лікарського засобу для лікування суб'єктів, інфікованих ВІЛ, де препаративну форму вводять підшкірно або внутрішньом'язово, періодично, з інтервалом часу в діапазоні від двох тижнів до шести місяців. 2. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від двох тижнів до одного місяця. 3. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від одного місяця до трьох місяців. 4. Застосування за п. 1, де препаративна форма повинна бути введена через інтервал часу в діапазоні від трьох місяців до шести місяців. 5. Застосування за п. 1, де препаративна форма повинна бути введена один раз кожні два тижні. 6. Застосування за п. 1, де препаративна форма повинна бути введена один раз на місяць. 2 (19) 1 3 96436 4 16. Спосіб лікування суб'єктів, інфікованих ВІЛ, який включає введення парентеральної препаративної форми, що містить ефективну проти вірусу кількість 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрилу, його Е-ізомерної форми або його Z-ізомерної форми; або його фармацевтично прийнятної кислотно-адитивної солі та носій, де препаративну форму вводять підшкірно або внутрішньом'язово, періодично, з інтервалом часу в діапазоні від двох тижнів до шести місяців. Область техніки, до якої відноситься винахід Даний винахід відноситься до довгострокового лікування ВІЛ інфекції шляхом періодичного парентерального введення препаративної форми, що містить NNRTI TMC278, через відносно тривалі інтервали часу. Передумови створення винаходу Лікування інфекції вірусу імунодефіциту людини (ВІЛ), також відомої як синдром набутого імунодефіциту (AIDS), залишається найважливішою задачею медицини. ВІЛ здатний уникати імунологічного тиску, адаптуючись до різноманітних типів клітин і умов росту, та розвивати резистентність проти доступних на даний час лікарських терапій. Останні включають нуклеозидні інгібітори зворотних транскриптаз (NRTIs), ненуклеозидні інгібітори зворотних транскриптаз (NNRTIs), нуклеотидні інгібітори зворотних транскриптаз (NtRTIs), інгібітори ВІЛ протеаз (Pis) та більш пізні інгібітори злиття. Хоча кожний з цих лікарських засобів є ефективним при придушенні ВІЛ, при використанні по окремості вони зіштовхуються з виживанням резистентних мутантів. Це привело до введення комбінованої терапії декількох анти-ВІЛ агентів, що звичайно мають різні профілі активності. Зокрема, введення «HAART» (високоактивна антиретровірусна терапія) привело до значного поліпшення анти-ВІЛ терапії, що виражається у значному зниженні пов'язаної з ВІЛ захворюваності та смертності. Сучасні посібники з антиретровірусної терапії рекомендують режим такої потрійної комбінованої терапії навіть для початкового лікування. Однак, жодна з доступних на даний час лікарських терапій не здатна цілком усувати ВІЛ. Навіть HAART може зіштовхнутися з проявом резистентності, часто внаслідок відсутності адгезії та нестійкості антиретровірусної терапії. У цих випадках ефективність HAART може бути відновлена шляхом заміни одного з її компонентів на компонент, що належить до іншого класу. При правильному застосуванні лікування за допомогою комбінацій HAART може придушити вірус на багато років, навіть десятиліть, до рівня, що вже не може викликати проявів AIDS. Один із класів лікарських засобів проти ВІЛ, які часто використовують у HAART, відноситься до NNRTIs, велика кількість яких на даний час є комерційно доступною, а деякі інші знаходяться на різних стадіях розробки. NNRTI, що розробляється на даний час, являє собою сполуку 4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]-аміно]-2піримідиніл]-аміно]-бензонітрил, позначену також як ТМС278. Ця сполука демонструє виражену активність не тільки проти дикого типу ВІЛ, а також проти багатьох його мутантних варіантів. Сполука ТМС278, її фармакологічна активність, а також ряд методик її одержання були описані у WO-03/16306. Приклади різних загальноприйнятих форм фармацевтичних дозувань включають таблетки, капсули, краплі, супозиторії, розчини для персрального введення та ін'єкційні розчини. Завдяки своїм фармакокінетичним властивостям та необхідності підтримувати рівень у плазмі вище мінімального, анти-ВІЛ лікарські засоби, що застосовуються на даний час, вимагають частого введення у відносно високих дозах. Кількість та/або об'єм форм дозувань, які потрібно вводити, звичайно позначають як «медикаментозне навантаження». Високе медикаментозне навантаження є небажаним з багатьох міркувань, таких як частота прийому, часто пов'язана з незручністю ковтати велику кількість форм дозувань, а також з необхідністю зберігати та транспортувати велику кількість або обсяг пігулок. Велике медикаментозне навантаження підвищує ризик того, що пацієнти не будуть приймати всю дозу цілком, таким чином, не виконуючи запропонованого режиму прийому дозування. Також це пов'язано зі зменшенням ефективності лікування, що також приводить до виникнення вірусної резистентності. Проблеми, пов'язані з великим медикаментозним навантаженням, збільшуються, коли пацієнт повинен приймати комбінацію різних анти-ВІЛ агентів. Отже, бажаним було б забезпечення ВІЛінгібуючої терапії, що зменшує медикаментозне навантаження, оскільки вона включає введення форм дозування порівняно малого розміру та, крім того, не вимагає частого прийому. Привабливим було б забезпечення анти-ВІЛ терапії, що включає введення лікарських форм через тривалі інтервали часу, такі як один тиждень або більше чи навіть один місяць або більше. На даний час було встановлено, що періодичне введення парентеральних препаративних форм NNRTI TMC278 через інтервали часу в один тиждень або більш тривалі, такі як один рік, приводять до таких їх рівнів у плазмі, що адекватні для придушення ВІЛ. Це дозволяє зменшити кількість введень, що вигідно з погляду медикаментозного навантаження та дотримання пацієнтом режиму лікування. Короткий опис суті винаходу Один з аспектів даного винаходу відноситься до застосування парентеральної препаративної форми, що містить ефективну проти вірусу кількість ТМС278 або його фармацевтично прийнятної кислотно-адитивної солі та носій, для виготовлення лікарського засобу для лікування суб'єктів, інфікованих ВІЛ, де препаративну форму вводять періодично через інтервал часу в діапазоні від одного тижня до одного року. Або даний винахід 5 відноситься до застосування парентеральної препаративної форми, що містить ефективну проти вірусу кількість ТМС278 або його фармацевтично прийнятної кислотно-адитивної солі та носій, для лікування суб'єктів, інфікованих ВІЛ, де препаративну форму вводять періодично через інтервали часу в діапазоні від одного тижня до одного року. В іншому аспекті даний винахід забезпечує спосіб лікування суб'єкта, інфікованого ВІЛ, який включає введення парентеральної препаративної форми, що містить ефективну проти вірусу кількість ТМС278 або його фармацевтично прийнятної кислотно-адитивної солі та носій, в якому препаративну форму вводять періодично через інтервали часу в діапазоні від одного тижня до одного року. В одному з варіантів втілення даний винахід відноситься до застосування або способу, описаних в даній заявці, де парентеральну препаративну форму вводять або вона повинна бути введена через інтервали часу, що знаходяться в діапазоні від одного тижня до одного місяця або в діапазоні від одного місяця до трьох місяців, або в діапазоні від трьох місяців до шести місяців, або в діапазоні від шести місяців до дванадцяти місяців. У ще одному варіанті втілення даний винахід відноситься до застосування або способу, описаних в даній заявці, де парентеральну форму вводять або вона повинна бути введена один раз кожні два тижні або один раз кожного місяця, або один раз кожні три місяці. Докладний опис винаходу Сполука, що використовується в даному винаході, являє собою 4-[[4-[[4-(2-ціаноетеніл)-2,6диметилфеніл]аміно]-2піримідиніл]аміно]бензонітрил, що має непатентоване найменування рилпівірин, також відомий як ТМС278 (або раніше був позначений як R278474). ТМС278 знаходиться в клінічній розробці як інгібітор ВІЛ, що належить до класу NNRTI. ТМС278 може бути використаний у формі основи або у формі фармацевтично прийнятної солі, зокрема у формі кислотно-адитивної солі. Фармацевтично прийнятні адитивні солі означають, що вони містять терапевтично активні нетоксичні форми солей. Кислотно-адитивні сольові форми можуть бути отримані шляхом обробки основної форми відповідними кислотами, наприклад неорганічними кислотами, наприклад, галогенводневими кислотами, наприклад, соляною кислотою, бромистоводневою кислотою та подібною; сірчаною кислотою; азотною кислотою; фосфорною кислотою та подібною; або органічними кислотами, наприклад, оцтовою кислотою, пропіоновою кислотою, гідроксіоцтовою кислотою, 2гідроксипропіоновою кислотою, 2-оксопропіоновою кислотою, щавлевою кислотою, малоновою кислотою, бурштиновою кислотою, малеїновою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, 2-гідрокси-1,2,3пропантрикарбоновою кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, 4метилбензолсульфоновою кислотою, циклогексансульфаміновою кислотою, 2-гідроксибензойною 96436 6 кислотою, 4-аміно-2-гідроксибензойною кислотою та подібними кислотами. Термін "адитивні солі" також включає гідрати та форми приєднання розчинників, які можуть бути отримані зі сполуки ТМС278. Прикладами таких форм є, наприклад, гідрати, алкоголяти та подібні. ТМС278 існує в стереоізомерних формах, більш конкретно - у Е- та Z-ізомерних формах. Обидва ізомери можуть бути використані в даному винаході. Всі посилання на ТМС278, зроблені в даній заявці, означають, що включена Е- або Zформа, а також будь-яка суміш обох форм. Переважною формою ТМС278 для використання в даному винаході є Ε-ізомер, тобто (Е)-4-[[4-[[4-(2ціаноетеніл)-2,6-диметилфеніл]-аміно]-2піримідиніл]-аміно]-бензонітрил, що позначається як Е-ТМС278. Також може бути використаний Zізомер ТМС278, тобто (Z)-4-[[4-[[4-(2-ціаноетеніл)2,6-диметилфеніл]-аміно]-2-піримідиніл]-аміно]бензонітрил, що може бути позначений як ZTMC278). Всі посилання на Ε-форму ТМС278 (тобто, ЕТМС278) у даному документі означають чистий Εізомер або будь-яку ізомерну суміш Е- та Z-форм, в якій переважно присутня Ε-форма, тобто ізомерну суміш, що містить більше, ніж 50% або зокрема більше, ніж 80% Ε-форми, або навіть більше, ніж 90% Ε-форми. Особливий інтерес представляє Εформа, по суті, вільна від Z-форми. В даному контексті «по суті вільний» означає суміші E-Z без або майже без Z-форми, наприклад, ізомерні суміші, що містять 90%, зокрема 95% або навіть 98% або 99% Ε-форми. Так само, всі посилання в даній заявці на Z-форму ТМС278 (тобто Z-TMC278) означають чистий Z- ізомер або будь-яку ізомерну суміш Z- та Ε-форм, в якій переважно присутня Zформа, тобто ізомерну суміш, що містить більше, ніж 50% або зокрема більше, ніж 80% Z-форми, або навіть більше, ніж 90% Z-форми. Особливий інтерес представляє Z-форма, по суті, вільна від Ε-форми. У даному контексті «по суті вільний» означає суміші E-Z, в яких відсутня або майже відсутня Ε-форма, наприклад, ізомерні суміші, що містять до 90%, зокрема - 95% або навіть 98% або 99% Z-форми. Також застосування за даним винаходом включає солі стереоізомерних форм ТМС278, зокрема, солі, зазначених вище Z-TMC278 або ЕТМС278. Термін «ТМС278», як використовується в даній заявці, відноситься як до основної форми, так і до її фармацевтично прийнятних кислотноадитивних солей, а також до стереоізомерних форм ТМС278, а також до будь-якої фармацевтично прийнятної кислотно-адитивної солі зазначених стереоізомерних форм. Зокрема, термін «ТМС278» відноситься до Е-ізомеру ТМС278, а також до його фармацевтично прийнятних кислотно-адитивних солей. Введення ТМС278 за даним винаходом може бути достатнім для лікування ВІЛ-інфекції, однак, в значній кількості випадків може бути рекомендоване одночасне введення інших інгібіторів ВІЛ. Останні переважно включають ВІЛ-інгібітори інших класів, зокрема, вибрані з NRTI, РІ та інгібіторів 7 злиття. В одному з варіантів втілення іншим ВІЛінгібітором, що вводиться одночасно, є РІ. У ще одному варіанті втілення іншим ВІЛ-їнгібітором, що вводиться одночасно, є NRTI. ВІЛ-інгібітори, що можуть бути введені одночасно, можуть бути тими, котрі застосовуються в комбінаціях HAART, що містять NNRTI. Наприклад, спільно можуть бути введені ще два NRTI або NRTI та РІ. Таке спільне введення може бути пероральним або парентеральним. У певних випадках лікування ВІЛ-інфекції може бути обмежене тільки введенням парентеральної форми ТМС278 відповідно до методології за даним винаходом, тобто у вигляді монотерапії без спільного введення додаткових інгібіторів ВІЛ. Такий варіант може бути рекомендований, наприклад, при відносно низькому вірусному навантаженні, наприклад, коли вірусне навантаження (представлене як кількість копій вірусної РНК у визначеному об'ємі сироватки) нижче, ніж приблизно 200 копій/мл, зокрема - нижче, ніж приблизно 100 копій/мл, більш конкретно - нижче, ніж 50 копій/мл, більш конкретно - нижче рівня детектування вірусу. В одному з варіантів втілення, цей тип монотерапії застосовують після первісного лікування за допомогою комбінації лікарських засобів проти ВІЛ, зокрема будь-якої комбінації HAART протягом визначеного періоду часу доти, поки вірусне навантаження в плазмі крові не досягне вищезазначеного низького рівня вірусу. Таким чином, в подальшому аспекті даний винахід відноситься до застосування парентеральної форми, що містить ефективну проти вірусу кількість ТМС278 або його фармацевтично прийнятної кислотно-адитивної солі та носій, для лікування пацієнтів, інфікованих ВІЛ, для виробництва лікарського засобу для лікування пацієнтів, інфікованих ВІЛ, де препаративну форму вводять після лікування зазначеного пацієнта комбінацією інгібіторів ВІЛ, та препаративну форму вводять періодично через інтервал часу, що знаходиться в діапазоні від одного тижня до одного року. Або в подальшому аспекті даний винахід забезпечує спосіб довгострокового лікування суб'єкта, інфікованого ВІЛ, який включає (і) лікування зазначеного суб'єкта комбінацією інгібіторів ВІЛ; з наступним (іі) періодичним введенням парентеральної форми, що містить ефективну кількість ТМС278 або його фармацевтично прийнятної кислотно-адитивної солі та носій, де препаративну форму вводять через інтервал часу, що знаходиться в діапазоні від одного тижня до одного року. В одному з варіантів втілення в застосуванні або в способі, зазначених в попередніх двох абзацах, періодичне лікування парентеральною препаративною формою ТМС278 починають або повинні починати після лікування комбінацією лікарських засобів проти ВІЛ, що зменшує вірусне навантаження нижче приблизно 200 копій/мл, зокрема нижче приблизно 100 копій/мл, більш конкретно нижче 50 копій/мл або нижче межі виявлення вірусу. Парентеральні форми ТМС278 вводять періодично через інтервали часу, щонайменше, в один 96436 8 тиждень, або більш конкретно - через інтервал часу, зазначений в даній заявці, що означає, що парентеральну форму вводять без будь-яких додаткових проміжних введень ТМС278. Або іншими словами, ТМС278 вводять у конкретні моменти часу, відділені один від одного періодом часу, щонайменше, в один тиждень або більш конкретно через інтервал часу, зазначений в даній заявці, протягом якого ТМС278 не вводять. Отже, режим введення є простим, що вимагає декількох введень та тому різко зменшує проблему «медикаментозного навантаження», з яким зіштовхуються при стандартному медикаментозному лікуванні ВІЛ. Це у свою чергу підвищує дотримання пацієнтом запропонованого медикаментозного лікування. Парентеральні форми ТМС278 можуть бути введені через інтервали часу, зазначені вище. В одному з варіантів втілення інтервал часу знаходиться в діапазоні від одного до двох тижнів або від двох до трьох тижнів, або від трьох до чотирьох тижнів. У ще одному втіленні інтервал часу знаходиться в діапазоні від одного до двох місяців або від двох до трьох місяців, або від трьох до чотирьох місяців. Інтервал часу може складати, щонайменше, один тиждень, але також може складати кілька тижнів, наприклад, 2, 3, 4, 5 або 6 тижнів, або інтервали часу в один місяць або кілька місяців, наприклад, 2, 3, 4, 5 або 6 місяців або навіть довше, наприклад, 7, 8, 9 або 12 місяців. В одному з варіантів втілення парентеральну препаративну форму вводять через інтервал часу в один, два або три місяці. Ці більш тривалі періоди між кожним введенням парентеральної форми дають додаткове полегшення «медикаментозного навантаження» та дотримання схеми лікування. Для більшого дотримання пацієнтами схеми лікування можна порекомендувати приймати ліки у визначений день тижня, коли препаративну форму вводять щотижня, або у визначений день місяця, коли введення щомісячне. Інтервали часу між кожним введенням парентеральної препаративної форми ТМС278 можуть варіювати. Наприклад, інтервали можуть бути коротше, коли вважають, що рівень ТМС278 у плазмі крові занадто низький, наприклад, коли він наближається до мінімального рівня в плазмі крові, визначеного нижче в даному документі. Інтервали можуть бути більш тривалими, коли вважають, що рівень ТМС278 у плазмі крові занадто високий. В одному з варіантів втілення парентеральні препаративні форми ТМС278 вводять через однакові інтервали часу, наприклад, щотижня або кожні два тижні, кожен місяць або кожен деякий інтервал часу, зазначений ь даній заявці. Рівні інтервали часу мають ту перевагу, що введення, наприклад, у той самий день тижня або той самий день місяця, таким чином, вносить вклад у дотримання схеми лікування. Як використовується в даній заявці, термін «лікування ВІЛ-інфекції» відноситься до ситуації лікування суб'єкта, інфікованого ВІЛ. Термін «суб'єкт» зокрема відноситься до людини. Переважно, парентеральну форму вводять одноразово, наприклад, шляхом однієї ін'єкції через інтервали часу, щонайменше, в один тиждень, 9 наприклад, шляхом однієї ін'єкції щотижня або однієї ін'єкції кожен місяць. Дозу ТМС278 для введення, що складає кількість ТМС278 у парентеральній препаративній формі для застосування за даним винаходом, вибирають так, щоб концентрація ТМС278 у плазмі крові підтримувалася протягом тривалого періоду часу вище мінімального рівня в плазмі крові. Термін «мінімальний рівень у плазмі крові» у даному контексті означає найбільш низький ефективний рівень у плазмі крові, останній - це такий рівень ТМС278 у плазмі крові, що забезпечує ефективне лікування ВІЛ, або, іншими словами, такий рівень ТМС278, що ефективний для придушення ВІЛ. Терміни «ефективне лікування ВІЛ», «ефективне придушення вірусного навантаження» або подібні терміни означають, що лікування приводить до того, що розмноження ВІЛ придушується до такого рівня, що вірусне навантаження стає порівняно низьким, наприклад, до вірусного навантаження (представленого як кількість копій вірусної РНК у визначеному об'ємі сироватки) нижче, ніж приблизно 200 копій/мл, зокрема нижче приблизно 100 копій/мл, більш конкретно - нижче 50 копій/мл, особливо нижче межі детектування вірусу. «Ефективна кількість» означає таку кількість ТМС278, яка при введенні зменшує вірусне навантаження, зокрема зменшує вірусне навантаження нижче кількості копій, зазначених вище. Термін «ефективний рівень у плазмі крові» означає такий рівень ТМС278 у плазмі крові, що приводить до зменшення вірусного навантаження, зокрема нижче кількості копій, зазначених вище. Зокрема, рівень ТМС278 у плазмі крові підтримується на рівні, вище мінімального рівня в плазмі крові, що знаходиться в діапазоні від приблизно 5 до приблизно 500 нг/мл, або від приблизно 5 нг/мл до приблизно 200 нг/мл, або від приблизно 5 нг/мл до приблизно 100 нг/мл, або від приблизно 10 нг/мл до приблизно 50 нг/мл. Більш конкретно, рівень ТМС278 у плазмі крові підтримують на рівні, вище мінімального рівня в плазмі крові, що знаходиться в діапазоні від приблизно 5 до приблизно 50 нг/мл, або в діапазоні від приблизно 10 до приблизно 50 нг/мл, або в діапазоні від приблизно 15 до приблизно 50 нг/мл. У визначених варіантах втілення рівень ТМС278 у плазмі крові підтримували вище мінімального рівня в плазмі крові - приблизно 10 нг/мл, або приблизно 15 нг/мл, або приблизно 20 нг/мл, або приблизно 40 нг/мл, або приблизно 100 нг/мл, або приблизно 200 нг/мл, або приблизно 400 нг/мл. У конкретному варіанті втілення рівень ТМС278 у плазмі крові підтримували вище рівня приблизно 13,5 нг/мл або приблизно 20,3 нг/мл. Рівень ТМС278 у плазмі повинен підтримуватися вище граничного рівня в плазмі крові, оскільки при більш низьких рівнях ліки можуть виявитися вже не ефективними, що підвищує ризик мутацій. Доза ТМС278, що вводиться, також залежить від інтервалу часу, через який її вводять. Доза повинна бути вищою, якщо введення здійснюють рідше. Доза, що вводиться, щораз повинна розраховуватися, виходячи з від приблизно 0,5 мг/день до 96436 10 приблизно 50 мг/день, або від приблизно 1 мг/день до приблизно 20 мг/день, або від приблизно 1 мг/день до приблизно 10 мг/день, або від приблизно 3 мг/день до приблизно 7 мг/день, наприклад, приблизно 5 мг/день. Це відповідає тижневій дозі від приблизно 3,5 мг до приблизно 350 мг, або від приблизно 7 мг до приблизно 140 мг, або від приблизно 7 мг до приблизно 70 мг, або від приблизно 21 мг до приблизно 49 мг, наприклад, приблизно 35 мг, або місячній дозі від приблизно 15 мг до приблизно 1500 мг, або від приблизно 30 мг до приблизно 600 мг, або від приблизно 30 мг до приблизно 300 мг, або від приблизно 90 мг до приблизно 210 мг, наприклад, приблизно 150 мг. Множення вищезазначеної денної дози на кількість днів за даний інтервал часу надає дози або дозу, що відповідає такому інтервалу часу. Було виявлено, що після введення рівень ТМС278 у плазмі крові залишається більш-менш стабільним, тобто коливається в обмежених межах. Було виявлено, що рівень у плазмі крові наближається до стабільного стану протягом тривалого періоду часу. Що стосується «стабільного стану», це означає умови, коли кількість ліків, що присутні у плазмі крові пацієнта, залишається більш-менш на тому самому рівні протягом тривалого періоду часу. Рівень ТМС278 у плазмі, в цілому, не виявляє спадів, нижче мінімального рівня в плазмі, при якому ліки є ефективними. Вираз «залишається більш-менш на тому самому рівні» не виключає, що можуть існувати невеликі коливання концентрації в плазмі в межах прийнятного діапазону, наприклад, зокрема у межах приблизно 30%, у межах приблизно 20%, ще більш конкретно в межах приблизно 10%. Концентрацію (або «С») ТМС278 у плазмі суб'єкта звичайно виражають в одиницях маса на об'єм, звичайно нанограми на мілілітр (нг/мл). Для зручності в даній заявці ця концентрація може бути позначена як «концентрація лікарського засобу в плазмі» або «концентрація в плазмі». Концентрація ТМС278 у плазмі може досягати відносно високих рівней, не викликаючи істотних побічних ефектів, але не повинна перевищувати максимального рівня в плазмі (або Сmах), що є рівнем у плазмі крові, коли ТМС278 викликає істотні побічні ефекти. Як використовується в даній заявці, термін «істотні побічні ефекти» означає, що побічні ефекти присутні у релевантної кількості пацієнтів до такого ступеня, що побічні ефекти впливають на нормальне життя пацієнтів. C max TMC278 може бути визначена з екстраполяції даних клітинних досліджень або за оцінкою клінічного дослідження та переважно не повинна перевищувати значення приблизно 1000 нг/мл. У деяких випадках на початку можуть бути присутні невеликі піки концентрації в плазмі незабаром після введення, після чого рівень у плазмі досягає стабільного, як зазначено вище. Парентеральні форми ТМС278 можуть бути введені шляхом внутрішньовенної ін'єкції або, переважно, шляхом підшкірного або внутрім'язового введення. Даний винахід базується на застосуванні парентеральних препаративних форм активного інг 11 редієнта ТМС278 та тому вид носія повинен вибиратися так, щоб відповідати парентеральному введенню. Носій повинен бути рідким та може бути маслоподібним, але в більшості випадків повинен бути водним. В останньому випадку носій містить стерильну воду, хоча в нього можуть бути включені інші інгредієнти. Носій може також містити додатковий розчинник, наприклад, спирт, такий як етанол, пропанол, етиленгліколь, пропіленгліколь, або полімер, що діє як співрозчинник, такий як поліетиленгліколь (PEG) або поліетоксильована касторова олія (Cremophor). Для поліпшення розчинності активної сполуки в парентеральні форми активного інгредієнта ТМС278 можуть бути додані додаткові інгредієнти, що сприяють розчиненню, такі як солюбілізатори та поверхнево-активні речовини, або інгредієнти, що одночасно є поверхнево-активною речовиною та солюбілізатором. Прикладами таких додаткових інгредієнтів є циклодекстрини або похідні циклодекстринів. Підходящими циклодекстринами є -, -, -циклодекстрини або їх ефіри та суміші їх ефірів, в яких одна або більше гідроксильних груп ангідроглюкозних залишків циклодекстрину заміщена С16алкілом, зокрема метилом, етилом або ізопропілом, наприклад, випадково метильований -CD; гідроксіС1-6алкілом, зокрема гідроксіетилом, гідроксипропілом або гідроксибутилом; карбоксіС16алкілом, зокрема карбоксиметилом або карбоксіетилом; С1-6алкілкарбонілом, зокрема ацетилом. Особливо як комплексанти та/або солюбілізатори на увагу заслуговують -CD, випадково метильований -CD, 2,6-диметил--CD, 2-гідроксіетил-СD, 2-гідроксіетил--СD, 2-гідроксипропіл--CD та (2-карбоксиметокси)пропіл--CD, та зокрема 2гідроксипропіл--CD (2-HP--CD). Іншими такими інгредієнтами з поверхневоактивними властивостями є полоксамери, що являють собою блок-кополімери поліоксіетилену, поліоксипропілену, що загалом відповідають формулі НО-[СН2СН2О]x-[CH(CH3)CH2O]y-[CH2CH2O]zH, де х, у та z можуть мати різні значення, доступні під торговою маркою Pluronic, наприклад, Pluronic F108, що відповідає полоксамеру 338, для якого середні значення х, у та z складають, відповідно 128, 54 та 128. Іншими такими інгредієнтами є -токоферил поліетиленгліколь сукцинати, зокрема вітамін Ε TGPS; ефіри поліоксіетилен сорбітану з жирними кислотами (також позначені як полісорбати), доступні під торговою маркою Tween, наприклад, Tween 80; поліетиленгліколі (PEGs), такі як PEG 400. Парентеральні препаративні форми активного інгредієнта ТМС278 також можуть містити суспендуючі агенти та буфери та/або агенти, що регулюють рН, та необов'язково консерванти і агенти, що забезпечують ізотонічність розчину. Конкретні інгредієнти можуть діяти як два або більше таких агентів одночасно, наприклад, діяти як консервант та буфер або діяти як буфер та агент, що забезпечує ізотонічність. Буферизуючі агенти та агенти, що регулюють рН, повинні бути використані в кількості, достатній для підтримки дисперсії від нейтральної до дуже 96436 12 слабко лужної (до рН 8,5), переважно у діапазоні рН від 7 до 7,5. Конкретні буфери являють собою солі слабкої кислоти. Буферизуючі агенти та агенти, що регулюють рН, що можуть бути додані, можуть бути вибрані з винної кислоти, малеїнової кислоти, гліцину, лактату натрію/молочної кислоти, аскорбінової кислоти, цитрату натрію/лимонної кислоти, ацетату натрію/оцтової кислоти, бікарбонату натрію/вугільної кислоти, сукцинату натрію/бурштинової кислоти, бензоату натрію/бензойної кислоти, фосфатів натрію, трис(гідроксиметил)аминометану, бікарбонату натрію/карбонату натрію, гідроксиду амонію, бензолсульфонової кислоти, бензоату натрію/кислоти, діетаноламіну, глюконо-дельта-лактону, соляної кислоти, бромистого водню, лізину, метансульфонової кислоти, моноетаноламіну, гідроксиду натрію, трометаміну, глюконової кислоти, гліцеринової кислоти, глутарової кислоти, глютамінової кислоти, етилендіамін тетраоцтової (EDTA) кислоти, триетаноламіну, включаючи їх суміші. Консерванти включають протимікробні препарати й антиоксиданти, що можуть бути вибрані з групи, що включає бензойну кислоту, бензиловий спирт, бутильований гідроксіанізол (ВНА), бутильований гідрокситолуол (ВНТ), хлорбутол, галат, гідроксибензоат, EDTA, фенол, хлоркрезол, метакрезол, хлорид бензетонію, хлорид міристил-піколінію, фенілртутьацетат та тимеросал. Поглиначі радикалів включають ВНА, ВНТ, вітамін Ε та аскорбіл пальмітат та їх суміші. Поглиначі кисню включають аскорбат натрію, сульфіт натрію, Lцистеїн, ацетилцистеїн, метіонін, тіогліцерин, ацетон біосульфіт натрію, ізоаскорбінову кислоту, гідроксипропіл циклодекстрин. Хелатуючі агенти включають цитрат натрію, EDTA натрію та яблучну кислоту. Агенти, що забезпечують ізотонічність середовища, являють собою, наприклад, хлорид натрію, декстрозу, сахарозу, фруктозу, трегалозу, маніт, гліцерин, сорбіт, ксиліт, лактозу, сульфат натрію. Суспензії звичайно містять від 0 до 10% (маса/об'єм), зокрема від 0 до 6% агента, що забезпечує ізотонічність. Переважними є типові неіонні агенти, що забезпечують ізотонічность, зокрема гліцерин, оскільки електроліти можуть впливати на колоїдну стабільність. В деяких випадках парентеральні препаративні форми ТМС278 можуть бути виготовлені з або в підходящому носії контрольованого вивільнення чи безперервного вивільнення або носії безперервного вивільнення. Наприклад, активний інгредієнт ТМС278 може бути інкапсульований у малі полімерні мікросфери, що повільно розкладаються та виділяють активний інгредієнт із контрольованою швидкістю. Однією з форм мікросфер є форма, в якій активний інгредієнт інкапсульований у біодеградуючий полімер, такий як полілактидні/полігліколідні полімери або кополімери. Іншою технологією на основі полімерів є технологія ReGel фірми MacroMed, в якій використовуються триблок-кополімери полі(лактид-ко-гліколід) та поліетиленгліколю. Вони є термочутливими та біодеградуючими полімерами, що перетворюються на гель при нагріванні та по 13 вертаються у вихідний стан при охолодженні. Ці полімерно-гідрогельні системи при температурі введення вводяться як розчини та перетворюються на нерозчинні гелі в місці ін'єкції. Депо нерозчинного гелю утворюється негайно після ін'єкції та залишається в цьому місці на період у кілька тижнів. Виділення лікарського засобу контролюється за допомогою комбінації дифузії з полімеру та деградації полімеру. Ще один тип уповільненого виділення форми дозування, введеної за допомогою ін'єкції, базується на ліпосомних системах, що можуть бути використані у випадку ліпофільних ліків або ліпофільно модифікованих проліків. Ліпосомні частки можуть бути покриті, наприклад, поліетиленгліколем, щоб виключити вплив імунної системи. Іншим типом постійного виділення форми дозування, введеної за допомогою ін'єкції, є мікроскопічні сферичні частки, відомі як DepoFoam фірми SkyePharma. Ці частки, в основному ліпідні за природою, містять безліч водних камер, в які інкапсульовані ліки, що повинні виділитися. Переважно носій вибраний з таких, з якими форма дозування є добре переносимою з міілмальними або відсутніми побічними ефектами. Парентеральні форми дозування ТМС278 при введенні за даним винаходом забезпечують ефективне лікування ВІЛ-інфекції, оскільки знижують вірусне навантаження при придушенні реплікації вірусу. Обмежена кількість введення ліків та відсутність небажаних побічних ефектів після кожного введення сприяє дотриманню пацієнтом режиму лікування. Дотримання пацієнтом режиму лікування також може бути посилене вибором парентеральних препаративних форм, що демонструють добру місцеву переносимість та легкість введення. Приклад Даний приклад демонструє дослідження, спрямоване на те, щоб показати, що введення парентеральної форми ТМС278 приводить до стабільного рівня в плазмі крові протягом тривалого періоду часу. При збільшенні дози парентеральної препаративної форми ТМС278 досягається його більш високий рівень у плазмі крові, наприклад, можна очікувати, що доза приблизно 10 мг/кг приводить до досягнення ефективного рівня в плазмі крові. Шляхом періодичного введення парентеральної форми через інтервали часу в один місяць досягається стабільний рівень ТМС278, у плазмі крові, ефективно придушуючи розмноження вірусу. Дослідження проводили для вивчення кінетики ТМС278 в плазмі та його абсолютної біодоступності на собаках породи бігль після одиничного внутрішньом'язового введення (ВМ) у водному 30% диметилацетаміду (DMA)/50% поліетиленгліколю 400 (PEG400) розчині ТМС278 при 2,5 мг/кг. Собакам дози вводили ВМ. У даному експерименті були використані два самці собак породи бігль (собаки №№ 16924 та 16854), у віці приблизно 3 роки та вагою між 11 та 12 кг на початковій фазі експерименту. Собаки одержували дози внутрішньом'язово з розрахунку 0,1 мл/кг маси тіла шляхом ін'єкції препаративної форми в лівий (собака № 16924) або правий (собака № 16854) т. biceps femoris. 96436 14 За день до введення дози ТМС278 одержували у водному розчині 30% (м/о) DMA/50% (м/о) PEG400 при 25 мг/мл. Інгредієнти розчину: ТМС278, DMA 30% (м/о), PEG 400 50% (м/о) та апірогенна вода. Вміст ТМС278 у препаративній формі перевіряли за допомогою РХ. Концентрація ТМС278 у препаративній формі складала 25 мг/мл. Зразки крові (4 мл з EDTA) брали з яремної вени собак у 0 (= перед веденням), 0,5, 1, 2, 4, 8, 24, 32, 48, 72, 96, 144, 192, 240 та 312 год після введення дози. Після взяття зразків їх негайно поміщали в лід, що тане, та захищали від світла. Зразки крові центрифугували при приблизно 1900 x г протягом 10 хвилин при 5°С для відділення плазми. Негайно після відділення зразки плазми захищали від світла, поміщали на лід, що тане, та зберігали при -18°C до аналізу. Заморожені зразки плазми переносили для проведення біоаналізу. Оскільки ТМС278 ще виявляли у зразках плазми через 312 год після введення дози, додаткові зразки крові з обох собак одержували на 36, 50, 64, 78, 92, 106, 120, 134 та 148 день. Ці зразки обробляли аналогічним чином та аналізували. На 232 день після введення дози проводили біопсію (тільки на собаці № 16924) підвздошного лімфатичного вузла (з боку ін'єкції), м'яза із задньої лапи, в яку не вводили ін'єкцію, та м'яза з боку ін'єкції після ультразвукового дослідження. Усі зразки тканини захищали від світла, наскільки це можливо, та зберігали на льоді, що тане. Усі зразки захищали від світла та зберігали при < -18°C. Нарешті, додатковий зразок крові одержували на 272-й день. Цей зразок обробляли та аналізували подібно до інших зразків крові. Концентрацію ТМС278 у плазмі собаки визначали шляхом підходящого дослідження за допомогою способу PX-MS/MS після твердофазної екстракції (SPE). Концентрації ТМС278 у плазмі визначали після відповідного очищення зразка. Зразки (аліквоти плазми по 0,1 мл) екстрагували за допомогою способу твердофазної екстракції (твердофазні колонки Bond Elut Certify, 130 мг, SPE, фірма Varian). Колонку SPE кондиціонували за допомогою 3 мл метанолу, 3 мл води та 1 мл 1 Μ оцтової кислоти. Після додавання 3 мл оцтової кислоти до аліквот плазми по 0,1 мл, зразки екстрагували на колонці, після чого відмивали колонку 1 мл води, 1 мл 1 Μ оцтової кислоти та 3 мл метанолу. Колонку елюювали за допомогою 3 мл метанолу/NH4ОН 25% (98:2, об'єм/об'єм). Екстракт випарювали насухо та відновлювали в 150 мкл форміату амонію 0,01 Μ (доведеного до рН 4 мурашиною кислотою)/метанол (50/50). Аліквоти по 20 мкл впорскували в колонку для обернено-фазової рідинної хроматографії (100x4,6 мм ID, набитої Hypersil C18 BDS) зі швидкістю потоку 800 мкл/хв. Суміш для елюювання складалася з форміату амонію 0,01 Μ (доведеного до рН 4 мурашиною кислотою)/метанол (40:60, об'єм/об'єм). Швидкість потоку в мас-спектрометрі складала приблизно 100 мкл/хв після поділу. Аналіз за допомогою PXMS/MS проводили за допомогою системи АРІ-3000 15 (фірма Applied Biosystems), з'єднаної із системою ВЕРХ. Концентрацію ТМС278 в зразках тканин собаки також визначали за допомогою підходящого способу PX-MS/MS. Зразки тканини гомогенізували при 10-кратному розведенні водою Milli-Q за допомогою Ultra-Turrax. Гомогенати тканини (аліквоти по 200 мкл) екстрагували додаванням 600 мкл метанолу (що містить ТМС278 та/або R152929 та/або метанол). Після інтенсивного перемішування та центрифугування надосадову рідину переносили в пробірку для ВЕРХ та впорскували аліквоту 20 мкл. Умови РХ та MSMS були такими ж, як описані вище. Нижня межа кількісного визначення складала 10,0 нг/г тканини. Зразки під час біологічного аналізу захищали від світла. Індивідуальні профілі концентрації від часу піддавали фармакокінетичному аналізу без компартменталізації. Визначали пік концентрацій в плазмі (Сmах) та відповідний пік часу (Тmах). Площа під кривою (AUC) з моменту часу 0 до часу t (AUC0t, де t момент часу, пов'язаний з останньою виміряною концентрацією, вище межі кількісного визначення) розраховували за допомогою лінійного/логарифмічного правила трапеції: тобто лінійного правила трапеції до Tmax: AUC0Tmax=[(ti+1-ti)·(Ci+Сі+1)/2], та логарифмічного правила трапеції для залишку кривої: AUCTmax-t=[(ti+1ti)·(Ci-Сі+1)/ln(Ci/Ci+1)], Ci та Сі+1 - концентрації в плазмі в моменти часу ti та ti+1, відповідно. Площа під кривою, екстрапольована до нескінченності (AUC0-) та абсолютна біодоступність ТМС278 у даній формулі не може бути розрахована адекватно, тому що концентрації в плазмі залишаються чітко постійними або злегка підвищуються між 72 год та 312 год після введення. Час напіввиведення розраховували між 1 год та 24 год (t1/2, 1-24 год) або між 8 год та 24 год (t1/2, 8-24 год) та між 24 год та 72 год після введення (t1/2, 24-72 год) відповідно до 96436 16 t1/2=ln(2)/k, де k відповідає константі швидкості за відповідний часовий діапазон. Розраховували середні (n=2) концентрації в плазмі та фармакокінетичні параметри. Індивідуальні та середні (n=2) концентрації в плазмі та/або деякі основні фармакокінетичні параметри наведені в Табл.1 та Табл.2. Рівні в тканинах (підвздошний лімфатичний вузол, м'яз), зібраних на 232 день після введення, наведені в Табл. 3. Після внутрішньом'язового введення водного 30% DMA/50% PEG400 розчину ТМС278 при 2,5 мг/кг, середній пік концентрацій у плазмі (Сmах) досягав 31,9 нг/мл. Індивідуальний пік рівня в плазмі крові досягався між 1 та 8 год після введення. Після досягнення Сmах, рівень у плазмі швидко знижувався до 24 год після введення, після чого випливало більш повільне зниження до 72 год після введення з часом напіввиведення (t1/2, 24-72 год) 63 год. Через 72 год після введення рівень у плазмі залишався чітко постійним або злегка підвищувався до 312 год після введення. Середнє значення АUС0-310 год досягало 1863 нг.год/мл. Оскільки концентрації в плазмі залишалися чітко постійними або злегка підвищеними між 72 год та 312 год після введення, брали додаткові зразки крові на 36, 50, 64, 78, 92, 106, 120, 134 та 148 день. Протягом цього періоду «розведення» рівень у плазмі залишався чітко постійним (діапазон: 1,24-4,23 нг/мл). Потім проводили біопсію підвздошного лімфатичного вузла (з боку ін'єкції), м'яза із задньої ноги, в яку не робили ін'єкцію, та м'яза з боку ін'єкції. Біопсію виконували на 232-й день тільки на собаці №16924. Рівень ТМС278 у м'язах був нижче межі кількісного визначення (10,0 нг/г). Рівень у лімфатичному вузлі досягав 72,6 нг/г, який був високий відносно концентрації в плазмі на 148-й день (тобто в середньому 1,33 нг/мл) та на 272-й день (
ДивитисяДодаткова інформація
Назва патенту англійськоюLong term treatment of hiv infection
Автори англійськоюBaert Lieven Elvire Colette, Kraus Guenter, Van 'T Klooster Gerben Albert Eleutherius
Назва патенту російськоюДолгосрочное лечение вич-инфекции
Автори російськоюБаерт Ливен Эльвир Колетте, Краус Гуентер, Вант Клустер Гербен Альберт Элеузериус
МПК / Мітки
МПК: A61K 31/505, A61P 31/18
Мітки: лікування, віл-інфекції, довгострокове
Код посилання
<a href="https://ua.patents.su/10-96436-dovgostrokove-likuvannya-vil-infekci.html" target="_blank" rel="follow" title="База патентів України">Довгострокове лікування віл-інфекції</a>
Попередній патент: Дозатор насіння з гнучким висівним диском
Наступний патент: Багатошарова пляшка та контейнер
Випадковий патент: Спосіб зведення дерев'яних споруд