Похідні с-4″-заміщених макролідів, спосіб їх одержання, проміжні сполуки, фармацевтична композиція та спосіб лікування бактеріальної інфекції або протозойної інфекції
Номер патенту: 70298
Опубліковано: 15.10.2004
Автори: Бронк Браян Скотт, Глейзер Едвард Алан, Ченг Хенгміао, Канеко Такуші, Летавіц Майкл Ентоні, Янг Бінгвей Вера
Формула / Реферат
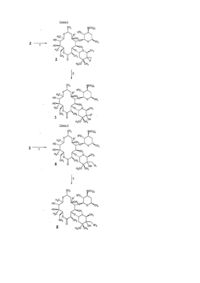
1. Сполука формули:
або її фармацевтично прийнятна сіль, в якій:
X являє собою -CН(NR9R10)-, -C(О)-, -C(=NOR9)-, -CH2NR9- або -N(C1-C6алкіл)CH2-, де перша рисочка кожного значення групи X приєднана до C-10 вуглецю сполуки формули 1 і остання рисочка кожного значення групи X приєднана до C-8 вуглецю сполуки формули 1;
R1 являє собою H, гідрокси або метокси;
R2 являє собою гідрокси;
R3 являє собою C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, ціано, -CH2S(О)nR8, де n є цілим числом в інтервалі від 0 дo 2, -CH2OR8, -CH2N(COR9)R8, -CH2NR8R15, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R3-групи, необов'язково, заміщені від 1 дo 3 групами R16;
або R2 і R3 узяті разом утворюють оксазолінове кільце, яке показано нижче:
;
R4 являє собою H, -C(О)R9, -C(О)OR9, -C(О)NR9R10 або гідроксизахисну групу;
R5 являє собою -SR8, -(CH2)nC(О)R8, де n дорівнює 0 або 1, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R5-групи, необов'язково, заміщені від 1 дo 3 групами R16;
кожний R6 і R7, незалежно один від одного, -H, гідрокси, C1-C6алкокси, C1-C6алкіл, C2-C6алкеніл, C2-C6алкініл, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4;
кожний R8 незалежно -Н, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, -(CH2)qCR11R12(CH2)rNR13R14, де q i r, кожний незалежно, лежать в інтервалі від 0 дo 3, при умові, що q i r одночасно обидва не дорівнюють 0, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R8-групи, за виключенням Н, необов'язково, заміщені від 1 дo 3 групами R16;
або де R8 являє собою -CH2NR8R15, R15 і R8 можуть бути узяті разом, утворюючи 4-10-членне насичене моноциклічне або поліциклічне насичене кільце або 5-10-членне гетероарильне кільце, що необов’язково містить крім атома азоту, до якого приєднані R15 і R8, 1 або 2 гетероатоми, що вибрані з О, S і -N(R8)-, вищезгадане насичене кільце необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки, і вищезгадані насичене і гетероарильне кільця необов’язково заміщені від 1 дo 3 групами R16;
кожний R9 і R10 незалежно H або C1-C6алкіл;
кожний R11, R12, R13 і R14 незалежно вибирають з H, C1-C10алкілу, -(CH2)m(C6-C10арилу) і -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані групи R11, R12, R13 і R14, за виключенням Н, необов'язково заміщені від 1 дo 3 групами R16;
або R11 і R13 узяті разом утворюють -(CH2)p-, де p є цілим числом в інтервалі від 0 дo 3, так що 4-7-членне насичене кільце, що вони утворюють, необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки;
або R13 і R14 узяті разом утворюють 4-10-членне насичене моноциклічне або поліциклічне насичене кільце або 5-10-членне гетероарильне кільце, де насичене і гетероарильне кільця необов’язково містять крім атома азоту, до якого приєднані R13 і R14, 1 або 2 гетероатоми, що вибрані з О, S і -N(R8)-, вищезгадане насичене кільце необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки, і вищезгадані насичене і гетероарильне кільця необов’язково заміщені від 1 дo 3 групами R16;
R15 являє собою H, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, в якому раніше згадані групи R15, необов’язково, заміщені від 1 дo 3 замісниками, незалежно вибраними з галогену і -OR9;
кожний R16 незалежно вибирають з галогену, ціано, нітро, трифторметилу, азидо, -C(О)R17, -C(О)OR17, -C(О)OR17, -OC(О)OR17, -NR6С(О)R7, -C(О)NR6R7, -NR6R7, гідрокси, C1-C6алкілу, C1-C6алкокси, -(CH2)m(C6-C10арилу) і -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4, і де згадані арильні і гетероарильні замісники, необов’язково, заміщені 1 або 2 замісниками незалежно вибраними з галогену, ціано, нітро, трифторметилу, азидо, -C(О)R17, -C(О)OR17, -C(О)OR17, -OC(О)OR17, -NR6С(О)R7, -C(О)NR6R7, -NR6R7, гідрокси, C1-C6алкілу і C1-C6алкокси;
кожний R17 незалежно вибирають з H, C1-C10алкілу, C2-C10алкенілу, C2-C10алкінілу, -(CH2)m(C6-C10арилу) або -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4;
при умові, що R8 не є H, коли R3 являє собою -CH2S(О)nR8.
2. Сполука згідно з пунктом 1, в якій R4 являє собою Н, ацетил або бензилоксикарбоніл.
3. Сполука згідно з пунктом 2, в якій R1 являє собою гідрокси, R2 являє собою гідрокси, R3 є -CH2NR8R15 або CH2SR8.
4. Сполука згідно з пунктом 3, в якій R3 являє собою -CH2NR8R15 і R15 і R8 незалежно вибирають з H, C1-C10алкілу, C2-C10алкенілу і C2-C10алкінілу, де згадані групи R15 і R8, за винятком H, необов’язково заміщені 1 або 2 замісниками, що незалежно вибирають з гідрокси, галогену і C1-C6алкокси.
5. Сполука згідно з пунктом 4, в якій R15 і R8 кожний незалежно вибирають з Н, метилу, етилу, алілу, н-бутилу, ізобутилу, 2-метоксіетилу, циклопентилу, 3-метоксипропілу, 3-етоксипропілу, н-пропілу, ізопропілу, 2-гідроксіетилу, циклопропілу, 2,2,2-трифторетилу, 2-пропінілу, втор-бутилу, трет-бутилу і н-гексилу.
6. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси, R3 є -CH2NHR8 і R8 є -(CH2)m(C6-C10арилом), де m є цілим числом в інтервалі від 0 дo 4.
7. Сполука згідно з пунктом 6, в якій R8 є фенілом або бензилом.
8. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси, R3 є -CH2NR15R8, і R15 і R8 узяті разом утворюють 4-7-членне насичене кільце.
9. Сполука згідно з пунктом 8, в якій R15 і R8 узяті разом утворюють піперидинове, триметилeнiмiнoве або морфолінове кільце.
10. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси, R3 є -CH2NR15R8, і R15 і R8 узяті разом утворюють 5-10-членне гетероарильне кільце, необов'язково, заміщене 1 або 2 С1-С6алкільними групами.
11. Сполука згідно з пунктом 10, в якій R15 і R8 узяті разом утворюють піролідинове, триазольне або імідазольне кільце, де згадана гетероарильна група, необов'язково, заміщена 1 або 2 метильними групами.
12. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси, R3 є -CH2SR8 і R8 вибирають з C1-C10алкілу, C2-C10алкенілу і C2-C10алкінілу, де згадана група R8, необов’язково, заміщена 1 або 2 замісниками, незалежно вибраними з гідрокси, галогену і C1-C6алкокси.
13. Сполука згідно з пунктом 12, в якій R8 є метилом, етилом або 2-гідроксіетилом.
14. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси, і R3 вибирають з C1-C10алкілу, C2-C10алкенілу і C2-C10алкінілу, де згадана група R3, необов’язково, заміщена 1 або 2 замісниками, незалежно вибраними з гідрокси, -C(О)R17, -NR6R7, галогену, ціано, азидо, 5-10-членного гетероарилу і C1-C6алкокси.
15. Сполука згідно з пунктом 14, в якій R3 є метилом, aлілом, вінілом, eтинілом, 1-метил-1-пропенілом, 3-метокси-1-пропінілом, 3-диметиламіно-1-пропінілом, 2-піридилeтинілом, 1-пропінілом, 3-гідрокси-1-пропінілом, 3-гідрокси-1-пропенілом, 3-гідроксипропілом, 3-метокси-1-пропенілом, 3-метоксипропілом, 1-пропінілом, н-бутилом, етилом, пропілом, 2-гідроксіетилом, формілметилом, 6-ціано-1-пентинілом, 3-диметиламіно-1-пропенілом або 3-диметилaмiнoпропілом.
16. Сполука згідно з пунктом 2, в якій R1 є гідрокси R2 є гідрокси і R3 є -(CH2)m(5-10-членним гетероарилом), де m є цілим числом в інтервалі від 0 дo 4.
17. Сполука згідно з пунктом 16, в якій R3 є 2-тієнілом, 2-піридилом, 1-метил-2-імідазолілом, 2-фурилом або 1-метил-2-піролілом.
18. Сполука згідно з пунктом 2, в якій R1 є гідрокси, R2 є гідрокси і R3 є -(CH2)m(C6-C10 арилом), де m є цілим числом в інтервалі від 0 дo 4.
19. Сполука згідно з пунктом 18, в якій R3 є фенілом.
20. Сполука згідно з пунктом 2, в якій R2 і R3 узяті разом утворюють оксазолінове кільце, яке показано нижче:
.
21. Сполука згідно з пунктом 2, в якій R3 є наступною групою:
,
де X3 є О, S або -N(R15)-, R9 і R15 такі, як зазначено в пункті 1, і де -OR9-група може бути приєднана до будь-якого атома вуглецю фенільної групи.
22. Фармацевтична композиція для лікування бактеріальної інфекції або протозойної інфекції у ссавця, риби або птаха, що містить терапевтично ефективну кількість сполуки згідно з пунктом 1 і фармацевтично прийнятний носій.
23. Спосіб лікування бактеріальної інфекції або протозойної інфекції у ссавця, риби або птаха, в якому вводять згаданому ссавцю, рибі або птахові терапевтично ефективну кількість сполуки згідно з пунктом 1.
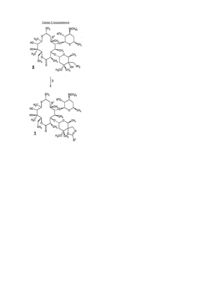
24. Спосіб одержання сполуки формули:
або її фармацевтично прийнятної солі, в якій:
X являє собою -CН(NR9R10)-, -C(О)-, -C(=NOR9)-, -CH2NR9- або -N(C1-C6алкіл)CH2-, де перша рисочка кожного значення групи X приєднана до C-10 вуглецю сполуки формули 1 і остання рисочка кожного значення групи X приєднана до C-8 вуглецю сполуки формули 1;
R1 являє собою H, гідрокси або метокси;
R2 являє собою гідрокси;
R3 являє собою C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, ціано, -CH2S(О)nR8, де n є цілим числом в інтервалі від 0 дo 2, -CH2OR8, -CH2N(COR9)R8, -CH2NR8R15, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R3-групи, необов'язково, заміщені від 1 дo 3 групами R16;
або R2 і R3 узяті разом утворюють оксазолінове кільце, яке показано нижче:
;
R4 являє собою H, -C(О)R9, -C(О)OR9, -C(О)NR9R10 або гідроксизахисну групу;
R5 являє собою -SR8, -(CH2)nC(О)R8, де n дорівнює 0 або 1, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R5-групи, необов'язково, заміщені від 1 дo 3 групами R16;
кожний R6 і R7, незалежно один від одного, -H, гідрокси, C1-C6алкокси, C1-C6алкіл, C2-C6алкеніл, C2-C6алкініл, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4;
кожний R8 незалежно -Н, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, -(CH2)qCR11R12(CH2)rNR13R14, де q i r, кожний незалежно, лежать в інтервалі від 0 дo 3, при умові, що q i r одночасно обидва не дорівнюють 0, -(CH2)m(C6-C10арил) або -(CH2)m(5-10-членний гетероарил), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані R8-групи, за виключенням Н, необов'язково, заміщені від 1 дo 3 групами R16;
або де R8 являє собою -CH2NR8R15, R15 і R8 можуть бути узяті разом, утворюючи 4-10-членне насичене моноциклічне або поліциклічне насичене кільце або 5-10-членне гетероарильне кільце, що необов’язково містить крім атома азоту, до якого приєднані R15 і R18, 1 або 2 гетероатоми, що вибрані з О, S і -N(R8)-, вищезгадане насичене кільце необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки, і вищезгадані насичене і гетероарильне кільця необов’язково заміщені від 1 дo 3 групами R16;
кожний R9 і R10 незалежно H або C1-C6алкіл;
кожний R11, R12, R13 і R14 незалежно вибирають з H, C1-C10алкілу, -(CH2)m(C6-C10арилу) і -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4, і де раніше загадані групи R11, R12, R13 і R14, за виключенням Н, необов'язково заміщені від 1 дo 3 групами R16;
або R11 і R13 узяті разом утворюють -(CH2)p-, де p є цілим числом в інтервалі від 0 дo 3, так що 4-7-членне насичене кільце, що вони утворюють, необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки;
або R13 і R14 узяті разом утворюють 4-10-членне насичене моноциклічне або поліциклічне насичене кільце або 5-10-членне гетероарильне кільце, де насичене і гетероарильне кільця необов’язково містять крім атому азоту, до якого приєднані R13 і R14, 1 або 2 гетероатоми, що вибрані з О, S і -N(R8)-, вищезгадане насичене кільце необов’язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв’язки, і вищезгадані насичене і гетероарильне кільця необов’язково заміщені від 1 дo 3 групами R16;
R15 являє собою H, C1-C10алкіл, C2-C10алкеніл, C2-C10алкініл, в якому раніше згадані групи R15, необов’язково, заміщені від 1 дo 3 замісниками, незалежно вибраними з галогену і -OR9;
кожний R16 незалежно вибирають з галогену, ціано, нітро, трифторметилу, азидо, -C(О)R17, -C(О)OR17, -C(О)OR17, -OC(О)OR17, -NR6С(О)R7, -C(О)NR6R7, -NR6R7, гідрокси, C1-C6алкілу, C1-C6алкокси, -(CH2)m(C6-C10арилу) і -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4, і де згадані арильні і гетероарильні замісники, необов’язково, заміщені 1 або 2 замісниками незалежно вибраними з галогену, ціано, нітро, трифторметилу, азидо, -C(О)R17, -C(О)OR17, -C(О)OR17, -OC(О)OR17, -NR6С(О)R7, -C(О)NR6R7, -NR6R7, гідрокси, C1-C6алкілу і C1-C6алкокси;
кожний R17 незалежно вибирають з H, C1-C10алкілу, C2-C10алкенілу, C2-C10алкінілу, -(CH2)m(C6-C10арилу) або -(CH2)m(5-10-членного гетероарилу), де m є цілим числом в інтервалі від 0 дo 4;
при умові, що R8 не є H, коли R3 являє собою -CH2S(О)nR8;
в якому вводять у взаємодію сполуку формули:
,
де X, R1 і R4 такі, як зазначено вище, з сполукою формули HSR8, HOR8 або HNR8R15, де n, R15 і R8 такі, як зазначено вище, і якщо використовується вищезгадана сполука формули HSR8 для одержання R3-групи формули -СH2SR8, необов'язково, окислюють до -СН2S(О)R8 або -СН2S(О)2R8.
25. Спосіб згідно пункту 24, в якому сполуку формули 3 одержують взаємодією сполуки формули:
,
де X, R1 і R4 такі, як зазначено вище, з (CH3)3S(О)nX2, де n дорівнює 0 або 1 і X2 є галогеном, -BF4 або -PF6, в присутності основи.
26. Спосіб згідно з пунктом 25, де X2 є йодом або BF4, і згадану основу вибирають з: трет-бутоксиду калію, трет-бутоксиду натрію, етоксиду натрію, гідриду натрію, 1,1,3,3-тетраметилгуанідину, 1,8-діазобіцикло[5.4.0]ундец-7-eну, 1,5-діазобіцикло[4.3.0]нон-5-eну, гексаметилдисилазиду калію (KГMДС), етоксиду калію або метоксиду натрію.
27. Сполука формули:
або її фармацевтично прийнятна сіль, в якій:
X являє собою -CН(NR9R10)-, -C(О)-, -C(=NOR9)-, -CH2NR9- або -N(C1-C6алкіл)CH2-, де перша рисочка кожного значення групи X приєднана до C-10 вуглецю сполуки формули 3 і остання рисочка кожного значення групи X приєднана до C-8 вуглецю сполуки формули 3;
R1 являє собою H, гідрокси або метокси;
R4 являє собою H, -C(О)R9, -C(О)OR9, -C(О)NR9R10 або гідроксизахисну групу;
кожний R9 і R10 незалежно H або C1-C6алкіл.
Текст
Цей винахід стосується нових похідних С-4"-заміщених макролідів, що використовуються в якості антибіотичних і антипротозойних агентів для ссавців, включаючи людину, а також для риб і птахів. Цей винахід також стосується фармацевтичних композицій, що містять нові сполуки і способів лікування бактеріальних і протозойних інфекцій у ссавців, риб і птахів, шляхом призначення нових сполук ссавцям, рибі і птахам, що потребують такого лікування. Відомо використання макролідних антибіотиків при лікуванні широкого спектру бактеріальних і протозойних інфекцій у ссавців, риб і птахів. Такі антибіотики представляють собою різноманітні похідні еритроміцину А, такі як, азитроміцин, який є комерційно досяжним і описаний у патентах US 4474768 і 4517359, обидва з яких включені в цей опис в якості посилань. Подібні азитроміцини і інші макролідні антибіотики є новими макролідними сполуками представленого винаходу проявляючи потенційну активність проти різноманітних бактеріальних і протозойних інфекцій, як описано нижче. Представлений винахід стосується сполук формули: і їх фармацевтично прийнятних солей, в яких: X представляє собою -CH(NR9R10)-, -C(O)-, -C(=NOR9)-, -CH2NR9- або -N(C1-С6алкіл)СН2-, в якому перша рисочка, кожного значення групи X, приєднана до С-10 вуглецю сполуки формули 1 і остання рисочка кожного значення групи X приєднана до С-8 вуглецю сполуки формули 1; R1 представляє собою Н, гідрокси або метокси; R2 представляє собою гідрокси; R3 представляє собою С1-С10алкіл, Сг-Сюалкеніл, С2-С10алкініл, ціано, -CH2S(O)nR8, в якій n лежить в інтервалі від 0 до 2, -CH2OR8. -CH2M(COR9)R8, -CH2NR8R15, -(CH2)m(C6-С10арил) або -(CH2)m(5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4, і в якому раніше загадані R3 групи необов'язково заміщені від 1 до 3 груп R16; або R2 і R3 узяті разом утворюють оксазолінове кільце, яке показано нижче: R4 представляє собою Н, -C(O)R9, -C(O)OR9, -C(O)NR9R10 або гідрокси захищаєму групу; R5 представляє собою -SR8, -(CH2)nC(O)R8, в якій η дорівнює 0 або 1, С1-С10алкіл, С2-С10алкеніл, С2-С10алкініл, -(СН2)m(С6-С10арил) або -(СН2)m (5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4, і в якому раніше загадані R5 групи необов'язково заміщені від 1 до 3 груп R16; кожний R6 і R7 незалежно один від одного Н, гідрокси, С1-С6алкокси, С1-С6алкіл, С2-С6алкеніл, С2-С6алкініл, -(СН2)m(С6-С10арил) або -(СН2)m(5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4; кожний R8 незалежно С1-С10алкіл, С2-С10алкеніл, С2-С10алкініл, (CH2)qCR11R12(CH2)rNR13R14, в якій q і r кожний незалежно лежать в інтервалі від 0 до 3, при умові, що q і r одночасно обидва не дорівнюють 0, (СН2)m(С6-С10арил) або -(СН2)m(5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4, і в якому раніше загадані R8 групи, за виключенням Н, необов'язково заміщені від 1 до 3 груп R16; або в якій R8 представляє собою -CH2NR8R15, R15 і R8 можуть бути узяті разом утворюючи 4-10 членний насичений моноциклічне або поліциклічне насичене кільце або 5-10 членне гетероарильне кільце, необов'язково містить крім атому азоту до якого приєднані R13 і R14 1 або 2 гетероатоми, що вибрані О, S і N(R8)-, вищезгадане насичене кільце необов'язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв'язки, і вищезгадане насичене і гетероарильне кільце необов'язково заміщені від 1 до 3 груп R16; кожний R9 і R10 незалежно Η або С1-С6алкіл; кожний R11, R12, R13 і R14 незалежно вибирають з Н, С1-С10алкил, -(СН2)m(С6-С10арил) і -(СН2)m (5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4, і в якому раніше загадані R11, R12, R13 і R14 групи, за виключенням Н, необов'язково заміщені від 1 до 3 груп R16; або R11 і R13 узяті разом утворюють -(СН2)p-, в якій ρ лежить в інтервалі від 0 до 3, так що 4-7 членне насичене кільце, що вони утворюють, необов'язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв'язки; або R13 і R14 узяті разом утворюють 4-10 членне насичене моноциклічне або поліциклічне насичене кільце або 5-10 членне гетероарильне кільце, в якому насичене і гетероарильне кільце, необов'язково містить крім атому азоту до якого приєднані R13 і R14, 1 або 2 гетероатоми, що вибрані О, S і -N(R8)-. вищезгадане насичене кільце необов'язково включає 1 або 2 вуглець-вуглецеві подвійні або потрійні зв'язки, і вищезгадане насичене і гетероарильне кільце необов'язково заміщені від 1 до 3 груп R16; R15 представляє собою Н, С1-С10алкіл, С2-С10алкеніл, С2-С10алкініл, в якому раніше згадані групи R15 необов'язково заміщені від 1 до 3 замісників, незалежно вибраних з галогену і -OR9; кожний R16 незалежно вибирають з галогену, ціано, нітро, трифторметил, азидо, -C(O)R17, -C(O)OR17, C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гідрокси, C1-С6алкіл, C1-С6алкокси, -(СН2)m (С6С10арил) і -(СН2)m(5-10 членний гетероарил), в якій m лежить в інтервалі від 0 до 4, і в яких згадані арильні і гетероарильні замісники необов'язково заміщені від 1 до 2 замісників незалежно вибраних з галогену, ціано, нітро, трифторметил, азидо, -C(O)R17, -C(O)OR17, -C(O)OR17, -OC(O)OR17, -NR6C(O)R7, -C(O)NR6R7, -NR6R7, гідрокси, C1-С6алкіл і C1-С6алкокси; кожний R17 незалежно вибирають з Н, C1-С10алкіл, С2-С10алкеніл, С2-С10алкініл, -(СН2)m (С6-С10арил) або (СН2)m(5-10 членний гетероарил), в якій m лежить в інтервалі від 0до 4; при умові, що R8 не є Н, коли R3 представляє собою -CH2S(O)nR8. Переважними сполуками формули 1 є сполуки, в яких R1 є гідрокси, R2 є гідрокси, R3 є -CH2NR8R15 або CH2SR8 і R4 є Η. іншими переважними сполуками формули і є сполуки, в яких R1 є гідрокси, R2 гідрокси, R3 є -CH2NR8R15, R4 є Н, R15 і R8 кожний незалежно вибирають з Н, C1-С10алкіл, С2-С10алкеніл і С2-С10алкініл, в яких згадані групи R15 і R8, за винятком Н, необов'язково заміщені від 1 до 2 замісників незалежно вибраних з гідрокси, галогену і С1-С6алкокси. Особливо переважні сполуки мають перераховані основні структури в яких R15 є Η або вибирають з наступних груп в яких R8, також незалежно вибирають з метилу, етилу, алілу, н-бутилу, ізобутилу, 2-метоксиетилу, циклопентилу, 3-метоксипропілу, 3-етоксипропілу, н-пропілу, ізопропілу, 2-гідроксиетилу, циклопропілу, 2,2,2-трифторетилу, 2-пропінілу, втор-бутилу, терт-бутилу і н-гексилу. Іншими переважними сполуками формули і є сполуки, в яких R1 є гідрокси, R2 є гідрокси, R3 є -CH2NHR8, R4 є Η, і R8 є -(СН2)m(С6-С10арил), в якій т лежить в інтервалі від 0 до 4. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R8 є фенілом або бензилом. Іншими переважними сполуками формули 1 є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R3 є CH2NR15R8, R4 є Η і R15 і R8 узяті разом утворюють насичене кільце. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R15 і R8 узяті разом утворюють піперидинове, триметиленімінове або морфолінове кільце. іншими переважними сполуками формули 1 є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R3 є CH2NR15R8, R4 є Η і R15 і R8 узяті разом утворюють гетероарильне кільце, необов'язково заміщене 1 або 2 С1С6алкільними групами. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R15 і R8 узяті разом утворюють пїролідинове, тріазольне або імідазольне кільце, в якому згадана гетероарильна група необов'язково заміщена 1 або 2 метильними групами. Іншими переважними сполуками формули 1 є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R3 є -CH2SR8, R4 є Η і R8 вибирають з С1-С10алкілу, С2-С10алкенілу і С2-С10алкінілу, в яких згадана група R8 необов'язково заміщена 1 або 2 замісниками, незалежно вибраними з гідрокси, галогену і C1-С6алкокси. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R8 є метилом, етилом або 2-гідроксиетилом. Іншими переважними сполуками формули 1 є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R4 є Η і R3 вибирають з C1-С10алкілу, С2-С10алкенілу і С2-С10алкінілу, в яких згадана група R3 необов'язково заміщена 1 або 2 замісниками, незалежно вибраними з гідрокси, -C(O)R17, -NR6R7, галогену, ціано, азидо, 5-10 членного гетероарилу і C1-С6алкокси. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R3 є метилом, алілом, винілом, етінілом, 1-метил-1-препенілом, 3-метокси-1-пропінілом, 3-диметиламіно-1пропінілом, 2-піридилетинілом, 1-пропінілом, 3гідрокси-1-пропінілом, 3-гідрокси-1-пропенілом, 3гідроксипропілом, 3-метокси-1-пропенілом, 3-метоксипропілом, 1-пропінілом, н-бутилом, етилом, пропілом, 2гідроксиетилом, формілметилом, 6-ціано-1-пентинілом, З-диметиламіно-1-пропенілом або 3диметиламінопропілом. Іншими переважними сполуками формули і є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R4 є Η і R3 є (СН2)m(5-10 членний гетероарил), в якому m лежить в інтервалі від 0 до 4. Особливо переважні сполуки мають згадану основну структурну формулу, в якій R3 є 2-тієнілом, 2-піридилом, 1-мeтил-2-імідазолілом, 2-фурилом або 1-метил-2-піролілом. Іншими переважними сполуками формули 1 є ті сполуки, в яких R1 є гідрокси, R2 є гідрокси, R4 є Η і R3 є (СН2)m(С6-С10арил), в якому т лежить в інтервалі від 0 до 4, Особливо переважні сполуки мають згадану основну структурну формулу, в якій R3 є фенілом. Особливо переважними сполуками формули 1 є ті сполуки, в яких R2 і R3 узяті разом утворюють оксазолінове кільце, яке показано нижче в який R5 такий як зазначено вище. Особливі сполуки формули 1 включають сполуки, в яких R3 вибирають із наступних: в якій X3 є О, S або -N(R15)-, і в якій -OR9 група може бути приєднана до будь якого атому вуглецю фенільної групи. Винахід також стосується фармацевтичних композицій для лікування бактеріальних інфекцій або протозойних інфекцій у ссавців, риби або птиці, що містять терапевтично ефективну кількість сполуки формули 1 або її фармацевтично прийнятної солі і фармацевтично прийнятний носій. Винахід також стосується способу лікування бактеріальних інфекцій або протозойних інфекцій у ссавців, риб або птиць, що полягає у призначенні згаданому ссавцю, рибі або птиці терапевтично ефективної кількості сполуки формули і або її фармацевтично прийнятної солі. Під терміном «лікування», що використовується тут, якщо не вказано інше, розуміють лікування або попередження бактеріальних інфекцій або протозойних інфекцій, як передбачено способом представленого винаходу. Як зазначено тут, якщо не вказано інше, термін «бактеріальна інфекція» або «протозойна інфекція» включають бактеріальні інфекції або протозойні інфекції, що властиві ссавцям, рибі і птиці, а також захворювання викликані цими бактеріальними інфекціями або протозойними інфекціями, можуть лікуватись або попереджуватись призначенням антибіотиків, таких як, сполуки представленого винаходу. Такими бактеріальними інфекціями і протозойними інфекціями і захворюваннями викликаними цими інфекціями є наступний перелік: пневмонія, отити середньої оболонки стінки кровоносної судини, синусити, бронхіти, тонзиліти і мастоїдити, що викликані інфекціями Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphilococcus aureus або Peptostreptococcus spp.: фарингіти, ревматоїдна лихоманка і гломерулонефрити, що викликані інфекцією Streptococcus pyogenes, стрептококами Групи С і G, Clostridium diptheriae або Acfinobacillus haemoliticum; респіраторні захворювання, що викликані інфекціями Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae, Haemophilus influenzae або Chlamydia pneumoniae; нескладні інфекції шкіри і м'яких тканин, гнійні і остеомієліти, і пологова лихоманка, що викликана інфекціями Staphilococcus aureus, зкоогульовані-позитивні стафілококи (наприклад, S.epidermidis, S.hemotilicus, та і.), Streptococcus pyogenes, Streptococcus agalactiae, стрептококальні групи C-F (мілкі-колонії стрептококів), віридансні стрептококи, Corynehacterium minutissimum, Clostridium spp,, або Bartonella henselae; нескладні гострі інфекції сечовивідних шляхів, що викликані Staphilococcus saprophiticus або Enterococcus spp.: уретрити і цервецити; і захворювання, що передаються статевим шляхом, що викликані інфекціями Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyficum або Neiserria gonorrheae; захворювання викликані токсинами наступних інфекцій S.aureus (харчове отруєння і синдром токсичного отруєння), або стрептококами Групи А, В і С; виразковикликаємі інфекції Helicobacter pilori; синдром постійної лихоманки, викликаний інфекцією Borrelia recunrenfis; хвороба Ліма, що викликана інфекцією Borrelia burgdorferi; кон'юнктивіт, кератити і дакроцистіти, що викликані інфекціями Chlamydia trachomatis, Neisseria gonorrhoeae, S.aureus, S.pneumoniae, S.pyogenes, H.influenzae або Usteria spp.; захворювання розсіяння Mycobacterium avium комплексу (МАС), що викликані інфекцією Mycobacterium avium або Mycobacterium intracellulare; гастроентерити, що викликані інфекцією Campilobacter jejuni; кишкові протозоа викликані інфекцією Cryptosporidium spp.; одонтогенні інфекції, що викликані інфекцією вірідансних стрептококів; постійний кашель, що викликаний інфекцією Bordetella pertussis; газова гангрена, що викликана інфекцією Clostridium perfringens або Bacteroides spp.; і атеросклероз, що викликаний інфекцією Helicobacter pilori або Chlamydia pneumoniae. Бактеріальні інфекції і протозойні інфекції і захворювання, що викликаються такими інфекціями, можуть бути вилікувані або попереджені у тварин і такими захворюваннями є: бичачі респіраторні захворювання, що викликані інфекціями P.haem., P.multocida, Mycoplasma bows або Bordetella spp.; захворювання на брюшний тиф самиць, що викликані інфекціями Е.соli або протозойними (наприклад, кокадія, криптоспорідія, та і.); мастити молочних залоз, що викликані інфекціями Staph. aureus, Strop, uberis, Strop, agalactiae, Strep, dysgalactiae, Klebsiella spp.. Corynebacterium або Enterococcus spp.; респіраторні захворювання свиней, що викликані A.pleuro., P Multocida або Mycoplasma spp.; захворювання брюшини свиней, що викликані інфекцією Е. coli, Lawsonia intracellularis, Salmonella або Serpulina hyodyisinteriae; гноїння копит, що викликане інфекцією Fusobacterium spp.; метрити самиць, що викликані інфекцією Е.соli; волосяні нарости, що викликані інфекцією Fusobacterium necrophorum або Bacteroides nodosus; почервоніння очей, що викликано інфекцією Moraxella bovis; передчасні пологи, що викликані протозойними (наприклад, неоспоріум); інфекції сечовивідних шляхів у собак і котів, що викликані інфекцією Е.соli; інфікування шкіри і м'яких тканин у собак і котів, що викликані інфекцією Staph. epidermidis, Staph. Vitermedius, coagulase neg. Staph або P.multocida і інфекції зубів і ротової порожнини у собак і котів, що викликані інфекцією Alcaligenes spp., Bacteroides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas або Prevotella. Інші бактеріальні інфекції і протозойні інфекції і захворювання, що викликаються такими інфекціями, можуть виліковуватись або попереджатись згідно із способом представленого винаходу відповідно до описаного J.Р.Sanford et al., "The Sanford Guide To Antimicrobial Therapy", 26th Edition, (Antimicrobial Therapy, Inc., 1996). Представлений винахід також стосується способу одержання вищезгаданої сполуки формули 1 або її фармацевтично прийнятної солі, в якій R3 є -CH2S(O)nR8, -CH2OR8 або -CH2NR8R15, в яких n, R15 і R8 такі як зазначено вище, при умові, що R8 не є Н, коли R3 є -CH2S(O)nR8, який полягає у взаємодії сполуки формули: в якій X, R1 і R4 такі, як зазначено вище, з сполукою формули HSR8, HOR8 або HNR8R15, в яких п, R15 і R8 такі, як зазначено вище, необов'язково надалі окислюють, у випадку -SR8 замісника, для одержання -S(O)R3 або S(O)2R8. Ще в одному аспекті вищезгаданого процесу одержання сполуки формули 1 або її фармацевтично прийнятної солі, вищезгадану сполуку формули 3 одержують взаємодією сполуки формули: в якій X, R1 і R4 такі як зазначено вище, з (СН3)3S(О)nХ2, в якій η дорівнює 0 або 1 і X2 є галогеном, -BF4 або PF6, переважно йодом або -BF4, в присутності основи, такої як: трет-бутоксид калію, трет-бутоксид натрію, етоксид натрію, гідрид натрію, 1,1,3,3-тетраметилгуанідину, 1,8-діазобіцикло[5.4.0]ундец-7-ен, 1,5діазобіцикло[4.3.0]нон-5-ен, гексаметилдисилазид калію (КГМДС), етоксид калію або метоксид натрію, переважно, КГМДС або натрій вмістна основа, така як, гідрид натрію. Представлений винахід також стосується сполук формул 2 і 3, формули яких вказані вище, що використовуються для одержання вищезгаданих сполук формули 1 і їх фамацевтично прийнятних солей. Під терміном "гідроксизахисна група", що використовується тут, якщо не вказано інше, слід розуміти ацетильну, бензилоксикарбонільну і різноманітні гідрокси захисні групи, що добре відомі спеціалістам в цій галузі, включаючи групи, що вказані Т.W.Greene, P.G.M.Wuts, "Protective Groups in Organic Synthesis," (J.Wiley & Sons, 1991). Під термін "галоген", що використовується тут, якщо не вказано інше, слід розуміти хлор, фтор, бром та йод. Під терміном "алкіл", що використовується тут, якщо не вказано інше, слід розуміти насичені моновалентні вуглеводневі радикали, які мають лінійний, розгалужений або циклічний ланцюги або їх комбінацію. Зрозуміло, що у випадку циклічних замісників, згадана алкільна група, має принаймні три атоми вуглецю. Такими циклічними замісниками є циклопроліл, циклобутил і циклопентил. Під терміном "алкокси", що використовується тут, якщо не вказано інше, слід розуміти -О-алкільну групу, в якій алкіл такий, як зазначено вище. Під терміном "арил", що використовується тут, якщо не вказано інше, слід розуміти органічний радикал, похідне від ароматичних вуглеводнів у якому відсутній один водень, такі як, феніл або нафтіл. Під терміном "5-10 членний гетероцикл", що використовується тут, якщо не вказано інше, слід розуміти ароматичну гетероциклічну групу, що містить один або більшу кількість гетероатомів, що вибрані з групи, що містить О, S і N, в якій кожна гетероциклічна група має містити 5-10 атомів в цій циклічній системі. Прикладами придатних 5-10 членних гетероарильних груп є піридиніл, імідазоліл, піримідиніл, піразоліл, (1,2,3)- і (1,2,4)тріазоліл, піразиніл, тетразоліл, фурил, тієніл, ізоксазоліл, оксазоліл, піроліл і тіазоліл. Під фразою "фармацевтично прийнятна сіль(солі)", що використовується тут, якщо не вказано інше, слід розуміти солі кислотних або основних груп, що можуть бути присутні в сполуках представленого винаходу. Сполуки представленого винаходу основної природи здатні до утворення широкого переліку солей з різноманітними неорганічними і органічними кислотами. Кислоти можуть використовуватись для одержання фармацевтично прийнятних кислотноадитивних солей основних сполук з утворенням не токсичних кислотноадитивних солей, наприклад, солей, що містять фармакологічно прийнятні аніони, такі як гідрохлоридні, гідробромідні, гідройодидні, нітратні, сульфатні, бісульфатні, фосфатні, кисло-фосфатні, ізонікотинатні, ацетатні, лактатні, саліцилатні, цитратні, кисло-цитратні, тартратні, пантотенатні бітартратні, аскорбатні, сукцинатні, малеатні, гентисинатні, фумаратні, глюконатні, глукоранатні, сахаратні, форміатні, бензоатні, глутаматні, метансульфонатні, етансульфонатні, бензолсульфонатні, п-толуолсульфонатні та памоатні (наприклад, 1,1-метилен-біс-(2-гідрокси-3-нафтоат)) солі. Сполуки представленого винаходу, що містять аміно замісники можуть утворювати фармацевтично прийнятні солі з різноманітними амінокислотами, на додаток з кислотами вказаними вище. Деякі сполуки представленого винаходу кислої природи здатні утворювати основні солі з різноманітними фармацевтично прийнятними катіонами. Прикладами таких солей є солі лужних і лужноземельних металів і особливо, кальцієві, магнієві, натрієві і калієві солі сполук представленого винаходу. Деякі сполуки представленого винаходу можуть мати асиметричний центр і існувати в різноманітних енантіомерних формах. Цей винахід стосується використання всіх оптичних ізомерів і стеріоізомерів сполук представленого винаходу і їх сумішей, і всіх фармацевтичних композицій і способів лікування, в яких вони можуть використовуватись або міститись. Представлений винахід включає сполуки представленого винаходу і їх фармацевтично прийнятні солі, в яких один або більша кількість атомів водню, вуглецю або інших атомів замінена їх ізотопом. Такі сполуки можуть використовуватись для дослідження і в якості діагностичного інструментарію при дослідженні фармакокінетики метаболізму і в дослідженнях по зв'язуванню. Сполуки представленого винаходу можуть бути одержані згідно до Схем 1-3, що показані нижче і описаних далі. В наступних Схемах, якщо не вказано інше, замісники X, R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R13, R14, R15, R16 і R17 такі як вказано вище. В цьому винаході в якості вихідних сполук використовуються різноманітні зразки макролідів. Ці макроліди представляють собою азитророміцин, еритроміцин, кларитроміцин, еритроміциламін, а також їх аналоги. Азитроміцин може бути одержаний згідно методики описаної в патентах US 4474768 і 4517359, згаданих вище. Еритроміцин може бути одержаний або виділений згідно з методикою описаною в патентах US 2653899 і 2823203. Кларитроміцин може биті одержаний згідно з методикою описаною в патенті US 4331803. Вищезгадані вихідні матеріали потребують захисту функціональних груп від можливих модифікацій, що можуть мати місце і зняття захисту після завершення модифікацій. Більш загально, для захисту амінозамісників в макролідних сполуках цього винаходу використовують бензілоксикарбонільні (Cbz) і тбутилоксикарбонільні (Вос) групи. Гідрокси групи захищаються у вигляді ацетатів або Cbz карбонатів. В цьому винаході була встановлена відносна реакційна здатність різних гідроксильних груп заявляємих молекул макролідів. Така різниці в реакційній здатності дозволяє вибіркову модифікацію різних частин сполук цього винаходу. У вищезгаданих Схемах, С-2' гідрокси група (R4 є Н), вибірково захищалась, обробкою макролідної сполуку одним еквівалентом оцтового ангідриду в дихлоретані у відсутності зовнішньої основи, для одержання відповідної сполуку, в якій R4 є ацетилом. Ацетильна захисна група може бути видалена, обробкою сполуки формули 3 метанолом при температурі 23-65°С протягом 10-48 годин. С-2' гідрокси група може також бути захищена іншою захисною групою відомою спеціалістам в цій галузі, типу групи Cbz. У випадку, коли X є CH2NH-, C-9 аміно група може також вимагати захисту, коли потрібно виконати подальші синтетичні модифікації. Відповідні захисні групи для амінозамісників -групи Вос і Cbz. Для захисту С-9 аміно групи, макролід може бути оброблений бікарбонатом т-бутилу в безводному тетрагідрофурані (ТГФ), або бензилоксикарбоніл естером N-гідроксисукциніміду, або бензилхлорформіатом, щоб захистити аміногрупу у вигляді її т-бутилу або бензилкарбамату. С-9 аміно і С-2' гідрокси групи можуть бути вибірково захищені групою Cbz в одну стадію, обробкою сполуки формули 2 бензилхлорформіатом у ТГФ і воді. Група Вос може бути знята додаванням кислоти і група Cbz може бути знята звичайним каталітичним гідруванням. У наступному описі, приймається, що у випадку, коли X є -CH2NH-, С-9 амінозамісник, також як і С-2' гідрокси група були захищені і потім з них був знятий захист, як вважав би за потрібне кваліфікований спеціаліст у цій галузі. В схемі 1, сполука формули 2 може бути одержана згідно з методиками добре відомими для спеціалістів в цій галузі, включаючи одну або більшу кількість методик описаних в Journal of Antibiotics, 1988, стор. 10291047. На стадії 1 Схеми 1, сполука формули 2 взаємодіяла з R3MgX1 або R3-Li і Mg(X1)2, в якій X1 є галоїдом, таким як, хлор або бром, в розчиннику, такому як, ТГФ, диметиловий етер етиленгліколю (ДМЕ), діізопропіловий етер, толуол, діетиловий етер або тетраметилетилендіамін (ТМЕДА), гексан або суміш двох або більшої кількості згаданих розчинників, переважно в ефірному розчиннику, при температурі, що лежить в інтервалі від приблизно -78°С до приблизно кімнатної температури (20-25°С), одержуючи сполуку формули 1, в якій R2 є гідроксигрупою і R1, R3 і R4 такі, як зазначено вище. Схема 2 ілюструє одержання сполук формули 1 через використання проміжного епоксиду. На стадії 1 Схеми 2, сполука формули 3 може бути одержана за двома методиками. За першим способом (Спосіб А), сполука формули 2 взаємодіяла з (CH3)3S(O)X2, в якій X2 є галогеном, -BF4 або -PF6, переважно йодом, в присутності основи, такої як, трет-бутоксид калію, етоксид натрію, трет-бутоксид натрію, гідрид натрію, 1,1,3,3тетраметилгуанідин, 1,8-діазобіцикло[5.4.0]ундец-7-ен, 1,5-діазобіцикло[4.3.0]нон-5-ен, етоксид калію або метоксид натрію, переважно натрій вмістної основи, такої як, гідрид натрію, в розчиннику, такому як, ТГФ, ефірний розчинник, диметилформамід (ДМФА) або диметилсульфоксид (ДМСО), або суміші двох або більшої кількості згаданих розчинників, при температурі, що лежить в інтервалі від приблизно 0°С до приблизно 60°С, одержуючи сполуку формули 3, що має наступну конфігурацію епоксиду, що складає переважаючу частку: У другому способі (Спосіб Б), сполука формули 2 взаємодіяла з (CH2)3SX2, в якій X є галогеном, -BF4 або PF6, переважно -BF4, в присутності основи, такої як, трет-бутоксид калію, трет-бутоксид натрію, етоксид натрію, гідрид натрію, 1,1,3,3-тетраметилгуанідин, 1,8-діазобіцикло[5.4.0]ундец-7-ен, 1,5діазобіцикло[4.3.0]нон-5-ен, етоксид калію, гексаметилдісилілазид калію (КГМДС) або метоксид натрію, переважно КГМДС, в розчиннику, такому як, ТГФ, ефірний розчинник, ДМФА або ДМСО, або суміші двох або більшої кількості згаданих розчинників, при температурі, що лежить в інтервалі від приблизно 0°С до приблизно 60°С, одержуючи сполуку формули 3, що має наступну конфігурацію епоксиду, що складає переважаючу частку: На стадії 2 Схеми 2, сполука формули 3 може бути перетворена у сполуку формули 1, в якій R2 є гідрокси і R є група, що приєднана до вуглецю С-4" через метиленову групу, така в якій R3 є -CH2NR15R8 або CH2S(O)nR8, в якій n, R15 і R8 такі, як зазначено вище. Для одержання сполуки формули і, в якій R3 є CH2NR15R8, сполуку формули 3 можна піддати взаємодії з сполукою формули HNR15R8, в якій R15 і R8 такі, як зазначено вище, у відсутності або у присутності полярного розчинника, такого як, вода, метанол або ТГФ, або в суміші згаданих розчинників, при температурі, що лежить в інтервалі від приблизно кімнатної до приблизно 100°С, переважно при температурі приблизно 60°С, необов'язково в присутності галоїдного реагенту, такого як, йодид калію, перхлорат літію, перхлорат магнію, тетрафторборат літію, гідрохлорид піридинію або тетраалкіламоній галоїдного реагенту, такого як, тетрабутиламоніййодиду. Для одержання сполуки формули 1, в якій R3 є -CH2S(O)nR8, в якій n і R3 такі, як зазначено вище, сполуку формули 3 можна піддати взаємодії з сполукою формули HSR8 в присутності К2СО3, КІ або вище, сполуку формули 3 можна піддати взаємодії з сполукою формули HSR3 в присутності К2СО3, КІ або метоксиду натрію, в ароматичному розчиннику, такому як, метанол, бензол або толуол, при температурі, що лежить в інтервалі вид приблизно кімнатної температури до приблизно 120°С. При потребі, сірчаний замісник може бути окислений до -SO- або -SO2- згідно з методикою, що добре відома спеціалісту в цій галузі. Для одержання сполуки формули 1, в який R3 є -CH2SR8 і R8 є -(CH2)qCR11R12(CH2)rNR13R14, в якій замісники згаданої групи Rs такі, як зазначено вище, сполука формули 3 може бути оброблена сполукою формули HS-(CH2)qCR11R12(CH2)r-NPhth, де NPhth представляє собою фталімідо і йодидом калію, для одержання після видалення фталімідо групи сполуки формули 1, в якій R3 є CH2S(CH2)qCR11R12(CH2)r-NH2, яка в подальшому може бути модифікована, якщо це потрібно. За аналогічною методикою, сполука формули і, в який R3 є -CH2NR15R8 і R8 є -(CH2)qCR11R12(CH2)rNR13R14 можуть бути одержані взаємодією сполуки формули 3 з сполукою формули HNR9-(CH2)qCR11R12(CH2)rNR13R14 або з сполукою формули H2N-(CH2)qCR11R12(CH2)rNH2 з наступним відновним алкілуванням атому азоту. Використовуючи ці ж самі або аналогічні методи, може бути одержана сполука формули 1, в якій R3 є -CH2OR8 і R8 такі, як зазначено вище, взаємодією сполуки формули 3 з сполукою формули HOR8. Схема 3 розкриває одержання сполуки формули 1, в якій R2 і R3 узяті разом утворюють оксазолільний замісник. На стадії 1 Схеми 3 сполуку формули 2 піддавали взаємодії з азидом натрію в присутності NH4CI в метанолі або воді, або в суміші цих двох розчинників, при температурі, що лежить в інтервалі від приблизно 0°С до приблизно 100°С, переважно приблизно при 80°С, одержуючи сполуку формули 4. На стадії 2 Схеми 3, сполука формули 4 може бути перетворена у відповідний амін формули 5, шляхом каталітичного гідрування. Переважно, при такому гідруванні використовують порошок Pd (10% на вугіллі) в атмосфері Н2 (з тиском 1атм). Одержаний амін формули 5 може бути перетворений у різноманітні сполуки формули 1, в яких R3 є CH2NR15R8 використовуючи загальноприйняті синтетичні методи, такі як, зняття аміногрупи. На стадії 3 Схеми 3, сполука формули 5 може бути перетворена у сполуку формули 1, в якій R2 і R3 узяті разом, як показано, піддають взаємодії сполуку формули 5 з сполукою формули R5-CN, R5-C=N(OCH3), R5C=N(OC2H5), R5-C(O)Cl або R5-CO2H, в якій R такий, як зазначено вище, за винятком R5 не є NH2, в присутності або у відсутності кислоти, такої як, НСІ або кислота Л'юїса, така як, ZnСІ2 або BF4Et3O, або основи, такої як, NaOH або TEA, в розчиннику, такому як, ТГФ, хлорвуглеводень (такий як, СН2СІ2 або хлорбензол), при температурі, що лежить в інтервалі від приблизно кімнатної температури до приблизно температури кипіння. Для одержання відповідної сполуки, в якій R5 - аміно група, сполуку формули 5 піддають взаємодії з BrCN і ацетатом натрію в метанолі, при температурі, що лежить в інтервалі від приблизно кімнатної температури до 3 приблизно температури кипіння. Альтернативно, сполука формули 5 може одержуватись, як показано на стадіях 4 і 5 Схеми 3. На стадії 4 Схеми 3, сполуку формули 5 піддавали взаємодії з тіокарбонілдіімідазолом в метиленхлориді при температурі, що лежить в інтервалі від приблизно 0°С до кімнатної температури, одержуючи сполуку формули 25. На стадії 5 Схеми 3, сполуку формули 25 обробляли R5-X1, в якій X1 є галогеном, таким як, бром або йод, і основою, такою як, метоксид натрію в розчиннику такому як, метанол або ацетон, при температурі, що лежить в інтервалі від приблизно 0°С до кімнатної температури. Сполуки представленого винаходу можуть мати асиметричний атом вуглецю і існувати у різноманітних енантіомерних і діастеріомерних формах. Діастереомерні суміші можуть бути розділені на окремі діастереомери використовуючи їхні фізико-хімічні відмінності, за методиками, що добре відомі спеціалістам в цій галузі, наприклад, хроматографією або фракційною кристалізацією. Енантіомери можуть бути розділенні перетворенням енантіомерної суміші у діастеріомерну суміш взаємодією з придатною оптично-активною сполукою (наприклад, спиртом), розділенням діастеріомерів і перетворенням (наприклад, гідролізом) індивідуальних діастеріомерів у відповідні чисті енантіомери. Таке розділення може також бути здійснене використовуючи стандартну хіральну ВСРХ. Використання всіх таких ізомерів, включаючи діастеріомерні суміші і чисті енантіомери розглядається як частина представленого винаходу. Сполуки представленого винаходу основної природи здатні утворювати широкий спектр різноманітних солей з різними неорганічними і органічними кислотами. Крім того, такі солі повинні бути фармацевтично прийнятними для призначення тваринам, також бажано з практичної точки зору спочатку виділити сполуки представленого винаходу з реакційної суміші у вигляді фармацевтично неприйнятної солі і потім просто перетворити сполуку у вільну основу обробляючи лужним реагентом і надалі перетворити вільну основу у фармацевтично прийнятну кислотноадитивну сіль. Кислотноадитивні солі сполук цього винаходу основної природи легко одержується взаємодією основної сполуки з прийнятною еквівалентною кількістю вибраної мінеральної або органічної кислоти у водному середовищі або прийнятному органічному розчиннику, такому як, метанол або етанол. Шляхом обережного випарювання розчинника легко одержується бажана тверда сіль. Бажана кислотна сіль може також бути одержана з розчину вільної основи в органічному розчиннику додаванням до розчину прийнятної мінеральної або органічної кислоти Таким чином сполуки представленого винаходу кислої природи здатні утворювати основні солі з різноманітними фармацевтично прийнятними катіонами. Для сполук, що призначаються ссавцям, рибі або птахам, такі солі повинні бути фармацевтично прийнятними. Коли потрібні фармацевтично прийнятні солі, вони можуть при бажанні одержані ізолюванням сполуки представленого винаходу з реакційної суміші у вигляді фармацевтично неприйнятні солі і потім просто перетворені у фармацевтично прийнятну сіль за методикою, що описана вище, для перетворення фармацевтично прийнятних кислотноадитивних солей у фармацевтично прийнятні солі. Прикладами основних солей є солі лужних і лужноземельних металів і особливо, натрієві, амінні і калієві солі. Такі солі можуть бути одержані за відповідними методиками. В якості реагентів при одержанні фармацевтично прийнятних основних солей цього винаходу, використовують хімічні основи, що утворюють нетоксичні основні солі з сполуками представленого винаходу, що мають кислу природу. Такими нетоксичними основними солями є наступні фармацевтично прийнятні катіони, як натрій, калій, кальцій, магній, різні аміно катіони та ін. Ці солі можуть утворюватись під час взаємодії відповідної кислотної сполуки з водним розчином, що містить бажаний фармацевтично прийнятний катіон, такий як, натрій, калій, кальцій, магній, різні аміно катіони та ін. і подальшим випарюванням одержаного розчину до суха, переважно, під вакуумом. Альтернативно, вони можуть також бути одержані змішуванням нижче спиртового розчину, кислотної сполуки і бажаного алкоголяту лужного металу і подальшим упарюванням одержаного розчину до суха за умов, що приведені вище. В будь якому випадку, переважно використовували стехіометричні кількості реагенту для гарантування повного закінчення реакції і одержання максимального виходу бажаного продукту. Активність сполук представленого винаходу проти бактеріальних і протозойних патогенів продемонстрована здатністю сполук інгібувати ріст згаданих патогенів у людей (Дослідження І) або тварин (Дослідження II і III). Дослідження І В Дослідженні І, що описується нижче, використовували стандартну методологію і критерії інтерпретації, що розроблені для забезпечення напрямків хімічної модифікації, що можуть вести до одержання сполук, які обходять деякі механізми опору макролідам. У Дослідженні І, в перелік бактеріальних штамів були включені різноманітні цілі патогенних видів, включаючи представників макролідних механізмів опіру, що були охарактеризовані. Використання цього переліку дає можливість визначити зв'язок між хімічною структурою і активністю, спектром активності і структурним елементом або модифікацією, що може усунути механізм опору. Бактеріальні патогени, що включені в список для досліджень показані а таблиці нижче. В багатьох випадках, і макролід-сприймаємий материнський штам і макролід-стійкий штам одержаний з нього придатні для забезпечення більш точної оцінки здатності сполук обійти механізм захисту. Штами містять ген стійкості до макролідів, що позначається еrmА/ermB/ermC, лінкозамідів і стрептограмін В антибіотиків, одержуються шляхом модифікації (метилювання) 23S рРНК молекули Erm метилази, таким чином взагалі попереджаючи зв'язування всіх трьох структурних класів. Описуються два типи макролідних продуктів; msrA кодує компонент системи продукту в стафілококу, які перешкоджають входу макролідів і стрептограмінів, в той час як mefA/E кодує трансмембранний білок, який проявляє продукування тільки макролідів. Інактивація макролідних антибіотиків може мати місце і може бути встановлена шляхом фосфорилюванням 2'-гідроксилу (mph) або розщепленням макроциклічного лактону (естерази). Штами можуть бути охарактеризовані використовуючи стандартну технологію реакції ланцюгової полімерази (PCR) і/або встановленням послідовності детермінантним опором. Використана PCR технологія, що використана в цьому описі описується J.Sutcliffe et al., "Detection Of Erithromycin-Resistant Determinants By PCR', Antimicrobial Agents and Chemotherapy, 40(11), 2562-2566 (1996). Дослідження проводили в мікротитрованих лотках і інтерпретували згідно Performance Standards for Antimicrobial Disk Susceptibility Tests - Sixth Edition: Approved Standard, що опубліковано The National Committee for Clinical Laboratory Standards (NCCLS) основні принципи; для того щоб порівняти штами використовувалась мінімальна концентрація інгібування (МКІ). Сполуки спочатку розчиняли в диметилсульфоксиді (ДМСО) з розрахунку 40мг/мл готового розчину. Позначення штаму Staphilococcus aureus 1116 Staphilococcus aureus 1117 Staphilococcus aureus 0052 Staphilococcus aureus 1120 Staphilococcus aureus 1032 Staphilococcus hemoliticus 1006 Streptococcus pyogenes 0203 Streptococcus pyogenes 1079 Streptococcus pyogenes 1062 Streptococcus pyogenes 1061 Streptococcus pyogenes 1064 Streptococcus agalactiae 1024 Streptococcus agalactiae 1023 Streptococcus pneumoniae 1016 Streptococcus pneumoniae 1046 Streptococcus pneumoniae 1095 Streptococcus pneumoniae 1175 Streptococcus pneumoniae 0085 Haemophilus influenzae 0131 Moraxella catarrhalis 0040 Moraxella catanmalis 1055 Escherichia coli 0266 Механізм(и) опору макроліду сприйнятливий батько ermB сприйнятливий батько ermC msrA, mph, естераза msrA, mph сприйнятливий батько ermB сприйнятливий батько ermB ermB сприйнятливий батько ermB сприйнятливий ermB ermB mefE сприйнятливий сприйнятливий сприйнятливий еритроміцин проміжний опір сприйнятливий Дослідження II використовували для перевірки активності проти Pasteurella multocida і Дослідження III використовували для перевірки активності проти Pasteurella haemolitica. Дослідження II Це дослідження базується на методі рідкісного розведення в мікролітрових об'ємах. Одиночну колонію P.multocida (штам 59А067) вводили в 5мл бульйону мізково сердцевої інфузії (ВНІ). Тестуєму сполуку одержували розчиненням 1мг сполуки в 125мкл диметилсульфоксиду (ДМСО). Розводячи тестуєму сполуку одержували придатний для використання бульйон мізково серцевої інфузії (ВНІ). Концентрація тестуємої сполуки, що використовувалась лежала в інтервалі від 200мкг/мл до 0,098мкг/мл після двох окремих послідовних розведень. P.multocida вводили ВНІ розводячи з невведеним ВНІ бульйоном одержуючи 104 клітинну суспензію на 200мкл. ВНІ клітини суспензії змішували з відповідною серією розведення тестуємої сполуки і інкубували при температурі 37°С на протязі 18 годин. Мінімальна концентрація інгібування (МКІ) дорівнює концентрації сполуки, що викликає 100% інгібування росту P.Multocida, порівняно з непривитим контролем. Дослідження III Це дослідження базується на методі розведення агару, використовуючи реплікатор Стірза. Від двох до п'яти колоній, що ізольовані на агарових пластинках на які прививали ВНІ бульйон і культивували на протязі ночі при температурі 37°С і струшуванні (200 обертів у хвилину). На наступний ранок 300 мкл цілком розвинутої Р.haemolyfica прекультури прививали до 3мл свіжого ВНІ бульйону і культивували при температурі 37°С і струшуванні (200 обертів у хвилину). Відповідні кількості тестуємих сполук розчиняли в етанолі і готували ряд подвійних серійних розведень. Два мл відповідного серійного розведення змішували з 18мл розплавленого ВНІ агару і давали затвердіти. Коли привита P.haemolytica культура досягала 0,5 стандарту щільності Макфарланда, приблизно 5 мкл культури P. haemolytica прививали на ВНІ агарові пластинки, що містять різні концентрації тестуємої сполуки, використовуючи реплікатор Стірза і культивували протягом 18 годин при 37°С. Вихідні концентрації тестуємих сполук лежали в діапазоні від 100-200мкг/мл. Мінімальна концентрація інгібування (МКІ) дорівнює концентрації сполуки, що викликає 100% інгібування росту P.haemolytica, порівняно з непривитим контрольним. In vivo активність сполук формули (1) може бути визначена звичайним вивченням захищеності тварин, за методиками, що добре відомі для спеціалістів в цій галузі, і в яких зазвичай використовують мишей. Мишей розділяли по клітках (10 у клітку) по мірі їх прибуття, і дозволяли акліматизуватися, як мінімум 48 годин, перед використанням. Тваринам внутрішньочеревинно прививали по 0,5мл 3x103 CFU/мл суспензії бактерій (P.multocida штам 59А006). Кожний експеримент мав принаймні 3, контрольні групи, що не піддавались лікуванню, включаючи одну, інфіковану дозою введення 0,1Х і дві інфіковані дозою введення 1Х; може також використовуватись 10Х група даних. Взагалі, усі миші в даному дослідженні можуть бути оскаржені в межах 30-90 хвилин, особливо, якщо використовується шприц для серійних упорскувань (типу шприц Корнуолла®), щоб керувати введенням. Починали через тридцять хвилин після введення, використовуючи першу сполуку. Могла б бути необхідна друга людина, щоб почати дозування сполуки, якщо усім тваринам не буде введена доза до 30 хвилин. Шляхи введення - підшкірне або ротове введення. Підшкірні дози призначають у вільну шкіру за горловиною, приймаючи до уваги, що ротові дози даються за допомогою голки, через яку вводили їжу. В обох випадках, використовували 0,2мл на мишу. Сполуки вводили через 30 хвилин, 4 години і 24 години після введення патогену. Контрольні сполуки з відомою ефективністю, призначали тим же самим шляхом, включаючи їх у кожний тест. За тваринами спостерігали кожний день і реєстрували кількість залишившихся у живих тварин у кожній групі. За моделлю P.multocida, слідкували на протязі 96 годин (чотири дні) після введення патогену. PD50 - розрахована доза тестуємої сполуки, що 50% відсотків мишей з групи захищає від хвороби викликаної бактеріальною інфекцією, що була б смертельна у відсутності фармакотерапии. Сполуки формули 1 та їх фармацевтично прийнятні солі (надалі «активні сполуки»), можуть бути призначені будь-яким шляхом - оральним, парентеральним, місцево або ректальним при лікуванні або попереджені бактеріальних або протозойних інфекцій. Загалом, ці сполуки найбільш бажано призначати у дозах в інтервалі від приблизно 0,2мг на кг ваги тіла (мг/кг/день) до приблизно 250мг/кг/день, в одиничній або розподіленій дозах (тобто, від 1 до 4 доз на день), хоча зміни обов'язково будуть траплятися в залежності від виду, ваги та стану суб'єкту, якого лікують, та вибраного конкретного шляху призначення. Однак, найбільш бажано використовувати рівень доз, що лежить в інтервалі від приблизно 4мг/кг/день до приблизно 50мг/кг/день. Зміни, між тим, можуть траплятися в залежності від виду тварини, риби або птиці яку лікують, та її індивідуальної реакції на згаданий медикамент, а також від типу вибраної фармацевтичної композиції і періоду часу та інтервалу, в яких дане призначення проводять. В деяких випадках рівні доз, нижчі найнижчої межі вищезгаданого інтервалу, можуть бути більш ніж адекватними, в той час, як в інших випадках можуть бути застосовані ще вищі дози без викликання будь-якого шкідливого побічного ефекту, при умові, що такі вищі дози спочатку розподілені на декілька малих доз для призначення протягом дня. Активні сполуки можуть бути призначені самостійно або в комбінації з фармацевтично прийнятними носіями або розріджувачами будь-яким з заздалегідь вказаних шляхів, і такі призначення можуть бути проведені в одноразовій або багаторазовій дозах. Більш конкретно, активні сполуки можуть бути призначені у великій кількості різних дозованих форм, тобто вони можуть бути скомбіновані з різними фармацевтично прийнятними носіями у формі таблеток, капсул, пігулок, пастилок, твердих льодяників, порошків, спреїв, кремів, бальзамів, супозиторіїв, желе, гелів, паст, лосьйонів, мазей, водних суспензій, розчинів для ін'єкцій, еліксирів, сиропів і т.ін. Такі носії включають тверді розріджувачи або наповнювачі, стерильне водне середовище та різні нетоксичні органічні розчинники і т.д. Більш того, оральні фармацевтичні композиції можуть бути прийнятно підсолоджені і/або ароматизовані. Загалом активні сполуки даного винаходу присутні в таких дозованих формах з рівнями концентрації, що лежать в межах від приблизно 5,0ваг.% до 70ваг.%. Для орального призначення, таблетки, що містять ріноманітні екціпієнти, такі як мікрокристалічна целюлоза, цитрат натрію, карбонат кальцію, гідрофосфат кальцію та гліцин можуть бути використані разом різноманітними дезінтегрантами, такими як крохмаль (переважно кукурудзяний, картопляний або тапіоковий крохмаль), алгінінова кислота та певні комплексні силікати, разом зі зв'язуючими гранулятами, такими як полівінілпіролідон, цукроза, желатин та акація. Додатково змащуючи агенти, такі як стеарат магнію, лаурилсульфат натрію та тальк, є часто дуже корисними для цілей таблетування. Тверді композиції подібного типу можуть також бути застосовані як наповнювач в желатинових капсулах; переважні матеріали, у цьому зв'язку, також включають лактозу або молочний цукор, а також поліетиленгліколі з великою молекулярною вагою. Коли для орального призначення бажані водні суспензії і/або еліксири, активна сполука може бути скомбінована з різноманітними підсолоджуючими або ароматизуючими агентами, забарвлюючими речовинами або барвниками і, якщо це бажано, емульсифікуючими і/або суспендуючими агентами, а також з разом з такими розбавниками, як вода, етанол, пропіленгліколь, гліцерин та різні подібні їх комбінації. Для парентерального призначення можуть бути застосовані розчини активної сполуки даного винаходу або в кунжутному чи арахісовому маслі, або у водному . пропіленгліколі. Водні розчини повинні бути придатно забуферені (переважно, рН більше, ніж 8), якщо це необхідно, і рідкий розріджувач спочатку робиться ізотонічним. Такі водні розчини придатні для призначення у вигляді внутрішньовенних ін'єкцій. Масляні розчини придатні для призначення у вигляді внутрішньосуглобових, внутрішньом'язових та підшкірних ін'єкцій. Одержання всіх цих розчинів в стерильних умовах виконується за стандартними фармацевтичними методиками, добре відомими фахівцю в даній галузі. Крім того, також можливо призначати активні сполуки даного винаходу місцево при лікуванні запальних захворювань шкіри, і це може бути зроблено шляхом застосування кремів, желе, гелів, паст, пластирів, мазей і т.і., у відповідності зі стандартною фармацевтичною практикою. Для призначення тваринам іншим ніж людина, таким як, велика рогата худоба або свійським тваринам, активну сполуку можуть призначати в їжу тварин або орально у вигляді рідких композицій для вливання. Активні сполуки можуть також призначатись у формі ліпосомної кормової системи, таких як, маленьких моношарових пухирців, великих моношарових пухирців і багатошарових пухирців. Ліпосоми можуть бути одержані з різноманітних фосфоліпідів, таких як, холестерол, стеариламін або фосфатідилхолінів. Активні сполуки можуть також бути зв'язані з розчинними полімерами, що використовуються в якості носія лікарського засобу. Таким полімером може бути полівінілпіролідин, співполімер пірану, полігідроксипропілметакриламідфеніл, полігідроксиетиласпартамідфенол або поліетиленоксид-полілізин заміщений залишком палмітоілу. Крим того, активна сполука може бути з'єднана з класом біодеградуючих полімерів, що використовуються для контрольованого вивільнення лікарського засобу, наприклад, полімолочна кислота, полігліколева кислота, співполімер полімолочної і полігліколевої кислоти, полі-єкарболактонів, полігідроксібутирової кислоти, поліортоетерів, поліацеталів, полідигідропіринів, поліціаноакрілатів і гідрогелі поперечно-зшитих або амфіпатичних блок співполімерів. Наступні приклади, що далі приведені ілюструють способи і використання проміжних продуктів представленого винаходу. Зрозуміло, що представлений винахід не обмежується рамками конкретних Прикладів, що приведені нижче. Сполуки Прикладів 1-18 мають структурну формулу 6, що приведена нижче, в якій значення R замісників показані в таблиці (див. нижче). Сполуки одержували, як описано нижче в Приготуваннях 1-6. В таблиці вказано вихід і данні масспектру для кінцевих продуктів. Таблиця 1 Приклад 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 R Замісник н-бутиламіно пропіламіно метоксиетиламіно диметиламіно циклопропіламіно аліламіно імідазол-1-іл 2,2,2-трифторетиламіно біс(2-гідроксиетил)аміно біс(2-метоксиетил)аміно 2-гідроксиетилтіо меркапто 4-метилімідазол-1-іл 2-пропініламіно діаліламіно 1,2,3-тріазол-1-іл 2-метилімідазол-1-іл 1,2,4-тріазол-1-іл Приготування 1 2 1 1 1 2 3 2 4 1 5 6 3 2 2 4 3 4 Вихід 67% 15% 27% 87% 59% 53% 48% 19% 58% 49% 83% 13% 45% 43% 41% 40% 21% 67% Масспектр 835 821 836 806 818 818 829 860 866 895 840 795 843 816 858 830 843 835 Способи приготування для Таблиці 1 Приготування 1 250-500мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 1-2мл аміну, відповідні значення R груп показані в Таблиці 1 вище. Додавали каталітичну кількість (20мг) гідрохлориду піридинію і розчин нагрівали при 50-75°С, приблизно, на протязі від чотирьох до восьми днів. Реакційну суміш гасили 50мл насиченого розчину NaHCO3. Органічний шар екстрагували 3х50мл СН2СІ2 і сушили над Na2SO4. Фільтрували, фільтрат концентрували і сушили одержуючи неочищене масло або тверду речовину. Наступним очищенням на колонці, що містила силікагель (1,5-4%МеОН/СНСІ3, 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приготування 2 250-500мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 1-2мл аміну, відповідні значення R груп показані в Таблиці 1 вище. Додавали каталітичну кількість (20мг) гідрохлориду піридинію і розчин нагрівали при 40-75°С, приблизно, на протязі від чотирьох до восьми днів. Реакційну суміш гасили 50мл насиченого розчину NaHCO3. Органічний шар екстрагували 3х50мл СН2СІ2 і сушили над Na2SO4. Фільтрували, фільтрат концентрували і сушили одержуючи неочищене масло або тверду речовину. Наступним очищенням на колонці, що містила силікагель (1,5-4%МеОН/СНСІ3, 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приготування 3 300мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 2-4мл МеОН/Н2О. Додавали імідазольний реагент, відповідні значення R груп показані в Таблиці 1, вище, (25екв) і каталітичну кількість (20мг) гідрохлориду піридинію. Реакційну суміш кип'ятили із зворотнім холодильником при 45-50°С на протязі від трьох до чотирьох днів. Реакційну суміш гасили насиченим розчином NaHCO3, екстрагували 3х50мл СН2СІ2, сушили над Na2SO4, фільтрували і концентрували до твердої речовини. Твердий продукт розчиняли в 500мл ЕtOАс і промивали 3x150мл 2N NaOH для видалення надлишку імідазолу. Наступним очищенням на колонці, що містила силікагель (24%МеОН/СНСІ3, 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приготування 4 200-500мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 1-2мл 2-пропанолу або метанолу. До одержаного розчину додавали надлишок реагенту і каталітичну кількість (20мг) гідрохлориду піридинію. Розчин нагрівали при 40-75°С, приблизно, на протязі від двох до семи днів. Реакційну суміш концентрували одержуючи неочищений продукт. Наступним очищенням на колонці, що містила силікагель (2-4%МеОН/СНСІ3 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приготування 5 180мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 2мл бензолу. До одержаного розчину додавали надлишок К2СО3 і 0,5мл тіолу. Суміш перемішували при кімнатній температурі на протязі 16 годин. Реакційну суміш гасили 100мл насиченого розчину NaHCO3, екстрагували 3x25мл СН2СІ2, сушили над Na2SO4, фільтрували і концентрували до твердої речовини. Наступним очищенням на колонці, що містила силікагель (2%МеОН/СНСІ3, 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приготування 6 150мг сполуки формули 3, в якій X є -N(CH3)CH2-, R1 є гідрокси, і R4 є Н, одержали згідно з Способом А, що описаний вище, розчиняли в 3мл етанолу. До одержаного розчину додавали надлишок тіолу. Суміш перемішували при температурі 50°С на протязі 4 годин. Реакційну суміш гасили 100мл насиченого розчину NaHCO3, екстрагували 3x25мл СН2СІ2, сушили над Na2SO4, фільтрували і концентрували до твердої речовини. Наступним очищенням на колонці, що містила силікагель (2-4%МеОН/СНСІ3, 0,2%NH4OH) одержували кінцевий аміноспиртовий продукт. Приклади 19-35, що показані нижче описують одержання сполук структурної формули 7, що показана нижче, в якій R такі, як зазначено в прикладах. Приклад 19 До розчину метилмагнійброміду в Et2O (3,0Μ, 1,7мл) при 0°С додавали розчин метилового естеру пропаргілу (0,421г, 6ммоль) в ТГФ (5мл). Після перемішування при температурі 0°С на протязі 6 годин, при кімнатній температурі додавали розчин 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (0,224г, 0,3ммоль) в ДМЕ (10мл). Після перемішування на протязі 1 години реакційну суміш розводили водою (50мл) і EtOAc (50мл). Після розділення, водний шар промивали EtOAc (3x30мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (40мл) і насиченим водним розчином хлориду натрію (40мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою MeOH-CH2CI2-NH4OH (6:93,5:0,5 до 8:91,5:0,5), одержували 0,095г (вихід 39%) сполуки формули 7, в якій R є 3метокси-1-пропінілом; МС: 817 (АРІ). Приклад 20 До розчину метилмагнійброміду в Et2O (3,0Μ, 1,7мл) при 0°С додавали розчин 1-діметиламіно-2-пропіну (0,499г, 6ммоль) в ТГФ (5мл). Після перемішування при температурі 0°С на протязі 6 годин, при кімнатній температурі додавали розчин 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (0,224г, 0,3ммоль) в ДМЕ (10мл). Після перемішування на протязі 1 години, реакційну суміш розводили водою (50мл) і EtOAc (40мл). Після розділення, водний шар промивали EtOAc (3x30мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (40мл) і насиченим водним розчином хлориду натрію (50мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою MeOH-CH2Cl2-NH4OH (6:93,5:0,5 до 10:89,5:0,5) одержували 0,093г (вихід 37%) сполуки формули 7, в якій R є 3-диметиламіно-1-пропінілом: МС: 831 (АРІ). Приклад 21 До суспензії тетрафторборату триметилсульфонію (1,03г, 6,3ммоль) в ТГФ (40мл) при -10°С додавали КГМДС (1,20г, 6,0ммоль). Після перемішування при температурі нижче 0°С протягом 0,5 годин, реакційну колбу охолоджували до -78°С і додавали розчин сполуки формули IV, в якій X є -N(CH3)CH2- і R13 є бензилоксикарбокси (2,60г, 3ммоль) в ДМЕ (10мл). Через 0,5 годин, реакційну суміш розводили насиченим водним розчином хлориду амонію (40мл) і EtOAc (50мл). Після розділення, водний шар промивали EtOAc (3х30мл). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію (40мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою MeOH-CH2CI2NH4OH (2:97,6:0,4 до 4:95,6:0,4) одержували 0,834г (вихід 32%) сполуки формули 3, в якій X є -N(CH3)CH2- і R13 є бензилоксикарбонілом: МС: 881 (АРІ). Конфігурація епоксидного замісника є такою, як передбачено для Способу Б відповідно до Схеми 2, що приведена вище. Приклад 22 До розчину сполуки Прикладу 21 (0,101г, 0,115) в ДМЕ (3мл) по краплям додавали LiAIH4 (1,0М, 2,1мл). Через 10 хвилин реакційну суміш послідовно обробляли водою (0,044мл), 15% розчином NaOH (0,044мл) і водою (0,132мл) і потім перемішували при кімнатний температурі на протязі 0,5 годин. Реакційну суміш розводили EtOAc (20мл) і водою (20мл). Після розділення, водний шар екстрагували EtOAc (3x30мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (50мл) і насиченим водним розчином хлориду натрію (60мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою МеОН-СН2СІ2-МН4ОН (3:96,5:0,5 до 3,5:95:0,5) одержували 0,042г (вихід 49%) проміжної сполуки: МС: 749 (АРІ). До розчину проміжної сполуки описаної вище (0,151г, 0,202ммоль) і формальдегіду (0,17мл, 2,02ммоль) в метанолі (20мл) додавали паладієвий каталізатор (0,075мг, 10% Pd/C). Реакційну колбу промивали і заповнювали воднем (50псі) і збовтували при кімнатній температурі на протязі 24 годин. Реакційну суміш фільтрували крізь Целіт™ і концентрували під вакуумом. Хроматографією на силікагелі за допомогою гексанацетон-н-пропанол-NН4ОН (100:10:3:0,5 до 50:10:3:0,5 ) одержували 0,098 г (вихід 64%) of 4"S-метил-9-деоксо9а-аза-9а-метил-9а-гомоеритроміцину А: МС: 763 (АРІ). Приклад 23 До розчину 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (1,0г, 1,34ммоль) в ДМЕ (50мл) при 0°С додавали етилмагнійбромід в ТГФ (0,5М, 40,2мл). Після перемішування при 0°С на протязі 0,5 годин, реакційну суміш розводили насиченим водним розчином бікарбонату натрію (100мл) і EtOAc (100мл). Після розділення, водний шар промивали EtOAc (3x100мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (100мл) і насиченим водним розчином хлориду натрію (100мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою MeOH-CH2CI2-NH4OH (4:95,5:0,5) одержували 0,089г (вихід 9%) сполуки формули 7, в якій R є етинілом: МС: 774 (АРІ). Приклад 24 До розчину N-метилпіролу (0,217г, 2,68ммоль) в ТГФ (5мл) при -78°С додавали BuLi (2,5Μ, 1,08мл). Розчин нагрівали до кімнатної температури протягом 2 годин і потім через канюлю у колбу при кімнатній температурі додавали МдСІ2 (0,38г, 4,02ммоль) і ТГФ (5мл). Після витримування при кімнатній температурі на протязі 1 години, у реакційну суміш вводили розчин 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9агомоеритроміцину А (0,200г, 0,268ммоль) в ТГФ (2мл) і суміш перемішували при кімнатній температурі на протязі 45 хвилин. Реакційну суміш розводили насиченим водним розчином бікарбонату натрію (50мл) і EtOAc (50мл). Після розділення, водний шар промивали EtOAc (3x50мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (50мл) і насиченим водним розчином хлориду натрію (50мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі MeOH-CH2CI2-NH4OH (1:98:1 до 8:91:1) одержували 0,032г (вихід 14%) сполуки формули 7, в якій R є 1-метил-2-піролілом: МС: 829 (АРІ). Приклад 25 До розчину N-метилімідазолу (0,440г, 5,36ммоль) в ТГФ (5мл) при -78°С додавали BuLi (2,5Μ, 2,15мл). Розчин нагрівали до кімнатної температури протягом 1 години і потім через канюлю у колбу при кімнатній температурі додавали МдСІ2 (0,6374г, 6,69ммоль) і ТГФ (5мл). Після витримування при кімнатній температурі на протязі 1 години у реакційну суміш вводили розчин 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9агомоеритроміцину А (0,200г, 0,268ммоль) в ДМЕ (2мл) і суміш перемішували при кімнатній температурі на протязі 45 хвилин. Реакційну суміш розводили насиченим водним розчином бікарбонату натрію (50мл) і EtOAc (50мл). Після розділення, водний шар промивали EtOAc (3x50мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (50мл) і насиченим водним розчином хлориду натрію (50мл), сушили над Na2SO4 і концентрували під вакуумом, Хроматографією на силікагелі MeOH-CH2Cl2-NH4OH (1:98:1 до 8:91:1) одержували 0,042г (вихід 19%) сполуки формули 7, в якій R є 1-метил-2-імідазолілом: МС: 830 (АРІ). Приклад 26 До розчину неочищеного зразку сполуки одержаної в Прикладі 20 (0,360г) в ізопропанолі (40мл) додавали оксид платини (0,076г, 0,335ммоль). Реакційну колбу промивали і заповнювали воднем (50псі) і збовтували при кімнатній температурі на протязі 24 годин. Фільтруванням аліквотної частини реакційної суміші крізь Целіт™ і концентруванням під вакуумом одержували сполуку формули 7, в якій R є 3-диметиламіно-1пропенілом: МС: 833 (АРІ). Приклад 27 Оксид платини (0,076г, 0,335ммоль) додавали до розчину, що залишився з Прикладу 26 і реакційну колбу промивали і заповнювали воднем (50псі) і збовтували при кімнатній температурі на протязі 96 годин. Реакційну суміш фільтрували крізь Целіт™ і концентрували під вакуумом. Хроматографією на силікагелі MeOH-CH2Cl2-NH4OH (1:98:1 до 8:91:1) одержували 0,027г (вихід 5%) сполуки формули 7, в якій R є 3диметиламінопропілом: МС: 835 (АРІ). Приклад 28 До розчину неочищеного зразку сполуки одержаної в Прикладі 19 (0,40г) в ізопропанолі (40мл) додавали оксид плитини (0,076г, 0,335ммоль). Реакційну колбу промивали і заповнювали воднем (50псі) і збовтували при кімнатній температурі на протязі 24 годин. Фільтруванням аліквотної частини реакційної суміші крізь Целіт™ і концентруванням під вакуумом одержували сполуку формули 7, в якій R є 3-метокси-1-пропенілом: МС: 819 (АРІ). Приклад 29 Оксид платини (0,076г, 0,335ммоль) додавали до розчину, що залишився з Прикладу 28 і реакційну колбу промивали і заповнювали воднем (50псі) і збовтували при кімнатній температурі на протязі 96 годин. Реакційну суміш фільтрували крізь Целіт™ і концентрували під вакуумом. Хроматографією на силікагелі MeOH-CH2CI2-NH4OH (1:98:1 до 8:91:1) одержували 0,119г (вихід 21%) сполуки формули 7, в якій R є 3метоксипропілом: МС: 822 (АРІ). Приклад 30 До колби, що містила MgBr2-OEt2 (2,28г, 8,84ммоль) в ДМЕ (5мл) при 0°С додавали літійпропініл (1,865г, 8,03ммоль). Після 6 годин витримування при температурі 0°С, до реакційної суміші вводили розчин 4"-деоксі4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (0,300г, 0,402ммоль) в ДМЕ (2мл) і вміст колби перемішували при 0°С протягом 1 години і потім при кімнатній температурі протягом 0,5 годин. Реакційну суміш розводили насиченим водним розчином бікарбонату натрію (75мл) і EtOAc (75мл). Після розділення, водний шар промивали EtOAc (3x75мл). Об'єднані органічні екстракти промивали насиченим водним розчином бікарбонату натрію (75мл) і насиченим водним розчином хлориду натрію (75мл), сушили над Na2SO4 і концентрували під вакуумом. Хроматографією на силікагелі за допомогою MeOH-CH2CI2-NH4OH (1:98:1 до 8:91:1) одержуючи 0,099г (вихід 31%) сполуки формули 7, в якій R є 1-пропінілом, у вигляді суміші ізомерів: МС: 788 (АРІ). Приклад 31 До розчину 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміціну А (0,59г, 0,79ммоль) в ТГФ (20мл) додавали розчин MeMgBr в Et2O (1,7мл, 5,1ммоль, 3,0Μ Et2O розчин) при температурі 0°С. Суспензію перемішували при 0°С на протязі однієї години і поступово нагрівали до кімнатної температури. Через 3 години, реакційну суміш гасили насиченим розчином NH4CI (10мл). Органічний розчинник відганяли під вакуумом до його повного видалення. Залишившийся водний розчин підлуговували до рН 9,5 насиченим водним розчином NaHCO3 після чого додавали етилацетат (30мл). Водний шар, після відділення, екстрагували етилацетатом (2x30мл). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Очищаючи, за допомогою хроматографії (силікагель і MeOH/CHCI3/NH4OH (4:95,9:0,1) в якості елюенту) одержуючи 4"метил-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцин А (який є сполукою формули 7, в якій R є метилом і має R конфігурацію) у вигляді білою твердої речовини, 240мг (0,315ммоль, вихід 40%): FABMC: м/е 763 (МН+). Приклад 32 Відповідно до методики Прикладу 31, піддавали взаємодії 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9агомоеритроміцин А (299мг, 0,403ммоль) і фенілмагнійбромід (0,87мл, 2,61ммоль, 3,0Μ ΤΓΦ розчин) одержуючи сполуки формули 7, в якій R є фенілом, 74мг (0,09ммоль, вихід 22%): FABMC: м/е 825 (МН+). Приклад 33 Відповідно до методики Прикладу 31, піддавали взаємодії 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9агомоеритроміцин А (482мг, 0,646ммоль) і вінілмагнійбромід (4,2мл, 4,2ммоль, 1,0Μ ΤΓΦ розчин), одержуючи сполуки формули 7, в якій R є вінілом, 133мг (0,172ммоль, вихід 26,6%): FABMC: м/е 774 (МН+). Приклад 34 Відповідно до методики Прикладу 31, піддавали взаємодії 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9агомоеритроміцин А (494мг, 0,662ммоль) і бензилмагнійбромід (4,4мл, 4,4ммоль, 1,0Μ ΤΓΦ розчин) одержуючи сполуки формули 7, в якій R є бензилом, 133мг (0,172ммоль, вихід 5,4%): FABMC: м/е 839 (МН+). Приклад 35 До розчину 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (602мг, 0,806ммоль) в хлороформі (8мл) додавали TMSCN (220мл, 1,64ммоль) і потім додавали Znl2 (13мг, 0,04ммоль). Реакційну суміш перемішували при кімнатній температурі на протязі 30 хвилин. Додавали 10% водний розчин К2СО3 (10мл). Органічний шар промивали насиченим водним розчином хлориду натрію, сушили (MgSO4) і концентурвали під вакуумом одержуючи неочищений продукт. Після хроматографії на силікагелі, використовуючи в якості елюенту CHCI3-MeOH-NH4OH (97:3:0,1), одержували сполуку формули 7, в якій R є ціано, у вигляді білої твердої речовини, 94,4мг (0,122ммоль, вихід 15%): FABMC: м/е 774 (МН+). Наступна схема ілюструє одержання сполук вказаних у Таблиці 2, нижче. У наступних схемах Cbz означає бензилоксикарбоніл. Сполуку формули 8, що зазначена на схемі вище, (20,0г, 22,7ммоль) розчиняли в хлороформі (150мл) і потім додавали формальдегід (5,1мл 37% розчину 68,1ммоль) і мурашину кислоту (2,8мл, 74,9ммоль). Одержаний розчин нагрівали при 60°С на протязі ночі, одержуючи сполуку формули 9. Реакційну суміш виливали у воду (150мл) і метиленхлорид (50мл). Органічний шар промивали водою (150мл) більше одного разу, і водні шари об'єднували, рН розчину доводили до 9, додаванням 5N розчину NaOH. Продукт екстрагували метиленхлоридом (3x100мл). Об'єднані органічні шари промивали насиченим водним розчином хлориду натрію, сушили над сульфатом натрію і органічний розчинник відганяли під вакуумом одержуючи сполуку формули 9 (19,6г, 96%). МС (ТС) m\z 895. 1-2г Сполуки формули 9 розчиняли в метанолі (10мл) і після цього додавали КІ (10ек.) і амін, відповідні R групи зазначені у Таблиці 2, нижче (10ек.). Після встановлення завершення реакції, реакційну суміш розводили водою (10мл) і екстрагували СН2СІ2 (3x15мл). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над Na2SO4, фільтрували і очищали флеш-хроматографією одержуючи сполуку формули 10, з R групою вказаною в Таблиці 2, нижче. Таблиця 2 Приклад 36 37 38 39 40 41 42 43 44 45 46 47 47(а) 47(b) 47(с) 47(d) 47(е) 47(f) 47(g) 47(h) 47(і) 47(j) 47(k) 47(l) 47(m) 47(n) 47(o) 47(p) 47(q) 47(r) 47(s) 47(t) 47(u) 47(v) 47(w) 47(x) 47(y) 47(z) 47(aa) 47(ab) R аліламіно пропіламіно ізопропіламіно циклопропіламіно ізобутиламіно втор-бутиламіно диметиламіно триметиленіміно бутиламіно діетиламіно етиламіно N-етилметиламіно піролідино піперидино 3,4-дифторбензиламіно 4-метоксибензиламіно 4-трифторметилбензиламіно аніліно 4-фторбензиламіно 3-фторбензиламіно 2-фторбензиламіно 2,4-дифторбензиламіно 2,5-дифторбензиламіно 3,5-дифторбензиламіно 1-(4-фторфеніл)піперазин 2-трифторметилбензиламіно 4-трифторметоксибензиламіно 3-трифторметоксибензиламіно 2-фторфенілетиламіно 3-фторфенілетиламіно 4-піридилметиламіно (метил)(3-піридилметил)аміно 4-гідрокси-3-метоксибензиламіно піпероніламіно 3-метоксибензіламіно 2-метоксибензиламіно 4-фторфенілетиламіно 3-піридилметиламіно 2-піридилметиламіно бензиламіно Час реакції (години) 24 48 72 48 48 72 24 24 48 168 48 48 96 96 48 48 48 120 60 48 48 48 48 48 48 48 48 48 48 48 48 72 48 48 48 48 48 48 48 48 Вихід (%) 29 42 44 33 43 38 35 30 34 44 31 36 60 60 18.7 17,1 44,8 31 ЗО 42,8 55,8 41,4 33,7 44,4 25,9 41,6 39,7 38,3 31,2 25,5 37,9 11 8 25 24 25 62 30,5 49,9 28 Масспектр 818 820 820 818 834 834 806 818 834 834 806 820 832,7 846,7 904,8 898,5 936,7 865,7 886,7 886,7 886,7 904,1 904,1 904,1 941,1 936,1 952,1 936,1 900,2 900,2 869,6 883,5 914,1 912,1 898,1 898,5 900,1 869,3 869,3 868,6 Наступна схема ілюструє одержання сполук, що вказані нижче в Прикладах 48-49. Приклад 48 До розчину гідриду натрію (41,5мг, 1,73ммоль) в ДМФА (5мл) додавали триметилсульфоксоніййодид (399мг, 1,77ммоль). Через 15 хвилин, мутна реакційна суміш ставала прозорою. До неї повільно додавали розчин 4"-деоксі-4"-оксо-9-деоксо-9а-аза-9а-метил-9а-гомоеритроміцину А (940мг, 1,26ммоль) в ДМСО (3мл). Одержаний жовтий розчин перемішували 15 хвилин при кімнатній температурі і 45 хвилин при температурі 55°С і потім при кімнатній температурі на протязі ночі. Реакційну суміш переносили у воду (20мл) і етилацетат (20мл). Органічний шар промивали насиченим водним розчином хлориду натрію, сушили (MgSO4) і концентрували одержуючи неочищений продукт, який піддавали хроматографії на силікагелі (CHCI3-MeOHNH4OH (97/3/0,1)) одержуючи сполуку формули 12, у вигляді білою твердої речовини, 362мг (0,476ммоль, вихід 38%): FABMC: м/е 761 (MH+). Приклад 49 До розчину сполуки одержаної в Прикладі 48 (95мг, 0,12ммоль) в 9мл МеОН-Н2О (8/1) додавали азид натрію (39мг, 0,60ммоль) після чого додавали NH4CI (19мг, 0,36ммоль). Реакційну суміш нагрівали при 80°С на протязі 24 годин. Метанол відганяли під вакуумом на роторному випаровувачі. Одержану суміш переносили у етилацетат (15мл) і Н2О (15мл). Водний шар, після відділення, екстрагували етилацетатом (15мл). Об'єднані органічні екстракти промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи сполуку формули 13, у вигляді білої твердої речовини, 90мг (0,11ммоль, вихід 93%): FABMC: м/е 804 (МН+). Наступна схема ілюструє одержання сполук, що вказані нижче в Прикладах 50-54. Приклад 50 До розчину сполуки одержаної в Прикладі 49 (709мг, 0,882ммоль) додавали порошок Pd (10% на вугіллі) (94мг, 0,088ммоль). Суспензію перемішували в атмосфері Н2 (1атм) протягом 18 годин. Реакційну суміш фільтрували крізь Целіт™. Випарюванням фільтрату одержували сполуку формули 14, у вигляді білої твердої речовини, 670мг (0,88ммоль, вихід 100%): FABMC: м/е 778 (МН+). Приклад 51 До розчину сполуки одержаної в Прикладі 50 (163мг, 0,209ммоль) в СН2СІ2 (10мл) при 0°С додавали тіокарбонілдімідазол (43мг, 0,242ммоль). Льодяну ванну прибирали і реакційну суміш перемішували при кімнатній температурі на протязі ночі. Розчинник відганяли. Продукт суміші переносили у етилацетат і воду. Органічний шар промивали 5% розчином К2СО3 і потім насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи сполуку формули 15, у вигляді білої твердої речовини, 170мг (0,207ммоль, вихід 99%). Сполуку формули 15 (168мг, 0,205ммоль) розчиняли в ацетоні (6мл) після чого додавали 3,4дихлорфенацилбромід (63мг, 0,234ммоль) і розчин бікарбонату натрію (38мг, 0,417ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 20 годин. Органічний розчинник відганяли Продукт суміші переносили у етилацетат і промивали 5% розчином К2СО3, насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Хроматографією на силікагелі (CHCI3-MeOH-NH4OH=98/2/0,1) одержували сполуку формули 16, в якій R є таким, як вказано нижче, у вигляді білої твердої речовини, 90мг (0,09ммоль, вихід 44%): FABMC:M/e1006(MH+). Приклад 52 До розчину сполуки формули 15 (225мг, 0,274ммоль) в безводному метанолі (10мл) додавали метоксид натрію (50мг, 0,926ммоль). Розчин перемішували на протязі 10 хвилин і охолоджували до 0°С. По краплям додавали метилйодид (60мл, 0,99ммоль). Реакційну суміш нагрівали до кімнатної температури і перемішували при кімнатній температурі на протязі 7 годин. Органічний розчинник відганяли. Продукт суміші переносили у етилацетат і промивали 5% розчином К2СО3, насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Хроматографією на силікагелі (CHCI3MeOH-NH4OH=97/3/0,1) одержували сполуку формули 16, в якій R є тіометилом, у вигляді білої твердої речовини, 231мг (0,277ммоль, вихід 36%); РАВМС: м/е 834 (МН+). Приклад 53 До розчину сполуки формули 14 (250мг, 0,321ммоль) в дихлоретані (10мл) додавали гідрохлорид етил 2тіофенкарбоксимідату (72мг, 0,461ммоль), який одержали шляхом пропускання газоподібного НСІ крізь бензольний розчин 2-тіофенкарбонітрилу і етанолу (1,1 еквівалент) на протязі 2 годин і перемішування при кімнатній температурі на протязі ночі. Мутна реакційна суміш ставала світлою після додавання триетиламіну (65мл, 0,467ммоль). Одержану суміш кип'ятили із зворотнім холодильником на протязі ночі. Суміш переносили в етилацетат і воду, і рН доводили до 1,9 додаванням 10% розчину НСІ. Водний шар підлуговували до рН 9,5 і екстрагували етилацетатом. Органічний екстракт промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Хроматографією на силікагелі (CHCI3-MeOH-NH4OH=99/1/0,1) одержували сполуку формули 16, в якій R є тієнілом, у вигляді білої твердої речовини, 92мг (0,106ммоль, вихід 33%): FABMC: м/е 870 (МH+). Приклад 54 ZnCI2 (2мг) завантажували у круглодонну колбу і нагрівали у вакуумі до утворення розплаву. Після охолодження до кімнатної температури додавали розчин сполуки формули 14 (236мг, 0,303ммоль) і 2ціанопіридину (49мг, 0,467ммоль) в хлорбензолі (10мл). Реакційну суміш нагрівали із зворотнім холодильником на протязі ночі. Додавали воду до одержання рН 2. Після розділення, водний шар підлуговували до рН 9,5 і розчин екстрагували етилацетатом. Органічний екстракт промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Хроматографією на силікагелі (CHCI3-Me0H-NH4OH=98/2/0,1) одержували сполуку формули 16, в якій R є 2-піридилом, у вигляді білої твердої речовини, 47мг (0,054ммоль, вихід 18%): FABMC: м/е 865 (МН+). Приклад 55 До розчину сполуки формули 14 (383мг, 0,492ммоль) в метанолі (5мл) по краплям додавали розчин ціаноброміду (57мг, 0,538ммоль) і ацетат натрію (90мг, 1,097ммоль) в метанолі (5мл). Реакційну суміш перемішували при кімнатній температурі на протязі ночі. Розчинник відганяли під вакуумом і твердий залишок переносили у етилацетат і воду, рН доводили до рН 9,5 10% розчином К2СО3. Органічний екстракт промивали насиченим водним розчином хлориду натрію, сушили над сульфатом магнію і концентрували одержуючи неочищений продукт. Хроматографією на силікагелі (СНСІ3-MeOH-NH4OH=96/4/0,1) одержували сполуку формули 16, в якій R є аміно, у вигляді білої твердої речовини, 124мг (0,155ммоль, вихід 31%): FABMC: м/е 803 (МН+). Наступна схема ілюструє одержання сполук, що вказані нижче в Прикладах 56-63. Приклад 56 Розчин сполуки формули 17 (3г, 3,7ммоль) в 30мл МеОН нагрівали при температурі 50°С на протязі ночі з 2,25г (37,5ммоль) етилендіаміну і 6,21г (37,1ммоль) йодиду калію. МеОН відганяли від одержаної суміші і залишок розчиняли в СН2Сl2 і промивали насиченим водним розчином хлориду натрію. Після висушування над Na2SO4, СН2СІ2 відганяли під вакуумом. Залишок хроматографували на SiO2 (5%MeOH-CH2CI2-0,5% NH4OH -10%MeOH-CHCI3-1%NH4OH) одержуючи 2,72г (89%) сполуки формули 18, в якій Υ є -ΝΗ-: МС м/е 821 (М+1). Приклад 57 Розчин сполуки одержаної в Прикладі 56 (1,0г, 1,2ммоль), о-анісовий альдегід (174мг, 1,3ммоль) і ацетат натрію (100мг, 1,2ммоль) в 20мл СН2СІ2 перемішували при кімнатній температурі на протязі 1 години. До цього розчину додавали 388мг (1,8ммоль) триацетоксиборгідрид натрію. Після 2,5 годин перемішування при кімнатній температурі, реакційну суміш розводили СН2СІ2 і промивали насиченим розчином NaHCO3 і насиченим водним розчином хлориду натрію. Після висушування над Na2SO4 органічний розчинник відганяли. Залишок двічі хроматографували на SiO2 (2% МеОН-СН2СІ2-0,2% NH4OH). Матеріал потім очищали на препаративній платівці SiO2 (10% МеОН-СН2СІ2-1% NH4OH) одержуючи 660мг (58%) сполуки формули 13, в якій Υ є -ΝΗ-, Υ1 є Н, і Υ2 є 2-метоксибензилом: МС м/е 940 (М+1). Приклади 58-59 В методиках аналогічних тій, що описана в Прикладі 57, для сполук Прикладів 58 і 59, заміняли о-анісовий альдегід на п-трифторметилбензальдегід і п-феноксибензальдегід, відповідно, одержуючи згадані сполуки, що мали структурну формулу 19 і Υ і Υ1 були такими, як зазначено вище, для сполуки Прикладу 57 і Υ2 був таким, як зазначено нижче. Приклад 58 59 Υ2 4-трифторметилбензил 4-феноксибензил Масспектр 978 (М+1) 1002 (М+1) Вихід 33% 46% Приклад 60 Розчин сполуки одержаної в Прикладі 57 вище (468мг, 0,5ммоль), ізобутиральдегід (36мг, 0,5ммоль) і ацетат натрію (42мг, 0,5ммоль) в 5мл СН2СІ2 перемішували при кімнатній температурі на протязі 1,5 годин. До цього розчину додавали 164мг (0,77ммоль) триацетоксиборгідриду натрію. Після перемішування при кімнатній температурі на протязі 0,5 годин, реакційну суміш розводили СН2СІ2 і промивали розчином NaHCO3 і насиченим водним розчином хлориду натрію. Після висушування над MgSO4, розчинник відганяли під вакуумом. Залишок хроматографували на SiO2 (4% МеОН-СН2СІ2-0,4% NH4OH) одержуючи 256мг (51%) сполуки формули 13, в якій Υ є -ΝΗ-, Υ1 є 2-метилпропілом, і Υ2 є 2-метоксибензилом: МС м/е 996 (М+1). Приклад 61 Розчин сполуки формули 20 (522мг, 0,65ммоль), 2-фталімідоетантіо (1,08г, 5,2ммоль) і йодиду калію (865мг, 5,2ммоль) в 5мл МеОН нагрівали під азотом протягом 48 годин. МеОН відганяли під вакуумом і залишок розчиняли в СН2СІ2 і промивали розчином NaHCO3 і насиченим водним розчином хлориду натрію. Після висушування над MgSO4, СН2Сl2 відганяли під вакуумом. Одержаний залишок розчиняли в 10мл ЕtOH і обробляли 7,5мл гідразин гідрату. Після перемішування при кімнатній температурі на протязі 3 годин ЕtOH відганяли під вакуумом і залишок екстрагували СН2СІ2. Органічний шар промивали насиченим водним розчином хлориду натрію і сушили над MgSO4. Залишок хроматографували на SiO2 (4%MeOH-CH2CI2Q,4%NH4OH до 5%МеОН-СН2СІ2-0,5%NH4OH) одержуючи 287мг (53%) сполуки формули 18, в якій Υ є S: МС м/е 837 (М+1). Приклад 62 За методом аналогічним тому, що описаний в Прикладі 57 використовуючи в якості вихідної сполуку Прикладу 60, одержувалась сполука формули 19, в якій Υ є S, Y1 і Υ2 обидва 2-метоксибензили (вихід 79%, МС м/е 957 (М+1)), і сполука формули 19, в якій Υ є S, Υ1 є Η і Υ2 є 2-метоксибензилом (вихід 3%, МС м/е 1077 (М+1)). Приклад 63 За методом аналогічним тому, що описаний в Прикладі 60 і вихідної сполуки формули 19, в якій Υ є S, Υ1 є Η і Υ2 є 2-метоксибензилом і пропіональдегіду, одержувалась сполука формули 19, в якій Υ є S, Y1 є нпропілом і Υ2 є 2-метоксибензилом, вихід 70%, МС м/е 999 (М+1). Наступна схема ілюструє одержання сполук, що вказані нижче в Прикладах 64-72. Приклад 64 Сполуку формули 20 одержували з вихідної сполуки формули 12 в якій, Υ=ΝΗ, використовуючи методику аналогічну до методики описаної в Прикладі 56, вихід 35%: МС м/е821 (М+1). Приклад 65 Використовуючи методику подібну до описаної в Прикладі 63 і в якості вихідної сполуки, продукт Прикладу 64, одержували сполуку формули 21, в якій Υ є ΝΗ, Υ1 є Н, і Υ2 є 2-метоксибензилом, вихід 16%; МС м/е 942 (М+1). Приклад 66 Використовуючи методику подібну до описаної в Прикладі 63 і в якості вихідної сполуки, продукт Прикладу 64 і п-трифторметилбензальдегід, одержували сполуку формули 21, в якій Υ є ΝΗ, Υ1 є Н, і Υ2 є 4трифторметилбензилом, вихід 18%; МС м/е 980 (М+1). Приклад 67 Розчин продукту з Прикладу 64 (145мг, 0,18ммоль) і о-анісовийальдегід (122мг, 0,9ммоль) в 10мл ЕtOH перемішували на протязі ночі при кімнатній температурі. ЕtOH відганяли під вакуумом і залишок розчиняли в 5мл МеОН. До суміші додавали боргідрид натрію (34мг, 0,9ммоль) і суміш перемішували при кімнатній температурі на протязі 2 годин. МеОН відганяли під вакуумом і залишок розчиняли в СН2СІ2 і промивали водою і насиченим водним розчином хлориду натрію. Органічний шар сушили над Na2SO4 і випаровували. Залишок хроматографували на SiO2 (5% МеОН-СН2СІ2-0,2% NH4OH) одержуючи 104мг (54%) сполуки формули 21, в який Υ є NH і Y1 і Y2 є 2-метоксибензилом, вказаною сполукою; МС м/е 1061 (М+1). Приклад 68 За допомогою методики, що подібна до описаної в Прикладі 61, одержували сполуку формули 20, в який Υ є S, вихід 63%; МС м/е 838 (М+1). Приклад 69 За допомогою методики, що подібна до описаної в Прикладі 57, одержували сполуку формули 21, в який Υ є S, Υ1 є Η і Υ2 є 2-метоксибензилом, вихід 28%; МС м/е 958 (М+1). Приклад 70 Розчин продукту з Прикладу 64 (80мг, 0,1ммоль), о-анісового альдегіду (136мг, 1ммоль), ацетат натрію (64мг, 0,78ммоль) і триацетоксиборгідрид натрію (64мг, 0,3ммоль) перемішували на протязі ночі при кімнатній температурі. Одержаний розчин розводили СН2СІ2 і промивали насиченим розчином №2СО3 і насиченим водним розчином хлориду натрію. Органічний шар сушили над К2СО3 і випарювали. Залишок хроматографували на SiO2 платівці (2,5% МеОН-метил4-бутилетер-2,5% триетиламін) одержуючи 20мг (19%) сполуки формули 21, в якій Υ є S і Y1 і Y2 є 2-метоксибензилом, МС м/е 1078 (М+1). Приклад 71 Розчин продукту з Прикладу 70 (31мг, 0,03ммоль), формальдегід (37% водний розчин, 83мкл, 1ммоль) і мурашину кислоту (18мкл, 0,47ммоль) в 2мл СНСІ3 нагрівали при температурі 61°С на протязі 1 години. Реакційну суміш розводили СН2СІ2 і промивали насиченим розчином NaHCO3 і насиченим водним розчином хлориду натрію. Після висушування над К2СО3, розчинник відганяли під вакуумом. Залишок хроматографували на SiO2 платівці (5% МеОН-СН2СІ2-2,5% триетиламін) одержуючи 14мг (45%) сполуки формули 21, в якій Υ є S, Y1 є метилом і Υ2 є 2-метоксибензилом; МС м/е 972 (М+1). Приклад 72 Розчин сполуки формули 12 (380мг, 0,5ммоль) і перхлорат магнію (223мг, 1ммоль) в 5мл МеОН кип'ятили із зворотнім холодильником під Ν2 протягом 9 днів. МеОН відганяли під вакуумом і залишок розчиняли в СН2СІ2 і промивали водою і насиченим водним розчином хлориду натрію. Залишок хроматографцвали на SiO2 (2,5% МеОН-СН2СІ2-0,5% NH4OH) одержуючи 25мг (6%) конфігурації вказаної нижче (МС м/е 793 (М+1)): Наступна схема розкриває одержання сполук вказаних нижче в Прикладах 73-75. Приклад 73 Розчин сполуки формули 17 (500мг, 0,62ммоль), азиду натрію (80мг, 1,23ммоль). і перхлорат літію (135мг, 1,27ммоль) в 5мл ацетонітрилу кип'ятили із зворотнім холодильником на протязі 4 днів. Після випарювання ацетонітрилу залишок розчиняли в СН2СІ2 і промивали водою і насиченим водним розчином хлориду натрію. СН2СІ2 шар сушили над MgSO4 і концентрували. Залишок розчиняли в 5мл МеОН і кип'ятили із зворотнім холодильником на протязі ночі. Залишок одержаний після випарювання розчинника хроматографували на SiO2 (4% МеОН-СН2СІ2-0,4% NH4OH) одержуючи 218мг (44%) сполуки формули 22: м/е 803 (М+1). Приклад 74 Розчин сполуки формули 22 (250мг, 0,311ммоль) в 15мл ЕtOH гідрували в присутності 30мг 10% Pd/C в апараті Парра. Після видержування на протязі 2 годин при кімнатній температурі реакційну суміш фільтрували крізь Целіт™ і розчинник відганяли під вакуумом. Залишок хроматографували на SiO2 98% МеОН-СН2СІ2-0,8 NH4OH) одержуючи 140мг (58%) сполуки формули 23; МС м/е 777 (М+1). Приклад 75 За методикою подібною до тієї, що описана в Прикладі 57 і використовуючи в якості вихідного, сполуку формули 26, одержували сполуку формули 24, в якій Y1 є Η і Y2 є 2-метоксибензилом, вихід 43%; МС м/е 897 (М+1).
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of с-4"-substituted macrolides
Назва патенту російськоюПроизводные с-4"-замещенных макролидов
МПК / Мітки
МПК: A61P 33/00, A61K 31/7052, A61K 31/7048, A61P 31/04, C07H 17/08, A61K 31/7042, C07H 17/00
Мітки: спосіб, сполуки, бактеріальної, композиція, с-4"-заміщених, макролідів, фармацевтична, інфекції, похідні, одержання, лікування, протозойної, проміжні
Код посилання
<a href="https://ua.patents.su/22-70298-pokhidni-s-4-zamishhenikh-makrolidiv-sposib-kh-oderzhannya-promizhni-spoluki-farmacevtichna-kompoziciya-ta-sposib-likuvannya-bakterialno-infekci-abo-protozojjno-infekci.html" target="_blank" rel="follow" title="База патентів України">Похідні с-4″-заміщених макролідів, спосіб їх одержання, проміжні сполуки, фармацевтична композиція та спосіб лікування бактеріальної інфекції або протозойної інфекції</a>
Попередній патент: Спосіб безперервного дозрівання пива та реактор для його здійснення
Наступний патент: Фармацевтична композиція, що містить росиглітазон та інсулін (варіанти), спосіб лікування цукрового діабету
Випадковий патент: Спосіб пом'якшення води