Спосіб одержання похідних 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу-2r
Номер патенту: 98870
Опубліковано: 25.06.2012
Автори: Цапко Магдаліна Дмитрівна, Воловенко Юліан Михайлович, Коваленко Наталія Володимирівна
Формула / Реферат
Спосіб одержання сполуки формули І
 I,
I,
де 1R - Н або галоген, 2R - Н або NO2, R - феніл, аміногрупа, ціанометильна група або група
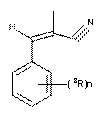 , де 3R - Н, О4R, N(4R)2, де 4R – Н або С1-С6алкіл, n=0-2,
, де 3R - Н, О4R, N(4R)2, де 4R – Н або С1-С6алкіл, n=0-2,
за яким сполуку формулу VI алкілують сполукою формули V або VII в органічному розчиннику.

V
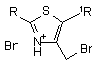
VII
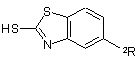
VI
Текст
Реферат: Винахід належить до способу 2 іл)метил)сульфаніл)-1,3-бензтіазолу- R S R N одержання похідних 1 2-(((5- R-2-R-1,3-тіазол-4 1R S S N 2R з метою одержання розширеного асортименту сполук, які можуть бути застосовані в медицині як сполуки для одержання фізіологічно активних речовин. UA 98870 C2 (12) UA 98870 C2 UA 98870 C2 Даний винахід належить до галузі органічної хімії, зокрема хімії гетероциклічних сполук, а 2 саме способу одержання похідних (((1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу- R (І) S R N 1R S S N 2R ,I де R - Н або галоген, R - Н або NO2, R - феніл, аміногрупа, ціанометильна група або група 1 2 ( 3R)n 5 10 15 , 3 4 4 4 де R - Н, О R, N( R)2, де R – Н або С1-С6алкіл, n=0-2. Тіазольне кільце зустрічається в сполуках розповсюджених у природі, які стоять в перших рядах важливості для живих систем, наприклад, вітамін В1 і пеніцилін [1]. Похідними тіазолу є аналітичний засіб аміфеназол, феноклозинова кислота, яка є активним антиперетиком з анальгетичними характеристиками; препарат клометіазол має седативне, гіпнотичне і антиконвульсативні дії [2-4], а також лікарські препарати фамотидин [5], цефалоспорин [6] та інші [7]. Різноманітні області біологічних активностей стимулюють підвищений інтерес до розробки нових сполук цієї структури. В літературі [7] описано близький спосіб, за яким сполуку IV одержано взаємодією гідробромід 4-(хлорметил)-2-метил-1,3-тіазолу II з метил 4-(2-аміно-3,5-диціано-6-сульфаніл-4піридил)фенілкарбоматом III в диметилформаміді у присутності натрію гідрогенкарбомату. Недоліком цього способу є: 1) низький вихід цільового продукту реакції, а саме 36 %; 2) трудомісткий спосіб очищення продукту хроматографічним методом S NH2 N S + N N N HS NH2 S N N Cl N N II 20 25 N H III O IV O O O . В основу винаходу поставлено задачу - створення способу одержання похідних (((1,3-тіазол2 4-іл)метил)сульфаніл)-1,3-бензтіазолу- R (I), які можуть мати фізіологічну активність, і можуть бути застосовані в медицині. 1 Поставлена задача вирішується при здійснені способу отримання похідних 2-(((5- R-2-R-1,32 тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу- R (І) взаємодією похідних 4-бромометил-2-(R)1,3-тіазолу формули І (схема І) або гідробромідів похідних 4-бромометил-2-(R)-1,3-тіазолу формули IV (схема II) в органічних розчинниках за схемами І і II: Схема І S R S R N V 30 N H 1R S + Br N HS N 1R S S N 2R I(a-k) VI Схема II 1 2R UA 98870 C2 1R 1 R Br 2R 2R I(a-k) VI VII , де R - Н або галоген, R - Н або NO2, R - феніл, аміногрупа, ціанометильна група або група 1 2 ( 3R)n 3 5 10 15 20 25 30 35 40 45 4 4 4 , де R - Н, О R, N( R)2, де R – Н або С1-С6алкіл, n=0-2, Одержані продукти мають достатню чистоту для подальшого використання як фізіологічно активних речовини. Винахід підтверджується наступними прикладами, які ілюструють, але не обмежують об'єм даного винаходу. Синтез 2-(((5-бромо-2-метил-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу (Іа). Приклад 1. До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу додають 0,001 моль 1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 3,3 г (93 %), сполуки (Іа), т.пл. 69-72 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,88 д (1Н, У 7,6 Гц СН), 7,84 д - (1Н, J 8,0 Гц, СН), 7,43 т (1Н, J 7,6 Гц, J 7,2 Гц), 7,32 т (1Н, J 7,6 Гц, J 7,6 Гц), 4,65 с (2Н, СН2), 2,64 с (3Н, СН3). Знайдено, %: С 40,41; N 7,92; Вr 22,45: S 26,99 C12H9BrN2S3. Вираховано, %: С 40,34; N 7,84; Вr 22,36: S 26,92. Приклад 2. До 0,001 моль 5-бромо-4-(бромометил)-2-метил-1,3-тіазолу додають 0,001 моль 1,3бензтіазол-2-тіолу у 15 мл (20 мл) спирту, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 3,2 г (89 %), сполуки (Іа), т.пл. 69-72 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,88 д (1Н, J 7,6 Гц СН), 7,84 д - (1Н, J 8,0 Гц, СH), 7,43 т (1Н, J 7,6 Гц, J 7,2 Гц), 7,32 т (1Н, J 7,6 Гц, J 7,6 Гц), 4,65 с (2Н, СН2), 2,64 с (3Н, СН3). Знайдено, %: С 40,41; N 7,92; Вr 22,45: S 26,99 C12H9BrN2S3. Вираховано, %: С 40,34; N 7,84; Вr 22,36: S 26,92. Синтез 2-(((2-метил-1,3-тіазол-4-іл)метил)сульфаніл)-5-нітро-1,3-бензтіазолу (Іb). Приклад 1. 2 До 0,001 моль 4-бромометил-2-метил-1,3-тіазолу додають 0,001 моль 5- R-1,3-бензтіазол-2тіолу у 15 мл (20 мл) спирту, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,8 г 1 (88 %), сполуки (Іb), т.пл. 159-160 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,96 с (1Н, СН), 8,27 д (1Н, J 8,8 Гц СН), 7,97 д (1Н, J 8,8 Гц, СН), 7,40 с (1Н, СН), 4,72 с (2Н, СН 2), 2,66 с (3Н, CH3). Знайдено, %: С 44,59; N 13,04; S 29,80. С12Н9N3O2S3. Вираховано, %: С 44,56; N 12,99; S 29,74. Приклад 2. 2 До 0,001 моль гідроброміду 4-бромометил-2-метил-1,3-тіазолу додають 0,001 моль 5- R-1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником 2 UA 98870 C2 5 10 15 20 25 30 35 40 45 50 55 60 (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 2,9 г (89 %), сполуки (Іb), т.пл. 159-160 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,96 с (1Н, СН), 8,27 д - (1H, J 8,8 Гц СН), 7,97 д (1Н, J 8,8 Гц, СН), 7,40 с (1Н, СН), 4,72 с (2Н, СН 2), 2,66 с (3Н, СН3). Знайдено, %: С 44,61; N 13,12; S 29,86. С12Н9N3O2S3. Вираховано, %: С 44,56; N 12,99; S 29,74. Синтез 2-([(2-метил-1,3-тіазол-4-іл)метил]сульфаніл)-1,3-бензтіазолу (Іс). Приклад 1. До 0,001 моль 4-бромометил-2-метил-1,3-тіазолу додають 0,002 моль 1,3-бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl 2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,4 г 1 (86 %), сполуки (Іс), т.пл. 56-58 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,87 д (1Н, J 8,0 Гц, СН), 7,83 д (1Н, J 8,0 Гц, СН), 7,42 м (1Н, СН), 7,34 с (1Н, СН), 4,66 с (2Н, СН2), 2,66 с (3Н, СН3). Знайдено, %: %: С 51,82; N 10,23; S 34,61. C12H10N2S3. Вираховано, %: С 51,77; N 10,06; S 34,55. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-2-метил-1,3-тіазолу додають 0,001 моль 1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 2,4 г (87 %), сполуки (Іс)., т.пл. 56-58 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,87 д (1Н, J 8,0 Гц, СН), 7,83 д (1Н, J 8,0 Гц, СН), 7,42 м (1Н, СН), 7,34 с (1Н, СН), 4,66 с (2Н, СН 2), 2,66 с (3Н, СН3). Знайдено, %: С 51,82; N 10,23; S 34,61. C2H10N2S3. Вираховано, %: С 51,77; N 10,06; S 34,55. Синтез 5-нітро-2-(((2-феніл-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу (Id). Приклад 1. 2 До 0,001 моль 4-бромометил-2-феніл-1,3-тіазолу додають 0,001 моль 5- R-1,3-бензтіазол-2тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl 2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 3,2 г 1 (89 %), т.пл. 142 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,95 с (1Н, СН), 8,27 д - (1Н, J 8,8 Гц, СН), 7,99 д (2Н, J 8,8 Гц), 7,89 уш. с (2Н, α,α'- прот. Фен. кольца), 7,64 с (1Н, СН), 7,43 уш. с (1Н, СН), 4-83 с (2Н, СН2), Знайдено, %: С 52,64; N 11,01; S 25,05. C17H11N3O2S3. Вираховано, %: С 52,97; N 10,90; S 24,95. Приклад 2. 2 До 0,001 моль гідроброміду 4-бромометил-2-феніл-1,3-тіазолу додають 0,001 моль 5- R-1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 3,1 г (88 %), т.пл. 142 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,95 с (1Н, СН), 8,27 д (1Н, J 8,8 Гц, СН), 7,99 д (2Н, J 8,8 Гц), 7,89 уш. с (2Н, α,α'- прот. Фен. кольца), 7,64 с (1Н, СН), 7,43 уш. с (1Н, СН), 4,83 с (2Н, СН2). Знайдено, %: С 52,64; N 11,01; S 25,05. С17Н11N3О2S3. Вираховано, %: С 52,97; N 10,90; S 24,95. Синтез 4-(((1,3-бензтіазол-2-іл)сульфаніл)метил)-1,3-тіазол-2-іламіну (Iе). Приклад 1. До 0,001 моль 4-бромометил-2-аміно-1,3-тіазолу додають 0,001 моль 1,3-бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl 2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,4 г 1 (86 %), сполуки (Іе), т.пл. 138 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7.86 д (1Н, J 8,0 Гц, СН), 7,81 д (1Н, J 8,0 Гц, СН), 7,41 т (1Н, J 8,0 Гц, J 7,6 Гц, СН), 7,31 т (1Н, J 8,0 Гц, J 7,4 Гц, СН), 6,79 3 UA 98870 C2 5 10 15 20 25 30 35 40 45 50 55 60 уш. с (2Н, NH2), 6,40 с. (1Н, СН), 4,44 с (2Н, СН 2). Знайдено, %: С 47,31; N 15,11; S 34,49. C11H9N3S3. Вираховано, %: С 47,28; N 15,04; S 34,43. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-2-аміно-1,3-тіазолу додають 0,001 моль 1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 2,5 г (88 %), сполуки (Іе), т.пл. 138 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,86 д (1Н, J 8,0 Гц, СН), 7,81 д (1Н, J 8,0 Гц, СН), 7,41 т (1Н, J 8,0 Гц, J 7,6 Гц, СН), 7,31 т (1Н, J 8,0 Гц, J 7,4 Гц, СН), 6,79 уш. с. (2Н, NH2), 6,40 с. (1Н, СН), 4,44 с (2Н, СН2). Знайдено, %: С 47,31; N 15,11; S 34,49. C11H9N3S3. Вираховано, %: С 47,28; N 15,04; S 34,43. Синтез 4-(((5-нітро-1,3-бензтіазол-2-іл)сульфаніл)метил)-1,3-тіазол-2-іламіну (If). Приклад 1. 2 До 0,001 моль 4-бромометил-2-амино-1,3-тіазолу додають 0,001 моль 5- R-1,3-бензтіазол-2тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 1,9 г 1 (87 %), сполуки (Іе), т.пл. 205 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,86 с (1Н, СН), 8,27 д (1Н, J 8,8 Гц, СН), 7,95 д (1Н, J 8,8 Гц, СН), 6,89 с (2Н, NH2), 6.45 с (1Н, СН), 4,49 с (2Н, СН2). Знайдено, %: С 40,79; N 17,31; S 29,72. С11Н8N4О2S3. Вираховано, %: С 40,73; N 17,27; S 29,65. Приклад 2. 2 До 0,001 моль гідроброміду 4-бромометил-2-аміно-1,3-тіазолу додають 0,001 моль 5- R-1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 2,0 г (88 %), сполуки (Іе), т.пл. 205 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,86 с (1Н, СН), 8,27 д (1Н, J 8,8 Гц, СН), 7,95 д (1Н, J 8,8 Гц, СН), 6,89 с (2Н, NH 2), 6,45 с (1Н, СН), 4,49 с (2Н, СН2). Знайдено, %: С 40,79; N 17,31; S 29,72. C11H8N4O2S3. Вираховано, %: С 40,73; N 17,27; S 29,65. Синтез 2-(4-{[(5-нітро-1,3-бензтіазол-2-іл)сульфаніл]метил}-1,3-тіазол-2-іл)ацетонітрилу (Ig). Приклад 1. 2 До 0,001 моль 4-бромометил-2-карбонітрилу-1,3-тіазолу [8] додають 0,001 моль 5- R-1,3бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 3,0 г (87 %), сполуки (If), т.пл. 159 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,98 д (1Н, J 2,4 Гц СН), 8,29 д (1Н, J 2,4 Гц, J 8,8 Гц, СН), 7,99 д (1Н, J 8,8 Гц, СН), 7,66 с (1Н, СН), 4,79 с (2Н, СН2), 4,43 с (2Н, СН2). Знайдено, %: С 44,68; N 16,21; S 27,84. С13Н8N4О2S3. Вираховано, %:C 44,81; N 16,08; S 27,61. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-2-карбонітрилу-1,3-тіазолу додають 0,001 моль 52 R-1,3-бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 3,1 г (89 %), сполуки (If)., т.пл. 159 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,98 д (1Н, J 2,4 Гц СН), 8,29 д (1Н, J 2,4 Гц, J 8,8 Гц, СН), 7,99 д (1Н, J 8,8 Гц, СН), 7,66 с (1Н, СН), 4,79 с (2Н, СН2), 4,43 с (2Н, СН2). Знайдено, %: С 44,69; N 16,27; S 27,89. C13H8N4O2S3. Вираховано, %: С 44,81; N 16,08; S 27,61. Синтез 2-(4-{[(1,3-бензтіазол-2-іл)сульфаніл]метил}-1,3-тіазол-2іл)ацетонітрилу (Ih). Приклад 1. 4 UA 98870 C2 5 10 15 20 25 30 35 40 45 50 55 60 До 0,001 моль 4-бромометил-2-карбонітрилу-1,3-тіазолу додають 0,001 моль 1,3-бензтіазол2-тіолу у 15 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють 2,6 г 1 (87 %), сполуки (If), т.пл. 149-150 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,88 д (1Н, J 8,0 Гц СН), 7,85 д (1Н, J 8,8 Гц, СН), 7,59 с (1Н, СН), 7,43 м (1Н, СН), 7,32 м (1Н, СН), 4,73 с (2Н, СН 2), 4,42 с (2Н, СН2). Знайдено, %: С 59,51; N 13,89; S 31,79. C 13H9N3S3. Вираховано, %: С 59,46; N 13,85; S 31,70. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-2-карбонітрилу-1,3-тіазолу додають 0,001 моль 1,3-бензтіазол-2-тіолу у 15 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють 2,7 г (89 %), сполуки (If), т.пл. 217 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,88 д (1Н, J 8,0 Гц СН), 7,85 д (1Н, J 8,8 Гц, СН), 7,59 с (1Н, СН), 7,43 м (1Н, СН), 7,32 м (1H, СН), 4,73 с (2Н, СН2), 4,42 с (2Н, СН2). Знайдено, %: С 59,56; N 13,93; S 31,84. C13H9N3S3. Вираховано, %: С 59,46; N 13,85; S 31,70. Синтез 2-(4-(((1,3-бензтіазол-2-іл)сульфаніл)метил)-1,3-тіазол-2-іл)-3-(4(диметиламіно)феніл)акрилонітрил (Іі). Приклад 1. До 0,001 моль 4-бромометил-(2-(1-ціано-2-(4-(диметиламіно)феніл)вініл)-1,3-тіазолу додають 0,001 моль 1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють сполуку Іе з виходом 3,2 г (75 %), т.пл. 123 °C. Спектр ЯМР 1 Н (ДМСО-d6), δ, м.ч.: 7,9-7,85 м (5Н, СН), 7,56 с (1Н, СН) 7,43 уш. с (1Н, СН), 7,33 уш. с (1Н, СН), 6,77 д (2Н, J 7,6 Гц, J 2,4 СН), 4,73 с (2Н, СН2), 2,53 с (3Н, CH3-N); 2.49 с (3Н, CH3-N). Знайдено, %: С 60,83; N 12,99; S 22,23. C22H17N5O2S3. Вираховано, %: С 60,80; N 12,89; S 22,13. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-(2-(1-ціано-2-(4-(диметиламіно)феніл)вініл)-1,3тіазолу додають 0,001 моль 1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють сполуку Іе з виходом 3,3 г (76 %), т.пл. 123 °C. 1 Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 7,9-7,85 м (5Н, СН), 7,56 с (1Н, СН) 7,43 уш. с (1Н, СН), 7,33 уш. с (1Н, СН), 6,77 д (2Н, J 7,6 Гц, J 2,4 СН), 4,73 с (2Н, СН2), 2,53 с (3Н, CH3-N); 2,49 с (3Н, CH3-N). Знайдено, %: С 60,85; N 12,99; S 22,33. C22H17N5O2S3. Вираховано, %: С 60,80; N 12,89; S 22,13. Синтез 3-(4-гідрокси-3-метоксифеніл)-2-(4-(((5-нітро-1,3-бензтіазол-2-іл)сульфаніл)метил)1,3-тіазол-2-іл)акрилонітрил (Ij). Приклад 1. До 0,001 моль 4-бромометил-(2-(1-ціано-2-(4-гідрокси-3-метоксифеніл)вініл)-1,3-тіазолу 2 додають 0.001 моль 5- R-1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють сполуку Ij з виходом 4,1 г (84 %), т.пл. 157 °C. 1 Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 9,00 с (1Н, ОН), 8,29 д (1Н, J 8,0 Гц, СН), 8,03 с (1Н, СН), 8,01 д (1Н, J 8,0 Гц СН), 7,72 с (1Н, СН), 7,67 с (1Н, СН), 7,46 д (2Н, J 8,0 Гц, СН), 6,89 д (1Н, J 8,0 Гц СН), 4,82 с (2Н, СН2), 3,86 с (3Н, О-СН3). Знайдено, %: С 52,31; N 11,69; S 20,03 C21H14N4O4S2. Вираховано, %: С 52,27; N 11,61; S 19,93. 5 UA 98870 C2 5 10 15 20 25 30 35 40 45 50 55 Приклад 2. До 0,001 моль гідроброміду 4-бромометил-(2-(1-ціано-2-(4-гідрокси-3-метоксифеніл)вініл)2 1,3-тіазолу додають 0,001 моль 5- R-1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють сполуку Ij з виходом 4,0 г (83 %), т.пл. 157 °C. 1 Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 9,00 уш. с (1Н, ОН), 8,29 д (1Н, J 2,0, Гц J 8.8 Гц СН), 8,03 с (1Н, СН), 8,02 д (1Н, J 8,8 Гц СН), 7,72 с (1Н, СН), 7,67 с (1Н, СН), 7,46 д (2Н, J 8,0 Гц), 6,88 д (1H, J 8,4 Гц СН), 4,82 с (2Н, СН2), 3,86 с (3Н, О-СН3). Знайдено, %: С 52,31; N 11,69; S 20,03 C21H14N4O4S2. Вираховано, %: С 52,27; N 11,61; S 19,93. 2-(4-((1,3-бензтіазол-2-сульфаніл)метил)-1,3-тіазол-2-іл)-3-фенілакрилонітрил (Ik). Приклад 1. До 0,001 моль 2-(4-(бромометил)-1,3-тіазол-2-іл)-3-фенілакрилонітрил додають 0,001 моль 1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,001 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті 1 виділяють сполуку Ik з виходом 2,9 г (75 %), т.пл. 124-125 °C. Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,18 с (1Н, СН) 7,96 м (2Н, СН), 7,89 д (1Н, J 7,2, СН), 7,87 д (1Н, J 7,6, СН), 7,74 с (1Н, СН), 7,53 уш. с (3Н, СН), 7,44 дд (1Н, J 7,2 Гц, J 7,6, СН), 7,33 дд (1Н, J 7,2 Гц, J 7,6 СН), 4,78 с (2Н, СН2). Знайдено, %: Вираховано, %: С 61,39; N 10,78; S 24,61. C20H13N3S3. Вираховано, %: С 61,35; N 10,73; S 24,57. Приклад 2. До 0,001 моль гідроброміду 4-бромометил-(2-(1-ціано-2-(4-(диметиламіно)феніл)вініл)-1,3тіазолу додають 0,001 моль 1,3-бензтіазол-2-тіолу у 25 мл ацетонітрилу, додають 0,002 моль основи, перемішують до повного розчинення і залишають до повного виділення продукту реакції. Після охолодження осад фільтрують, промивають 1 мл ацетонітрилу і 20-30 мл води. Осад екстрагують (3×25 мл) бензену або (3×40 мл) хлороформу. Органічну фазу відокремлюють, залишать над осушником (СаСl2) - і пропускають через тонкий шар силікагелю, розчинник упарюють. В результаті виділяють сполуку Ik з виходом 3,0 г (76 %), т.пл. 124-125 °C. 1 Спектр ЯМР Н (ДМСО-d6), δ, м.ч.: 8,18 с (Ш, СН) 7,96 м (2Н, СН), 7,89 д (1Н, J 7,2, СН), 7,87 д (1Н, J 7,6, СН), 7,74 с (1Н, СН), 7,53 уш. с (3Н, СН), 7,44 дд (1Н, J 12 Гц, J 7,6 СН), 4,78 с (2Н, СН2). Знайдено, %: Вираховано, %: С 61,39; N 10,78; S 24,61. C20H13N3S3. Вираховано, %: С 61,35; N 10,73; S 24,57. Комп'ютерне моделювання за програмою PASS показало потенційну можливість використання сполук, що заявляються, в широкому спектрі направленостей фізіологічної активності, зокрема в лікуванні ішемічної церебральної хвороби. Слід зауважити, що сполука IV [7], (що вибрана для порівняння) за програмою PASS не має потенційної можливості в лікуванні ішемічної церебральної хвороби. У таблиці 1 представлена потенційна біоактивність заявлених похідних тіазолу з показниками активності. 1 Таким чином, одержано сполуки ряду похідних 2-(((5- R-2-R-1,3-тіазол-42 іл)метил)сульфаніл)-1,3-бензтіазолу- R формули (І), які, згідно розрахунку за програмою PASS, можуть мати широкий спектр направленостей фізіологічної активності, зокрема в лікуванні ішемічної церебральної хвороби. Джерела інформації: 1. М.Д. Машковский, //Лекарственные средства, ч 1, 2., Москва, медицина, 1998 г. 2. 1b. Lyden P.; Jacoby M; Schim J.; Albers G.; Mazzeo P.; Ashwood Т.; Nordlund A.; Odergren Т.; The Clomethiazole Acute Stroke Study in tissue-type plasminogen activator-treated stroke (CLASS-T) final results. Neurology 2001, vol. 57, № 7, pp. 1199-1205. 3. Martin Bernard Keat, GB831873, 1960-04-06. 4. A. Shulman, // A Possible Mode of Action of 2: // 4-Diamino-5-phenyl-thiazole Hydrochloride (Daptazole or Amiphenazole); // Nature 177, 703 (14 April 1956); doi: 10.1038/177703a0. 5. Bod, P., Harsanyi, II Austrian AT 389,510. Chem. Abstr. 113:59163 k.-1984. 3. 649. 6. Mamsuo, M.; Manabe, R. I UP 01.79.178 Chem. Abstr. 111:153790 t. 1994. 29, 339. 7. EP 1 417 173 B1. 60 6 UA 98870 C2 Таблиця Сполука 2-(((5-бромо-2-метил-1,3-тіазол-4іл)метил)сульфаніл)-1,3-бензотіазолу (Іа). 2-(((2-метил-1,3-тіазол-4іл)метил)сульфаніл)-5-нітро-1,3бензотіазолу (Іb). 2-([(2-метил-1,3-тіазол-4іл)метил]сульфаніл)-1,3-бензотіазолу (Іс). 5-нітро-2-(((2-феніл-1,3-тіазол-4іл)метил)сульфаніл)-1,3-бензотіазолу (Id). 4-(((1,3-бензотіазол-2-іл) сульфаніл)метил)-1,3-тіазол-2іламіну (Іе). 4-(((5-нітро-1,3-бензотіазол-2іл)сульфаніл)метил)-1,3-тіазол-2іламіну (If). 2-(4-{[(5-нітро-1,3-бензо-тіазол-2іл)сульфаніл]метил}-1,3-тіазол2іл)ацетон-нітрилу (Ig). 2-(4-{[(1,3-бензотіазол-2іл)сульфаніл]метил}-1,3-тіазол2іл)ацетонітрилу (Ih) 2-(4-(((1,3-бензотіазол-2іл)сульфаніл)метил)-1,3-тіазол-2-іл)3-(4(диметиламіно)феніл)акрилонітрил (Іі). 3-(4-гідрокси-3-метоксифеніл)-2-(4(((5-нітро-1,3-бензотіазол-2іл)сульфаніл)метил)-1,3-тіазол-2іл)акрилонітрил (Ij). 2-(4-((1,3-бензотіазол-2сульфаніл)метил)-1,3-тіазол-2-іл)-3фенілакрилонітрил (Ik). (сполука IV [7] для порівняння) Метил 4-(2-аміно-3,5-диціано-6-{[(2метил-1,3-тіазол-4іл)метил]сульфаніл}4піридил)фенілкарбамат V [7]. Ра* показник активності Рі* показник не активності Потенційна активність Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Лікування хвороби ішемічної церебральної Ра* Рі* 0,678 0,026 0,670 0,027 0,701 0,023 0,800 0,012 0,823 0,010 0,796 0,013 0,705 0,023 0,729 0,019 0,724 0,020 0,714 0,021 0,732 0,019 ФОРМУЛА ВИНАХОДУ Спосіб одержання сполуки формули І S R N 1R S S N 5 2R I, 1 2 де R - Н або галоген, R - Н або NO2, R - феніл, аміногрупа, ціанометильна група або група 7 UA 98870 C2 ( 3R)n 3 4 4 4 , де R - Н, О R, N( R)2, де R – Н або С1-С6алкіл, n=0-2, за яким сполуку формулу VI алкілують сполукою формули V або VII в органічному розчиннику. S R N V 1R 1 R S HS Br Br N 2R VI VII Комп’ютерна верстка Г. Паяльніков Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 8
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of 2-(((5-1r-2-r-1,3-thiazole -4-yl)methyl)sulphonyl)-1,3- benzothiazole-2r derivatives
Автори англійськоюKovalenko Natalia Volodymyrivna, Volovenko Yulian Mykchaylovich, Tsapko Mahdalina Dmytrivna
Назва патенту російськоюСпособ получения производных 2-(((5-1r-2-r-1,3-тиазол-4-ил)метил)сульфанил)-1,3-бензтиазола-2r
Автори російськоюКоваленко Наталия Владимировна, Воловенко Юлиан Михайлович, Цапко Магдалина Дмитриевна
МПК / Мітки
МПК: C07D 277/40, A61K 31/428, C07D 277/74, C07D 277/22, C07D 277/32
Мітки: одержання, похідних, спосіб, 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу-2r
Код посилання
<a href="https://ua.patents.su/10-98870-sposib-oderzhannya-pokhidnikh-2-5-1r-2-r-13-tiazol-4-ilmetilsulfanil-13-benztiazolu-2r.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних 2-(((5-1r-2-r-1,3-тіазол-4-іл)метил)сульфаніл)-1,3-бензтіазолу-2r</a>
Попередній патент: Ариламіди 1-гідроксі-3-оксо-6,7-дигідро-3н,5н-піридо[3,2,1-ij]хінолін-2-карбонової кислоти, які виявляють діуретичну активність
Наступний патент: Композиція інгредієнтів профілактичного бальзаму “щедрість карпат”
Випадковий патент: Спосіб підвищення водостійкості аміачно-селітрових промислових вибухових речовин












