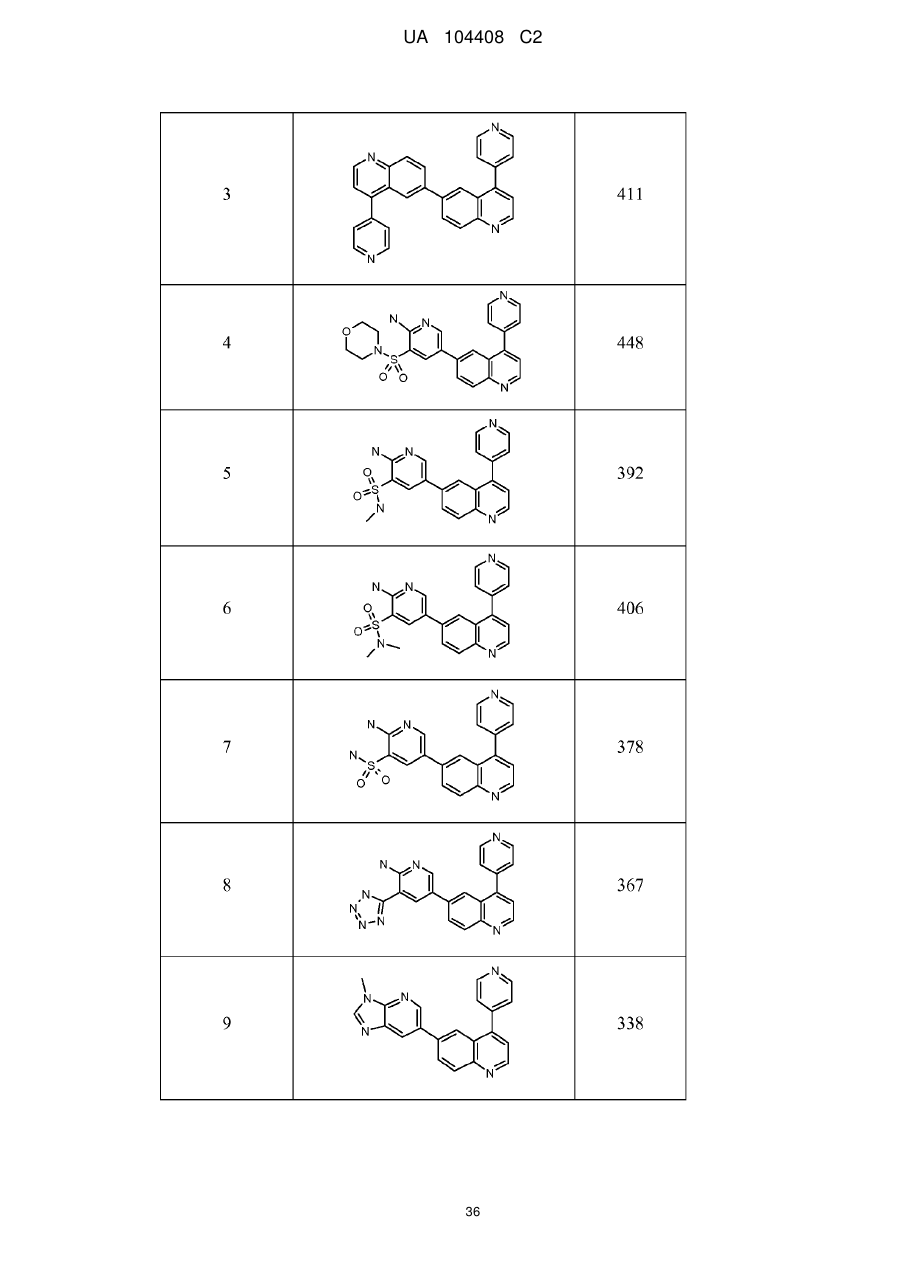
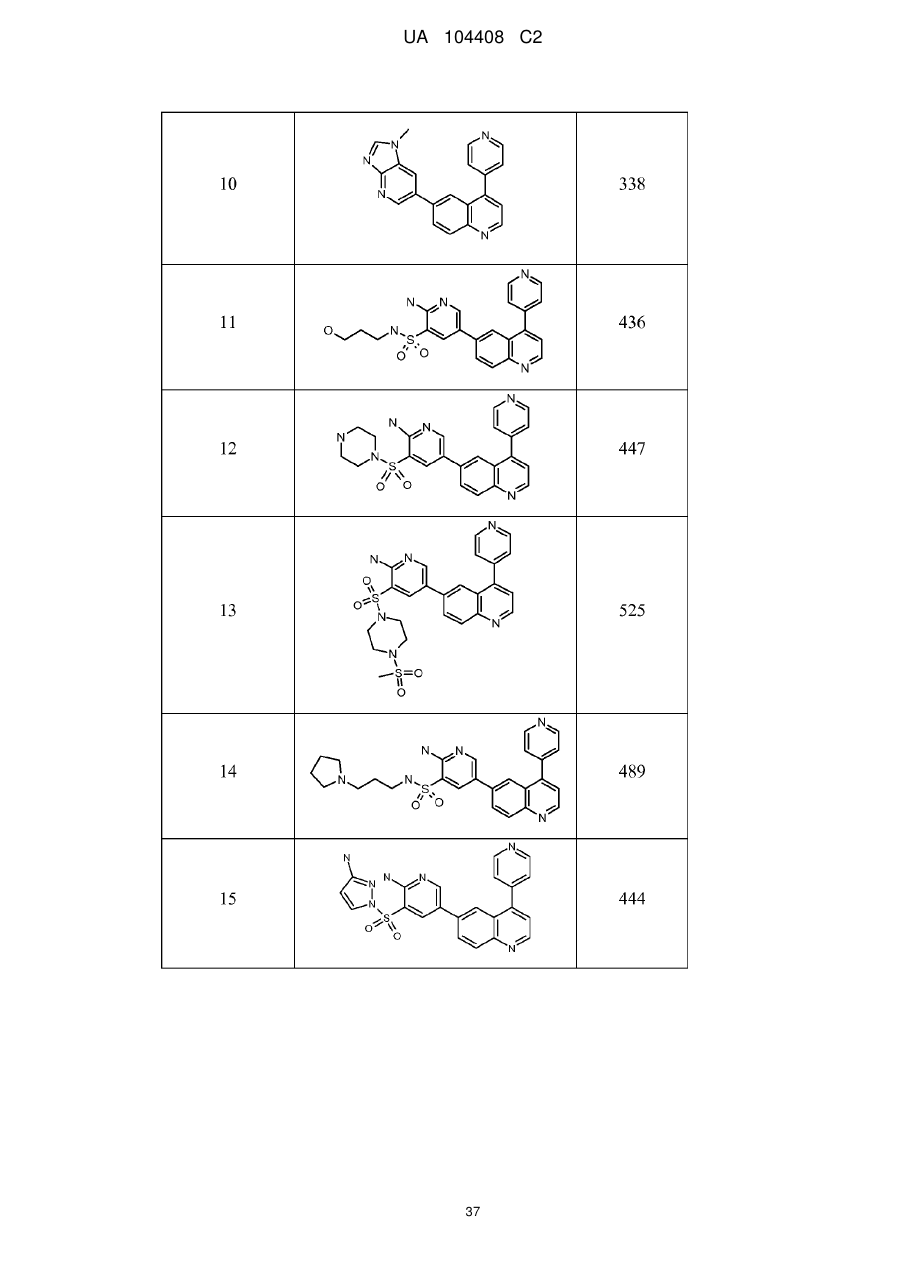
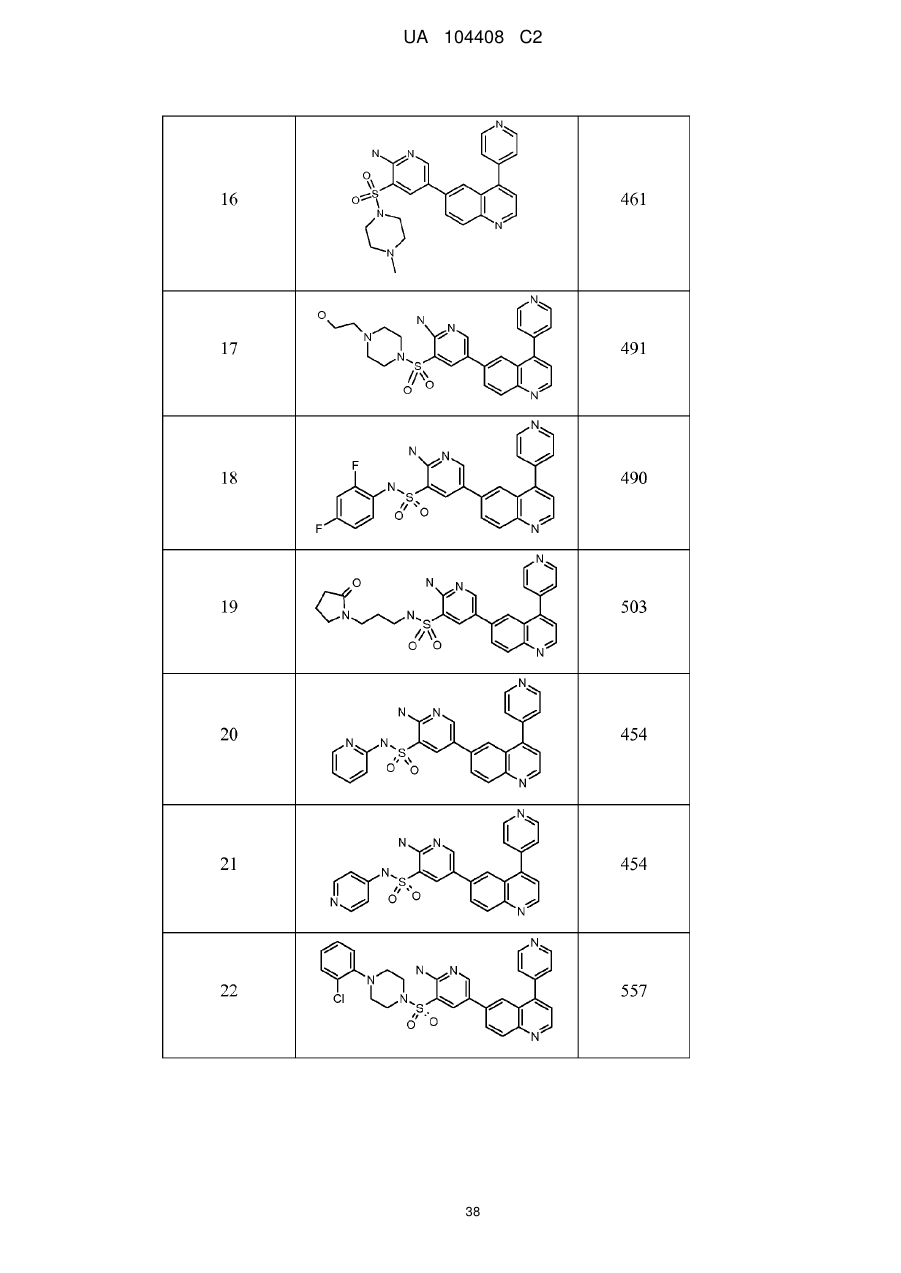
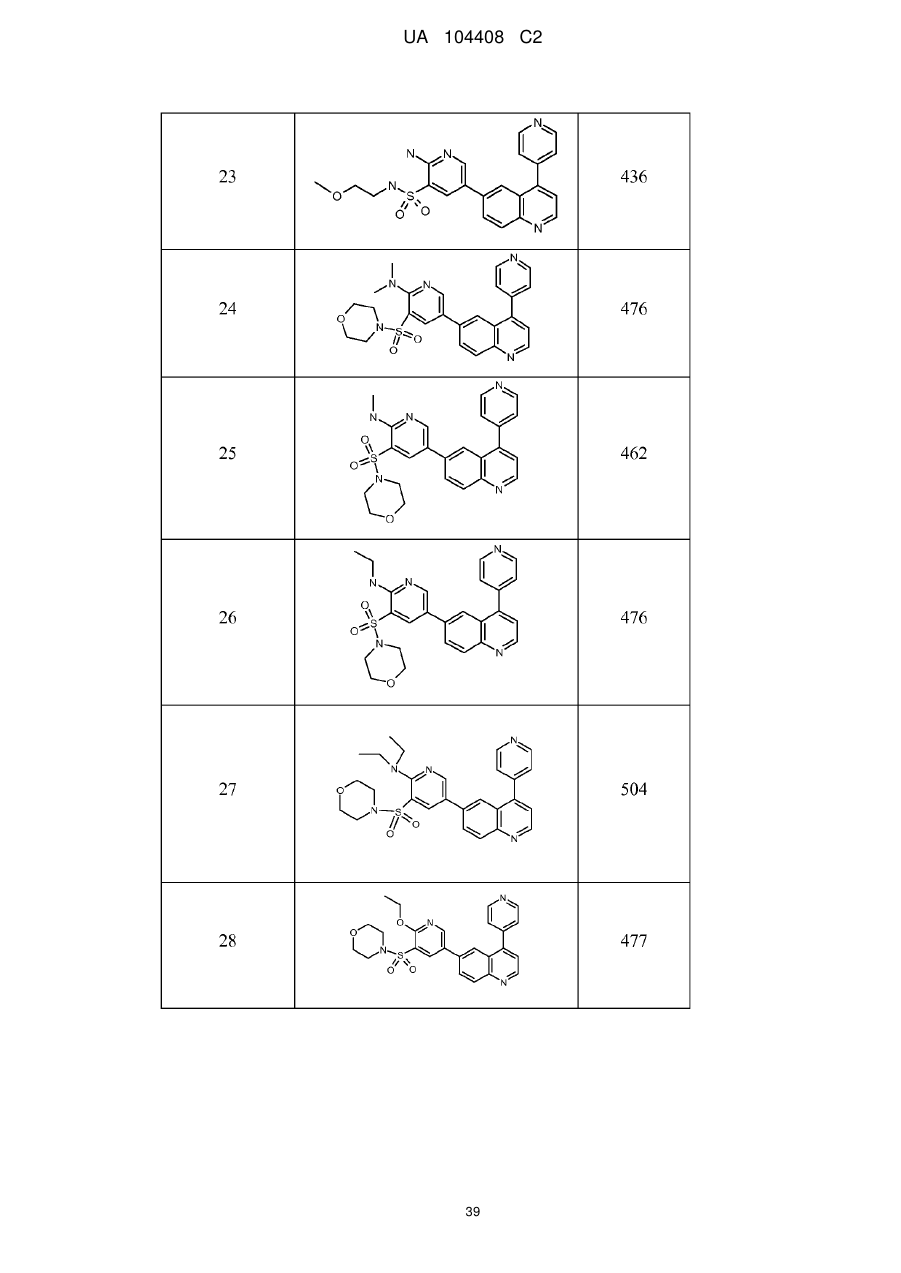
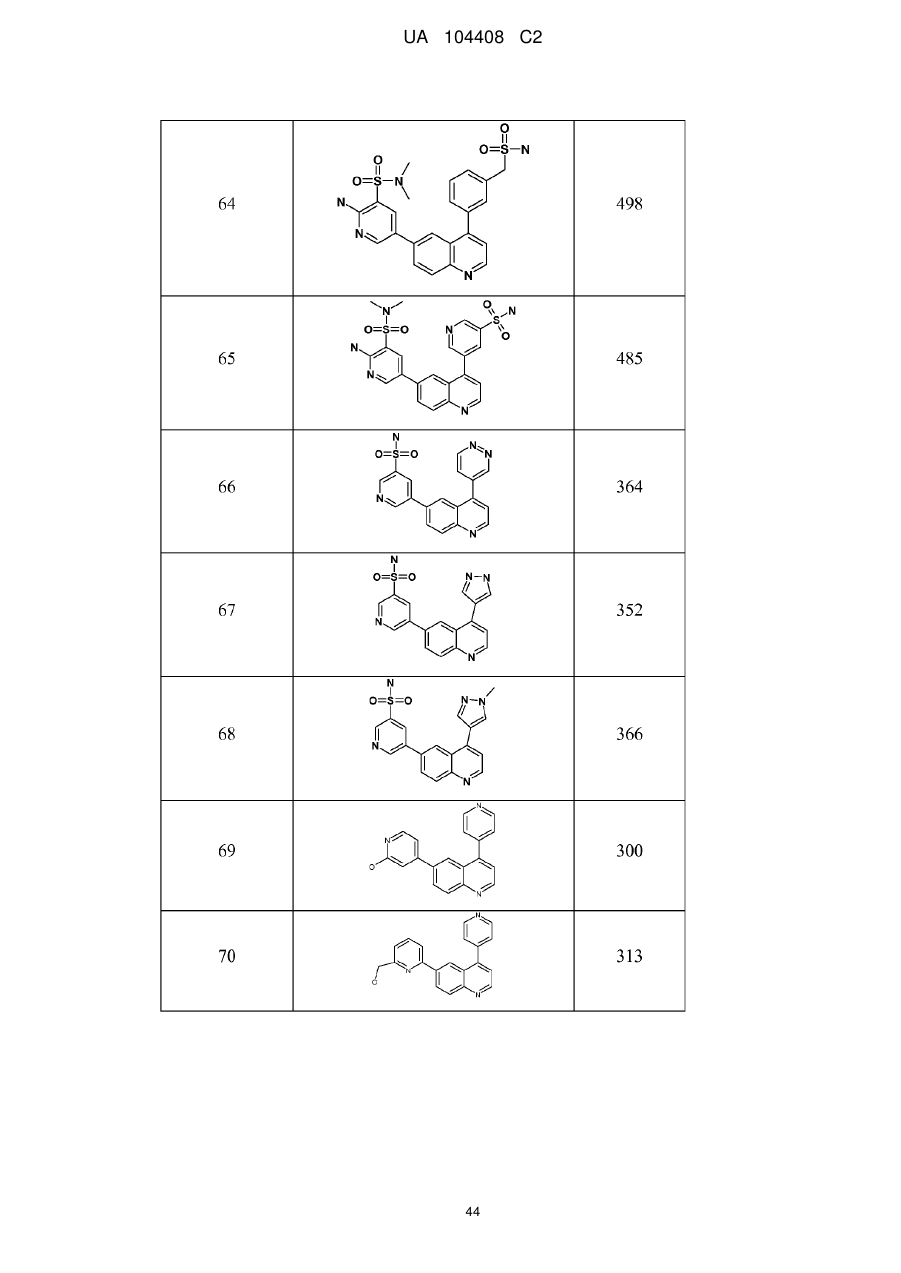
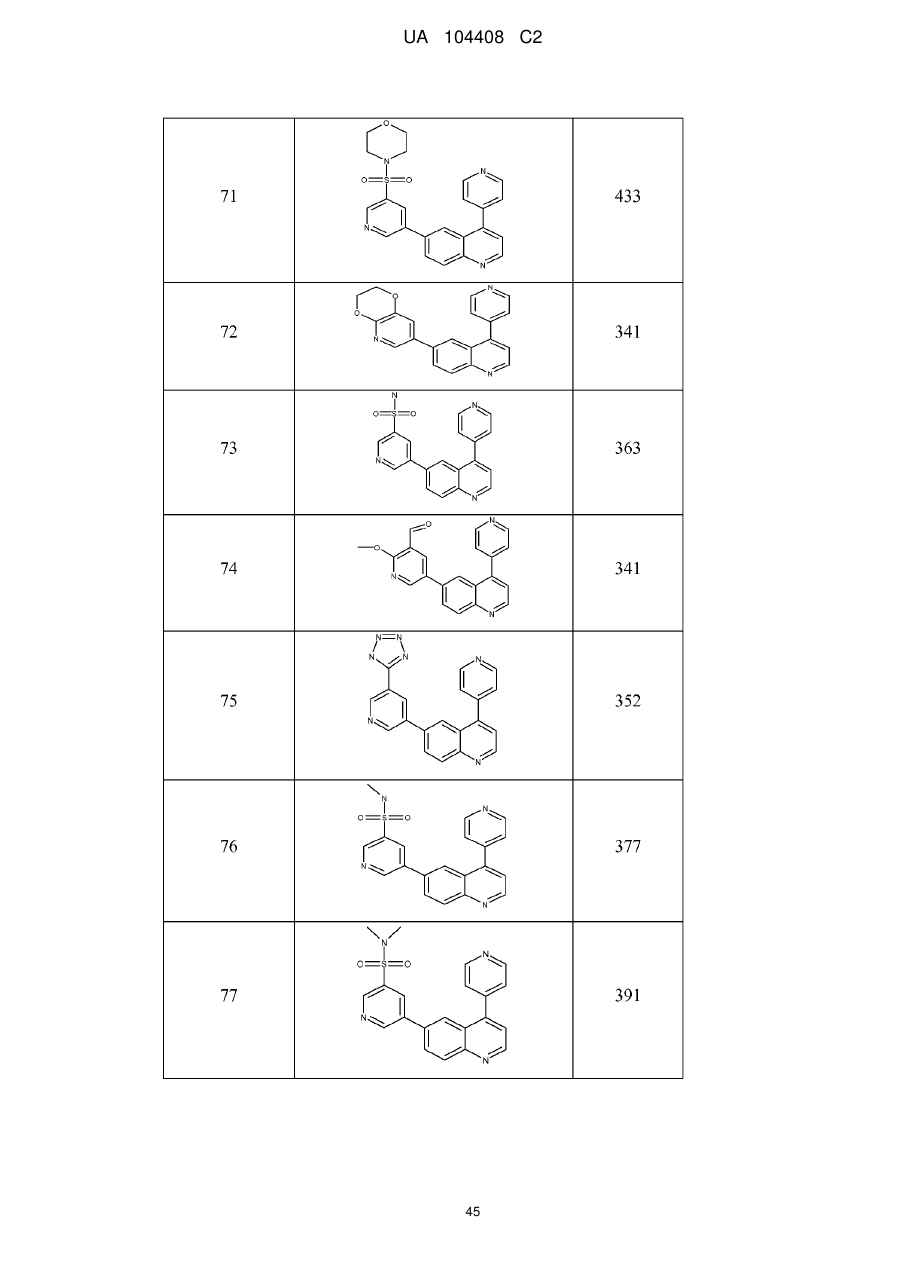
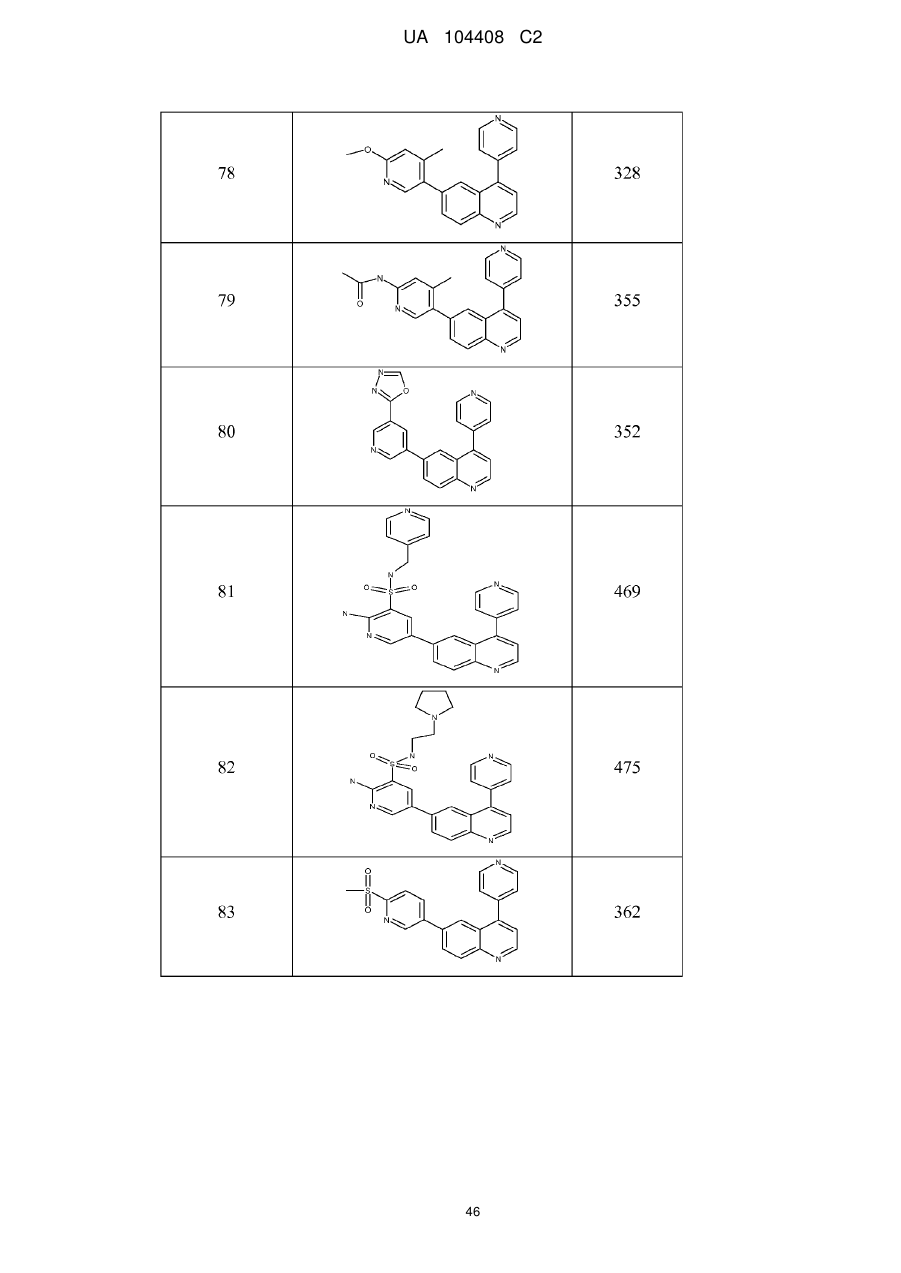
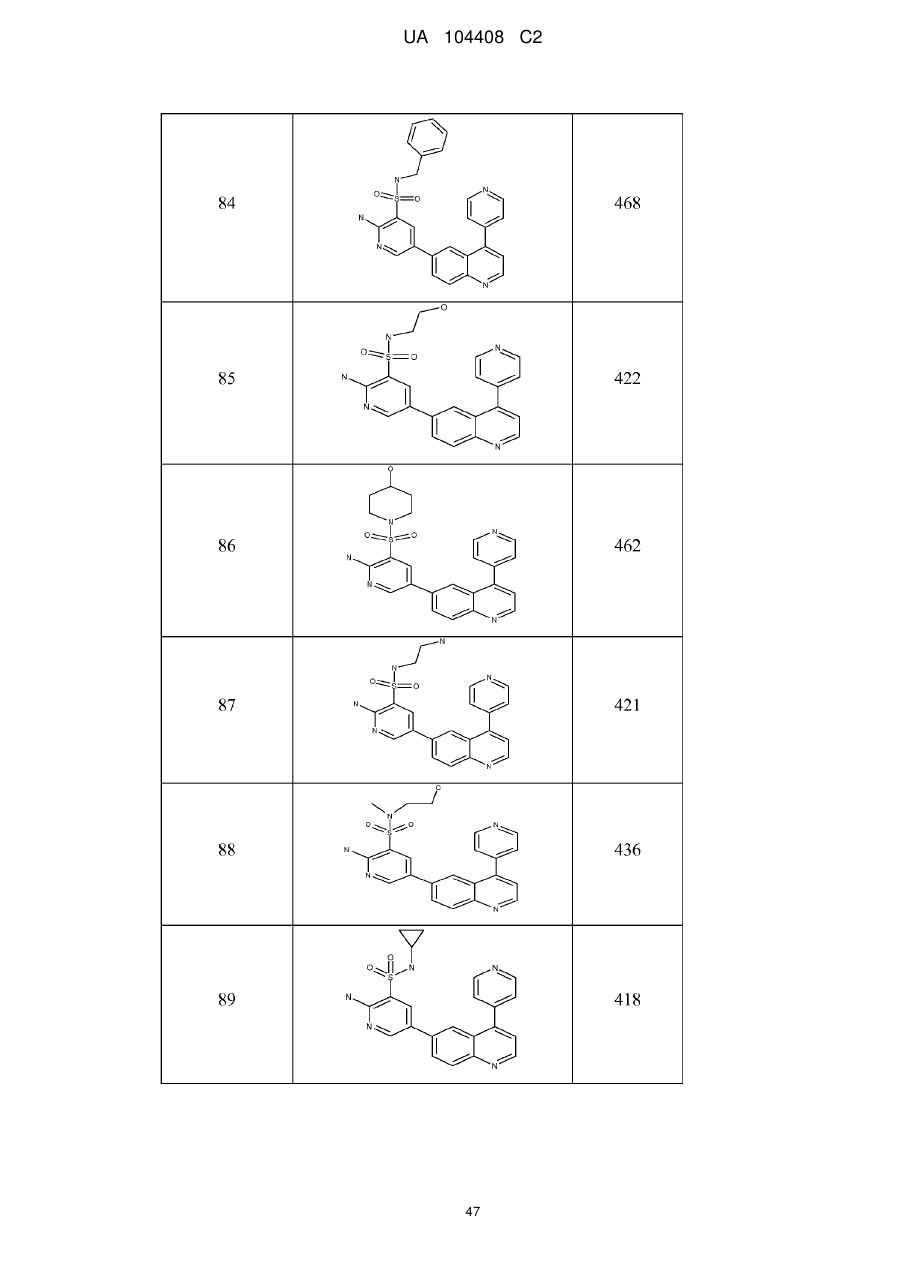
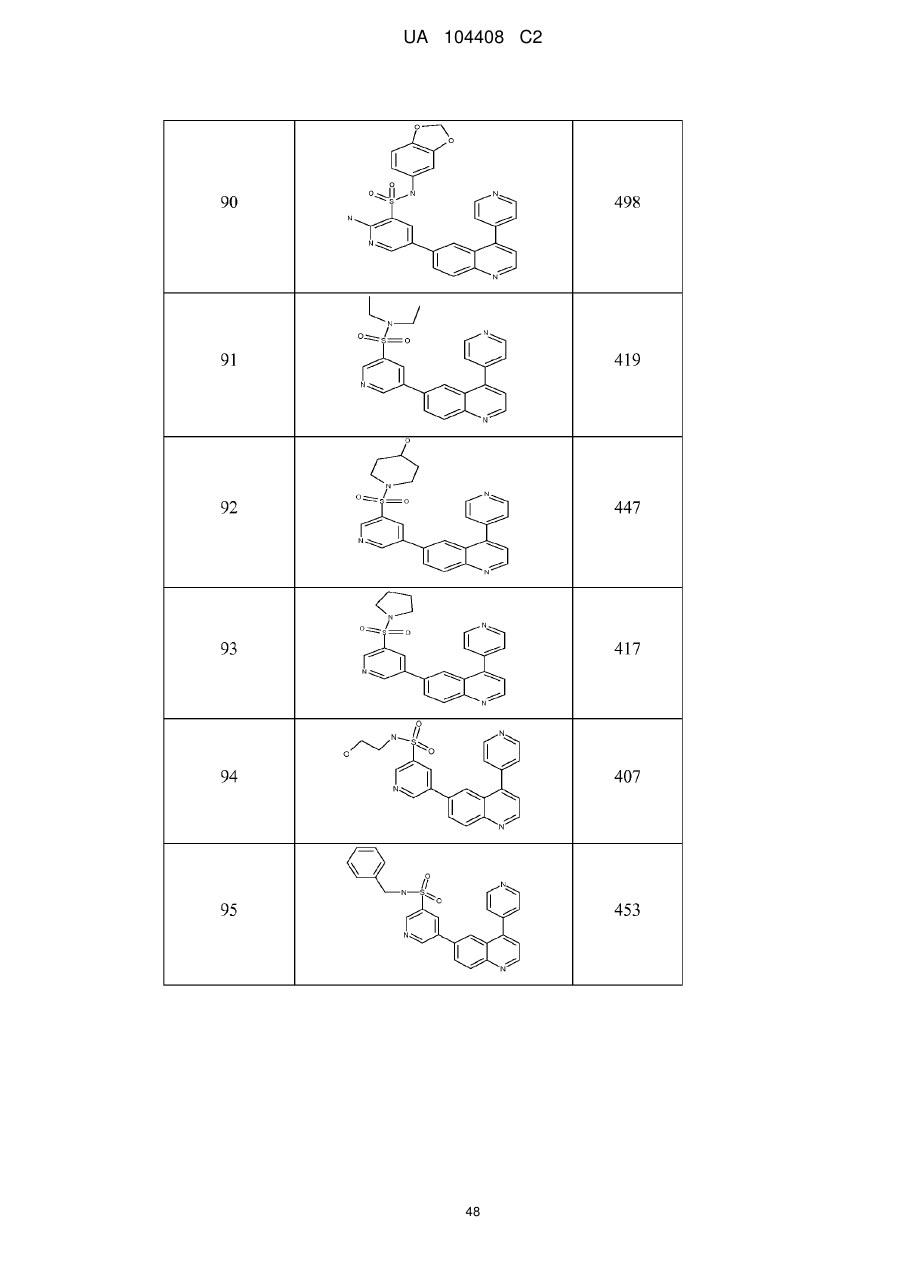
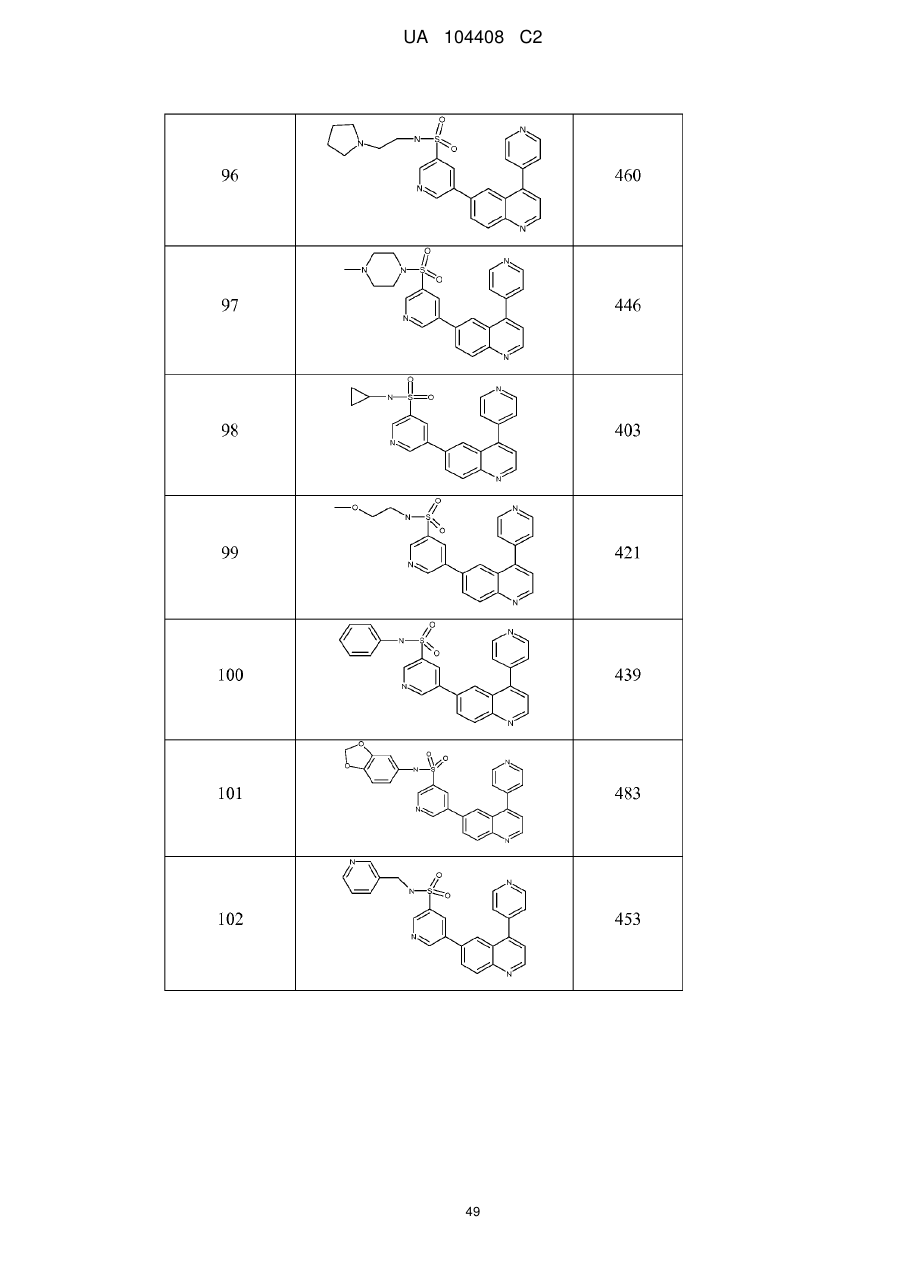
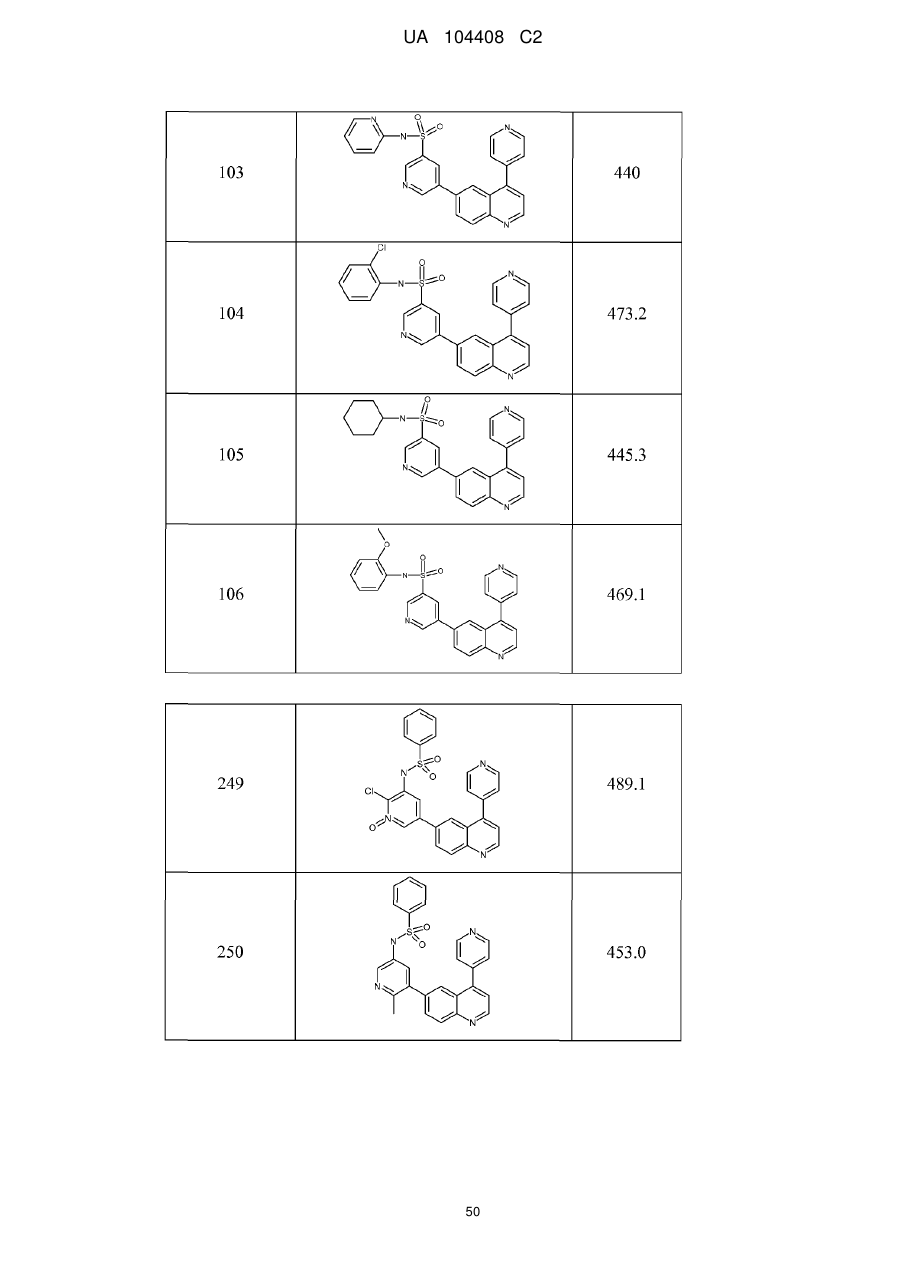
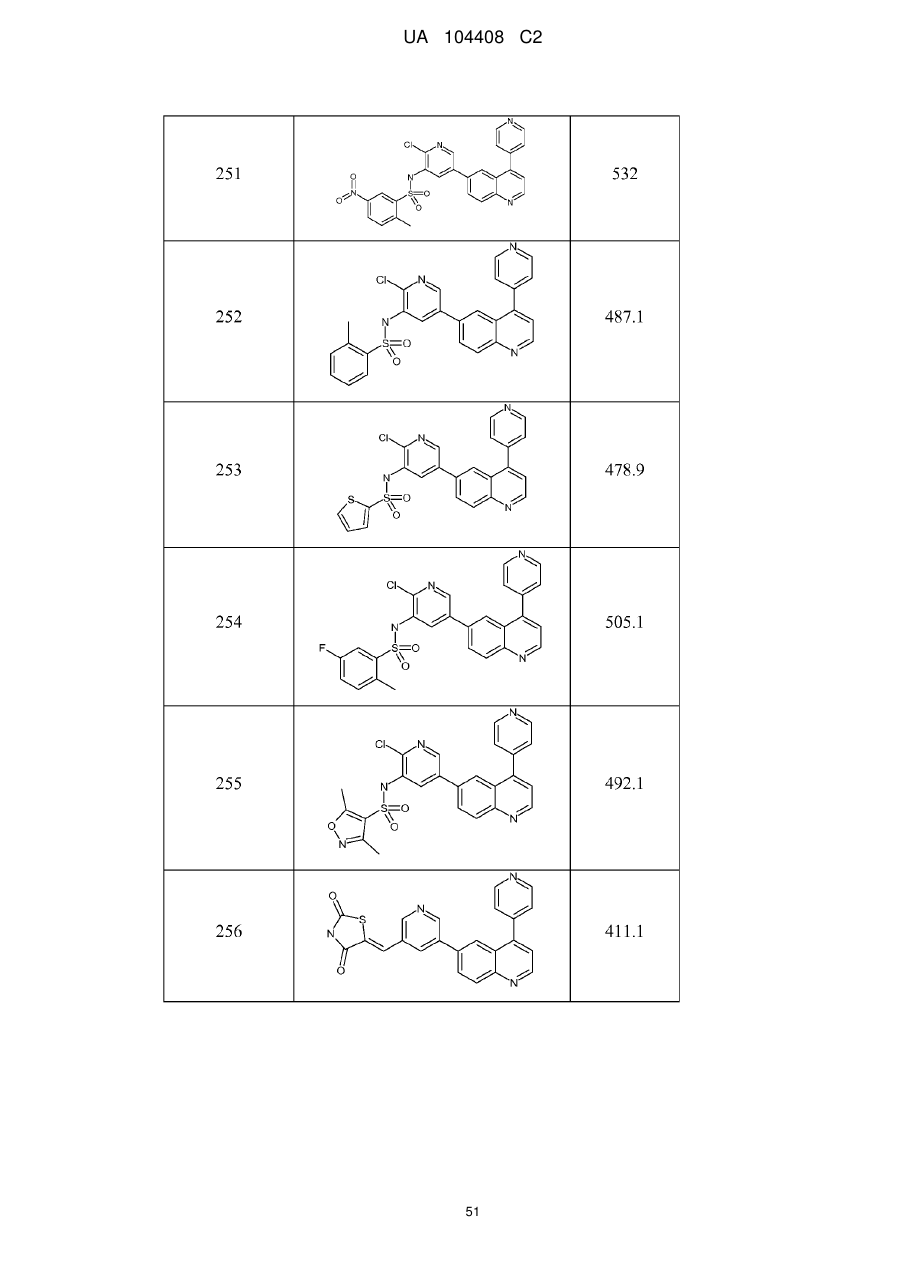
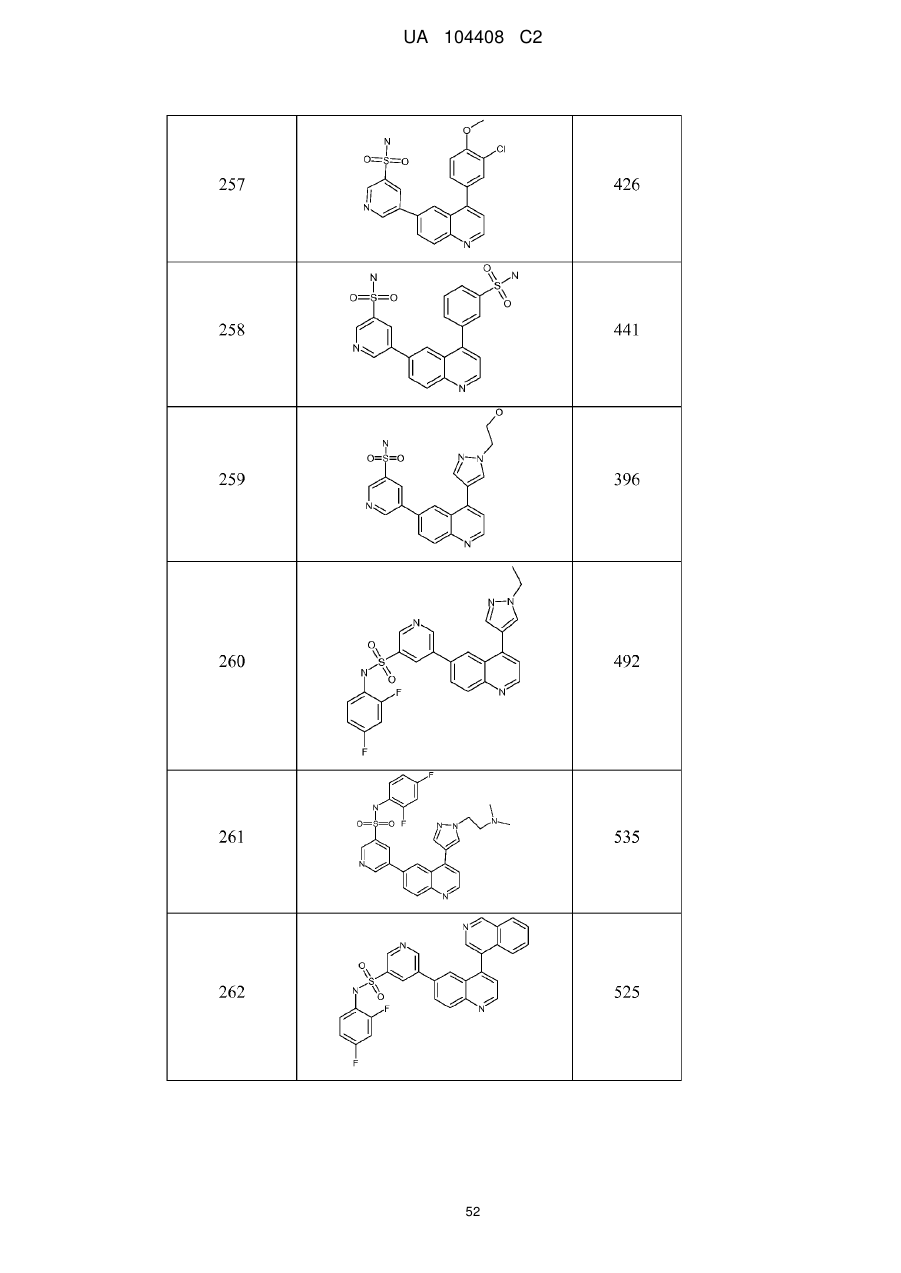
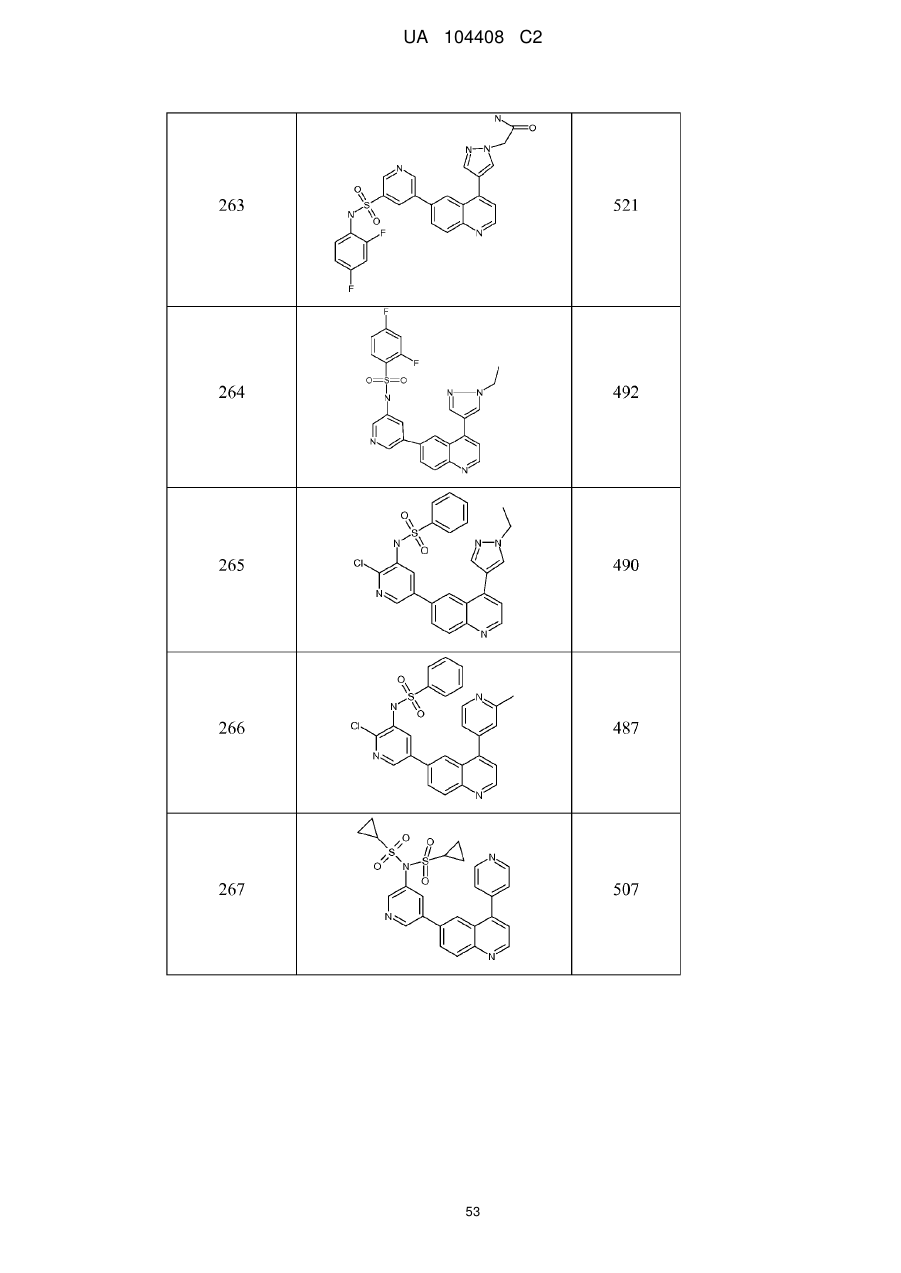
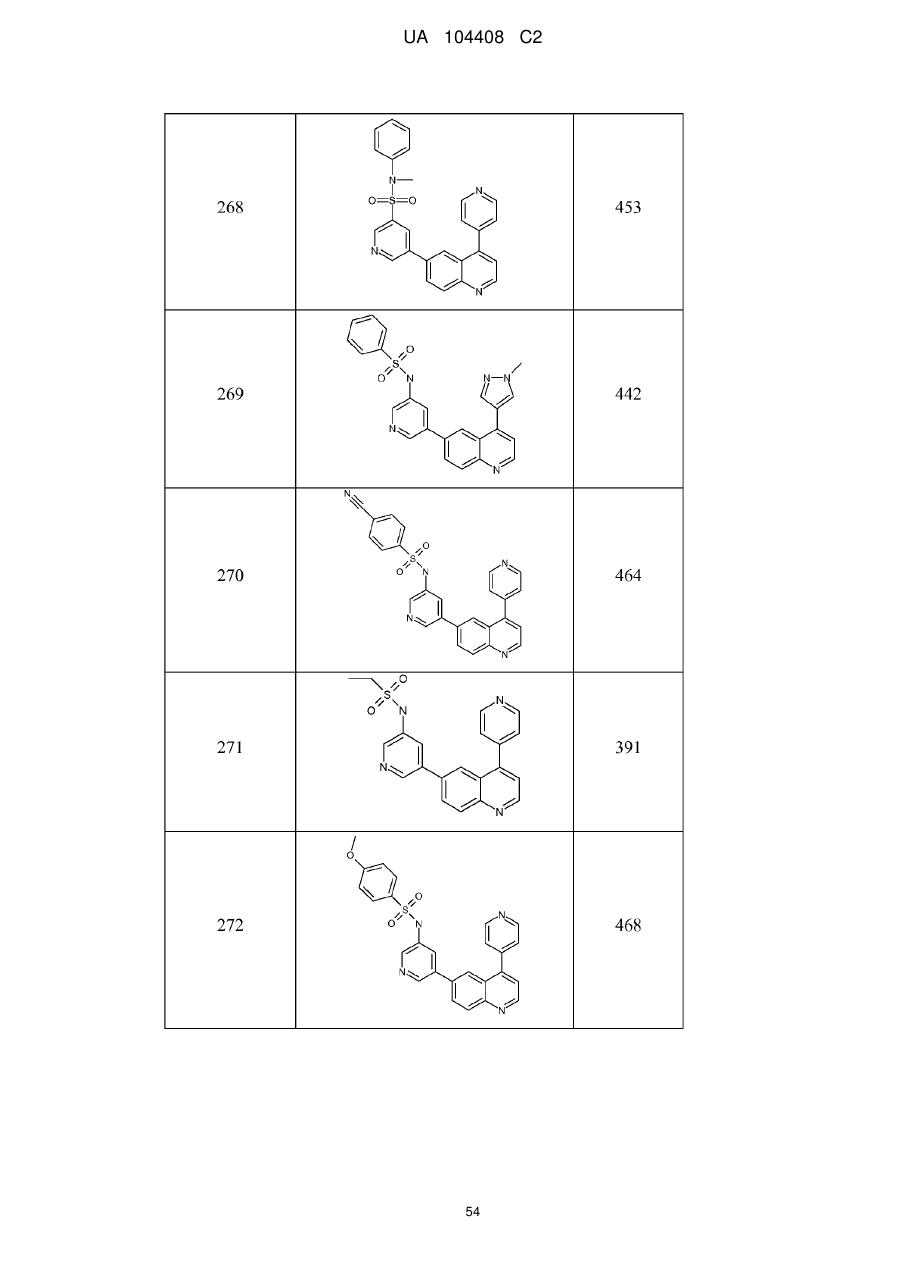
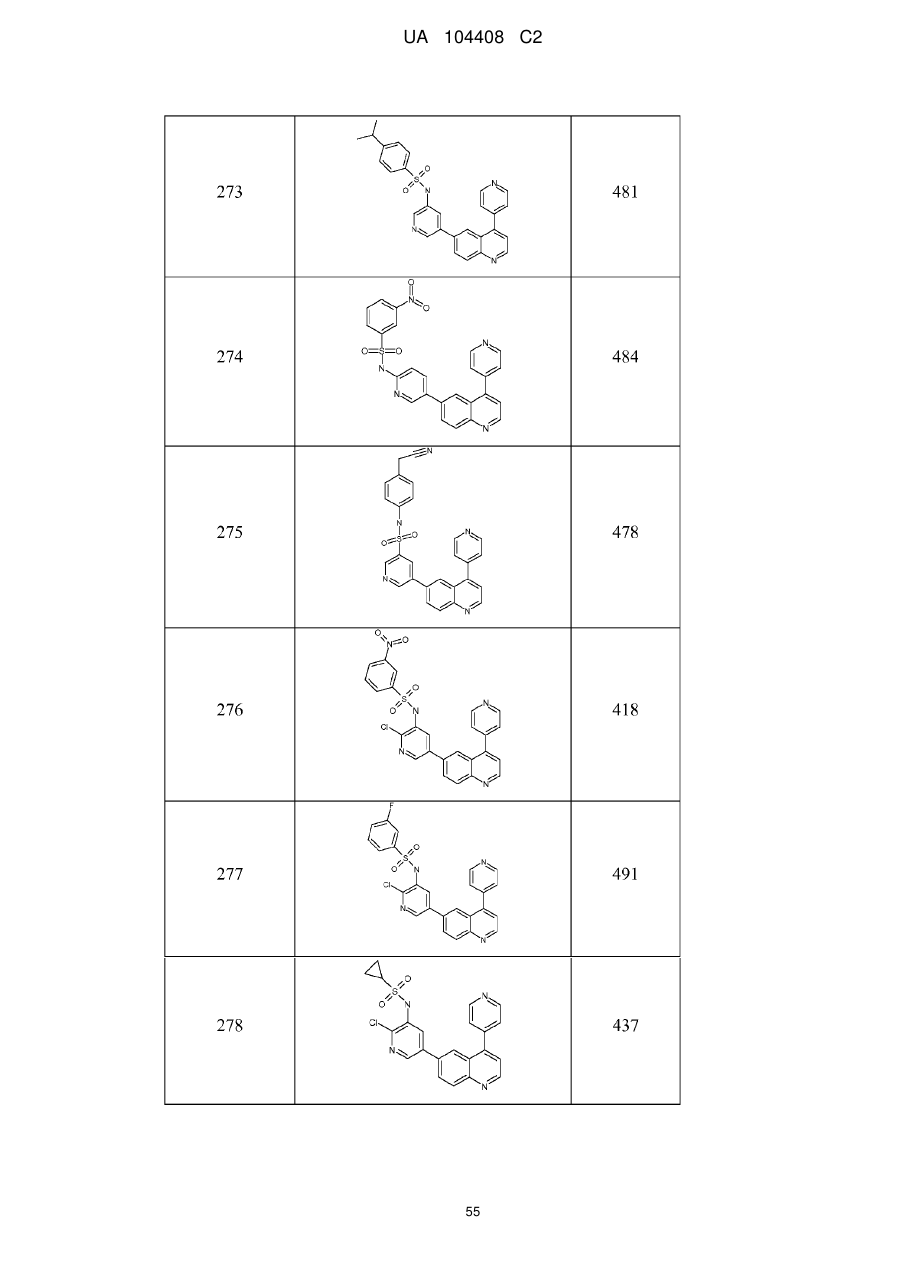
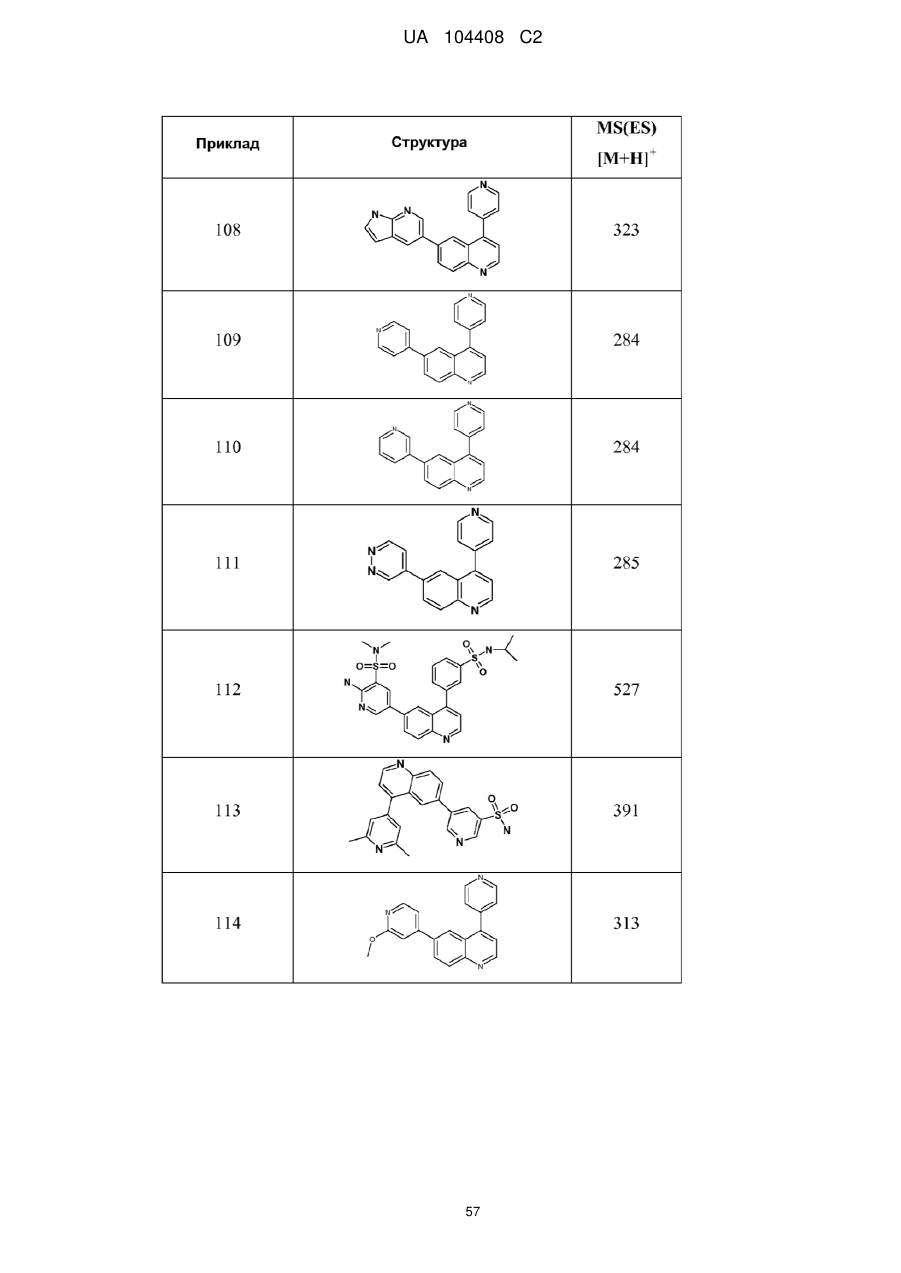
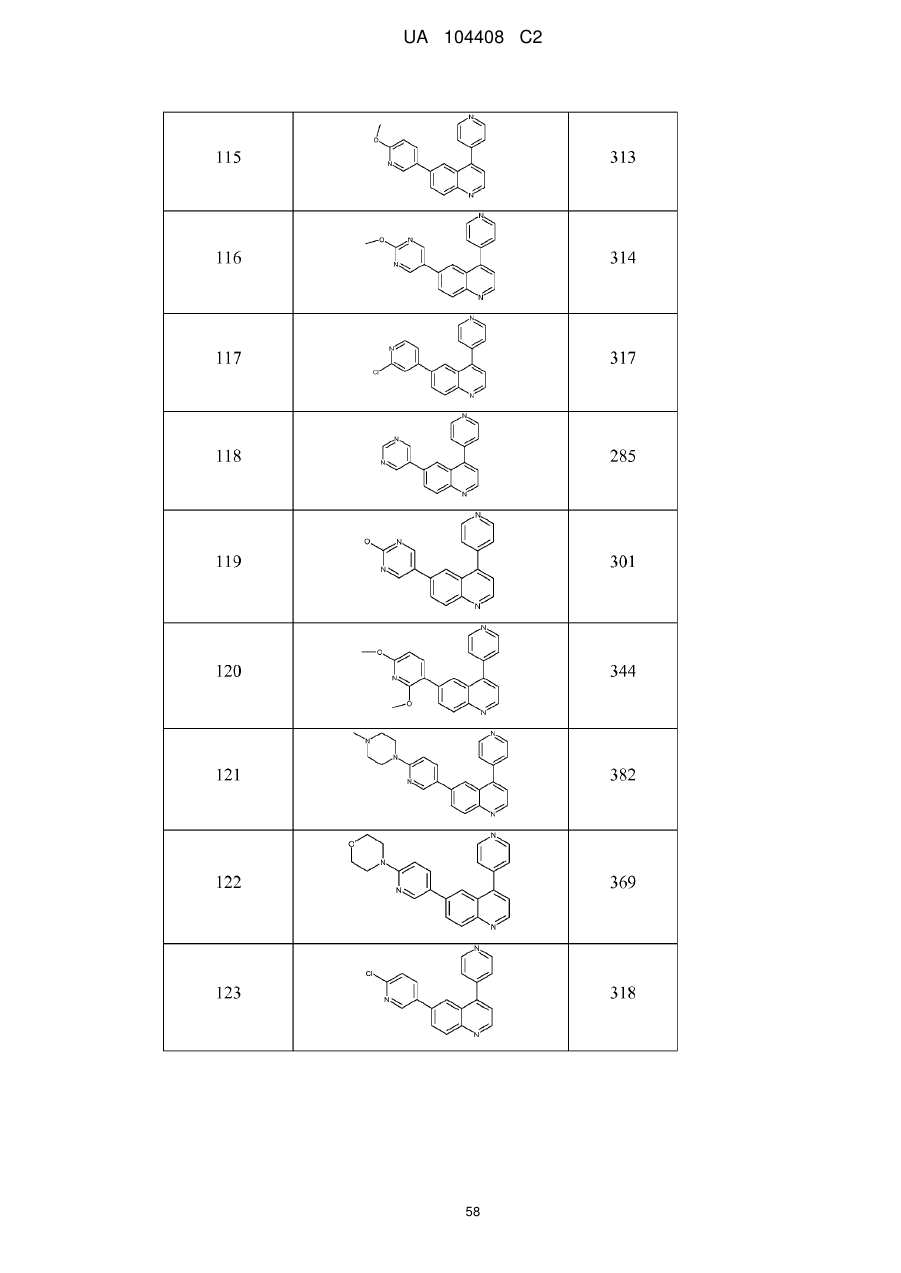
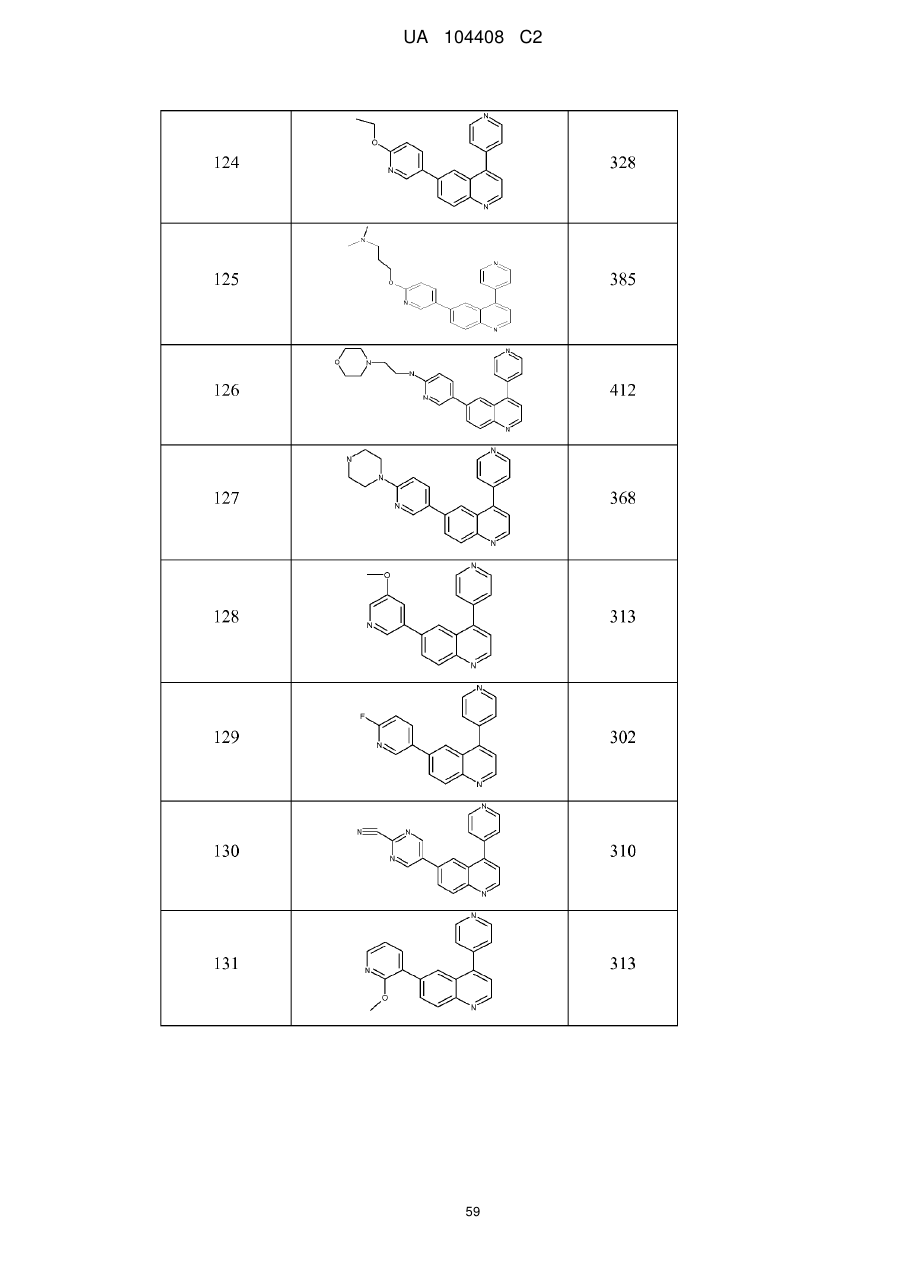
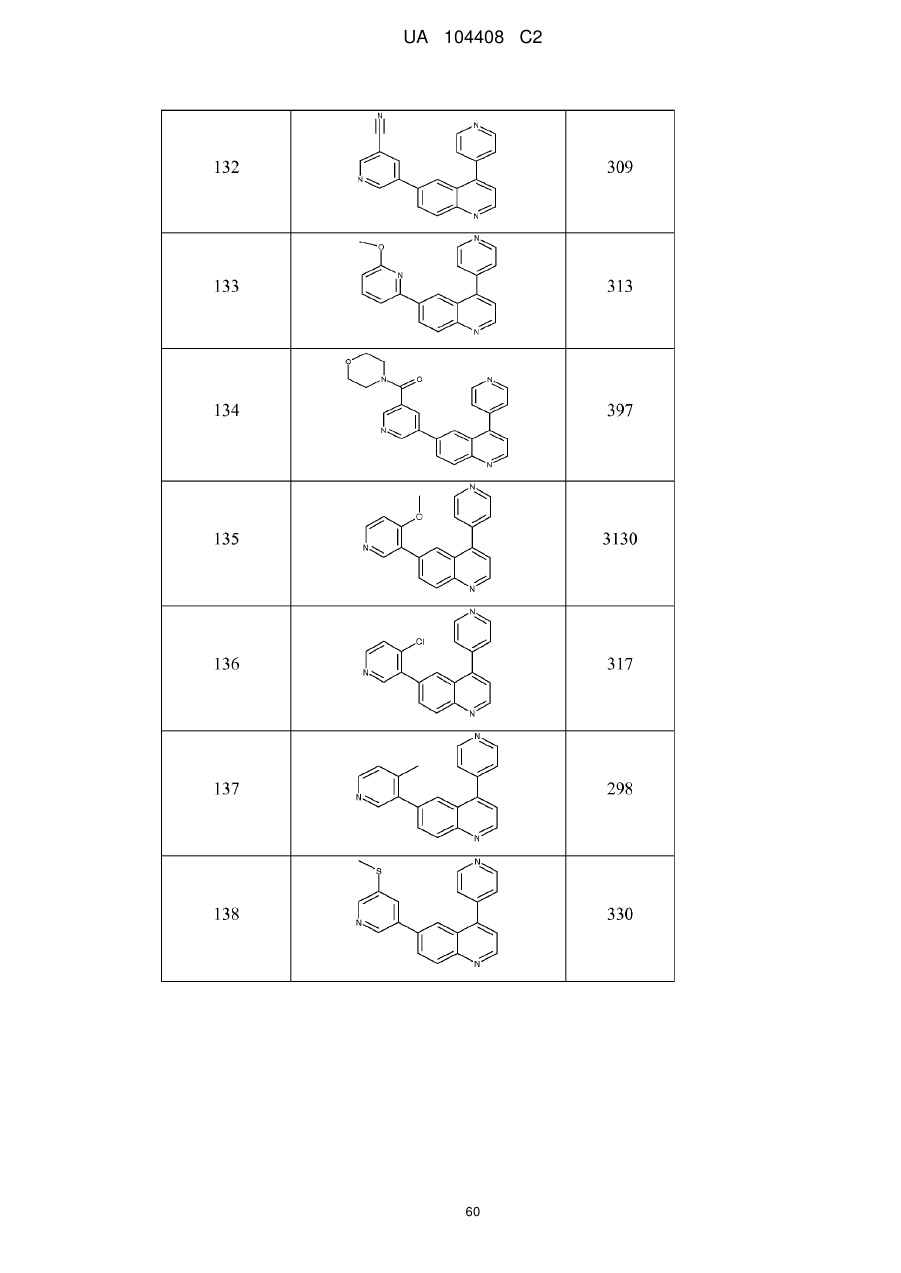
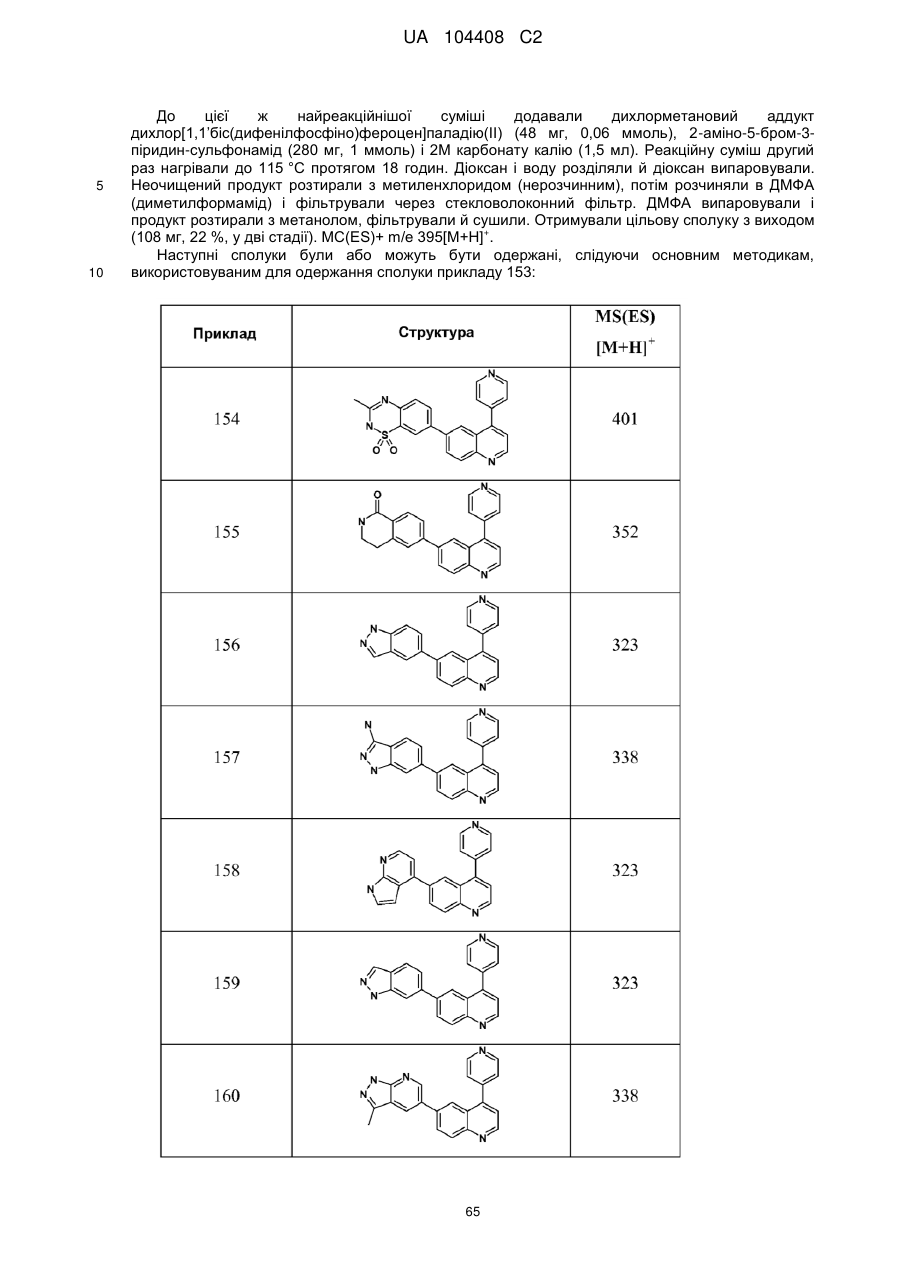
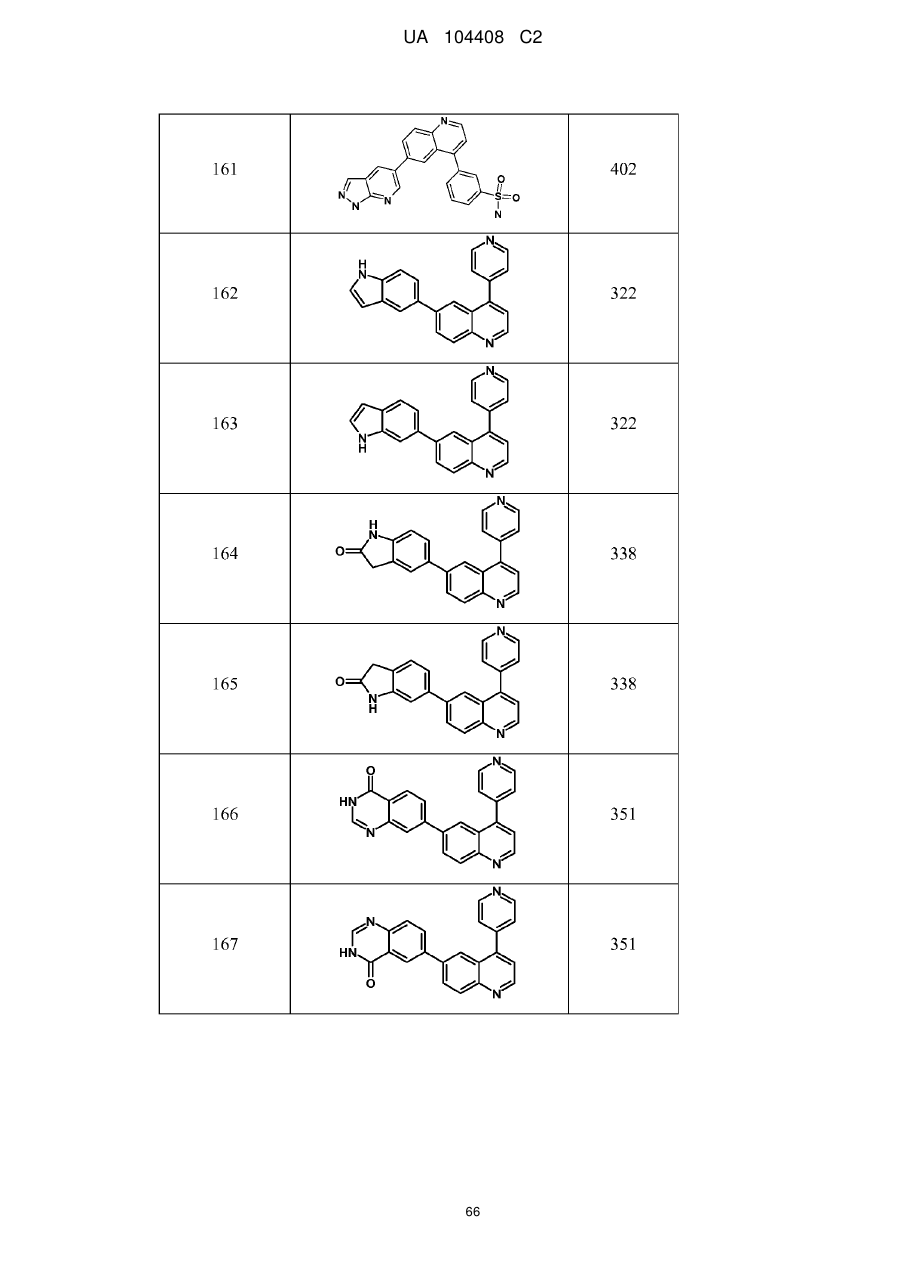
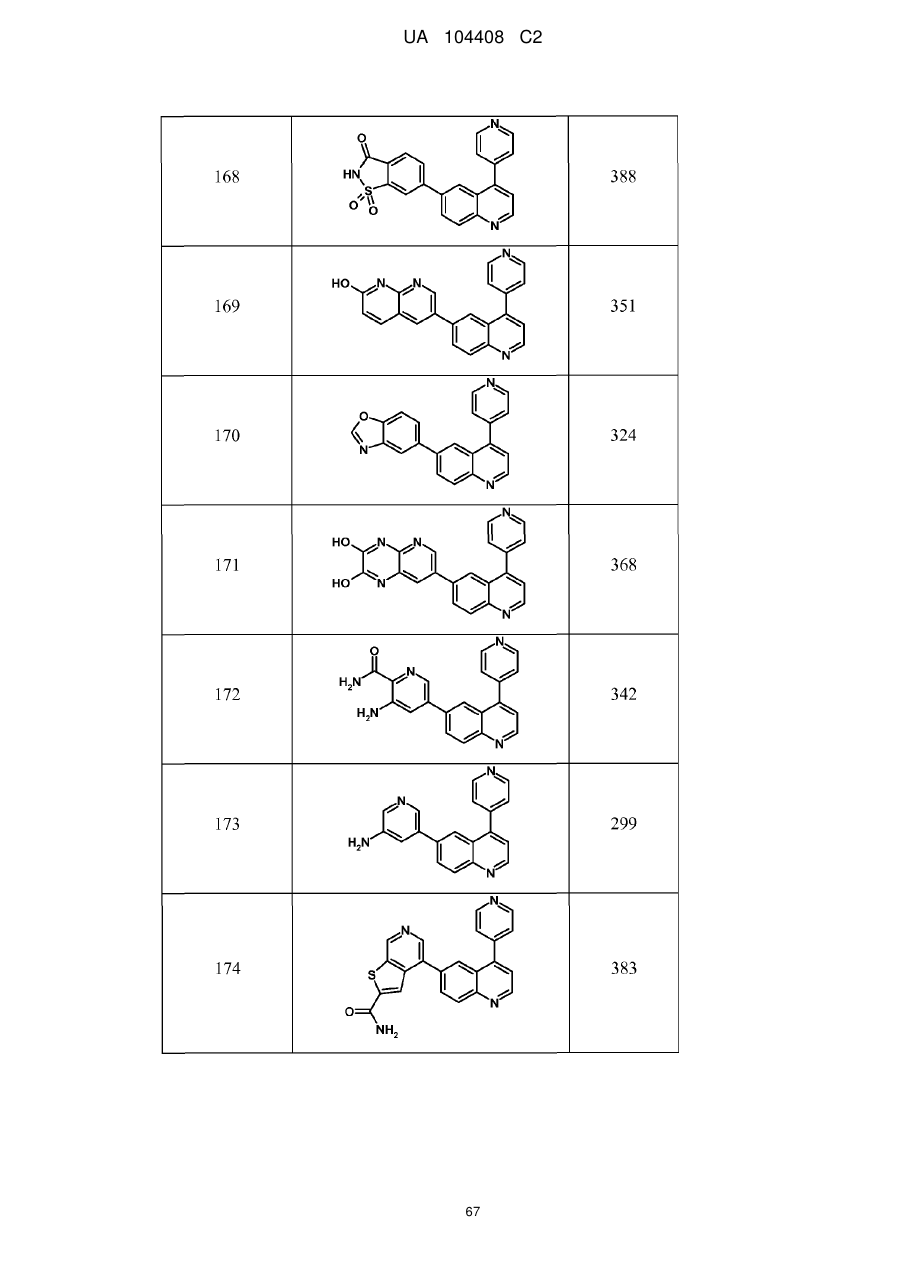
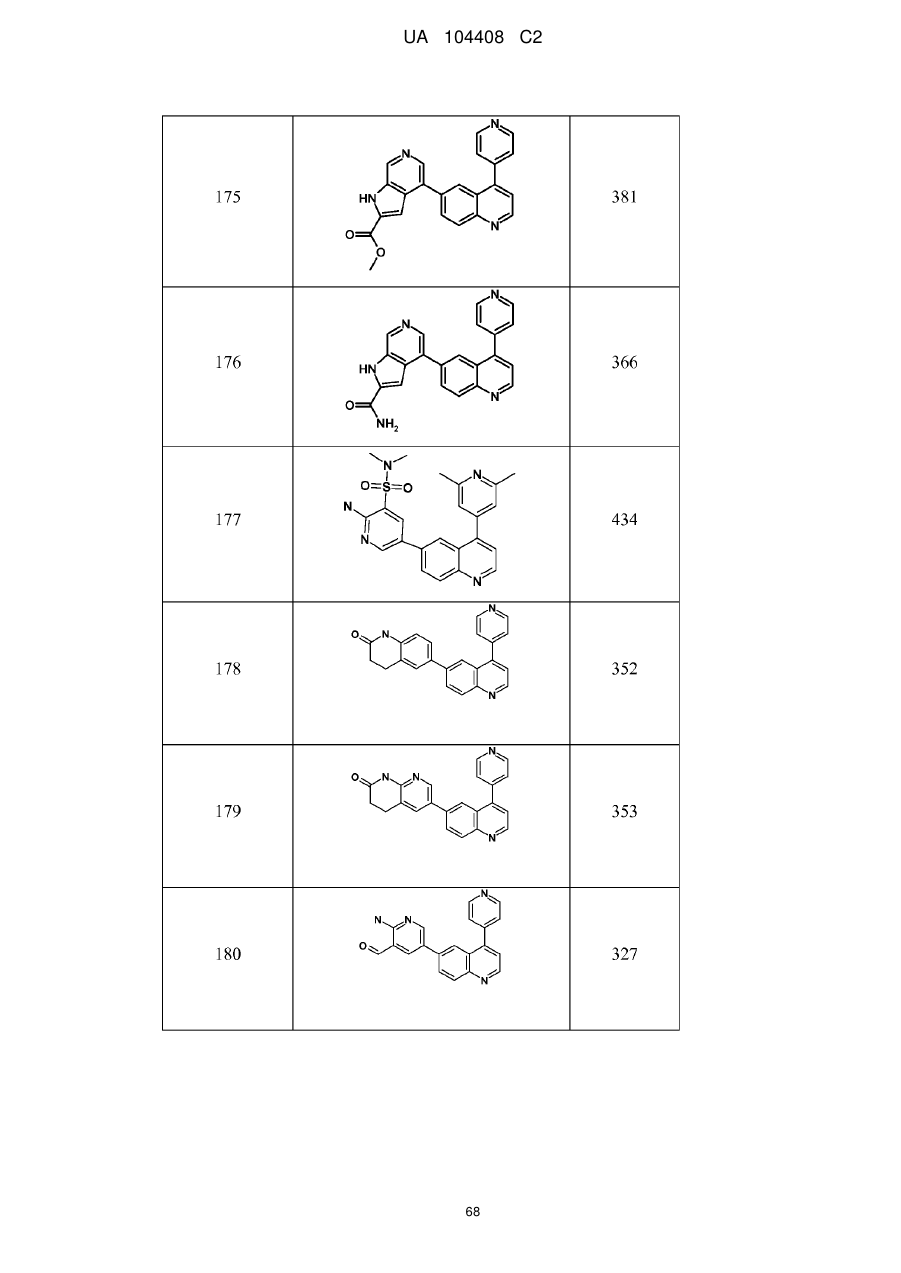
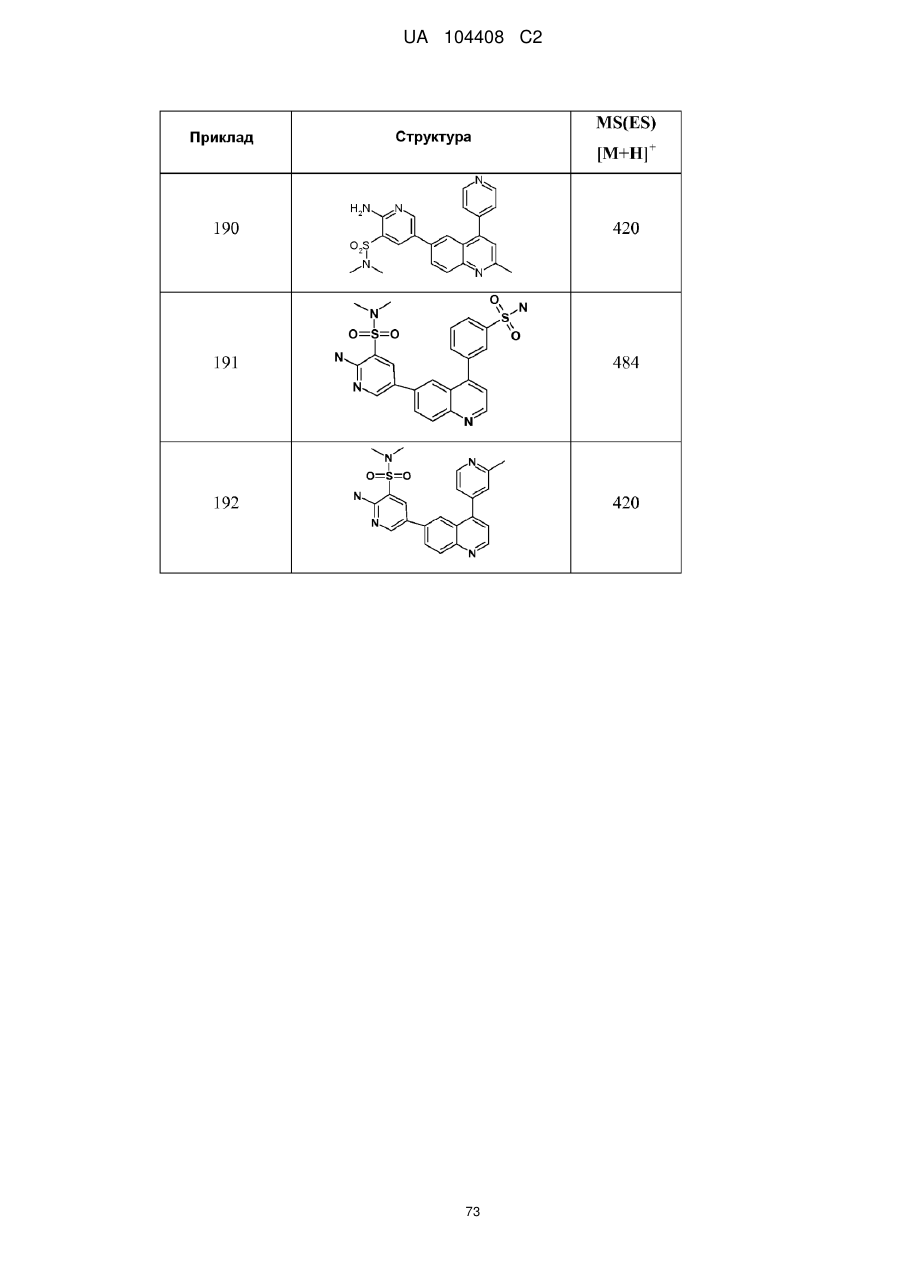
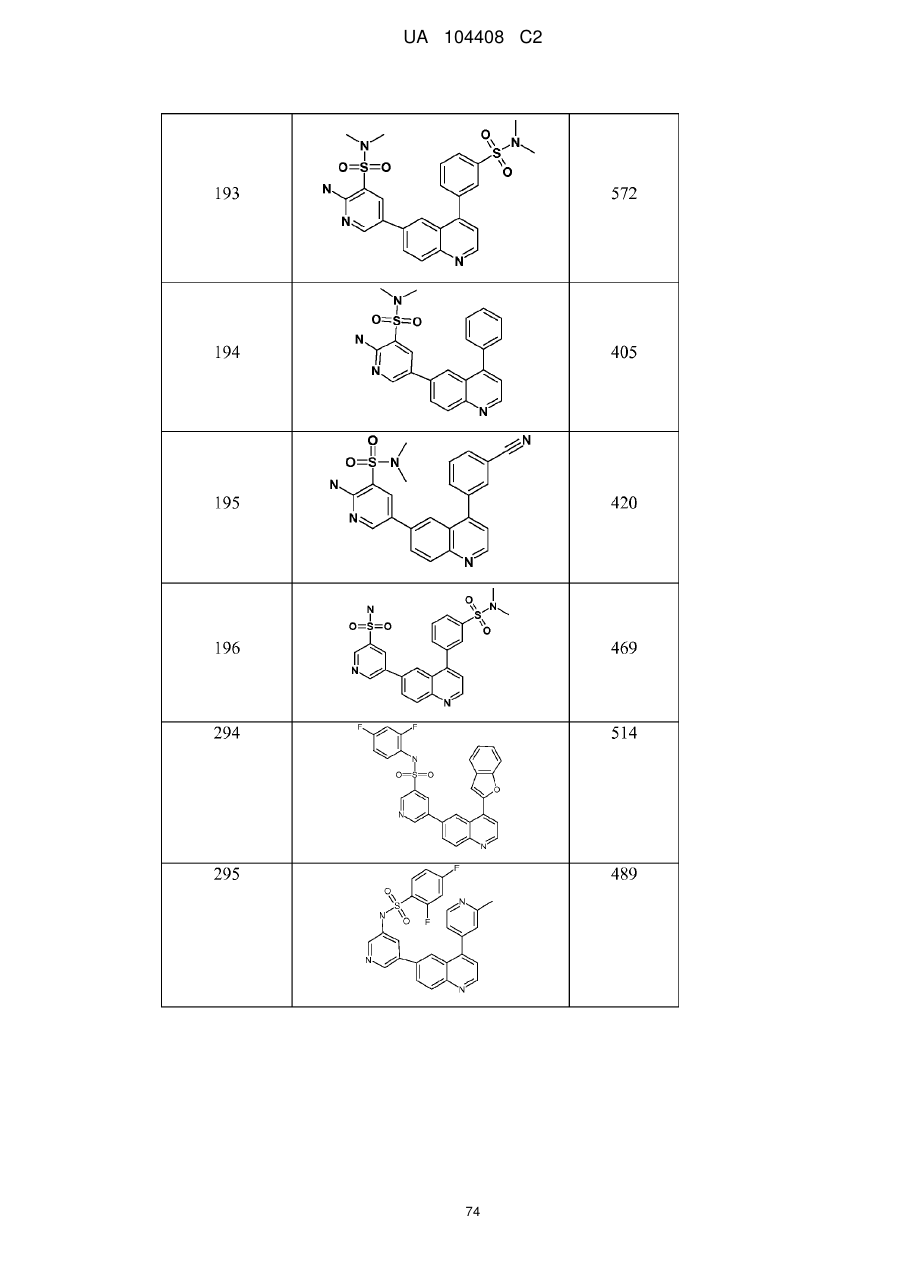
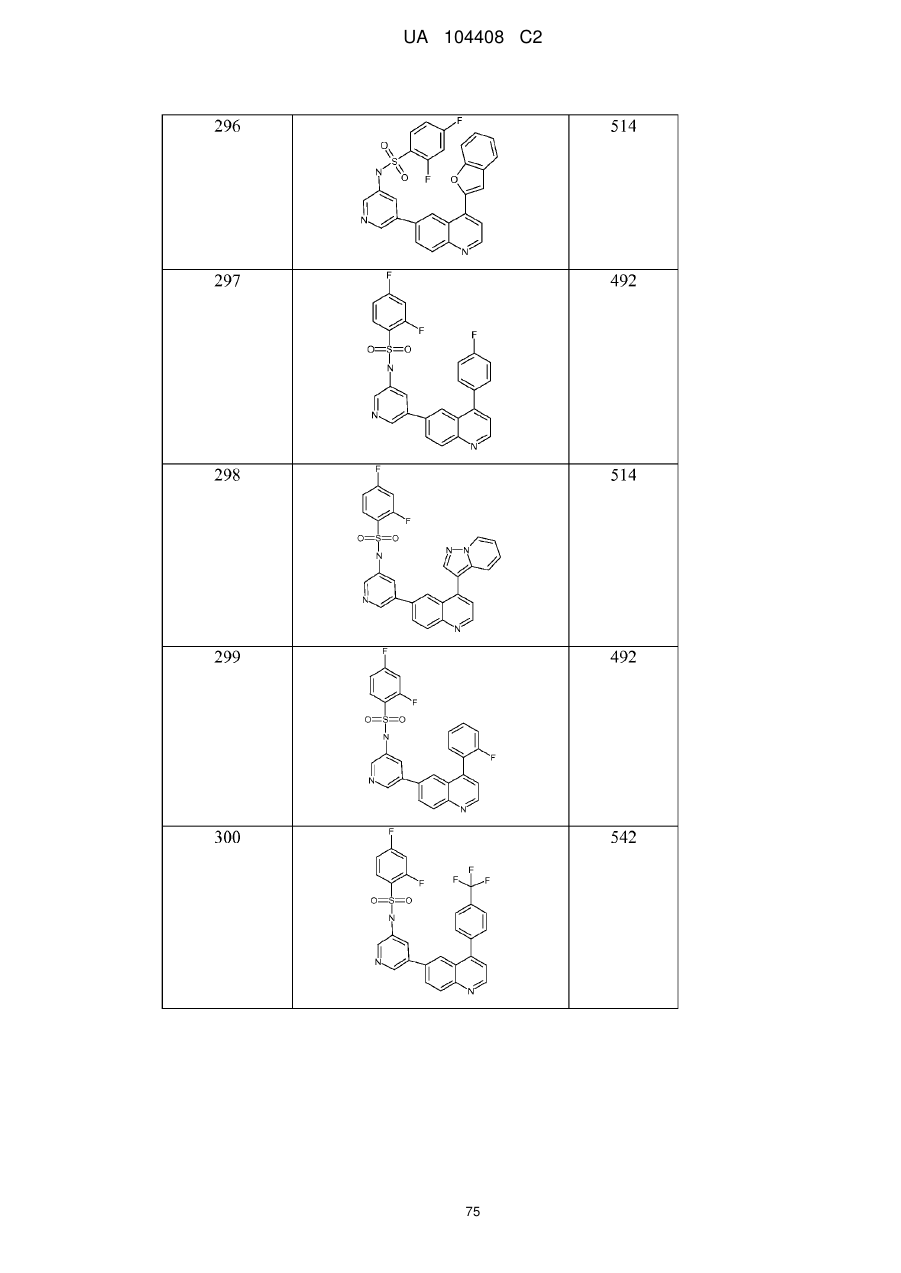
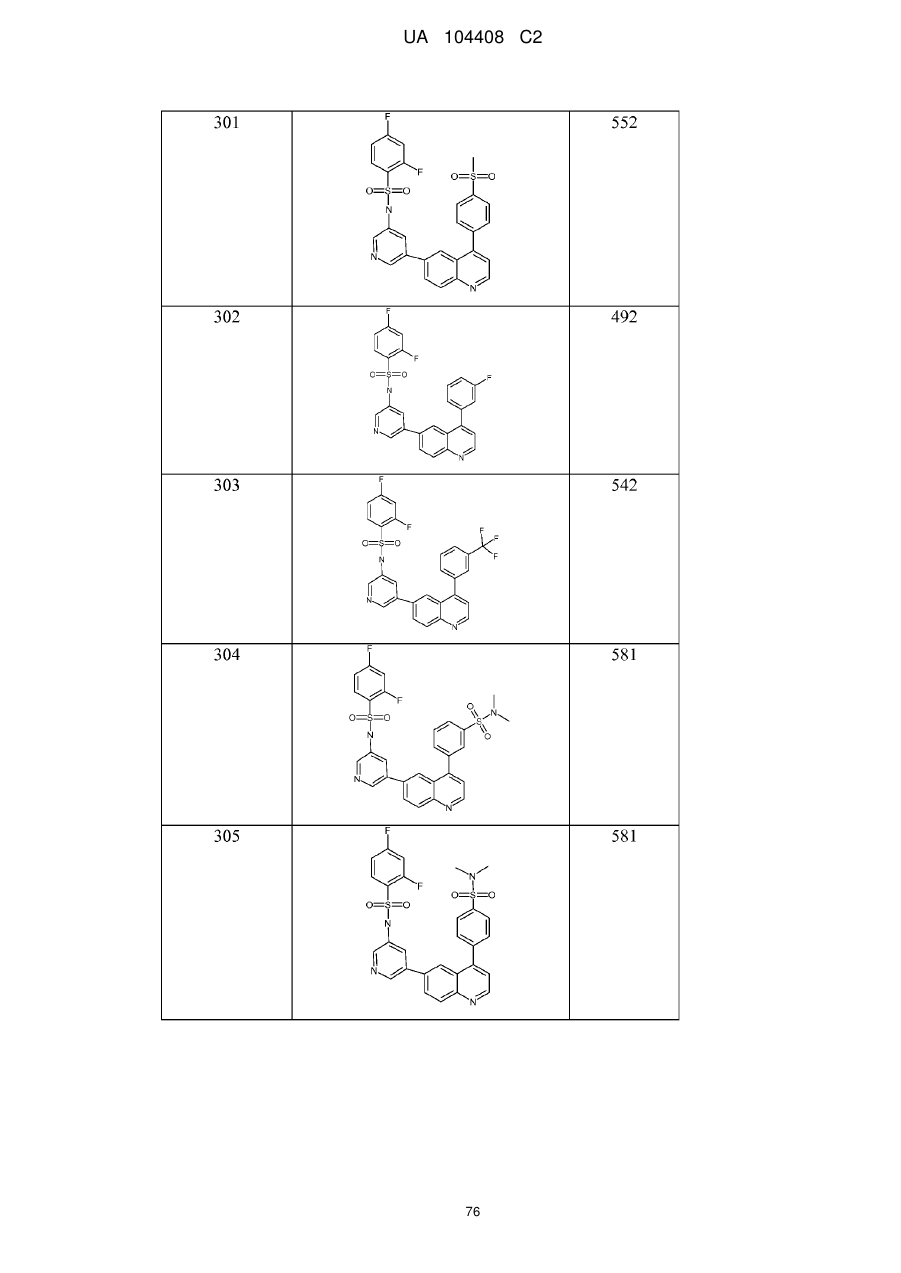
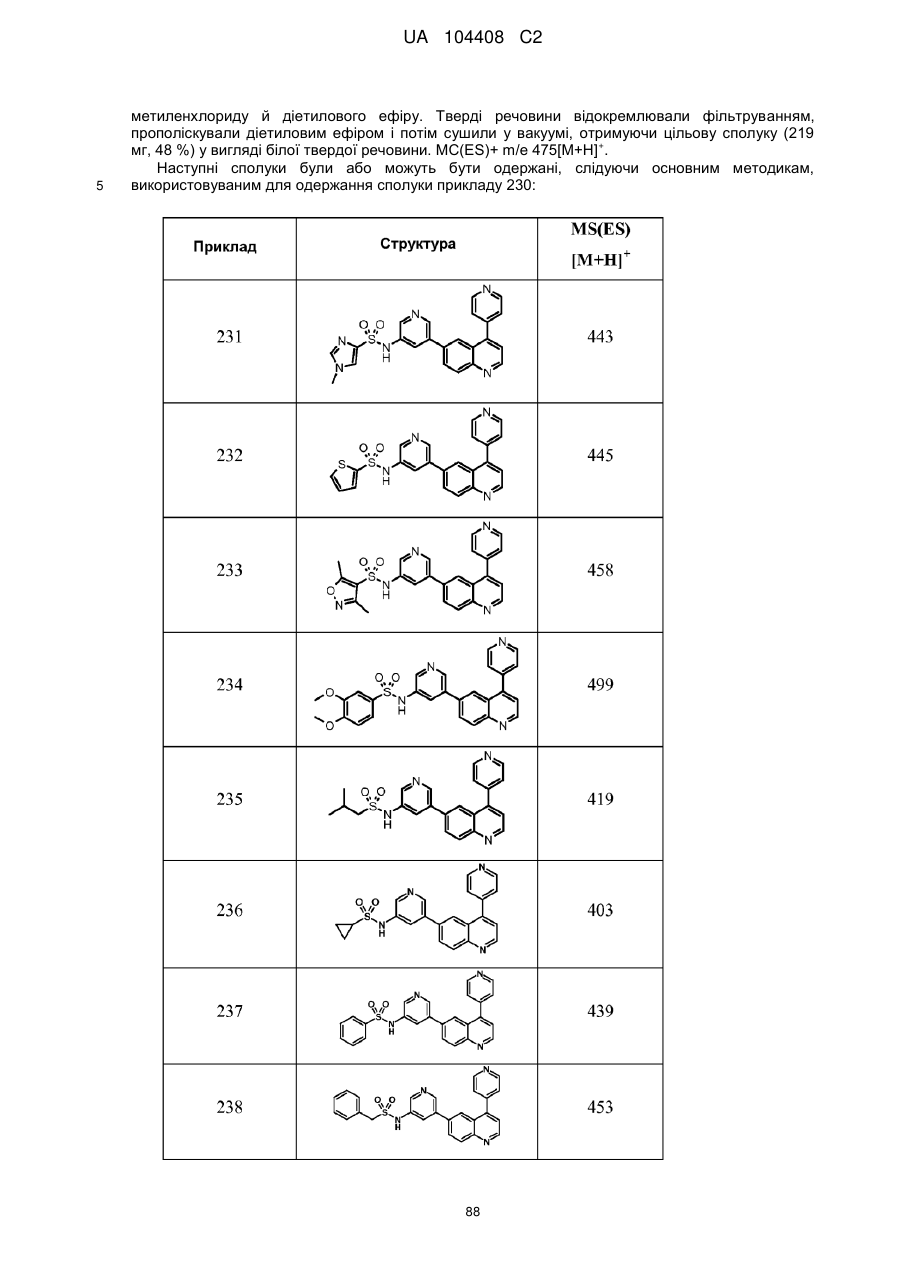
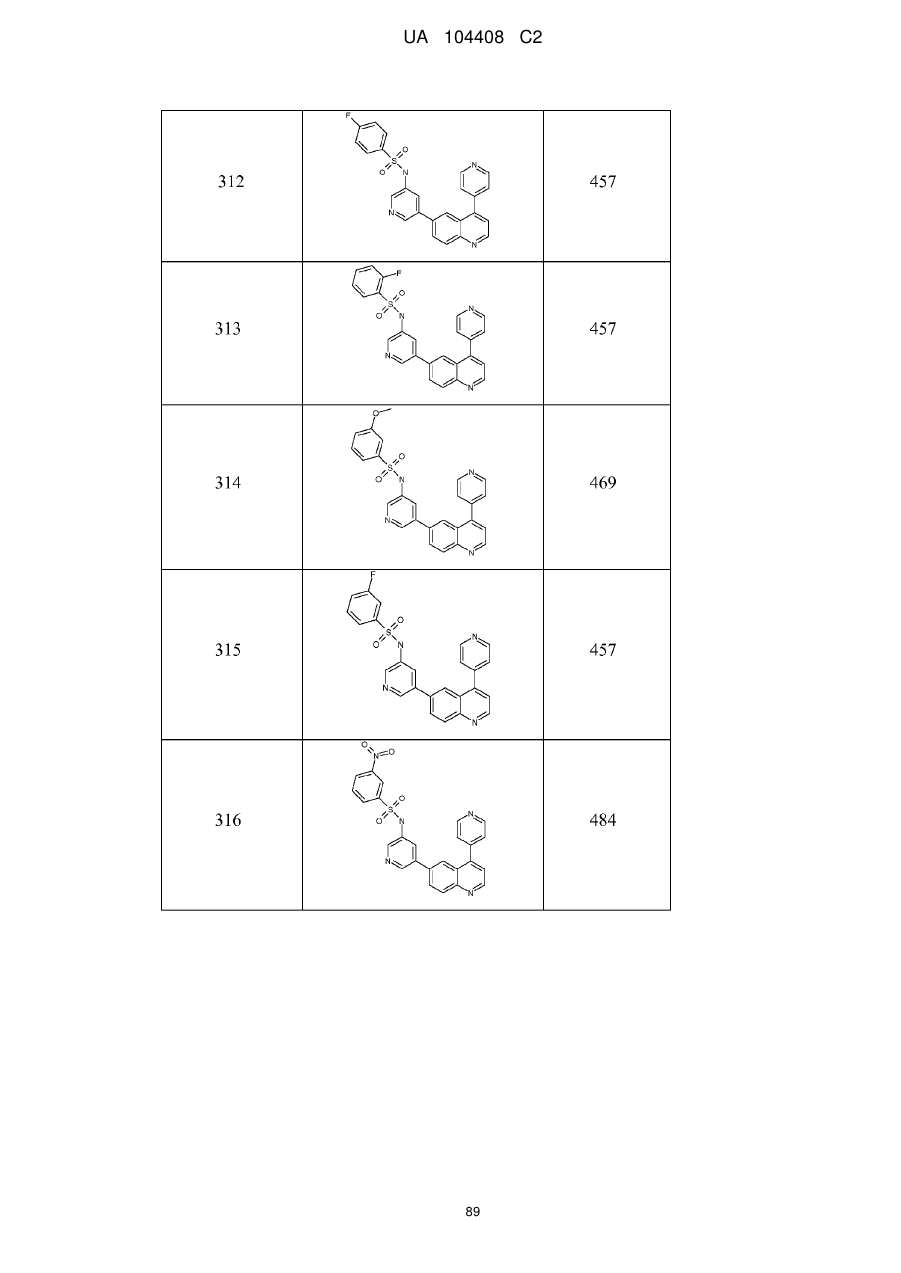
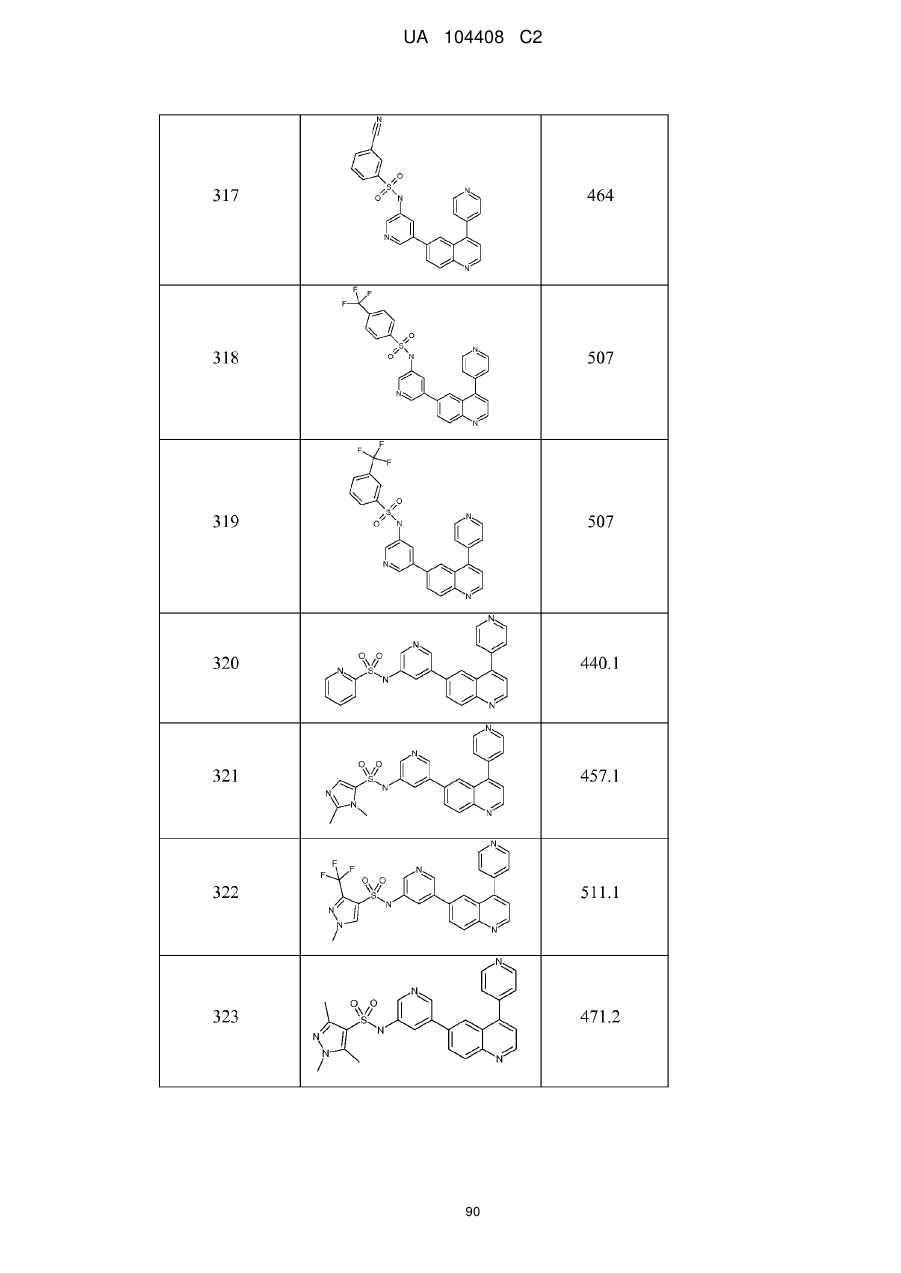
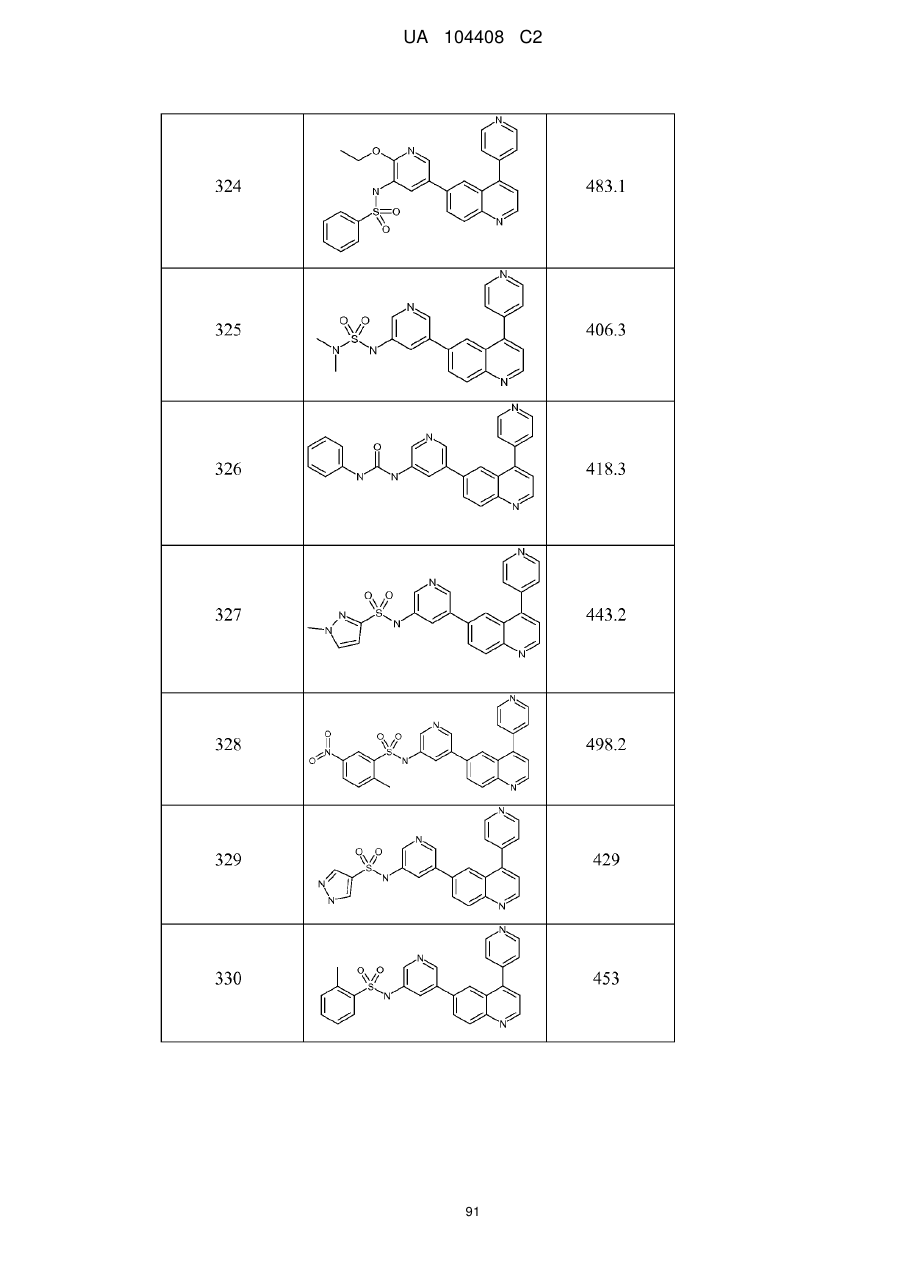
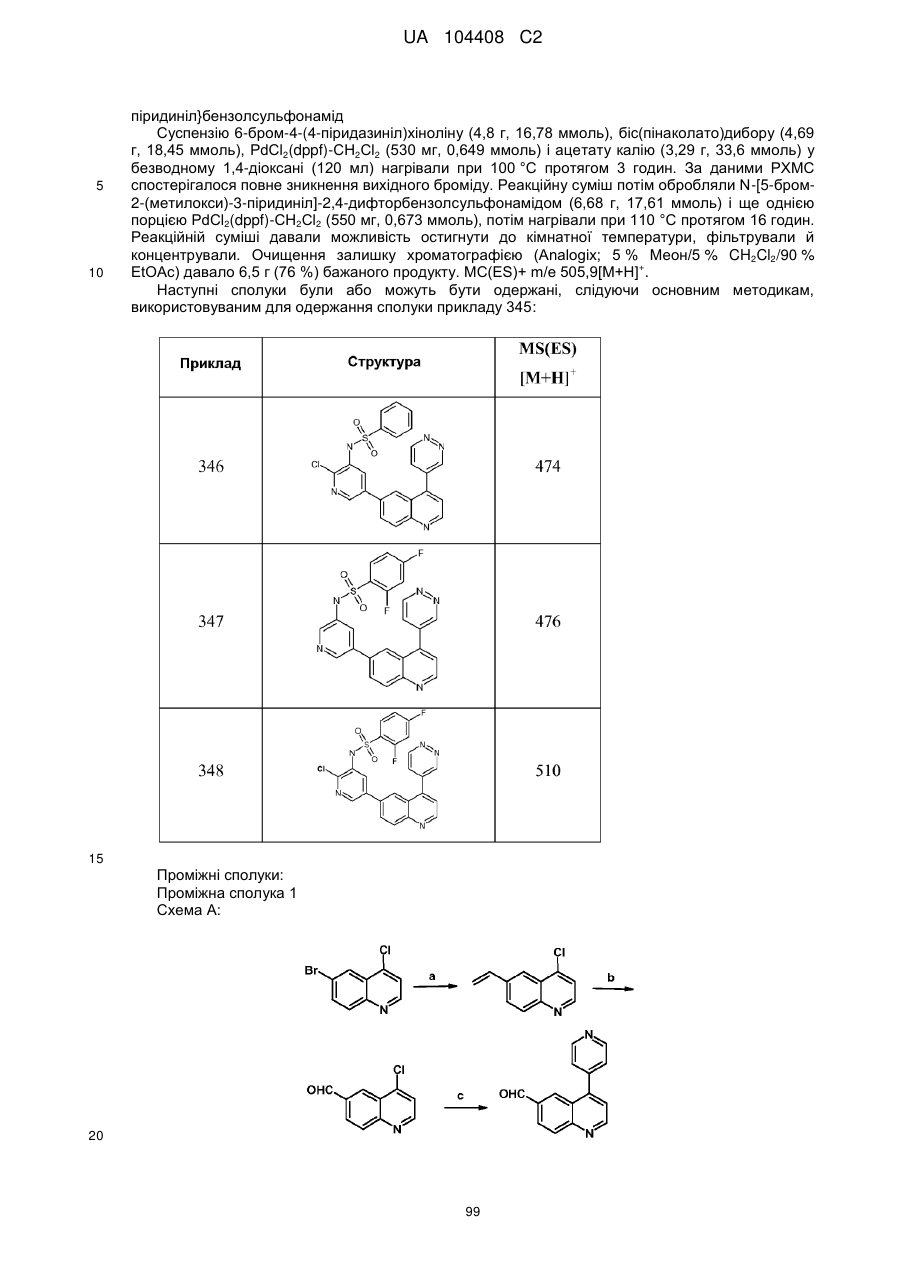
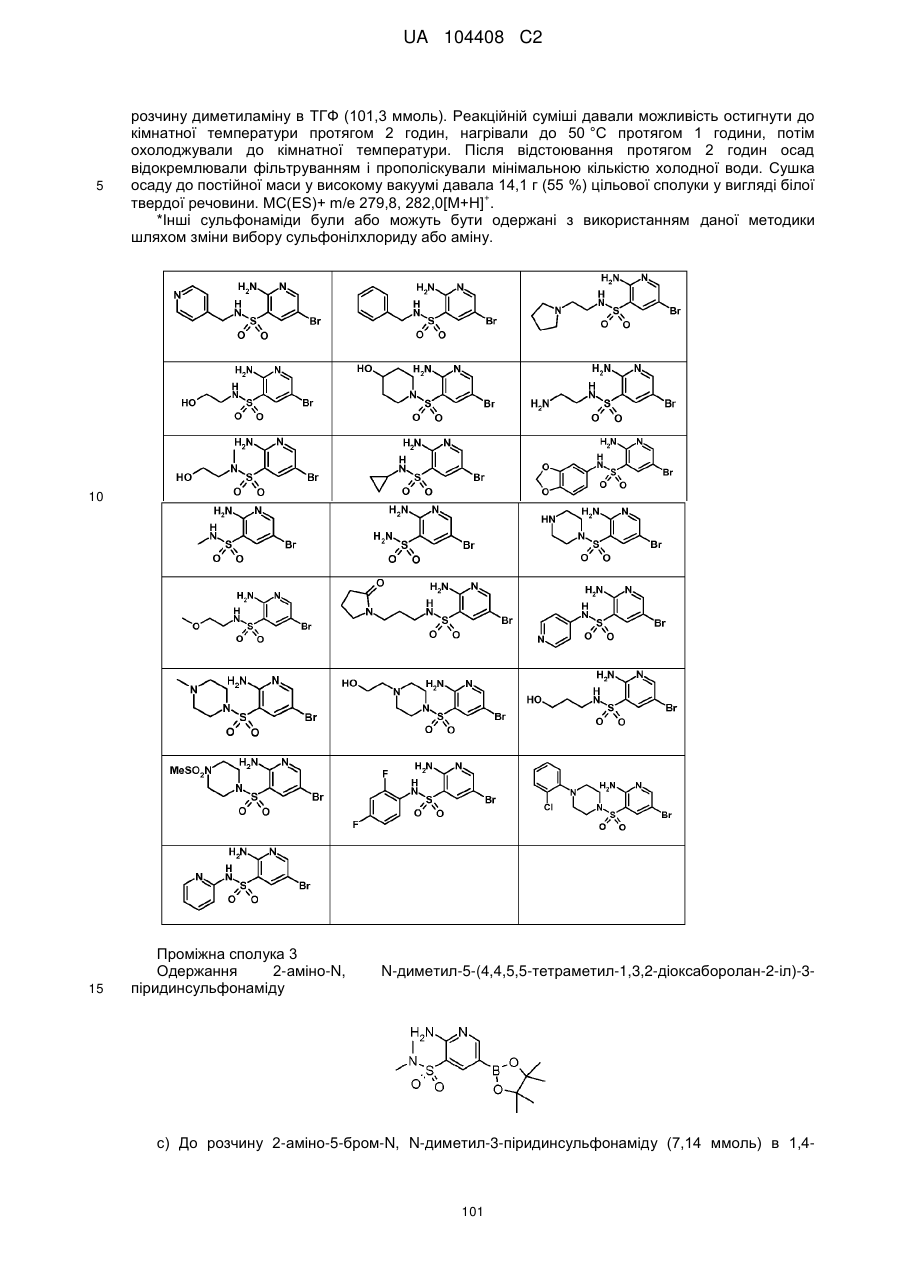
Похідні хіноліну як інгібітори pi3-кінази
Номер патенту: 104408
Опубліковано: 10.02.2014
Автори: Сарпонг Марта, Донателлі Карла А., Дарсі Майкл Джерард, Ріджерс Ленс, Адамс Ніколас Д., Бергесс Жоель Лоррейн, Шмідт Стенлі Дж., Ньюлендер Кеннет Аллен, Найт Стівен Девід
Формула / Реферат
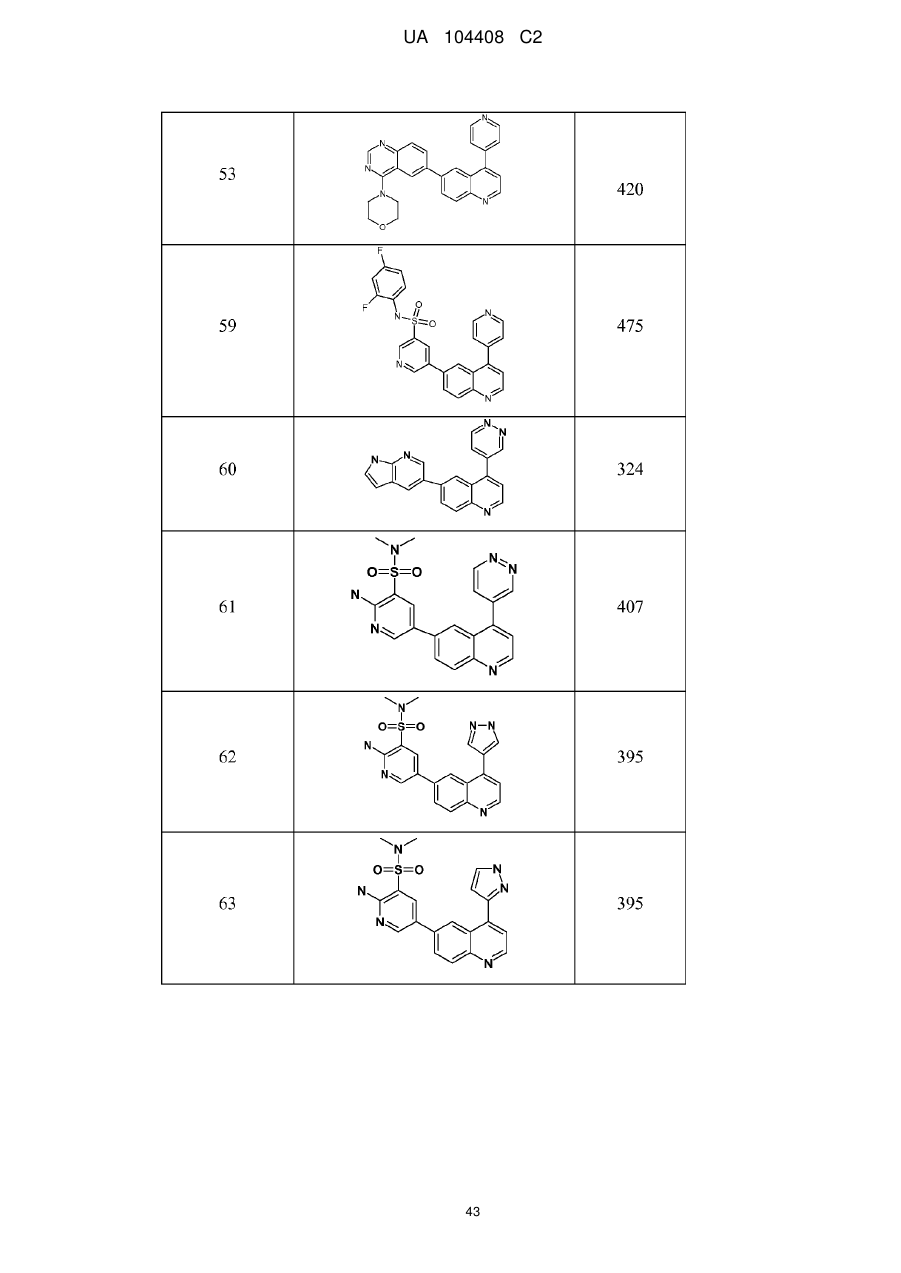
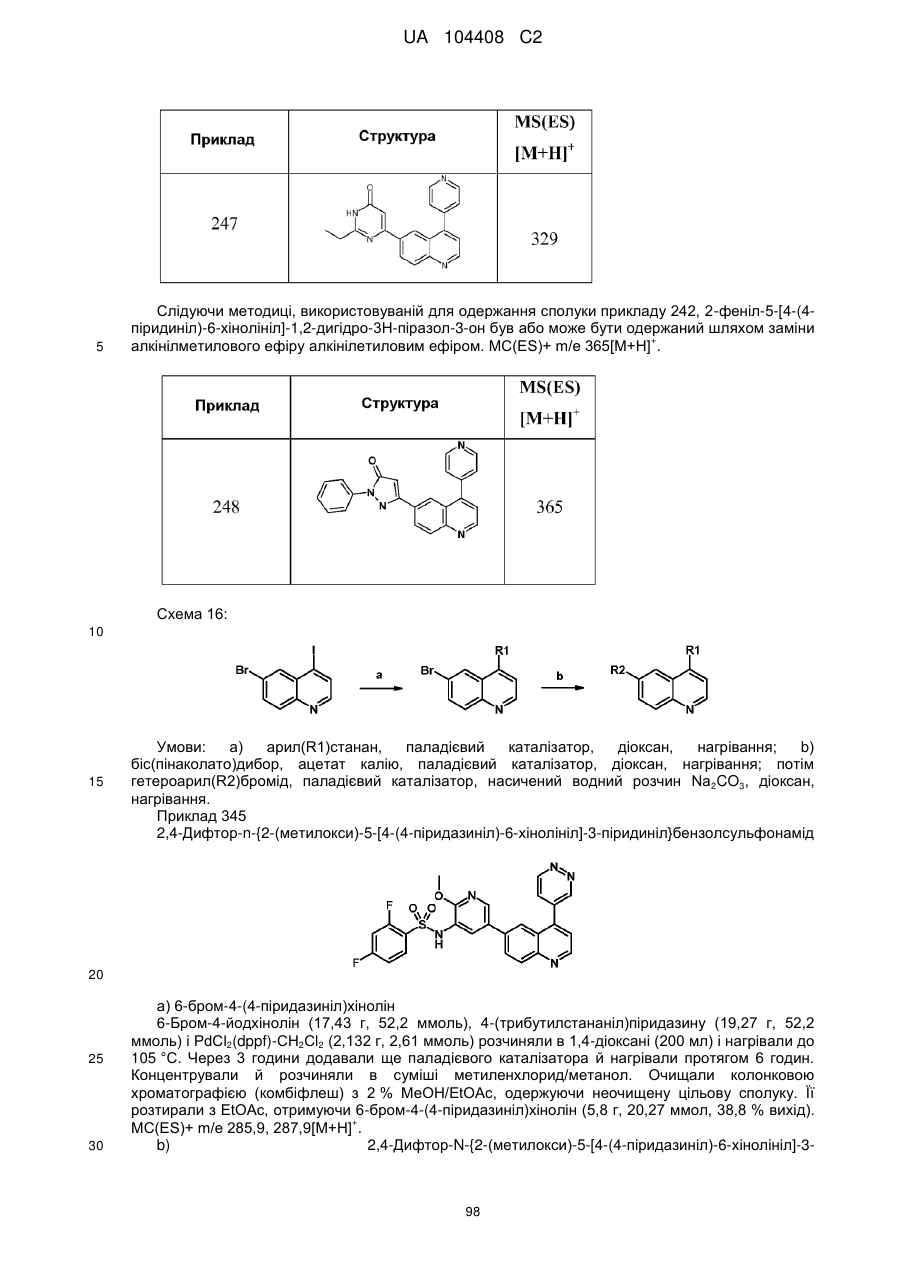
1. Сполука, що являє собою 2,4-дифторо-N-{2-(метилокси)-5-[4-(4-піридазиніл)-6-хінолініл]-3-піридиніл}бензолсульфонамід формули
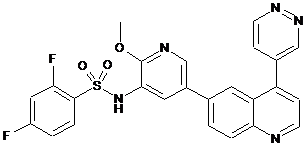 ,
,
або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, що являє собою 2,4-дифторо-N-{2-(метилокси)-5-[4-(4-піридазиніл)-6-хінолініл]-3-піридиніл}бензолсульфонамід
 .
.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль для застосування в медичній терапії.
4. Сполука за п. 1 або її фармацевтично прийнятна сіль для застосування в інгібуванні однієї або більше фосфатоіноїзитид 3-кіназ РІ3К у людини.
5. Сполука за п. 1 або її фармацевтично прийнятна сіль для застосування при лікуванні одного або більше хворобливих станів, вибраних з групи, що складається з аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, мультиорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантата й пошкоджень (уражень) легенів, у людини.
6. Сполука за п. 1 та/або її фармацевтично прийнятна сіль та принаймні один антинеопластичний агент, як-от вибраний з групи, що складається з антимікротрубочкових агентів, координаційних комплексів платини, алкілуючих агентів, антибіотичних агентів, інгібіторів топоізомерази II, антиметаболітів, інгібіторів топоізомерази І, гормонів і гормональних аналогів, інгібіторів шляху сигнальної трансдукції, інгібіторів ангіогенезу нерецепторної тирозинкінази, імунотерапевтичних агентів, проапоптотичних агентів та інгібіторів передачі сигналів клітинного циклу, для застосування у спільному введенні для лікування раку.
7. Сполука для застосування за п. 5, де хворобливий стан вибраний з групи, що складається із розсіяного склерозу, псоріазу, ревматоїдного артриту, системного червоного вовчака, запального захворювання кишечнику, запалення легенів, тромбозу, інфекції/запалення головного мозку, менінгіту й енцефаліту.
8. Сполука за п. 5, де хворобливий стан вибраний з групи, що складається з: хвороби Альцгеймера, хвороби Хантінгтона, травми ЦНС, удару та ішемічних станів.
9. Сполука за п. 5, де хворобливий стан вибраний з групи, що складається з: атеросклерозу, гіпертрофії серця, дисфункції серцевих міоцитів, підвищеного кров'яного тиску і звуження судин.
10. Сполука за п. 5, де хворобливий стан вибраний з групи, що складається з: хронічного обструктивного захворювання легенів, анафілактичного шоку, фіброзу, псоріазу, алергічних захворювань, астми, удару, ішемії-реперфузії, агрегації/активації тромбоцитів, атрофії/гіпертрофії скелетних м'язів, рекрунтмента лейкоцитів у ракових тканинах, ангіогенезу, інвазивного метастазу, меланоми, саркоми Капоші, гострих і хронічних бактеріальних і вірусних інфекцій, сепсису, відторгнення при трансплантації, відторгнення трансплантата, гломерулосклерозу, гломерулонефриту, прогресуючого ренального фіброзу, ендотеліальних і епітеліальних пошкоджень у легенях і запалення легеневих дихальних шляхів.
11. Сполука за п. 5, де захворюванням є рак.
12. Сполука за п. 11, де рак вибраний з групи, що складається з: гліом головного мозку, гліобластом, лейкемій, синдрому Баннайана-Зонана, хвороби Коудена, хвороби Лермітта-Дюкло, раку грудей, запального раку грудей, пухлини Вільмса, саркоми Юїнга, рабдоміосаркоми, епендимоми, медулобластоми, раку ободової кишки, раку голови й шиї, раку нирок, раку легенів, раку печінки, меланоми, раку яєчників, раку підшлункової залози, раку простати, саркоми, остеосаркоми, крупноклітинної пухлини кісток і щитовидної залози.
13. Сполука за п. 11, де рак вибраний з групи, що складається з: раку яєчників, раку підшлункової залози, раку грудей, раку простати й лейкемії.
14. Застосування сполуки відповідно до п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування одного або більше хворобливих станів, вибраних з групи, що складається з аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, мультиорганної недостатності, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперматозоїдів, відторгнення при трансплантації, відторгнення трансплантата й пошкоджень (уражень) легенів, у людини.
15. Сполука за п. 4, де зазначеною РІ3-кіназою є РІ3Кa.
16. Сполука за п. 4, де зазначеною РІ3-кіназою є РІ3Кg.
17. Сполука за п. 4, де зазначеною РІ3-кіназою є РІ3Кd.
18. Сполука за п. 5, де сполуку або її фармацевтично прийнятну сіль уводять у складі фармацевтичної композиції.
19. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
Текст
Реферат: Винахід стосується способу інгібування активності/функції РІ3-кіназ з використанням похідних хіноліну. Винахід також стосується способу лікування одного або більше хворобливих станів, вибраних з: аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, UA 104408 C2 (12) UA 104408 C2 нейродегенеративних захворювань, алергії, астми, панкреатиту, недостатності багатьох органів, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперми, відторгнення при трансплантації, відторгнення трансплантата й легеневих пошкоджень, шляхом введення похідних хіноліну. UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Даний винахід відноситься до застосування похідних хіноліну для модуляції, особливо інгібування активності або функції сімейства фосфоїнозитид 3" ОН кінази (називаних далі РІ3 кіназами), відповідно Рi3Кα, Рi3Кδ, Рi3Кβ і/або Рi3Кγ, зокрема Рi3Кα. Відповідно, даний винахід відноситься до застосування похідних хіноліну в лікуванні одного або більше хворобливих станів, вибраних з: аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, недостатності багатьох органів, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперми, відторгнення при трансплантації, відторгнення трансплантата й легеневих пошкоджень, особливо раку. Передумови винаходу Клітинні мембрани є величезним сховищем вторинних посередників, які можуть залучатися до безлічі шляхів сигнальної трансдукції. Що стосується функції й регуляції ефекторних ферментів у сигнальних шляхах фосфоліпідів, дані ферменти генерують вторинні посередники з фосфоліпідних пулів мембран (клас I Рi3 кіназ (наприклад, Рi3кальфа) є кіназними ферментами подвійної специфічності, що означає, що вони показують як активність ліпідкінази (фосфорилування фосфоїнозитидів), так і протеїнкінази, що свідчить про їх здатність фосфорилювати білок як субстрат, включаючи аутофосфорилування, як внутрішньомолекулярний регуляторний механізм. Дані сигнальні ферменти фосфоліпідів активуються у відповідь на безліч позаклітинних сигналів, таких як фактори росту, мітогени, інтегрини (взаємодії клітина-клітина), гормони, цитокіни, віруси й нейротрансмітери, такі як описано в даному описі нижче на схемі I, а також за допомогою внутрішньоклітинної регуляції іншими сигнальними молекулами (взаємні перешкоди, коли первинний сигнал може активувати деякі паралельні шляхи, які на ще одній стадії передають сигнали Рi3К-ам внутрішньоклітинними сигнальними подіями), такими як, наприклад, малі GTP-ази, кінази або фосфатази. Внутрішньоклітинна регуляція може також відбуватися в результаті аберантної експресії або недостатності експресії клітинних онкогенів або супресорів пухлини. Інозитфосфоліпідні (фосфоїнозитиди) внутрішньоклітинні сигнальні шляхи починають з активації сигнальних молекул (позаклітинні ліганди, стимули, рецепторна димеризація, трансактивування ксеногенним рецептором (наприклад, рецепторною тирозинкіназою) і рекрутменту й активації Рi3К, включаючи залучення G-білок-зв'язаного трансмембранного рецептора, інтегрованого в мембрану плазми. PI3K перетворює мембранний фосфоліпід PI(4,5)P2 на PI(3,4,5)P3, який функціонує як вторинний посередник. PI і PI(4)Р є також субстратами PI3K і можуть фосфоризуватися й перетворюватися на PI3P і PI(3,4)P2, відповідно. На додаток, дані фосфоїнозитиди можуть перетворюватися на інші фосфоїнозитиди за допомогою 5'-специфічної і 3'-специфічної фосфатаз, таким чином, PI3K ферментна активність прямо або побічно приводить у результаті до генерування двох 3'-фосфоїнозитидних підтипів, які функціонують як 2-гі посередники у внутрішньоклітинних шляхах сигнальної трансдукції (Trends Biochem. Sci 22(7) стор. 267-72 (1997) Vanhaesebroeck et al.; Chem. Rev. 101(8) стор. 2365-80 (2001) Leslie et al (2001); Annu. Rev. Cell, Dev, Biol. 17р, 615-75 (2001) Katso et àl. і Cell. Mol. Life Sci. 59(5) стор. 761-79 (2002) Toker et al.). Множинні PI3K ізоформи, категоризовані за їхніми каталітичними субодиницями, їх регуляції відповідними регуляторними субодиницями, експресійним структурам і сигналспецифічним функціям (р110α, β, δ і γ), виконують дану ферментну реакцію (Exp. Cell. Res. 25(1) стор. 239-54 (1999) Vanhaesebroeck and Katso et al., 2001, вище). Близько родинні ізоформи р110α та β адекватно експресуються, тоді, як δ і γ більш специфічно експресуються в гематопоетичній клітинній системі, клітинах гладких м'язів, міоцитах і ендотеліальних клітинах (Trends Biochem. Sci. 22(7) стор. 267-72 (1997) Vanhaesebroeck et al.). Їх експресія могла б також регулюватися індукованим чином залежно від клітинного, тканинного типа і стимулів, а також контексту захворювання. Індукованість білкової експресії включає синтез білка, а також стабілізацію білка, які частково регулюються асоціацією з регуляторними субодиницями. На теперішній час ідентифіковано вісім PI3K ссавців, розділених на три головні класи (I, II і III) на підставі гомології послідовності, структури, партнерів зв'язування, способу активації й переваги щодо субстрату. Клас I PI3K in vitro може фосфорилувати фосфатидилінозит (PI), фосфатидилінозит-4-фосфат (PI4P) і фосфатидилінозит-4,5-біфосфат (PI(4,5)P2), даючи фосфатидилінозит-3-фосфат (PI3P), фосфатидилінозит-3,4-біфосфат (PI(3,4)P2) і фосфатидилінозит-3,4,5-трифосфат (PI(3,4,5)P3), відповідно. Клас II PI3K фосфорилує PI і фосфатидилінозит-4-фосфат. Клас III PI3K може фосфорилувати лише PI (Vanhaesebroeck et al., 1997, вище; Vanhaesebroeck et al., 1999, Leslie et al., 2001, вище). 1 UA 104408 C2 Схема I: Перетворення PI(4,5)P2 на PIP3 5 10 15 20 25 Як проілюстровано на схемі А вище, фосфоїнозитид 3-кінази (PI3K) фосфорилують гідроксил третього атома вуглецю інозитного кільця. Фосфорилування фосфоїнозитидів, які генерують PtdIns у 3,4,5-трифосфат (PtdIns(3,4,5)P3), PtdIns(3,4)P2 і PtdIns(3)P, дає вторинні посередники для безлічі шляхів сигнальної трансдукції, включаючи шляхи суттєві для клітинної проліферації, клітинної диференціації, росту клітин, розміру й виживання клітин, апоптозу, адгезії, рухливості клітин, міграції клітин, хемотаксису, інвазії, цитоскелетного перегрупування, змін форми клітин, транспортування везикул і метаболічного шляху (Katso et al., 2001, вище, і Mol. Med. Tîday 6(9) стор.347-57 (2000) Stein). Зв'язані з G-білком рецептори опосередкують активацію фосфоїнозитид 3’OH-кінази через невеликі GTP-ази, такі як Gβγ і Ras, і згодом передача сигналу PI3K грає центральну роль у встановленні й координації полярності клітин і динамічній організації цитоскелету, що разом забезпечує силу, яка приводить клітини в рух. Хемотаксис – безпосередній рух клітин до градієнта концентрації хімічних атрактантів, називаних також хемокінами, залучений у багатьох важливих захворюваннях, як-от запалення/аутоімунність, нейродегенерація, ангіогенез, інвазія/метастаз і загоєння ран (Immunol. Today 21(6) стор. 260-4 (2000) Wyman et al.; Science 287(5455) стор. 1049-53 (2000) Hirsch et al.; FASEB J. 15(11) стор. 2019-21 (2001) Hirsch et al. і Nat. Immunol. 2(2) стор. 108-15 (2001) Gerard et al.). Прогрес, досягнутий використанням генетичних підходів і фармакологічних засобів, забезпечив розуміння сигнальних і молекулярних шляхів, які опосередкують хемотаксис у відповідь на активовані хемоатрактантом зв'язані з G-білком рецептори. PI3-Кіназа, відповідальна за генерування даних фосфорилованих сигнальних продуктів, спочатку ідентифікувалася як активність, що асоціюється з вірусними онкобілками й тирозинкіназами рецептором фактора росту, який фосфорилує фосфатидилінозит (PI) і його фосфориловані похідні при 3’-гідроксилі інозитного кільця (Panayotou et al., Trends Cell Biol. 2 стор. 358-60 2 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 (1992)). Проте нещодавні біохімічні дослідження показали, що Рi3 кінази класу I (тобто ізоформи PI3Kγ класу IB) є подвійними специфічними кіназними ферментами, що означає, що вони показують активність як ліпідкінази, так і протеїнкінази, показуючи, що вони здатні до фосфорилування інших білків як субстратів, а також до аутофосфорилування як внутрішньомолекулярного регуляторного механізму. Вважається, що активація PI3-кінази залучена в низку клітинних відповідних реакцій, включаючи ріст клітин, диференціацію й апоптоз (Parker et al., Current Biology, 5 стор. 577-99 (1995); Yao et al., Science, 267 стор. 2003-05 (1995)). PI3-кіназа, ймовірно, залучена в низку аспектів активації лейкоцитів. Показано, що активність р85-асоційованої PI3-кінази фізично асоційована з цитопластичним доменом CD28, який є важливою костимуляторною молекулою для активації Т-клітин у відповідь на антиген (Pages et al., Nature, 369 стор. 327-29 (1994); Rudd. Immunity 4 стор. 527-34 (1996)). Активація Т-клітин через CD28 знижує поріг для активації антигеном і підвищує величину і тривалість проліферативної відповіді. Дані ефекти зв'язані із збільшеннями транскрипції низки генів, включаючи інтерлейкін-2 (IL2), важливий фактор росту Т-клітин (Fraser et al., Science 251 стор. 313-16 (1991)). Мутація CD28 така, що він не може довго взаємодіяти з PI3-кіназою, веде до невдачі ініціації продукування IL2, передбачаючи критичну роль PI3-кінази в активації Т-клітин. PI3Kγ ідентифікований як посередник G бета-гаммазалежної регуляції JNK активності, і G бета-гамма є субодиницями гетеротримерних G білків (Lopez-Ilasaca et al., J. Biol. Chem. 273(5) стор. 2505-8 (1998)). Клітинні процеси, в яких PI3K грають істотну роль, включають придушення апоптозу, реорганізацію скелета актину, росту серцевих міоцитів, стимуляцію глікогенсинтази інсуліном,активізацію TNFα-опосередкованих нейтрофілів і генерування супероксидів, і міграцію й адгезію лейкоцитів до ендотеліальних клітин. Нещодавно, (Laffargue et al., Immunity 16(3) стор. 441-51 (2002)) було описано, що PI3Kγ передає запальні сигнали через всілякі G(i)-зв'язані рецептори і його центральний сигнал до функції мастоцитів, стимулів або подразників у контексті лейкоцитів, імунологія включає, наприклад, цитокіни, хемокіни, аденозини, антитіла, інтегрини, фактори агрегації фактори росту, віруси або гормони (J. Cell. Sci. 114(Pt 16) стор. 2903-10 (2001) Lawlor et al.; Laffargue et al., 2002, вище, і Curr. Opinion Cell Biol. 14(2) стор. 203-13 (2002) Stephens et al.). Специфічні інгібітори відносно індивідуальних представників сімейства ферментів забезпечують неоціненні засоби для розшифровки функцій кожного ферменту. Дві сполуки, LY294002 і уортманін (див. тут і далі) широко використовувалися й використовуються як інгібітори PI3-кінази. Дані сполуки є неспецифічними інгібіторами PI3K, оскільки вони не розрізняють чотирьох представників Рi3-кіназ класу I. Наприклад, величини IC50 уортманіну відносно кожної з різних класу I PI3-кіназ знаходяться в інтервалі 1-10 нМ. Аналогічним чином, величини IC50 для LY294002 відносно кожної з даних PI3-кіназ складають близько 15-20 мкМ (Fruman et al., Ann. Rev. Biochem., 67, стор. 481-507 (1998)), також 5-10 мкМ для CK2 протеїнкінази і певну інгібуючу активність відносно фосфоліпаз. Уортманін є грибковим метаболітом, який необоротно інгібує PI3K активність шляхом ковалентного зв'язування з каталітичним доменом даного ферменту. Інгібування активності PI3K уортманіном усуває подальшу клітинну відповідну реакцію на позаклітинний фактор. Наприклад, нейтрофіли відповідають на хемокін fMet-Leu-Phe (fMLP) стимулюванням PI3K і синтезуванням PtdIns(3,4,5)P3. Даний синтез корелює з активацією спалаху респіраторів, що залучається до нейтрофільного руйнування інвазуючих мікроорганізмів. Обробка нейтрофілів уортманіном запобігає відповідній реакції fMLP-індукованого респіраторного спалаху (Thelen et al., Proc. Natl. Acad. Sci. USA, 91, стор. 4960-64 (1994)). Дійсно, дані експерименти з уортманіном, так само як інші експериментальні свідчення показують, що PI3K активність у клітинах гематопоетичного походження, особливо нейтрофілах, моноцитах та інших типах лейкоцитів залучена в багато імунних реакцій клітин, що не є клітинами пам'яті, асоційованих з гострим і хронічним запаленням. 3 UA 104408 C2 5 10 15 20 25 30 35 40 45 На підставі досліджень з використанням уортманіну є свідчення того, що функція PI3-кінази потрібна також для деяких аспектів передачі сигналів лейкоцитів через зв'язані з G-білком рецептори (Thelen et al., 1994, вище). Більш того, було показано, що уортманін і LY294002 блокують міграцію нейтрофілів і вивільнення супероксиду. Інгібуючі циклооксигеназу похідні бензофурану описані авторами John M. Janusz et al., у роботі J. Мed. Chem. 1998; Vol 41, No 18. Тепер цілком зрозуміло, що дерегуляція онкогенів і пухлино-супресорних генів сприяє утворенню злоякісних пухлин, наприклад, шляхом збільшення росту клітин і проліферації або збільшеної виживаності клітин. У даний час відомо також, що сигнальні шляхи, опосередковані сімейством PI3K, грають центральну роль у низці клітинних процесів, включаючи проліферацію і виживаність, і дерегуляція даних шляхів є причинним фактором широкого спектру пухлин людини та інших захворювань (Katso et al., Annual Rev. Cell Dev. Biol., 2001, 17: 615-617 і Foster et al., J. Cell Science, 2003, 116: 3037-3040). PI3K класу I є гетеродимером, що складається з pl10 каталітичної субодиниці й регуляторної субодиниці, й дане сімейство додатково підрозділяється на ферменти класу Ia і класу Ib на підставі регуляторних структур і механізму регуляції. Ферменти класу Ia складаються з трьох окремих каталітичних субодиниць (p110α, p110β і p110δ), які димеризують з п'ятьма регуляторними субодиницями (p85α, p55α, p50α, p85β і p55γ), причому каталітичні субодиниці здатні взаємодіяти з усіма регуляторними субодиницями з утворенням безлічі гетеродимерів. PI3K класу Ia зазвичай активуються у відповідь на фактор росту-стимуляцію рецепторних тирозинкіназ, через взаємодію регуляторних доменів субодиниці SH2 із специфічними фосфотирозиновими залишками активованого рецептора або адапторних білків, таких як IRS-1. Малі GTP-ази (як приклад ras) також залучаються до активації PI3K у поєднанні з активацією рецептора тирозинкінази. Як р110α, так і р110β конститутивно експресуються в усіх типах клітин, тоді як експресія р110β більш обмежується лейкоцитними популяціями й деякими епітеліальними клітинами. На противагу цьому, єдиний фермент класу Ib складається з р110γ каталітичної субодиниці, яка взаємодіє з р101 регуляторною субодиницею. Крім того, фермент класу Ib активується у відповідь на пов'язані з G-білком рецепторні (GPCR) системи, і його експресія, ймовірно, обмежується лейкоцитами. Тепер існує важливе свідчення, яке вказує на те, що PI3K ферменти класу Ia сприяють опухолегенезу в широкій різноманітності видів раку людини або прямо, або побічно (Vivanco and Sawyers, Nature Reviews Cancer, 2002, 2, 489-501). Наприклад, р110α субодиниця ампліфікується в деяких пухлинах, таких як пухлини яєчників (Shayesteh, et al., Nature Genetics, 1999, 21: 99-102) і шийки матки (Ma et al., Oncîgene, 2000, 19: 2739-2744). Зовсім нещодавно активуючі мутації в р110α (PIK3CA гені) асоціювали з різними іншими пухлинами, такими як пухлини ободової кишки і грудей і легенів (Samuels, et al., Science, 2004, 304, 554). Родинні для пухлини мутації в р85α також ідентифіковані в ракових захворюваннях, таких як рак яєчників і ободової кишки (Philp et al., Cancer Research, 2001, 61, 7426-7429). На додаток до безпосередніх ефектів вважається, що активація PI3K класу Ia сприяє опухолегенним подіям, які відбуваються у верхній бік у сигнальних шляхах, наприклад, за допомогою ліганд-залежної або ліганд-незалежної активації рецепторних тирозинкіназ, GCPR систем або інтегринів (Vara et al., Cancer Treatment Reviews, 2004, 30, 193-204). Приклади таких верхніх сигнальних шляхів включають надекспресію рецепторної тирозинкінази Erb2 в безлічі пухлин, що веде до активації PI3K-опосередкованих шляхів (Harari et al., Oncogene, 2000, 19, 6102-6114) і надекспресії онкогену Ras (Kauffmann-Zeh et al., Nature, 1997, 385, 544-548). На додаток, PI3K-ази класу Ia можуть сприяти безпосередньо опухолегенезу, що викликається різними сигнальними подіями вниз по потоку. Наприклад, втрата функції PTEN пухлино-супресорної фосфатази, яка каталізує перетворення PI(3,4,5)P3 назад на PI(4,5)P2 асоціюється з дуже широким рядом пухлин через 4 UA 104408 C2 5 10 15 20 25 30 35 дерегуляцію PI3K-опосередкованого продукування PI(3,4,5)P3 (Simpson and Parsons, Exp. Cell Res., 2001, 264, 29-41). Крім того, вважається, що збільшення ефектів інших PI3Kопосередкованих сигнальних подій сприяє безлічі пухлин, наприклад, шляхом активації AKT (Nicholson and Andeson, Cellular Signalling, 2002, 14, 381-395). На додаток до ролі в опосередкуванні проліферативного сигналу й сигналу виживаності в пухлинних клітинах, є також надійне свідчення, що PI3K ферменти класу Iа також сприяють опухолегенезу через його функцію в пухлино-асоційованих стромальних клітинах. Наприклад, відомо, що PI3K передача сигналів грає важливу роль в опосередкуванні ангіогенних подій в ендотеліальних клітинах у відповідь на проангіогенні фактори, такі як VEGF (Abid et al., Arteriîscler. Thromb. Vasc. Biol., 2004, 24, 294-300). Оскільки PI3K ферменти класу I також залучаються до рухливості й міграції (Sawyer, Expert Opinion investing. Drugs, 2004, 13, 1-19), передбачається, що PI3K інгібітори принесуть терапевтичну користь через інгібування інвазії й метастазу пухлинних клітин. Короткий опис винаходу Даний винахід відноситься до нових сполук формули (I): де R2 є необов'язково заміщеною кільцевою системою, вибраною з групи, що складається з: формули (II), (III), (IV), (V), (VI), (VII), (VIII), (IX) і (X): R1 вибраний з групи, що складається з: гетероциклоалкілу, заміщеного гетероциклоалкілу, арилу, заміщеного арилу, гетероарилу й заміщеного гетероарилу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С3гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, 7 заміщеного арилу, гетероарилу, заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, нітро, ацилокси й арилокси; n дорівнює 1-2; X є C або N; Y є C, O, N або S; і/або їхніх фармацевтично прийнятних солей; за умови, що в кожній з формул (V)–(X) щонайменше один X або Y не є вуглецем; за додаткової умови, що R2 не є хіноліном або заміщеним хіноліном. R3 може бути приєднаний в будь-якому з чотирьох відкритих положень вуглецю. 5 UA 104408 C2 5 10 15 Відповідно, даний винахід відноситься до сполуки формули (I) або її фармацевтично прийнятної солі. Відповідно, даний винахід відноситься до способу лікування раку, яка включає введення суб'єктові, що потребує цього, ефективної кількості сполуки формули (I). Відповідно, даний винахід відноситься до способу лікування одного або більше хворобливих станів, вибраних з: аутоімунних розладів, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, недостатності багатьох органів, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперми, відторгнення при трансплантації, відторгнення трансплантата й легеневих ушкоджень, який включає введення суб'єктові, що потребує цього, ефективної кількості сполуки формули (I). У даний винахід включені способи спільного введення даних інгібуючих PI3 кіназу сполук з додатковими активними інгредієнтами. Детальний опис винаходу Дані сполуки формули (I) інгібують одну або більше PI3 кіназ. Відповідно, сполуки формули (I) інгібують PI3Kα. Сполуки, що охоплюються обсягом даного винаходу, інгібують також одну або більше PI3 кіназ, вибраних з: PI3Kδ, PI3Kβ і PI3Kγ. Відповідно, даний винахід відноситься до нових сполук формули (I)(A): 20 25 30 35 40 45 де R2 є необов'язково заміщеною кільцевою системою, вибраною з групи, що складається з: формули (II), (III) і (IV), визначених вище; R1 вибраний з групи, що складається з: гетероциклоалкілу, заміщеного гетероциклоалкілу, арилу, заміщеного арилу, гетероарилу й заміщеного гетероарилу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С3гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, 7 заміщеного арилу, гетероарилу, заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, нітро, ацилокси й арилокси; n дорівнює 1-2; X є C або N; Y є C, O, N або S; та/або їхніх фармацевтично прийнятних солей. Відповідно, в низку представлених у даний час сполук формули (I) включені сполуки формули (I)(B) де вибраний з групи, що складається з: формул (V), (VI) і (IX), визначених вище; R1 вибраний з групи, що складається з: гетероциклоалкілу, заміщеного гетероциклоалкілу, арилу, заміщеного арилу, гетероарилу й заміщеного гетероарилу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С37гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, 6 UA 104408 C2 5 арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, нітро, ацилокси й арилокси; n дорівнює 1-2; X є С або N; Y є С, O, N або S; і/або їхні фармацевтично прийнятні солі; за умови, що в кожній з формул (V), (VI) і (IX) щонайменше один з X або Y не є вуглецем. Відповідно, в низку представлених даних сполук формули (I) включені сполуки формули (I)(С) 10 15 20 25 30 де вибраний з групи, що складається з: формул (VII), (VIII) і (X), визначених вище; R1 вибраний з групи, що складається з: гетероциклоалкілу, заміщеного гетероциклоалкілу, арилу, заміщеного арилу, гетероарилу й заміщеного гетероарилу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С37гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, нітро, ацилокси й арилокси; n дорівнює 1-2; X є С або N; Y є С, O, N або S; та/або їхні фармацевтично прийнятні солі; за умови, що в кожній з формул (VII), (VIII) і (X) щонайменше один з X або Y не є вуглецем. Відповідно, в низку представлених у даний час сполук формули (I) включені сполуки формули (I)(D) де R2 є необов'язково заміщеною кільцевою системою, вибраною з групи, що складається з: формули (II), (III), (IV), (V), (VI) і (VIII): 7 UA 104408 C2 5 10 15 20 R1 вибраний з групи, що складається з: гетероциклоалкілу, заміщеного гетероциклоалкілу, арилу, заміщеного арилу, гетероарилу й заміщеного гетероарилу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С37гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, нітро, ацилокси й арилокси; n дорівнює 1-2; X є С або N; Y є С, O, N або S; і/або їхні фармацевтично прийнятні солі; за умови, що в кожній з формул (V), (VI) і (VIII) щонайменше один з X або Y не є вуглецем. Даним винаходом охоплюються відповідним чином сполуки формули (I)(D), де R1 є гетероарил або заміщений гетероарил; R2 вибраний з групи, що складається з формули (III) і формули (VI). Серед сполук даного винаходу знаходяться відповідно сполуки формул (I), (I)(A), (I)(B), (I)(C) і (I)(D), де R2 є піридинілом або заміщеним піридинілом. Серед сполук даного винаходу знаходяться відповідно сполуки формул (I), (I)(A), (I)(B), (I)(C) і (I)(D), де R2 не є піридинілом або заміщеним піридинілом. Серед сполук даного винаходу знаходяться відповідно сполуки формули (I), де R2 є необов'язково заміщеною кільцевою системою, вибраною з групи, що складається з формул (V)(A), (VI)(A), (VI)(B) і (IX)(A): 25 30 35 де Х є С або N; Y є С, O, N або S; Серед сполук даного винаходу знаходяться відповідно сполуки формули (I), де R2 є необов'язково заміщеною кільцевою системою, вибраною з групи, що складається з формул (VII)(A), (VIII)(A) і (X)(A): де X є С або N; Y є С, O, N або S; за умови, що щонайменше один Y не є вуглецем. Відповідно даний винахід відноситься до нових сполук формули (I)(G): 8 UA 104408 C2 5 10 15 20 де кожен R1, R3, R4 і R5 незалежно вибраний з водню, галогену, ацилу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, С 1-6алкілу, заміщеного С1-6алкілу, С3заміщеного С3-7циклоалкілу, С3-7гетероциклоалкілу, заміщеного С37циклоалкілу, гетероциклоалкілу, алкілкарбокси, аміноалкілу, арилу, заміщеного арилу, гетероарилу, 7 заміщеного гетероарилу, арилалкілу, заміщеного арилалкілу, арилциклоалкілу, заміщеного арилциклоалкілу, гетероарилалкілу, заміщеного гетероарилалкілу, ціано, гідроксилу, алкокси, ацилокси й арилокси; або R5 є R6, де R6 є групою -SO2NR80 або -NSO2R80, де R80 вибраний з групи, що складається з: С1-6алкілу, С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С1-6алкілу, заміщеного С3-6циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, де n дорівнює 0-2; n дорівнює 0-2, m дорівнює 0-3; або їхніх фармацевтично прийнятних солей. Відповідно, даний винахід відноситься до нових сполук формули (I)(Н): 25 30 35 40 45 де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С3гетероциклоалкілу, заміщеного С3-7гетероциклоалкілу, ціано, гідроксилу й алкокси; 7 кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С36алкілу, 7гетероциклоалкілу, заміщеного С 3-7гетероциклоалкілу, ціано, гідроксилу й алкокси; або R5 є R6, де R6 є групою –SO2NR80 або –NSO2R80, де R80 вибраний з групи, що складається з: С1-6алкілу, С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С1-6алкілу, заміщеного С3-6циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, де n дорівнює 0-2; n дорівнює 0-2, m дорівнює 0-2; або їхніх фармацевтично прийнятних солей. 9 UA 104408 C2 Відповідно, даний винахід відноситься до нових сполук формули (I)(J): 5 10 15 20 25 30 35 40 45 де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R3 і R4 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1-6алкілу, заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С37гетероциклоалкілу, заміщеного С 3-7гетероциклоалкілу, ціано, гідроксилу й алкокси; кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1заміщеного С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, С36алкілу, 7гетероциклоалкілу, заміщеного С 3-7гетероциклоалкілу, ціано, гідроксилу, алкокси, нітро; R6 є групою –SO2NR80 або –NSO2R80, де R80 вибраний з групи, що складається з: С 1алкілу, С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С 1-6алкілу, заміщеного С36 6циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, де n дорівнює 0-2; n дорівнює 0-2, m дорівнює 0-3; або їхніх фармацевтично прийнятних солей. Відповідно, даний винахід відноситься до нових сполук формули (I)(K): де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 16алкілу, заміщеного С 1-6алкілу, ціано, гідроксилу, алкокси; n дорівнює 0-2, m дорівнює 0-1; R6 є групою –SO2NR80 або –NSO2R80, де R80 вибраний з групи, що складається з: С 1С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С 1-6алкілу, заміщеного С36алкілу, циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу, необов'язково конденсованого з 6 п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, де n дорівнює 0-2; 10 UA 104408 C2 або їхніх фармацевтично прийнятних солей. Відповідно, даний винахід відноситься до нових сполук формули (I)(L): 5 10 15 20 де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1алкілу, заміщеного С1-6алкілу, ціано, гідроксилу й алкокси; 6 R6 є групою –SO2NR80 або –NSO2R80, де R80 вибраний з групи, що складається з: С 1С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С 1-6алкілу, заміщеного С36алкілу, 6циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH; n дорівнює 0-2, m дорівнює 0-1; або їхніх фармацевтично прийнятних солей. Відповідно, даний винахід відноситься до нових сполук формули (I)(М): 25 30 35 40 де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 1алкілу, заміщеного С1-6алкілу, ціано, гідроксилу, алкокси; 6 R6 є групою –NSO2R80, де R80 вибраний з групи, що складається з: С 1-6алкілу, С3C3-6гетероциклоалкілу, заміщеного С1-6алкілу, заміщеного C3-6циклоалкілу, 6циклоалкілу, заміщеного C3-6гетеро-циклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 16алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 16алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або (CH2)nCOOH; n дорівнює 0-2, m дорівнює 0-1; або їхніх фармацевтично прийнятних солей. Відповідно, даний винахід відноситься до нових сполук формули (I)(N): 11 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 де R1 вибраний з групи, що складається з гетероарилу, заміщеного гетероарилу, гетероциклоалкілу, заміщеного гетероциклоалкілу, аміно, заміщеного аміно, ариламіно, ациламіно, гетероциклоалкіламіно, алкокси, С1-6алкілу й заміщеного С1-6алкілу; кожен R5 незалежно вибраний з: водню, галогену, ацилу, аміно, заміщеного аміно, С 16алкілу, заміщеного С 1-6алкілу, ціано, гідроксилу, алкокси; R6 є групою –SO2NR80, де R80 вибраний з групи, що складається з: С1-6алкілу, С3C3-6гетероциклоалкілу, заміщеного С1-6алкілу, заміщеного C3-6циклоалкілу, 6циклоалкілу, заміщеного C3-6гетеро-циклоалкілу, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 16алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 16алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або (CH2)nCOOH; n дорівнює 0-2, m дорівнює 0-1; або їхніх фармацевтично прийнятних солей. Даний винахід відноситься відповідним чином до сполук формул (I)(M) і (I)(N), де R1 вибраний з групи, що складається з необов'язково заміщеного піперазину, необов'язково заміщеного піридазину, необов'язково заміщеного морфоліну, необов'язково заміщеного піразолу, заміщеного аміно і необов'язково заміщеного піперидину; R80 вибраний з групи, що складається з: С 1-6алкілу, С3-6циклоалкілу, C3-6гетероциклоалкілу, заміщеного С3-6алкілу, заміщеного C3-6циклоалкілу, заміщеного C3-6гетероциклоалкілу, арилу й заміщеного арилу. Даний винахід відноситься відповідним чином до сполук формул (I)(M) і (I)(N), де R1 вибраний з групи, що складається з необов'язково заміщеного піперазину, необов'язково заміщеного піридазину, необов'язково заміщеного морфоліну, необов'язково заміщеного піразолу, заміщеного аміно й необов'язково заміщеного піперидину; R80 вибраний з групи, що складається з: арилу, необов'язково заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 1-6алкілу, С3-6циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-6циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH; n дорівнює 0-2. Даний винахід відноситься відповідним чином до сполуки, визначеної формулою (I), (I)(A), (I)(B), (I)(C), (I)(D), (I)(E), (I)(F), (I)(G), (I)(H), (I)(J), (I)(K), (I)(M) або (I)(N). Серед сполук даного винаходу відповідно знаходяться сполуки, вибрані з групи, що складається з: 5-[4-(4-піридиніл)-6-хінолініл]-1H-індазол-3-аміну; 4,4-ди-4-піридиніл-6,6'-біхіноліну; 3-(4-морфолінілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 2-аміно-N-метил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(4-піридиніл)-6-хінолініл]-3-(1H-тетразол-5-іл)-2-піридинаміну; 6-(3-метил-3Н-імідазо[4,5-b]піридин-6-іл)-4-(4-піридиніл)хіноліну; 6-(1-метил-1Н-імідазо[4,5-b]піридин-6-іл)-4-(4-піридиніл)хіноліну; 3-(1-піперидинілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 2-аміно-N-етил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-[2-(диметиламіно)етил]-N-метил-5-[4-(4-піридиніл)-6-хінолініл]-3піридинсульфонаміду; 12 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-аміно-N-(3-піридинілметил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-3-піридиніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-феніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-(3-гідроксипропіл)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 3-(1-піперазинілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 3-{[4-(метилсульфоніл)-1-піперазиніл]сульфоніл}-5-[4-(4-піридиніл)-6-хінолініл]-2піридинаміну; 2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-N-[3-(1-піролідиніл)пропіл]-3-піридинсульфонаміду; 3-[(3-аміно-1Н-піразол-1-іл)сульфоніл]-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 3-[(4-метил-1-піперазиніл)сульфоніл]-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 2-[4-({2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}сульфоніл)-1-піперазиніл]етанолу; 2-аміно-N-(2,4-дифторфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-[3-(2-оксо-1-піролідиніл)пропіл]-5-[4-(4-піридиніл)-6-хінолініл]-3піридинсульфонаміду; 2-аміно-N-2-піридиніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-4-піридиніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 3-{[4-(2-хлорфеніл)-1-піперазиніл]сульфоніл}-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 2-аміно-N-[2-(метилоксі)етил]-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N, N-диметил-3-(4-морфолінілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; N-метил-3-(4-морфолінілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; N-етил-3-(4-морфолінілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; N, N-діетил-3-(4-морфолінілсульфоніл)-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 6-[6-(етилокси)-5-(4-морфолінілсульфоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[6-(метилокси)-5-(4-морфолінілсульфоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 3-метил-7-[4-(4-піридиніл)-6-хінолініл]-2Н-1,2,4-бензотіадіазин-1,1-діоксиду; 6-[4-(4-піридиніл)-6-хінолініл]-3,4-дигідро-1(2Н)-ізохінолінону; 4-(4-піридиніл)-6-(1Н-піроло[2,3-b]піридин-5-іл)хіноліну; 6-(1Н-індазол-5-іл)-4-(4-піридиніл)хіноліну; 6-[4-(4-піридиніл)-6-хінолініл]-1Н-індазол-3-аміну; 4-(4-піридиніл)-6-(1Н-піроло[2,3-b]піридин-4-іл)хіноліну; 6-(1Н-індазол-6-іл)-4-(4-піридиніл)хіноліну; {3-оксо-6-[4-(4-піридиніл)-6-хінолініл]-2,3-дигідро-1Н-ізоіндол-1-іл}оцтової кислоти; 4-(4-піридиніл)-6-(7Н-піроло[2,3-d]піримідин-4-іл)хіноліну; 6-[4-(4-піридиніл)-6-хінолініл]-1,3-дигідро-2Н-імідазо[4,5-b]піридин-2-ону; 6-[4-(4-піридиніл)-6-хінолініл]-[1,3]оксазоло[4,5-b]піридин-2(3Н)-ону; 6-(1Н-піразоло[3,4-b]піридин-5-іл)-4-(4-піридиніл)хіноліну; 4-(4-піридиніл)-6-(1Н-[1,2,3]триазоло[4,5-b]піридин-6-іл)хіноліну; 6-(1Н-імідазо[4,5-b]піридин-6-іл)-4-(4-піридиніл)хіноліну; 6-(1-оксидо-3-піридиніл)-4-(4-піридиніл)хіноліну; 4-(4-піридиніл)-6-(1Н-піроло[3,2-b]піридин-6-іл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-1Н-піразоло[3,4-b]піридин-3-аміну; 6-(3-метил-1Н-піразоло[3,4-b]піразин-5-іл)-4-(4-піридиніл)хіноліну; 2-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-1H-піразоло[3,4-b]піридин-3-іл}пропанаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-1Н-піразоло[3,4-b]піридин-3-іл}ацетаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-1Н-піразоло[3,4-b]піридин-3-іл}метансульфонаміду; 2-(метилокси)-N-{5-[4-(4-піридиніл)-6-хінолініл]-1Н-піразоло[3,4-b]піридин-3-іл}ацетаміду; 6-піразоло[1,5-а]піримідин-6-іл-4-(4-піридиніл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразоло[3,4-b]піридин-3-ону; 6-(1-метил-1Н-піроло[3,2-b]піридин-6-іл)-4-(4-піридиніл)хіноліну; 6-(3-метил-1Н-піразоло[3,4-b]піридин-5-іл)-4-(4-піридиніл)хіноліну; 3-[6-(1Н-піразоло[3,4-b]піридин-5-іл)-4-хінолініл]бензолсульфонаміду; 7-[4-(4-піридиніл)-6-хінолініл]-2Н-піридо[3,2-b][1,4]оксазин-3(4Н)-ону; 4-[4-(4-піридиніл)-6-хінолініл]-1,3-дигідро-2Н-піроло[2,3-b]піридин-2-ону; 2-аміно-N, N-диметил-5-[2-метил-4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-5-[8-фтор-4-(піридиніл)-6-хінолініл]-N, N-диметил-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-[8-метил-4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-5-[7-фтор-4-(4-піридиніл)-6-хінолініл]-N, N-диметил-3-піридинсульфонаміду; 5-[5-фтор-4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[7-метил-4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[5-метил-4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 13 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 4-(4-піридиніл)-6-[5-(трифторметил)-3-піридиніл]хіноліну; 4,6-ди-4-піридинілхіноліну; 6-(3-піридиніл)-4-(4-піридиніл)хіноліну; 6-(2-піридиніл)-4-(4-піридиніл)хіноліну; 6-(2,1,3-бензоксадіазол-5-іл)-4-(4-піридиніл)хіноліну; 6-(2,1,3-бензотіадіазол-5-іл)-4-(4-піридиніл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразол-3-ону; 2-етил-6-[4-(4-піридиніл)-6-хінолініл]-4(1Н)-піримідинону; 7-[4-(4-піридиніл)-6-хінолініл]-2-хіноксалінолу; 2-(4-морфолініл)-7-[4-(4-піридиніл)-6-хінолініл]хіноксаліну; 4-(4-морфолініл)-6-[4-(4-піридиніл)-6-хінолініл]хіназоліну; 1-феніл-5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразол-3-ону; 1-(3-метилфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразол-3-ону; 1-(3-хлорфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразол-3-ону; 1-метил-5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3Н-піразол-3-ону; N-(2,4-дифторфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 6-(1Н-індол-5-іл)-4-(4-піридиніл)хіноліну; 6-(1Н-індол-6-іл)-4-(4-піридиніл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-1,3-дигідро-2Н-індол-2-ону; 6-[4-(4-піридиніл)-6-хінолініл]-1,3-дигідро-2Н-індол-2-ону; 7-[4-(4-піридиніл)-6-хінолініл]-4-(1Н)-хіназолінону; 6-[4-(4-піридиніл)-6-хінолініл]-4-(1Н)-хіназолінону; 6-[4-(4-піридиніл)-6-хінолініл]-1,2-бензизотіазол-3(2Н)-он 1,1-діоксиду; 6-[4-(4-піридиніл)-6-хінолініл]-1,8-нафтиридин-2(1Н)-ону; 6-(1,3-бензоксазол-5-іл)-4-(4-піридиніл)хіноліну; 7-[4-(4-піридиніл)-6-хінолініл]-1,4-дигідропіридо[2,3-b]піразин-2,3-діону; 3-аміно-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинкарбоксаміду; 5-[4-(4-піридиніл)-6-хінолініл]-3-піридинаміну; 4-[4-(4-піридиніл)-6-хінолініл]тієно[2,3-с]піридин-2-карбоксаміду; метил 4-[4-(4-піридиніл)-6-хінолініл]-1Н-піроло[2,3-с]піридин-2-карбоксилату; 4-[4-(4-піридиніл)-6-хінолініл]-1Н-піроло[2,3-с]піридин-2-карбоксаміду; 6-(1Н-бензимідазол-2-іл)-4-(4-піридиніл)хіноліну; 6-(1Н-імідазо[4,5-с]піридин-2-іл)-4-(4-піридиніл)хіноліну; 6-(1Н-імідазо[4,5-b]піридин-2-іл)-4-(4-піридиніл)хіноліну; 6-(1Н-пурин-8-іл)-4-(4-піридиніл)хіноліну; 6-імідазо[1,2-а]піридин-6-іл-4-(4-піридиніл)хіноліну; 6-імідазо[1,2-а]піримідин-6-іл-4-(4-піридиніл)хіноліну; 1-{6-[4-(4-піридиніл)-6-хінолініл]імідазо[1,2-а]піридин-3-іл}-1-пропанону; 6-(4-піридазиніл)-4-(4-піридиніл)хіноліну; 1-{6-[4-(4-піридиніл)-6-хінолініл]імідазо[1,2-а]піридин-3-іл}-1-пропанолу; 4-(1-піперидиніл)-6-(1Н-піразоло[3,4-b]піридин-5-іл)хіноліну; 4-(4-морфолініл)-6-(1Н-піразоло[3,4-b]піридин-5-іл)хіноліну; 4-(4-метил-1-піперазиніл)-6-(1Н-піразоло[3,4-b]піридин-5-іл)хіноліну; 4-(4-піридазиніл)-6-(1Н-піроло[2,3-b]піридин-5-іл)хіноліну; 6-(1Н-імідазо[4,5-b]піридин-6-іл)-4-(1-піперидиніл)хіноліну; 6-(1Н-імідазо[4,5-b]піридин-6-іл)-4-(4-морфолініл)хіноліну; 2-аміно-5-{4-[3-(аміносульфоніл)феніл]-6-хінолініл}-N, N-диметил-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-[4-(2-метил-4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-5-(4-{3-[(диметиламіно)сульфоніл]фенілу}-6-хінолініл)-N, N-диметил-3піридинсульфонаміду; 2-аміно-N, N-диметил-5-[4-(4-піридазиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-[4-(1Н-піразол-4-іл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-(4-феніл-6-хінолініл)-3-піридинсульфонаміду; 2-аміно-N, N-диметил-5-[4-(1Н-піразол-3-іл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-5-[4-(2,6-диметил-4-піридиніл)-6-хінолініл]-N, N-диметил-3-піридинсульфонаміду; 2-аміно-5-(4-{3-[(аміносульфоніл)метил]фенілу}-6-хінолініл)-N, N-диметил-3піридинсульфонаміду; 2-аміно-5-[4-(3-ціанофеніл)-6-хінолініл]-N, N-диметил-3-піридинсульфонаміду; 2-аміно-5-{4-[5-(аміносульфоніл)-3-піридиніл]-6-хінолініл}-N, N-диметил-3піридинсульфонаміду; 14 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 5,5-(4,6-хіноліндиїл)ди(3-піридинсульфонаміду); 2-аміно-N, N-диметил-5-[4-(3-{[(1-метилетил)аміно]сульфоніл}феніл)-6-хінолініл]-3піридинсульфонаміду; 2-аміно-N, N-диметил-5-(4-{3-[(метиламіно)сульфоніл]фенілу}-6-хінолініл)-3піридинсульфонаміду; 2-аміно-N, N-диметил-5-{4-[6-(4-метил-1-піперазиніл)-3-піридиніл]-6-хінолініл}-3піридинсульфонаміду; 5-[4-(3-ціанофеніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(2-метил-4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(4-піридазиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-{4-[6-(4-метил-1-піперазиніл)-3-піридиніл]-6-хінолініл}-3-піридинсульфонаміду; 5-[4-(2,6-диметил-4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(1Н-піразол-4-іл)-6-хінолініл]-3-піридинсульфонаміду; 5-(4-{3-[(диметиламіно)сульфоніл]феніл}-6-хінолініл)-3-піридинсульфонаміду; 5-[4-(1-метил-1Н-піразол-4-іл)-6-хінолініл]-3-піридинсульфонаміду; 5-{4-[2-(4-морфолінілметил)феніл]-6-хінолініл}-3-піридинсульфонаміду; 5-{4-[2-(4-морфолінілкарбоніл)феніл]-6-хінолініл}-3-піридинсульфонаміду; 5-{4-[2-(4-морфолініл)феніл]-6-хінолініл}-3-піридинсульфонаміду; 4-(4-піридиніл)-3,4-дигідро-6,6'-біхінолін-2(1Н)-ону; 6-[4-(4-піридиніл)-6-хінолініл]-3,4-дигідро-1,8-нафтиридин-2(1Н)-ону; 2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбальдегіду; {2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}метилацетату; 5-[4-(4-піридиніл)-6-хінолініл]-2,3-піридиндіаміну; 2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбоксаміду; 6-[4-(4-піридиніл)-6-хінолініл]піридо[2,3-d]піримідин-4(1Н)-ону; 5-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1,2-дигідро-3Н-піразол-3-ону; 7-[4-(4-піридиніл)-6-хінолініл]піридо[3,2-d]піримідин-4(1Н)-ону; 6-[5-(1Н-піразол-5-іл)-3-піридиніл]-4-(4-піридиніл)хіноліну; N-(2,4-дифторфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбоксаміду; 6-[2-(метилокси)-4-піридиніл]-4-(4-піридиніл)хіноліну; 6-[6-(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; 4-[4-(4-піридиніл)-6-хінолініл]-2-піридинолу; 6-[2-(метилокси)-5-піримідинил]-4-(4-піридиніл)хіноліну; {6-[4-(4-піридиніл)-6-хінолініл]-2-піридиніл}метанолу; 6-(2-хлор-4-піридиніл)-4-(4-піридиніл)хіноліну; 4-(4-піридиніл)-6-(5-піримідинил)хіноліну; 5-[4-(4-піридиніл]-6-хінолініл]-2(1Н)-піримідинону; 6-[2,6-біс(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[6-(4-метил-1-піперазиніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[6-(4-морфолініл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-(6-хлор-3-піридиніл)-4-(4-піридиніл)хіноліну; 6-[6-(етилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; N, N-диметил-3-({5-[4-(4-піридиніл)-6-хінолініл]-2-піридиніл}окси)-1-пропанаміну; 5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбоксаміду; метил 5-[4-(4-піридиніл)-6-хінолініл]-2-піридинкарбоксилату; N-{5-[4-(4-піридиніл)-6-хінолініл]-2-піридиніл}ацетаміду; N-[2-(4-морфолініл)етил]-5-[4-(4-піридиніл)-6-хінолініл]-2-піридинаміну; 6-[6-(1-піперазиніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[5-(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-(6-фтор-3-піридиніл)-4-(4-піридиніл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-2-піримідинкарбонітрилу; 6-[2-(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; 5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбонітрилу; 6-[6-(метилокси)-2-піридиніл]-4-(4-піридиніл)хіноліну; 6-[5-(4-морфолінілкарбоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[4-(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[5-(4-морфолінілсульфоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 7-[4-(4-піридиніл)-6-хінолініл]-2,3-дигідро[1,4]діоксино[2,3-b]піридину; 5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-(метилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбальдегіду; 15 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 6-(4-хлор-3-піридиніл)-4-(4-піридиніл)хіноліну; 4-(4-піридиніл)-6-[5-(1Н-тетразол-5-іл)-3-піридиніл]хіноліну; N-метил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N, N-диметил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 6-[4-метил-6-(метилокси)-3-піридиніл]-4-(4-піридиніл)хіноліну; N-{4-метил-5-[4-(4-піридиніл)-6-хінолініл]-2-піридиніл}ацетаміду; 6-(4-метил-3-піридиніл)-4-(4-піридиніл)хіноліну; 6-[5-(1,3,4-оксадіазол-2-іл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 2-аміно-N-(4-піридинілметил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N, N-діетил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(4-піридиніл)-6-хінолініл]-3-(1-піролідинілсульфоніл)-2-піридинаміну; 2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-N-[2-(1-піролідиніл)етил]-3-піридинсульфонаміду; 6-[6-(метилсульфоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 2-аміно-N-(фенілметил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-(2-гідроксіетил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 1-({2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}сульфоніл)-4-піперидинолу; 2-аміно-N-(2-аміноетил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 6-[5-(метилтіо)-3-піридиніл]-4-(4-піридиніл)хіноліну; 6-[5-(метилсульфоніл)-3-піридиніл]-4-(4-піридиніл)хіноліну; 2-аміно-N-(2-гідроксіетил)-N-метил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-циклопропіл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2-аміно-N-1,3-бензодіоксол-5-іл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N, N-діетил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 1-({5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}сульфоніл)-4-піперидинолу; 4-(4-піридиніл)-6-[5-(1-піролідинілсульфоніл)-3-піридиніл]хіноліну; N-(2-гідроксіетил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-(фенілметил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 5-[4-(4-піридиніл)-6-хінолініл]-N-[2-(1-піролідиніл)етил]-3-піридинсульфонаміду; 6-{5-[(4-метил-1-піперазиніл)сульфоніл]-3-піридиніл}-4-(4-піридиніл)хіноліну; N-циклопропіл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-[2-(метилокси)етил]-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-феніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-1,3-бензодіоксол-5-іл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-(3-піридинілметил)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-2-піридиніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-(2-хлорфеніл)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-циклогексил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-[2-(метилокси)феніл]-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 2,4-дифтор-N-{5-[4-(4-піридиніл]-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 1-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-імідазол-4-сульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-тіофенсульфонаміду; 3,5-диметил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-4-ізоксазолсульфонаміду; 3,4-біс(метилокси)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1-пропансульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}циклопропансульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду й 1-феніл-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}метансульфонаміду; 5-{4-[3-хлор-4-(метилокси)феніл]-6-хінолініл}-3-піридинсульфонаміду; 5-{4-[3-(аміносульфоніл)феніл]-6-хінолініл}-3-піридинсульфонаміду; 5-{4-[1-(2-гідроксіетил)-1Н-піразол-4-іл]-6-хінолініл}-3-піридинсульфонаміду; N-(циклопропілсульфоніл)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}циклопропансульфонаміду; N-(2,4-дифторфеніл)-5-[4-(1-етил-1Н-піразол-4-іл)-6-хінолініл]-3-піридинсульфонаміду; N-метил-N-феніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; N-(2,4-дифторфеніл)-5-(4-{1-[2-(диметиламіно)етил]-1Н-піразол-4-іл}-6-хінолініл)-3піридинсульфонаміду; N-(2,4-дифторфеніл)-5-[4-(4-ізохінолініл)-6-хінолініл]-3-піридинсульфонаміду; N-феніл-N'-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}сечовини; 2-{4-[6-(5-{[(2,4-дифторфеніл)аміно]сульфоніл}-3-піридиніл)-4-хінолініл]-1Н-піразол-1 16 UA 104408 C2 5 10 1520 25 30 35 40 45 50 55 іл}ацетаміду; N-{5-[4-(1-метил-1Н-піразол-4-іл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 4-(4-піридиніл)-3,6'-біхіноліну; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензаміду; 5-[4-(1-бензофуран-2-іл)-6-хінолініл]-N-(2,4-дифторфеніл)-3-піридинсульфонаміду; 6-[5-(1Н-піразол-4-іл)-3-піридиніл]-4-(4-піридиніл)хіноліну; N, N-діетил-2-оксо-5-[4-(4-піридиніл)-6-хінолініл]-1,2-дигідро-3-піридинсульфонаміду; 4-ціано-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-метил-N-феніл-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинкарбоксаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}етансульфонаміду; 4-(метилокси)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 4-(1-метилетил)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинаміну; 4-фтор-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(1-етил-1Н-піразол-4-іл)-6-хінолініл]-3-піридиніл}-2,4-дифторбензолсульфонаміду; 1-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-піразол-3-сульфонаміду; 2-фтор-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-аміно-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-метил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-ціано-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2-метил-5-нітро-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-піразол-4-сульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-метил-5-нітробензолсульфонаміду; N-{2-хлор-5-[4-(1-етил-1Н-піразол-4-іл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридазиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 3-нітро-N-{5-[4-(4-піридиніл)-6-хінолініл]-2-піридиніл}бензолсульфонаміду; 2-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2,4-дифтор-N-{5-[4-(4-піридазиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 5-фтор-2-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3-нітробензолсульфонаміду; N-{2-хлор-5-[4-(2-метил-4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-метилбензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3-фторбензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-тіофенсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}циклопропансульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-5-фтор-2-метилбензолсульфонаміду; N-(2-хлор-5-{4-[3-(метилсульфоніл)феніл]-6-хінолініл}-3-піридиніл)бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3,5-диметил-4-ізоксазолсульфонаміду; 2,4-дифтор-N-(5-{4-[3-(метилсульфоніл)феніл]-6-хінолініл}-3-піридиніл)бензолсульфонаміду; 2,4-дифтор-N-{5-[4-(2-метил-4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 3-(метилокси)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-[4-(ціанометил)феніл]-5-[4-(4-піридиніл)-6-хінолініл]-3-піридинсульфонаміду; 3-фтор-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-(метилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2,4-дифторбензолсульфонаміду; 3-нітро-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(1-бензофуран-2-іл)-6-хінолініл]-3-піридиніл}-2,4-дифторбензолсульфонаміду; 3-ціано-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-4-(трифторметил)бензолсульфонаміду; N-{2-гідрокси-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3-(трифторметил)бензолсульфонаміду; N-{5-[4-(1-бензофуран-2-іл)-6-хінолініл]-2-хлор-3-піридиніл}бензолсульфонаміду; N-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензаміду; 2,4-дифтор-N-{5-[4-(4-фторфеніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2,4-дифтор-N-[5-(4-піразоло[1,5-а]піридин-3-іл-6-хінолініл)-3-піридиніл]бензолсульфонаміду; 2,4-дифтор-N-{5-[4-(2-фторфеніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2,4-дифтор-N-(5-{4-[4-(трифторметил)феніл]-6-хінолініл}-3-піридиніл)бензолсульфонаміду; 2,4-дифтор-N-(5-{4-[4-(метилсульфоніл)феніл]-6-хінолініл}-3-піридиніл)бензолсульфонаміду; 17 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 метил 1-метил-5-[({5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}аміно)сульфоніл]-1Н-пірол-2карбоксилату; 5-бром-2-(метилокси)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 5-(5-ізоксазоліл)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-тіофенсульфонаміду; 2,4-дифтор-N-{5-[4-(3-фторфеніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 2,4-дифтор-N-(5-{4-[3-(трифторметил)феніл]-6-хінолініл]-3-піридиніл)бензолсульфонаміду; 2-хлор-4-ціано-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-[5-(4-{3-[(диметиламіно)сульфоніл]феніл}-6-хінолініл)-3-піридиніл]-2,4-дифторбензолсульфонаміду; N-[5-(4-{4-[(диметиламіно)сульфоніл]фенілу}-6-хінолініл)-3-піридиніл]-2,4-дифторбензолсульфонаміду; 1,2-диметил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-імідазол-4-сульфонаміду; 3-[6-(5-{[(2,4-дифторфеніл)сульфоніл]аміно}-3-піридиніл)-4-хінолініл]бензаміду; 4-[6-(5-{[(2,4-дифторфеніл)сульфоніл]аміно}-3-піридиніл)-4-хінолініл]бензаміду; N-{4-[6-(5-{[(2,4-дифторфеніл)сульфоніл]аміно}-3-піридиніл)-4-хінолініл]феніл}ацетаміду; N-{3-[6-(5-{[(2,4-дифторфеніл)сульфоніл]аміно}-3-піридиніл)-4-хінолініл]феніл}ацетаміду; 6-(4-морфолініл)-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3-піридинсульфонаміду; 2-фтор-4-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-фурансульфонаміду; 1,3-диметил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-піразол-4-сульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-(трифторметил)бензолсульфонаміду; N-{2-(метилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}циклогексансульфонаміду; N-[5-(4-циклопентил-6-хінолініл)-2-(метилокси)-3-піридиніл]бензолсульфонаміду; 2,5-дихлор-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; 3-ціано-4-фтор-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1-піролідинсульфонаміду; (5Z)-5-({5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}метиліден)-1,3-тіазолідин-2,4-діону; N-{2-(метилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}циклопропансульфонаміду; N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-2-піридинсульфонаміду; 1,2-диметил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-імідазол-5-сульфонаміду; 1-метил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-3-(трифторметил)-1Н-піразол-4сульфонаміду; 1,3,5-триметил-N-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}-1Н-піразол-4-сульфонаміду; N-{2-(етилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N, N-диметил-N'-{5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}сульфаміду; N-{2-хлор-5-[4-(4-піридазиніл)-6-хінолініл]-3-піридиніл}-2,4-дифторбензолсульфонаміду; N-{2-хлор-1-оксидо-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{6-метил-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}бензолсульфонаміду; N-{2-(метилокси)-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}метансульфонаміду; N-{2-хлор-5-[4-(4-піридиніл)-6-хінолініл]-3-піридиніл}метансульфонаміду; 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-піридазиніл)-6-хінолініл]-3піридиніл}бензолсульфонаміду; та/або їхніх фармацевтично прийнятних солей. Даний винахід відноситься також до способу лікування раку, який включає спільне введення суб'єктові, що потребує цього, ефективної кількості сполуки формули (I) та її фармацевтично прийнятної солі й щонайменше одного антинеопластичного агента, такого як щонайменше один агент, вибраний з групи, що складається з агентів проти мікротрубочок, координаційних комплексів платини, алкілуючих агентів, антибіотичних агентів, інгібіторів топоізомерази II, антиметаболітів, інгібіторів топоізомерази I, гормонів і гормональних аналогів, інгібіторів шляху сигнальної трансдукції, інгібіторів ангіогенезу нерецепторної тирозинкінази, імунотерапевтичних агентів, проапоптотичних агентів і інгібіторів передачі сигналів клітинного циклу. Даний винахід відноситься також до способу лікування раку, який включає спільне введення суб'єктові, що потребує цього, ефективної кількості сполуки формули (I) і/або її фармацевтично прийнятної солі й щонайменше одного інгібітору шляху сигнальної трансдукції, як-от агент, вибраний з групи, що складається з інгібітору рецепторної тирозинкінази, інгібітору нерецепторної тирозинкінази, блокатора SH2/SH3 домену, інгібітору серин/треонінкінази, інгібітору фосфотидилінозит-3-кінази, інгібітору передачі сигналів міоїнозиту й інгібітору Ras онкогену. Використовуваний у даному описі термін "ефективна кількість" означає кількість лікарського засобу або фармацевтичного агента, яка викликатиме біологічну або медичну відповідну 18 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 реакцію тканини, системи, тварини або людини, які має на увазі, наприклад, дослідник або лікар. Крім того, термін "терапевтично ефективна кількість" означає будь-яку кількість, яка, порівняно до відповідного суб'єкту, який не отримує таку кількість, приводить до покращуваного лікування, зцілення, запобігання або полегшення захворювання, розладу або побічного ефекту, або зниження швидкості розвитку захворювання або розладу. Даний термін охоплює також кількості, ефективні для посилення нормальної фізіологічної функції. Сполуки формули (I) включаються у фармацевтичні композиції винаходу. Визначення Терміном "заміщений аміно", використовуваним у даному описі, позначається група NR30R40, де кожен R30 і R40 вибраний незалежно з групи, що включає водень, С 1-6алкіл, ацил, С3-7циклоалкіл, де щонайменше один з R30 і R40 не є воднем. Термін "ацил", використовуваний у даному описі, якщо не вказане інше, означає – С(О)(алкіл), –С(О)(циклоалкіл), –С(О)(арил) або –С(О)(гетероарил), де гетероарил і арил є необов'язково заміщеними. Термін "арил", використовуваний у даному описі, якщо не вказане інше, означає ароматичну вуглеводневу кільцеву систему. Кільцева система може бути моноциклічною або конденсуючою поліциклічною (наприклад, біциклічною, трициклічною та ін.). У різних варіантах здійснення моноциклічне арильне кільце є кільцем С5-С10 або С5-С7, або С5-С6, де число вказаних атомів вуглецю належить до атомів вуглецю, які утворюють кільцеву систему. Придатною арильною групою є С6 кільцева система, тобто фенільне кільце. В різних варіантах здійснення поліциклічним кільцем є біциклічна арильна група, де придатними біциклічними арильними групами є С8-С12 або С9-С10. Відповідною поліциклічною арильною групою є нафтильне кільце, яке має 10 атомів вуглецю. Термін "гетероарил", використовуваний у даному описі, якщо не вказане інше, означає ароматичну кільцеву систему, що містить атом(и) вуглецю і щонайменше один гетероатом. Гетероарил може бути моноциклічним або поліциклічним. Моноциклічна гетероарильна група може мати 1-4 гетероатоми в кільці, тоді як поліциклічний гетероарил може містити 1-10 гетероатомів. Поліциклічне гетероарильне кільце може містити конденсовані спіро або місточкові кільцеві сполуки, наприклад поліциклічним гетероарилом є біциклічний гетероарил. Біциклічні гетероарильні кільця можуть містити від 8 до 12 атомів. Моноциклічні гетероарильні кільця можуть містити від 5 до 8 атомів (атомів вуглецю й гетероатомів). Приклади гетероарильних груп включають, але не обмежуються ними, бензофуран, бензотіофен, фуран, імідазол, індол, ізотіазол, оксазол, піразин, піразол, піридазин, піридин, піримідин, пірол, хінолін, хіназолін, хіноксалін, тіазол і тіофен. Термін "моноциклічний гетероарил", використовуваний у даному описі, якщо не вказане інше, означає моноциклічне гетероарильне кільце, що містить 1-5 атомів вуглецю і 1-4 гетероатоми. Термін "алкілкарбокси", використовуваний у даному описі, якщо не вказане інше, означає групу -(CH2)nCOOR80, де R80 представляє водень або С1-6алкіл, n дорівнює 0-6. Термін "алкокси", використовуваний у даному описі, означає -О(алкіл), включаючи -ОСН3, ОСН2СН3 і -ОС(СН3)3, де алкіл є таким, як описано в даному описі. Термін "алкілтіо", використовуваний у даному описі, означає -S(алкіл), включаючи -SСН3, SСН2СН3, де алкіл є таким, як описано в даному описі. Термін "циклоалкіл", використовуваний у даному описі, якщо не вказане інше, означає неароматичний, ненасичений або насичений циклічний або поліциклічний С3-12 радикал. Приклади циклоалкільних і заміщених циклоалкільних замісників, використовуваних у даному описі, включають циклогексил, аміноциклогексил, циклобутил, аміноциклобутил, 4гідроксициклогексил, 2-етилциклогексил, пропіл-4-метоксициклогексил, 4-метоксициклогексил, 4-карбоксициклогексил, циклопропіл, аміноциклопентил і циклопентил. Термін "гетероциклоалкіл", використовуваний у даному описі, означає неароматичне ненасичене або насичене, моноциклічне або поліциклічне гетероциклічне кільце, що містить щонайменше один атом вуглецю і щонайменше один гетероатом. Приклади моноциклічних гетероциклічних кілець включають: піперидин, піперазин, піролідин і морфолін. Приклади поліциклічних гетероциклічних кілець включають хінуклідин. Термін "заміщений", використовуваний у даному описі, якщо не вказане інше, означає, що хімічний фрагмент, про який ідеться, має від одного до п'яти замісників, відповідно від одного до трьох замісників, вибраних з групи, що складається з: водню, галогену, С 1-6алкілу, аміно, сечовини, трифторметилу, -(CH2)nCOOH, С3-7циклоалкілу, заміщеного аміно, арилу, гетероарилу, арилалкілу, арилциклоалкілу, гетероарилалкілу, гетероциклоалкілу, ціано, гідроксилу, алкокси, алкілтіо, арилокси, ацилокси, ацилу, ациламіно, аміноацилу, ариламіно, 19 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 нітро, оксо -CO2R50, -SO2R70, -NR50SO2R70, NR50C(O)R75 і -CONR55R60, де R50 і R55 кожен незалежно вибраний з водню, алкілу і С 3-7циклоалкілу; R55 і R60 можуть необов'язково утворювати гетероциклоалкільне кільце; n дорівнює 0-6; R75 вибраний з групи, що складається з: С1-6алкілу, С3-7циклоалкілу, заміщеного С3-7циклоалкілу, арилу, заміщеного арилу, гетероарилу, заміщеного гетероарилу, аміно, заміщеного аміно, ариламіно, C 3-6гетероциклоалкілу, алкокси, арилокси й заміщеного C 3-6гетероциклоалкілу; кожен R60 і R70 незалежно вибраний з групи, що складається з: С 1-6алкілу, С3-7циклоалкілу, заміщеного C36гетероциклоалкілу, C3-6-гетероциклоалкілу, галогену, аміно, заміщеного аміно, ариламіно, трифторметилу, ціано, гідроксилу, алкокси, оксо, -(CH2)nCOOH, арилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С1-6алкілу, С3-7циклоалкілу, галогену, аміно, заміщеного аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH, або гетероарилу, необов'язково конденсованого з п'ятичленним кільцем або заміщеного однією-п'ятьма групами, вибраними з групи, що складається з С 1-6алкілу, С3-7циклоалкілу, галогену, аміно, трифторметилу, ціано, гідроксилу, алкокси, оксо або -(CH2)nCOOH. Термін "заміщений", коли він зустрічається у визначенні R60, R70, R75, "ариламіно" й "арилокси", означає, що обговорюваний хімічний фрагмент має від одного до п'яти замісників, відповідно від одного до трьох, вибраних з групи, що складається з: водню, С 1-6алкілу, галогену, трифторметилу, -(CH2)nCOOH, аміно, заміщеного аміно, ціано, гідроксилу, алкокси, алкілтіо, арилокси, ацилокси, ацилу, ациламіно й нітро, n дорівнює 0-6. Термін "ацилокси", використовуваний у даному описі, означає -ОС(О)алкіл, де алкіл є таким, як описано в даному описі. Приклади ацилокси замісників, використовуваних у даному описі, включають: -ОС(О)СН3, -ОС(О)СН(СН3)2 і -ОС(О)(СН2)3СН3. Термін "ациламіно", використовуваний у даному описі, якщо не вказане інше, означає N(H)C(O) алкіл, -N(H)C(O)(циклоалкіл), де алкіл є таким, як описано в даному описі. Приклади N-ациламіно замісників, використовуваних у даному описі, включають -N(H)(C(O)CH3, N(H)C(O)CH(CH3)2 і -N(H)C(O)(CH2)3CH3. Термін "аміноацил", використовуваний у даному описі, означає -C(O)N(алкіл)n, C(O)N(циклоалкіл)n, де алкіл є таким, як описано в даному описі, n дорівнює 1-2. Термін "арилокси", використовуваний у даному описі, означає -О(арил), -О(заміщений арил), -О(гетероарил) або -О(заміщений гетероарил). Термін "ариламіно", використовуваний у даному описі, означає -NR80(арил), NR80(заміщений арил), –NR80(гетероарил) або NR80(заміщений гетероарил), де R80 є Н, С16алкіл або С3-7циклоалкіл. Термін "гетероатом", використовуваний у даному описі, означає кисень, азот або сірку. Термін "галоген", використовуваний у даному описі, означає замісник, вибраний з броміду, йодиду, хлориду і фториду. Термін "алкіл" і його похідні й у всіх вуглецевих ланцюгах, використовуваний у даному описі, включаючи алкільні ланцюги, визначувані терміном “(CH 2)n" “(CH2)m" і аналогічними, означає лінійний або розгалужений, насичений або ненасичений вуглеводневий ланцюг, і, якщо не вказане інше, вуглецевий ланцюг містить від 1 до 12 атомів вуглецю. Термін "заміщений алкіл", використовуваний у даному описі, означає алкільну групу, заміщену одним-шістьма замісниками, вибраними з групи, що складається з галогену, трифторметилу, алкілкарбокси, аміно, заміщеного аміно, ціано, гідроксилу, алкокси, алкілтіо, арилокси, ацилокси, ацилу, ациламіно, карбамату, сечовини, сульфонамату, С37циклогетероалкілу, С3-7циклоалкілу й нітро. Приклади алкільних і заміщених алкільних замісників, використовуваних у даному описі, включають: -CH3, -CH2-CH3, -CH2-CH2-CH3, -СН(СН3)2, -CH2-CH2-С(СН3)3, -CH2-CF3, -СС-С(СН3)3, -ССCH2-ОН, циклопропілметил, -CH2-С(СН3)2-CH2-NH2 -СС-С6Н5, -СС-С(СН3)2-ОН, -CH2-СН(ОН)СН(ОН)-СН(ОН)-СН(ОН)-CH2-ОН, піперидинілметил, метоксифенілетил, -С(СН3)3, -(СН2)3-CH3, CH2-СН(СН3)2, -СН(CH3)-CH2-СН3, -СН=CH2 і -СС-CH3. Термін "лікування" і його похідні, використовуваний у даному описі, означає профілактичну й лікувальну терапію. Профілактична терапія означає застосування заходів для захисту суб'єкта (пацієнта) від хвороби, до якої він або вона схильний або може бути схильний. Вона називається також превентивним або профілактичним лікуванням. Терміном "спільне введення" і його похідними, використовуваними в даному описі, позначається або одночасне введення, або будь-яким чином роздільне послідовне введення інгібуючої PI3 кіназу сполуки, описаної в даному описі, й додаткового активного інгредієнта або інгредієнтів. Термін додатковий активний інгредієнт або інгредієнти, використовуваний у даному 20 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 описі, охоплює будь-яку сполуку або терапевтичний агент, про який відомо або яка(ий) демонструє сприятливі властивості, коли вводиться пацієнтові, що потребує лікування. Відповідно, якщо введення не є одночасним, сполуки вводяться близько за часом одну за одною. Крім того, не має значення, чи вводяться сполуки в тій самій дозованій формі, наприклад, одна сполука може вводитися місцево, а інша сполука може вводитися орально. Термін "сполуки", використовуваний у даному описі, охоплює всі ізомери сполуки. Приклади таких ізомерів включають енантіомери, таутомери, ротамери. У формулах (V) -(X), коли між двома атомами показаний "пунктирний" зв'язок, це означає, що такий зв'язок може бути або одинарним, або подвійним. Кільцева система, що містить такі зв'язки, може бути ароматичною або неароматичною. Деякі сполуки, представлені в даному описі, можуть містити один або більше хіральних атомів або іншим чином можуть бути здатні існувати у вигляді двох енантіомерів або двох або більше діастереоізомери. Відповідно, сполуки даного винаходу охоплюють суміші енантіомерів/ діастереоізомерів, а також і очищених енантіомерів/діастереоізомерів або енантіомерно/ діастереоізомерно збагачені суміші. Обсяг винаходу охоплює також індивідуальні ізомери сполук, представлених формулою I або II, наведеної вище, а також будь-які повністю або частково врівноважені їхні суміші. Даний винахід охоплює також індивідуальні ізомери сполук, представлених вищезгаданими формулами, у вигляді сумішей з їхніми ізомерами, в яких один або більше хіральних центрів інвертовані. Далі, прикладом можливого таутомера є оксо замісник замість гідрокси замісника. Як вказано вище, також мається на увазі, що всі таутомери й суміші таутомерів включені в обсяг сполук формули I або II. Сполуки формули (I) включаються у фармацевтичні композиції винаходу. Коли наявна СООН або -ОН група, можуть використовуватися фармацевтично прийнятні ефіри, наприклад метиловий, етиловий, півалоїлоксиметиловий і аналогічні для -СООН, і ацетат, малеат і аналогічні для -ОН, і дані ефіри відомі в даній галузі для модифікації характеристик розчинності або гідролізу, для використання у вигляді форм із сповільненим вивільненням або проліків. У даний час виявлено, що сполуки даного винаходу є інгібіторами фосфатоїноїзитид 3-кіназ PI3K, особливо PI3Kα. Коли фермент фосфатоїнозитид 3-кіназа (PI3K) інгібується сполукою даного винаходу, PI3K не здатний виявляти його ферментативні, біологічні й/або фармакологічні ефекти або дії. Відтак сполуки даного винаходу корисні при лікуванні аутоімунних захворювань, запальних захворювань, серцево-судинних захворювань, нейродегенеративних захворювань, алергії, астми, панкреатиту, недостатності багатьох органів, захворювань нирок, агрегації тромбоцитів, раку, рухливості сперми, відторгнення при трансплантації, відторгнення трансплантата й легеневих пошкоджень, особливо раку. Сполуки, відповідні формулі (I), є придатними для модуляції, особливо інгібування активності фосфатоїнозитид 3-кінази (PI3K), особливо фосфатоїнозитид 3-кінази (PI3Kα). Тому сполуки даного винаходу також корисні для лікування розладів, опосередкованих PI3K. Вказане лікування включає модуляцію, а саме інгібування або знижуюче регулювання, фосфатоїнозитид 3-кіназ. Відповідно, сполуки даного винаходу використовуються для одержання лікарського засобу для лікування розладів, вибраних із розсіяного склерозу, псоріазу, ревматоїдного артриту, системного червоного вовчаку, запального захворювання кишечнику, запалення легенів, тромбозу або інфекції/запалення головного мозку, такого як менінгіт або енцефаліт, хвороби Альцгеймера, хвороби Хантінгтона, травми ЦНС, тромбозу або удару або ішемічних станів, серцево-судинних захворювань, таких як атеросклероз, гіпертрофія серця, сердечна міоцитна дисфункція, підвищений кров'яний тиск або звуження судин. Відповідно, сполуки формули (I) корисні для лікування аутоімунних або запальних захворювань, таких як розсіяний склероз, псоріаз, ревматоїдний артрит, системний червоний вовчак, запальне захворювання кишечнику, запалення легенів, тромбоз або інфекція/запалення головного мозку, таких як менінгіт або енцефаліт. Відповідно, сполуки формули (I) корисні для лікування нейродегенеративних захворювань, що включають розсіяний склероз, хворобу Альцгеймера, хворобу Хантінгтона, травми ЦНС, удар або ішемічні стани. Сполуки формули (I) корисні, відповідно, для лікування серцево-судинних захворювань, таких як атеросклероз, гіпертрофія серця, дисфункція сердечних міоцитів, підвищений кров'яний тиск або звуження судин. Сполуки формули (I) корисні, відповідно, для лікування хронічних обструктивних захворювань легенів, анафілактичного шоку, фіброзу, псоріазу, алергічних захворювань, астми, удару, ішемічних станів, ішемії-реперфузії, агрегації/активації тромбоцитів, атрофії/гіпертрофії скелетних м'язів, рекрунтменту лейкоцитів у ракових тканинах, ангіогенезу, інвазивного 21 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 метастазу, зокрема меланоми, саркоми Капоші, гострих і хронічних бактерійних і вірусних інфекцій, сепсису, відторгнення при трансплантації, відторгнення трансплантата, гломерулосклерозу, гломерулонефриту, прогресуючого ренального фіброзу, ендотеліальних і епітеліальних пошкоджень у легенях, і запалення легеневих дихальних шляхів. Оскільки фармацевтично активні сполуки даного винаходу є активними як інгібітори PI3 кінази, особливо сполуки, які інгібують PI3Кα, або селективно, або в кон'югації з однією або більш PI3Кδ, PI3Кβ і/або PI3Кγ, вони виявляють терапевтичну корисність при лікуванні раку. Відповідно, винахід відноситься до способу лікування раку у ссавців, включаючи людину, де рак вибраний із: гліом головного мозку, гліобластом, лейкемій, синдрому Баннайана-Зонана, хвороби Коудена, хвороби Лермітта-Дюккло, раку грудей, запального раку грудей, пухлини Вільма, саркоми Юїнга, рабдоміосаркоми, епендимоми, медулобластоми, раку ободової кишки, раку голови й шиї, раку нирок, раку легенів, раку печінки, меланоми, раку яєчників, раку підшлункової залози, раку простати, саркоми, остеосаркоми, крупноклітинної пухлини кісток і раку щитовидної залози. Винахід відноситься, відповідним чином, до способу лікування раку у ссавців, включаючи людину, де рак вибраний з: лейкемії лімфобластних Т-клітин, хронічної мієлогенної лейкемії, хронічної лімфоцитарної лейкемії, лейкемії волосяних клітин, гострої лімфобластомної лейкемії, гострої мієлогенної лейкемії, хронічної нейтрофільної лейкемії, гострої лейкемії лімфобластомних Т-клітин, плазмацитоми, лейкемії імунобластомних крупних клітин, лейкемії клітин мантії, множинної мієломної мегакаріобластомної лейкемії, розсіяної мієломи, гострої мегакаріоцитної лейкемії, промієлоцитарної лейкемії й еритролейкемії. Відповідно, винахід відноситься до способу лікування раку у ссавців, включаючи людину, де рак вибраний із: злоякісної лімфоми, лімфоми Ходжкіна, неходжкінської лімфоми, лімфоми лімфобластомних Т-клітин, лімформи Буркіттса й фолікулярної лімфоми. Відповідно, винахід відноситься до способу лікування раку у ссавців, включаючи людину, де рак вибраний з: нейробластоми, раку сечового міхура, уротеліального раку, раку легенів, раку вульви, цервікального раку, раку ендометрію, ренального раку, мезотеліоми, езофагеального раку, раку слинних залоз, гепатоклеточного раку, раку шлунку, носоглоткового раку, щокового раку, раку ротової порожнини, GIST (стромальної пухлини шлунку) і тестикулярного раку. Коли сполука формули (I) вводиться для лікування раку, термін "спільне введення" і його похідні, використовуваний у даному описі, означає або одночасне введення, або будь-яким чином роздільне послідовне введення інгібуючої PI3 кіназу сполуки, описаної вище, і додаткового активного інгредієнта або інгредієнтів, про які відомо, що вони корисні при лікуванні раку, включаючи хіміотерапію й лікування опроміненням. Термін додатковий активний інгредієнт або інгредієнти, використовуваний у даному описі, охоплює будь-яку сполуку або терапевтичний агент, про якого відомо, що вона(він) демонструє або яка(ий) демонструє сприятливі властивості, коли вводиться пацієнтові, що потребує лікування раку. Переважно, якщо введення не є одночасним, сполуку вводять близько за часом одну за одною. Крім того, не має значення, чи вводять сполуку в тій самій дозованій формі, наприклад, одна сполука може вводитися місцево, а інша сполука може вводитися орально. У конкретному випадку будь-який антинеопластичний агент, який має активність проти сприйнятливої пухлини, що піддається лікуванню, може вводитися спільно при лікуванні раку в даному винаході. Приклади таких агентів можна знайти в публікації Cancer Principles and Practice of Oncology V.T. Devita and S. Hellman (editors), 6th edition (15 лютого 2001 р.), Lippincott Williams & Wilkins Publishers. Фахівець у даній галузі зможе розрізнити, які комбінації агентів будуть корисні, на підставі конкретних характеристик лікарських засобів і пухлин, про які йдеться. Конкретні антинеопластичні агенти, корисні в даному винаході, включають, але не обмежуються ними, агенти проти мікротрубочок, такі як дитерпеноїди й алкалоїди барвінку; координаційні комплекси платини; алкілуючі агенти, такі яказотистий іприт, оксазофосфорини, алкілсульфонати, нітрозосечовини й триазени; антибіотики, такі як антрацикліни, актиноміцини й блеоміцини; інгібітори топоізомерази II, такі як епіподофілотоксини; антиметаболіти, такі як пурин і аналоги піримідину, й антифолатні сполуки; інгібітори топоізомерази I, такі як камптотецини; гормони й гормональні аналоги; інгібітори шляхів сигнальної трансдукції; інгібітори нерецепторного тирозинкіназного ангіогенезу; імунотерапевтичні агенти; проапоптичні агенти й інгібітори передачі сигналу клітинного циклу. Прикладами додаткового активного інгредієнта або інгредієнтів (антинеопластичний агент) для застосування в комбінації або такими, що вводяться спільно з АКТ інгібуючими сполуками даного винаходу, є хіміотерапевтичні агенти. Агентами проти мікротрубочок або антимітотичними агентами є фазоспецифічні агенти, активні проти мікротрубочок пухлинних клітин під час фази М або мітозу клітинного циклу. 22 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклади агентів проти мікротрубочок включають, але не обмежуються ними, дитерпеноїди й алкалоїди барвінку. Дитерпеноїди, які виробляють з природних джерел, є фазоспецифічними протираковими агентами, які працюють у G2/M фазах клітинного циклу. Вважається, що дитерпеноїди стабілізують β-тубулінові субодиниці мікротрубочок шляхом зв'язування з даним білком. Розбирання білка, ймовірно, потім інгібується затриманим мітозом і подальшою загибеллю клітин. Приклади дитерпеноїдів включають, але не обмежуються ними, паклітаксел і його аналог доцетаксел. Паклітаксел, 13-складний ефір 5β,20-епокси-1,2α,4,7β,10β,13α-гекса-гідрокситакс-11-ен-9-он4,10-діацетат-2-бензоату з (2R, 3S)-N-бензоїл-3-фенілізосерином, є природним дитерпеноїдним продуктом, виділеним з дерева коротколистяного або американського тиса Taxus brevifolia, і є комерційно доступним у вигляді ін'єктованого розчину ТАКСОЛ®. Він є членом таксанового сімейства терпенів. Вперше він був виділений у 1971 році авторами Wani et al., J. Am. Chem. Soc., 93:2325. (1971), які охарактеризували його структуру за допомогою хімічного й рентгенокристалографічного методів. Один з механізмів його активності відноситься до здатності паклітакселу зв'язувати тубулін, інгібуючи, тим самим, ріст ракових клітин. Schiff et al., Proc. Natl, Acad. Sci. USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667 (1979); Kumar, J. Biol. Chem., 256: 10435-10441 (1981). Що стосується огляду синтезу й протиракової активності деяких похідних паклітакселу, см.: D.G.I. Kingston et al., Studies in Organic Chemistry vol. 26, під назвою "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds, (Elsevier, Амстердам, 1986) стор. 219-235. Паклітаксел був схвалений для клінічного застосування при лікуванні раку рефрактора яєчників у Сполучених Штатах (Markman et al., Yale Journal of Biology and Medicine. 64-583, 1991; McGuire et al., Ann. Intem. Med., 111:273, 1989) і для лікування раку грудей (Holmes et al., J. Nat.Cancer Inst., 83:1797, 1991). Він є потенційним кандидатом для лікування новоутворень на шкірі (Einzig et al., Proc. Am. Soc.Clin. Oncol. 20:46) і карцином голови й шиї (Forastire et al., Sem. Oncol. 20:56, 1990). Сполука виявляє також потенціал для лікування полікістозу нирок (Woo et al., Nature, 368:750, 1994), раку легенів і малярії. Лікування пацієнтів паклітакселом приводить у результаті до придушення кісткового мозку (множинні клітинні лінії, Ignoff, R.J. et al., Cancer Chemotherapy Pocket Quide, 1998), пов'язаного з тривалістю введення доз вище за порогову концентрацію (50 нМ) (Kearns, C.M. et al., Seminars in Oncology, 3(6) стор. 16-23, 1995). Доцетаксел, 13-ефір N-тре-бутилового ефіру (2R, 3S)-N-карбокси-3-фенілізосерину з тригідратом 5β-20-епокси-1,2α,4,7β,10β,13α-гексагідрокситакс-11-ен-9-он-4-ацетат-2-бензоату, комерційно доступний у вигляді ін'єктованого розчину як TAXОTERE®. Доцетаксел показаний для лікування раку грудей. Доцетаксел є напівсинтетичною похідною паклітакселу, q.v., отримуваною з використанням природного попередника, 10-деацетилбакатину III, екстрагованого з голок ягідного або європейського тиса. Дозою, лімітуючою токсичність доцетакселу, є нейтропенія. Алкалоїди барвінку є фазоспецифічними антинеопластичними агентами, що походять з рослини барвінок. Алкалоїди барвінку діють у М фазі (мітозу) клітинного циклу шляхом пов'язання специфічно з тубуліном. Згодом, зв'язана молекула тубуліну не здатна полімеризуватися в мікротрубочки. Вважається, що мітоз затримується в метафазі з подальшою загибеллю клітин. Приклади алкалоїдів барвінку включають, але не обмежуються ними, вінбластин, вінкристин і вінорелбін. Вінбластин, сульфат вінкалейкобластину, комерційно доступний як VELBAN® у вигляді ін'єктованого розчину. Хоча він, можливо, має призначення як ще однієї лінії терапії всіляких солідних пухлин, у першу чергу він показаний при лікуванні тестикулярного раку й різних лімфом, включаючи хворобу Ходжкіна й лімфоцитарної та гістіоцитарних лімфом. Мієлосупресія є показником дози, лімітуючої побічну дію вінбластину. Вінкристин, вінкалейкобластин, 22-оксосульфат, є комерційно доступним як ONCOVIN® у вигляді ін'єктованого розчину. Вінкристин показаний для лікування гострої лейкемії і знайдено також, що він корисний у лікувальних режимах при злоякісних лімфомах Ходжкіна й неходжкінських лімфомах. Алопеція й неврологічні ефекти є найбільш звичайною побічною дією вінкристину, й у меншій мірі має місце ефект мієлосупресії й запалення слизової оболонки шлунково-кишкового тракту. Вінорелбін, 3",4’-дидегідро-4’-деокси-C’-норвінкалейкобластин [R-(R*,R*)-2,3дигідроксибутандіоат (1:2)(сіль], комерційно доступний як ін'єктований розчин вінорелбінтартрату (NAVELBINE®), є напівсинтетичним алкалоїдом барвінку. Вінорелбін показаний як єдиний агент або в комбінації з іншими хіміотерапевтичними агентами, такими як цисплатин, при лікуванні різних солідних пухлин, зокрема, недрібноклітинного раку легенів, 23 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 прогресуючого раку грудей і гормональнорефракторного раку простати. Мієлосупресія є найбільш звичайним показником дози, лімітуючої побічну дію вінорелбіну. Координаційні комплекси платини є нефазоспецифічними протираковими агентами, які взаємодіють з ДНК. Платинові комплекси входять у пухлинні клітини, піддаються гідратації й утворюють внутрішньо- і міжниткові поперечні зв'язки з ДНК, викликаючи згубні для пухлини біологічні дії. Приклади координаційних комплексів платини включають, але не обмежуються ними, цисплатин і карбоплатин. Цисплатин, цис-діаміндихлорплатина, комерційно доступний у вигляді ін'єктованого розчину як PLATINOL®. Цисплатин перш за все показаний при лікуванні метастатичного тестикулярного раку й раку яєчників і прогресуючого раку сечового міхура. Побічними діями цисплатину, що обмежують вихідну дозу, є нефротоксичність, яка може регулюватися гідратацією й діурезом, і ототоксичність. Карбоплатин, діамін [1,1-циклобутандикарбоксилат(2-)-O, O"]платини, комерційно доступний як PARAPLATIN® у вигляді ін'єктованого розчину. Карбоплатин показаний перш за все при лікуванні на першій і другій стадії прогресуючої карциноми яєчників. Придушення кісткового мозку є визначальним фактором дози, що обмежує токсичність карбоплатину. Алкілуючі агенти є нефазовими антираковими специфічними агентами і сильними електрофілами. Зазвичай алкілуючі агенти утворюють ковалентні зв'язки шляхом алкілування ДНК через нуклеофільні фрагменти молекули ДНК, такі як фосфатна, аміно, сульфгідрильна, гідроксильна, карбоксильна й імідазольна групи. Таке алкілування перериває функцію нуклеїнової кислоти, що веде до загибелі клітин. Приклади алкілуючих агентів включають, але не обмежуються ними, азотистий Іприт, такі як циклофосфамід, мелфалан і хлорамбуцил; алкілсульфонати, такі як бусульфан; нітрозомочевини, такі як кармустин; і триазени, такі як дакарбазин. Циклофосфамід, моногідрат 2-оксиду 2-біс[2-хлоретил)аміно]тетрагідро-2Н-1,3,2оксазафосфорину, комерційно доступний у вигляді ін'єктованого розчину або пігулок як CYTOXAN®. Циклофосфамід показаний як єдиний агент або в комбінації з іншими хіміотерапевтичними агентами при лікуванні злоякісних лімфом, розсіяної мієломи й лейкемій. Алопеція, нудота, блювота й лейкопенія є найбільш звичайними показниками дози, що обмежує побічні дії циклофосфаміду. Мелфалан, 4-[біс(2-хлоретил)аміно]-L-фенілаланін, комерційно доступний у вигляді ін'єктованого розчину, або пігулок як ALKERAN®. Мелфалан показаний для паліативного лікування розсіяної мієломи й неоперабельної епітеліальної карциноми яєчників. Придушення кісткового мозку є найбільш звичайним показником дози, що обмежує побічну дію мелфалану. Хлорамбуцил, 4-[біс(2-хлоретил)аміно]бензолбутанова кислота, комерційно доступна у вигляді пігулок LEUKERAN®. Хлорамбуцил показаний для паліативного лікування хронічної лімфатичної лейкемії і злоякісних лімфом, таких як лімфосаркома, гігантська фолікулярна лімфома й хвороба Ходжкіна. Придушення кісткового мозку є найбільш звичайним показником дози, що обмежує побічну дію хлорамбуцилу. Бусульфан, диметансульфонат 1,4-бутандіолу, комерційно доступний у вигляді пігулок MYLERAN®. Бусульфан показаний для паліативного лікування хронічної мієлогенної лейкемії. Придушення кісткового мозку є найбільш звичайним показником дози, що обмежує побічну дію бусульфану. Кармустин, 1,3-[біс(2-хлоретил)-1-нітрозосечовина, комерційно доступний у вигляді окремих ампул ліофілізованого матеріалу як BICNU®. Кармустин показаний для паліативного лікування у вигляді єдиного агента або в комбінації з іншими агентами пухлин головного мозку, розсіяної мієломи, хвороби Ходжкіна й неходжинських лімфом. Затримана мієлосупресія є найбільш звичайним показником дози, що обмежує побічні дії кармустину. Дакарбазин, 5-(3,3-диметил-1-триазено)імідазол-4-карбоксамід, комерційно доступний у вигляді окремих ампул матеріалу як DTIC-Dome®. Дакарбазин показаний для лікування метастатичної злоякісної меланоми, й у комбінації з іншими агентами для другої лінії лікування хвороби Ходжкіна. Нудота, блювота й анорексія є найбільш звичайними показниками дози, що обмежує побічну дію дакарбазину. Антибіотичні антинеопластичні агенти є нефазовими специфічними агентами, які зв'язуються або інтеркалюються з ДНК. Зазвичай, така дія приводить у результаті до стабільних комплексів з ДНК або розриву ниток, що перериває звичайну функцію нуклеїнових кислот, приводячи до загибелі клітин. Приклади антибіотичних антинеопластичних агентів включають, але не обмежуються ними, актиноміцини, такі як дактиноміцин, антроцикліни, такі як даунорубіцин і доксорубіцин; і блеоміцини. Дактиноміцин, відомий також як актиноміцин D, комерційно доступний у ін'єктованій формі 24 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 як COSMEGEN®. Дактиноміцин показаний для лікування пухлини Вільма й рабдоміосаркоми. Нудота, блювота й анорексія є найбільш звичайними показниками дози, що обмежують побічні дії дактиноміцину. Даунорубіцин, гідрохлорид (8S-цис-)-8-ацетил-10-[(3-аміно-2,3,6-тридеокси-α-L-ліксогексопіранозил)окси]-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12-нафтацендіону, є комерційно доступним у вигляді ліпосомної ін'єктованої форми як DAUNOXOME® або у вигляді ін'єктованого засобу як CERUBIDINE®. Даунорубіцин показаний для індукції ремісії при лікуванні гострої нелімфоцитарної лейкемії та прогресуючої ВІЛ асоційованої саркоми Капоші. Мієлосупресія є найбільш звичайним показником дози, що обмежує побічну дію даунорубіцину. Доксорубіцин, гідрохлорид (8S, 10S)-10-[(3-аміно-2,3,6-тридеокси-α-Lліксогексопіранозил)окси]-8-гліколоїл-7,8,9,10-тетрагідро-6,8,11-тригідрокси-1-метокси-5,12нафтацендіону, комерційно доступний у вигляді ін'єктованої форми як RUBEX® або ADRIAMYCIN RDF®. Доксорубіцин перш за все показаний для лікування гострої лімфоблатомної лейкемії й гострої мієлобластомної лейкемії, а також як корисний компонент при лікуванні деяких солідних пухлин і лімфом. Мієлосупресія є найбільш звичайним показником дози, що обмежує побічну дію доксорубіцину. Блеоміцин, суміш цитотоксичних глікопептидних антибіотиків, виділених зі штаму Streptomyces verticillus, комерційно доступна як BLENOXANE®. Блеоміцин показаний як паліативне лікування, у вигляді єдиного агента або в комбінації з іншими агентами, карциноми сквамозних клітин, лімфом і тестикулярних карцином. Легенева і шкірна токсичність є найбільш звичайними побічними діями блеоміцину, що обмежують дозу. Інгібітори топоізомерази II включають, але не обмежуються ними, епіподофілотоксини. Епіподофілотоксини є фазоспецифічними антинеопластичними агентами, вироблюваними з рослини мандрагори. Епіподофіллотоксини зазвичай впливають на клітини в S і G 2 фазах клітинного циклу шляхом утворення потрійних або трехкомплонентних комплексів з топоізомеразою II і ДНК, викликаючи розриви ДНК ниток. Розриви ниток накопичуються, й слідує загибель клітин. Приклади епіподофілотоксинів включають, але не обмежуються ними, етопозид і теніпозид. Етопозид, 4’-деметилепіподофілотоксин 9-[4,6-0-(R)-етиліден-β-D-глюкопіранозиду] комерційно доступний у вигляді ін'єктованого розчину, або капсул як VEPESID® і зазвичай відомий як VP-16. Етопозид показаний як єдиний агент або в комбінації з іншими хіміотерапевтичними агентами при лікуванні тестикулярного й недрібноклітинного раку легенів. Мієлосупресія є найбільш звичайним побічним ефектом етопозиду. Випадки лейкопенії мають тенденцію бути важчими, ніж тромбоцитопенії. Теніпозид, 4’-деметилепіподофілотоксин 9-[4,6-0-(R)теніліден-β-D-глюкопіранозиду], комерційно доступний у вигляді ін'єктованого розчину як VUMON® і зазвичай відомий як VМ-26. Теніпозид показаний як одиночний агент або в комбінації з іншими хіміотерапевтичними агентами при лікуванні гострої лейкемії у дітей. Мієлосупресія є найбільш звичайним побічним ефектом теніпозиду, що обмежує дозу. Теніпозид може викликати і лейкопенію й тромбоцитопенію. Антиметаболічні неопластичні агенти є фазоспецифічними антинеопластичними агентами, які можуть діяти в S фазі (синтез ДНК) клітинного циклу шляхом інгібування синтезу ДНК або шляхом інгібування синтезу пуринової або піримідинової основи й, тим самим, обмежуючи синтез ДНК. Отже, S фаза не розвивається або не продовжується, і слідує загибель клітин. Приклади антиметаболічних антинеопластичних агентів включають, але не обмежуються ними, фторурацил, метотрексат, цитарабін, мекаптопурин, тіогуанін і гемцитабін. 5-фторурацил-5-фтор-2,4-(1H, 3H)-піримідиндіон, комерційно доступний як фторурацил. Введення 5-фторурацилу веде до інгібування синтезу тимідилату, а також об'єднується, як з РНК, так і з ДНК. Результатом зазвичай є загибель клітин. 5-Фторурацил показаний у вигляді одиночного агента або в комбінації з іншими хіміотерапевтичними агентами при лікуванні карцином грудей, ободової кишки, прямої кишки, шлунку й підшлункової залози. Побічними ефектами 5-фторурацилу, що обмежують дозу, є мієлосупресія й мукозит. Інші фторпіримідинові аналоги включають 5-фтордезоксіуридин (флоксуридин) і монофосфат 5фтордезоксіуридину. Цитарабін, 4-аміно-1-β-D-арабінофуранозил-2(1H)-піримідинон, комерційно доступний як CYTOSAR-U® і зазвичай відомий як ARA-C. Вважається, що цитарабін проявляє фазоспецифічність клітин у S-фазі шляхом інгібування подовження ланцюгів ДНК і кінцевим об'єднанням цитарабіну із зростаючим ДНК ланцюгом. Цитарабін показаний у вигляді одиночного агента або в комбінації з іншими хіміотерапевтичними агентами при лікуванні гострої лейкемії. Інші аналоги цитидину включають 5-азацитидин і 2",2’-дифтордезоксицитидин 25 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 (гемцитабін). Цитарабін викликає лейкопенію, тромбоцитопенію й мукозит. Меркаптопурин, моногідрат 1,7-дигідро-6Н-пурин-6-тіону, комерційно доступний як PURINETHOL®. Меркаптопурин виявляє фазоспецифічність клітин у S-фазі інгібуванням синтезу ДНК по ще невизначеному механізму. Меркаптопурин показаний у вигляді одиночного агента або в комбінації з іншими хіміотерапевтичними агентами при лікуванні гострої лейкемії. Мієлосупресія й мукозит шлунково-кишкового тракту є очікуваними побічними ефектами меркаптопурину у високих дозах. Корисним аналогом меркаптопурину є азатіоприн. Тіогуанін, 2-аміно-1,7-дигідро-6Н-пурин-6-тіон, комерційно доступний як TABLOID®. Тіогуанін виявляє фазоспецифічность клітин у S-фазі інгібуванням синтезу ДНК по ще невизначеному механізму. Тіогуанін показаний у вигляді одиночного агента або в комбінації з іншими хіміотерапевтичними агентами при лікуванні гострої лейкемії. Мієлосупресія, включаючи лейкопенію, тромбоцитопенію й анемію, є найбільш звичайним побічним ефектом, що обмежує дозу тіогуаніну при його введенні. Проте трапляються побічні ефекти в шлунково-кишковому тракті й можуть бути показниками обмеження дози. Інші аналоги пурину включають пентостатин, еритрогідроксиноніладенін, фосфат флударабіну й кладрибін. Гемцитабін, моногідрохлорид 2’-дезокси-2",2’-дифторцитидину (β-ізомер), комерційно доступний як GEMZAR®. Гемцитабін проявляє фазоспецифічність клітин у S-фазі шляхом блокування просування клітин через Gl/S кордон. Гемцитабін показаний у комбінації з цисплатином при лікуванні недрібноклітинного раку легенів, що локально розвивається, й у вигляді одиночного засобу – при лікуванні раку підшлункової залози, що розвивається локально. Мієлосупресія, включаючи лейкопенію, тромбоцитопенію й анемію, є найбільш звичайним побічним ефектом, що обмежує дозу гемцитабіну при його введенні. Метотрексат, N-[4-[[(2,4-діаміно-6-птеридиніл)метил]метиламіно]бензоїлу]-L-глутамінова кислота, комерційно доступний як метотрексат натрію. Метотрексат виявляє специфічно фазоклітинні ефекти, особливо в S-фазі шляхом інгібування синтезу ДНК, репарації й реплікації через інгібування редуктази дигідрофолевої кислоти, яке потрібне для синтезу пуриннуклеотидів і тимідилату. Метотрексат показаний як одиночний агент або в комбінації з іншими хіміотерапевтичними агентами при лікуванні хоріокарциноми, менінгеальної лейкемії, неходжінської лімфоми й карцином грудей, голови, шиї, яєчників і сечового міхура. Мієлосупресія (лейкопенія, тромбоцитопенія й анемія) і мукозит є очікуваними побічними ефектами при введенні метотрексату. Камптотецини, що включають камптотецин і похідні камптотецину, доступні або розробляються як інгібітори топоізомерази I. Вважається, що цитотоксична активність камптотецинів пов'язана з інгібуючою топоізомеразу I активністю. Приклади камптотецинів включають, але не обмежуються ними, іринотекан, топотекан і всілякі оптичні форми 7-(4метилпіперазинометилен)-10,11-етилендіокси-20-камптотецину, описаного нижче. Іринотекан HCl, гідрохлорид (4S)-4,11-діетил-4-гідрокси-9-[(4-піперидино-піперидино)карбонілокси]-1H-пірано[3",4",6,7]індолізино[1,2-b]хінолін-3,14-(4H, 12H)-діону, комерційно доступний у вигляді ін'єктованого розчину CAMPTOSAR®. Іринотекан є похідною камптотецину, яка зв'язується поряд з його активним метаболітом SN-38 в топоізомераза I–ДНК комплекс. Вважається, що мають місце випадки цитотоксичності в результаті невідновних розривів подвійних ниток, що викликаються взаємодією комплексу топоізомераза I:ДНК:іринотекан або SN-38 з реплікаційними ферментами. Іринотекан показаний для лікування метастатичної раку ободової кишки або прямої кишки. Побічними ефектами, що обмежують дозу іринотекану HCl, є мієлосупресія, включаючи нейтропенію, і GIефекти, включаючи діарею. Топотекан HCl, моногідрохлорид (S)-10-[(диметиламіно)метил]-4-етил-4,9-дигідрокси-1Hпірано[3",4",6,7]індолізино[1,2-b]хінолін-3,14-(4H, 12H)-діону, комерційно доступний у вигляді ін'єктованого розчину HYCAMTIN®. Топотекан є похідною камптотецину, яка зв'язується в топоізомераза I–ДНК комплекс і запобігає релігуванню розривів одиночних ниток, викликане топоізомеразою I у відповідь на деформацію кручення молекули ДНК. Топотекан показаний для другої лінії лікування метастатичної карциноми яєчників і дрібноклітинного раку легенів. Показником дози, що обмежує побічні ефекти топотекану HCl, є мієлосупресія, перш за все, нейтропенія. Становить інтерес також похідна камптотецину формули А, поданої нижче, яка в даний час розробляється, включаючи форму рацемічної суміші (R, S), а також R і S енантіомери: 26 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 відома під хімічною назвою "7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(R,S)камптотецин" (рацемічна суміш) або "7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(R)камптотецин" (R енантіомер) або "7-(4-метилпіперазинометилен)-10,11-етилендіокси-20(S)камптотецин" (S енантіомер). Така сполука, також як і родинні сполуки, описані, включаючи способи одержання, в патентах США 6063923; 5342947; 5559235; 5491237 і заявці США, що знаходиться на розгляді, 08/977217, поданій 24 листопада 1997 р. Гормони й гормональні аналоги є корисними сполуками для лікування ракових захворювань, у яких є взаємозв'язок між гормоном(гормонами) і ростом і/або недостатністю росту раку. Приклади гормонів і гормональних аналогів, корисних для лікування раку, включають, але не обмежуються ними, адренокортикостероїди, такі як преднізон і преднізолон, які корисні при лікуванні злоякісної лімфоми й гострої лейкемії у дітей; аміноглютетимід та інші інгібітори ароматази, такі як анастрозол, летразол, воразол і ексеместан, корисні при лікуванні адренокортикальної карциноми й гормон-залежної карциноми грудей, що містять естрогенові рецептори; прогестрини, такі як мегестролацетат, корисні при лікуванні гормон-залежного раку грудей і ендометріальної карциноми; естрогени, андрогени й антиандрогени, такі як флютамід, нілютамід, бікалютамід, ацетат ципротерону й 5α-редуктази, такі як фінастерид і дутастерид, корисні при лікуванні карциноми простати і доброякісної гіпертрофії простати; й антиестрогени, такі як тамоксифен, тореміфен, ралоксифен, дролоксифен, йодоксифен, а також селективні естроген-рецепторні модулятори (SERMS), описані в патентах США 5681835, 5877219 і 6207716, корисні при лікуванні гормон-залежної карциноми грудей та інших чутливих ракових захворювань; і гонадотропін-вивільняючий гормон (GnRH) і його аналоги, які стимулюють вивільнення люїтинізуючого гормону (LH) і/або фолікул-стимулюючого гормону (FSH), для лікування карциноми простати, наприклад агоністи й антагоністи LHRH, такі як гозерелінацетат і лупролід. Інгібітори шляху сигнальної трансдукції є тими інгібіторами, які блокують або інгібують хімічний процес, який викликає внутрішньоклітинні зміни. У використовуваному в даному описі сенсі даною зміною є проліферація або диференціація клітин. Інгібітори сигнальної трансдукції, корисні в даному винаході, включають інгібітори рецепторних тирозинкіназ, нерецепторні тирозинкінази, блокатори SH2/SH домену, серин/треонінкінази, фосфотидилінозит-3 кінази, міоинозит сигналізатор і Ras онкогени. Деякі протеїнтирозинкінази каталізують фосфорилування специфічних тирозильних залишків у різноманітних білках, що залучаються до регулювання росту клітин. Такі протеїнтирозинкінази можуть широко класифікуватися як рецепторні й нерецепторні кінази. Рецепторні тирозинкінази є трансмембранними білками, що мають позаклітинний лігандзв'язуючий домен, трансмембранний домен і домен тирозинкінази. Рецепторні тирозинкінази залучаються до регуляції клітинного росту й зазвичай називаються рецепторами фактора росту. Показано, що невідповідна або неконтрольована активація багатьох з даних кіназ, тобто аберантна активність рецептора кіназного фактора росту, наприклад, шляхом надекспресії або мутації, приводить у результаті до неконтрольованого росту клітин. Відповідно, аберантна активність таких кіназ була пов'язана із злоякісним ростом тканини. Відповідно, інгібітори таких кіназ могли б надати методи лікування раку. Рецептори фактора росту включають, наприклад, рецептор епідермального фактора росту (EGFr), рецептор тромбоцитарного фактора росту (PDGFr), erbB2, erbB4, рецептор судинно-ендотеліального фактора росту (VEGFr), тирозинкіназу з доменами імуноглобулін-подібною гомологією й епідермального фактора росту (TIE-2), рецептор інсулінового фактора росту-I (IGFI), фактор стимуляції колонії макрофага (cfms), BTK, ckit, cmet, рецептори фактора росту фібробластів (FGF), Trk рецептори (TrkA, TrkB і TrkC), рецептори ефрину (eph) і RET протоонкоген. Деякі інгібітори рецепторів росту знаходяться на стадії розробки і включають ліганд-антагоністи, антитіла, інгібітори 27 UA 104408 C2 5 10 15 20 25 30 35 40 45 50 55 60 тирозинкінази й антисмислові олігонуклеотиди. Рецептори фактора росту й агенти, які інгібують рецепторну функцію фактора росту, описані, наприклад, у публікації Kath, John C., Exp. Opin. Ther. Patents (2000) 10(6):803-818; Shawver et al. DDT Vol 2, No 2 лютого 1997; і Lofts, F. J. еt al., "Growth factor receptors as targets", New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David, CRC press 1994, London. Тирозинкінази, які не є рецепторними кіназами фактора росту, називаються нерецепторними тирозинкіназами. Не-рецепторні тирозинкінази для використання в даному винаході, які є мішенями або цілями протиракових лікарських засобів, включають сSrc, Lсk, Fyn, Yes, Jak, cAbl, FAK (фокальна адгезійна кіназа), Brutons тирозинкіназа і Bcr-Abl. Такі нерецепторні кінази й агенти, які інгібують нерецепторну функцію тирозинкінази, описані в публікації Sinh, S. аnd Corey, S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8 (5): 465-80; і Bolen, J, B., Brugge, J.S., (1997) Annual review of Immunology, 15:371-404. Блокатори SH2/SH3 домену є агентами, які розривають зв'язок SH2 або SH3 домену в широкій множині ферментів або адапторних білків, включаючи, PI3-K p85 субодиниці, кінази Srс сімейства, адапторні молекули, (Shс, Crk, Nck, Grb2) і Rаs-GAP. SH2/SH3 домени як мішень для протиракових лікарських засобів описані Smithgall, T.E. (1995), Journal of Pharmacological and Toxicological Methods 34(3) 125-32. Інгібітори серин/треонінкіназ, включаючи блокатори каскаду МАР кінази, які включають блокатори Raf кіназ (rаfk), мітоген або позаклітинну регуляторну кіназу (МЕК-ази) й позаклітинні регуляторні кінази (ERK-ази); і блокатори членів сімейства протеїнкінази З, що включають блокатори РКС (альфа, бета, гамма, епсилон, мю, лямбда, йота, зета), сімейство IKB (IKKa, IKKb), PKB сімейство кіназ, члени сімейства act кінази і TGF бета рецепторні кінази. Такі серин/треонінкінази та їхні інгібітори описані в публікаціях Yamamoto, T., Taya, S., Kaibuchi, K., (1999), Journal of Biochemistry, 126 (5) 799-803; Brodt, P, Samani, A., and Navab, R, (2000), Biochemical Pharmacology, 60, 1101-1107; Massague, J., Weis-Garcia, F. (1996) Cancer Surveys. 27:41-64; Philip, P.A., Harris, A.L. (1995), Cancer Treatment and Research. 78: 3-27, Lackey, K. еt al Bioorganic and Medicinal Chemistry Letters, (10), 2000, 223-226; патенті США 6268391; і MartinezIacaci, L., et al, Int. J. Cancer (2000), 88(1), 44-52. Інгібітори членів сімейства фосфотидилінозит-3 кінази, що включають блокатори PI3-кінази, АТМ, Днк-pk і Ku також можуть бути корисними в даному винаході. Такі кінази описані Abraham, R.T. (1996), у Current Opinion in Immunology, 8 (3) 412-8; Canman, C.E., Lim, D.S. (1998), Oncogene 17 (25) 3301-3308; Jackson, S.P. (1997), International Journal of Biochemistry and Cell Biology. 29 (7):935-8; і Zhong, H. еt al, Cancer res, (2000) 60(6), 1541-1545. В даному винаході також становлять інтерес Myo-інозит сигнальні інгібітори, такі як блокатори фосфоліпази С і аналоги міоїнозиту. Такі сигнальні інгібітори описані Powis, G., and Kozzikowski A., (1994) New Molecular Targets for Cancer Chemotherapy ed., Paul Workman and David Kerr, CRC press 1994, London. Ще однією групою інгібіторів шляху сигнальної трансдукції є інгібітори Ras онкогену. Такі інгібітори включають інгібітори фарнезилтрансферази, геранілгераніл трансферази і CAAX протеази, а також антисмислові олігонуклеотиди, рибозими й імунотерапію. Показано, що такі інгібітори блокують ras активацію в клітинах, що містять мутантні ras дикого типа, діючи, тим самим, як агенти антипроліферації. Інгібування Ras онкогенну обговорюється в публікаціях Scharovsky, O.G., Rozados, V.R., Gervasoni, S.I. Matar, P. (2000), Journal of Biomedical Science. 7(4) 292-8; Ashby, M.N. (1998), Current Opinion in Lipidology 9(2) 99-102; і BioChim. Biophys. Acta, (19899) (!) 1423(3): 19-30. Як указано вище, антагоністи антитіл відносно зв'язку ліганду рецепторної кінази також можуть служити як інгібітори сигнальної трансдукції. Дана група інгібіторів шляху сигнальної трансдукції включає використання гуманізованих антитіл до позаклітинного ліганду, що зв'язує домен рецепторних тирозинкіназ. Наприклад, імклон С225 EGFR специфічні антитіла (див. Green, M.C. et al, Monoclonal Antibody Therapy for Solid Tumors, Cancer Treat. Rev., (2000), 26(4), 269-286); Herceptin® erbB2 антитіла (див. Tyrosine Kinase Signalling in Breast cancer: erbB Family Receptor Tyrosine Kinases, Breast cancer Res., 2000, 2(3), 176-183); і 2CB VEGFR2 специфічні антитіла (див. Brekken, R.A. et al, Selective Inhibition of VERGFR2 Activity by а monoclonal antiVEGF antibody blocks tumor growth in mice, Cancer Res. (2000) 60, 5117-5124). Інгібітори ангіогенезу нерецепторної кінази можуть бути також корисні в даному винаході. Інгібітори пов'язаних з ангіогенезом VEGFR і TIE2 обговорені вище відносно інгібіторів трансдукції (обидва рецептори є рецепторними тирозинкіназами). Ангіогенез зазвичай зв'язаний з erbB2/EGFR шляху сигналів, оскільки було показано, що інгібітори erbB2 і EGFR інгібують ангіогенез, перш за все VEGF експресію. Відповідно, інгібітори нерецепторної тирозинкінази можуть використовуватися в комбінації зі сполуками даного винаходу. Наприклад, анти-VEGF 28
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline derivatives as p13 kinase inhibitors
Автори російськоюAdams, Nicholas, D., Burgess, Joelle, Lorraine, Darcy, Michael, Gerard, Donatelli, Carla, A., Knight, Steven, David, Newlander, Kenneth, Allen, Ridgers, Lance, Sarpong, Martha, Schmidt, Stanley, J.
МПК / Мітки
МПК: C07D 285/24, C07D 487/04, A61K 31/47, C07D 495/04, C07D 417/14, C07D 498/04, C07D 401/04, C07D 401/14, C07D 471/04, C07D 413/14
Мітки: pі3-кінази, хіноліну, похідні, інгібітори
Код посилання
<a href="https://ua.patents.su/107-104408-pokhidni-khinolinu-yak-ingibitori-pi3-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну як інгібітори pi3-кінази</a>
Попередній патент: Інтерфейс користувача та спосіб його застосування
Наступний патент: Похідні сульфонілхіноліну
Випадковий патент: Концентрований білковий продукт та спосіб його виробництва