Похідні піроло[3.4-c]піразолу як інгібітори кінази
Номер патенту: 81682
Опубліковано: 25.01.2008
Автори: Форте Барбара, Фанчеллі Даніелє, Молль Юрген, Віанелло Паола, Варазі Маріо
Формула / Реферат
1. Спосіб лікування клітинних проліферативних порушень, викликаних і/або пов'язаних із зміненою активністю протеїнкінази, при якому вводять ссавцеві, який потребує цього, ефективну кількість сполуки формули (І)
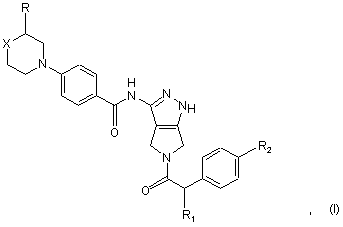
в якій
R являє собою водень або метил;
R1 являє собою гідрокси або лінійний або розгалужений С1-С3-алкіл або алкоксигрупу;
R2 являє собою водень або атом галогену;
X являє собою двовалентну групу, вибрану з метилену (-СН2-) або фторметилену (-CHF-), або X означає гетероатом або гетероатомну групу, вибрану з кисню (-О-) або азоту (-NR'-), де R' являє собою атом водню, лінійну або розгалужену С1-С4-алкільну групу або С3-С6-циклоалкільну групу;
або її фармацевтично прийнятної солі.
2. Спосіб за п. 1, де протеїнкіназа є Авроракіназа.
3. Спосіб за п. 2, де Авроракіназа є Аврора-2.
4. Спосіб за п. 1, де клітинні проліферативні порушення вибрані з групи, яка містить рак, хворобу Альцгеймера, вірусні інфекції, аутоімунні захворювання і нейродегенеративні розлади.
5. Спосіб за п. 4, де рак вибраний з групи, яка містить карциному, плоскоклітинну карциному, гемопоетичні пухлини мієлоїдного або лімфоїдного походження, пухлини мезенхімного походження, пухлини центральної і периферичної нервової системи, меланому, семіному, тератокарциному, остеосаркому, пігментозну ксеродерму, кератоксантому, фолікулярний рак щитовидної залози і саркому Капоші.
6. Спосіб за п. 1, де клітинне проліферативне порушення вибране з групи, яка містить доброякісну гіперплазію простати, сімейний аденоматозний поліпоз, нейрофіброматоз, псоріаз, проліферацію клітин гладких м'язів судин, пов'язану з атеросклерозом, фіброз легень, артрит, гломерулонефрит і післяопераційний стеноз і рестеноз.
7. Спосіб за п. 1, при якому додатково здійснюють вплив на ссавця, який потребує цього, променевої терапії або хіміотерапевтичного режиму в комбінації щонайменше з одним цитостатичним або цитотоксичним агентом.
8. Спосіб за п. 1, де ссавець, який потребує цього, є людина.
9. Спосіб інгібування активності Аврора-2-кінази, при якому здійснюють контактування вказаної кінази з ефективною кількістю сполуки, представленої в п. 1.
10. Сполука формули (І)

в якій
R являє собою водень або метил;
R1 являє собою гідрокси або лінійний або розгалужений С1-С3-алкіл або алкоксигрупу;
R2 являє собою водень або атом галогену;
X являє собою двовалентну групу, вибрану з метилену (-СН2-) або фторметилену (-CHF-), або X означає гетероатом або гетероатомну групу, вибрану з кисню (-О-) або азоту (-NR'-), де R' являє собою атом водню, лінійну або розгалужену С1-С4-алкільну групу або С3-С6-циклоалкільну групу;
або її фармацевтично прийнятна сіль.
11. Сполука формули (І) за п. 10, де R означає водень або метил; R1 вибраний з гідрокси, метилу або метокси; R2 означає водень або атом фтору; X вибраний з метилену, трифторметилену, -О- або -NR', де R' приймає значення, визначені в п. 10.
12. Сполука формули (І) за п. 1, необов'язково у вигляді її фармацевтично прийнятної солі, вибрана з групи, яка містить:
(1) N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4-метилпіперазин-1-іл)бензамід;
(2) N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4-етилпіперазин-1-іл)бензамід;
(3) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгiдpoпіpoлo[3.4-с]піразол-3-іл}-4-(4-ізопропілпіперазин-1-іл)бензамід;
(4) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгідpoпipoлo[3.4-с]піразол-3-іл}-4-(4-циклопропілпіперазин-1-іл)бензамід;
(5) 4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід;
(6) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-піперидин-1-ілбензамід;
(7) 4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід;
(8) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-морфолін-4-ілбензамід;
(9) 4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2-метокси-2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід;
(10) N-{5-[(2R)-2-гiдpoкcи-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-(4-метилпіперазин-1-іл)бензамід;
(11) N-{5-[(2R)-2-мeтил-2-фeнiлeтaнoїл]-1,4,5,6-тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-(4-метилпіперазин-1-іл)бензамід;
(12) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4-етилпіперазин-1-іл)бензамід;
(13) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4-ізопропілпіперазин-1-іл)бензамід;
(14) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4-циклопропілпіперазин-1-іл)бензамід;
(15) 4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2-фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід;
(16) N-{5-[(2R)-2-фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-піперидин-1-ілбензамід;
(17) 4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід;
(18) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-морфолін-4-ілбензамід;
(19) 4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2-фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}бензамід.
13. Спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі вказаних в п. 10, при якому здійснюють:
а) взаємодію сполуки формули (II) із сполукою формули (III)
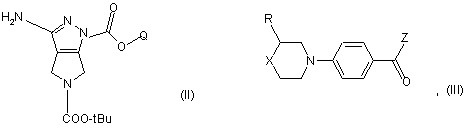
де R і X приймають значення, визначені в п. 10, Q являє собою нижчу алкільну групу, tBu означає трет-бутил і Z являє собою гідрокси або придатну відхідну групу, з одержанням сполуки формули (IV)
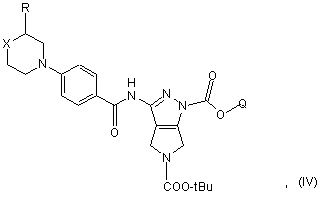
b) перетворення сполуки формули (IV) в кислотних умовах на сполуку формули (V)
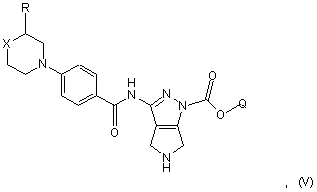
с) взаємодію сполуки формули (V) із сполукою формули (VI)
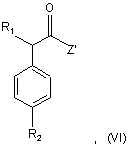
де R1 і R2 приймають значення, визначені в п. 10, і Z' являє собою гідрокси або придатну відхідну групу, з одержанням сполуки формули (VII)
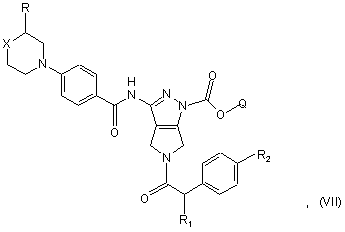
d) перетворення сполуки формули (VII) в основних умовах на відповідну сполуку формули (І) і, якщо бажано, перетворення її на фармацевтично прийнятну сіль.
14. Спосіб за п. 13, де у сполуках формули (II) Q являє собою лінійну або розгалужену С1-С4-алкільну групу.
15. Спосіб за п. 14, де Q являє собою метил або етил.
16. Спосіб за п. 13, де у сполуках формул (III) і (VI) Z і Z' являють собою, кожний незалежно, гідрокси або атом галогену.
17. Спосіб за п. 16, де атом галогену являє собою хлор.
18. Спосіб за п. 13, де стадію (b) проводять в кислотних умовах в присутності хлористоводневої, трифтороцтової або метансульфонової кислоти.
19. Спосіб за п. 13, де стадію (d) проводять в основних умовах в присутності гідроксиду натрію, калію або літію або третинного аміну, такого як триетиламін.
20. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначеної в п. 10, і щонайменше один фармацевтично прийнятний наповнювач, носій і/або розріджувач.
21. Фармацевтична композиція за п. 20, яка містить додатково один або декілька хіміотерапевтичних агентів.
22. Набір, який містить сполуку формули (І) або її фармацевтично прийнятну сіль, визначені в п. 10, або їх фармацевтичну композицію, визначену в п. 20, і один або декілька хіміотерапевтичних агентів, як комбінований препарат для одночасного, роздільного або послідовного застосування в протираковій терапії.
23. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 10 для застосування як лікарський засіб.
24. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, визначеної в п. 10, для одержання лікарського засобу, який має протипухлинну активність.
Текст
1. Спосіб лікування клітинних проліферативних порушень, викликаних і/або пов'язаних із зміненою активністю протеїнкінази, при якому вводять ссавцеві, який потребує цього, ефективну кількість сполуки формули (І) 3 81682 R X N H N N NH O R2 N O R1 , (I) в якій R являє собою водень або метил; R 1 являє собою гідрокси або лінійний або розгалуж ений С 1 -С 3 -алкіл або алкоксигрупу; R2 являє собою водень або атом галогену; X являє собою двовалентну групу, вибрану з метилену (-СН 2-) або фторметилену (-CHF-), або X означає гетероатом або гетероатомну групу, вибрану з кисню (-О-) або азоту (-NR'-), де R' являє собою атом водню, лінійну або розгалужену С1-С4-алкільну групу або С3-С6циклоалкільну групу; або її фармацевтично прийнятна сіль. 11. Сполука формули (І) за п. 10, де R означає водень або метил; R1 вибраний з гідрокси, метилу або метокси; R2 означає водень або атом фтору; X вибраний з метилену, трифторметилену, -О- або -NR', де R' приймає значення, визначені в п. 10. 12. Сполука формули (І) за п. 1, необов'язково у вигляді її фармацевтично прийнятної солі, вибрана з групи, яка містить: (1) N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід; (2) N-{5-[(2R)-2-метокси-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4етилпіперазин-1-іл)бензамід; (3) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпіpoлo[3.4-с]піразол-3-іл}-4-(4ізопропілпіперазин-1-іл)бензамід; (4) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгідpoпipoлo[3.4-с]піразол-3-іл}-4-(4циклопропілпіперазин-1-іл)бензамід; (5) 4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2-метокси-2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; (6) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-піперидин-1ілбензамід; (7) 4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2-метокси-2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; (8) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-морфолін-4ілбензамід; 4 (9) 4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2-метокси2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; (10) N-{5-[(2R)-2-гiдpoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід; (11) N-{5-[(2R)-2-мeтил-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпipoлo[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід; (12) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4етилпіперазин-1-іл)бензамід; (13) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4ізопропілпіперазин-1-іл)бензамід; (14) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4циклопропілпіперазин-1-іл)бензамід; (15) 4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; (16) N-{5-[(2R)-2-фенілпропаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-піперидин-1ілбензамід; (17) 4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2-метил-2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; (18) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-морфолін-4ілбензамід; (19) 4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід. 13. Спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі вказаних в п. 10, при якому здійснюють: а) взаємодію сполуки формули (II) із сполукою формули (III) O H2N N N O R Q Z X N N O (II) , (III) COO-tBu де R і X приймають значення, визначені в п. 10, Q являє собою нижчу алкільну групу, tBu означає трет-бутил і Z являє собою гідрокси або придатну відхідну групу, з одержанням сполуки формули (IV) R X N H N O N N O Q O N COO-tBu , (IV) b) перетворення сполуки формули (IV) в кислотних умовах на сполуку формули (V) 5 81682 6 14. Спосіб за п. 13, де у сполуках формули (II) Q являє собою лінійну або розгалужену С1-С4алкільну групу. R X N 15. Спосіб за п. 14, де Q являє собою метил або етил. O H N N N O Q 16. Спосіб за п. 13, де у сполуках формул (III) і (VI) Z і Z' являють собою, кожний незалежно, гідрокси або атом галогену. O N H , (V) с) взаємодію сполуки формули (V) із сполукою формули (VI) O R1 Z' 17. Спосіб за п. 16, де атом галогену являє собою хлор. 18. Спосіб за п. 13, де стадію (b) проводять в кислотних умовах в присутності хлористоводневої, трифтороцтової або метансульфонової кислоти. 19. Спосіб за п. 13, де стадію (d) проводять в основних умовах в присутності гідроксиду натрію, калію або літію або третинного аміну, такого як триетиламін. R2 , (VI) де R1 і R2 приймають значення, визначені в п. 10, і Z' являє собою гідрокси або придатну відхідну групу, з одержанням сполуки формули (VII) R 21. Фармацевтична композиція за п. 20, яка містить додатково один або декілька хіміотерапевтичних агентів. X N O H N N N O Q O R2 N O 20. Фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки формули (І) або її фармацевтично прийнятної солі, визначеної в п. 10, і щонайменше один фармацевтично прийнятний наповнювач, носій і/або розріджувач. , (VII) R1 d) перетворення сполуки формули (VII) в основних умовах на відповідну сполуку формули (І) і, якщо бажано, перетворення її на фармацевтично прийнятну сіль. Даний винахід належить до похідних піролопіразолу, до способу їх одержання, до фармацевтичних композицій, які містять ці сполуки, і до застосування їх як терапевтичних агентів, особливо в лікуванні раку і порушень проліферації клітин. Порушення функції протеїнкіназ (РК) є ознакою численних захворювань. Велика частина онкогенів і протоонкогенів, які беруть участь в розвитку злоякісних пухлин людини, кодують РК. РК причетні також до 22. Набір, який містить сполуку формули (І) або її фармацевтично прийнятну сіль, визначені в п. 10, або їх фармацевтичну композицію, визначену в п. 20, і один або декілька хіміотерапевтичних агентів, як комбінований препарат для одночасного, роздільного або послідовного застосування в протираковій терапії. 23. Сполука формули (І) або її фармацевтично прийнятна сіль за п. 10 для застосування як лікарський засіб. 24. Застосування сполуки формули (І) або її фармацевтично прийнятної солі, визначеної в п. 10, для одержання лікарського засобу, який має протипухлинну активність. багатьох доброякісних захворювань, таких як доброякісна гіперплазія простати, сімейний аденоматоз, поліпоз, нейрофіброматоз, псоріаз, проліферація клітин гладких м'язів судин, пов'язана з атеросклерозом, фіброз легень, артрит, гломерулонефрит і післяопераційний стеноз і рестеноз. РК причетні також до запальних станів і до розмноження вірусів і паразитів. PKs також відіграють головну роль в патогенезі і розвитку нейродегенеративних розладів. 7 Як основне посилання про зниження активності РК або дисрегуляції [див., наприклад, Current Opinion in Chemical Biology 1999, 3, 459465]. Серед деяких відомих в даній галузі протеїнкіназ, що беруть участь в розвитку ракових клітин, є Авроракінази, зокрема, Аврора-2. Було встановлено, що Аврора-2 надмірно експресується в ряді різних типів пухлин. її генний л оку с карту ється як 20q13, хромосомний регіон, часто надекспресований при багатьох видах раку, включаючи рак молочної залози [Cancer Res. 1999, 59(9), 2041-4] і товстої кишки. 20q13 ампліфікація корелює з несприятливим прогнозом у пацієнтів з вузликовим негативним раком молочної залози, і підвищена експресія Аврори-2 є указаниям на несприятливий прогноз і знижений час життя у пацієнтів з раком сечового міхура [J. Nail. Cancer Inst., 2002, 94(17), 1320-9]. Як основне посилання про роль Аврори-2 в анормальній функції центросом при раку див. також Molecular Cancer Therapeutics, 2003, 2, 589595. Об'єкт даного винаходу належить до сполук, які застосовні в терапії як агенти проти носія захворювань, які викликані і/або пов'язані з дисрегуляцією активності протеїнкінази, і, більш конкретно, активність Авроракіназ. Інший аспект належить до сполук, яким властива інгібуюча активність у відношенні протеїнкінази, і, більш конкретно, інгібуюча активність у відношенні Авроракіназ. Автори в даній роботі відкрили, що деяким піролопіразолам і їх похідним властива інгібуюча активність у відношенні протеїнкінази, наприклад, інгібуюча активність у відношенні Авроракіназ. Більш конкретно, сполуки даного винаходу застосовні в лікуванні різних типів раку, що включають, але без обмеження тільки ними: карциному, таку як карцинома сечового міхура, молочної залози, товстої кишки, нирки, печінки, легені, включаючи дрібноклітинний рак легені, стравоходу, жовчного міхура, яєчника, підшлункової залози, шлунка, шиї, щитовидної залози, простати і шкіри, включаючи плоско клітинну карциному; гомопоетичні пухлини лімфоїдного походження, що включають лейкоз, гострий лімфоцитарний лейкоз, гострий лімфобластомний лейкоз, лімфому В-клітин, лімфому Т-клітин, лімфому Ходжкіна (Hodgkin's), неходжкінську лімфому, клітинну лімфому волосся і лімфому Беркітта (Burketfs); гомопоетичні пухлини мієлоїдного походження, що включають гострий і хронічний мієлогенний лейкоз, мієлодиспастичний синдром і промієлоцитарний лейкоз; пухлини мезенхімного походження, що включають фібросаркому і рабдоміосаркому; пухлини центральної і периферичної нервової системи, що включають астроцитому, нейробластому, гліому і шванному; інші пухлини, що включають меланому, семіному, тератокарциному, остеосаркому, пігментозну ксеродерму, кератоксантому, фолікулярний рак щитовидної залози і саркому Капоші (Kaposi's). 81682 8 Через ключову роль PKs і Авроракіназ в регулюванні проліферації клітин дані піролопіразоли також застосовні в лікуванні безлічі клітинних проліферативних порушень, таких як, наприклад, доброякісна гіперплазія простати, сімейний аденоматоз, поліпоз, нейрофіброматоз, псоріаз, проліферація клітин гладких м'язів судин, пов'язана з атеросклерозом, фіброз легень, артрит, гломерулонефрит і післяопераційний стеноз і рестеноз. Таким чином, в першому варіанті здійснення даний винахід належить до способу лікування клітинних проліферативних порушень, викликаних і/або пов'язаних із зміненою активністю протеїнкінази, який включає введення ссавцеві, який потребує цього, ефективної кількості сполуки формули (І) в якій R являє собою водень або метил; R1 являє собою гідрокси або лінійний або розгалужений С1-С3-алкіл або алкоксигрупу; R2 являє собою водень або атом галогену; X являє собою двовалентну групу, вибрану з метилену (-СН2-) або фторметилену (-CHF-), або X означає гетероатом або гетероатомну групу, вибрану з кисню (-О-) або азоту (-NR'-), де R' являє собою атом водню, лінійну або розгалужену С1-С4алкільну групу або С3-С6-циклоалкільну групу; або її фармацевтично прийнятної солі. Вищенаведений спосіб дозволяє лікувати клітинні проліферативні порушення, викликані і/або пов'язані із зміненою активністю Авроракіназ. У переважному варіанті здійснення способу, описаного вище, клітинне проліферативне порушення являє собою рак. Специфічні типи раку, які можуть бути піддані лікуванню, включають карциному, спіналіому, гомопоетичні пухлини мієлоїдного або лімфоїдного походження, пухлини мезенхімного походження, пухлини центральної і периферичної нервової системи, меланому, семіному, тератокарциному, остеосаркому, пігментозну ксеродерму, кератоксантому, фолікулярний рак щитовидної залози і саркому Капоші. Даний винахід також належить до сполуки формули (І) 9 в якій R являє собою водень або метил; R1 являє собою гідрокси або лінійний або розгалужений С1-С3-алкіл або алкоксигрупу; R2 являє собою водень або атом галогену; X являє собою двовалентну групу, вибрану з метилену (-СН2-) або фторметилену (-CHF-), або X означає гетероатом або гетероатомну групу, вибрану з кисню (-О-) або азоту (-NR'-), де R' являє собою атом водню, лінійну або розгалужену С1-С4алкільну групу або С3-С6-циклоалкільну групу; або до її фармацевтично прийнятної солі. Даний винахід також включає способи синтезу піролопіразолів формули (І) і фармацевтично прийнятних солей, а також фармацевтичні композиції, що їх містять. Більш повна оцінка даного винаходу і його багато які супутні переваги можуть бути сприйняті по мірі кращого розуміння їх за допомогою відсилання до наступного докладного опису. Деякі гетероциклічні сполуки відомі в даній галузі як інгібітори протеїнкінази. Серед них 3карбоксамідопіразоли і 3-уреїдопіразоли і їх похідні розкриті як інгібітори протеїнкінази [в міжнародних патентних заявках WO 01/12189, WO 01/12188, WO 02/48114 і WO 02/70515], всі вони складені від імені заявника даної заявки. Конденсовані біциклічні сполуки, які включають залишок піразолу і володіють інгібуючою кіназу активністю, також розкриті [в WO 00/69846, WO 02/12242 і в WO 03/028720, ще не опублікованій заявці РСТ/ЕР03/04862 (яка має пріоритет по даті подачі заявки на патент США 60/381092, від 17 травня 2002 p.)], що належить заявнику даної заявки. У доповнення до вищевикладеного, похідні амінофенілпіперазину або амінофенілпіперидину, які володіють інгібуючою активністю відносно пренілтрансферазних протеїнів, розкриті [в WO 02/30927, що належить Pierre Fabre Medicament.] Сполуки даного винаходу попадають в об'єм загальної формули вищезазначеної [заявки WO 02/12242], введеної в даний опис у вигляді посилання, але не представлені в ній конкретними прикладами. Сполуки формули (І) даного винаходу мають асиметричні атоми вуглецю і тому можуть існувати як індивідуальні оптичні ізомери, як рацемічні суміші або у вигляді будь-якої іншої суміші, яка містить переважаючу кількість одного з двох 81682 10 оптичних ізомерів, які всі маються на увазі в рамках даного винаходу. Крім того, застосування як протипухлинного агента всіх можливих ізомерів і їх сумішей, метаболітів і фармацевтично прийнятних біопопередників (інакше званих як проліки) сполук формули (І) також входить в об'єм даного винаходу. Проліки являють собою будь-які ковалентнозв'язані сполуки, які вивільняють активну початкову лікарську сполуку формули (І) in vivo. У випадках, коли сполуки можуть існувати в таутомерних формах, кожна форма передбачається включеною в даний винахід незалежно від того, чи існує в рівновазі або в переважаючій одній формі. Таким чином, якщо не обумовлено особливо, у випадках, коли вказана тільки одна з наступних таутомерних форм формули (Іа) або (Іb), інша форма, що залишилася, передбачається включеною в об'єм даного винаходу: У даному описі, якщо не обумовлено особливо, під терміном "лінійний або розгалужений С1-С3 або С1-С4-алкіл" автори мають на увазі будь-яку з груп, таку як, наприклад, метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, третбутил і втор-бутил. Під терміном "лінійний або розгалужений С1С3-алкокси" автори мають на увазі будь-яку з груп, таку як, наприклад, метокси, етокси, н-пропокси і ізопропокси. Під терміном "атом галогену" автори мають на увазі атом фтору, хлору, брому або йоду. Під терміном "С3-С6-циклоалкіл" автори мають на увазі будь-яку з груп, таку як циклопропіл, циклобутил, циклопентил або циклогексил. Очевидно, що в залежності від природи групи X, цей же гетероцикл, приєднаний до феніленового фрагмента сполук формули (І), може являти собою піперидино, 4фторпіперидино, піперазино, 4-алкілпіперазино, 4циклоалкілпіперазино або морфоліноцикл. Фармацевтично прийнятні солі сполук формули (І) включають кислотно-адитивні солі з неорганічними або органічними кислотами, такими як, наприклад, азотна, хлористоводнева, бромистоводнева, сірчана, перхлорна, фосфорна, оцтова, трифтороцтова, пропіонова, гліколева, молочна, щавлева, малонова, яблучна, малеїнова, винна, лимонна, бензойна, корична, мигдалева, метансульфонова, ізетіонова і саліцилова кислоти. Переважний клас сполук даного винаходу представлений похідними формули (І), в якій R означає водень або метил; К] вибраний з гідрокси, метилу або метокси; R2 означає водень або атом 11 фтору; X вибраний з метилену, трифторметилену, -О- або -NR', де R' приймає значення, визначені вище. Як посилання на будь-яку визначену сполуку формули (І), необов'язково у вигляді фармацевтично прийнятної солі, див. експериментальну частину і формулу винаходу. Як зазначено раніше, наступний об'єкт даного винаходу належить до способу одержання сполук формули (І) і їх фармацевтично прийнятних солей, і даний спосіб включає: де R і X приймають значення, визначені вище, Q являє собою нижчу алкільну групу, t-Bu означає трет-бутил і Z являє собою гідрокси або відповідну відхідну групу, для одержання сполуки формули (IV) b) перетворення сполуки формули (IV) в кислотних умовах на сполуку формули (V) c) взаємодію сполуки формули (V) із сполукою формули (VI) де R1 і R2 приймають значення, визначені вище, і Z' являє собою гідрокси або відповідну відхідну групу, для одержання сполуки формули (VII) 81682 12 a) взаємодію сполуки формули (II) із сполукою формули (III) d) перетворення сполуки формули (VII) в основних умовах на відповідну сполуку формули (І) і, якщо бажано, перетворення її на фармацевтично прийнятну сіль. Спосіб, описаний вище, являє собою спосібаналог, який може бути здійснений проведенням в дуже добре відомих методичних умовах. У відповідності зі стадією (а) способу, взаємодія між сполуками формул (II) і (III) може бути проведена різними шляхами згідно із звичайними способами ацилування амінопохідних. Як приклад, сполука формули (II) може бути піддана взаємодії з ацилхлоридом формули (III), де Z означає атом хлору як відповідна відхідна група. Переважно, дану реакцію проводять при температурі, що змінюється від кімнатної температури до приблизно 60°С, у відповідному розчиннику, такому як, наприклад, тетрагідрофуран або дихлорметан, і в присутності акцептора протона, такого як триетиламін або діізопропілетиламін. У сполуках формули (II) Q являє собою нижчу алкільну групу, наприклад, С1-С4-алкільну групу, більш переважно метил або етил. У відповідності зі стадією (Ь) способу, із сполуки формули (IV) може бути легко видалений захист біля атома азоту піролідину при обробці кислотою. Дана реакція може бути зручно проведена в присутності мінеральної або органічної кислоти, такої як, наприклад, хлористоводнева, трихлороцтова або метансульфонова кислота, у придатному розчиннику, такому як дихлорметан, 1,4-діоксан, нижчий спирт (наприклад метанол або етанол), при температурі, що знаходиться в інтервалі від кімнатної температури до приблизно 40°С, і протягом періоду часу, що змінюється від приблизно 1 години до приблизно 48 годин. Сполука формули (V), одержана таким чином, потім зазнає взаємодії, згідно зі стадією (с) способу, із сполукою формули (VI). З 13 вищесказаного кваліфікованому фахівцеві ясно, що дана реакція ацилування може бути виконана різними шляхами і в різних методичних умовах, які широко відомі в даній галузі для приготування карбоксамідів. Реакція між сполукою формули (V) і карбоновою кислотою формули (VI), де Z' означає гідрокси, може бути проведена в присутності конденсуючого агента, такого як, наприклад, карбодіімід, тобто 1,3-дициклогексилкарбодіімід, 1,3-діізопропілкарбодіімід, 1-(3диметиламінопропіл)-3-етилкарбодіімід, Nциклогексилкарбодіімід-N'пропілоксиметилполістирол або Nциклогексилкарбодимід-М'-метилполістирол, у придатному розчиннику, такому як, наприклад, дихлорметан, хлороформ, тетрагідрофуран, діетиловий ефір, 1,4-діоксан, ацетонітрил, толуол або N,N[-диметилформамід, при температурі, що знаходиться в інтервалі від приблизно -10°С до кипіння із зворотним холодильником, протягом відповідного періоду часу, тобто від приблизно 30 хвилин до приблизно 96 годин. Вказана реакція необов'язково проводиться в присутності придатного каталізатора, наприклад, 4диметиламінопіридину, або в присутності додаткового конденсуючого реагенту, такого як Nгідроксибензотриазол. Реакція між сполукою формули (V) і сполукою формули (VI) може бути також проведена, наприклад, методом змішаних ангідридів, із застосуванням алкілхлорформіату, такого як етил, ізобутил або ізопропілхлорформіат, в присутності третинної основи, такої як триетиламін, N,Nдіізопропілетиламін або піридин, у придатному розчиннику, такому як, наприклад, толуол, дихлорметан, хлороформ, тетрагідрофуран, ацетонітрил, діетиловий ефір, 1,4-діоксан або N,Nдиметилформамід, при температурі, що знаходиться в інтервалі від приблизно -30°С до кімнатної температури. Реакція між сполукою формули (V) і карбоксильним похідним формули (VI), де Z' означає придатну відхідну групу, може бути проведена в присутності третинної основи, такої як триетиламін, N,N-діізопропілетиламін або піридин, у придатному розчиннику, такому як толуол, дихлорметан, хлороформ, діетиловий ефір, тетрагідрофуран, ацетонітрил або М,Мдиметилформамід, при температурі, що знаходиться в інтервалі від приблизно -10°С до кипіння із зворотним холодильником. Сполуки формули (V) характеризуються присутністю асиметричного атома вуглецю з приєднаним до нього R1 який нижче позначений зірочкою 81682 14 Отже, сполуки формули (VI) можуть бути або у формі одного з енантіомерів, або у вигляді їх сумішей, також численних рацемічних сумішей. Ясно, що в залежності від природи сполуки формули (VI), яка застосовується за способом даного винаходу, могли б бути одержані відповідні сполуки формули (VII), що мають належну визначену стереохімію при тому ж самому атомі вуглецю. Згідно з переважним варіантом здійснення даного винаходу стадію (с) проводять взаємодією придатної сполуки формули (VI), яка знаходиться в заданій енантіомерній формі. Крім того, якщо застосовуються рацемічні суміші сполуки формули (VI), і кожного разу, коли бажано одержати кінцеві сполуки формули (І) в оптично чистій формі, буде потрібне оптичне розділення проміжної сполуки формули (VII) або, в альтернативному випадку, кінцевої сполуки формули (І) за допомогою обробки звичайними способами. Як приклад, звичайні методики для розділення рацематів включають, наприклад, роздільну кристалізацію діастереомерних солей або препаративну хіральну ВЕРХ (HPLC). Нарешті, у відповідності зі стадією (d) способу, із сполуки формули (VII) видаляється захист при атомі азоту піразолу обробкою звичайними способами, що приводять, наприклад, до селективного гідролізу карбаматної групи. Як приклад, дана реакція може бути проведена в основних умовах, наприклад, в присутності гідроксиду натрію, калію або літію або третинного аміну, такого як триетиламін, і у відповідному розчиннику, такому як N,Nдиметилформамід, метанол, етанол, тетрагідрофуран, вода або їх суміші. Звичайно реакція проводиться при температурі, що знаходиться в інтервалі від кімнатної температури до приблизно 60°С, протягом періоду часу від приблизно 30 хвилин до приблизно 96 годин. Нарешті, фармацевтично прийнятні солі сполук формули (І) або, в альтернативному випадку, вільні сполуки з їх солей можуть бути всі одержані традиційними способами. Вихідні продукти способу даного винаходу відомі або легко одержувані відомими способами. Як приклад, одержання сполуки формули (II), де Q являє собою етил, розкрите у вищезазначеній [міжнародній патентній заявці WO 02/12242 (див., зокрема, приклад 26 на сторінці 249]; та ж сама сполука названа тут як складний 5трет-бутиловий ефір, складний 1-етиловий ефір 3аміно-4,6-дигідропіроло[3,4-с]піразол-1,5дикарбонової кислоти). Аналогічним шляхом з таким же успіхом можуть бути приготовані додаткові сполуки формули (II), де Q являє собою нижчу алкільну групу, відмінну від етилу. Сполуки формул (III) і (VI), наприклад, ті, в якихZ і Z' являють собою атом галогену, наприклад, атом хлору, є або відомими, або можуть бути легко одержані з відповідних відомих карбонових кислот за методиками традиційних способів. 15 Крім того, кваліфікованому фахівцеві в даній галузі повинно бути ясно, що якщо сполука формули (І), приготована за вищенаведеним способом з охопленням будь-яких його варіантів, одержана у вигляді суміші ізомерів, то їх розділення на індивідуальні ізомери формули (І), що виконується за традиційними методиками, знаходиться все ж в об'ємі даного винаходу. ФАРМАКОЛОГІЯ Сполуки формули (І) активні як інгібітори протеїнкінази, більш конкретно, як інгібітори Авроракіназ, і тому застосовні, наприклад, для обмеження проліферації неконтрольованих пухлинних клітин. У терапії вони можуть бути використані в лікуванні різних пухлин, таких як названі раніше, а також в лікуванні інших клітинних проліферативних порушень, таких як псоріаз, проліферація клітин гладких м'язів судин, пов'язана з атеросклерозом, і післяопераційний стеноз і рестеноз. Інгібуюча активність і ефективність вибраних сполук визначена за способом аналізу, заснованим на застосуванні SPA технології (Amersham Pharmacia Biotech). Аналіз включає перенесення радіоактивноміченого фосфатного фрагмента кіназою на біотинільований субстрат. ЗЗР-міченому біотинільованому продукту, що утворюється, дозволяють зв'язатися зі стрептавідинпокритими SPA гранулами (навантаження біотину 130 пмоль/мг), і вимірюють світлове випромінювання сцинтиляційним лічильником. Визначення інгібування активності Аврори-2 Кіназна реакція: 8мкМ біотинільованого пептиду (4 повтори LRRWSLG), 10мкМ АТФ (0,5мкКі Р33у-АТР), 7,5 нг Аврори-2, інгібітор в кінцевому об'ємі, рівному 30мкл буфера (HEPES 50мМ рН=7,0, MgCl2 10мМ, 1мМ DTT, 0,2мг/мл BSA, 3 мкМ ортованадат) додавали в кожну комірку 96-ямкового планшета з U-подібним дном. Після 60-хвилинної інкубації при кімнатній температурі реакцію припиняли і біотинільований пептид поглинали додаванням 100мкл суспензії гранул. Стратифікація: 100мкл CgCl2 5М додавали в кожну ямку і залишали на 4 години перед визначенням радіоактивності за допомогою лічильника Top-Count. Визначення ІС50: інгібітори випробовували при різних концентраціях, що знаходяться в інтервалі від 0,0015 до 10мкМ. Експериментальні дані аналізували за допомогою комп'ютерної програми GraphPad Prizm з використанням чотирипараметрового логарифмічного рівняння: у = нижнє значення + (верхнєнижнє)/(1+10Ù((logIC50 - х)(* нахил)), де х являє собою логарифм концентрації інгібітору, у являє собою відповідь; у приймає значення від нижнього до верхнього по сигмоїдному типу. Обчислення Кі: Експериментальний спосіб: реакцію проводили в буфері (10мМ Tris, pH 7,5, 10мМ MgCl2, 0,2мг/мл BSA, 7,5мМ DTT), що містить 3,7 нМ ферменту, гістон і АТФ (постійне відношення: 81682 16 що не містить радіоактивності/мічений АТФ 1/3000). Реакцію припиняли з допомогою ЕДТА і субстрат розташовували на фосфомембрані (96ямкові планшети Multiscreen від Millipore). Після інтенсивного промивання планшети оцінювали на лічильнику. Вимірювали контроль для кожного АТФ (час нуль) і концентрації гістону. Моделювання досвіду: швидкості реакції вимірювали при чотирьох концентраціях АТФ, субстрат (гістон) і інгібітору. Матрицю 80-точкової концентрації будували на основі відповідних величин АТФ і Km величин субстрату і ІС50 величин інгібітору (0,3, 1, 3, 9 вказували на Km або ІС50 величини). Попередній досвід за оцінкою тимчасового режиму за відсутності інгібітору і при різних концентраціях АТФ і субстрату дозволяє вибрати один остаточний час (10 хвилин) в лінійному діапазоні реакції для експерименту по визначенню Кі. Оцінка кінетичних параметрів: кінетичні параметри оцінювали спільною нелінійною регресією методом найменших квадратів, використовуючи рівняння 1 (конкурентний інгібітор відносно АТФ, довільний механізм) і повний набір даних (80 точок): n= Vm × A × B K B a × K a × K b + a × K a × B + a × K b × A + A × B + a × a × I × (K b + ) b Ki рівняння 1, де А = АТФ, В = субстрат, 7 = інгібітор, Vm = максимальна швидкість, Ка, Kb, Кі - константи дисоціації АТФ, субстрату і інгібітору, відповідно, a і β - кооперативний фактор зв'язування між субстратом і АТФ і зв'язування між субстратом і інгібітором, відповідно. Сполуки даного винаходу, крім того, були перевірені in vitro для оцінки антипроліферативного ефекту на культурах клітин і інгібуючого ефекту на клітинний цикл. Визначення клітинної проліферації in vitro Клітинну лінію НСТ-116 раку товстої кишки людини висівали при 5000 клітин/см2 в 24-ямковий планшет (Costar), використовуючи середу F12 (Gibco), що містить 10% FCS (EuroClone, Italy), 2мМ L-глутамін і 1% пеніцилін/стрептоміцин, і підтримували при 37°С, в 5% СО2 і при 96% відносній вологості. На наступний день планшети обробляли двічі 5мкл розчину сполук у відповідному розбавленні, починаючи від 10мМ вихідного зразка в ДМСО. Дві необроблені контрольні комірки включали в кожний планшет. Через 72 години після обробки середу видаляли і клітини витягували з кожної комірки, застосовуючи 0,5мл 0,05% (мас/об.) трипсину, 0,02% (мас/об.) ЕДТА (Gibco). Зразки розбавляли 9,5мл ізотону (Coulter) і знімали дані за допомогою лічильника Multisizer 3 cell (Beckman Coulter). Дані представляли у вигляді процента від контрольних комірок: % CTR=(оброблений-чистий)/(контрольчистий) Величини ІС50 розраховували за методом LSW із застосуванням Microsoft Excel апроксимації сигмоїдальної кривої. 17 Визначення in vitro клітинного циклу Клітинну лінію НСТ-116 раку товстої кишки людини висівали при 5000 клітин/см2 в 24-ямковий планшет (Costar) і культивували, як відмічено вище. Клітини в їх експонентній фазі росту обробляли протягом 24 годин різними концентраціями сполуки. Також збирали супернатант культурального середовища для того, щоб уникнути втрати апоптичних або мітотичних клітин, що відділилися. Після цього клітини промивали, застосовуючи PBS, і відділяли 0,05% (мас/об.) трипсином, 0,02% (мас/об.) ЕДТА (Gibco). Активність трипсину переривали використанням культурального середовища. Злиті і незлиті фракції клітин об'єднували і центрифугували при 2000 об./хв. протягом 10 хвилин. Клітини ресуспендували в PBS і знімали дані за допомогою лічильника Multisizer 3 cell (Beckman Coulter). Для фіксації додавали етанол (70%, об./об.) і клітини витримували протягом ночі при 20°С. Один мільйон фіксованих клітин центрифугували при 2000об./хв. протягом 5 хвилин і промивали за допомогою PBS і потім забарвлювали протягом 1 години при кімнатній температурі в темряві додаванням 200мкл: 25мкг/мл пропідій йодид (Sigma) і 15 мкг/мл рибонуклеази A (RNAse A, Sigma), 0,001% (об./об.) Nonidet P40 (Sigma) в цитраті натрію (0,1% мас/об., рН 7,5). Зразки аналізували проточною цитометрією при 488 нм збудженні (FACSCalibur, Beckton Dickinson) з програмним забезпеченням Cell Quest 3,0 (Beckton Dickinson). Звичайно відбирали 10000 подій (активація подвійних різних модулів DDM і утворення тільки одиничних клітин) і профілі клітинного циклу фіксували за допомогою CellQuest (Verity Software). Розподіл клітинного циклу популяції розраховували за допомогою модифікованої моделі в програмному забезпеченні Modfit 3.1 (Verity Software) і виражали в % G0/G1, S, G2/M і поліплоїдії. За даними вищенаведених аналізів сполуки формули (І) винаходу володіли значною інгібуючою активністю у відношенні протеїнкінази, наприклад, інгібуючою активністю відносно Аврори-2. Як приклад дивіться представлену далі таблицю 1, що являє собою експериментальні дані чотирьох типових сполук винаходу, випробуваних як інгібітори кінази Аврора-2 (ІС50нМ), по їх клітинному антипроліферативному ефекту (ІС50нМ) і по їх здатності здійснювати блокування клітинного циклу і викликати поліплоїдію (% G2/M + поліплоїдія при 200нМ). Цікаво, що ті ж самі сполуки були перевірені в порівнянні зі структурно дуже близькою сполукою попереднього рівня, визначеною тут як посилальна сполука, яка, зокрема, розкрита у вищезазначеній заявці WO 02/12242 - див. сторінку 160, строки 5-7; посилальна сполука там названа як N-{5-фенілацетил-4,6дигідропіроло[3.4-е]піразол-3-іл}-4-(4метилпіперазино)бензамід 81682 18 Посилальна сполука (R = R1 = R2 = Н; X = NMe) N-{5-фенілацетил-4,6-дигідропіроло[3,4с]тразол-3-іл}-4-(4-метилпіперазино)бензамід. Сполука (1) (R = R2 = Н; R1 = ОМе; X = NMe) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpoпipoлo[3,4-c]пipaзoл-3-іл}-4-(4метилпіперазин-1-іл)бензамід. Сполука (11) (R = R2 = Н; R1 = Me; X = NMe) N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід. Сполука (6) (R = R2 = Н; R1 = ОМе; X = СН2) N-{5-[(2R)-2-мeтoкcи-2-фeнiлeтaнoїл]-1,4,5,6тeтpaгiдpompoлo[3.4-c]пipaзoл-3-іл}-4-піперидин-1ілбензамід. Сполука (5) (R = Me; R, - ОМе; R2 = Н; X = NMe) 4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2метокси-2-фенілетаноіл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}бензамід. Таблиця 1 Сполука Посилальна сполука відсутня (1) (11) (6) (5) Інгібування Аврори-2, ІС50(нМ) 140 16 63 37 18 АнтипроліБлокування ферація клітинного циклу клітин, (%G2/M+поліплоїдія ІС50(нМ) при 200нМ) 220 31 17 30 50 33 19 90 90 90 90 Несподівано виявлено, що одержана інгібуюча активність сполук даного винаходу відносно Аврори-2 є постійною і такою, що значно перевищує подібну активність посилальної сполуки. Крім того, ті ж самі сполуки володіли клітинним антипроліферативним ефектом разом із здатністю блокувати клітинний цикл і викликати поліплоїдію, значно перевищуючи подібні ефекти посилальної сполуки, перевіреної в тих же умовах. Зі всього вищевикладеного очевидно, що нові сполуки формули (І) даного винаходу володіють біологічним профілем, що розглядається як ціле, який несподівано перевищує активність найближчого попереднього рівня по [заявці WO 02/12242], і, отже, є особливо переважними в 19 терапії проти проліферативних порушень, пов'язаних із зміненою активністю кінази Аврора-2. Сполуки даного винаходу можуть бути введені як індивідуальні агенти або, альтернативно, в комбінації з відомими протираковими терапіями, такими як променева терапія, або як режим хіміотерапії в комбінації з цитостатичними або цитотоксичними агентами, антибіотиками, алкілуючими агентами, антиметаболітами, гормональними агентами, імунологічними агентами, агентами типу інтерферону, інгібіторами циклооксигенази (наприклад інгібітори СОХ-2), інгібіторами матриксметалопротеази, інгібіторами теломерази, інгібіторами тирозинкінази, агентами проти рецептора фактора росту, анти-HER агентами, анти-EGFR агентами, агентами проти розвитку кровоносних судин (наприклад інгібітори ангіогенезу), інгібіторами фарнезилтрансферази, інгібіторами ras-raf сигналтрансдукторної системи клітини, інгібіторами клітинного циклу, іншими cdks інгібіторами, агентами, що зв'язують тубулін, інгібіторами топоізомерази І, інгібіторами топоізомерази II і т.п. У разі приготування фіксованої дози в таких комбінованих продуктах сполуки даного винаходу використовуються в інтервалі дозувань, описаних нижче, і інший фармацевтично активний засіб в інтервалі затверджених дозувань. Сполуки формули (І) можуть бути застосовані послідовно з відомими протираковими агентами, коли комбінований препарат протипоказаний. Сполуки формули (І) даного винаходу, придатні для введення ссавцем, наприклад, людям, можуть бути введені звичайними шляхами і рівень доз залежить від віку, маси, станів пацієнта і шляху введення. Наприклад, відповідне дозування, прийняте для перорального введення сполуки формули (І), може знаходитися в інтервалі від приблизно 10 до приблизно 500 мг на дозу, від 1 до 5 прийомів на добу. Сполуки даного винаходу можуть бути введені в різних лікарських формах, наприклад, перорально в формі таблеток, капсул, цукрових таблеток або таблеток з плівковим покриттям, рідких розчинів або суспензій; ректально в формі супозиторіїв; парентерально, наприклад, внутрішньом'язово, або шляхом внутрішньовенної і/або внутрішньооболонкової, і/або внутрішньоспінальної ін'єкції або інфузії. Даний винахід також включає фармацевтичні композиції, які містять сполуку формули (І) або її фармацевтично прийнятну сіль в поєднанні з фармацевтично прийнятним наповнювачем, який може бути носієм або розріджувачем. Фармацевтичні композиції, які містять сполуки даного винаходу, звичайно приготовляють наступними традиційними способами і вводять у відповідній фармацевтичній формі. Наприклад, тверді форми для перорального введення можуть містити разом з активною сполукою розріджувачі, наприклад, лактозу, декстрозосахарозу, сахарозу, целюлозу, кукурудзяний крохмаль або картопляний крохмаль; змащувальні агенти, наприклад, двоокис кремнію, тальк, стеаринову кислоту, стеарат магнію або кальцію і/або 81682 20 поліетиленгліколі; зв'язуючі речовини, наприклад, крохмаль, аравійську камедь, желатиновану метилцелюлозу, карбоксиметилцелюлозу або полівінілпіролідон; дезінтегруючі агенти, наприклад, крохмаль, альгінову кислоту, альгінат або натрійгліколят крохмалю; спінювальні суміші; барвники; підсолоджувачі; змочувальні речовини, такі як лецитин, полісорбати, лаурилсульфати; і, загалом, нетоксичні і фармакологічно неактивні речовини, що використовуються в фармацевтичних препаратах. Дані фармацевтичні препарати можуть бути виготовлені відомим способом, наприклад, за допомогою змішування, гранулювання, таблетування і способами покриття цукром і оболонкою. Рідкі дисперсії для перорального введення можуть являти собою, наприклад, сиропи, емульсії і суспензії. Як приклад, сиропи можуть містити як носій сахарозу або сахарозу з гліцерином і/або маніт і сорбіт. Суспензії і емульсії можуть містити як приклади носіїв природну смолу, агар, альгінат натрію, пектин, метилцелюлозу, карбоксиметилцелюлозу або полівініловий спирт. Суспензії або розчини для внутрішньом'язових ін'єкцій можуть містити, нарівні з активною сполукою, фармацевтично прийнятний носій, наприклад, стерильну воду, оливкове масло, етилолеат, гліколі, наприклад, пропіленгліколь, якщо бажано, придатну кількість гідрохлориду лідокаїну. Розчини для внутрішньовенних ін'єкцій або інфузій можуть містити як носій стерильну воду абопереважно вони можуть знаходитися у вигляді стерильних, водних, ізотонічних, фізіологічних розчинів або можуть містити пропіленгліколь як носій. Супозиторії можуть містити, нарівні з активною сполукою, фармацевтично прийнятний носій, наприклад, масло какао, поліетиленгліколь, сурфактант, такий як складний ефір жирної кислоти і поліоксіетиленсорбітану, або лецитин. Нижче наведені наступні приклади для кращої ілюстрації даного винаходу, але без обмеження тільки ними. ПРИКЛАДИ Загальні методи Флеш-хроматографію виконували на силікагелі (Merck grade 9385, 60А). ВЕРХ/МС (HPLC/MS) виконували на колонці Waters X Terra RP 18 (4,6×50мм, 3,5мкм), використовуючи систему ВЕРХ Waters 2790, забезпечену 996 Waters PDA детектором, і на Micromass mod. ZQ ординарному квадрупольному мас-спектрометрі, забезпеченому електророзпилювальним іонним джерелом (ESI). Рухома фаза А являла собою 5 мМ ацетатамонійний буфер (рН 5,5, оцтова кислота/ацетонітрил 95:5), рухома фаза В являла собою Н2О/ацетонітрил (5:95). Градієнт від 10 до 90% В 8 хвилин, витримували 90% В 2 хвилини. УФ-визначення при 220нм і 254нм. Швидкість потоку 1 мл/хв. Об'єм проби 10 мкл. Повне сканування, інтервал маси від 100 до 800 amu (атомні одиниці маси). Капілярне напруження становило 2,5KB; джерело температури було при 21 120°С; конус/пучок мав 10В. Години утримування (ВЕРХ, кімнатна температура) подані в хвилинах при 220нм або 254нм. Маса дана як відношення m/z. 1Н-ЯМР спектроскопія виконана на Mercury VX 400 при 400,45МГц, забезпеченому 5мм подвійною резонансною пробою (1Н {15N31P}ID_PFG Varian). Приклад 1 Одержання 5-трет-бутил 1-етил 3-аміно-4,6дигідропіроло[3.4-с]піразол-1,5-дикарбоксилату Розчин етилхлоркарбонату (8,9мл, 93ммоль) в тетрагідрофурані (ТГФ, 250мл) повільно додавали до суміші трет-бутил 3-аміно-4,6-дигідропіроло[3.4с]піразол-5(Ш)-карбоксилату (20г, 89ммоль) і діізопропілетиламіну (DIEA, 92мл, 528ммоль) в ТГФ (500мл) при 0-5°С. Реакцію підтримували при тій же температурі протягом двох годин, потім суміші дозволяли досягнути кімнатної температури і перемішували протягом ночі. Одержану суміш упарювали у вакуумі досуха і залишок, що утворився, екстрагували етилацетатом (AcOEt) і водою. Органічний шар відділяли, сушили над сульфатом натрію і упарювали досуха. Суміш очищали флеш-хроматографією (елюент: етилацетат/циклогексан від 4/6 до 7/3), одержуючи 19 г зазначеної в заголовку сполуки у вигляді білої твердої речовини [М+Н]+ 297. Приклад 2 Одержання 5-трет-бутил 1-етил 3-{[4-(4метилпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-с]піразол-1,5-дикарбоксилату Оксалілхлорид (23,2мл, 265ммоль) додавали до суспензії 4-(4-метил-1-піперазиніл)бензойної кислоти (11,7г, 53ммоль) в дихлорметані (DCM, 320мл) і диметилформаміді (ДМФА, 0,52мл). Після кип'ятіння суміші із зворотним холодильником протягом 6,5 години леткі компоненти ретельно видаляли при зниженому тиску (при цьому залишок три рази переводили в толуол). Дигідрохлорид 4метилпіперазинобензоїлхлориду, що утворився, додавали порціями до розчину 5-трет-бутил 1етил 3-аміно-4,6-дигідропіроло[3.4-с]піразол-1,5дикарбоксилату (13,1г, 44,3ммоль) в сухому ТГФ (620мл) і DIEA (54,4мл, 0,32моль) при перемішуванні при кімнатній температурі. Одержану суспензію перемішували 16 годин при кімнатній температурі і 1 годину при 40°С. Після видалення розчинника при зниженому тиску залишок обробляли AcOEt (600мл) і органічний шар промивали водним карбонатом натрію (200мл), насиченим сольовим розчином (200мл) і сушили над сульфатом натрію. Розчинник випаровували, залишок розтирали в суміші діетилового ефіру (EtaO, 135мл) і AcOEt (15мл), фільтрували, сушили у вакуумі при 40°С, одержуючи 20г зазначеної в заголовку сполуки у вигляді білого порошку [М+Н]+ 499. Аналогічним способом і при взаємодії 5-третбутил 1-етил 3-аміно-4,6-дигідропіроло[3.4с]піразол-1,5-дикарбоксилату з відповідним ацилхлоридним похідним одержували наступні сполуки: 81682 22 5-трет-бутил 1-етил 3-{[4-(4-етилпіперазин-1іл)бензоїл]аміно}-4,6-дигідропіроло[3.4-с]піразол1,5-дикарбоксилат, [М+Н]+ 513, 5-трет-бутил 1-етил 3-{[4-(4ізопропілпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-(5)с]піразол-1,5-дикарбоксилат, [М+Н]+ 527, 5-трет-бутил 1-етил 3-{[4-(4циклопропілпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-с]піразол-1,5-дикарбоксилат, [М+Н]+ 525, 5-трет-бутил 1-етил 3-{[4-(3,4диметилпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-с]піразол-1,5-дикарбоксилат, [М+Н]+ 513, 5-трет-бутил 1-етил 3-[(4-піперидин-1ілбензоїл)аміно]-4,6-дигідропіроло[3.4-с]піразол1,5-дикарбоксилат, [М+Н]+ 484, 5-трет-бутил 1-етил 3-{[4-(4-фторпіперидин-1іл)бензоїл]аміно}-4,6-дигідропіроло[3.4-с]піразол1,5-дикарбоксилат, [М+Н]+ 502, 5-трет-бутил 1-етил 3-[(4-морфолін-4ілбензоїл)аміно]-4,6-дигідропіроло[3.4-с]піразол1,5-дикарбоксилат, [М+Н]+ 486, 5-трет-бутил 1-етил 3-{[4-(4-третбутилпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-(5)с]піразол-1,5-дикарбоксилат; [М+Н]+ 541. Приклад 3 Одержання тригідрохлориду етил 3-{[4-(4метилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату 4H розчин хлористоводневої кислоти в діоксані (122мл, 488ммоль) додавали по краплях до перемішуваного розчину 5-трет-бутил 1-етил 3{[4-(4-метилпіперазин-1-іл)бензоїл]аміно}-4,6дигідропіроло[3.4-с]піразол-1,5-дикарбоксилату (19,5г, 39,2ммоль), одержаного в прикладі 2, в сухому DCM (240мл); при цьому майже відразу відбувалося осаджування білої твердої речовини. Одержану суміш перемішували при кімнатній температурі протягом 24 годин; після розбавлення ефіром Et2O (100мл) тверду речовину фільтрували, інтенсивно промивали Et2O і сушили у вакуумі при 50°С, одержуючи 20,1г зазначеної в заголовку сполуки, використаної на наступній стадії без подальшого очищення. [М+Н]+ 399. 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,4 (т, 3Н); 2,8 (д, 3Н); 3,2 (м, 4Н); 3,5 (м, 2Н); 4,1 (м, 2Н); 4,4 (кв., 2Н); 4,6 (м, 4Н); 7,1-8,0 (м, 4Н); 10,3 (ушир.с, 2Н); 10,7 (ушир.с, 1Н);11,4(с, 1Н). Додержуючись вищеописаної методики і виходячи з відповідного проміжного продукту, аналогічно одержували наступні сполуки: тригідрохлорид етил 3-{[4-(4-етилпіперазин-1іл)бензоїл]аміно}-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилату, [М+Н]+ 413, тригідрохлорид етил 3-{[4-(4ізопропілпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату, [М+Н]+ 427, тригідрохлорид етил 3-{[4-(4циклопропілпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату, [М+Н]+ 425, 23 тригідрохлорид етил 3-{[4-(3,4диметилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату, [М+Н]+ 413, етил 3-[(4-піперидин-1-ілбензоїл)аміно]-5,6дигідропіроло[3.4-с]шразол-1(4Н)-карбоксилат, [М+Н]+ 384, тригідрохлорид етил 3-{[4-(4-фторпіперидин-1іл)бензоїл]аміно}-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилату, [М+Н]+ 402, тригідрохлорид етил 3-{[4-(4-морфолін-4іл)бензоїл]аміно}-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилату, [М+Н]+ 386, тригідрохлорид етил 3-{[4-(4-третбутилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату, [М+Н]+ 441. Приклад 4 Одержання етил 5-[(2R)-2-метокси-2фенілетаноїл]-3-{[4-(4-метилпіперазин-1іл)бензоїл]аміно}-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилату Оксалілхлорид (10,12мл, 115ммоль) додавали до розчину R-(-)-a-метоксифенілоцтової кислоти (1,91г, 11,5ммоль) в DCM (90мл) і ДМФА (0,50мл). Після перемішування суміші при кімнатній температурі протягом 16 годин леткі компоненти ретельно відганяли при зниженому тиску. Розчин одержаного R-(-)-aметоксифенілацетилхлориду в DCM (20мл) додавали по краплях до розчину тригідрохлориду етил 3-{[4-(4-метилпіперазин-1-іл)бензоїл]аміно}5,6-дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилату (4,5г, 8,9ммоль) в DCM (400мл) і DIEA (11,8мл, 69ммоль) при перемішуванні при кімнатній температурі. Розчин, що утворився, перемішували протягом 20 годин при кімнатній температурі. Реакційну суміш потім промивали водним карбонатом натрію (200мл), насиченим сольовим розчином (200мл) і сушили над сульфатом натрію. Розчинник випаровували і залишок розтирали в суміші Et2O (100мл) і AcOEt (10мл), фільтрували і сушили у вакуумі при 40°С, одержуючи 3,94г зазначеної в заголовку сполуки у вигляді білого порошку, використаного на наступній стадії без додаткового очищення. [М+Н]+ 547; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,3 (т, 3Н); 2,3 (д, 3Н); 2,6 (м, 4Н); 3,3-3,4 (м, 7Н); 4,3 (кв., 2Н); 4,6-4,9 (м, 4Н); 5,1 (д, 1Н); 7,0-8,0 (м, 9Н); 11,1 (д, 1Н). Додержуючись вищеописаної методики і виходячи з відповідного ацилхлоридного похідного, аналогічно одержували наступні сполуки: етил 5-[(2R)-2-метокси-2-фенілетаноїл]-3-{[4(4-етилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 561, етил 5-[(2R)-2-метокси-2-фенілетаноїл]-3-{[4(4-ізопропілпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 575, етил 5-[(2R)-2-метокси-2-фенілетаноїл]-3-{[4(4-циклопропілпіперазин-1-іл)бензоїл]аміно]-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 573, 81682 24 етил 3-{[4-(3,4-диметилпіперазин-1іл)бензоїл]аміно}-5-[(2R)-2-метокси-2фенілетаноїл]-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилат, [М+Н]+ 561, етил 5-[(2R)-2-метокси-2-фенілетаноїл]-3-[(4піперидин-1-ілбензоїл)аміно]-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 532, етил 3-{[4-(4-фторпіперидин-1іл)бензоїл]аміно}-5-[(2Я)-2-метокси-2фенілетаноїл]-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилат, [М+Н]+ 550, етил 5-[(2R)-2-метокси-2-фенілетаноїл]-3-[(4морфолін-4-ілбензоїл)аміно]-5,6-дигідропіроло[3.4с]піразол-1(4Н)-карбоксилат, [М+Н]+ 534, етил 3-{[4-(4-трет-бутилпіперазин-1іл)бензоїл]аміно}-5-[(2R)-2-метокси-2фенілетаноїл]-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилат, [М+Н]+ 589, етил 5-[(2R)-2-метил-2-фенілетаноїл]-3-{[4-(4етилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 545, етил 5-[(2R)-2-метил-2-фенілетаноїл]-3-{[4-(4ізопропілпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 559, етил 5-[(2R)-2-метил-2-фенілетаноїл]-3-{[4-(4циклопропілпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 557, етил 3-{[4-(3,4-диметилпіперазин-1іл)бензоїл]аміно}-5-[(2R)-2-метил-2-фенілетаноїл]5,6-дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 545, етил 5-[(2R)-2-метил-2-фенілетаноїл]-3-[(4піперидин-1-ілбензоїл)аміно]-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 516, етил 3-{[4-(4-фторпіперидин-1іл)бензоїл]аміно}-5-[(2R)-2-метил-2-фенілетаноїл]5,6-дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 534, етил 5-[(2R)-2-метил-2-фенілетаноїл]-3-[(4морфолін-4-ілбензоїл)аміно]-5,6-дигідропіроло[3.4с]піразол-1(4Н)-карбоксилат, [М+Н]+ 518, етил 3-{[4-(4-трет-бутилпіперазин-1іл)бензоїл]аміно}-5-[(2R)-2-метил-2-фенілетаноїл]5,6-дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 573, етил 5-[(2R)-2-гідрокси-2-фенілетаноїл]-3-{[4(4-метилпіперазин-1-іл)бензоїл]аміно}-5,6дигідропіроло[3.4-с]піразол-1(4Н)-карбоксилат, [М+Н]+ 533. Приклад 5 Одержання N-{5-[(2R)-2-метокси-2фенілетаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}-4-(4-метилпіперазин-1-іл)бензаміду (1) Розчин етил 5-[(2R)-2-метокси-2фенілетаноїл]-3-{[4-(4-метилпіперазин-1іл)бензоїл]аміно}-5,6-дигідропіроло[3.4-с]піразол1(4Н)-карбоксилату (3,94г, 7,2ммоль) в метанолі (МеОН, 130мл) і триетиламіні (Et3N, 13мл) перемішували при кімнатній температурі протягом 25 16 годин (виділялася деяка кількість осаду). Тверду речовину відділяли і промивали ефіром Et2O, одержуючи 1,6г зазначеної в заголовку сполуки. Розчин упарювали до декількох мілілітрів і відділяли другу порцію твердого продукту (1,62г). Обидві порції об'єднували і аналізували за допомогою РХ-МС (LC-MS) (чистота близько 90% при 254 і 220нМ). Після хроматографічного очищення (коротка колонка з силікагелем, DCM/MeOH 45:5) одержували 2,83г (83%) зазначеної в заголовку сполуки у вигляді білої твердої речовини. Т. пл. 289°С; [М+Н]+ 475. 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 2,21 (с, 3Н); 2,43 (м, 4Н); 3,29 (м, 7Н); 4,20-4,90 (м, 4Н); 5,09 (с, 1Н) 6,80-8,00 (м, 9Н); 10,6 (ушир., 1Н); 12,09 (ушир., 1H). Аналогічним способом через гідроліз сполук прикладу 4 в присутності основи одержані наступні сполуки: (2)N-{5-[(2R)-2-метокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4етилпіперазин-1-іл)бензамід; [М+Н]+ 489; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,1 (т, 3Н); 2,3-2,7 (м, 6Н); 3,2-3,4 (м, 7Н); 4,3-6,0 (м, 4Н); 5,1 (д, 1H); 6,9-8,0 (м, 9Н); 10,6 (ушир.с, 1Н); 12,1 (ушир., 1Н). (3)N-{5-[(2R)-2-метокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4ізопропілпіперазин-1-іл)бензамід; [М+Н]+ 503; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,3-1,3 (дд, 6Н); 3,33,4 (м, 9Н); 4,6-4,9 (м, 4Н); 5,1 (д, 1Н); 7,0-8,0 (м, 9Н); 10,7 (ушир.с, 1H); 12,3 (ушир.с, 1H). (4)N-{5-[(2R)-2-метокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4циклопропілпіперазин-1-іл)бензамід; [М+Н]+ 501; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 0,3-0,5 (м, 4Н); 3,23,4 (м, 7Н); 3,2-5,0 (м, 4Н); 5,1 (д, 1Н); 6,8-8,2 (м, 9Н); 10,5-10,7 (ушир., 1Н); 12,0-12,4 (ушир., 1Н). (5)4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2R)-2метокси-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}бензамід; [М+Н]+489; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,0-1,1 (м, 3Н); 2,24 (с, ЗН); 3,3-3,5 (м, 7Н); 4,3-5,0 (м, 4Н); 5,1 (д, 1Н); 6,9-8,0 (м, 9Н); 10,6 (ушир.с, 1H); 11,9-12,6 (ушир., 1Н). (6)N-{5-[(2R)-2-метокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4піперидин-1-ілбензамід; [М+Н]+ 460; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,5-1,7 (м, 6Н); 3,23,4 (м, 7Н); 4,3-4,9 (м, 4Н); 5,1 (д, 1H); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., 1H). (7)4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2метокси-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}бензамід; [М+Н]+ 478; 'Н-ЯМР (ДМСО-ё6) 8 м.ч.: 1,65-2,1 (м, 4Н); 3,15-3,6 (м, 7Н); 4,35-5,0 (м, 5Н); 5,1 (д, 1Н); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., Ш). (8)Н-{5-[(2К)-2-метокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4морфолін-4-ілбензамід; [М+Н]+ 462; 1Н-ЯМР (ДМСО-(d6) δ м.ч.: 3,15-3,5 (м, 7Н); 3,7-3,8 (м, 4Н); 4,3-4,9 (м, Н); 5,1 (д, 1H); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., 1Н). 81682 26 (9)4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2метокси-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}бензамід; [М+Н]+ 517. (10)N-{5-[(2R)-2-гідрокси-2-фенілетаноїл]1,4,5,6-тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід; [М+Н]+ 461; 1 Н-ЯМР (ДМСО-(d6) δ м.ч.: 2,3 (с, 3Н); 2,452,65 (м, 4Н); 3,2-3,4 (м, 4Н); 4,1-4,9 (м, 4Н); 5,69 (д, 1Н); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., 1H); 11,5-12,9 (ушир., 1Н). (11)N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4метилпіперазин-1-іл)бензамід; [М+Н]+ 459; 1 Н-ЯМР (ДМСО-в6) δ м.ч.: 1,33 (д, 3Н); 2,21 (с, ЗН); 3,85-5,0 (м, 5Н); 4,2-4,9 (м, 4Н); 5,1 (с, 1Н), 6,8-8,0 (м, 9Н); 10,3-10,7 (ушир., 1Н); 11,8-12,5 (ушир., 1H). (12)N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4етилпіперазин-1-іл)бензамід; [М+Н]+ 473; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,06 (т, 3Н); 1,36 (д, 3Н); 2,41 (кв., 2Н); 2,47-2,6 (м, 4Н); 3,2-3,4 (м, 4Н); 3,9-5,0 (м, 5Н); 6,9-8,0 (м, 9Н); 10,5 (ушир.с, 1Н); 11,9-12,5 (ушир., 1Н). (13)N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4ізопропілпіперазин-1-іл)бензамід; [М+Н]+ 487. (14)N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-(4циклопропілпіперазин-1-іл)бензамід; [М+Н]+485. (15)4-(3,4-диметилпіперазин-1-іл)-N-{5-[(2К)-2фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; [М+Н]+ 473. (16)N-{5-[(2R)-2-фенілпропаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-піперидин-1ілбензамід; [М+Н]+ 444; 1 Н-ЯМР (ДМСО-(d6) δ м.ч.: 1,37 (д, 3Н); 1,6 (с, 6Н); 3,2-3,4 (м, 4Н); 3,90-4,05 (м, 1H); 4,1-4,9 (м, 4Н); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., 1Н). (17)4-(4-фторпіперидин-1-іл)-N-{5-[(2R)-2метил-2-фенілефаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}бензамід; [М+Н]+ 462; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,37 (д, 3Н); 1,652,05 (м, 4Н); 3,15-3,6 (м, 7Н); 3,2-3,4 (м, 4Н); 3,854,07 (м, 1Н); 4,1-5,05 (м, 5Н); 5,1 (д, 1H); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир., 1Н). (18)N-{5-[(2R)-2-метил-2-фенілетаноїл]-1,4,5,6тетрагідропіроло[3.4-с]піразол-3-іл}-4-морфолін-4ілбензамід; [М+Н]+ 446; 1 Н-ЯМР (ДМСО-d6) δ м.ч.: 1,37 (д, 3Н); 3,2-3,4 (м, 4Н); 3,7-3,85 (м, 4Н); 3,9-4,1 (м, 1Н); 4,1-4,95(м, 4Н); 6,9-8,0 (м, 9Н); 10,4-10,7 (ушир, 1Н). (19)4-(4-трет-бутилпіперазин-1-іл)-N-{5-[(2R)-2фенілпропаноїл]-1,4,5,6-тетрагідропіроло[3.4с]піразол-3-іл}бензамід; [М+Н]+ 501.
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;pyrrolo[3,4-c]pyrazole derivatives active as kinase inhibitors
Автори англійськоюDANIELE FANCELLI, Forte Barbara, Moll Jurgen, MARIO VARASI, PAOLA VIANELLO
Назва патенту російськоюПроизводные пироло[3,4-c]пиразола как ингибиторы киназы
Автори російськоюФанчелли Даниеле, Форте Барбара, Молль Юрген, Варази Марио, Вианелло Паола
МПК / Мітки
МПК: C07D 487/04, A61K 31/4162, A61P 35/00
Мітки: інгібітори, піроло[3.4-c]піразолу, похідні, кінази
Код посилання
<a href="https://ua.patents.su/13-81682-pokhidni-pirolo34-cpirazolu-yak-ingibitori-kinazi.html" target="_blank" rel="follow" title="База патентів України">Похідні піроло[3.4-c]піразолу як інгібітори кінази</a>
Попередній патент: Контейнер для транспортування і збереження вантажів
Наступний патент: Спосіб ректифікаційного очищення водно-спиртових розчинів
Випадковий патент: Спосіб інактивації насіння бобових культур та пристрій для його здійснення












