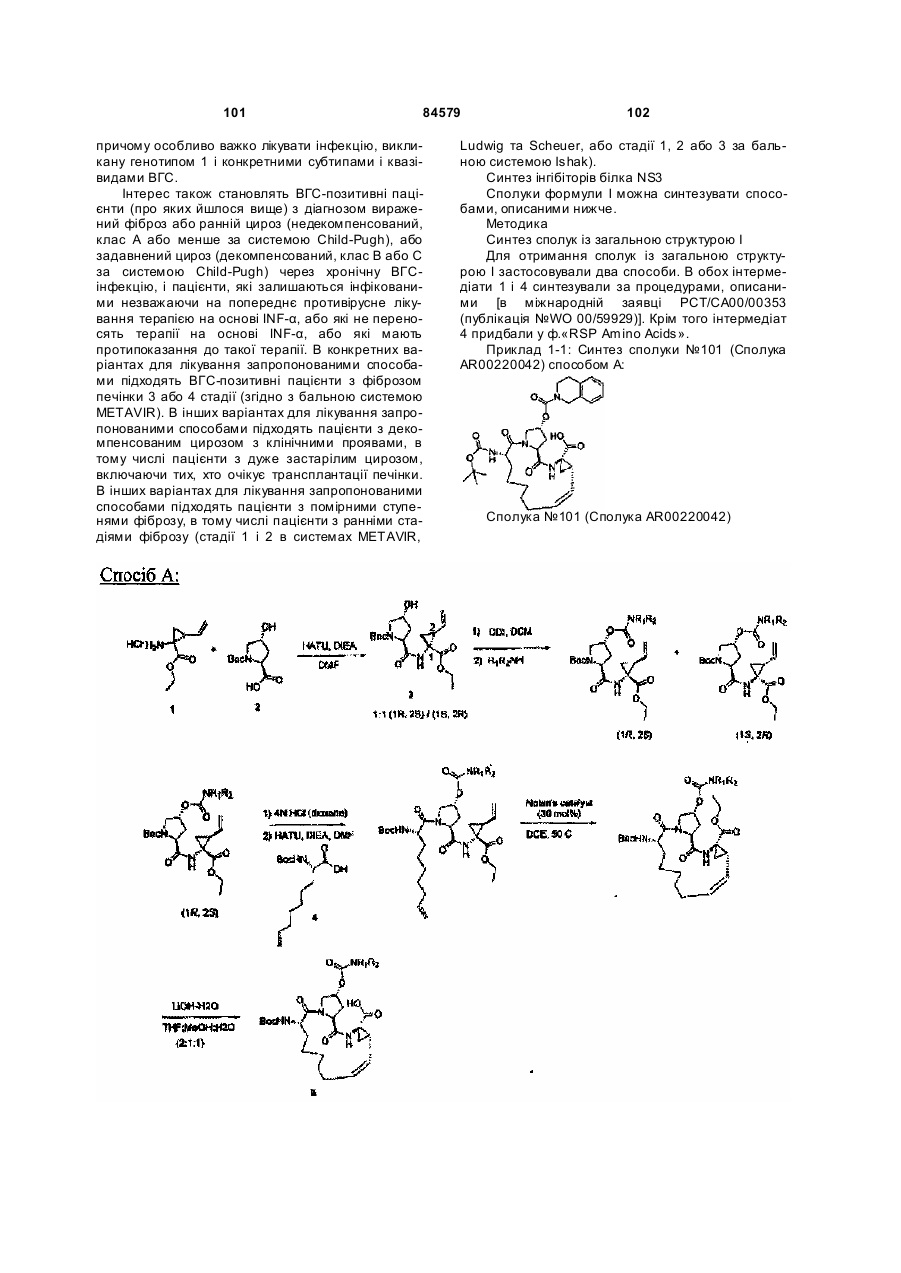
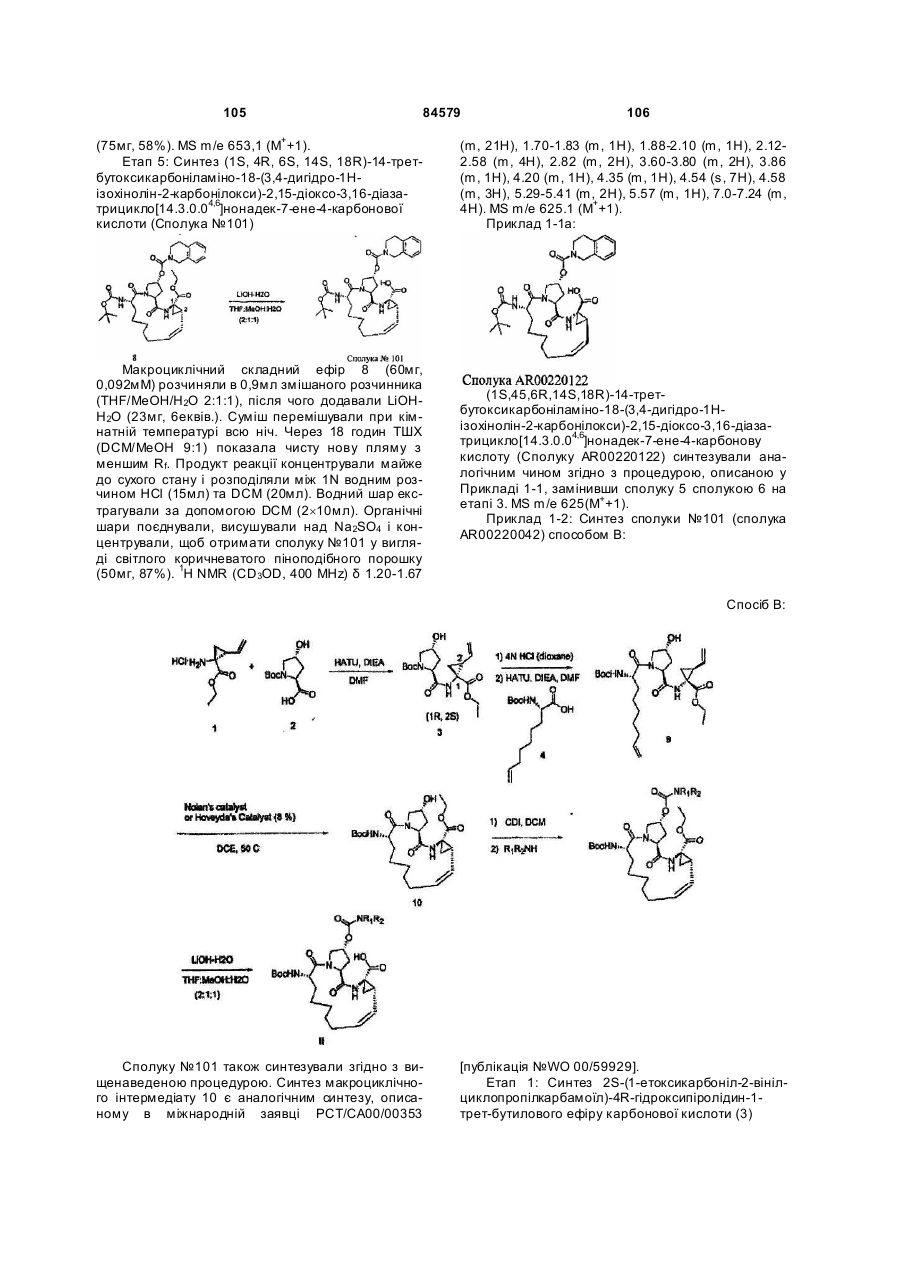
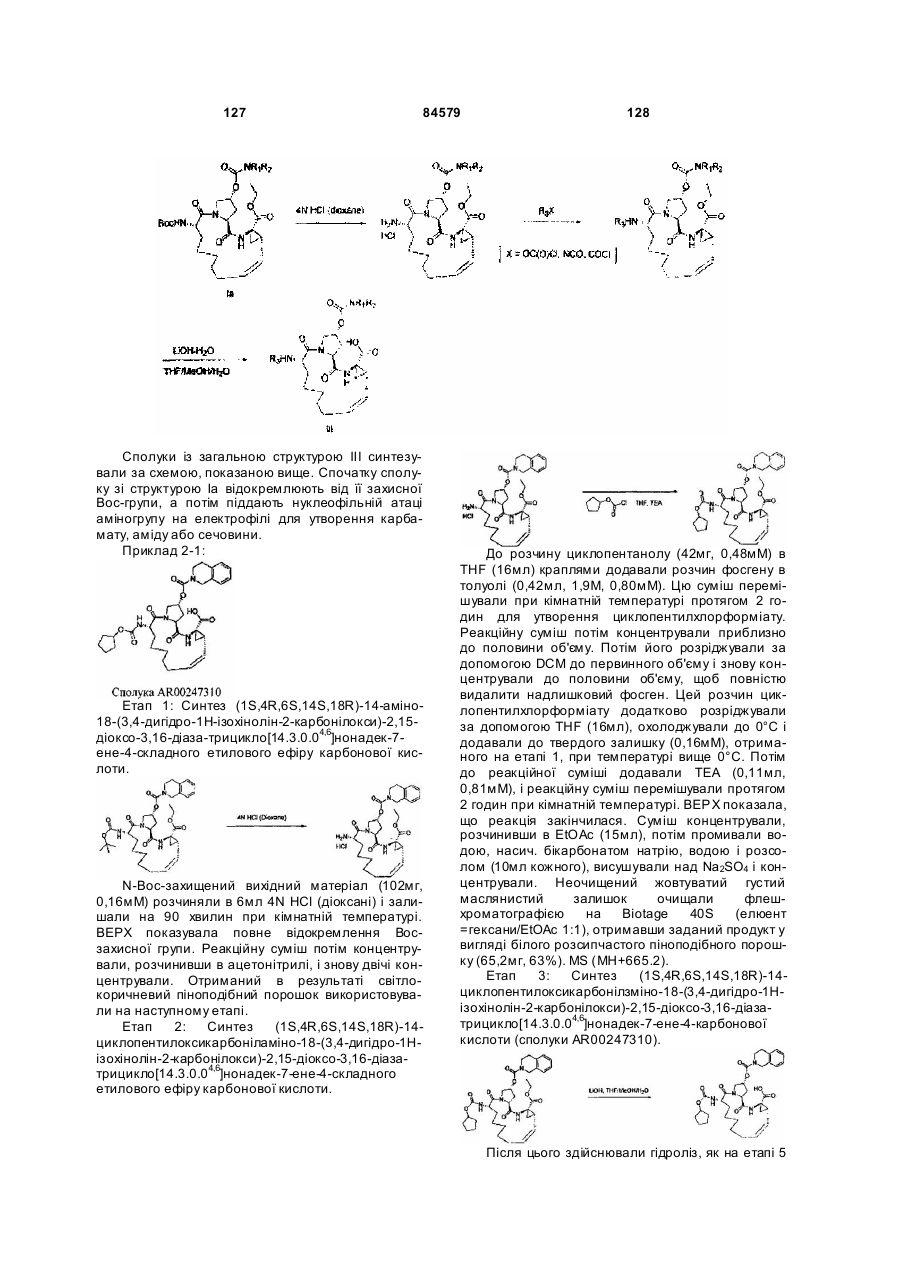
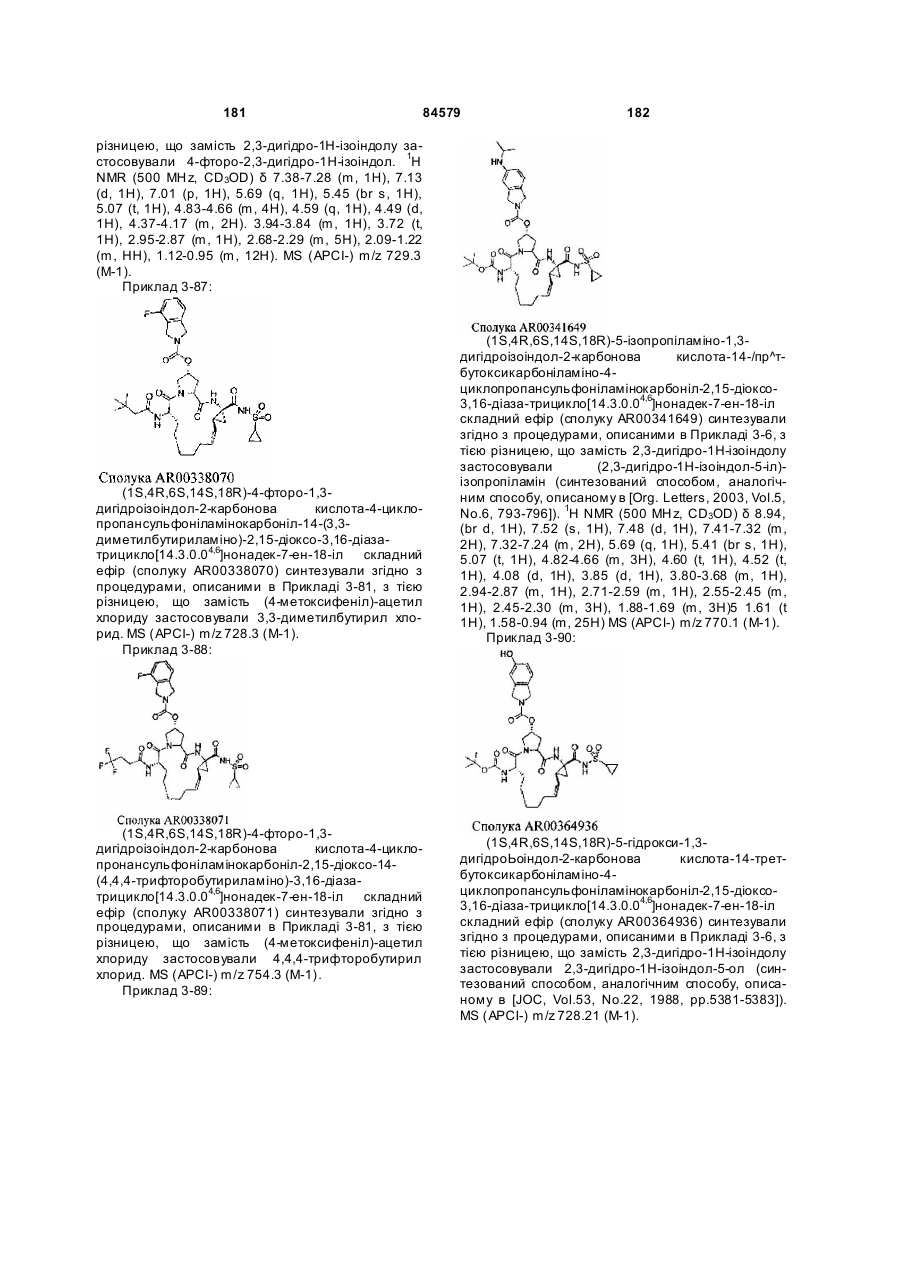
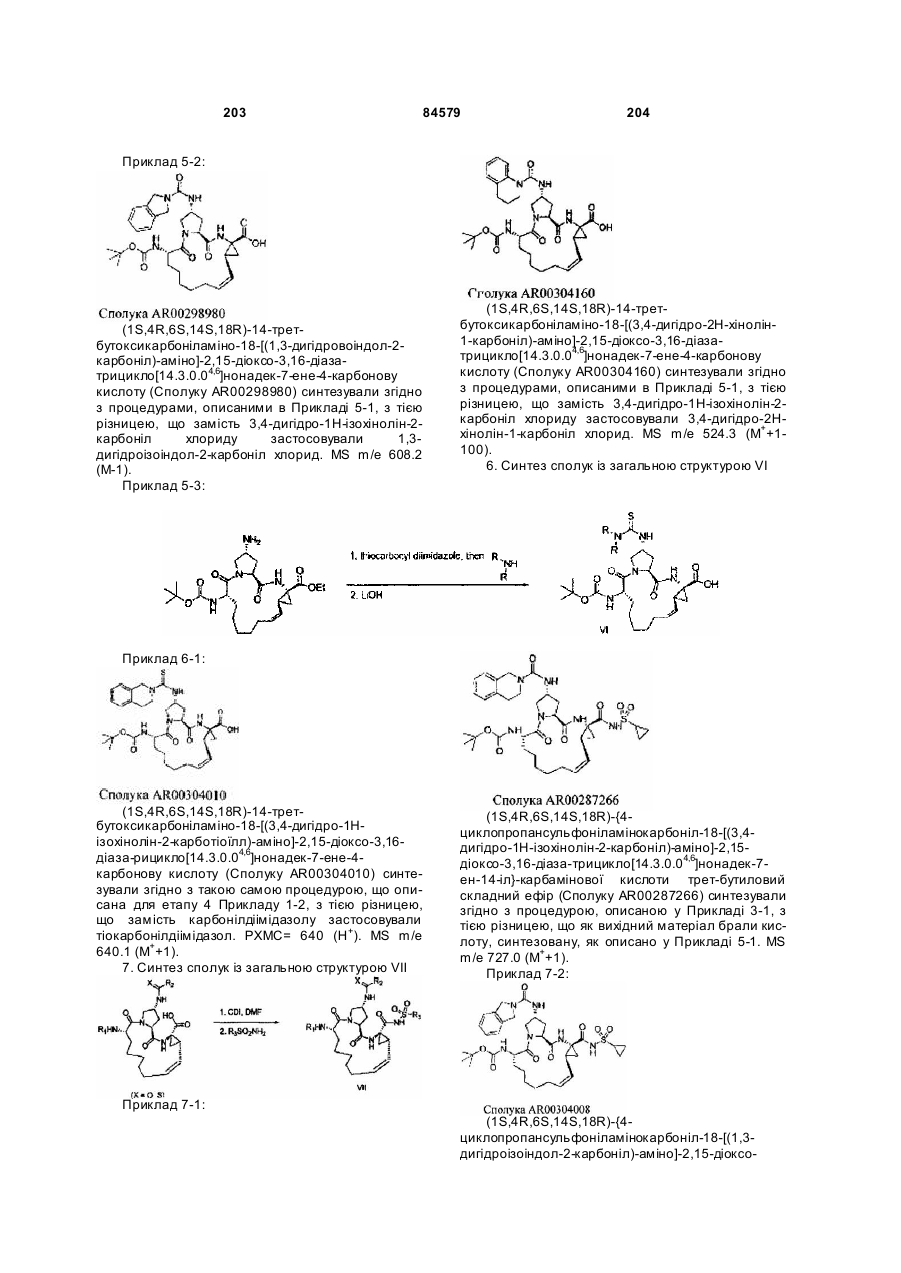
Макроциклічні карбонові кислоти і ацилсульфонаміди як інгібітори реплікації вірусу гепатиту с (вгс)
Номер патенту: 84579
Опубліковано: 10.11.2008
Автори: Джіанг Ютонг, Вуддард Бенджамін Т., Венгловскі Стівен Марк, Кондроски Кевін Рональд, Блетт Лоренс М., Джосі Джон Ентоні, Кеннеді Ейпріл Лайн, Маддуру Мачендер Р., Догерти Джордж Ендрю, Стенджел Пітер Джон, Ендрюс Стівен Вейд
Формула / Реферат
1. Сполука, що має формулу І, VIII або IX:
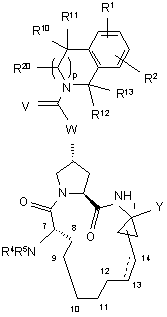 , I
, I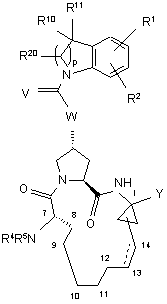 , VIII
, VIII 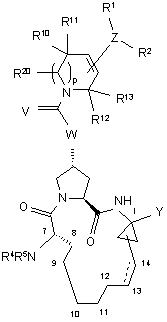 , IX
, IX
де:
(a) R1 і R2 кожний незалежно являють собою Н, галоген, ціано, нітро, гідрокси, С1-6алкіл, С3-7циклоалкіл, C4-10алкілциклоалкіл, С2-6алкеніл, С1-6алкокси, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, С6 або C10арил, піридал, піримідал, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси, S(O)2NR6R7, NHC(O)NR6R7, NHC(S)NR6R7, C(O)NR6R7, NR6R7, C(O)R8, C(O)OR8, NHC(O)R8, NHC(O)OR8, SOmR8, NHS(O)2R8, CHnNR6R7, OCHnNR6R7 або OCHnR9, де R9 являє собою імідазоліл або піразоліл; причому згадані тієніл, піримідал, фураніл, тіазоліл і оксазоліл в позначенні R1 і R2 є необов'язково заміщеними двома атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; при цьому згадані С6 або C10арил, піридал, фенокси і тіофенокси в позначенні R1 і R2 є необов'язково заміщеними 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору;
(б) m = 0, 1 або 2;
(в) R4 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, феніл або бензил, причому феніл або бензил є необов'язково заміщеними 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору;
(г) R5 являє собою С1-6алкіл, C(O)NR6R7, C(S)NR6R7, C(O)R8, C(O)OR8, S(O)2R8 або (CO)CHR21NH(CO)R22;
(д) R6 і R7 кожний незалежно являє собою Η, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або феніл, причому феніл є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R6 і R7 взяті разом з азотом, до якого вони приєднані, для утворення індолінілу, піролідинілу, піперидинілу, піперазинілу або морфолінілу;
(e) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R8 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R8 являє собою С1-6алкіл, необов'язково заміщений 5 групами атомів фтору; або R8 являє собою тетрагідрофуранове кільце, з'єднане через С3- або С4-позицію тетрагідрофуранового кільця; або R8 являє собою тетрапіранілове кільце, з'єднане через С4-позицію тетрапіранілового кільця;
(є) Υ являє собою сульфонімід формули -C(O)NHS(O)2R9, де R9 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу, або R9 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R9 являє собою С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, NR6R7 або (СО)ОН, або R9 являє собою гетероароматичне кільце, необов'язково заміщене двома атомами галогену, ціано, нітро, гідрокси або С1-6алкокси; або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб;
(ж) R10 і R11 кожний незалежно являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, С6 або C10арил, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR14, де R14 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R10 і R11 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R10 і R11 взяті разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; або R10 і R11 є об'єднаними у вигляді О;
(з) р = 0 або 1;
(и) R12 і R13 кожний незалежно являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, С6 або C10арил, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR14, де R14 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R12 і R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R12 і R13 взяті разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; або R12 і R13 кожний незалежно являє собою С1-6алкіл, необов'язково заміщений (CH2)nOR8;
(і) R20 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, С6 або C10арил, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR14, де R14 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R12 і R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору;
(ї) n = 1-4;
(й) V вибраний із О, S або NH;
(к) якщо V являє собою О або S, то W вибирають з О, NR15 або CR15; якщо V являє собою NH, то W вибирають з NR15 або CR15, де R15 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або С1-6алкіл, необов'язково заміщений 5 групами атомів фтору;
(л) пунктирна лінія представляє необов'язковий подвійний зв'язок;
(м) R21 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, або фенілу; або R21 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R21 являє собою піридал, піримідал, піразиніл, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси; і
(н) R22 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, або фенілу;
(о) Ζ являє собою конденсовану або приєднану систему арильних або гетероарильних кілець.
2. Сполука, що має формулу II:
 , ІІ
, ІІ
де:
(а) R1 і R2 кожний окремо являють собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси;
(б) R5 являє собою C(O)NR6R7, C(O)R8, C(O)OR8;
(в) R6 і R7 кожний незалежно являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкіл циклоалкіл або феніл;
(г) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або 3-тетрагідрофурил;
(д) Υ являє собою сульфонімід формули -C(O)NHS(O)2R9, де R9 - це С1-3алкіл, С3-7циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С1-3алкілу, С3-7циклоалкілу, С1-3алкокси, або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб;
(е) R10 і R11 кожний незалежно являє собою Н, С1-3алкіл, або R10 і R11 взяті разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексану;
(є) W вибирають з О або ΝΗ; і
ж) пунктирна лінія представляє необов'язковий подвійний зв'язок.
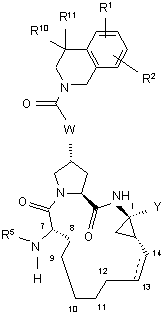
3. Сполука за п. 1, що має загальну формулу III:
 , ІІІ
, ІІІ
де:
(a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси;
(б) R5 являє собою C(O)NR6R7, C(O)R8, C(O)OR8;
(в) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або 3-тетрагідрофурил;
(г) Υ являє собою сульфонімід формули -C(O)NHS(O)2R9, де R9 - це С1-3алкіл, С3-7циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С1-3алкілу, С3-7циклоалкілу, С1-3алкокси, або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб;
(д) W вибирають з О або ΝΗ; і
(е) пунктирна лінія представляє необов'язковий подвійний зв'язок.
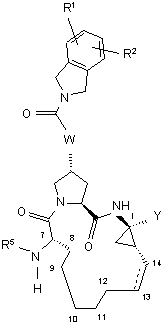
4. Сполука, що має загальну формулу IV:
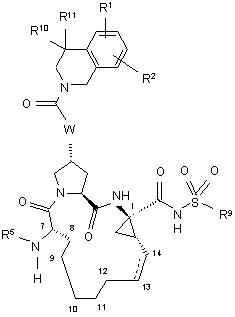 , IV
, IV
де:
(a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; і
(б) R5 являє собою C(O)OR8 або C(O)NHR8;
(в) R8 являє собою С1-6алкіл, С5-6циклоалкіл або 3-тетрагідрофурил;
(г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси;
(д) R10 і R11 кожний незалежно являє собою Н, С1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу;
(e) W вибирають з О або NH; і
(є) пунктирна лінія представляє необов'язковий подвійний зв'язок.
5. Сполука, що має загальну формулу V:
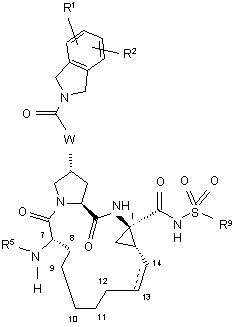 , V
, V
де:
(a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси;
(б) R5 являє собою C(O)OR8 або C(O)NHR8;
(в) R8 являє собою С1-6алкіл, C5-6циклоалкіл або 3-тетрагідрофурил;
(г) R9 являє собою С1-3алкіл, С3-5циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси;
(д) W вибирають з О або NH; і
(є) пунктирна лінія представляє необов'язковий подвійний зв'язок.
6. Сполука, що має загальну формулу VI:
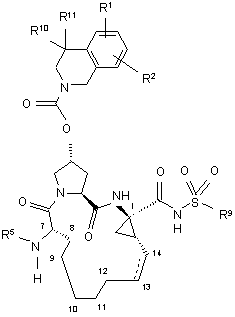 , VI
, VI
де:
(a) R1 і R2 кожний незалежно являє собою Н, хлоро, фторо, ціано, гідрокси, С1-3алкіл, С1-3алкокси;
(б) R5 являє собою C(O)OR8 або C(O)NHR8;
(в) R8 являє собою С1-6алкіл, C5-6циклоалкіл;
(г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси;
(д) R10 і R11 кожний незалежно являє собою Н, С1-3алкіл, або R10 і R11 взяті разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу;
(e) пунктирна лінія представляє необов'язковий подвійний зв'язок.
7. Сполука, що має загальну формулу VII:
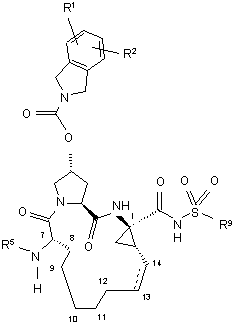 , VII
, VII
де:
(а) R1 і R2 кожний незалежно являє собою Н, хлоро, фторо, ціано, гідрокси, С1-3алкіл, C1-3алкокси;
(б) R5 являє собою C(O)OR8 або C(O)NHR8;
(в) R8 являє собою С1-6алкіл, C5-6циклоалкіл;
(г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси;
(д) пунктирна лінія представляє необов'язковий подвійний зв'язок.
8. Фармацевтична композиція, що містить:
а) сполуку за будь-яким з пунктів 1-7 і
б) фармацевтично прийнятний носій.
9. Спосіб лікування інфекції, викликаної вірусом гепатиту С, у індивіда, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7.
10. Спосіб за п. 9, який відрізняється тим, що при ньому досягають стійкої вірусологічної відповіді.
11. Спосіб лікування фіброзу печінки у індивіда, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7.
12. Спосіб підвищення функції печінки індивіда з інфекцією, викликаною вірусом гепатиту С, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7.
13. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості нуклеозидного аналога.
14. Спосіб за п. 13, який відрізняється тим, що нуклеозидний аналог вибирають з рибавірину, левовірину, вірамідину, L-нуклеозиду та ізаторибіну.
15. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду пірфенідону або аналога пірфенідону перорально щодня у кількості приблизно 400-3600 мг.
16. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості інгібітора полімерази NS5B РНК-залежної РНК.
17. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості антагоніста фактора некрозу пухлини, вибраного з групи, що складається з етанерсепту, інфліксимабу та адалімубабу.
18. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості тимозину-![]() .
.
19. Спосіб за п. 18, який відрізняється тим, що тимозин-![]() вводять підшкірно двічі на тиждень у кількості приблизно 1,0-1,6 мг.
вводять підшкірно двічі на тиждень у кількості приблизно 1,0-1,6 мг.
20. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості гамма-інтерферону ![]() .
.
21. Спосіб за п. 20, який відрізняється тим, що ![]() вводять підшкірно у кількості приблизно 10-300 мкг.
вводять підшкірно у кількості приблизно 10-300 мкг.
22. Спосіб за п. 9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості альфа-інтерферону ![]() .
.
23. Спосіб за п. 22, який відрізняється тим, що ![]() являє собою монопегильований (30 kD, лінійний) консенсусний
являє собою монопегильований (30 kD, лінійний) консенсусний ![]() , який вводять з інтервалом дозування кожні 8-14 днів.
, який вводять з інтервалом дозування кожні 8-14 днів.
24. Спосіб за п. 22, який відрізняється тим, що ![]() являє собою монопегильований (30 kD лінійний) консенсусний
являє собою монопегильований (30 kD лінійний) консенсусний ![]() , який вводять з інтервалом дозування раз у кожні 7 днів.
, який вводять з інтервалом дозування раз у кожні 7 днів.
25. Спосіб за п. 22, який відрізняється тим, що ![]() являє собою консенсусний
являє собою консенсусний ![]() INFERGEN.
INFERGEN.
26. Спосіб за будь-яким з пп. 9, 11, або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості агента, вибраного з групи, що включає 3'-азидотимідин, 2'3'-дидеоксіінозин, 2'3'-дидеоксицитидин, 2'3'-дидегідро-2'3'-дидеокситимідин, комбівір, абакавір, адефовір, дипоксил, цидофовір, та інгібітора інозинмонофосфатдегідрогенази.
27. Сполука за п. 1, що має формулу:
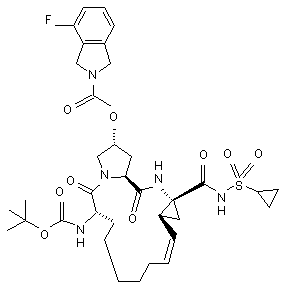 .
.
28. Композиція за п. 8, яка містить сполуку, що має формулу:
 .
.
29. Спосіб за будь-яким пп. 9, 11 та 12, що включає призначення ефективної кількості сполуки, що має формулу:
 .
.
Текст
1. Сполука, що має формулу І, VIII або IX: C2 2 (19) 1 3 6алкенілу, 84579 С1-6алкокси, гідроксі-С 1-6алкілу, С1необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R6 і R7 взяті разом з азотом, до якого вони приєднані, для утворення індолінілу, піролідинілу, піперидинілу, піперазинілу або морфолінілу; (e) R8 являє собою С 1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R8 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С37циклоалкілу, С 4-10алкілциклоалкілу, С 2-6алкенілу, С1-6алкокси, гідроксі-С 1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С16алкокси, необов'язково заміщеного 5 групами атомів фтору; або R8 являє собою С1-6алкіл, необов'язково заміщений 5 групами атомів фтору; або R8 являє собою тетрагідрофуранове кільце, з'єднане через С3- або С4-позицію тетрагідрофуранового кільця; або R8 являє собою тетрапіранілове кільце, з'єднане через С4-позицію тетрапіранілового кільця; (є) Υ являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 являє собою С 1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу, або R9 являє собою С6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідроксі-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R9 являє собою С16алкіл, необов'язково заміщений 5 групами атомів фтор у, NR6R7 або (СО)ОН, або R9 являє собою гетероароматичне кільце, необов'язково заміщене двома атомами галогену, ціано, нітро, гідрокси або С1-6алкокси; або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (ж) R10 і R11 кожний незалежно являє собою С 16алкіл, С 3-7циклоалкіл, С 4-10алкілциклоалкіл, С 6 або C10арил, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою С1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С 6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С 1-6алкілу, С16алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R10 і R11 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідроксі-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R10 і R11 взяті разом з 6алкілу, 4 атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; або R10 і R11 є об'єднаними у вигляді О; (з) р = 0 або 1; (и) R12 і R13 кожний незалежно являє собою Н, С16алкіл, С 3-7циклоалкіл, С 4-10алкілциклоалкіл, С 6 або C10арил, гідроксі-С1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою С1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С 6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, С1-6алкокси, гідроксі-С 1-6алкілу, С16алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R12 і R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідроксі-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R12 і R13 взяті разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; або R12 і R13 кожний незалежно являє собою С 1-6алкіл, необов'язково заміщений (CH 2)nOR8; (і) R20 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, С 6 або C 10арил, гідроксі-С 16алкіл, С 1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С 6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу, С37циклоалкілу, С 4-10алкілциклоалкілу, С 2-6алкенілу, С1-6алкокси, гідроксі-С 1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С16алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або C10арил в позначенні R12 і R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, С1-6алкілу С 37циклоалкілу, С 4-10алкілциклоалкілу, С 2-6алкенілу, С1-6алкокси, гідроксі-С 1-6алкілу, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, С16алкокси, необов'язково заміщеного 5 групами атомів фтору; (ї) n = 1-4; (й) V вибраний із О, S або NH; (к) якщо V являє собою О або S, то W вибирають з О, NR15 або CR15; якщо V являє собою NH, то W вибирають з NR15 або CR15, де R15 являє собою Н, С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або С1-6алкіл, необов'язково заміщений 5 групами атомів фтору; (л) пунктирна лінія представляє необов'язковий подвійний зв'язок; 5 84579 (м) R21 являє собою С 1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, або фенілу; або R21 являє собою С 6 або C10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідроксі-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; або R21 являє собою піридал, піримідал, піразиніл, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси; і (н) R22 являє собою С1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси, С1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, або фенілу; (о) Ζ являє собою конденсовану або приєднану систему арильних або гетероарильних кілець. 2. Сполука, що має формулу II: R1 R11 R10 R2 N O W N O R5 NH Y 1 7 8 N 6 R1 R2 N O W N O 7 R5 8 N Y 1 O 14 9 12 H 13 , ІІІ де: (a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)NR6R7, C(O)R 8, C(O)OR 8; (в) R8 являє собою С 1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл або 3-тетрагідрофурил; (г) Υ являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це С 1- 3алкіл, С3-7циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С1-3алкілу, С3-7циклоалкілу, С1-3алкокси, або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (д) W вибирають з О або ΝΗ; і (е) пунктирна лінія представляє необов'язковий подвійний зв'язок. 4. Сполука, що має загальну формулу IV: 11 10 O 14 9 NH R1 R 11 R 10 12 H 13 10 11 де: (а) R1 і R2 кожний окремо являють собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)NR6R7, C(O)R 8, C(O)OR 8; (в) R6 і R7 кожний незалежно являє собою Н, С16алкіл, С 3-7циклоалкіл, С 4-10алкіл циклоалкіл або феніл; (г) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл або 3-тетрагідрофурил; (д) Υ являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це С 1- 3алкіл, С3-7циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С1-3алкілу, С3-7циклоалкілу, С1-3алкокси, або Υ являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (е) R10 і R11 кожний незалежно являє собою Н, С110 і R11 взяті разом з атомом вуглецю, 3алкіл, або R до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексану; (є) W вибирають з О або ΝΗ; і ж) пунктирна лінія представляє необов'язковий подвійний зв'язок. 3. Сполука за п. 1, що має загальну формулу III: R2 N , ІІ O W O N O R5 7 NH 8 N 1 O N H O O S R9 14 9 12 H 13 , IV де: (a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; і (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С1-6алкіл, С5-6циклоалкіл або 3тетрагідрофурил; (г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси; (д) R10 і R11 кожний незалежно являє собою Н, С110 11 взято разом з атомом вуглецю, 3алкіл, або R і R до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; (e) W вибирають з О або NH; і (є) пунктирна лінія представляє необов'язковий подвійний зв'язок. 5. Сполука, що має загальну формулу V: 10 11 7 84579 8 R1 R1 R2 R2 N N O O O W O ON O NH 7 R5 8 N 1 N H O O O S R9 R5 NH 8 N ,V де: (a) R1 і R2 кожний незалежно являє собою Н, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С1-6алкіл, C5-6циклоалкіл або 3тетрагідрофурил; (г) R9 являє собою С1-3алкіл, С3-5циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси; (д) W вибирають з О або NH; і (є) пунктирна лінія представляє необов'язковий подвійний зв'язок. 6. Сполука, що має загальну формулу VI: R1 R11 R10 R2 N O O O N O 7 NH 8 1 O N H O O S R9 14 9 12 H 13 , VI де: (a) R1 і R2 кожний незалежно являє собою Н, хлоро, фторо, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С 1-6алкіл, C5-6циклоалкіл; (г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси; (д) R10 і R11 кожний незалежно являє собою Н, С110 і R11 взяті разом з атомом вуглецю, 3алкіл, або R до якого вони приєднані, для утворення циклопропілу, циклобутилу; (e) пунктирна лінія представляє необов'язковий подвійний зв'язок. 7. Сполука, що має загальну формулу VII: 10 11 O N H O O S R9 14 12 13 13 11 10 1 9 H 12 H N 7 14 9 R5 N O , VII де: (а) R1 і R2 кожний незалежно являє собою Н, хлоро, фторо, ціано, гідрокси, С1-3алкіл, C1-3алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С 1-6алкіл, C5-6циклоалкіл; (г) R9 являє собою С1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С1-3алкокси; (д) пунктирна лінія представляє необов'язковий подвійний зв'язок. 8. Фармацевтична композиція, що містить: а) сполуку за будь-яким з пунктів 1-7 і б) фармацевтично прийнятний носій. 9. Спосіб лікування інфекції, викликаної вірусом гепатиту С, у індивіда, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7. 10. Спосіб за п.9, який відрізняється тим, що при ньому досягають стійкої вірусологічної відповіді. 11. Спосіб лікування фіброзу печінки у індивіда, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7. 12. Спосіб підвищення функції печінки індивіда з інфекцією, викликаною вірусом гепатиту С, який передбачає введення індивіду ефективної кількості сполуки за будь-яким з пунктів 1-7. 13. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості нуклеозидного аналога. 14. Спосіб за п.13, який відрізняється тим, що нуклеозидний аналог вибирають з рибавірину, левовірину, вірамідину, L-нуклеозиду та ізаторибіну. 15. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду пірфенідону або аналога пірфенідону перорально щодня у кількості приблизно 400-3600 мг. 16. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості інгібітора полімерази NS5B РНК-залежної РНК. 17. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості антагоніста фактора некрозу пухлини, вибраного з групи, що складається з етанерсепту, ін фліксимабу та адалімубабу. 18. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості тимозину- a . 10 11 9 84579 19. Спосіб за п.18, який відрізняється тим, що тимозин- a вводять підшкірно двічі на тиждень у кількості приблизно 1,0-1,6 мг. 20. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості гамма-інтерферону (IFN - g ) . 21. Спосіб за п.20, який відрізняється тим, що IFN - g вводять підшкірно у кількості приблизно 10300 мкг. 22. Спосіб за п.9, 11 або 12, який відрізняється тим, що додатково передбачає введення індивіду ефективної кількості альфа-інтерферону (IFN - a) . 23. Спосіб за п.22, який відрізняється тим, що IFN - a являє собою монопегильований (30 kD, лінійний) консенсусний IFN - a , який вводять з інтервалом дозування кожні 8-14 днів. 24. Спосіб за п.22, який відрізняється тим, що IFN - a являє собою монопегильований (30 kD лінійний) консенсусний IFN - a , який вводять з інтервалом дозування раз у кожні 7 днів. 25. Спосіб за п.22, який відрізняється тим, що IFN - a являє собою консенсусний IFN - a INFERGEN. 26. Спосіб за будь-яким з пп.9, 11, або 12, який відрізняє ться тим, що додатково передбачає введення індивіду ефективної кількості агента, вибраного з групи, що включає 3'-азидотимідин, 2'3'-дидеоксіінозин, 2'3'-дидеоксицитидин, 2'3'дидегідро-2'3'-дидеокситимідин, комбівір, абакавір, адефовір, дипоксил, цидофовір, та інгібітора інозинмонофосфатдегідрогенази. 27. Сполука за п.1, що має формулу: 10 28. Композиція за п.8, яка містить сполуку, що має формулу: F N O O H N N O O O O S N H O N H O O . 29. Спосіб за будь-яким пп.9, 11 та 12, що включає призначення ефективної кількості сполуки, що має формулу: F N O O O O H N N O N H O O O N H O S . F N O O O O H N N O N H O O O N H O S . Винахід відноситься до сполук, способів їхнього синтезу, композицій і способів лікування інфекційних захворювань, викликаних вірусом гепатиту C (ВГС). Винахід, зокрема, пропонує нові аналоги пептидів, фармацевтичні композиції, що містять такі аналоги, і способи застосування цих аналогів при лікуванні інфекційних захворювань, викликаних ВГС. Передумови створення винаходу У Сполучених Штатах викликана ВГС інфекція є найбільш поширеною хронічною інфекцією, що переноситься кров'ю. Хоча кількість нових випадків захворювання зменшилась, загальна кількість хронічних захворювань є значною - за даними Центрів з профілактики і контролю захворювань в США - це 3,9млн. інфікованих (1,8%). У Сполуче них Штата х серед причин смертності дорослого населення десяте місце посідає хронічне захворювання печінки, від наслідків якого щорічно вмирає приблизно 25000 людей, що становить приблизно 1% всієї смертності. Дослідження показують, що в 40% випадків хронічне захворювання печінки пов'язане з ВГС, що спричиняє 8000-10000 смертей щороку. ВГС-асоційоване захворювання печінки в кінцевій стадії є найчастішим показанням для трансплантації печінки серед дорослих пацієнтів. В останні десять років швидко розвивається антивірусна терапія, причому спостерігається значне підвищення ефективності лікування. Тим не менш навіть при комбінованій терапії, при якій застосовують пегільований інтерферон-альфа (IFN 11 84579 α) і рибавірин, для 40-50% пацієнтів ця терапія є безуспішною, тобто вони не реагують або мають рецидиви. Ці пацієнти сьогодні не мають ефективної терапевтичної альтернативи. Зокрема, пацієнти, у яких при біопсії печінки виявили задавнений фіброз або цироз, мають підвищений ризик розвинення ускладнень від задавненої хвороби печінки, в тому числі асцит, жовтяницю, варикозну кровотечу, енцефалопатію та прогресуюче руйнування печінки, а також значний ризик гепатоклітинної карциноми. Високий рівень розповсюдження хронічних захворювань, викликаних ВГС, має важливі наслідки для здоров'я населения з точки зору майбутньої загальної кількості хронічних захворювань печінки у Сполучених Шта тах. Дані, взяті з «Огляду харчування і національної охорони здоров'я» (NHANES III), свідчать про значне зростання показника нових ВГС-захворювань за період з кінця 1960-х до початку 1980-х років, особливо серед людей віком 20-40 років. Підрахували, що людей з довготривалою, протягом 20 років і довше, ВГС-інфекцією може стати у 4 рази більше у період 1990-2015pp., тобто від 750тис. до 3млн. і більше. Пропорційне збільшення кількості людей, інфікованих протягом 30 або 40 років, буде навіть більшим. Оскільки ризик хронічної хвороби печінки, викликаної ВГС, пов'язаний з тривалістю інфекції, причому ризик цирозу поступово зростає для людей, інфікованих протягом більше 20 років, це призведе до значного зростання захворювання на цироз і смертності серед пацієнтів, інфікованих у період 1965-1985 роки. ВГС є оболонковим плюс-РНК вірусом сімейства Fla viviridae. Геном однониткової PHK ВГС має довжину приблизно 9500 нуклеотидів і одну відкриту рамку зчитування, яка кодує один великий поліпротеїн, що складається приблизно з 3000 амінокислот. В інфікованих клітинах цей поліпротеїн на багатьох сайтах розщеплюється клітинними та вірусними протеазами на структурні і неструктурні (NS) білки цього вірусу. У вірусі гепатиту C (ВГС) на утворення зрілих неструктурних білків (NS2, NS3, NS4, NS4A, NS4B, NS5A та NS5B) впливають дві вірусні протеази. Перша вірусна протеаза розщеплює на стику NS2-NS3 поліпротеїну. Др угою вір усною протеазою є серинова протеаза, що міститься в N-кінцевій області білка NS3 (NS3-протеаза). NS3-протеаза опосередковує всі акти розщеплення на сайтах нижче відносно позиції NS3 в поліпротеїні (тобто на сайтах між Cкінцем білка NS3 і С-кінцем поліпротеїну). NS3протеаза виявляє активність як в цис-положенні, на сайті розщеплення NS3-NS4, так і в трансположенні, для решти сайтів: NS4A-NS4B, NS4BNS5A та NS5A-NS5B. Вважають, що білок NS4A виконує багато функцій, діючи як кофактор для NS3-протеази і, можливо, допомагаючи в локалізації на мембрані білка NS3 та інших компонентів вірусної реплікази. Утворення комплексу між NS3 та NS4A, очевидно, є необхідним для NS3опосередкованих актів процесінгу і підсилює протеолітичну е фективність на всіх сайта х, упізнаваних NS3. NS3-протеаза також виявляє активність нуклеозидтрифосфатази і активність гелікази PHK. 12 Білок NS5B є РНК-залежною полімеразою PHK, що приймає участь в реплікації PHK ВГС. Література: [METAVIR (1994) Hepatology 20: 15-20; Brunt (2000) Hepatol. 31: 241-246; Alpini (1997) J. Hepatol. 27: 371-380; Baroni et al. (1996) Hepatol. 23: 11891199; Czaja et al. (1989) Hepvtol. 10: 795-800; Grossman et al. (1998) J. Gastroenterol. Hepatol. 13: 1058-1060; Rcckey and Chung (1994) J. Invest. Med. 42: 660-670; Sakaida et al. (1998) J. Hepatol 28: 471479; Shi et al. (1997) Proc. Natl. Acad. ScI USA 94: 10663-10668; Baroni et al. (1999) Liver 19: 212-219; Lortat-Jacob et al. (1997) J. Hepatol. 26: 894-903; Llorent et al. (1996) J. Hepatol. 24: 555-563; U.S. Patent No.5,082,659; European Patent Application EP 294,160; U.S. Patent No.4,806,347; Balish et al. (1992)7. Infect. Diseases 166: 1401-1403; Katayamae/ al. (2001) J. Viral Hepatitis 8: 180-185; U.S. Patent No.5,082,659; U.S. Patent No.5,190,751; U.S. Patent No.4,806,347; Wandl et al. (1992) Br. J. Haematol. 81: 516-519; European Patent Application No.294,160; Canadian Patent No.1,321,348; European Patent Application No.276,120; Wandl et al. (1992) Sem. Oncol. 19: 88-94; Balish et al. (1992) J. Infectious Diseases 166: 1401-1403; Van Dijk et al. (1994) Int. J. Cancer 56: 262-268; Sundmacher et al. (1987) Current Eye Res. 6: 273-276; U.S. Patent Nos. 6,172,046; 6,245,740; 5,824,784; 5,372,808; 5,980,884; published international patent applications WO 96/21468; WO 96/11953; WO 00/59929; WO 00/66623; WO 2003/064416; WO 2003/064455; WO 2003/064456; WO 97/06804; WO 98/17679; WO 98/22496; WO 97/43310; WO 98/46597; WO 98/46630; WO 99/07733; WO 99/07734; WO 00/09543; WO 00/09558; WO 99/38888; WO 99/64442; WO 99/50230; WO 95/33764; Torre et al. (2001) J. Med. Virol. 64: 455-459; Bekkering etal. (2001) J. Hepatol. 34: 435-440; Zeuzem etal. (2001) Gastroenterol. 120: 1438-1447; Zeuzem (1999) J. Hepatol. 31: 61-64; Keeffe and Hollinger (1997) Hepatol. 26: 101S-107S; Wills (1990) CHn. Pharmacokinet. 19: 390-399; Heathcote et al. (2000) New Engl. J. Med. 343: 1673-1680; Husa and Husova (2001) Bratisl. Lek. Listy 102: 248-252; Glue et al. (2000) CHn. Pharmacol. 68: 556-567; Bailon et al. (2001) Bioconj. Chem. 12: 195-202; and Neumann et al. (2001) Science 282: 103; Zalipski (1995) Adv. Drug Delivery Reviews S. 16, 157-182; Mann et al. (2001) Lancet 358: 958-965; Zeuzem et al. (2000) New Engl. J. Med. 343: 1666-1672; U.S. Patent Nos. 5,633,388; 5,866,684; 6,018,020; 5,869,253; 6,608,027; 5,985,265; 5,908,121; 6,177,074; 5,985,263; 5,711,944; 5,382,657 and 5,908,121; Osborn etal. (2002) J. Pharmacol Exp. Therap. 303: 540-548; Sheppard et al. (2003) Nat. Immunol. 4: 6368; Chang et al. (1999) Nat. Biotechnol. 17: 793-797; Adolf (1995) Multiple Sclerosis 1 Suppl. 1: S44-S47; Chu et al, Tet.Lett. (1996), 7229-7232; Ninth Conference on Antiviral Research, Urabandai, Fukyshima, Japan (1996) Antiviral Research, (1996), 30: 1, A23 (abstract 19); Steinkuhler et al, Biochem. 37: 8899-8905; Ingallinella et al, Biochem., 37: 89068914]. В об'єм даного винаходу включені сполуки формули І: 13 84579 де: (a) R1 кожний незалежно являє собою H, галоген, ціано, нітро, гідрокси, C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, С 2-6алкеніл, C 16алкокси, гідрокси-C 1-6алкіл, C 1-6алкіл, необов'язково заміщений 5 групами атомів фтору, С6 або 10арил, піридал, піримідал, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси, SO2NR5R6, NHC(O)R5, NHC(O)NR5R6, NHC(S)NR5R6, NR5R6, C(O)R5, C(O)OR 5, C(O)NR 5R6, SO mR5 , NHSO2R5; причому згадані тієніл, піримідал, фураніл, тіазоліл та оксазоліл у позначеннях R1a і R1b є необов'язково заміщеними двома атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С410алкілциклоалкілу, С 2-6алкенілу, C 1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, C1- 6алкокси, необов'язково заміщеного 5 групами атомів фтор у; при цьому згадані С 6 або 10арил, піридал, фенокси і тіофенокси у позначенні R1 є необов'язково заміщеними 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С4-10алкілциклоалкілу, C2-6алкенілу, C1-6алкокси, гідрокси-C1-6алкілу, C16алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; б) R2 являє собою C1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл або феніл, причому феніл є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С410алкілциклоалкілу, С 2-6алкенілу, C 1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, C1- 6алкокси, необов'язково заміщеного 5 групами атомів фтору; в) R3 являє собою H, C1-6алкіл, -C(O)R5, C(O)OR 5, C(O)NR 5R6, C(S)NR 5R6, S(O) 2R5; г) R5 та R6 кожний незалежно являє собою H, C1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або феніл, причому феніл є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; д) Y являє собою сульфонімід формули C(O)NHS(O)2R4, де R4 являє собою C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі являють собою необов'язково заміщені 1-3 атомами гало 14 гену, ціано, нітро, C1-6алкокси, амідо або феніл, або R4 являє собою С6 або 10арил, який є необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С410алкілциклоалкілу, С 2-6алкенілу, C 1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, C1- 6алкокси, необов'язково заміщеного 5 групами атомів фтор у; або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль або складний ефір; e) m=0,1 або 2; є) X=O, NH або NR; і ж) Z=O або S. В об'єм даного винаходу входить фармацевтична, композиція, що включає інгібітор білка NS3, який являє собою сполуку формули І (наприклад, формул І-VII) або її фармацевтично прийнятну сіль, або складнийефір у суміші з фармацевтично прийнятним носієм. В об'єм винаходу також входить будь-який фармацевтично прийнятний пролікарський дериват сполуки формули І (наприклад, формул І-VII), оскільки проліки здатні забезпечувати підвищене всмоктування шлунково-кишковим трактом або печінкою. Запропоновано також спосіб лікування пацієнта з інфекцією, викликаною вірусом гепатиту C (ВГС), який включає введення пацієнту терапевтично ефективної кількості сполуки формули І або її терапевтично прийнятної солі або складного ефіру, або ви щеописаної фармацевтичної композиції. Крім того, запропоновано спосіб лікування інфекційної хвороби, викликаної ВГС, який включає введення пацієнту певної кількості сполуки формули І або її терапевтично прийнятної солі або складного ефіру, або фармацевтичної композиції, що містить сполуку формули І, у поєднанні з певною кількістю одного або більше додаткових противірусних засобів, ефективних для досягнення у пацієнта стійкої вірусологічної відповіді. Визначення термінів В даному описі термін "фіброз печінки" означає розростання рубцевої тканини в печінці, яке може виникати при інфекції, що викликає хронічний гепатит. Терміни "індивід", "хазяїн", "організм-носій", "реціпієнт", "суб'єкт" є рівнозначними і відносяться до ссавців, в тому числі (але не тільки) приматів, включаючи людиноподібних мавп і людей. Термін "функція печінки" означає нормальне функціонування печінки, в тому числі (але не тільки) синтетичну функцію, включаючи (але не обмежуючись цим) синтез білків, наприклад сироваткових білків (наприклад, альбуміну, коагулюючих факторів, лужної фосфатази, амінотрансфераз (наприклад, аланінтрансамінази, аспартаттрансамінази), 5'-нуклеозидази, gглутамінілтранспептидази тощо), синтез білірубіну, синтез холестерину і синтез жовчних кислот; метаболічну функцію печінки, в тому числі (але не тільки) вуглеводний обмін, амінокислотний і аміачний обмін, гормональний обмін і ліпідний обмін; усунення токсичної дії екзогенних лікарських засобів; гемодпнамічну функцію, в тому числі вісцеральну гемодинаміку і портальну гемодинаміку, тощо. 15 84579 Терміни "стійка вірусологічна відповідь" (CBB) і "тривала відповідь" означають реакцію індивіда на схему лікування ВГС-інфекції у виглядi титра вірусу сироватки. Взагалі, термін "стійка вірусологічна відповідь" відноситься до невиявної PHK ВГС (наприклад, менш ніж 500, менш ніж 200 або менш ніж 100 геномних копій на мілілітр сироватки), виявленої в сироватці пацієнта протягом принаймні одного місяця, двох місяців, трьох місяців, чотирьох місяців, п'яти місяців або шести місяців після припинення лікування. Термін "пацієнт, для якого лікування виявилось безуспішним" в даному описі відноситься до ВГС-інфікованих пацієнтів, які не прореагували на попереднє лікування ВГС-інфекції («нереагуючі пацієнти»), або до пацієнтів, які спочатку прореагували на попереднє лікування, але у яких терапевтична відповідь не збереглася («пацієнти, у яких виникли рецидиви»). Попереднє лікування, як правило, може включати монотерапію інтерферономальфа (IFN-α) або комбіновану IFN-α-терапію, причому остання може включати введення IFN-α і противірусного засобу, наприклад рибавірину. Термін «лікування» означає досягнення бажаного фармакологічного та/або фізіологічного ефекту. Цей ефект може бути профілактичним, у вигляді повного або часткового запобігання хвороби або її симптому та/або може бути терапевтичним, у вигляді часткового або повного вилікування хвороби та/або усунення шкідливої дії, характерної для цієї хвороби. Термін «лікування» в даному описі охоплює будь-яке лікування хвороби у ссавця, зокрема людини, і включає: а) запобігання виникненню хвороби у суб'єкта, який може бути схильним до неї, але якому ще не поставлений діагноз наявності у нього цієї хвороби; б) інгібування хвороби, тобто призупинення її розвитку; і в) послаблення хвороби, тобто викликання регресії хвороби. Терміни «індивід», «хазяїн», «суб'єкт» і «пацієнт» в даному описі є рівнозначними і відносяться до ссавців, в тому числі (але не тільки) мишиних; людиноподібних мавп, людей, сільськогосподарських тварин, спортивних тварин і домашніх тварин. Термін «специфічний аналог пірфенідону» і всі його граматичні еквіваленти відносяться до всіх до одного (і цим обмежуються) аналогів пірфенідону, наведених в таблиці 1. Термін «агоніст рецептора інтерферону типу І» відноситься до будь-якого ліганду рецептора інтерферону типу І людини, природного або неприродного, який зв'язується з рецептором і викликає за його допомогою сигнальну трансдукцію. Агоністи рецептора інтерферону типу І включають інтерферони, в тому числі природні, модифіковані, синтетичні, пегільовані; гібридні білки, що містять інтерферон і гетерологічний білок; зчеплені інтерферони; антитіло, специфічне до рецептора інтерферону; непептидні хімічні агоністи тощо. Термін «агоніст рецептора інтерферону типу II» відноситься до будь-якого ліганду рецептора інтерферону типу II людини, природного або неприродного, який зв'язується з рецептором і викликає за його допомогою сигнальну трансдукцію. Агоністи рецептора інтерферону типу II включають 16 нативний g-інтерферон (IFN-g) людини, види рекомбінантного IFN-g, види глікозилованого IFN-g, види пегільованого IFN-g, види модифікованого або варінтного IFN-g, гібридні білки IFN-g, агоністи антитіл, специфічних до до рецептора, непептидні агоністи тощо. Термін «агоніст рецептора інтерферону типу III» відноситься до будь-якого ліганду рецептора a IL-28 (IL-28R) людини, природного або неприродного, амінокислотна послідовність якого описана Sheppard et al., infra., який зв'язується з рецептором і викликає за його допомогою сигнальну трансдукцію. Термін «агоніст рецептора інтерферону» відноситься до будь-якого агоністу рецептора інтерферону тип у І, тип у II або типу III. Термін «акт дозування» означає введення противірусного засобу пацієнту, який його потребує, причому цей акт може включати одне або більше вивільнень противірусного засобу з дозатора лікарського засобу. Таким чином, в даному описі термін «акт дозування» включає (але не обмежується цим) установлення пристрою безперервної доставки лікарського засобу (наприклад, насоса або іншої системи для введення з контрольованим вивільненням) і одноразову підшкірну ін'єкцію, після якої встановлюють систему безперервної доставки. Термін «безперервна доставка» (наприклад, в контексті «безперервна доставка речовини в тканину») означає транспортування лікарського засобу в місце доставки, наприклад в тканину, таким чином, щоб забезпечувати доставку заданої кількості речовини в тканину упродовж вибраного періоду часу, причому протягом цього вибраного періоду часу пацієнт кожну хвилину отримує приблизно однакову кількість лікарського засобу. «Контрольоване вивільнення» (наприклад, в контексті «контрольоване вивільнення лікарського засобу») означає вивільнення речовини (наприклад, агоністу рецептора інтерферону типу І або типу III, наприклад IFN-α) із заданою або іншим чином контрольованою швидкістю, інтервалом та/або кількістю, на яке суттєво не впливають оточуючі умови. Отже, «контрольоване вивільнення» включає (але не обмежується цим), головним чином безперервну доставку і доставку за схемою (наприклад, доставку з перервами протягом певного періоду часу, тобто яка переривається однаковими або неоднаковими часовими інтервалами). Терміни «доставка за схемою» і «часова доставка», застосовані у контексті «доставка лікарського засобу», означають доставку лікарського засобу за схемою, як правило, рівномірною, протягом попередньо вибраного періоду часу (наприклад, відмінного від періоду, пов'язаного з болюсним вливанням). «Часова» доставка лікарського засобу або «за схемою» включає доставку лікарського засобу із зростаючою швидкістю, швидкістю, що зменшується, головним чином постіною швидкістю або пульсуючою швидкістю, або діапазоном швидкостей (наприклад, кількість лікарського засобу за одиницю часу або об'єм лікарської форми за одиницю часу), а також включає доставку безперервну або майже безперервну, або три 17 84579 валу. Термін «пристрій контрольованої доставки лікарського засобу» означає будь-який пристрій, в якому вивільнення (наприклад, швидкість, вибір моменту для вивільнення) лікарського засобу або іншої заданої речовини, що в ньому міститься, регулюється або визначається власне пристроєм, і на нього не впливають оточуючі умови, або вивільнення відбувається зі швидкістю, яка є відтворюваною в даних оточуючи х умовах. Термін «головним чином постійна», застосований, наприклад, в контексті «головним чином постійна інфузія» або «головним чином постійна доставка», означає, що доставку лікарського засобу переривають, головним чином, упродовж попередньо вибраного періоду доставки лікарського засобу, причому кількість лікарського засобу, отримана пацієнтом протягом будь-якого 8годинного інтервалу в цьому попередньо вибраному періоді, ніколи не падає до нуля. Крім того, термін «головним чином постійна» доставка лікарського засобу може також включати доставку лікарського засобу з головним чином постійною, попередньо вибраною швидкістю або діапазоном швидкостей (наприклад, кількість лікарського засобу за одиницю часу або об'єм лікарської форми за одиницю часу), яку переривають головним чином упродовж попередньо вибраного періоду доставки лікарського засобу. Під терміном «головним чином стабільний стан», застосованим щодо біологічного параметра, який може змінюватися в залежності від часу, розуміють, що цей біологічний параметр має головним чином постійну величину протягом певного періоду часу, так що площа під кривою (ППК), визначена величиною цього біологічного параметра в залежності від часу для будь-якого 8-годинного періоду протягом згаданого певного періоду часу (ППК8год), становить не більше 20% вище або нижче, краще - не більше 15% вище або нижче, а ще краще - не більше 10% вище або нижче, середньої площі під кривою біологічного параметра протягом 8-годинного інтервалу упродовж згаданого певного періоду часу (середня ППК8год). Середню ППК8год визначають як частку (q) площі під кривою біологічного параметра протягом усього певного періоду часу (загальна ППК), поділену на кількість 8-годинних інтервалів в згаданий період часу (всього 1/3 днів), тобто q=(загальна ППК)/(всього 1/3 днів). Наприклад, коли йдеться про концентрацію лікарського засобу в сироватці, то ця концентрація утримується в, головним чином, стабільному стані протягом певного періоду часу, коли площа під кривою концентрації лікарського засобу в сироватці протягом будь-якого 8годинного періоду в згаданому періоді часу (ППК8год) становить не більше 20% вище або нижче середньої площі під кривою концентрації лікарського засобу у сироватці протягом 8-годинного періоду in в згаданому періоду часу (середня ППК8год), тобто ППК8год становить не більше 20% вище або нижче середньої ППК8год для кон 18 центрації лікарського засобу у сироватці протягом згаданого періоду часу. Перед подальшим описом винаходу слід усвідомити, що даний винахід не обмежується описуваними конкретними варіантами, оскільки вони, звичайно, можуть змінюватись. Слід також розуміти, що наведена тут термінологія застосована лише для опису конкретних варіантів, а не для обмеження, оскільки об'єм винаходу обмежується тільки формулою винаходу. Там, де дається діапазон величин, слід розуміти, що кожна величина, яка знаходиться в межах діапазону, до десятої частки одиниці нижньої границі, якщо чітко не зазначено інакше, між верхньою і нижньою границями цього діапазону, і будьяка інша зазначена величина або інша величина, що знаходиться в межах згаданого діапазону, входить в об'єм винаходу. Верхню і нижню границі менших діапазоні можна незалежно включати в ці менші діапазони, і це також входить в об'єм винаходу за умови виключення будь-якої конкретної границі в зазначеному діапазоні. Там, де зазначений діапазон включає одну або обидві такі границі, в об'єм винаходу також входять діапазони, що виключають будь-яку з цих включених границь. Якщо не зазначено інакше, всі застосовані в даному описі технічні та наукові терміни мають значення, загальноприйняті в галузі, до якої відноситься винахід, і зрозумілі фахівцям цієї галузі. Хоча при реалізації або випробуванні даного винаходу можна також використовувати будь-які способи і матеріали, подібні або еквівалентні описаним, далі будуть описані кращі способи і матеріали. Всі згадані в описі публікації включені як посилання і наведені для розкриття і опису способів та/або матеріалів, у зв'язку з якими наведені ці публікації. Слід також зазначити, що застосовані в описі і формулі винаходу форми однини включають і відповідності у множині, якщо контекст чітко не диктує інше. Наприклад, слово "спосіб" включає ряд таких способів, а слово "доза" відноситься до однієї або більше доз та їхніх еквівалентів, відомих фахівцям. Згадані в даному описі публікації наведені виключно для розкриття їхньої суті до дати подання даної заявки. Ніщо в даному описі не може бути витлумачено як припущення того, що даний винахід не має права датувати заднім числом таку публікацію через попередній винахід. Крім того, наведені дати публікацій можуть відрізнятися від фактичних дат публікацій, що, можливо, треба окремо підтверджувати. Даний винахід пропонує сполуки формули І, а також фармацевтичні композиції і лікарські форми, що містять будь-яку сполуку формули І. Запропонована сполука є корисною для лікування інфекції, викликаної вірусом гепатиту С (ВГС), та інших порушень, про які йтиметься далі. Композиції Даний винахід пропонує сполуки загальної формули І: 19 84579 де: (a) R1 і R2 кожний незалежно являють собою H, галоген, ціано, нітро, гідрокси, C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, С 2-6алкеніл, C 16алкокси, гідрокси-C 1-6алкіл, C 1-6алкіл, необов'язково заміщений 5 групами атомів фтору, С6 або 10арил, піридал, піримідал, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси, S(O)2NR6R7, NHC(O)NR6R7, NHC(S)NR6R7, C(O)NR6R7, NR6R7, C(O)R8, C(O)OR 8, NHC(O)R8, NHC(O)OR 8, SO mR8, NHS(O)2R8, OCHn NR6R7 або OCHnR16, де R16 являє собою імідазоліл або піразоліл; причому згадані тієніл, піримідал, фураніл, тіазоліл і оксазоліл в позначенні R1 і R2 є необов'язково заміщеними двома атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; при цьому згадані С 6 або 10арил, піридал, фенокси і тіофенокси в позначенні R1 і R2 є необов'язково заміщеними 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3.7 циклоалкілу, С4-10алкілциклоалкілу, С2-6алкенілу, C1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, C16алкокси, необов'язково заміщеного 5 групами атомів фтору; (б) m=0,1 або 2; (в) R4 являє собою H, C1- 6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, феніл або бензил, причому феніл або бензил є необов'язково заміщеними 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; (г) R5 являє собою C1-6алкіл, C(O)NR6R7, C(S)NR6R7, C(O)R8, C(O)OR 8, S(O)2R8 або (CO)CHR21NH(CO)R22; (д) R6 і R7 кожний незалежно являє собою H, C1-6алкіл, С3-7циклоалкіл, G4-10алкілциклоалкіл або феніл, причому феніл є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 20 5 групами атомів фтору; або R6 і R7 взяті разом з азотом, до якого вони приєднані для утворення індолінілу, піролідинілу, піперидинілу, піперазинілу або морфолінілу; (e) R являє собою C1-6алкіл, С3-7циклоалкіл, С410алкілциклоалкіл, які всі є необов'язково заміщеними 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси, або фенілу; або R8 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С37циклоалкілу, С 4-10алкілциклоалкілу, С 2-6алкенілу, C1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, C16алкокси, необов'язково заміщеного 5 групами атомів фтору; або R8 являє собою C 1-6алкіл, необов'язково заміщений 5 групами атомів фтору; або R являє собою тетрагідрофуранове кільце, з'єднане через С3- або С4-позицію тетрагідрофуранового кільця; або R8 являє собою тетрапіранілове кільце, з'єднане через С4-позицію тетрапіранілового кільця; (є) Y являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 являє собою C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси або фенілу, або R9 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; або R9 являє собою C16алкіл, необов'язково заміщений 5 групами атомів фтор у, NR6R7 або (CO)OH, або R9 являє собою гетероароматичне кільце, необов'язково заміщене двома атомами галогену, ціано, нітро, гідрокси або C1-6алкокси; або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський зісіб; (ж) R10 і R11 кожний незалежно являє собою C16алкіл, С 3-7циклоалкіл, С 4-10алкілциклоалкіл, С 6 або 10арил, гідрокси-C 1-6алкіл, C 1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси або фенілу; або R14 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або 10арил в позначенні R10 і R11 є необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, Сьб алкокси, необов'язково заміщеного 5 групами атомів фтор у; або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопен 21 84579 тилу або циклогексилу; або R10 і R11 є об'єднаними у вигляді O; (з) р=0 або 1; (и) R12 і R13 кожний незалежно являє собою H, C1-6алкіл, С3-7циклоалкіл, С4-10алкілцикдоалкіл, С6 або 10арил, гідрокси-C1-6алкіл, C1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою C1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси або фенілу; або R14 являє собою С6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С410алкілциклоалкілу, С 2-6алкенілу, C 1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, C1- 6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або 10арил в позначенні R12 i R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, C1-6алкілу, С3-7циклоалкілу, С410алкілциклоалкілу, С 2-6алкенілу, C 1-6алкокси, гідрокси-C1-6алкілу, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, C1- 6алкокси, необов'язково заміщеного 5 групами атомів фтор у; або R12 і R13 взято разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; або R12 і R13 кожний незалежно являє собою Сі-б алкіл, необов'язково заміщений (CH2)nOR8; (і) R20 являє собою H, C1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, С 6 або 10арил, гідрокси-C1-6алкіл, C1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою H, C1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси або фенілу; або R14 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або 10арил в позначенні R12 і R13 є необов'язково заміщеним 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; (ї) n=0-4; (й) V вибраний із O, S або NH; (к) якщо V являє собою O або S, то W вибирають з O, NR15 або CR15; якщо V являє собою NH, то W вибирають з NR15 або CR15, де R15 являє собою H, C1-6алкіл, С3-7циклоалкіл, С4або C1-6алкіл, необов'язково 10алкілциклоалкіл заміщений 5 групами атомів фтор у; (л) пунктирна лінія представляє необов'язковий подвійний зв'язок; (м) R21 являє собою C1-6алкіл, С3-7циклоалкіл, 22 С4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтору, або фенілу; або R21 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, C16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, C 2C1-6алкокси, гідрокси-C1-6алкілу, C16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, C1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; або R21 являє собою піридал, піримідал, піразиніл, тієніл, фураніл, тіазоліл, оксазоліл, фенокси, тіофенокси; і (н) R22 являє собою C1-6алкіл, С3-7циклоалкіл, C4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, C1-6алкокси, C1-6алкілу, необов'язково заміщеного 5 групами атомів фтор у, або фенілу. Даний винахід пропонує сполуки загальної формули II: де: (а) R1 і R2 кожний окремо являють собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)NR6R7, C(O)R8 , C(O)OR 8; (в) R6 і R7 кожний незалежно являє собою H, C1-6алкіл, С3-7циклоалкіл, C4-10алкілциклоалкіл або феніл; (г) R являє собою C1-6алкіл, С3-7циклоалкіл, C410алкілциклоалкіл або 3-тетрагідрофурил; (д) Y являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це C1-3алкіл, С37циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, C13алкілу, С 3-7циклоалкілу, С 1-3алкокси, або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (e) R10 і R11 кожний незалежно являє собою H, C1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутилу, циклопентану або циклогексилу; (є) W вибирають з O або NH; і ж) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули III: 23 84579 24 17 Даний винахід пропонує сполуки загальної формули V: де: (а) R1 і R2 кожний незалежно являє собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R4 являє собою H; (в) R5 являє собою C(O)NR6R7, C(O)R8, C(O)OR 8; (г) R8 являє собою C1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або 3-тетрагідрофурил; (д) Y являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це С1-3алкіл, С37циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С13алкілу, С 3-7циклоалкілу, С 1-3алкокси, або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (e) W вибирають з O або NH; і (є) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули IV: де: (а) R1 і R2 кожний незалежно являє собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С1-6алкіл, С5-6циклоалкіл або 3-тетрагідрофурил; (г) R9 являє собою С 1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С13алкокси; (д) R10 і R11 кожний незалежно являє собою H, С1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані, для утворення циклопропілу, циклобутану, циклопентилу або циклогексилу; (e) W вибирають з O або NH; і (є) пунктирна лінія представляє необов'язковий подвійний зв'язок. де: (а) R1 і R2 кожний незалежно являє собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С1-6алкіл, С5-6циклоалкіл або 3-тетрагідрофурил; (г) R9 являє собою С 1-3алкіл, С3-5циклоалкіл або' феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С13алкокси; (д) R10 і R11 кожний незалежно являє собою H, С1-3алкіл або С4-5циклоалкіл; (e) W вибирають з O або NH; і (є) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули VI: де: (а) R1 і R2 кожний незалежно являє собою H, хлоро, фторо, ціано, гідрокси, С1-3алкіл, С13алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С 1-6алкіл, С5-6циклоалкіл; (г) R9 являє собою С 1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С13алкокси; (д) R10 і R11 кожний незалежно являє собою H, С1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані для утворення циклопропілу, циклобутилу. (e) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули VII: 25 84579 де: (а) R1 і R2 кожний незалежно являє собою H, хлоро, фторо, ціано, гідрокси, С1-3алкіл, С13алкокси; (б) R5 являє собою C(O)OR 8 або C(O)NHR8; (в) R8 являє собою С 1-6алкіл, C5-6циклоалкіл; (г) R9 являє собою С 1-3алкіл, С3-4циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, гідрокси, С1-3алкілу, С13алкокси; (д) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули VIII: де: (а) R1 і R2 кожний незалежно являє собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R4 являє собою H; (в) R5 являє собою C(O)NR6R7, C(O)R8, C(O)OR 8; (г) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або 3-тетрагідрофурил; (д) Y являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це С1-3алкіл, С37циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С13алкілу, С 3-7циклоалкілу, С 1-3алкокси, або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (e) R10 і R11 кожний незалежно являє собою H, С1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; (є) R20 являє собою H, С1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, С 6 або 10арил, гідрокси-С 1-6алкіл, С1-6алкіл, необов'язково замі 26 щений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою H, С1-6алкіл, C3-7циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідрокси-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або 10арил в позначенні R12 і R13 є необов'язково заміщеним З атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідрокси-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтор у; (ж) W вибирають з O або NH; і (з) пунктирна лінія представляє необов'язковий подвійний зв'язок. Даний винахід пропонує сполуки загальної формули IX: де: (а) R1 і R2 кожний незалежно являє собою H, гало, ціано, гідрокси, С1-3алкіл, С1-3алкокси; (б) R4 являє собою H; (в) R5 являє собою C(O)NR6R7, C(O)R8, C(O)OR 8; (г) R8 являє собою С1-6алкіл, С3-7циклоалкіл, С4-10алкілциклоалкіл або 3-тетрагідрофурил; (д) Y являє собою сульфонімід формули C(O)NHS(O)2R9, де R9 - це С1-3алкіл, С37циклоалкіл або феніл, необов'язково заміщений двома атомами галогену, ціано, нітро, гідрокси, С13алкілу, С 3-7циклоалкілу, С 1-3алкокси, або Y являє собою карбонову кислоту або її фармацевтично прийнятну сіль, сольват або пролікарський засіб; (e) R10 і R11 кожний незалежно являє собою H, С1-3алкіл, або R10 і R11 взято разом з атомом вуглецю, до якого вони приєднані для утворення циклопропілу, циклобутилу, циклопентилу або циклогексилу; (є) R20 являє собою H, С1-6алкіл, С37циклоалкіл, С 4-10алкілциклоалкіл, C 6 або 10арил, гідрокси-С 1-6алкіл, С1-6алкіл, необов'язково заміщений 5 групами атомів фтору, (CH2)nNR6R7, (CH2)nC(O)OR 14, де R14 являє собою H, С1-6алкіл, C3-4циклоалкіл, С4-10алкілциклоалкіл, які всі є необов'язково заміщені 1-3 атомами галогену, ціано, нітро, гідрокси, С1-6алкокси або фенілу; або R14 являє собою С 6 або 10арил, необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С1 27 6алкілу, 84579 С3-7циклоалкілу, С4-10алкілциклоалкілу, С2С1-6алкокси, гідрокси-С 1-6алкілу, С16алкілу, необов'язково заміщеного 5 групами атомів фтору, С1-6алкокси, необов'язково заміщеного 5 групами атомів фтору; причому С6 або 10арил в позначенні R12 і R13 є необов'язково заміщений 3 атомами галогену, ціано, нітро, гідрокси, С16алкілу, С 3-7циклоалкілу, С 4-10алкілциклоалкілу, С 2С1-6алкокси, гідрокси-С 1-6алкілу, С16алкенілу, 6алкілу, необов'язково заміщеного 5 групами атомів фтору, Cue алкокси, необов'язково заміщеного 5 групами атомів фтор у; (ж) W вибирають з O або NH; і (з) пунктирна лінія представляє необов'язковий подвійний зв'язок; і (и) Z являє собою конденсовану або приєднану кільцеву систему гетероарилу. Даний винахід крім того пропонує композиції, в тому числі фармацевтичні, які включають сполуки загальних формул І - VII, та їхні солі, складні ефіри або інші деривати. Запропонована фармацевтична композиція включає запропоновану сполуку і фармацевтично прийнятне середовище для лікарського засобу. Відомий широкий спектр фармацевтично прийнятних середовищ для лікарських засобів, описаних в цілому ряді публікацій, наприклад, [A.Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams & Wilkins; Pharmaceutical Dosage Forms and Drag Delivery Systems (1999) H.C.Ansel et al.t eds., 7th ed., Lippincott, Williams & Wilkins; and Handbook of Pharmaceutical Excipients (2000) A.H.Kibbe et ah, eds., 3rd ed. Amer. Pharmaceutical Assoc]. Фармацевтично прийнятні середовища для лікарських засобів, наприклад основи, допоміжні лікарські речовини, носії або розріджувачі, є легкодоступними для фахівців. Більш того, легкодоступними для фахівців є фармацевтично прийнятні допоміжні речовини, наприклад засоби, що створюють або регулюють рН, засоби, що регулюють тонічність, стабілізатори, зволожуючі засоби тощо. В багатьох варіантах винаходу запропонована сполука інгібує ферментативну активність NS3протеази вірусу гепатиту C (ВГС). Факт інгібування запропонованою сполукою NS3 ВГС можна легко визначити відомим методом. Звичайні методи включають визначення того, чи розщеплюється білком NS3 поліпротеїн або інший поліпептид ВГС, що містить сайт впізнавання NS3, у присутності згаданого засобу. В багатьох варіантах винаходу запропонована сполука інгібує ферментативну активність NS3 принаймні на 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80% або принаймні 90% чи більше порівняно з ферментативною активністю NS3 за відсутності згаданої сполуки. В багатьох варіантах винаходу запропонована сполука інгібує ферментативну активність NS3протеази ВГС на 50% при концентрації менш ніж 50μМ, наприклад при концентрації менш ніж 40μМ, 25μМ, 10μМ, 1μМ, 100нМ, 80нМ, 60нМ, 50нМ, 25нМ, 10нМ або 1нМ чи ще менше. В багатьох варіантах винаходу запропонована сполука інгібує реплікацію вірусу гепатиту C. На6алкенілу, 28 приклад, запропонована сполука інгібує реплікацію ВГС принаймні на 10%, 15%, 20%, 25%, 30%, 40%, 50%, 60%, 70%, 80% або 90% чи ще більше порівняно з реплікацією ВГС за відсутності цієї сполуки. Факт інгібування запропонованою сполукою реплікації ВГС можна визначити відомими методами, в тому числі методом реплікації вірусу in vitro. Лікування інфекції, викликаної вірусом гепатиту Описувані способи і композиції, як правило, є ефективними при лікуванні інфекції, викликаної ВГС. Ефективність запропонованого способу лікування ВГС-інфекції можна визначити за зменшенням вірусного навантаження, зменшенням часу до сероконверсії (коли вірус стає невиявним у сироватці пацієнта), збільшенням швидкості стійкої вірусологічної відповіді на терапію, зменшенням числа захворювань або смертей в клінічних результатах або за іншим показником реакції на хворобу. Як правило, ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка ефективно зменшує вірусне навантаження або за допомогою якої досягається стійка вірусологічна відповідь на терапію. Ефективність запропонованого способу лікування ВГС-інфекції можна визначити, вимірюючи вірусне навантаження або параметр, асоційований з ВГС-інфекцію, в тому числі (але не тільки) фіброз печінки, підвищення рівнів трансамінази в сироватці, некрозапальну активність в печінці. Показники фіброзу печінки детально обговорюються нижче. Запропонований спосіб включає введення ефективної кількості сполуки формули І, необов'язково у поєднанні з ефективною кількістю одного або більше додаткових противірусних засобів. В деяких варіантах винаходу такою ефективною кількістю є кількість, яка ефективно зменшує вірусні титри до невиявних рівнів, наприклад до 10005000, 500-1000, 100-500 геномних копій на мілілітр сироватки. В деяких варіантах ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка ефективно зменшує вір усне навантаження до менш ніж 100 геномних копій/мл сироватки. В деяких варіантах ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для досягнення 1,5-log, 2-log, 2,5log, 3-log, 3,5-log, 4-log, 4,5-log або 5-log зниження у вірусному ти трі в сироватці індивіда. В багатьох варіантах ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для досягнення стійкої вірусологічної відповіді, наприклад невиявної PHK ВГС (наприклад, в сироватці пацієнта знаходять менш ніж 500, 400, 200 або 100 геномних копій/мл сироватки протягом принаймні 1 місяця, двох, трьох, чотирьох, п'яти або шести місяців після припинення лікування). Як вже зазначалося, визначити ефективність 29 84579 запропонованого способу лікування ВГС-інфекції можна, вимірюючи параметр, асоційований з ВГСінфекцією, наприклад фіброз печінки. Способи визначення ступеня фіброзу печінки детально описані нижче. В деяких варіантах ступінь фіброзу печінки показує рівень сироваткового маркера. Один необмежуючий приклад: стандартними методами вимірюють рівні аланінової амінотрансферази (АлАТ). Як правило, нормальним вважається рівень АлАТ менше 45 міжнародних одиниць (IU). В деяких варіантах ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для зниження рівнів АлАТ до менш ніж 45 IU/мл сироватки. Терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для зниження рівня маркера фіброзу печінки принаймні на 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80% або більше порівняно з рівнем цього маркера у нелікованого або плацебо-лікованого пацієнта. Методи вимірювання сироваткових маркерів включають імунологічні методи, наприклад імуноферментний твердофазний аналіз (ELISA), радіоімуноаналіз (RIA), із застосуванням антитіла, специфічного до даного сироваткового маркера. В багатьох варіантах винаходу е фективною кількістю сполуки формули І і додаткового противірусного засобу є синергічна кількість. В даному описі термін "синергічна комбінація" або "синергічна кількість" сполуки формули І і додаткового противірусного засобу означає комбіноване дозування, яке є більш ефективним в лікуванні або профілактиці ВГС-інфекції, ніж незначне поліпшення результату лікування, яке можна було б спрогнозувати або очікувати від лише сумарної комбінації і) терапевтичного або профілактичного ефекту від сполуки формули І при введенні в такій самій дозі, що і при монотерапії, та іі) терапевтичного або профілактичного ефекту від додаткового противірусного засобу при введенні в такій самій дозі, що і при монотерапії. В деяких варіантах винаходу вибрана кількість сполуки формули І і вибрана кількість додаткового противірусного засобу є ефективними при застосуванні в комбінованій терапії хвороби, але ця вибрана кількість сполуки формули І та/або вибрана кількість додаткового противірусного засобу є неефективною при застосуванні в монотерапії цієї хвороби. Таким чином, даний винахід охоплює: (1) схеми, при яких вибрана кількість додаткового противірусного засобу підсилює терапевтичний ефект вибраної кількості сполуки формули І при застосуванні в комбінованій терапії хвороби, але не забезпечує терапевтичного ефекту при застосуванні в монотерапії згаданої хвороби; (2) схеми, при яких вибрана кількість сполуки формули І підсилює терапевничний ефект вибраної кількості додаткового противірусного засобу при застосуванні в комбінованій терапії хвороби, але не забезпечує терапевтичного ефекту при застосуванні в монотерапії згаданої хвороби; і (3) схеми, при яких вибрана кількість сполуки формули І і вибра 30 на кількість додаткового противірусного засобу забезпечують терапевтичний ефект при застосуванні в комбінованій терапії хвороби, але кожна із згаданих вибраних кількостей сполуки формули І і додаткового противірусного засобу, відповідно, не забезпечує терапевтичного ефекту при застосуванні в монотерапії згаданої хвороби. Слід розуміти, що використаний в даному описі термін "синергічно ефективна кількість" сполуки формули І і додаткового противірусного засобу, та його граматичні еквіваленти включають будь-який з вищеописаних пунктів (1)-(3). Фіброз Даний винахід пропонує способи лікування фіброзу печінки (в тому числі тих його форм, що є результатом ВГС-інфекції або пов'язані з нею), які, як правило, включають уведення терапевтичної кількості сполуки формули І і необов'язково одного або більше додаткових противірусних засобів. Нижче описуються ефективні кількості сполук формули І, з одним або більше додаткових противірусних засобів чи без них, а також схеми дозування. Ефективність лікування сполукою формули І, необов'язково з одним або більше додаткових противірусних засобів, для зменшення фіброзу печінки визначають будь-яким з відомих методів визначення ступеня фіброзу печінки та функції печінки. Зменшення фіброзу печінки визначають, аналізуючи біоптат печінки. Аналіз біопсії печінки включає оцінювання двох головних компонентів: некрозапалення, яке оцінюють за "ступенем" як показником інтенсивності і активності існуючої хвороби, та осередків фіброзу і паренхіматозної або васкулярної перебудови, яку оцінюють як "стадію", що відображає тривалу прогресію хвороби. [Див., наприклад, Brunt (2000) Hepatol. 31: 241246; and METAVIR (1994) Hepatology 20: 15-20]. На основі аналізу біопсії печінки визначають бал. Існує ряд стандартних бальних систем, які дають кількісну оцінку ступеня та вираженості фіброзу. Такими бальними системами є METAVIR, Knodell, Scheuer, Ludwig та Ishak. Бальна система MEYAVIR базується на аналізі різних ознак біопсії печінки, в тому числі фіброзу (портального фіброзу, цетрилобулярного фіброзу та цирозу); некрозу (перепортального і лобулярного некрозу, ацедофільної ретракції і балонної дистрофії); запалення (запалення портального тракту, портальних лімфатичних агрегатів і розповсюдження портального запалення); змін жовчних протоків; та на індексі Knodell (шкала перипортального некрозу, лобулярного некрозу, портального запалення, фіброзу та загальної активності хвороби). Визначення кожної стадії в системі METAVIR такі: 0 балів - немає фіброзу; 1 бал - портальний фіброз без септ; 2 бали - портальний фіброз з рідкими септами; 3 бали - багато септ без цирозу; 4 бали - цироз. Бальна система Knodell, яку також називають Індексом активності гепатиту, класифікує проби за допомогою бальної системи в чотири категорії гістологічних ознак: І - перипортальний та/або містечковий некроз; II - інтралобулярна дистрофія і точковий некроз; III - портальне запалення; IV фіброз. Стадії в системі Knodell визначаються так: 31 84579 0 балів - немає фіброзу; 1 бал - слабкий фіброз (портальне розширення фіброзу); 2 бали - помірний фіброз; 3 бали - виражений фіброз (місточковий фіброз); і 4 бали - цироз. Чим вище бал, тим більш виражене ушкодження тканини печінки. [Knodell (1981) Hepatol. 1: 431]. Бальна система Scheuer класифікує наступним чином: 0 балів - немає фіброзу; 1 бал - збільшені, фібротичні портальні тракти; 2 бали - перипортальні або порто-портальні септи, але інтактна структура; 3 бали - фіброз зі структурною деформацією, але не явний цироз; 4 бали - вірогідний або явний цироз. [Scheuer (1991) J. Hepatol. 13: 372]. Систему Ishak описано в статті[Ishak (1995) J. Hepatol. 22: 696-699]. Стадія 0 - немає фіброзу; стадія 1 - поширення фіброзу деяких портальних ділянок, з короткими волокнистими септами; стадія 2 - фібротичне розростання більшості портальних ділянок з періодичним утворенням портопортальних (P-P) містків; стадія 4 - фібротичне розростання портальних ділянок з утворенням зазначених P-P містків і порто-центральних (P-C) містків; стадія 5 - утворення зазначених містків (PP та/або P-C) з періодичними вузликовими потовщеннями (неповний цироз); стадія 6 - цироз, вірогідний або виражений). Ефект протифіброзної терапії можна також визначити і оцінити за допомогою бальної системи Child-Pugh, що являє собою багатокомпонентну бальну систему, що базується на відхиленнях в рівні білірубіну в сироватці, рівні альбуміну в сироватці, протромбіновому часі, наявності та вираженості асциту і наявності та вираженості енцефалопатії. На основі наявності та вираженості відхилення цих параметрів пацієнта можна віднести до однієї з трьох категорій збільшення вираженості хвороби: А, В або C. В деяких варіантах винаходу терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для здійснення зміни на одну одиницю або більше в стадії фіброзу, що визначають на основі результатів біопсії печінки до і після терапії. В деяких конкретних варіантах терапевтично ефективна кількість сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, зменшує фіброз печінки принаймні на одну одиницю за бальними системами METAVIR, Knodell, Scheuer, Ludwig або Ishak. Для оцінки ефективності лікування за допомогою сполуки формули І можна також застосовувати допоміжні, або непрямі показники функції печінки. Як показник ефективності запропонованого способу лікування можна також застосовувати морфометричне комп'ютеризоване напівавтоматичне оцінювання кількісного ступеня фіброзу печінки на основі специфічного забарвлювання колагену табо сироваткових маркерів фіброзу печінки. Допоміжні показники функції печінки включають, але не обмежуються цим, рівні трансамінази в сироватці, протромбіновий час, рівень білірубіну, підрахування тромбоцитів, портальний тиск, рівень альбуміну і оцінку за шкалою Child-Pugh. 32 Ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для збільшення показника функції печінки принаймні на 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% або 80% чи більше порівняно з цим показником функції печінки у нелікованого індивіда або у плацебо-лікованого індивіда. Фахівці можуть легко визначати такі показники функції печінки за допомогою стандартних аналізів, багато з яких є комерційно доступними і які традиційно застосовують в клінічних умовах. Для визначення ефективності запропонованого способу лікування можна також вимірювати сироваткові маркери фіброзу печінки. Сироваткові маркери фіброзу печінки включають, але не обмежуються цим, гіалуронат, N-кінцевий пептид проколагену III, домен 7S колагену типу IV, С-кінцевий пептид проколагену І і ламінін. Додатковими біохімічними маркерами фіброзу печінки є α-2макроглобулін, гаптоглобін, гаммаглобулін, аполіпопротеїн А і гамма-гутамілтранспептидаза. Терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для зниження в сироватці рівня маркера фіброзу печінки принаймні на 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% або 80% чи більше порівняно з рівнем цього маркера у нелікованого індивіда або у плацеболікованого індивіда. Фахівці можуть легко визначати такі сироваткові маркери фіброзу печінки за допомогою стандартних аналізів, багато з яких є комерційно доступними і які традиційно застосовують в клінічних умовах. Способи вимірювання сироваткових маркерів включають імунологічні методи, імуноферментний твердофазний аналіз (ELISA), радіоімунний аналіз (RIA) та інші, в яких використовують антитіло, специфічне до даного сироваткового маркера. Для оцінки ефективності лікування за допомогою агоніста рецептора інтерферону і пірфедоніну (або аналога пірфедоніну) можна також застосовувати кількісні проби на функціональний резерв печінки. Вони включають: пробу на очищення від індоціанового зеленого (ICG), пробу на здатність елімінації галактози (GEC), пробу на наявність амінопірину в диханні (ABT), пробу на очищення від антипірину, пробу на очищення від моноетилгліцин-ксилідиду (MEG-X) і пробу на очищення від кофеїну. Застосований в даному описі термін "ускладнення, асоційоване з цирозом печінки" відноситься до порушення, яке є наслідком декомпенсованої хвороби печінки, тобто трапляється після розвинення фіброзу печінки і як його результат, і включає, але не обмежується цим, асцит, варикозну кровотечу, портальну гіпертензію, жовтяницю, прогресуючу недостатність печінки, енцефалопатію, гепатоцелюлярну карценому, ушкодження печінки, яке потребує її трансплантації, і смерть, пов'язану з хворобою печінки. Терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є 33 84579 ефективною для зниження числа порушень, пов'язаних з цирозом печінки (наприклад, вірогідності того, що пацієнт їх не виявить), принаймні на 10%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75% або 80% чи більше порівняно з нелікованим індивідом або плацебо-лікованим індивідом. Фахівцям відомі способи визначення ефективності лікування сполукою формули І, і необов'язково одним або більше додаткових противірусних засобів, для зменшення числа порушень, пов'язаних з цирозом печінки. Зменшення фіброзу печінки підвищує функцію печінки. Отже, даний винахід пропонує способи підвищення функції печінки, які взагалі передбачають уведення терапевтично ефективної кількості сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів. Функції печінки включають, але не обмежуються цим, синтез білків, наприклад сироваткових білків (альбуміну, коагулюючих факторів, лужної фосфатази, амінотрансфераз (наприклад, аланінтрансамінази, аспартат-трансамінази), 5'нуклеозидази, g-глутамінілтранспептидази тощо), синтез білірубіну, синтез холестерину і синтез жовчних кислот; метаболічну функцію, яка включає (але не обмежується цим) вуглеводний обмін, амінокислотний і аміачний обміни, гормональний обмін і ліпідний обмін; усунення токсичної дії екзогенних лікарських засобів; гемодинамічну функцію, в тому числі вісцеральну і портальну гемо динаміку, і таке інше. За допомогою відомих тестів функції печінки фа хівці можуть з'ясувати, чи підвищилась функція печінки. Отже, синтез маркерів функції печінки, наприклад альбуміну, лужної фосфатази, аланінтрансамінази, аспартат-трансамінази, білірубіну та інших, можна оцінювати, визначаючи рівень цих маркерів у сироватці за допомогою стандартних імунологічних і ферментативних аналізів. Вісцеральний кровообіг і портальну гемодинаміку можна визначити за портальним заклиненим тиском та/або резистентністю, застосовуючи стандартні методи. Метаболічні функції можна визначати, вимірюючи рівень аміаку в сироватці. За допомогою стандартних імунологічних і ферментативних аналізів можна визначити, чи в нормальному діапазоні знаходяться нормально секретовані сироваткові білки, вимірюючи рівні цих білків. Фахівцям відомі нормальні діапазони для сироваткових білків. Нижче наведені необмежуючі приклади. Нормальний рівень аланін-трансамінази становить приблизно 45 IU/мл сироватки. Нормальний рівень аспартат-трансамінази - приблизно 5-40 одиниць на літр сироватки. Білірубін визначають стандартними аналізами. Нормальні рівні білірубіну становлять, як правило, менше 1,2мг/дл. Рівні сироваткового альбуміну визначають стандартними аналізами. Нормальні рівні сироваткового альбуміну становлять 35-55г/л. Стандартними аналізами визначають і пролонгацію протромбінового часу. Нормальним є протромбіновий час, довший за контрольний менш ніж на 4 секунди. Терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше до 34 даткових противірусних засобів, є кількість, яка є ефективною для підвищення функції печінки принаймні на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% або більше. Наприклад, терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, є кількість, яка є ефективною для зниження підвищеного рівня сироваткового маркера функції печінки принаймні на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% чи більше, або для зниження рівня сироваткового маркера функції печінки до нормального діапазону. Терапевтично ефективною кількістю сполуки формули І, і необов'язково одного або більше додаткових противірусних засобів, також є кількість, що є ефективною для підвищення зниженого рівня сироваткового маркера функції печінки принаймні на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% чи більше, або для підвищення рівня сироваткового маркера функції печінки до нормального діапазону. Агоністи рецептора інтерферону типу І У будь-якому з вищеописаних способів і в деяких варіантах винаходу вводять агоніст рецептора інтерферону (IFN) типу І. Агоністи рецепторів інтерферону типу І включають: агоністи IFN-α, IFNβ, IFN-t, IFN-w, агоністи антитіл, специфічних до рецептора інтерферону типу І, і будь-який інший агоніст рецептора інтерферону типу І, в тому числі неполіпептидні агоністи. Інтерферон-альфа (IFN-α) В даному винаході можна застосовувати будьякий відомий IFN-α. Термін «інтерферон-альфа" в даному описі означає сімейство відповідних поліпептидів, які інгібують реплікацію вірусу і проліферацію клітин і модулюють імунну відповідь. Термін "IFN-α" включає: природний IFN-α, синтетичний IFN-α, IFN-α, отриманий в результаті реакції (дериват) (наприклад, пегільований IFN-α, глікозилований IFN-α і т.п.), і аналоги природного або синтетичного IFN-α, фактично будь-який IFN-α з противірусними властивостями, характерними для природного IFN-α. Відповідні α-інтерферони включають, але не обмежуються цим, природні IFN-α (в тому числі (але не тільки) природні IFN-α2a, IFN-α-2b); рекомбінантний IFN-α2b, наприклад інтерферон Intron-A від ф."Schering Corporation" (Kenilworth, N.J.); рекомбінантний IFN-α2a, наприклад інтерферон Roferon від ф."Ноffmann-Lа Roche" (Nutley, N.J.); рекомбінантний IFN-α2c, наприклад інтерферон Berofar-α2 від ф."Воеhringer Ingelheim Pharmaceutical, Inc." (Ridgefield, Conn.); IFN-α-n1, очищену суміш природних α-інтерферонів, наприклад інтерферон Sumiferon від ф."Sumitomo" (Japan) та IFN-α-n1 Wellferon (INS) від ф."GlaxoWellcome Ltd." (London, Great Britain); та IFN-α-n3 під торговою назвою Alferon - суміш природних aінтерферонів, що їх вигото вляє ф."Іnterferon Sciences" і постачає ф."Рurdue Frederick Co." (Norwalk, Conn.). Термін "IFN-α" також включає консенсусний IFN-α. Термін "консенсусний IFN-α" (який ще має назви "CIFN", "IFN-con" і "консенсусний інтерферон") включає, але не обмежується цим, амінокислотні послідовності, іменовані IFN-con1, IFN-con2 35 84579 та IFN-соn3, [описані в пат. США №4695623 і №4897471]; і консенсусний інтерферон, визначений в результаті детермінації консенсусної послідовності природних α-інтерферонів (наприклад, Infergen®, ф."ІnеrМunе, Inc.", Brisbane, Calif.). IFNcon1 - це агент консенсусного інтерферону в продукті Infergen® alfacon-1. Продукт консенсусний інтерферон Infergen® згадується в даному описі під його зареєстрованою патентованою назвою (Infergen®) або під родовою назвою (інтерферон alfacon-1). Послідовність ДНК, яка кодує IFN-con, можна синтезувати способами, описаними у вищезгаданих патентах або іншими стандартними способами. Особливий інтерес становить застосування CIFN. В даному винаході також можна застосовувати гібридні поліпептиди, що включають IFN-α і гетерологічний поліпептид. До відповідних гібридних поліпептидів IFN-α відносяться Albuferon-alpha™ (гібридний продукт, що складається з альбуміну людини та IFN-α, ф."Нuman Genome Sciences"; [див., наприклад, Osborn et аl. (2202) J. Pharmacol. Exp. Therap. 303: 540-548]). Для даного винаходу також підходять ген-зчеплені форми IFN-α. [Див., наприклад, Masci et аl. (2003) Curr. Oncol. Rep. 5: 108-113]. Пегільований інтерферон-альфа (PEG-IFN-α) Термін "IFN-α" також включає деривати IFN-α, отримані (наприклад, хімічно модифіковані) для зміни певних властивостей, наприклад часу напівжиття сироватки. По суті, термін "IFN-α" включає глікозилований IFN-α; IFN-α, отриманий за допомогою поліетиленгліколю (ПЕГ) (пегільований IFNα) і т.п.Пегільований IFN-α і способи його отримання описані, наприклад, [у патентах США №№5382657, 5981709 і 5951974]. Пегільований IFN-α включає кон'югати ПЕГ і будь-які з вищеописаних молекул IFN-α, в тому числі (але не тільки) ПЕГ, кон'югований з IFN-α-2a (Roferon, ф."Ноffmann La-Roche", Nutley, N.j.), з IFN-α-2b (Intron, ф."Schering-Plough", Madison, N.J.), з IFN-α2c (Berofor Alpha, ф."Воеhringer Ingelheim", Ingelheim, Germany) і з консенсусним інтерфероном, визначеним детермінацією консенсусної послідовності природних а-інтерферонів (Infergen®, ф."InterMune, Inc.", Brisbane, Calif.). Будь-який з вищезгаданих поліпептидів IFN-α можна модифікувати за допомогою одного або більше компонентів ПЕГ, тобто пегілювати. Молекула ПЕГ поліпептиду пегільованого інтерферону кон'югує з одним або більше амінокислотних бічних ланцюгів поліпептиду IFN-α. B одних варіантах винаходу пегільований IFN-α містить ПЕГкомпонент лише на одній амінокислоті. В інших варіантах пегільований IFN-α містить ПЕГкомпонент на двох або більше амінокислотах, наприклад IFN-α містить ПЕГ-компонент, з'єднаний з двома, трьома, чотирма, п'ятьма, шістьма, сімома, вісьмома, дев'ятьма або десятьма різними амінокислотними залишками. IFN-α може бути з'єднаний безпосередньо з ПЕГ (тобто без зв'язуючої групи) через аміногрупу, сульфгідрильну гр упу, гідроксильну груп у або карбоксильну гр упу. В одних варіантах пегільований IFN-α є пегі 36 льованим на амінокінці (N-кінці) або біля N-кінця поліпептиду IFN-α, наприклад ПЕГ-компонент з'єднується з поліпептидом IFN-α на одному або більше амінокислотних залишків амінокислот 1-4 або амінокислот 5-10. В інших варіантах пегільований IFN-α є пегільованим на одному або більше амінокислотних залишків, від 10 до 28. В інших варіантах пегільований IFN-α є пегільованим на карбоксильному кінці (C-кінці) або біля С-кінця поліпептиду IFN-α, наприклад на одному або більше залишків амінокислот 156-166 або амінокислот 150-155. В інших варіантах пегільований IFN-α є пегільованим на одному або більше амінокислотних залишків амінокислот 100-114. Поліетиленгліколева деривація амінокислотних залишків на одному з доменів рецепторзв'язуючого та/або активного сайту білка IFN-α або біля такого домена може розірвати функціонування цих доменів. В деяких варіантах винаходу амінокислоти, на яких пегілювання слід уникати, включають амінокислотні залишки амінокислот 3040 і амінокислотні залишки амінокислот 113-149. В деяких варіантах ПЕГ з'єднують з IFN-α за допомогою зв'язуючої гр упи. Зв'язуюча гр упа являє собою будь-яку біосумісну зв'язуючу груп у, де "біосумісна" означає, що ця сполука або група є нетоксичною і її можна застосовувати in vitro або in vi vo, не спричиняючи травми, болісності, хвороби або смерті. ПЕГ можна з'єднувати із зв'язуючою групою, наприклад, шляхом ефірного зв'язку, тіолового зв'язку або амідного зв'язку. Відповідні біосумісні зв'язуючі групи включають, але не обмежуються цим, такі групи: ефірну, амідну, імідну, карбаматну, карбоксильну, гідроксильну, карбогідратну, сукцинімідну (в тому числі, наприклад, сукцинімідилсукцинат (SS), сукцинімідилпропіонат (SPA), сукцинімідилбутаноат (SBA), сукцинімідилкарбоксиметилат (SCM), сукцинімідилсукцинамід (SSA) або N-гідрокси-сукцинімід (NHS)); епоксидну груп у, оксикарбонілімідазольну груп у ( в тому числі, наприклад, карбонілдимідазол (CDI)); нітрофенільну гр упу (в тому числі, наприклад, нітрофенілкарбонат (NPC) або трихлорфенілкарбонат (TPC)); трисилатну груп у, альдегідну груп у, ізоціанатну груп у, вінілсульфонову гр упу, тирозинову гр упу, цистеїнову гр упу, гістидинову гр уп у або первинний амін. Методи отримання ефір-активованих поліетиленгліколів сукцинімідилпропіонату (SPA) і сукцинімідилбутаноату (SBA) описані [у пат. США №5672662 (Harris et al.) і у міжнародній патентній заявці WO 97/03106]. Методи приєднання ПЕГ до поліпептиду IFN-α відомі, і будь-який з цих відомих методів може бути застосований. [Див., наприклад, Park et al, Anticancer Res., 1: 373-376 (1981); Zaplipsky and Lee, Polyethylen Glycol Chemistry: Biotechnical and Biomedical Applications, J.M.Harris, ed., Plenum Press, NY, Chapter 21 (1992); U.S.Patent No.5,985,265; U.S.Patent No.5,762,662 (Harris et al.) and WO 97/03106]. Пегільований IFN-α і способи його отримання описані, наприклад [у патентах США №№5382657, 37 84579 5981709, 5985265 і 5951974]. Пегільований IFN-α включає кон'югати ПЕГ і будь-якої з вищеописаних молекул IFN-α, в тому числі (але не тільки) ПЕГ, кон'югований з IFN-α-2a (Roferon, ф."Hoffmann LaRoche", Nutley, N.j.), де пегільований Roferon відомий під назвою Pegasys (ф."Hoffmann La-Roche"); з IFN-α-2b (Intron, ф."Schering-Plough", Madison, N.J.), де пегільований Intron відомий під назвою PEG-Intron (ф."Schering-Plough"); з IFN-α-2c (Berofor Alpha, ф."Воеhringer Ingelheim", Ingelheim, Germany) і з консенсусним інтерфероном (CINF), визначеним в результаті детермінації консенсусної послідовності природних α-інтерферонів (Infergen®, ф."ІnterМunе, Inc.", Brisbane, Calif), де пегільований Infergen має назву PEG-Infergen. В багатьох варіантах винаходу ПЕГ являє собою молекулу монометоксиПЕГ, яка взаємодіє з групами первинного аміну на поліпептиді ІFN-α. Методи модифікування поліпептидів за допомогою монометоксиПЕГ шляхом відновного алкілування відомі в галузі. [Див., наприклад, Chamow etal. (1994) Bioconj, Chem. 5: 133-140]. В одному з необмежуючих прикладів ПЕГ зв'язують з IFN-α за допомогою SPA-зв'язуючої гр упи. SPA-складні ефіри ПЕГ і способи їх отримання описані [у пат. США №5672662]. SPA-зв'язки забезпечують зв'язок з трьома аміногрупами на поліпептиді IFN-α. Наприклад, молекулу ПЕГ ковалентно зв'єднують за допомогою зв'язку, який являє собою амідний зв'язок між пропіоніловою групою ПЕГкомпонента та є-аміногрупою поверхневооголеного лізинового залишку в поліпептиді IFN-α. Такий зв'язок можна утворити, наприклад, конденсацією складного ефіру ПЕГ, активованого αметокси, w-пропановою кислотою (mPEGspa). Ще один необмежуючий приклад: один кон'югат монопегільованого CINF, якому віддають перевагу для застосування в даному винаході, має лінійний ПЕГ-компонент приблизно 30 кілодальтонів (kD), з'єднаний ковалентним зв'язком з поліпептидом CINF, де ковалентний зв'язок являє собою амідний зв'язок між пропіоніловою групою ПЕГкомпонента та є-аміногрупою поверхневооголеного лізинового залишку в поліпептиді CINF, причому поверхнево-оголений лізиновий залишок вибирають із lys 31, lys 50, l ys 71, l ys 84, lys 121, l ys 122, lys 134, l ys 135, l ys 165, а амідний зв'язок утворюють конденсацією складного ефіру ПЕГ, активованого α-метокси, w-пропановою кислотою. Поліетиленгліколь Поліетиленгліколь (ПЕГ), що підходить для кон'югації з поліпептидом IFN-α, є розчинним у воді при кімнатній температурі, і має загальну формулу R(O-CH2-CH2)nO-R, де R - це водень або захисна група, наприклад алкілова або алканолова, n - ціле число від 1 до 1000. R - це захисна група, що, як правило, має 1-8 атомів вуглецю. В багатьох варіантах винаходу ПЕГ має принаймні одну гідроксильну груп у, наприклад кінцеву, яку модифікують, щоб утворити функціональну груп у, здатну взаємодіяти з аміногрупою, наприклад з є-аміногрупою лізинового залишку, вільною аміногрупою на N-кінці поліпептиду або з будьякою іншою аміногрупою, наприклад аміногрупою 38 аспарагіну, глутаміну, аргініну або гістидину. В інших варіантах ПЕГ хімічно модифікують таким чином, що він стає здатним взаємодіяти з вільними карбоксильними групами в поліпептиді IFN-α, наприклад з вільною карбоксильною групою на С-кінці поліпептиду IFN-α. Відповідні деривати ПЕГ, здатні взаємодіяти з вільною карбоксильною групою на С-кінці IFN-α, включають, але не обмежуються цим, пегільований амін і гідразинові деривати. ПЕГ (наприклад, PEG-NH-NH 2). В інших варіантах ПЕГ хімічно модифікують таким чином, що він включає кінцеву гр уп у тіокарбонової кислоти, -COSH, яка вибірково взаємодіє з аміногрупами і утворює деривати аміду. Завдяки реакційноздатному характеру тіокислоти досягаються вибірковість певних аміногруп серед інших. Наприклад, -SH виявляє достатню здатність виходити з групи при взаємодії з N-кінцевою аміногрупою при відповідних рН-умовах, так що εаміногрупи в лізинових залишках протонуються і залишаються ненуклеофільними. З іншого боку, взаємодії у певних рН-умовах можуть змусити деякі з піддатливих лізинових залишків взаємодіяти вибірково. В інших варіантах винаходу ПЕГ включає реакційноздатний складний ефір, наприклад Nгідроксисукцинімідат, на кінці ланцюга ПЕГ. Така молекула ПЕГ, що містить N-гідроксисукцинімідат, вибірково взаємодіє з аміногрупами в конкретних рН-умовах, наприклад при нейтральному рівні рН6,5-7,5. Наприклад, N-кінцеві аміногрупи можна вибірково модифікувати в умовах нейтрального рН. Однак, якби реакційна здатність цього реагента була надмірною, піддатливі групи -NH2 лізину також могли б прореагувати. ПЕГ можна кон'югувати безпосередньо з поліпептидом IFN-α або через лінкер. В деяких варіантах лінкер додають до поліпептиду IFN-α, утворюючи поліпептид лінкер-модифікованого IFN-α. Такі лінкери забезпечують різні функціональні залежності, наприклад різні реакційноздатні групи, такі як сульгідрильні, аміно- або карбоксильні групи для зв'язування ПЕГ-реагента з поліпептидом лінкер-модифікованого IFN-α. В деяких варіантах ПЕГ, кон'югований з поліпептидом IFN-α, є лінійним. В інших варіантах ПЕГ, кон'югований з поліпептидом IFN-α, є розгалуженим. Деривати розгалуженого ПЕГ, як ті, що описані [у пат. США №5643575], "зірчасті поліетиленгліколі" та багатоплечові поліетиленгліколі, описані, наприклад, [в каталозі "Polyethylene Glycol Derivatives 1997-1998"] ф."Shearwater Polymers, Inc.". "Зірчасті ПЕГ" відомі в галузі і описані, наприклад, [у пат. США №6046305]. Як правило застосовують ПЕГ з молекулярною масою в межах приблизно 2-100 кілодальтонів (kDa), де термін "приблизно" щодо ПЕГ означає, що в препаратах поліетиленгліколю деякі молекули матимуть більшу молекулярну масу, деякі меншу, ніж зазначена молекулярна маса. Наприклад, ПЕГ, що підходить для кон'югації з IFN-α, має молекулярну масу приблизно 2-5kDa, 510kDa, 10-15kDa, 15-20kDa, 20-25kDa, 25-30kDa, 30-40kDa, 40-50kDa, 50-60kDa, 60-70kDa, 7080kDa, 80-90kDa, 90-100kDa. 39 84579 Отримання кон'югатів ПЕГ- IFN-α Як вже говорилося, ПЕГ-компонент можна приєднувати, безпосередньо або за допомогою лінкера, до амінокислотного залишку на N-кінці чи біля нього, всередині або на С-кінці поліпептиду IFN-α чи біля нього. Кон'югацію можна здійснювати в розчині або у твердій фазі. N-кінцевий зв'язок Способи приєднання ПЕГ-компонента до амінокислотного залишку на N-кінці поліпептиду IFN-α або біля нього відомі. [Див., наприклад, пат. США №5985265]. В деяких варіантах застосовують відомі способи селективного отримання хімічно модифікованого на N-кінці інтерферону-альфа. Наприклад, можна застосувати спосіб модифікації білка відновним алкілуванням, при якому використовують різні реакційні можливості різних типів первинних аміногруп (лізин проти N-кінця), придатних для деривації, в конкретному білку. У відповідних реакційних умовах досягають, головним чином, вибіркової деривації білка на N-кінці за допомогою полімеру, що містить карбонільну групу. Реакцію проводять при рН, який дає можливість скористатися різницями між рКа α-аміногруп лізиного залишку і рКа α-аміногрупи N-кінцевого залишку білка. Шляхом такої вибіркової деривації прикріплення ПЕГ-компонента до IFN-α контролюють: кон'югація із згаданим полімером відбувається здебільшого на N-кінці IFN-α, і не відбувається значної модифікації інших реакційноздатних груп, наприклад лізинових бічноланцюгових аміногруп. С-кінцевий зв 'язок В результаті процедур N-кінець-специфічного зв'язування, описаних, наприклад, [у пат. США №5985265], отримують здебільшого монопегільовані продукти. Однак процедури очищення, направлені на видалення надлишкових реагентів і числених побічних пегільованих продуктів, видаляють поліпептиди, блоковані на N-кінці. З точки зору економічності терапії такі способи призводять до значного збільшення виробничих витрат. Наприклад, дослідження структури амінокислотної послідовності поліпептиду CINF широко описаного Infergen® alfacon-1 виявляє, що кліпування становить приблизно 5% на карбоксильному кінці і, отже, є тільки одна головна С-кінцева послідовність. Таким чином, в деяких варіантах не використовують пегільований на N-кінці IFN-α, натомість поліпептид IFN-α пегілюють на С-кінці. Отже, ефективним синтетичним, а також терапевтичним способом отримання монопегільованого продукту Infergen вважають такий. ПЕГ-реагент, що є вибірковим для С-кінця, можна отримувати зі спейсерами або без них. Як вихідний матеріал можна використати, наприклад, поліетиленгліколь, модифікований у простий метиловий ефір на одному кінці і який має амінофункцію на іншому кінці. Як конденсуючий агент можна застосувати водорозчинний карбодіімід. Щоб утворити амідний зв'язок, приєднання IFN-α (Infergen® alfacon-1 CINF, або конденсусного інтерферону) до водорозчинного карбідііміду як конденсуючого агента, як правило, здійснюють у водному середовищі з 40 відповідною буферною системою при оптимальному рН. Для збільшення молекулярної маси в білок можна ковалентно додати ПЕГ з високою молекулярною масою. Вибір реагентів залежатиме від методів оптимізації процесінгу. Необмежуючим прикладом відповідного реагента є EDAC, або 1-етил-3-(3диметиламінопропіл)карбодіімід. Водорозчинність EDAC дає можливість безпосередньо вводити в реакцію органічний розчинник без необхідності попереднього розчинення. Надлишковий реагент та ізосечовина, що утворилася як побічний продукт реакції перехресного зшивання, обидва є водорозчинними і їх можна легко видалити діалізом або гель-фільтрацією. Для полегшення введення в реакцію маломолярної кількості готують концентрований розчин EDAC у воді. Основний розчин готують і використовують одразу з огляду на водонестійкий характер реагента. У більшості описаних в літературі протоколів по синтезу рекомендований для оптимального реакційного середовища рН=4,7-6,0. Однак реакції конденсації протікають без значних втрат на виході при рН=7,5. Воду можна використовувати як розчинник. У випадку застосування Infergen кращим середовищем буде буфер 2-(N-морфоліно)етансульфокислоти, попередньо титрований до рН4,7-6,0. Однак з огляду на те, що згаданий продукт знаходиться в тому самому буфері, можна також додати 0,1M фосфату з рН7-7,5. Співвідношення ПЕГ-аміну і молекули IFN-α оптимізують таким чином, що C-кінцевий карбоксильний (карбоксильні) залишок (залишки) пегілюються вибірково і дає (дають) в результаті монопегільований (монопегільовані) дериват (деривати). Навіть якщо при описі використання ПЕГ-амін згадувався ви ще за назвою або структурою, мається на увазі, що ці деривати є лише прикладами і можна використовувати інші гр упи, наприклад деривати гідразину, як в PEG-NH-NH 2, які також будуть конденсуватися з карбоксильною групою білка IFN-α. Крім водної фази згадані реакції можна також проводити на твердій фазі. Поліетиленгліколь можна вибрати зі списку сполук з молекулярною масою 300-40000. Вибір різних поліетиленгліколів буде диктуватися ефективностю зв'язування та біологічними характеристиками очищеного деривату in vitro та in vivo, тобто швидкістю кровотоку, антивірусною активністю тощо. Крім того, до С-кінця білка можна додавати відповідні спейсери. Для зв'язування з відповідним ПЕГ-реагентом і отримання дериватів IFN-α з високою молекулярною масою спейсерами можуть бути реакційноздатні групи, наприклад SH2, NH2 або COOH. Для синтезування пегільованих на Скінці інтерферонів може бути запропонований метод комбінованих фаз тверда фаза/розчин. Наприклад, С-кінець IFN-α подовжують на твердій фазі за допомогою спейсера Gly-Gl y-Cys-NH 2, а потім монопегілюють у розчині за допомогою активованого дитіопіридину-ПЕГ-реагента відповідної молекулярної маси. Оскільки з'єднання на С-кінці залежить від блокування на N-кінці, передбачувані способи і продукти будуть вигідними з точки зору вартості (третій білок не витрачається дарма, як в 41 84579 способах пегілювання на N-кінці) і вносить свій вклад в здешевлення лікування вірусної інфекції. Крім групи -COOH на С-кінці IFN-α десь в молекулі може існувати більш реакційноздатна група амінокислотних залишків для взаємодії з ПЕГреагентом і досягнення монопегілювання на сайті або досягнення багатьох актів монопегілювання. Вважають, що ці реакції будуть, у кращому випадку, мінімальними завдяки стеричній свободі молекули на C-кінці і стеричній перешкоді, створюваній карбодіімідами і ПЕГ-реагентами, наприклад, в молекулах з розгалуженим ланцюгом. Тому, кращим способом модифікації за допомогою поліетиленгліколю для Infergen і аналогічних йому білків, нативних або експресованих в системі-хазяїні, які можуть блокувати N-кінці до різних ступенів, є поліпшення ефективності і підтримання вищої in vi vo біологічної активності. Інший спосіб пегілювання на С-кінці такий. Дискримінації С-кінцевого пегілювання досягають за допомогою стерично блокованого реагента, який виключає реакції на карбоксильних залишках, схованих або у спіралі, або всередині IFN-α. Наприклад, один такий реагент повинен бути ПЕГ з розгалуженим ланцюгом і молекулярною масою ≈40kD, тоді такий реагент можна синтезувати наступним чином: OH3C(CH2CH2O)n-CH2CH2NH2+ глутамінова кислота, тобто HOCO-CH2CH2CH(NH2)-COOH конденсують за допомогою відповідного реагента, наприклад дициклогексилкарбодііміду або водорозчинного EDAC для отримання ПЕГ-реагента OH3C(CH2CH2O)n-CH2CH2NHCOCH(NH2)CH2OCH3(CH2CH2O)n CH2CH2NHCOCH2 з розгалуженим ланцюгом. Цей реагент можна використовувати з надлишком, щоб з'єднати аміногрупу з вільною і гнучкою карбоксильною групою інтерферону-a і утворити пептидний зв'язок. При необхідності пегільований IFN-α відокремлюють від непегільованого IFN-α будь-яким відомим способом, в тому числі (але не тільки) іонообмінною хроматографією, ексклюзійною хроматографією або обома разом. Наприклад, якщо кон'югат ПЕГ- IFN-α включає монопегільований IFN-α, продукти спочатку відокремлюють шляхом іонообмінної хроматографії для отримання матеріалу, що має зарядну характеристику монопегільованого матеріалу (можу бути присутній інший мультипегільований матеріал з явним таким 42 самим зарядом), а потім ці монопегільовані матеріали відокремлюють шляхом ексклюзійної хроматографії. IFN-β Термін «інтерферон-бета, або (3-інтерферон (IFN-β) включає поліпептиди IFN-β, природні або неприродні, і аналоги природних або неприродних IFN-β, які зберігають антивірусну активність батьківського природного або неприродного IFN-β. Будь-який з цілого ряду β-інтерферонів можна синтезувати безперервним методом, запропонованим даним винаходом. Відповідні р-інтерферони включають (але не обмежуються цим) природний IFN-β; IFN-β1a, наприклад Avonex® (ф. "Biogen, Inc.") і Rebif® (ф. "Serono", SA); IFN-β1b (Betaseron®, ф."Berlex") і т.п. Склад IFN-β може включати N-блоковані види, де N-кінцеву амінокислоту ациловано за допомогою ацилової групи, наприклад формілової, ацетилової, малонілової групи і т.п.Придатним для застосування також є консенсусний IFN-β. Поліпептиди IFN-β можна отримувати будьяким відомим способом. Стандартним способом можна синтезувати послідовності ДНК, що кодують IFN-β. B багатьох варіантах винаходу поліпептиди IFN-β є продуктами експресії синтезованих послідовностей ДНК, трансформованих або трансфектованих в бактеріальних хазяях, наприклад Е.соlі, або в еукаріотних клітинах-хазяях (наприклад, дріжджах; клітинах ссавців, наприклад клітинах CHO, тощо). В цих варіантах IFN-β є «рекомбінантним IFN-β». Якщо клітина-хазяїн є бактеріальною, IFNβ модифікують таким чином, щоб він включав Nкінцевий метонін. Слід розуміти, що описаний тут IFN-β може включати один або більше модифікованих амінокислотних залишків, наприклад отриманих глікозилуванням, хімічними модифікаціями тощо. IFN-t Термін «інтерферон-тау, або t-інтерферон» (IFN-t) включає поліпептиди IFN-t, природні або неприродні, та аналоги природних або неприродних IFN-t, які зберігають антивірусну активність батьківського природного або неприродного IFN-t. Відповідні t-інтерферони включають (але не обмежуються цим) природний IFN-t; Tauferon® (ф. "Pepgen Corp.") і т.п. IFN-t може включати амінокислотну послідовність, наприклад будь-яку із запропонованих банком генів під інвентарними номерами: P15696; Р56828; Р56832; Р56829; Р56831; Q29429; Q28595; Q28594; S08072; Q08071; Q08070;Q08053; Р56830; Р28169; Р28172 і Р28171. Для досягнення намічених змін в послідовності можна різними відомими способами змінювати послідовність поліпептиду будь-якого відомого IFN-t. Варіантний поліпептид буде, як правило, головним чином аналогічним запропонованим послідовностям, тобто буде відрізнятися принаймні однією амінокислотою, а, можливо, принаймні двома, але не більше ніж десятьма амінокислотами. Ці зміни послідовності можуть бути у вигляді заміщення, вставки або делеції. Консервативні заміщення амінокислот, як правило, включають заміни в межах таких груп: (гліцин, аланін); (валін, ізолейцин, 43 84579 лейцин); (аспарагінова кислота, глутамінова кислота); (аспарагін, глутамін); (серин, треонін); (лізин, аргінін) або (фенілаланін, тирозин). Модифікації, що становлять інтерес, які можуть або не можуть змінювати первинну амінокислотну послідовність, включають: хімічну деривацію поліпептидів, наприклад ацетилування або карбоксилування; зміни в амінокислотній послідовності, що вводять або видаляють сайт глікозилування; зміни в амінокислотній послідовності, що роблять білок сприйнятливим до пегілювання, і т.п.Також входять в цей перелік модифікації глікозилування, наприклад створені в результаті модифікування характеру глікозилування поліпептиду під час його синтезу і процесінгу або на етапах подальшого процесінгу, наприклад під час підцання поліпептиду дії ферментів, які впливають на глікозилування, наприклад глікозилуючих або деглікозилуючих ферментів ссавців; Також включені послідовності, що містять фосфориловані амінокислотні залишки, наприклад фосфотирозин, фосфосерин або фосфотреонін. До складу IFN-t можуть входити N-блоковані види, де N-кінцеву амінокислоту ациловано за допомогою ацилової групи, наприклад формілової, ацетилової, малонілової групи і т.п.Придатним для застосування також є консенсусний IFN-t. Поліпептиди IFN-t можна отримувати будьяким відомим способом. Стандартним способом можна синтезувати послідовності ДНК, що кодують IFN-t. В багатьох варіантах винаходу поліпептиди IFN-t є проуктами експресії синтезованих послідовностей ДНК, трансформованих або трансфектованих в бактеріальних хазяях, наприклад Е.соlі, або в еукаріотних клітинах-хазяях (наприклад, дріжджах; клітинах ссавців, наприклад клітинах CHO, тощо). В цих варіантах IFN-t є «рекомбінантним IFN-t». Якщо клітина-хазяїн є бактеріальною, IFN-т модифікують таким чином, щоб він включав Nкінцевий метонін. Слід розуміти, що описаний тут IFN-t може включати один або більше модифікованих амінокислотних залишків, наприклад отриманих глікозилуванням, хімічними модифікаціями тощо. IFN-w Термін «інтерферон-омега, або w-інтерферон» (IFN-w) включає поліпептиди IFN-w, природні або неприродні, та аналоги природних або неприродних IFN-w, які зберігають антивірусну активність батьківського природного або неприродного IFN-w. Будь-який відомий w-інтерферон можна синтезувати методом безперервного синтезування, запропонованим даним винаходом. Відповідні IFN-w велючають (але не обмежуються цим) природний IFN-w; рекомбінантний IFN-w, наприклад Biomed 510 (ф. "Bio Medicines") тощо. IFN-w може включати амінокислотну послідовність, наприклад запропоновану банком генів під інвентарним номером NP_002168 або ААА70091. Для досягнення намічених змін в послідовності можна різними відомими способами змінювати послідовність поліпептиду будь-якого відомого IFN-w. Варіантний поліпептид буде, як правило, головним чином аналогічним запропонованим по 44 слідовностям, тобто буде відрізнятися принаймні однією амінокислотою, а, можливо, принаймні двома, але не більше ніж десятьма амінокислотами. Ці зміни послідовності можуть бути у вигляді заміщення, вставки або делеції. Консервативні заміщення амінокислот, як правило, включають заміни в межах таких гр уп: (гліцин, аланін); (валін, ізолейцин, лейцин); (аспарагінова кислота, глутамінова кислота); (аспарагін, глутамін); (серин, треонін); (лізин, аргінін) або (фенілаланін, тирозин). Модифікації, що становлять інтерес, які можуть або не можуть змінювати первинну амінокислотну послідовність, включають: хімічну деривацію поліпептидів, наприклад ацетилування або карбоксилування; зміни в амінокислотній послідовності, що вводять або видаляють сайт глікозилування; зміни в амінокислотній послідовності, що роблять білок сприйнятливим до пегілювання, і т.п.Також входять в цей перелік модифікації глікозилування, наприклад створені в результаті модифікування характеру глікозилування поліпептиду під час його синтезу і процесінгу або на етапах подальшого процесінгу, наприклад під час піддання поліпептиду дії ферментів, які впливають на глікозилування, наприклад глікозилуючих або деглікозилуючих ферментів ссавців. Також включені послідовності, що містять фосфориловані амінокислотні залишки, наприклад фосфотирозин, фосфосерин або фосфотреонін. До складу IFN-w можуть входити N-блоковані види, де N-кінцеву амінокислоту ациловано за допомогою ацилової групи, наприклад формілової, ацетилової, малонілової групи і т.п.Придатним для застосування також є консенсусний IFN-w. Поліпептиди IFN-w можна отримувати будьяким відомим способом. Стандартним способом можна синтезувати послідовності ДНК, що кодують IFN-w. B багатьох варіантах винаходу поліпептиди IFN-w є проуктами експресії синтезованих послідовностей ДНК, трансформованих або трансфектованих в бактеріальних хазяях, наприклад Е.соlі, або в еукаріотних клітинах-хазяях (наприклад, дріжджах; клітинах ссавців, наприклад клітинах CHO, тощо). В цих варіантах IFN-w є «рекомбінантним IFN-w». Якщо клітина-хазяїн є бактеріальною, IFNw модифікують таким чином, щоб він включав Nкінцевий метонін. Слід розуміти, що описаний тут IFN-w може включати один або більше модифікованих амінокислотних залишків, наприклад отриманих глікозилуванням, хімічними модифікаціями тощо. Агоністи рецепторів інтерферону типу III В будь-якому з вищеописаних способів агоніст рецептора інтерферону є в деяких варіантах агоністом рецептора інтерферону типу III. Агоністи інтерферону типу III включають поліпептид IL-28b, поліпептид IL-28a і поліпептид IL-29; антитіло, специфічне до рецептора інтерферону тип у III, і будь-який інший агоніст рецептора інтерферону типу III, в тому числі неполіпептидні агоністи. IL-28A, IL-28B та IL-29 (що мають колективну назву "інтерферони типу III", IFN типу III) описані в роботі [Sheppart et al. (2003) Nature 4: 63-68]. Кожний поліпептид зв'язує гетеродимерний рецептор, що складається з ланцюга рецептора-β IL-10 і ре 45 84579 цептора-р IL-28. [Sheppard et al. (2003), supra]. Амінокислотні послідовності IL-28A, IL-28B та IL-29 можна знайти в банку генів під інвентарними номерами NP_742150, NP_742151 і NP_742152, відповідно. Для досягнення намічених змін в послідовності амінокислотну послідовність поліпептиду IFN типу III можна змінювати різними відомими способами. Варіантний поліпептид буде, як правило, головним чином аналогічним запропонованим послідовностям, тобто буде відрізнятися принаймні однією амінокислотою, а, можливо, принаймні двома, але не більше ніж десятьма амінокислотами. Ці зміни послідовності можуть бути у вигляді заміщення, вставки або делеції. Для визначення ключових амінокислот можна застосовувати сканування мутацій, які систематично вводять аланін або інші залишки. Заміщення, що становлять інтерес, конкретних амінокислот включають консервативні і неконсервативні зміни. Консервативні заміщення амінокислот, як правило, включають заміни в межах (гліцин, аланін); (валін, ізолейцин, лейцин); (аспарагінова кислота, глутамінова кислота); (аспарагін, глутамін); (серин, треонін); (лізин, аргінін) або (фенілаланін, тирозин). Модифікації, що становлять інтерес, які можуть або не можуть змінювати первинну амінокислотну послідовність, включають: хімічну деривацію поліпептидів, наприклад ацетилування або карбоксилування; зміни в амінокислотній послідовності, що вводять або видаляють сайт глікозилування; зміни в амінокислотній послідовності, що роблять білок сприйнятливим до пегілювання, і т.п.Також входять в цей перелік модифікації глікозилування, наприклад створені в результаті модифікування характеру глікозилування поліпептиду під час його синтезу і процесінгу або на етапах подальшого процесінгу, наприклад під час піддання поліпептиду дії ферментів, які впливають на глікозилування, наприклад глікозилуючих або деглікозилуючих ферментів ссавців. Також включені послідовності, що містять фосфориловані амінокислотні залишки, наприклад фосфотирозин, фосфосерин або фосфотреонін. В об'єм винаходу входять поліпептиди, модифіковані звичайними хімічними методами, щоб підвищити їхню стійкість до протеолітичного розщеплення, оптимізувати розчинність або зробити їх більш відповідними статусу терапевтичного засобу. Наприклад, остов пептиду можна циклізувати для підвищення стабільності [див., наприклад, Friedler et аl. (2000) J. Biol. Chem. 275: 2378323789]. Можна використовувати аналоги, що включають залишки, відмінні від природних Lамінокислот, наприклад D-амінокислот, або синтетичні амінокислоти. Для підвищення стабільності білок'можна пегілювати. Поліпептиди можна зливати з альбуміном. Поліпептиди можна синтезувати in vitro відомими способами, рекомбінантними способами або можна виділяти з клітин, індукованих або природно продукуючих білок. Конкретна послідовність і спосіб її отримання будуть обумовлюватись зручністю, економічністю, необхідною чистотою тощо. При необхідності під час синтезу або експресії в 46 поліпептид можна вводити різні групи, що дають можливість зв'язуватися з іншими молекулами або з поверхнею. Так, цистеїни можна використовувати для отримання тіоефірів, гістидинів - для з'єднання з іонним комплексом металу, карбоксильні групи - для утворення амідів або складних ефірів, аміногрупи - для утворення амідів і т.д. Агоністи рецепторів інтерферону типу II Агоністи рецепторів інтерферону типу II включають будь-який природний або неприродний ліганд рецептора інтерферону типу II людини, який з'єднується з рецептором і викликає сигнальну трансдукцію через цей рецептор. Агоністи рецепторів інтерферону типу II включають інтерферони, в тому числі природні, модифіковані, синтетичні, пегільовані інтерферони, гібридні білки, що містять інтерферон і гетерологічний білок, зчеплені інтерферони, антитіло, специфічне до рецептора інтерферону; непептидні хімічні агоністи тощо. Конкретним прикладом агоніста рецептора інтерферону типу II є INF-g та його варіанти. Хоча як приклад в даному винаході описується використання поліпептиду INF-g, зрозуміло, що в запропонованому способі можна використовувати будьякий агоніст рецептора інтерферону типу II. Інтерферон-гамма (INF-g) Послідовності нуклеїнової кислоти, які кодують поліпептиди INF-g, можна знайти в суспільних базах даних, наприклад в банку генів, журнальних публікаціях тощо. Хоча інтерес становлять поліпептиди INF-g різних ссавців, для лікування людської хвороби, як правило, буде застосовуватися білок людини. Послідовність, що кодує INF-g людини, можна знайти в банку генів під інвентарними номерами: X13274, V00543 і NM_000619. Відповідну геномну послідовність можна знайти в банку генів під інвентарними номерами: J00219, М37265 і V00536. [Див., наприклад, Gray et al. (1982) Nature 295: 501 (Genbank X13274) and Rinderknecht et al. (1984) J.B.C. 259: 6790-6797]. INF-g Ib (Actimmune®, інтерферон людини) являє собою одноланцюговий поліпептид з 140 амінокислот. Його створено рекомбінантно в Е.соlі і деглікозиловано. [Rinderknecht et al. (1984) J.B.C. 259: 6790-6797]. Для застосування в цьому винаході також підходить рекомбінантний INF-g, описаний у [пат. США №6497871]. Інтерфероном-гамма (INF-g), використаним в запропонованих способах, може бути будь-який з природних g-інтерферонів, рекомбінантних gінтерферонів та їх дериватів, оскільки вони мають активність INF-g, зокрема INF-g людини. Людський INF-g виявляє антивірусні та антипроліферативні властивості, характерні для інтерферонів, а також ряд інших імуномодуляторних активностей, і є відомим в галузі. Хоча INF-g базується на послідовностях, зазначених ви ще, продукування білка і протеолітичний процесінг можуть дати в результаті обробку його варіантів. Необроблена послідовність, описана [Gray et al., supra], складається з 166 амінокислот. Хоча спочатку вважали, що рекомбінантний INF-g, продукований в Е.соlі, має 146 амінокислот (починаючи з амінокислоти 20), у подальшому виявили, що нативний людський INF-g є 47 84579 розщепленим після залишку 23 і утворює білок з 143 або 144 амінокислот, якщо є кінцевий метіонін, як це потрібно для експресії в бактеріях. Під час очищення зрілий білок може додатково розщеплюватися на С-кінці після залишку 162 (це стосується послідовності, описаної Gray et al), в результаті чого утворюється білок з 139 або 140 амінокислот, якщо є початковий метіонін, наприклад, якщо це потрібно для бактеріальної експресії. N-кінцевий метіонін є артефактом, кодованим трансляційним "стартовим" сигнальним AUG мРНК, який в конкретному випадку експресії в Е.соlі, не піддається хімічній переробці. В інших мікробних системах або еукаріотних експресійних системах метіонін можна видаляти. В запропонованих способах можна застосовувати будь-який з нативних пептидів INF-g, його модифікації та варіанти або комбінацію одного або більше пептидів. Пептиди INF-g, що становлять інтерес, включають фрагменти і можуть бути порізному скороченими на карбоксильному кінці відносно повної послідовності. Ці фрагменти продовжують виявляти характерні властивості людського у-інтерферону, поки присутні амінокислоти 24-149 (нумерація від залишків необробленого поліпептиду). Амінокислотну послідовність, що йде після амінокислоти 155, можна замінити маргінальними послідовностями без втрати активності. [Див., наприклад, пат. США №5690925]. Компоненти нативного INF-g включають молекули, що по-різному відходять від амінокислотних залишків 24-150, 24151, 24-152, 24-153, 24-155 і 24-157. Будь-який з цих варіантів та інші відомі варіанти, що мають активність INF-g, можуть бути застосовані в запропонованих способах. Для досягнення в послідовності намічених змін послідовність INF-y можна змінювати різними відомими способами. Варіантний поліпептид буде, як правило, головним чином аналогічним запропонованим послідовностям, тобто буде відрізнятися принаймні однією амінокислотою, а, можливо, принаймні двома, але не більше ніж десятьма амінокислотами. Ці зміни послідовності можуть бути у вигляді заміщення, вставки або делеції. Для визначення ключових амінокислот можна застосовувати сканування мутацій, які систематично вводять аланін або інші залишки. Заміщення, що становлять інтерес, конкретних амінокислот включають консервативні і неконсервативні зміни. Консервативні заміщення амінокислот, як правило, включають заміни в межах (гліцин, аланін); (валін, ізолейцин, лейцин); (аспарагінова кислота, глутамінова кислота); (аспарагін, глутамін); (серин, треонін); (лізин, аргінін) або (фенілаланін, тирозин). Модифікації, що становлять інтерес, які можуть або не можуть змінювати первинну амінокислотну послідовність, включають хімічну деривацію поліпептидів, наприклад ацетилування або карбоксилування; зміни в амінокислотній послідовності, що вводять або видаляють сайт глікозилування; зміни в амінокислотній послідовності, що роблять білок сприйнятливим до петлювання, і т.п.В одному варіанті винаходу розглядається використання варіантів INF-g з одним або більше неприродних сайтів глікозилування та/або пегілювання, створе 48 них для отримання поліпептидів, генерованих глікозилуванням та/або пегілюванням, із зменшеним сироватковим кліренсом, наприклад варіантів поліпептиду INF-g, описаних [в міжнародній патентній заявці №WO 01/36001]. Включені також модифікації глікозилування, наприклад створені в результаті модифікування характеру глікозилування поліпептиду під час його синтезу або процесінгу, або на етапах подальшого процесінгу, наприклад піддаючи поліпептиди дії ферментів, які впливають на глікозилування, наприклад глікозилуючі або деглікозилуючі ферменти ссавців. Також включені послідовності, що мають фосфориловані амінокислотні залишки, наприклад фосфотирозин, фосфосерин або фосфотреонін. В об'єм винаходу входять поліпептиди, модифіковані звичайними хімічними методами, щоб підвищити їхню стійкість до протеолітичного розщеплення, оптимізувати розчинність або зробити їх більш відповідними статусу терапевтичного засобу. Наприклад, остов пептиду можна циклізувати для підвищення стабільності [див., наприклад, Friedler et аl. (2000) J. Biol. Chem. 275: 2378323789]. Можна використовувати аналоги, що включають залишки, відмінні від природних Lамінокислот, наприклад D-амінокислоти, або синтетичні амінокислоти. Для підвищення стабільності білок можна пегілювати. Поліпептиди можна зливати з альбуміном. Поліпептиди можна синтезувати in vitro відомими способами, рекомбінантними способами або можна виділяти з клітин, індукованих або природно продукуючих білок. Конкретна послідовність і спосіб її отримання будуть обумовлюватись зручністю, економічністю, необхідною чистотою тощо. При необхідності під час синтезу або експресії в поліпептид можна вводити різні групи, що дають можливість зв'язуватися з іншими молекулами або з поверхнею. Так, цистеїни можна використовувати для отримання тіоефірів, гістидинів - для з'єднання з іонним комплексом металу, карбоксильні групи - для утворення амідів або складних ефірів, аміногрупи - для утворення амідів і т.д. Поліпептиди можна також виділяти і очищати традиційними методами рекомбінантного синтезу. З хазяїна експресії можна готува ти лізат, і цей лізат можна очищати за допомогою високоефективної рідинної хроматографії, ексклюзійної хроматографії, гель-електрофорезу, афінної хроматографії та іншими методами очищення. Здебільшого, застосовані композиції будуть містити принаймні 20мас.% заданого продукту, частіше - принаймні 75мас.%, у кращому випадку - принаймні 95мас.%, а для терапевтичних цілей - принаймні 99,5мас.%, відносно мінорних компонентів, пов'язаних з методом приготування продукту та його очищення. Ці процентні вмісти, як правило, наведені на основі загального білка. Пірфенідон і його аналоги Описуються пірфенідон (5-метил-1-феніл-2(1Н)-піридон) і конкретні аналоги пірфенідону для лікування фібротичних станів. Термін «фібротичний стан» - це стан, що підлягає лікуванню шляхом уведення сполуки з антифібротичною активністю. 49 84579 Опис заміщувачів R1, R2 , X R1:карбоциклічні компоненти (насичені або ненасичені), гетероциклічні компоненти (насичені або ненасичені), алкіли (насичені або ненасичені). Приклади включають феніл, бензил, піримідил, нафтил, індоліл, піроліл, фурил, тієніл, імідазоліл, циклогексил, піперидил, піролідил, морфолініл, циклогексеніл, бутадієніл тощо. R1 може крім того включати заміщення в зга 50 даних карбоциклічних або гетероциклічних компонентах заміщувачами, такими як галоген, нітро, аміно, гідроксил, алкокси, карбоксил, ціано, тіо, алкіл, арил, гетероалкіл, гетероарил та їх комбінації, наприклад 4-нітрофеніл, 3-хлорофеніл, 2,5динітрофеніл, 4-метоксифеніл, 5-метил-піроліл, 2,5-дихлороциклогексил, гуанідиніл-циклогексеніл тощо. R2: алкіл, карбоциклічні компоненти, арил, гетероциклічні компоненти. Приклади включають метил, етил, пропіл, ізопропіл, феніл, 4нітрофеніл, тієніл тощо. X: може представляти будь-яке число (від 1 до 3) заміщувачів у карбоциклічному або гетероциклічному кільці. Заміщувачі можуть бути такими самими або іншими. Вони можуть включати водень, алкіл, гетероалкіл, арил, гетероарил, галоген, нітро, карбоксил, гідроксил, ціано, фьштщ, тіо, алкіламіно, галоарил тощо. Заміщувані можуть бути крім того необов'язково заміщені 1-3 заміщувачами, вибраними з групи, що складається з груп алкілу, арилу, нітро, алкокси, гідроксилу або галогену. Приклади включають: метил, 2,3-диметил, феніл, р-толіл, 4-хлорофеніл, 4-нітрофеніл, 2,5-дихлорофеніл, фурил, тієніл тощо. Конкретні приклади включають сполуки, перелічені в таблиці 1. Таблиця 1 IA 5-метил-1-(2'-піридил)-2-(1Н)піридин 6-метил-1-феніл-2-(1Н)піридон 5-метил-3-феніл-1-(2'-тієніл)-2-(1Н)піридон 5-метил-1-(2'-нафтил)-2-(1Н)піридон 5-метил-1-р-толіл-2-(1Н)піридон 5-метил-1-(1'-нафтил)-2-(1Н)піридон 5-етил-1-феніл-2-(1Н)піридон 5-метил-1-(5'-хіноліл)-2-(1Н)піридон 5-метил-1-(4'-хіноліл)-2-(1Н)піридон 5-метил-1-(4'-піридил)-2-(1Н)піридон 3-метил-1-феніл-2-(1H) піридон 5-метил-1-(4'-метоксифеніл)-2-(1Н)піридон 1-феніл-2-(1Н)піридон 1,3-дифеніл-2-(1Н)піридон 1,3-дифеніл-5-метил-2-(1Н)піридон 5-метил-1-(3'-трифторометилфеніл)-2-(1Н)піридон 3-етил-1-феніл-2-(1H) піридон 5-метил-1-(3'-піридил)-2-(1Н)піридон 5-метил-1-(3-ніт рофеніл)-2-(1Н)піридон 3-(4'-хлорофеніл)-5-метил-1-феніл-2-(1Н)піридон 5-метил-1-(2'-тієніл)-2-(1Н)піридон 5-метил-1-(2'-тіазоліл)-2-(1Н)піридон 3,6-диметил-1-феніл-2-(1Н)піридон 1-(4'-хлорофеніл)-5-метил-2-(1Н)піридон 1-(2'-ім ідазоліл)-5-метил-2-(1Н)піридон 1-(4'-нітрофеніл)-2-(1Н)піридон 1-(2'-фурил)-5-метил-2-(1Н)піридон 1-феніл-3-(4'-хлорофеніл)-2-(1Н)піридин У [патентах США №№3974281, 3839346, 4042699, 4052509, 5310562, 5518729, 5716632 і 6090822] описані способи синтезу і приготування пірфенідону і конкретних аналогів пірфенідону у фармацевтичних композиціях, придатних для за ІІВ 6-метил-і-феніл-3-(1Н)піридон 5-метил-1-р-толіл-3-(1Н)піридон 5-метил-1-(2'-нафтил)-3-(1Н)піридон 5-метил-1-феніл-3-(1Н)піридон 5-метил-1-(5'-хіноліл)-3-(1Н)піридон 5-етил-1-феніл-3-(1Н)піридон 5-метил-1-(4'-метоксифеніл)-3-(1Н)піридон 4-метил-1-феніл-3-(1Н)піридон 5-метил-1-(3'-піридил)-3-(1Н)піридон 5-метил-1-(2'-тієніл)-3-(1Н)піридон 5-метил-1-(2'-піридил)-3-(1Н)піридон 5-метил-1-(2'-хіноліл)-3-(1Н)піридон 1-феніл-3-(1Н)піридин 1-(2'-фурил)-5-метил-3-(1Н)піридон 1-(4'-хлорофеніл)-5-метил-3-(1Н)піридин стосування в запропонованих способах. Тимозин-α Тимозин-α (Zadaxin™, ф."SciСlone Pharmaceuticals, Inc.", San Mateo, CA) є синтетичною формою тимозину-альфа-1, природному гор 51 84579 мону, знайденому в кровотоку, який виробляється тимусом. Тимозин-α підвищує активність Т-клітин і NK-клітин. Zadaxin™, приготований для підшкірного вливання, є очищеним, стерильним ліофілізованим препаратом хімічно синтезованого тимозину-альфа-1, ідентичного людському тимозинуальфа-1. Тимозин-aльфа-1 являє собою ацетилований поліпептид з наступною послідовністю: Ac Ser - Asp - Ala - Ala - VaI - Asp - Thr - Ser - Ser - GIu - He - Thr - Thr -Lys - Asp - Leu - Lys - GIu - L ys - Lys - GIu - VaI - VaI - GIu - GIu - Ala - GIu - Asn - OH і з молекулярною масою 3108 дільтонів. Ліофілізований препарат містить 1,6мг синтетичного тимозину-α, 50мг манітолу і буфер з фосфа ту натрію для регулювання рН до 6,8. Рибавірин Рибавірин, 1-β-D-рибофуранозил-1Н-1,2,4тріазол-3-карбоксамід, є нуклеозидним аналогом, що його випускає ф."ICN Pharmaceuticals, Inc." (Costa Mesa, Calif.), описаним в "Merck Index", сполука №8199, 11th Edition. Його приготування і склад описані у [пат. США №4211771]. Даний винахід також передбачає використання дериватів рибавірину [див., наприклад, пат. США №6277830]. Рибавірин можна вводити перорально у формі капсули або таблетки. Звичайно, передбачені й інші види введення рибавірину, оскільки вони стали доступні, наприклад за допомогою назального спрея, трансдермально, за допомогою супозиторію, у ви гляді лікарської форми з уповільненим вивільненням тощо. Будь-яка форма введення буде дійовою, поки будуть доставлятися відповіднідози без руйнування активного інгредієнту. Рибавірин, як правило, вводять у кількості 4001200мг, 600-1000мг або 700-900мг на день. В деяких варіантах рибавірин уводять протягом всього курсу лікування інгібітором білка NS3. Левовірин Левовірин є L-енантіомером рибавірину і виявляє властивість підсилювати Th1 імунну відповідь порівняно з Th2 імунною відповіддю. Левовірин випускається ф."ICN Pharmaceuticals". Левовірин має таку структур у: Вірамідин Вірамідин є 3-карбоксамідиновим дериватом рибавірину і діє як пролікарський засіб рибавірину. Він ефективно перетворюється у рибавірин за допомогою аденозиндезаміназ. Вірамідин має таку структур у: 52 Нуклеозидні аналоги Нуклеозидні аналоги, придатні для застосування в запропонованій комбінованій терапії, включають (але не обмежуються цим) рибавірин, левовірин, вірамідин, ізаторибін, нуклеозид Lрибофуранозилу, описаний в [пат. США №5559101] і включений у формулу винаходу цього патенту, (наприклад, 1-β-L-рибофуранозилурацил, 1-β-L-рибофуранозил-5-фторурацил, 1-β-Lрибофуранозилцитозин, 9-β-Lрибофуранозиладенін, 9-β-Lрибофуранозилгіпоксантин, 9-β-Lрибофуранозилгуанін, 9-β-L-рибофуранозил-6тіогуанін, 2-аміно-α-Lрибофураніл[1',2':4,5]оксазолін, O2,О2-ангідро-1-αL-рибофуранозилурацил, 1-(2,3,5-три-O-бензоїл-αрибофуранозил)-4-тіоурацил, 1-α-Lрибофуранозилцитозин, 1-α-L-рибофуранозил-4тіоурацил, 1-α-L-рибофуранозил-5-фторурацил, 2аміно-β-L-арабінофурано[1',2':4,5]оксазолін, O2,О2ангідро-β-L-арабінофуранозилурацил, 2'-деокси-βL-уридин, 3',5'-Ді-О-бензоїл-2'-деокси-4-тіо-β-Lуридин, 2'-деокси-β-L-цитидин, 2'-деокси-β-L-4тіоуридин, 2'-деокси-β-L-тимідин, 2'-деокси-β-L-5фтор уридин, 2',3'-дидеокси-β-L-уридин і 2'-деоксиβ-L-інозин); сполуку, описану у [пат. США №6423695] і включений у формулу винаходу цього патенту; сполуку, описану у [патентній заявці №2002/0058635] і включений у формулу винаходу цього патенту; нуклеозидний аналог, описаний у [WO 01/90121 А2] (Idenix); нуклеозидний аналог, описаний у [WO 02/069903 А2] (Biocryst Pharmaceuticals Inc.); нуклеозидний аналог, описаний у [WO 02/057287 А2 або WO 02/057425 А2] (обидві Merck/Isis); тощо. Антагоністи TNF В деяких варіантах запропонований спосіб включає введення ефективної кількості інгібітора білка NS3 та ефективної кількості антагоніста фактора-а некрозу пухлини (TNF-α). Відповідні антагоністи TNF-α, придатні для застосування в запропонованому способі, включають агенти, які зменшують рівень синтезу TNF-α, агенти, які блокують або інгібують зв'язування TNF-α з рецептором TNF-α (TNFR), та агенти, які блокують або інгібують TNFR-опосередковану сигнальну трансдукцію. Якщо чітко не зазначено інакше, термін «антагоніст TNF-α» або «антагоніст TNF» кожний раз в даному описі означає антагоніст TNF-α, відмінний від пірфенідону або аналога пірфенідону. Терміни «поліпептид рецептора TNF» і «поліпептид TNFR» відносяться до поліпептидів, хімічно отриманих з TNFR (з будь-якого виду), які здатні зв'язувати TNF. Описано два окремі види рецепторів TNF клітинних поверхонь: TNFR типу II (або р75 TNFR, або TNFRII) і TNFR типу І (або р55 53 84579 TNFR, або TNFRI). Зрілий непроцесований людський р75 TNFR являє собою глікопротеїн з молекулярною масою приблизно 75-80 кілодальтонів (kD). Зрілий непроцесований людський р55 TNFR являє собою глікопротеїн з молекулярною масою приблизно 55-60kD. Наведені тут як приклади поліпептиди TNFR є хімічно отриманими з TNFR типу І та/або TNFR типу II. Розчинні TNFR включають р75 TNFR, гібриди р75 TNFR з гетерологічними клітинами, що зливаються, наприклад Fc-областю імуноглобуліну. Поліпептид TNFR може бути інтактним TNFR або відповідним фрагментом TNFR. В [пат. США №5605690] наведені приклади поліпептидів TNFR, в тому числі розчинних поліпептидів TNFR, що підходять для застосування в даному винаході. В одних варіантах винаходу поліпептид TNFR включає позаклітинний домен TNFR. В інших варіантах поліпептид TNFR являє собою гібридний поліпептид, що включає позаклітинний домен TNFR, зв'язаний з С-доменом молекули імуноглобуліну (Ig). В деяких варіантах поліпептид TNFR являє собою гібридний поліпептид, що включає позаклітинний домен р75 TNFR, зв'язаний з С-доменом молекули IgGl. В інши х варіантах, коли йдеться про введення людині, імуноглобулін, використаний для гібридних білків, є людським, наприклад людський IgGl. В даному винаході можна застосовувати моновалентну і мультивалентну форми поліпептидів TNFR. Мультивалентні форми поліпептидів TNFR мають більш ніж один сайт зв'язування TNF. В одних варіантах TNFR являє собою дво валенту, або димерну, форму TNFR. Наприклад, описаний у [пат. США №5605690 і в роботі Mohler et al., 1993, J. Immunol, 151: 1548-1561], поліпептид химерного антитіла з варіабельними областями важкого або легкого ланцюгів імуноглобуліну, або обох, заміщеними позаклітинними доменами TNFR, був би придатним для даного винаходу. Як правило, якщо такий рекомбінантний поліпептид TNFR:антитіло продукується клітинами, він утворює двовалентну молекулу за допомогою дисульфідних зв'язків між доменами імуноглобуліну. Такий рекомбінантний поліпептид TNFR:антитіло називається TNFR:Fc. В одному з варіантів запропонований спосіб передбачає введення ефективної кількості розчинного TNFR ENBREL®. TNFR ENBREL® - це димерний гібридний білок, що складається з позаклітинного ліганд-зв'язуючого компонента людського TNFR з молекулярною масою 75kD (р75), зв'язаного з Fc-компонентом IgGl людини. Fcкомпонент ENBREL® містить домен СН2, домен СН3 і шарнірну зону, але не домен CHl IgGl. ENBREL® продукують в експресуючій системі клітини CHO (яєчника китайського хом'ячка). Він складається з 934 амінокислот і має середню молекулярну масу приблизно 150kD. [Smith et al. (1990) Science 248: 1019-1023; Mohler et al (1993) J. Immunol. 151: 1548-1561; U.S.Pat. No.5,395,760 and U.S.Pat. No.5,605,690]. Також підходять для використання моноклональні антитіла, щ зв'язують TNF-α. Моноклональні антитіла включають «гуманізовані» моноклональні антитіла миши; химерні антитіла; 54 моноклональні антитіла, що є принаймні на 80%, 90%, 95% або 100% людськими в амінокислотній послідовності; тощо. [Див., наприклад, WO 90/10077; WO 90/04036 і WO 92/02190]. Відповідні моноклональні антитіла включають фрагменти антіла, наприклад Fv, F(ab')2 та Fab; синтетичні антитіла; антитіла, отримані методом фагового дисплея; тощо. Приклади відповідних моноклональних антитіл включають Infliximab (REMICADE®, Centocor) та Adalimumab (HUMIRA™, Abbott). REMICADE® є химерним моноклональним анти-TNF-α антитілом, яке включає приблизно 25% амінокислотної послідовності миши і приблизно 75% амінокислотної послідовності людини. REMICADE® включає варіабельну область моноклонального анти-TNF-α антитіла миши, злиту з С-областю IgGl людини. [Elliott et al. (1993) Arthritis Rheum. 36: 1681-1690; Elliott et al. (1994) Lancet 344: 1105-1110; Baert et al. (1999) Gastroenterology 116: 22-28]. HUMIRA™ являє собою непроцесоване моноклональне антитіло IgGl людини, ідентифіковане технологією фагового дисплея. Piascik (2003) J. Am. Pharm. Assoc. 43: 327-328. В термін «антагоніст TNF» також входять, і тому підходять для застосування в запропонованому способі, інгібітори активованої стресом проеїнкінази (SAPK). Інгібітори SAPK відомі в галузі і включають, але не обмежуються цим, 2алкілімідазоли, описані в [пат. США №6548520]; сполуки 1,4,5-заміщеного імідазолу, описані в [пат. CШA №6489325]; сполуки 1,4,5-заміщеного імідазолу, описані в [пат. CШA №6569871]; сполуки гетероариламінофенілкетону, описані в опублікованій [патентній заявці США №2003/0073832]; сполуки піридилімідазолу, описані в [пат. США №6288089]; і гетероариламінобензофенони, описані в [пат. США №6432962]. Також становлять інтерес сполуки, описані у [патентній заявці США №2003/0149041 і пат. США №6214854]. Активована стресом протеїнкіназа є членом сімейства активованих мітогеном протеїнкіназ, які активуються у відповідь на подразники, що викликають стрес. SAPK включають (але не обмежуються цим) р38 [Lee et al. (1994) Nature 372: 739] та N-кінцеву cjun-кіназу (JNK). Способи оцінювання активності антагоніста TNF відомі в галузі. Наприклад, активність антагоніста TNF можна оцінити клітинним конкурентнозв'язуючим аналізом. В цьому аналізі мічений ізотопом TNF змішують з послідовно розріджуваним антагоністом TNF і клітинами, експресуючими TNFR, зв'язаний з клітинною мембраною. Частини цієї суспензії центрифугують для розділення вільного і зв'язаного TNF і визначають величину радіоактивності у вільній і зв'язаній фракціях. Активність антагоніста TNF оцінюють за інгібуванням зв'язування TNF з клітинами у присутності антагоніста TNF. Інший приклад, антагоністи TNF можна аналізувати на активність за їхньою здатністю нейтралізувати активність TNF in vitro в біоаналізі за допомогою клітин, чутливи х до цитотоксичної активності TNF як клітин-мішеней. В цьому аналізі клітини-мішені, культивовані разом з TNF, оброб 55 84579 ляють різними кількостями антагоніста TNF і потім аналізують на цитоліз. Активність антагоніста TNF оцінюють за зменшенням цитолізу в TNFіндукованих клітинах-мішенях у присутності антагоніста TNF. Інгібітори білка NS5B В деяких варіантах винахід пропонує спосіб, що передбачає введення ефективної кількості запропонованого інгібітора білка NS3 та ефективної кількості інгібітора неструктурного білка-5 ВГС (NS5; РНК-залежної РНК-полімерази) пацієнту, інфікованому ВГС, який цього потребує. Відповідні інгібітори білка NS5B включають (але не обмежуються цим) сполуку, описану у [пат. США №6479508] (Boehringer-Ingelheim); сполуку, описану у будь-якій з [міжнародних патентних заявок №№РСТ/СА02/01127, РСТ/СА02/01128 і РСТ/СА02/01129, всі подані 18 липня 2002р.] ф."Boehringer Ingelheim"; сполуку, описану у [пат.США №6440985] (ViroPharma); сполуку, описану у [WO 01/47883], наприклад JTK-003 (Japan Tobacco); динуклеотидний аналог, описаний у роботі [Zhong et al. (2203) Antimicrob. Agents Chemother. 47: 2674-2681]; сполуку бензотіадіазину, описану в роботі [Dhanak et al (2002) J. Вiol. Chem. 277(41): 38322-7]; інгібітор білка NS5B, описаний у [WO 02/100846 A1 або WO 02/100851 А2] (обидві від ф."Shire"); інгібітор білка NS5B, описаний у [WO 01/85172 A1 або WO 02/098424 A1] (обидві від ф."Glахо SmithKline"); інгібітор білка NS5B, описаний у [WO 00/06529 або WO 02/06246 A1] (обидві від ф."Меrсk"); інгібітор білка NS5B, описаний у [WO 03/000254] (Japan Tobacco); інгібітор білка NS5B, описаний у [EP 1 256628 А2] (Agouron); JTK-002 (Japan Tobacco); JTK-109 (Japan Tobacco); тощо. В багатьох варіантах особливий інтерес становлять інгібітори NS5, які є специфічними до NS5, наприклад, інгібітори NS5, які інгібують РНКзалежну PHK-полімеразу білка NS5 і не мають значного інгібуючого впливу на інші РНК-залежні РНК-полімерази і на ДНК-залежні РНК-полімерази. Додаткові противірусні засоби Додаткові противірусні терапевтичні засоби, які можна вводити разом із запропонованою сполукою інгібітора білка NS5, включають (але не обмежуються цим) інгібітори інозинмонофосфатдегідрогенази (IMPDH); рибозими, комплементарні до вірусної нуклеотидної послідовності; інгібітори антисенсової PHK тощо. Інгібітори IMPDH Інгібітори IMPDH, що підходять для застосування в запропонованій комбінованій терапії, включають (але не обмежуються цим): VX-497 ((S)-N-3-[3-(3-метокси-4-оксазол-5-іл-феніл)уреідо]-бензил-тетрагідрофуран карбамінової кислоти-3-іл-естер); Vertex Pharmaceuticals; [див., наприклад, Markland et al. (2000) Antimicrob. Agents Chemother. 44: 859-866]; рибавірин; левовірин (Ribapharm; [див., наприклад, Watson (2002) Сurr Оріn Investig Drugs 3(5): 680-3]); вірамідин (Ribapharm) і т.п. Рибозим і антисенсові противірусні засоби Рибозим і антисенсові противірусні засоби, що підходять для застосування в запропонованій 56 комбінованій терапії, включають (але не обмежуються цим) ISIS 14803 (ISIS Pharmaceuticals/Elan Corporation; [див., наприклад, Witherell (2001) Curr Opin Investig Drugs 2(11): 1523-9]); Heptazyme™ тощо. В одних варіантах додатковий противірусний засіб уводять протягом усього курсу лікування сполукою інгібітора білка NS3. В інших варіантах додатковий противірусний засіб уводять протягом періоду, який перекривається з періодом лікування сполукою інгібітора NS3, наприклад лікування додатковим противірусним засобом може починатися до лікування сполукою інгібітора NS3 і закінчуватися до закінчення лікування сполукою інгібітора NS3; лікування додатковим противірусним засобом може починатися після початку лікування сполукою інгібітора NS3 і закінчуватися після закінчення лікування сполукою інгібітора NS3; лікування додатковим противірусним засобом може починатися після початку лікування сполукою інгібітора NS3 і закінчуватися до закінчення лікування сполукою інгібітора NS3 або лікування додатковим противірусним засобом може починатися до початку лікування сполукою інгібітора NS3 і закінчуватися після закінчення лікування сполукою інгібітора NS3. Дози, фармацевтичні композиції і шляхи введення В запропонованих способах активний агент (агенти) (наприклад, сполуку формули І і необов'язково один або більше .додаткових противірусних засобів) можна вводити хазяїну за допомогою будь-якого засобу, здатного дати в результаті бажаний терапевтичний ефект. Отже, цей агент може бути включений в цілий ряд фармацевтичних композицій для терапевтичного введення. Конкретніше, запропоновані агенти можна вводити у фармацевтичні композиції, поєднуючи з відповідними, фармацевтично прийнятними носіями або розріджувачами, або можна вводити в препарати у твердій, напівтвердій, рідкій або газоподібній формах, наприклад в таблетках, капсулах, порошках, гранулах, мазях, розчинах, супозиторіях, ін'єкціях, засобах для інгаляції і аерозолях. Фармацевтичні композиції Вищеописані активні агенти можна вводити у фармацевтичні композиції за допомогою відомих реагентів і способів. Запропоновано композиції, приготовані разом з фармацевтично прийнятним (прийнятними) наповнювачем (наповнювачами). Відомий цілий ряд фармацевтично прийнятних наповнювачів, які тут не треба детально обговорювати, бо вони детально описані в багатьох публікаціях, в тому числі, [наприклад, A.Gennaro (2000) "Remington: The Science and Practice of Pharmacy", 20th edition, Lippincott, Williams & Wilkins; Pharmaceutical Dosage Forms and Drug Delivery Systems (1999) H.C. Ansel et al, eds., 7th ed., Lippincott, Williams & Wilkins; and Handbook of Pharmaceutical Excipients (2000) A.H.Kibbe et al., eds., 3rd ed. Amer. Pharmaceutical Assoc]. Фармацевтично прийнятні наповнювачі, наприклад основи, ад'юванти, носії або розріджувачі, є доступними для фахівців. Більш того, також доступні для фахівців фармацевтично прийнятні до 57 84579 поміжні речовини, наприклад агенти, що регулюють рН і буферні агенти, агенти, що регулюють тонічність, стабілізатори, зволожувачі тощо. В одних варіантах агент вводять у водному буфері. Відповідні водні буфери включають (але не обмежуються цим) ацетатні, сукцинатні, цитратні і фосфатні буфери з концентраціями від 5мМ до 100мМ. В інши х варіантах водний буфер включає реагенти, що забезпечують ізотонічний розчин. До таких реагентів відносяться хлорид натрію і цукри, наприклад маніт, декстроза, цукроза, та інші. В інших варіантах водний буфер додатково включає неіонну поверхнево-активну речовину, наприклад полісобрат 20 або 80. Фармацевтичні композиції можуть необов'язково додатково включати консервант. Відповідні консерванти включають (але не обмежуються цим) бензиловий спирт, фенол, хлорбутанол, хлорид бензалконію тощо. В багатьох випадках таку композицію зберігають при 40C. Композиції можуть також бути ліофілізовані, і в цьому випадку вони, як правило, включають кріопротектори, наприклад цукрозу, трегалозу, лактозу, мальтозу, маніт тощо. Ліофілізовані композиції можна зберігати протягом тривалих періодів навіть при кімнатній температурі. Введення згаданих агентів можна здійснювати різними шляхами, в тому числі перорально, трансбукально, ректально, внутрішньочеревинно, інтрадермально, підшкірно, внутрішньом'язово, трансдермально, інтратрахеально тощо. В багатьох варіантах введення здійснюю у вигляді болюсного вливання, наприклад підшкірного болюсного вливання, внутрішньомі'язового болюсного вливання тощо. Запропоновані фармацевтичні композиції можна вводити перорально, парентерально або за допомогою імплантованої ємності. Перевагу віддають пероральному введенню або ін'єкцією. Підшкірне введення запропонованої фармацевтичної композиції здійснюють за допомогою стандартних методів і пристроїв, наприклад голки та шприца, системи доставки через отвір для підшкірної ін'єкції тощо. [Див., наприклад, патенти США №№3547119, 4755173, 4531937,4311137 та 6017328]. Поєднання отвору для підшкірної ін'єкції і пристрою для введення запропонованої фармацевтичної композиції пацієнту через цей отвір в даному описі називається «система доставки через отвір для підшкірної ін'єкції». В багатьох варіантах підшкірне введення здійснюють болюсним вливання за допомогою голки та шприца. У фармацевтичних лікарських формах згадані агенти можна вводити у вигляді їхніх фармацевтично прийнятних солей або їх можна застосовувати самі по собі або у відповідному поєднанні або в комбінації з іншими фармацевтично активними сполуками. Нижче наведені необмежуючі приклади способів і наповнювачів. Для пероральних препаратів згадані агенти можна застосовувати самі по собі або в комбінації з відповідними домішками для приготування таблеток, порошків, гранул або капсул, наприклад з традиційними домішками, такими як лактоза, маніт, кукурудзяний або картопляний крохмаль; із зв'язуючими речовинами, такими як кристалічна 58 целюлоза, деривати целюлози, камедь, кукурудзяний крохмаль або желатини; з дизінтеграторами, такими як кукурудзяний або картопляний крохмаль або натрію карбоксиметилцулюлоза; із змащувальними речовинами, такими як тальк або стеарат магнію; і, при необхідності, з розріджувачами, буферними агентами, змочувальними . агентами, консервантами та ароматизаторами. В композиції для ін'єкцій згадані агенти можна вводити, розчиняючи, суспендуючи або емульгуючи їх у водному або неводному розчиннику, наприклад у рослинних або інших аналогічних оліях, синтетичних гліцеридах аліфатичних кислот, ефірах вищи х аліфатичних кислот або поліпропіленгліколі, і, при необхідності, з традиційними домішками, наприклад солюбілізаторами, ізотонічними агентами, суспендуючими агентами, емульгаторами, стабілізаторами і консервантами. Крім того, згадані агенти можна приготувати у вигляді супозиторіїв, змішуючи з різними основами, наприклад емульгуючими або водорозчинними основами. Запропоновані сполуки можна вводити ректально або за допомогою супозиторіїв. Супозиторій може включати основи, наприклад масло какао, карбовакси або поліетиленгліколі, які тануть при температурі тіла і залишаються твердими при кімнатній температурі. Можна готувати дозовані лікарські форми для перорального або ректального введення, наприклад сиропи, еліксири та суспензії, в яких кожна дозована одиниця, наприклад чайна ложка, столова ложка, таблетка або супозиторій містить задану кількість композиції, яка містить один або більше інгібіторів. Аналогічним чином, дозовані лікарські форми для ін'єкцій або внутрішньовенного введення можуть включати інгібітор (інгібітори) в композиції у вигляді розчину в стерильній воді, фізіологічному розчині або іншому фармацевтично прийнятному носії. Термін «дозована лікарська форма» в даному описі відноситься до фізично дискретних одиниць, придатних як однократні лікарські форми для людей і тварин, причому кожна така одиниця містить задану кількість запропонованої сполуки, достатню для досягнення бажаного ефекту, у поєднанні з фармацевтично прийнятним розріджувачем, носієм або основою. Характеристики запропонованих нових дозованих лікарських форм залежать від конкретної включеної сполуки та ефекту, якого хочуть досягти, а також від асоційованої з кожною сполукою фармакодинаміки в хазяїні. Фармацевтично прийнятні наповнювачі, наприклад основи, ад'юванти, носії або розріджувачі, є доступними для фахівців. Більш того, доступними для фахівців є фармацевтично прийнятні допосіжні речовини, наприклад буферні агенти і агенти, що регулюють рН, агенти, що регулюють тонічність, стабілізатори, змочувальні агенти тощо. Інші противірусні засоби Як вже говорилося, в деяких варіантах запропонований спосіб лікування передбачає введення інгібітора білка NS3, який являє собою сполуку формули І і необов'язково один або більше додаткових противірусних засобів. В одних варіантах цей спосіб включає введен 59 84579 ня одного або більше агоністі рецептора інтерферону. Агоністи рецепторів інтерферону описувались вище. В інших варіантах цей спосіб включає введення пірфенідону або аналога пірфенідону. Пірфенідон і його аналоги описувались вище. Додаткові противірусні засоби, придатні для застосування в комбінованій терапії, включають (але не обмежуються цим) нуклеотидні та нуклеозидні аналоги. Необмежуючі приклади їх включають азидотимідин (AZT) (зидовудин) та його аналоги і деривати; 2',3'-дидеоксиінозин (DDI) (диданозин) та його аналоги і деривати; 2',3'дидеоксицитидин (DDC) (дидеоксицитидин) та його аналоги і деривати; 2',3'-дидегідро-2',3'дидеокситимідин (D4T) (ставудин) та його аналоги і деривати; комбівір; абакавір; адефовір дипоксил; рибавірин; аналоги рибавірину тощо. В деяких варіантах спосіб крім того включає введення рибавірину. Рибавірин, 1-β-Dрибофуранозил-1Н-1,2,4-тріазол-3-карбоксамід, що його випускає ф."ICN Pharmaceuticals, Inc." (Costa Mesa, Calif.), описаний в ["Merck Index", compound No.8199, Eleventh Edition]. Йогo приготування і склад описані у [пат. США №4211771]. Даний винахід охоплює використання дериватів рибавірину [див., наприклад, пат. США №6277830]. Рибавірин можна вводити перорально у формі капсули або таблетки, або в такій самій або іншій формі і таким самим або іншим шляхом у вигляді агоніста рецептора інтерферону. Звичайно, передбачаються й інші види введення обох медикаментів, якщо вони доступні, наприклад за допомогою назального спрею, трансдермально, внутрішньовенно, за допомогою супозиторіїв, лікарських форм з уповільненим вивільненням тощо. Будь-який тип уведення буде дієвим доти, доки відповідні дози доставляються без руйнування активного інгредієнта. В одних варіантах додатковий противірусний засіб уводять протягом усього курсу лікування сполукою інгібітора білка NS3. В інших варіантах додатковий противірусний засіб уводять протягом періоду, що перекривається з періодом лікування сполукою інгібітора білка NS3, наприклад лікування додатковим противірусним засобом може починатися до лікування сполукою інгібітора NS3 і закінчуватися до закінчення лікування сполукою інгібітора NS3; лікування додатковим противірусним засобом може починатися після початку лікування сполукою інгібітора NS3 і закінчуватися після закінчення лікування сполукою інгібітора NS3; лікування додатковим противірусним засобом може починатися після початку лікування сполукою інгібітора NS3 і закінчуватися до закінчення лікування сполукою інгібітора NS3 або лікування додатковим противірусним засобом може починатися до початку лікування сполукою інгібітора NS3 і закінчуватися після закінчення лікування сполукою інгібітора NS3. Способи лікування Монотерапії Запропоновану сполуку інгібітора білка NS3 можна застосовувати для лікування гострої та хронічної форм хвороби, викликаної ВГС. В бага 60 тьох варіантах сполук у інгібітора білка NS3 вводять протягом 1-7 днів або 1-2 тижнів, або 2-3 тижнів, або 3-4 тижнів, або 1-2 місяців, або 3-4 місяців, або 4-6 місяців, або 6-8 місяців, або 8-12 місяців, або принаймні 1 року і навіть більших періодів часу. Сполуку інгібітора білка NS3 можна вводити 5 разів на день, 4 рази на день, 3 рази на день, два рази на день, щоденно, через день, 2 рази на тиждень, три рази на тиждень, раз на тиждень, через тиждень, 3 рази на місяць або раз на місяць. В інших варіантах сполуку інгібітора біока NS3 вводять у ви гляді безперервної інфузії. В багатьох варіантах запропоновану сполуку інгібітора білка NS3 вводять перорально. У зв'язку з вищеописаними способами лікування хвороби, викликаної ВГС, запропоновану сполуку інгібітора білка NS3 можна вводити пацієнту в дозі 0,01-100мг/кг маси тіла пацієнта щоденно, по 1-5 невеликих доз, повторюваних через певні інтервали часу, на день. В одних варіантах сполуку інгібітора білка NS3 вводять в дозі 0,575мг/кг маси тіла пацієнта щоденно, по 1-5 невеликих доз, повторюваних через певні інтервали часу, на день. Кількість активного інгредієнта, яку можна поєднувати з носіями для утворення лікарської форми, може бути різною в залежності від хазяїна, який потребує лікування, і конкретного способу введення. Типовий фармацевтичний препарат може містити 5-95% активного інгредієнта (по масі). В інших варіантах фармацевтичний препарат може містити 20-80% активного інгредієнта. Фахівці розуміють, що рівні доз можуть змінюватись в залежності від конкретної сполуки інгібітора білка NS3, вираженості симптомів та сприйнятливості пацієнта до побічних ефектів. Фа хівці можуть легко визначити кращі дози даної сполуки інгібітора білка NS3 за допомогою ряду методів. Кращим методом є вимірювання фізіологічної активності даного агоніста рецептора інтерферону. В багатьох варіантах призначають багатократний прийом сполуки інгібітора білка NS3. Наприклад, сполуку інгібітора білка NS3 вводять раз на місяць, двічі на місяць, тричі на місяць, через тиждень, раз на тиждень, двічі на тиждень, тричі на тиждень, чотири рази на тиждень, п'ять разів на тиждень, шість разів на тиждень, через день, щоденно, двічі на день, тричі на день або протягом періоду часу від одного дня до одного тижня, від двох тижнів до чотирьох тижнів, від одного місяця до двох місяців, від двох місяців до чотирьох місяців, від чотирьох місяців до шести місяців, від шести до восьми місяців, від восьми місяців до одного року, від 1 року до 2 років, від 2 років до 4 років і навіть довше. Комбіновані терапії із застосуванням рибавірину В деяких варіантах згадані способи передбачають комбіновану терапію, що включає введення сполуки інгібітора білка NS3, як описано вище, та ефективної кількості рибавірину. Рибавірин можна вводити в дозах приблизно 400мг, 800мг, 1000мг або 1200мг на день. В одному варіанті винахід пропонує будь-який з вищеописаних способів, модифікований таким
ДивитисяДодаткова інформація
Назва патенту англійськоюMacrocyclic carboxylic acids and acylsulfonamides as inhibitors of hepatitis c virus replication
Автори англійськоюBlatt Lawrence M., WENGLOWSKY STEVEN MARK, ANDREWS STEVEN WADE, Jiang Yutong, KENNEDY APRIL LINE, CONDROSKI KEVIN RONALD, JOSEY JOHN ANTHONY, STENGEL PETER JOHN, Madduru Machender R., DOHERTY GEORGE ANDREW, WOODARD BENJAMIN T.
Назва патенту російськоюМакроциклические карбоновые кислоты и ацилсульфонамиды как ингибиторы репликации вируса гепатита с
Автори російськоюБлетт Лоренс М., Венгловски Стивен Марк, Эндрюс Стивен Вейд, Джианг Ютонг, Кеннеди Эйприл Лайн, Кондроски Кевин Рональд, Джоси Джон Энтони, Стенджел Питер Джон, Маддуру Мачендер Р., Догерти Джордж Эндрю, Вуддард Бенджамин Т.
МПК / Мітки
МПК: C08H 1/00, A61K 38/00
Мітки: гепатиту, вгс, кислоти, інгібітори, вірусу, ацилсульфонаміди, реплікації, макроциклічні, карбонові
Код посилання
<a href="https://ua.patents.su/107-84579-makrociklichni-karbonovi-kisloti-i-acilsulfonamidi-yak-ingibitori-replikaci-virusu-gepatitu-s-vgs.html" target="_blank" rel="follow" title="База патентів України">Макроциклічні карбонові кислоти і ацилсульфонаміди як інгібітори реплікації вірусу гепатиту с (вгс)</a>
Попередній патент: Лікарський засіб, що містить (2r)-2-пропілоктанову кислоту як активний інгредієнт
Наступний патент: Спосіб антинакипної обробки води
Випадковий патент: Свердловинний заряд для створення повітряно-краплинної суміші з речовини гідрозабивки