Біциклічні похідні морфін-6-глюкуроніду, їх отримання і застосування в терапії
Формула / Реферат
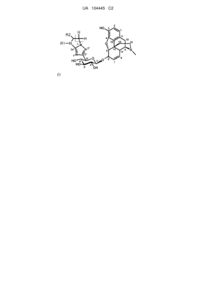
1. Сполука загальної формули (І):
 ,
,
де:
R1 являє собою атом водню або (С1-С4)алкіл;
R2 являє собою гідроксигрупу, тіолову групу, (С1-С4)алкілоксигрупу або тіо(С1-С4)алкіл;
n означає ціле число, яке дорівнює 1 або 2;
у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату.
2. Сполука загальної формули (І) за п. 1, де дана сполука має одну або декілька з наступних характеристик:
R1 являє собою атом водню;
R2 являє собою гідроксигрупу;
n дорівнює 2.
3. Сполука загальної формули (І) за п. 1 або 2, де дана сполука являє собою морфін-6-іл-5-С-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-b-D-ксилопіранозид.
4. Лікарський засіб, який відрізняється тим, що він містить сполуку загальної формули (І) за будь-яким з пп. 1-3 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І).
5. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку загальної формули (І) за будь-яким з пп. 1-3 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
6. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-3 для отримання лікарського засобу, призначеного для лікування або профілактики болю.
Текст
Реферат: Винахід належить до сполук, відповідних формулі (І), в якій R1 являє собою атом водню або (С1-С4)алкіл, R2 являє собою гідроксигрупу, тіолову групу, (С 1-С4)алкілоксигрупу або тіо(С1С4)алкіл, а n означає ціле число, якe дорівнює 1 або 2, у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату. Винахід належить також до способу їх отримання і їх застосування в терапії. UA 104445 C2 (12) UA 104445 C2 UA 104445 C2 ГАЛУЗЬ ТЕХНІКИ, ДО ЯКОЇ НАЛЕЖИТЬ ВИНАХІД Даний винахід належить до біциклічних похідних морфін-6-глюкуроніду, їх отримання і застосування для лікування і профілактики болю. Об'єктами даного винаходу є сполуки, які відповідають формулі (I): 5 10 15 20 25 30 35 40 45 , де: R1 являє собою атом водню або (С1-С4)алкіл; R2 являє собою гідроксигрупу, тіолову групу, (С1-С4)алкілоксигрупу або тіо(С1-С4)алкіл; n означає ціле число, яка дорівнює 1 або 2; у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату. Сполуки формули (I) можуть містити асиметричний атом вуглецю. Вони можуть, таким чином, існувати в формі двох енантіомерів. Такі енантіомери, а також їх суміші, включаючи рацемічні суміші, становлять частину даного винаходу. Сполуки формули (I) містять аномерний атом вуглецю. Вони можуть існувати в формі аномерів α або β. Аномери α, β і їх суміш складають частину даного винаходу. Сполуки формули (I) можуть існувати у вигляді основ або кислотно-адитивних солей. Такі адитивні солі становлять частину даного винаходу. Ці солі можуть бути отримані з фармацевтично прийнятними кислотами, але солі інших кислот, прийнятні, наприклад, для очищення або виділення сполук формули (I), також становлять частину даного винаходу. Сполуки формули (I) можуть знаходитися також у вигляді гідратів або сольватів, а саме у вигляді асоціатів або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також становлять частину даного винаходу. У рамках даного винаходу розуміють під: - (С1-С4)алкілом: аліфатичний насичений лінійний або розгалужений радикал, який необов'язково має замісники і містить від 1 до 4 атомів вуглецю; як приклади можна назвати метил, етил, пропіл, ізопропіл, бутил, ізобутил і трет-бутил; - гідроксигрупою: групу -OH; - тіоловою групою: групу -SH; - (С1-С4)алкоксигрупою: -О-(С1-С4)алкіл, де (С1-С4)алкіл має визначені раніше значення; як приклади можна назвати метокси-, етокси-, пропокси- і бутоксигрупу; - тіо(С1-С4)алкілом: -S-(С1-С4)алкіл, де (С1-С4)алкіл має визначені раніше значення; як приклади можна назвати тіометил, тіоетил, тіопропіл і тіобутил. Серед сполук формули (I) за даним винаходом сполуки першої групи мають одну або декілька з наступних характеристик: - R1 являє собою атом водню; - R2 являє собою гідроксигрупу; - n дорівнює 2. Серед сполук формули (I) за даним винаходом переважно можна назвати наступну сполуку: морфін-6-іл-5-C-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-Dксилопіранозид. СПОСІБ ОТРИМАННЯ Під захисною групою в подальшому описі розуміють групу, яка, з одного боку, дозволяє в ході синтезу захищати реакційноздатну функціональну групу, таку, як гідрокси- або аміногрупа, а з іншого боку, дозволяє в кінці синтезу відновлювати реакційноздатну функціональну групу без зміни. Приклади захисних груп, а також способи їх введення і видалення приведені в 1 UA 104445 C2 5 10 "Protective Groups in Organic Synthesis", Green et al., 2nd Edition (John Wiley & Sons, Inc., New York). Під відхідною групою в подальшому описі розуміють групу, яка може бути легко відщеплена від молекули внаслідок розриву гетеролітичного зв'язку з видаленням електронної пари. Така група також може бути легко заміщена іншою групою, наприклад, по реакції заміщення. Такими відхідними групами є, наприклад, галогени або активна гідроксигрупа, така, як метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат і т.д. Приклади відхідних груп, а також rd інформація по їх отриманню приведені в "Advances in Organic Chemistry", J. March, 3 Edition, Wiley Interscience, р. 310-316. На приведеній далі схемі реакцій 1 як переважний приклад пояснені реакції отримання морфін-6-іл-5-C-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-Dксилопіранозиду. Схема реакцій 1 15 20 25 30 35 На першій стадії сполука (7), яка містить в положенні 3 морфінового циклу захисну групу, наприклад півалоїльну групу, і в положенні 17 етилкарбоксильну групу, може бути пов'язана зі сполукою (6), яка попередньо захищена, наприклад, бензоїльною групою і в якій гідроксигрупа аномерного атома вуглецю активована, наприклад, трихлорацетімідною групою -CNHCCl3, з отриманням сполуки (8). Реакція зв'язування може бути здійснена, наприклад, в присутності кислоти Льюїса, такої, як трифторметансульфонілтриметилсилан (TMSOTf), в розчиннику, такому, як дихлорметан, при температурі в інтервалі від 0 до 25 °C. Сполука (7) може бути отримана, наприклад, способом, описаним в статті Portoghese and coll. J. Med. Chem. 1972, 15, 208-210. Сполука (6) може бути отримана активацією гідроксигрупи сполуки (5). У випадку, коли активуюча група являє собою трихлорацетімідну групу -CNHCCl3, реакція може бути здійснена в присутності трихлорацетонітрилу і сильної основи, такої, як 1,8-діазабіцикло[5.4.0]ундец-7-ен, в розчиннику, такому, як дихлорметан. Сполука (5) може бути попередньо отримана видаленням захисту аномерного атома сполуки (4). Наприклад, у випадку, коли захисна група являє собою бензоїл, видалення захисту гідроксигрупи може бути здійснене в присутності гідразинацетату (NH2NH2·CH3COOH). На другій стадії сполуку (8) відновлюють і одночасно видаляють захисні групи, наприклад, в присутності гідриду літію-алюмінію, в розчиннику, такому, як тетрагідрофуран, при температурі кипіння реакційної суміші і потім виділяють в присутності неорганічної кислоти, такої, як соляна 2 UA 104445 C2 5 10 15 20 25 30 35 40 45 кислота. Таким чином, отримують сполуку (9), яка являє собою приклад сполуки загальної формули (I). Винахід необмежувальним чином пояснений приведеними далі прикладами. ПРИКЛАДИ 1.1. 1,2,3,4-Тетра-О-бензоїл-α/β-D-глюкурононітрил До суспензії D-глюкуронаміду (25,0 г, 0,129 моль) в піридині (100 мл) при кімнатній температурі додають протягом 30 хв. розчин бензоїлхлориду (102 мл, 0,878 моль) в дихлорметані (90 мл). Реакційну суміш перемішують протягом ночі при кімнатній температурі і потім додають дихлорметан (200 мл) і воду (200 мл). Органічну фракцію промивають 1н. розчином соляної кислоти (200 мл), насиченим розчином гідрокарбонату натрію (3×200 мл) і насиченим розчином хлориду натрію (200 мл). Органічну фракцію сушать над сульфатом натрію і розчинник видаляють при зниженому тиску. Залишок (маслоподібна речовина жовтого кольору) розтирають з етанолом (200 мл) і отримують суміш аномерів (43,4 г, 57 %) у вигляді кристалів світло-жовтого кольору. Спектр ЯМР протонів в дейтерохлороформі, CDCl3, дає співвідношення α:β, яке дорівнює 2:1. Температура плавлення: 209-212 °C. 1 ЯМР H (400 МГц, CDCl3): δ 8,10-7,30 (м, 20Hα+20Hβ, H-аром), 6,88 (д, 1Hα, J 3,5 Гц, H-1α), 6,57 (д, 1Hβ, J 3,0 Гц, H-1β), 6,21 (т, 1Hα, J 9,5 Гц, H-3α), 5,93 (т, 1Hα, J 9,5 Гц, H-4a), 5,84 (т, 1Hβ, J 4,0 Гц, H-3β), 5,71-5,65 (м, 1Hα+1Hβ, H-2q, H-4β), 5,64 (м, 1Hβ, H-2β), 5,16 (д, 1Hβ, J4,0 Гц, H-5β), 5,11 (д, 1Hα, J 9,5 Гц, H-5). 13 ЯМР C (100 МГц, CDCl3): δ 165,5, 165,1, 164,8, 164,6, 164,3, 163,8 (C=O), 134,4-128,0 (Cаром), 115,3 (C-6β), 114,1 (C-6α), 90,9 (C-1β), 89,4 (C-1α), 69,3, 69,2, 69,0 (C-2α, C-3α, C-4α), 67,4 (C-4β), 66,7, 66,5 (C-2β, C-3β), 61,9 (C-5α), 60,8 (C-5β). + Маса [M+Na] для C34H25NO9Na: розраховано - 614,1427, знайдено - 614,1422. 1.2. 1,2,3,4-Тетра-О-бензоїл-5-C-(тетразол-5-іл)-α/β-D-ксилопіраноза До розчину отриманого раніше 1,2,3,4-тетра-O-бензоїл-α/β-D-глюкурононітрилу (43,0 г, 72,8 ммоль) в толуолі (500 мл) додають біс-(трибутилолово)оксид (3,70 мл, 7,26 ммоль) і триметилсилілазид (28,7 мл, 216 ммоль). Реакційну суміш перемішують протягом ночі при нагріванні із зворотним холодильником. Розчинник видаляють при зниженому тиску, залишок очищають хроматографією на силікагелі (циклогексан-етилацетат, від 1:1 до 0:1) і отримують 1,2,3,4-тетра-O-бензоїл-5-C-(тетразол-5-іл)-α/β-D-ксилопіранозу (27,0 г, 59 %) у вигляді кристалів коричневого кольору. Спектр ЯМР протонів в CDCl3 дає співвідношення α:β, яке дорівнює 2:1. Температура плавлення: 144-147 °C. 1 ЯМР H (400 МГц, CDCl3): δ 8,19-7,28 (м, 20H α+20Hβ, H-аром), 7,06 (д, 1Hα, J 3,5 Гц, H-1α), 6,50-6,44 (м, 1H β+1Hα, H-1β, H-3α), 6,21 (т, 1Hβ, J 9,0 Гц, H-3β), 6,13-6,01 (м, 2H p+1Hα, H-4β, H4q H-2β), 5,90-5,85 (м, 2Hα, H-2α, H-5α), 5,66 (д, 1Hβ, J 9,0 Гц, H-5β). 13 ЯМР C (400 МГц, CDCl3): δ 165,79, 165,2, 164,7 (C=O, C=N), 134,4-128,1 (C-аром), 93,0 (C1β), 89,9 (C-1α), 72,0, 70,5, 70,4, 70,3, 69,5 (C-2α, C-2β, C-3α, C-3β, C-4α, C-4β), 68,9 (C-5β), 67,0 (C-5α). + Маса [M+Na] для C34H26N4O9Na: розраховано - 657,1597, знайдено - 657,1595. 1.3. 1,2,3,4-Тетра-О-бензоїл-5-C-([1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-D-ксилопіраноза (4a) 1,2,3,4-Тетра-О-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-3-іл)-α/β-D-ксилопіраноза (4b) 3 UA 104445 C2 5 10 15 20 25 30 35 40 Розчин 1,2,3,4-тетра-O-бензоїл-5-C-(тетразол-5-іл)-α/β-D-ксилопіранози (2) (3,0 г, 4,73 ммоль) і 2-хлорпіримідину (813 мг, 7,10 ммоль) в піридині (38 мл) нагрівають із зворотним холодильником при перемішуванні протягом ночі. Розчинник видаляють при зниженому тиску, залишок очищають хроматографією на силікагелі (циклогексан-етилацетат, 3:7) і отримують суміш ізомерів 1,2,3,4-тетра-O-бензоїл-5-C([1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-D-ксилопіранози (4a) (1,8 г) і 1,2,3,4-тетра-O-бензоїл-5C-([1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-D-ксилопіранози (4b) (0,6 г) у вигляді кристалів світло-жовтого кольору. Спектр ЯМР протонів в CDCl3 дає співвідношення α:β, яке дорівнює 2:1 для ізомеру 1,2,3,4-тетра-O-бензоїл-5-C-([1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-Dксилопіранози (4a) і 7:3 для 1,2,3,4-тетра-O-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-3-іл)α/β-D-ксилопіранози (4b). Загальний вихід реакції становить 74 %. Аналізи 1,2,3,4-тетра-O-бензоїл-5-C-[1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-Dксилопіранози 4a Rf=0,55 (циклогексан-етилацетат, 1:4). Температура плавлення: 175-179 °C. 1 ЯМР H (400 МГц, CDCl3): 8,93 (м, 1Hα, H-5'α або H-7'α), 8,87 (м, 1Hβ, H-5'β або H-7'β), 8,73 (м, 1Hα, H-5'α або H-7'α), 8,64 (м, 1Hβ, H-5'β або H-7'β), 8,22-7,25 (м, 20Hα+20Hβ, H-аром), 7,04 (д, 1Hα, J 3,5 Гц, H-1α), 7,00 (дд, 1Hα, J 4,0 Гц, J 7,0 Гц, H-6'α), 6,93 (дд, 1Hβ, J 3,5 Гц, J 6,5 Гц, H-6'β), 6,57 (т, 1Hα, J9,5 Гц, H-3α), 6,52 (д, 1Hβ, J 7,5 Гц, H-1β), 6,29 (м, 2Hβ, Н-3β, H-4β), 6,11-6,01 (м, 2Hα+1Hβ, H-4α, Н-5α, Н-2β), 5,93 (дд, 1Hα, J 3,5 Гц, J 10,0 Гц, H-2α), 5,90-5,86 (м, 1Hβ, H-5β). 13 ЯМР C (100 МГц, CDCl3): δ 165,5, 165,2, 165,1, (С=О), 164,6 (С-3'β), 164,4 (С-3'α), 155,1 (С8а'α, С-8α'β), 154,2 (C-5'α або C-7'α), 154,0 (С-5'β або С-7'β), 140,3 (С-5'β або C-7'β), 140,1 (C-5'α або C-7'α), 134,4, 134,2, 133,8, 133,7, 133,5, 132,5, 132,4, 130,2-128,3 (С-аром), 110,4 (C-6'α, С6'β), 93,0 (С-1β), 89,7 (C-1α), 71,5 (C-2β або C-3β або C-4β або C-5β, 70,6 (С-2β або C-3β або C4β або C-5β), 70,4 (C-2α), 70,0 (C-2β або C-β або C-4β або C-5β, 69,5 (С-3α або C-4α), 69,1 (C-3α або C-4α), 68,7 (C-5β). + Маса [M+H] для C38H29N4O9: розраховано - 685,1935, знайдено - 685,1953. Аналізи 1,2,3,4-тетра-O-бензоїл-5-C-[1,2,4]триазоло[1,5-a]піримідин-3-іл)-α/β-Dксилопіранози 4b Rf=0,65 (циклогексан-етилацетат, 1:4) Температура плавлення: 188-190 °C. 1 ЯМР H (400 МГц, CDCl3): δ 8,80-8,71 (м, 2Hc+2Hβ, H-5'α, Н-7'α, H-5'β, H-7'β), 8,22-7,30 (м, 20Нα+20Нβ, H-аром), 7,10 (дд, 1Нα, J 6,5 Гц, J4,5 Гц, Н-6'α), 7,07-7,02 (м, 1Нα+1Нβ, Н-6'β, Н-1α), 6,47 (м, 1Нα+1Нβ, Н-1β + Н-3α), 6,27-6,16 (м, 1Hα+2β, H-4α, H-3β, H-4β), 6,06 (м, 1Hβ, H-2β), 5,89 (дд, 1Hα, J 3,5 Гц, J 10,0 Гц, H-2α), 5,73 (д, 1Нα, J 10,0 Гц, H-5α), 5,53 (д, 1Hβ, J 9,0 Гц, H-5β). 13 ЯМР C (100 МГц, CDCl3): δ 165,8, 165,6, 165,3, 165,0, 164,8, 164,5, 164,2 (C=O), 164,0 (С2'α), 163,8 (C-2'β), 155,3 (C-3a'α, C-3a'β), 155,1 (С-7'α), 155,0 (C-7'β), 136,0 С-5'α, C-5'β), 134,0, 133,7, 133,4-133,2, 130,2-128,2 (C-аром), 110,7 (С-6'α), 110,6 (C-6'β), 92,9 (C-1β), 90,0 (C-1α), 72,5 (C-3 β або C-4β або C-5β), 72,0 (C-3β або C-4β або C-5β), 71,3 (C-4α), 70,6 (С-3α), 70,3 (С-2α), 69,4 (С-5α). + Маса [M+H] для C38H29N4O9: розраховано - 685,2524, знайдено - 685,1953. 4 UA 104445 C2 1.4. 2,3,4-Три-О-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-2-іл)-α/β-D-ксилопіраноза (5b) 5 10 15 20 25 30 35 40 До розчину 1,2,3,4-тетра-O-бензоїл-5-C-([1,2,4]триазоло[4,3-a]піримідин-3-іл)-α/β-Dксилопіранози (4a) або 1,2,3,4-тетра-O-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-3-іл)-α/β-Dксилопіранози (4b) (500 мг, 0,73 ммоль) в N, N-диметилформаміді (19 мл) при 0 °C невеликими порціями протягом 10 хв. додають гідразинацетат (101 мг, 1,10 ммоль). Реакційну суміш перемішують спочатку протягом 1 год. при 0 °C і потім протягом 2 год. при кімнатній температурі. Розчинник видаляють при зниженому тиску, залишок очищають хроматографією на силікагелі (циклогексан-етилацетат, 1:4) і отримують 2,3,4-три-O-бензоїл-5-C([1,2,4]триазоло[1,5-a]піримідин-2-іл)-α/β-D-ксилопіранози 5 (284 мг, 67 %) у вигляді кристалів білого кольору. Спектр ЯМР протонів в CDCl3 дає співвідношення α:β, яке дорівнює 4:1. Rf=0,30 (циклогексан-етилацетат, 1:4) Температура плавлення: 133-135 °C. 1 ЯМР H (400 МГц, CDCl3) для аномеру α: δ 8,77 (дд, 1H, J 2,0 Гц, J 7,0 Гц, H-5' або H-7'), 8,69 (м, 1H, H-5' або H-7'), 8,02-7,27 (м, 15H, H-аром), 7,04 (м, 1H, H-6'), 6,43 (т, 1H, J 10,0 Гц, H-3), 6,11 (т, 1H, J 10,0 Гц, H-4), 5,95 (д, 1H, J 3,5 Гц, H-1), 5,88 (д, 1H, J 10,0 Гц, H-5), 5,49 (дд, 1H, J 3,5 Гц, J 0,0 Гц, H-2). 13 ЯМР C (100 МГц, CDCl3) для аномеру α: δ 165,8, 165,7, 165,0 (C=O), 164,9 (C-2'), 155,2 (С3а'), 155,1 (C-7'), 136,1 (C-5'), 133,2-132,9, 129,3-128,2 (C-аром), 110,8 (C-6'), 90,8 (C-1), 72,2 (C2), 71,7 (C-4), 70,5 (C-3), 66,3 (C-5). + Маса [M+H] для C31H25N4O8: розраховано - 581,1672, знайдено - 581,1661. 1.5. 2,3,4-Три-О-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-2-іл)-α-Dксилопіранозилтрихлорацетімідат (6) До розчину 2,3,4-три-O-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-2-іл)-α/β-Dксилопіранози 5 (650 мг, 1,12 ммоль) в дихлорметані (15 мл) при кімнатній температурі додають спочатку 1,8-діазобіцикло[5.4.0]ундец-7-ен (186 мкл, 1,24 ммоль) і потім трихлорацетонітрил (2,2 мл, 21,94 ммоль). Реакційну суміш перемішують протягом 1,5 год. при кімнатній температурі. Потім додають розчин оцтової кислоти (70 мкл, 1,22 ммоль) у воді (7 мл). Фракції розділяють і органічну фракцію промивають водою (7 мл) і потім сушать над сульфатом натрію. Розчинник видаляють при зниженому тиску, залишок очищають хроматографією на силікагелі (силікагель попередньо нейтралізують промиванням 5 %-м розчином триетиламіну в етилацетаті) (циклогексан-етилацетат, 1:1) і отримують 2,3,4-три-O-бензоїл-5-C([1,2,4]триазоло[1,5-a]піримідин-2-іл)-α-D-ксилопіранозилтрихлорацетімідат (6) (565 мг, 70 %) у вигляді кристалів жовтого кольору. Rf=0,35 (циклогексан-етилацетат, 2:3). Температура плавлення: 72-73 °C. 25 [α] D=117,2 (c=0,1, CDCl3). 1 ЯМР H (400 МГц, CDCl3): 8,81-8,76 (м, 2H, H-5', H-7'), 8,69 (с, 1H, NH), 8,00-7,29 (м, 15H, H-аром), 7,11 (дд, 1H, J 4,0 Гц, J 7,0 Гц, H-6'), 7,00 (д, 1H, J 3,5 Гц, H-1), 6,43 (т, 1H, J 10,0 Гц, H3), 6,20 (т, 1H, J 10,0 Гц, H-4), 5,81 (дд, 1H, J 3,5 Гц, J 10,0 Гц, H-2), 5,71 (д, 1H, J 10,0 Гц, H-5). 5 UA 104445 C2 5 10 15 20 25 30 35 40 13 ЯМР C (100 МГц, CDCl3): 165,6, 165,3, 164,7 (C=O), 164,0 (C-2'), 160,4 (C=N), 155,4 (C3a'), 155,1 (C-7'), 135,9 (C-5'), 133,5-133,2, 129,9-128,2 (C-аром), 110,7 (C-6'), 93,3 (C-1), 71,1 (C4), 70,6 (C-2), 70,1 (C-3), 69,4 (C-5). 1.6. 3-O-Півалоїл-N-етоксикарбонілнорморфін-6-іл-2,3,4-три-O-бензоїл-5-C([1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-D-ксилопіранозид (8) До охолодженого до 0 °C розчину 2,3,4-три-O-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-2іл)-α-D-ксилопіранозилтрихлорацетімідату (6) (1,5 г, 2,07 ммоль) і 3-O-півалоїл-Nетоксикарбонілнорморфіну (7) (738 мг, 1,73 ммоль) в дихлорметані (24 мл) додають трифторметансульфонілтриметилсилан (1,2 мл, 6,61 ммоль). Реакційну суміш перемішують спочатку протягом 30 хв. при 0 °C і потім протягом 1 год. при кімнатній температурі. Далі додають основу Хюніга (1,1 мл), суміш перемішують протягом 15 хв. і потім згущують досуха при зниженому тиску. Залишок очищають хроматографією на силікагелі (циклогексан-етилацетат, 1:4) і отримують 3-O-півалоїл-N-етоксикарбонілнорморфін-6-іл-2,3,4три-O-бензоїл-5-C-([1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-D-ксилопіранозиду (8) (470 мг, 31 %) у вигляді кристалів жовтого кольору. Rf=0,45 (циклогексан-етилацетат, 1:4). Температура плавлення: 171,5 °C. 23 [α] D=-65,3 (c=0,5, CDCl3) 1 ЯМР H (400 МГц, CDCl3): δ 8,80 (дд, 1H, J 2,0 Гц, 4,0 Гц, H-5" або H-7"), 8,75 (дд, 1H, J 2,0 Гц, 7,0 Гц, H-5" або H-7"), 8,02-7,29 (м, 15H, H-аром), 7,10 (дд, 1H, J 4,0 Гц, J 7,0 Гц, H-6"), 6,71 (д, 1H, J 8,0 Гц, H-1), 6,52 (д, 1H, J8,0 Гц, H-2), 6,21 (м, 1H, H-4'), 5,95 (т, 1H, J 9,0 Гц, H-3'), 5,755,69 (м, 2H, H-2', H-8), 5,47 (д, 1H, J 7,0 Гц, H-1'), 5,34 (д, 1H, J 9,5 Гц, H-5'), 5,23 (м, 1H, H-7), 4,98 (д, 1H, J 5,5 Гц, H-5), 4,93 (м, 1H, H-9), 4,46 (м, 1H, H-6), 4,20-4,05 (м, 2H, OCH2CH3), 3,99 (м, 1H, H-16a), 3,00 (м, 1H, H-16b), 2,90-2,70 (м, 2H, H-10), 2,48 (м, 1H, H-14), 1,88 (м, 2H, H-15), 1,31-1,25 (м, 12H, C(CH3)3, OCH2CH3). 13 ЯМР C (100 МГц, CDCl3): δ 165,7, 165,2, 164,7 (C=O), 155,4 (C-3a"), 154,9 (C-7"), 136,0 (C5"), 133,1-128,2 (C-аром), 122,2 (C-1), 119,2 (C-2), 110,6 (C-6"), 99,4 (С-1'), 89,9 (C-5), 73,0 (C-6), 72,7 (C-3'), 72,2 (C-2'), 71,3 (C-4', C-5'), 61,5 (OCH2CH3), 49,8 (C-9), 44,3 (C-13), 39,8 (C-14), 37,2 (C-16), 35,3 (C-15), 30,0 (C-10), 27,2 (C(CH3)3), 14,7 (OCH2CH3). + Маса [M+H] для C55H52N5O13: розраховано - 990,356, знайдено - 990,3596. 1.7. Морфін-6-іл-5-C-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-Dксилопіранозид (9) До суспензії гідриду літію-алюмінію (140 мг, 3,69 ммоль) в тетрагідрофурані (6 мл) додають розчин 3-O-півалоїл-N-етоксикарбонілнорморфін-6-іл-2,3,4-три-O-бензоїл-5-C([1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-D-ксилопіранозиду (8) (250 мг, 0,28 ммоль) в тетрагідрофурані (6 мл). Реакційну суміш перемішують протягом 1 год. при нагріванні із зворотним холодильником. Для усунення надлишку гідриду літію-алюмінію додають етилацетат і суміш доводять до pH=1 додаванням 1н. розчину соляної кислоти. Реакційну суміш згущують 6 UA 104445 C2 5 10 15 20 25 30 35 40 45 50 55 досуха. Перший раз залишок очищають на колонці для оберненофазової хроматографії (елююють спочатку чистою H2O, потім сумішшю "(H2O+0,1 % трифтороцтової кислоти)ацетонітрил", 80:20) для видалення солей. Друге очищення препаративною оберненофазовою хроматографією (елююють сумішшю "(H2O+0,1 % трифтороцтової кислоти)-ацетонітрил" з градієнтом від 95:5 до 20:80) дозволяє отримати морфін-6-іл-5-C-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-β-Dксилопіранозид (9) у вигляді кристалів білого кольору (61 мг, 40 %). Температура плавлення: 201ºC. 23 [α] D=-118,4 (c=0,5, метанол). 1 ЯМР H (300 МГц, D2O): 6,80 (д, 1H, J 8,0 Гц, H-1), 6,72 (д, 1H, J 8,0 Гц, H-2), 5,83 (м, 1H, H8), 5,43 (м, 1H, H-7), 5,36 (м, 1H, H-5"), 5,29 (д, 1H, J 5,5 Гц, H-5), 4,91 (д, 1H, J 8,0 Гц, H-1'), 4,52 (м, 1H, H-6), 4,51 (д, 1H, J 9,5 Гц, H-5'), 4,32-4,20 (м, 2H, H-9, H-6"a), 4,10 (м, 1H, H-6"b), 3,78 (т, 1H, J 9,5 Гц, H-4'), 3,68 (т, 1H, J 9,5 Гц, H-3'), 3,53 (дд, 1H, J 8,0 Гц, J 9,5 Гц, H-2'), 3,40 (м, 1H, H16a), 3,25 (м, 1H, H-10a), 3,12 (м, 1H, H-16b), 3,05-2,89 (м, 5H, H-10b, H-14, NCH3), 2,35-2,11 (м, 4H, H-15, H-7"). 13 ЯМР C (75 МГц, D2O): 131,2 (C-8), 126,1 (C-7), 120,5 (C-2), 117,8 (C-1), 102,5 (С-1'), 88,3 (C5), 74,9 (C-3'), 73,7 (C-6), 72,9 (C-2'), 71,7 (C-4'), 71,1 (C-5"), 70,4 (C-5'), 60,6 (C-9), 47,2 (C-16), 40,9 (NCH3), 40,1 (C-6"), 38,5 (C-14), 32,4 (C-15), 26,2 (C-7"), 20,9 (C-10). + Маса [M+H] для C27H34N5O8: розраховано - 556,2407, знайдено - 556,3278. Біологічна активність Сполуки за даним винаходом були об'єктами фармакологічних випробувань, які дозволили визначити їх аналгетичну дію. Були здійснені випробування, які полягали у вимірюванні активності in vivo сполук за даним винаходом відносно рефлекторної ноцицептивної відповіді. У даній методиці вимірювали латентний період рефлекторної ноцицептивної відповіді тварини як показника болю. Тест "Tail-Flick" (відсмикувати хвоста) Mетодика Аналгетичну активність визначали в тесті "Tail-Flick" на мишах-самцях Swiss (Iffa Credo). Даний тест оснований на мимовільному захисному рефлексі відсмикування твариною хвоста, що викликається болісним термічним впливом (джерело інфрачервоного випромінювання). Тест "Tail-Flick" (тест, розроблений D'Amour і Smith, 1941, Pharmacol. Exp. Ther.; 72: 74-79) полягає в тому, що після введення сполуки хвіст миші вміщують в фокус джерела інфрачервоного випромінювання таким чином, щоб надавати болісний термічний вплив (температура поверхні становить приблизно 55-60 °C). Час реакції (TR) миші (латентний період між моментом спрямування пучка випромінювання і моментом відсмикування мишею свого хвоста) вимірювали з повтореннями з різним часом в інтервалі від 20 до 120 хвилин після введення сполуки. Інтенсивність теплового потоку регулювали таким чином, щоб даний рефлекс відсмикування виявлявся у контрольних тварин в інтервалі від 0,5 до 3,5 с і опосередковано являв собою критерій мінімальної аналгезії (0 %). Перед введенням сполуки для кожної миші здійснювали два вимірювання часу реакції, що дозволяло встановлювати час базового вимірювання. Максимальний проміжок часу тривалістю 8 с був вибраний як максимальний час реакції, так щоб не викликати опікове пошкодження тканин у тварин і опосередковано визначити критерій максимальної аналгезії (100 %). Анальгетики збільшували час реакції в порівнянні з контрольною твариною, що не отримувала їх. Сполуки вводили підшкірно і перорально з дозами в інтервалі від 1,25 до 30 мг/кг. Результати Результати, отримані для сполук за даним винаходом, виражені наступними даними: - процентний ступінь від максимальної аналгетичної активності (показник % MPEmax), отриманий для кожної сполуки (при випробуваній дозі); - DE50 (виражений в мг/кг), відповідний ефективній дозі кожної сполуки, при якій була отримана 50 %-а аналгезія; даний показник розраховували для заданого часу після введення сполук; - тривалість дії анальгетика при заданій дозі. Процентний ступінь аналгетичної активності (% MPE) визначали по наступній формулі: % MPE=(TRпісля введення-TRдо введення)*100/(TRmax-TRдо введення). Серед найбільш активних сполук, активність яких оцінювали при підшкірному введенні, наприклад, морфін-6-іл-5-C-(5-гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-a]піримідин-2-іл)-βD-ксилопіранозид має процентний ступінь від максимальної аналгетичної активності (показник % MPEmax), яка дорівнює 80 % для дози 1,25 мг/кг, і DE50 менше 1,25 мг/кг при 7 UA 104445 C2 5 10 15 20 25 30 35 40 визначенні через 60 хвилин після введення. Аналгетична дія є стійкою і триває протягом більш 120 хвилин при даному способі введення. Таким чином, з викладеного виходить, що сполуки за даним винаходом мають аналгетичну активність. Отже, сполуки за даним винаходом можуть бути використані для отримання лікарських засобів, зокрема, лікарських засобів, призначених для лікування або профілактики болю. Таким чином, об'єктами даного винаходу в одному з інших його аспектів є лікарські засоби, що містять сполуки формули (I) або адитивну сіль даної сполуки з фармацевтично прийнятною кислотою, або також гідрат або сольват. Такі лікарські засоби знаходять застосування в терапії, зокрема, при лікуванні і профілактиці гострого або хронічного болю, зокрема, периферичного болю або болю, пов'язаного із запальними захворюваннями, такими, як артрит, ревматоїдний артрит, остеоартрит, спондиліт, подагра, васкуліт, хвороба Крона і синдром подразнення товстої кишки, невропатичні, м'язові, кісткові, післяопераційні болі, мігрень, люмбалгія, болі, пов'язані з раковими захворюваннями, діабетом і також СНІД. Сполуки за даним винаходом як болезаспокійливі засоби знаходять застосування також при лікуванні сексуальних розладів, зокрема, при лікуванні передчасної еякуляції у чоловіків. Даний винахід в одному з інших своїх аспектів належить до фармацевтичних композицій, що містять як активну речовину сполуку за даним винаходом. Такі фармацевтичні композиції містять ефективну дозу щонайменше однієї сполуки за даним винаходом або фармацевтично прийнятної солі, гідрату або сольвату згаданої сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. Ексципієнти вибирають з традиційних ексципієнтів, відомих фахівцям в даній галузі техніки, відповідно до необхідних фармацевтичної форми і способу введення. У фармацевтичних композиціях за даним винаходом, призначених для введення перорально, сублінгвально, підшкірно, внутрішньом'язово, внутрішньовенно, зовнішньо, місцево, інтратрахеально, інтраназально, інтраокулярно, черезшкірно або ректально, раніше згадана активна речовина формули (I) або її можливі сіль, сольват або гідрат можуть вводитися в лікарській формі стандартної дози в суміші з традиційними фармацевтичними ексципієнтами тваринам і людям для лікування згаданих раніше порушень або захворювань. Відповідні лікарські форми стандартної дози включають в себе форми для перорального прийому, такі, як таблетки, капсули з м'якою або твердою желатиновою оболонкою, порошки, гранули і розчини або суспензії для прийому всередину, форми для введення сублінгвально, трансбукально, інтратрахеально, інтраокулярно, інтраназально, шляхом інгаляції, форми для введення зовнішньо, черезшкірно, підшкірно, внутрішньом'язово або внутрішньовенно, форми для введення ректально і імплантати. Для зовнішнього застосування сполуки за даним винаходом можна використовувати у вигляді кремів, гелів, помад або лосьйонів. Як приклад лікарська форма стандартної дози сполуки за даним винаходом в формі таблеток може містити наступні компоненти: сполука за даним винаходом 50,0 мг маніт 223,75 мг кроскармелоза натрію 6,0 мг кукурудзяний крохмаль 15,0 мг гідроксипропілметилцелюлоза 2,25 мг стеарат магнію 3,0 мг. Даний винахід в одному з інших своїх аспектів належить також до способу лікування згаданих раніше патологій, який включає в себе введення хворому ефективної дози сполуки за даним винаходом або однієї з її фармацевтично прийнятних солей або гідратів, або сольватів. 8 UA 104445 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука загальної формули (І): HO n N N 1'' HO 15 20 25 13 5 5' O 1' 4' HO 10 16 3'' 2'' N 2' 3' 10 15 12 O N 3a'' 11 4 H 5 1 H R2 R1 2 3 O 14 9 N 8 6 7 OH , де: R1 являє собою атом водню або (С1-С4)алкіл; R2 являє собою гідроксигрупу, тіолову групу, (С 1-С4)алкілоксигрупу або тіо(С1-С4)алкіл; n означає ціле число, яке дорівнює 1 або 2; у вигляді основи або кислотно-адитивної солі, а також у вигляді гідрату або сольвату. 2. Сполука загальної формули (І) за п. 1, де дана сполука має одну або декілька з наступних характеристик: R1 являє собою атом водню; R2 являє собою гідроксигрупу; n дорівнює 2. 3. Сполука загальної формули (І) за п. 1 або 2, де дана сполука являє собою морфін-6-іл-5-С-(5гідрокси-4,5,6,7-тетрагідро[1,2,4]триазоло[1,5-]піримідин-2-іл)--D-ксилопіранозид. 4. Лікарський засіб, який відрізняється тим, що він містить сполуку загальної формули (І) за будь-яким з пп. 1-3 або адитивну сіль цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І). 5. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку загальної формули (І) за будь-яким з пп. 1-3 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. 6. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-3 для отримання лікарського засобу, призначеного для лікування або профілактики болю. Комп’ютерна верстка Л. Литвиненко Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Автори російськоюDlubala, Alain, Ripoche, Isabelle, Trecant, Claire
МПК / Мітки
МПК: C07H 15/24, C07D 487/04, A61P 25/04, A61K 31/7064, C07D 249/14, C07H 7/00, C07D 489/00, C07D 239/18, A61K 31/485, A61K 31/519, C07H 17/00, A61K 31/7042
Мітки: терапії, застосування, отримання, похідні, морфін-6-глюкуроніду, біциклічні
Код посилання
<a href="https://ua.patents.su/11-104445-biciklichni-pokhidni-morfin-6-glyukuronidu-kh-otrimannya-i-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Біциклічні похідні морфін-6-глюкуроніду, їх отримання і застосування в терапії</a>
Попередній патент: Пристрій для автоматичного контролю горизонтальних та вертикальних зміщень візирної осі зорової труби геодезичних приладів при перефокусуванні
Наступний патент: Композиційний препарат для вирощування сільськогосподарських культур
Випадковий патент: Вібраційний грохот