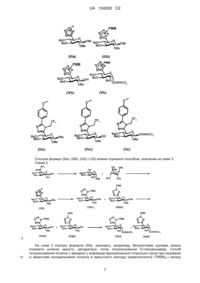
Похідні морфін-6-глюкуроніду, їх отримання і їх застосування в терапії
Формула / Реферат
1. Сполука загальної формули (І)
 , (I)
, (I)
в якій:
R1 означає 5-членну гетероциклічну ароматичну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену і (С1-С4)алкілу, галогену, гідроксилу, оксо, гало(С1-С4)алкілу, гало(С1-С4)алкілокси, С1-С4)алкілокси, арил(С1-С4)алкілу і арилу, причому вказана арильна група можливо заміщена однією або декількома групами, вибраними з груп: (С1-С4)алкілу, гало(С1-С4)алкілу, гідроксилу і (С1-С4)алкілокси,
у формі основи або солі приєднання з кислотою, а також у формі гідрату або сольвату.
2. Сполука загальної формули (І) за п. 1, де вказана сполука має одну або декілька наступних характеристик:
- гетероциклічну ароматичну групу вибирають з піролу, фурану, тіофену, імідазолу, триазолу, тетразолу, оксазолу, ізоксазолу, оксадіазолу, тіазолу, ізотіазолу і тіадіазолу, і
- якщо гетероциклічна ароматична група заміщена однією або декількома групами, вказану групу вибирають з метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, трет-бутилу, фторметилу, дифторметилу, трифторметилу, хлорметилу, дихлорметилу, трихлорметилу, фторетилу, дифторетилу, трифторетилу, хлоретилу, дихлоретилу, трихлоретилу, метоксифенілу, етоксифенілу, пропоксифенілу і бутилоксифенілу.
3. Сполука загальної формули (І) за п. 1, де:
- вказану гетероциклічну ароматичну групу вибирають з тетразолу, триазолу і оксазолу, і
- якщо вказана гетероциклічна ароматична група заміщена однією або декількома групами, вказану групу вибирають з метилу, трифторетилу і п-метоксифенілу.
4. Сполука загальної формули (І) за будь-яким з пп. 1-3, вибрана з:
- морфін-6-іл-5-С-(тетразол-5-іл)-a/b-D-ксилопіранозиду (1/1),
- морфін-6-іл-5-С-(тетразол-5-іл)-b-D-ксилопіранозиду,
- морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-a/b-D-ксилопіранозиду (2/3),
- морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-a-D-ксилопіранозиду,
- морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-b-D-ксилопіранозиду і
- морфін-6-іл-5-С-[5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-4Н-1,2,4-триазол-3-іл]-b-D-ксилопіранозиду.
5. Лікарський засіб, який відрізняється тим, що він містить сполуку загальної формули (І) за будь-яким з пп. 1-4 або сіль приєднання цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І).
6. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку загальної формули (І) за будь-яким з пп. 1-4 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт.
7. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-4 для отримання лікарського засобу, призначеного для лікування або попередження болю.
8. Сполука загальної формули (III)
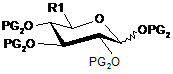 , (III)
, (III)
в якій:
R1 такий, як визначений в п. 1, і
PG2 означає бензоїльну групу.
9. Сполука загальної формули (III) за п. 8, де R1 вибирають з тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-2-(4-метоксибензил)-2Н-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4-метоксибензил)-1Н-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу.
10. Сполука загальної формули (IV)
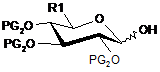 , (IV)
, (IV)
в якій:
R1 такий, як визначений в п. 1, і
PG2 означає бензоїльну групу.
11. Сполука загальної формули (IV) за п. 10, де R1 вибирають з 1,2,3,4-тетра-О-бензоїл-5-С-2-(4-метоксибензил)-2Н-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4-метоксибензил)-1H-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу.
12. Сполука загальної формули (V)
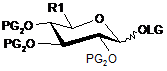 , (V)
, (V)
в якій:
R1 такий, як визначений в п. 1,
РG2 означає бензоїльну групу, і
LG означає трихлорацетамідатну групу.
13. Сполука загальної формули (V) за п. 12, де R1 вибирають з 1,2,3,4-тетра-О-бензоїл-5-С-2-(4-метоксибензил)-2H-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4-метоксибензил)-1Н-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу.
Текст
Реферат: UA 104302 C2 (12) UA 104302 C2 Даний винахід стосується похідних морфін-6-глюкуроніду наступної формули (І) HO O N R1 HO HO O O OH , (I) в якій: R1 означає 5-членну гетероароматичну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену і (С1-С4)алкілу, галогену, гідроксилу, оксо, гало(С 1С4)алкілу, гало(С1-С4)алкілокси, (С1-С4)алкілокси, арил(С1-С4)алкілу і арилу, причому вказана арильна група можливо заміщена однією або декількома групами, вибраними з груп: (С 1С4)алкілу, гало(С1-С4)алкілу, гідроксилу і (С1-С4)алкілокси, у вигляді основи або солі приєднання з кислотою, а також у вигляді гідрату або сольвату. Даний винахід також стосується способу отримання вказаних сполук і їх застосування в терапії. UA 104302 C2 5 ОПИС ГАЛУЗЬ ВИНАХОДУ Даний винахід стосується похідних морфін-6-глюкуроніду, їх отримання і їх застосування для лікування і попередження болю. Об'єктом даного винаходу є сполуки формули (I) , 10 15 20 25 30 35 40 45 в якій: R1 означає 5-членну гетероароматичну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену і (С1-С4)алкілу, галогену, гідроксилу, оксо, гало(С1С4)алкілу, гало(С1-С4)алкілокси, (С1-С4)алкілокси, арил(С1-С4)алкілу і арилу, причому вказана арильна група можливо заміщена однією або декількома групами, вибраними з груп: (С1С4)алкілу, гало(С1-С4)алкілу, гідроксилу і (С1-С4)алкілокси, в формі основи або солі приєднання з кислотою, а також в формі гідрату або сольвату. Сполуки формули (I) можуть містити один або декілька асиметричних атомів вуглецю. Таким чином, вони можуть знаходитися в формі енантіомерів або діастереоізомерів. Ці енантіомери і діастереоізомери, а також їх суміші, включаючи рацемічні суміші, належать до винаходу. Сполуки формули (I) містять аномерний вуглець. Вони можуть існувати в формі аномерів і . Аномери , і їх суміші належать до винаходу. Сполуки формули (I) можуть існувати у вигляді основ або солей приєднання з кислотами. Такі солі приєднання належать до винаходу. Ці солі можна отримати з використанням фармацевтично прийнятних кислот, але солі інших кислот, придатних, наприклад, для очищення або виділення сполук формули (I) також належать до винаходу. Сполуки формули (I) можуть також існувати в формі гідратів або сольватів, а саме в формі асоціацій або комбінацій з однією або декількома молекулами води або з розчинником. Такі гідрати і сольвати також належать до винаходу. У рамках даного винаходу розуміють під: - атомом галогену: атом фтору, хлору, брому або йоду; - (С1-С4)алкільною групою: аліфатичну, насичену, лінійну або розгалужену, заміщену або незаміщену групу, що містить від 1 до 4 атомів вуглецю; як приклади можна назвати метильну, етильну, пропільну, ізопропільну, бутильну, ізобутильну і трет-бутильну групи; - гало(С1-С4)алкільною групою: алкільну групу, один або декілька атомів водню якої були заміщені атомом галогену, таким як визначено вище; як приклади гало(С1-С4)алкільних груп можна назвати, зокрема, фторметильну, дифторметильну, трифторметильну, хлорметильну, дихлорметильну, трихлорметильну, фторетильну, дифторетильну, трифторетильну, хлоретильну, дихлоретильну і трихлоретильну групи; - гідроксильною групою: групу -ОН; - оксогрупою: групу =О -(С1-С4)алкілокси групою: О-(С1-С4)алкільну групу, де (С1-С4)алкільна група така, як визначена вище; як приклади можна назвати метокси, етокси, пропокси і бутилокси групи; - гало(С1-С4)алкілокси групою: (С1-С4)алкілокси групу, один або декілька атомів водню якої заміщені атомом галогену, таким як визначений вище; як приклади можна назвати групи -OCF3, -OCHF2 і -OCCl3; - арильною групою: ароматичну циклічну заміщену або незаміщену групу, що містить від 5 до 14 атомів вуглецю; як приклади незаміщених арильних груп можна назвати фенільну і 1 UA 104302 C2 5 10 15 20 25 30 35 40 45 нафтильну групи; як приклади заміщених арильних груп можна назвати (С1-С4)алкоксифенільні групи, такі як метоксифенільна, етоксифенільна, пропоксифенільна і бутилоксифенільна групи; - арил(С1-С4)алкільною групою: алкільну групу, один або декілька атомів водню якої заміщений арильною групою; як приклади можна назвати бензильну групу; - 5-членною гетероциклічною гетероароматичною групою: циклічну ароматичну групу, що містить від 1 до 4 атомів вуглецю і містить один або декілька гетероатомів, таких як азот, кисень або сірка; як приклади 5-членних гетероциклічних гетероароматичних груп можна назвати піроліл, фураніл, тіофеніл, піразоліл, імідазоліл, триазоліл, тетразоліл, оксазоліл, ізоксазоліл, оксадіазоліл, тіазоліл, ізотіазоліл і тіадіазоліл. Зі сполук формули (I), що є об'єктом винаходу, перша група сполук має одну або декілька наступних ознак: - гетероциклічну гетероароматичну групу вибирають з піролу, фурану, тіофену, імідазолу, триазолу, тетразолу, оксазолу, ізоксазолу, оксадіазолу, тіазолу, ізотіазолу і тіадіазолу і - якщо гетероциклічна гетероароматична група заміщена однією або декількома групами, вказану групу вибирають з метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, трет-бутилу, фторметилу, дифторметилу, трифторметилу, хлорметилу, дихлорметилу, трихлорметилу, фторетилу, дифторетилу, трифторетилу, хлоретилу, дихлоретилу, трихлоретилу, метоксифенілу, етоксифенілу, пропоксифенілу і бутилоксифенілу. Зі вказаних вище сполук можна зокрема назвати сполуки формули (I), для яких: - гетероциклічну гетероароматичну групу вибирають з тетразолу, триазолу, зокрема, 1,2,4триазолу і оксадіазолу, зокрема, 1,3,4-оксадіазолу і - якщо гетероциклічна гетероароматична група заміщена щонайменше однією групою, вказану групу вибирають з метильною, трифторетильною і п-метоксифенільною групами. Зі сполук формули (I), об'єктів винаходу, можна зокрема назвати наступні сполуки: - морфін-6-іл 5-С-(тетразол-5-іл)-/-D-ксилопіранозид (1/1), - морфін-6-іл 5-С-(тетразол-5-іл)--D-ксилопіранозид - морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)-/-D-ксилопіранозид (2/3) - морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозид - морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозид і - морфін-6-іл 5-С-[5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-4Н-1,2,4- триазол-3-іл]--Dксилопіранозид. СПОСІБ ОТРИМАННЯ Далі в тексті під захисною групою PG розуміють групу, яка дозволяє, з одного боку, захищати реакційноздатну функціональну групу, таку як гідрокси або амін, в процесі синтезу і, з іншого боку, регенерувати цілу функціональну групу в кінці синтезу. Приклади захисних груп, а також способи захисту і зняття захисту приведені в “Protective Groups in Organic Syntesis", Green et al., 2 Edition (John Willey & Sons, Inc., New York). Під групою LG, що видаляється, далі в тексті розуміють групу, яка може легко відщеплюватися від молекули шляхом розриву гетеролітичного зв'язку з видаленням електронної пари. Ця група може таким чином легко замінюватися іншою групою в ході реакції заміщення, наприклад. Такі групи, що видаляються, являють собою, наприклад, галогени або гідроксигрупу, що активується, таку як метансульфонат, бензолсульфонат, птолуолсульфонат, трифлат, ацетат і т. д. Приклади груп, що видаляються, а також дані про їх отримання приведені в “Advances in Organic Chemistry", J.March, 3 Edition, Willey Interscience, cтр.310-316. Згідно з винаходом можна отримати сполуку загальної формули (I) нижченаведеним способом, який ілюструє схема 1. 2 UA 104302 C2 Схема 1 1 5 10 15 20 25 30 На першій стадії сполука загальної формули (II), в якій PG означає захисну групу, таку як півалоїл, і R означає (С1-С4)алкільну групу, наприклад, метил або етил, може сполучатися із сполукою загальної формули (V), в якій R1 такий, як визначено відносно загальної формули (I), PG2 означає захисну групу, таку як бензоїл, і LG означає активуючу групу, таку як трихлорацетимідат -CNHCCl3, для отримання сполуки загальної формули (VI). Реакцію зв’язування можна, наприклад, провести в присутності кислоти Льюїса, такої як триметилсилантрифторметансульфоніл (TMSOTf) в розчиннику, такому як дихлорметан, при температурі від 0ºС до 25ºС. У деяких випадках сполука загальної формули (V) може захищатися перед реакцією зв’язування. Наприклад, якщо R1 означає тетразоліл, його можна заздалегідь захистити захисною групою, такою як 4-метоксибензил. Після реакції зв’язування ця захисна група може відщеплюватися, наприклад, у випадку тетразолілу, що несе 4-метоксибензил, в присутності трифтороцтової кислоти (TFA) при температурі кипіння із зворотним холодильником. Сполуку загальної формули (II) можна отримати, наприклад, способом, описаним в Portoghese and coll. J.Med.Chem.1972, 15, 208-210. Сполуку загальної формули (V) можна отримати активацією гідроксильної функціональної групи сполуки загальної формули (VI), в якій R1 і PG2 такі як визначені вище. У випадку, якщо група LG є групою, що видаляється, такою як трихлорацетимідат -CNHСCl3, реакцію можна здійснювати в присутності трихлорацетонітрилу і сильної основи, такої як 1,8діазабіцикло[5.4.0]ундек-7-ен, в розчиннику, такому як дихлорметан. Сполуку загальної формули (IV) можна заздалегідь отримати шляхом аномерного зняття захисту із сполуки загальної формули (III), в якій R1 і PG2 такі, як визначені вище. У випадку, якщо PG2 означає бензоїл, зняття захисту з гідроксильної групи може здійснюватися в присутності гідразинацетату (NH2NH2, CN3COOH). На другій стадії сполуки загальної формули (VI) відновлюють і одночасно з неї знімають захист, наприклад, в присутності гідриду літію і алюмінію в розчиннику, такому як тетрагідрофуран, при температурі кипіння із зворотним холодильником реакційного середовища з подальшим виділенням в присутності мінеральної кислоти, такої як соляна кислота. Таким чином, отримують сполуку загальної формули (I). 3 UA 104302 C2 Якщо R1 означає 2-метил-1,3,4-оксадіазол-5-іл, сполуку загальної формули (I) можна отримати з відповідної сполуки загальної формули (I), в якій R1 означає тетразоліл, причому останній отримують способом, який ілюструє схема 2. Схема 2 5 10 15 20 Відповідно до схеми 2 і на першій стадії морфін-6-іл 5-С-(тетразол-5-іл)-β-D-ксилопіранозид (1) може взаємодіяти з ацилхлоридом або ангідридом кислоти, таким як оцтовий ангідрид, відповідно до теплового перегрупування Huisgen для отримання 3-О-ацетилморфін-5-іл 2,3,4три-О-ацетил-5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозиду (2). На другій стадії з гідроксильних груп знімають захист, наприклад, в присутності метилату натрію для отримання морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозиду (3). На схемах 1 і 2 вихідні сполуки і реагенти, якщо спосіб їх отримання не описаний, є комерційно доступними, або описані в літературі або можуть бути отримані описаними в літературі або відомими фахівцеві способами. Проміжні продукти синтезу Відповідно до іншого аспекту об'єктом винаходу також є сполуки загальних формул (III), (IV) і (V). Ці сполуки придатні як проміжні продукти синтезу сполук загальної формули (I). Більш конкретно об'єктом винаходу є сполуки формул (IIIa), (IIIb), (IIIc), (IVb), (IVc), (Vb) і (Vc). Сполуки (IIIb), (IVb) і (Vb) знаходяться у вигляді суміші двох ізомерів в положенні параметоксибензильної групи (РМВ). 4 UA 104302 C2 Сполуки формул (IIIa), (IIIb), (IVb) і (Vb) можна отримати способом, описаним на схемі 3. Схема 3 5 10 На схемі 3 сполуку формули (IIIa), захищену, наприклад, бензоатними групами, можна отримати шляхом захисту, дегідратації, потім тетразолування D-глюкуронаміду. Спосіб тетразолування полягає у введенні у взаємодію функціональної нітрильної групи при нагріванні із зворотним холодильником толуолу в присутності азотиду триметилсилілу (TMSN3) і оксиду 5 UA 104302 C2 5 10 15 20 25 30 35 40 біс(трибутилолова) (Bu3Sn)2O. Відносно реакції захисту D-глюкуронаміду можна застосовувати адаптацію способу, описаного в Carbohydrate Research 2006, 341, 1, 41-48. Сполуку формули (IIIb), що являє собою суміш сполук (IIIb1) і (IIIb2), можна отримати із сполуки формули (IIIa) шляхом захисту аміну, наприклад, параметоксибензилом. Селективне зняття захисту в аномерному положенні сполуки формули (IIIb) дозволяє отримувати сполуки формули (IVb), що являє собою суміш сполук (IVb1) і (IVb2). У випадку захисної групи типу бензоату це зняття захисту можна здійснювати в присутності гідразинацетату. Вільну гідроксильну функціональну групу сполуки формули (IVb) можна перетворювати в імідат для отримання сполуки формули (Vb), що являє собою суміш сполук (Vb1) і (Vb2). Перетворення гідроксильної функціональної групи в імідатну функціональну групу можна, наприклад, провести в присутності трихлорацетонітрилу і DBU (1,8-діазабіцикло[5.4.0]ундек-7ен) відповідно до адаптації способу, описаного в Tetrahedron 2000, 56, 7591-7594. Сполуки формул (IIIс), (IVс) і (Vс) можна отримати способом, описаним по схемі 4. Схема 4 На схемі 4, сполука формули (IIIа), описана вище, може піддаватися тепловому перегрупуванню Huisgen в присутності хлориду імідоїлу, наприклад, хлориду 2,2,2-трифтор-N(4-метоксибензил)ацетимідоїлу для отримання сполуки формули (IIIс). Селективне зняття захисту в аномерному положенні сполуки формули (IIIс) дозволяє отримати сполуку формули (IVc). У випадку захисної групи типу бензоату це зняття захисту може здійснюватися в присутності гідразинацетату. Вільну гідроксильну функціональну групу сполуки формули (IVс) можна перетворювати в імідат для отримання сполуки формули (Vс). Перетворення гідроксильної функціональної групи в імідатну функціональну групу можна, наприклад, провести в присутності трихлорацетонітрилу і DBU (1,8-діазабіцикло[5.4.0]ундек-7-ен) відповідно до адаптації способу, описаного в Tetrahedron 2000, 56, 7591-7594. Винахід ілюструють нижченаведені приклади, що не мають обмежуючого характеру. У наступних прикладах описане отримання деяких сполук згідно з винаходом. Ці приклади не є обмежувальними і тільки ілюструють даний винахід. Номери сполук в прикладах співвідносяться з тими, які приведені в нижченаведеній таблиці, яка ілюструє хімічні структури і фізичні властивості декількох сполук за винаходом. ПРИКЛАДИ Приклад 1: трифторацетат морфін-6-іл 5-С-(тетразол-5-іл)-β-D-ксилопіранозиду (сполука 2) 1.1. 1,2,3,4- тетра-О-бензоїл-/-D-глюкурононітрил У суспензію D-глюкуронаміду (25,0 г 0,129 моль) в піридині (100 мл) при кімнатній температурі вводять протягом 30 хвилин розчин бензоїлхлориду (102 мл, 0,878 моль) в дихлорметані (90 мл). Реакційне середовище перемішують протягом ночі при кімнатній температурі, потім вводять дихлорметан (200 мл) і воду (200 мл). Органічну фазу промивають 6 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 розчином соляної кислоти 1N (200 мл), насиченим розчином гідрогенокарбонату натрію (3×200 мл) і насиченим розчином хлориду натрію (200 мл). Органічну фазу сушать на сульфаті натрію і розчинник видаляють при зниженому тиску. Залишок (масло жовтого кольору) розтирають в етанолі (200 мл) до отримання суміші аномерів (43,4 г, 57%) в формі кристалів світло-жовтого кольору. Спектр протонного ЯМР в дейтеріохлороформі, CDCl3, показує : 2:1. Точка плавлення: 209-212ºС. 1 ЯМР H (400 МГц, CDCl3): 8,10-7,30 (м, 20Hα+20Hβ, H-aro), 6,88 (д, 1Hα, J 3,5 Гц, H-1α), 6,57 (д, 1Hβ, J 3,0 Гц, H-1β), 6,21 (т, 1Hα, J 9,5 Гц, H-3α), 5,93 (т, 1Hα, J 9,5 Гц, H-4a), 5,84 (т, 1Hβ, J 4,0 Гц, H-3β), 5,71-5,65 (м, 1Hα+1Hβ, H-2a, H-4β), 5,64 (м, 1Hβ, H-2β), 5,16 (д, 1Hβ, J 4,0 Гц, H-5β), 5,11 (д, 1Hα, J 9,5 Гц, H-5a). 13 ЯМР C (100 МГц, CDCl3) 165,5, 165,1 , 164,8, 164,6, 164,3, 163,8 (C=O), 134,4-128,0 (Caro), 115,3 (C-6β), 114,1 (C-6α), 90,9 (C-1β), 89,4 (C-1α), 69,3, 69,2, 69,0 (C-2α, C-3α, C-4α), 67,4 (C-4β), 66,7, 66,5 (C-2β, C-3β), 61,9 (C-5α), 60,8 (C-5β). + Розрахункова маса C34H25NO9Na[M+Na] 614,1427, отримана 614,1422. 1.2. 1,2,3,4- тетра-О-бензоїл-5-С-(тетразол-5-іл)-/-D-ксилопіранозу У розчин 1,2,3,4-тетра-O-бензоїл-/-D-глюкуронітрилу, отриманого раніше, (43,0 г, 72,8 ммоль) в толуолі (500 мл) вводять оксид біс(трибутилолова) (3,70 мл, 7,26 ммоль) і азидид триметилсилілу (28,7 мл, 216 ммоль). Реакційне середовище перемішують протягом однієї ночі при нагріванні зі зворотним холодильником. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (циклогексан-етилацетат від 1:1 до 0:1) для отримання 1,2,3,4-тетра-O-бензоїл-5-С-(тетразол-5-іл)-/-D-ксилопіранози (27,0 г, 59%) у вигляді кристалів коричневого кольору. Спектр протонного ЯМР в CDCl3 показує відношення : 2:1. Точка плавлення: 144-147С. 1 ЯМР H (400 МГц, CDCl3): 8,19-7,28 (м, 20Hα+20Hβ, H-aro), 7,06 (д, 1Hα, J 3,5 Гц, H-1α), 6,50-6,44 (м, 1Hβ+1Hα, H-1β, H-3α), 6,21 (т, 1Hβ, J 9,0 Гц, H-3β), 6,13-6,01 (м, 2Hβ+1Hα, H-4β, H4α, H-2β), 5,90-5,85 (м, 2Hα, H-2α, H-5α), 5,66 (д, 1Hβ, J 9,0 Гц, H-5β). 13 ЯМР C (100 МГц, CDCl3) 165,79, 165,2, 164,7 (C=O, C=N), 134,4-128,1 (C-aro), 93,0 (C-1β), 89,9 (C-1α), 72,0, 70,5, 70,4, 70,3, 69,5 (C-2α, C-2β, C-3α, C-3β C-4α, C-4β), 68,9 (C-5β), 67,0 (C5α). + Розрахункова маса C34H26N4O9Na[M+Na] 657,1597, отримана 657,1595. 1.3. 1,2,3,4-тетра-О-бензоїл-5-С-[2-(4-метоксибензил)-2Н-тетразол-5-іл]-/-D-ксилопіранозу (IIIb2) і 1,2,3,4-тетра-O-бензоїл-5-С-[1-(4-метоксибензил)-1Н-тетразол-5-іл]-/-D-ксилопіранозу (IIIb1) У розчин 1,2,3,4-тетра-O-бензоїл-5-С-(тетразол-5-іл)-/-D-ксилопіранози (21,0 г, 33,12 ммоль) в тетрагідрофурані (210 мл) вводять триетиламін (5,5 мл, 39,46 ммоль) і хлорид 4метоксибензилу (5,0 мл, 36,71 ммоль). Реакційне середовище перемішують протягом однієї ночі із зворотним холодильником. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 4:1) до отримання суміші ізомерів (18,5 г, 73%) в формі кристалів світло-жовтого кольору. Спектр протонного ЯМР в CDCl3 показує відношення (IIIb1):(IIIb2) 2:1, причому для (IIIb1) відношення / становить 2:1 і для (IIIb2) відношення / становить 2:1. 1 ЯМР H (400 МГц, CDCl3) для аномерів α: 8,21-7,29 (м, 20Ha+20Hb, H-aro), 7,23 (д, 2Hb, J 8,5 Гц, H-aroPMBb), 7,17 (д, 2Ha, J 8,5 Гц, H-aroPMBa), 6,98 (д, 1Ha, J 3,5 Гц, H-1a), 6,96 (д, 1Hb, J 3,5 Гц, H-1b), 6,86 (д, 2Hb, J 8,5 Гц, h-aroPMBb), 6,75 (д, 2Ha, J 8,5 Гц, h-aroPMBa), 6,42 (т, 1Ha, J 10,0 Гц, H-3a), 6,33 (т, 1Hb, J 10,0 Гц, H-3b), 6,13 (т, 1Ha, J 10,0 Гц, H-4a), 5,84 (дд, 1Ha, J 3,5 Гц, J 10,0 Гц, H-2a), 5,76-5,63 (м, 3Ha+5Hb, CH2PhОCH3a, CH2PhОCH3b, H-5a, H-2b, H-4b, H-5b), 3,79 (с, 3Hb, OCH3b), 3,75 (с, 3Ha, OCH3S). 13 ЯМР C (100 МГц, CDCl3) для аномерів α: 165,8, 165,2, 164,5, 164,3, 164,2, 162,1 (C=O, C=N), 134,4-124,7 (C-aro), 114,5 {C-aroPMBa), 114,3 {C-aroPMBb), 90,0 (C-1a), 89,7 (C-1b), 71,1 (C-4a), 70,4, 70,2, (C-2a, C-3a), 69,9, 69,6, 69,5 (C-2b, C-3b, C-4b), 67,0 (C-5a), 66,0 (C-5b), 56,7 (CH2PhОCH3a), 55,3 (OCH3b), 55,2 (OCH3a), 52,1 (CH2PhОCH3b). + Розрахункова маса C42H34N4O10Na[M+Na] 777,2173, отримана 777,2181. 1.4. 2,3,4-три-О-бензоїл-5-С-[2-(4-метоксибензил)-2Н-тетразол-5-іл]-/-D-ксилопіранозу (IVb2) і 2,3,4-три-O-бензоїл-5-С-[1-(4-метоксибензил)-1Н-тетразол-5-іл]-/-D-ксилопіранозу (IVb1) У розчин суміші, отриманої на стадії 1.3 (13,4 г, 17,77 ммоль), в N,N-диметилформаміду (100 мл) при 0ºС вводять гідразинацетат (2,45 г, 26,60 ммоль) маленькими порціями протягом 15 хвилин. Реакційне середовище перемішують протягом 1 години при 0ºС, потім 4 годин при 7 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 60 кімнатній температурі. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 7:3) до отримання суміші ізомерів цільового продукту (8,0 г, 70%) в формі кристалів жовтого кольору. Спектр протонного ЯМР в CDCl3 показує відношення (Ivb2):(Ivb1) 2:1, причому для (IVb2) відношення / становить 5:1 і для (IVb1) відношення : становить 5:1. 1 ЯМР H (400 МГц, CDCl3)для аномерів α : 8,14-7,15 (м, 17Ha+17Hb, H-aro), 6,96 (д, 2Ha, J 9,0 Гц, h-aroPMBa), 6,71 (д, 2Hb, J 9,0 Гц, h-aroPMBb), 6,36-6,26 (м, 1Ha+1Hb, H-3a, H-3b), 6,02 (т, 1Ha, J 10,0 Гц, H-4a), 5,88 (д, 1Ha, J 3,5 Гц, H-1a), 5,86 (д, 1Hb, J 3,5 Гц, H-1b), 5,85-5,74 (м, 1Ha+3Hb, H-5a, H-5b, CH2PhОCH3b), 5,63 (с, 2Ha, CH2PhОCH3a), 5,51-5,42 (м, 1Ha+1Hb, H-4b, H2a), 5,31 (дд, 1Hb, J 3,5 Гц, J 10,0 Гц, H-2b), 3,82 (с, 3Hb, OCH3b), 3,75 (с, 3Ha, OCH3a). 13 ЯМР C (100 МГц, CDCl3) для аномерів α: 165,8, 165,5, 164,7, 162,9, 150,5 (C=O, C=N), 133,7-124,8 {C-aro), 114,5 {C-aroPMBb), 114,2 {C-aroPMBa), 90,9 (C-1a), 90,8 (C-1b), 72,1 (C-2a), 71,8 (C-2b або C-3b або C-4b), 71,2 (C-4a), 70,2 (C-2b або C-3b або C-4b), 70,0 (C-3a), 69,3 (C-2b або C-3b або C-4b), 64,1 (C-5a), 63,4 (C-5b), 56,7 (CH2PhОCH3a), 55,4 (OCH3b), 55,2 (OCH3a), 52,0 + Розрахункова маса C35H31N4O9[M+Н] 651,2091, отримана 651,2111. 1.5. 2,3,4-три-О-бензоїл-5-С-[2-(4-метоксибензил)-2Н-тетразол-5-іл]-- D-ксилопіранозилу трихлорацетимідат (Vb2) і 2,3,4-три-O-бензоїл-5-С-[1-(4-метоксибензил)-1Н-тетразол-5-іл]--Dксилопіранозилу трихлорацетимідат (Vb1) У розчин суміші, отриманої на стадії 1.4 (6,0 г, 9,23 ммоль), в дихлорметані (170 мл), при кімнатній температурі вводять 1,8-діазобицикло [5.4.0]ундек-7-ену (278 мкл, 1,86 ммоль), потім трихлорацетонітрил (14,6 мл, 184 ммоль). Реакційне середовище перемішують протягом 1 години при кімнатній температурі. Вводять розчин оцтової кислоти (105 мкл, 1,83 ммоль) у воді (50 мл). Фази розділяють, органічну фазу промивають водою (50 мл), потім сушать на сульфаті натрію. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (кремнезем попередньо нейтралізують промиванням розчином триетиламіну 5% в етилацетаті (циклогексан-етилацетат 7:3) для отримання суміші ізомерів цільового продукту (4,7 г, 65%) в формі жовтих кристалів. Спектр протонного ЯМР в CDCl3 показує відношення (Vb2):(Vb1) 3:1. 1 ЯМР H (400 МГц, CDCl3): 8,77 (с, 1H-b, NHb), 8,69 (с, 1Ha, NHa), 8,20-7,29 (м, 15Ha+17Hb, H-aro), 7,18 (д, 2Ha, J 8,5 Гц, H-aroPMBa), 6,99 (д, 2Hb, J 8,5 Гц, H-aroPMBb), 6,94 (м, 1Ha+1Hb, H-1a, H-1b), 6,74 (д, 2Ha, J 8,5 Гц, H-aroPMBa), 6,36 (т, 1Ha, J 10,0 Гц, H-3a), 6,29 (т, 1Hb, J 10,0 Гц, H-3b), 6,10 (т, 1Ha, J 10,0 Гц, H-4a), 5,80-5,69 (м, 2Ha+3Hb, H-2a, CH2PhОCH3b, H-5a, H-5b), 5,64 (с, 2Ha, CH2PhОCH3a), 5,62-5,55 (м, 2Hb, H-4b, H-2b), 3,84 (с, 3Hb, OCH3b), 3,75 (с, 3Ha, OCH3a). 13 ЯМР C (100 МГц, CDCl3): 165,6, 165,4, 164,4, 162,0, 160,5, 159,9 (C=O, C=N), 134,0-124,8 (C-aro), 1 14,6 {C-aroPMBb), 114,3 {C-aroPMBa), 93,1 (C-1a), 92,8 (C-1b), 70,9 (C-2b або C-3b або C-4b), 70,7 (C-4a), 70,5 (C-2a), 70,0 (C-2b або C-3b або C-4b), 69,8 (C-3a), 69,3 (C-2b або C-3b або C-4b), 66,9 (C-5a), 66,0 (C-5b), 56,5 (CH2PhOCH3a), 55,3 (OCH3b), 55,1 (OCH3a), 51,8 (CH2PhOCH3b). 1.6. 3-О-півалоїл-N-етоксикарбонілнорморфін-6-іл 2,3,4-три-О-бензоїл-5-С-[2-(4метоксибензил)-2Н-тетразол-5-іл]--D-ксилопіранозид У розчин суміші, отриманої на стадії 1.5 (36 г, 4,54 ммоль), і 3-О-півалоїл Nетоксикарбонілнорморфорфіну (1,0 г, 2,34 ммоль) в дихлорметані (50 мл) при 0ºС в атмосфері аргону вводять трифторметансульфоніл триметилсилану (1,7 мл, 9,38 ммоль). Реакційне середовище перемішують протягом 30 хвилин при 0ºС, потім 30 хвилин при кімнатній температурі. Вводять N-діізопропілетиламін (1 мл), суміш струшують протягом 15 хвилин, потім концентрують досуха при зниженому тиску. Залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 3:2) до отримання цільового продукту (1,7 г, 69%) у вигляді білих кристалів. Точка плавлення 185-188ºС. 1 ЯМР H (400 МГц, CDCl3): 7,97-7,28 (м, 15H, H-aro), 7,17 (м, 2H, H-aroPMB), 6,72 (м, 3H, HaroPMB, H-1), 6,54 (д, 1H, J 8,5 Гц, H-2), 6,13 (т, 1H, J 10,0 Гц, H-4’), 5,90 (т, 1H, J 10,0 Гц, H-3’), 5,72 (м, 1H, H-8), 5,67 (м, 1H, H-2’), 5,61 (д, 2H, J 5,0 Гц, CH2PhOCH3), 5,43 (д, 1H, J 7,0 Гц, H-1’), 5,32 (д, 1H, J 10,0 Гц, H-5’), 5,25 (м, 1H, H-7), 5,00-4,80 (м, 2H, H-9, H-5), 4,40 (м, 1H, H-6), 4,20 (м, 2H, OCH2CH3), 4,00 (м, 1H, H-16a), 3,74 (с, 3H, OCH3), 3,00 (м, 1H, H-16b), 2,84-2,74 (м, 2H, H10), 2,48 (м, 1H, H-14), 1,89 (м, 2H, H-15), 1,30 (м, 12H, C(CH3)3, OCH2CH3). 13 ЯМР C (100 МГц, CDCl3): 176,4, 165,7, 165,1, 164,5, 159,9 (C=O, C=N), 155,0, 150,5, 133,1, (C-aro), 130,7 (C-8), 129,8, 129,7, 129,6, 128,3, 128,2, 128,1, (C-aro), 127,4 (C-7), 122,2 (C-1), 119,3 (C-2), 114,3 (C-aroPMB), 99,4 (C-V), 89,9 (C-5), 72,9 (C-3’, C-6), 72,5 (C-2’), 71,5 (C-4’), 68,7 (C-5’), 8 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 61,6 (OCH2CH3), 56,6 (CH2PhOCH3), 55,2 (OCH3), 50,2 (C-9), 44,3 (C-13), 39,8 (C-14), 37,2 (C-16), 35,3 (C-15), 35,0 (C(CH3)3), 30,2 (C-10), 29,8 (C(CH3)3), 14,7 (OCH2CH3). + Розрахункова маса C59H57N5O14Na[M+Н] 1082,3800, отримана 1082,3802. 1.7. 3-О-півалоїл-N-етоксикарбонілнорморфін-6-іл 2,3,4-три-О-бензоїл-5-С-(тетразол-5-іл)-βD-ксилопіранозид Розчин сполуки, отриманої на стадії 1.6 (1,6 г, 1,51 ммоль), в трифтороцтової кислоті (4,5 мл, 60,6 ммоль) нагрівають із зворотним холодильником протягом 15 хвилин. Реакційне середовище концентрують досуха залишок обробляють в толуолі (2×10 мл) і повторно концентрують. Залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 1:2) до отримання цільового продукту (850 мг, 60%) у вигляді світло-жовтих кристалів. Точка плавлення 169-171ºС. 1 ЯМР H (400 МГц, CDCl3): 7,98-7,24 (м, 15H, H-aro), 6,76 (д, 1H, J 8,0 Гц, H-1 ), 6,58 (д, 1H, J 8,0 Гц, H-2), 6,01 (т, 1H, J 10,0 Гц, H-3’), 5,98-5,95 (м, 1H, H-8), 5,72 (м, 1H, H-4’), 5,62 (м, 1H, H2’), 5,41 (д, 1H, J 10,0 Гц, H-5’), 5,34-5,26 (м, 2H, H-1’ і H-7), 5,02-4,96 (м, 1H, H-9), 4,85 (м, 1H, H5), 4,38-4,31 (м, 1H, H-6), 4,22-4,13 (м, 2H, OCH2CH3, 4,07-3,98 (м, 1H, H-16a), 3,10-2,83 (м, 2H, H16b, H-10a), 2,82-2,72 (м, 1H, H-10b), 2,47 (м, 1H, H-14), 1,93-1,85 (м, 2H, H-15), 1,47 (с, 9H, C(CH3)3), 1,33-1,25 (м, 3H, OCH2CH3). 13 ЯМР C (100 МГц, CDCl3): 165,6, 165,1, 165,0 (C=O, C=N), 133,5, 132,4, 130,0, 129,8, 128,5, 128,4, 128,3 (C-aro, C-8, C-7), 122,5 (C-1), 119,9 (C-2), 90,9 (C-1’), 77,0 (C-6), 72,0 (C-2’ або C-3’), 71,9 (C-2’ або C-3’), 70,7 (C-4’), 68,3 (C-5’), 61,8 (OCH2CH3), 49,7 (C-9), 44,5 (C-13), 40,0 (C-14), 37,1 (C-16), 35,5 (C-15), 29,7 (C-10), 27,2 (C(CH3)3), 14,7 (OCH2CH3). + Розрахункова маса C51H49N5O13Na[M+Н] 962,3225, отримана 962,3211. 1.8. Трифторацетат морфін-6-іл 5-С-(тетразол-5-іл)--D-ксилопіранозиду (сполука 2) У суспензію гідриду літію і алюмінію (300 мг, 7,91 ммоль) в тетрагідрофурані (12 мл) вводять розчин сполуки, отриманої на стадії 1.7 (500 мг, 0,532 ммоль), в тетрагідрофурані (12 мл). Реакційне середовище перемішують протягом 1 години із зворотним холодильником. Вводять етилацетат для усунення надлишку гідриду літію і алюмінію і середовище доводять до рН 1 шляхом додавання розчину соляної кислоти 1N. Реакційне середовище концентрують досуха. Залишок очищають перший раз на хроматографічній колонці в зворотній фазі (чиста Н2О, потім (Н2О+0,1% трифтороцтової кислоти)-ацетонітрил 80:20) для видалення солей. Друге очищення препаративною хроматографією в зворотній фазі (градієнт (Н2О+0,1% трифтороцтової кислоти)-ацетонітрил від 95:5 до 20:80) дозволяє отримати цільову сполуку в формі білих кристалів (42 мг, 16%). Точка плавлення 204-207ºС. 1 ЯМР H (400 МГц, D2O): 6,74 (д, 1H, J 8,0 Гц, H-1), 6,65 (д, 1H, J 8,0 Гц, H-2), 5,73 (м, 1H, H8), 5,30 (м, 1H, H-7), 5,23 (д, 1H, J 5,5 Гц, H-5), 4,94-4,88 (м, 2H, H-1’, H-5’), 4,48 (м, 1H, H-6), 4,15 (м, 1H, H-9), 3,80 (т, 1H, J 9,5 Гц, H-4’), 3,69 (т, 1H, J 9,5 Гц, H-3’), 3,54 (м, 1H, H-2’), 3,37 (м, 1H, H-16a), 3,24 (м, 1H, H-10a), 3,10 (м, 1H, H-16b), 2,95 (с, 3H, NCH3), 2,95-2,83 (м, 2H, H-10b, H-14), 2,32-2,02 (м, 2H, H-15). 13 ЯМР C (100 МГц, D2O): 145,5 (C=N), 137,8, 134,0 (C-ipso), 131,1 (C-8), 129,0 (C-ipso), 126,0 (C-7), 123,3 (C-ipso), 120,4 (C-2), 117,7 (C-1), 102,3 (C-1’), 88,1 (C-5), 75,0 (C-3’), 73,3 (C-6), 73,0 (C-2’), 72,4 (C-4’), 69,3 (C-5’), 60,5 (C-9), 47,1 (C-16), 41,5 (C-13), 40,9 (NCH3), 38,4 (C-14), 32,4 (C15), 20,8 (C-10). + Розрахункова маса C23H28N5O7[M+Н] 486,1989, отримана 486,1982. Приклад 2: трифторацетат морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)--Dксилопіранозиду (сполука 5) 2.1. 3-О-ацетилморфін-6-іл 2,3,4-три-О-ацетил-5-С-(2-метил-1,3,4-оксадіазол-5-іл)--Dксилопіранозид Розчин трифторацетату морфін-6-іл 5-С-(тетразол-5-іл)--D-ксилопіранозиду (134 мг, 0,28 ммоль), отриманий на стадії 1.8 з прикладу 1, в оцтовому ангідриді (3 мл) кип'ятять із зворотним холодильником протягом однієї ночі. Реакційне середовище концентрують досуха, залишок обробляють толуолом (2×10 мл) і повторно концентрують. Продукт очищають хроматографією на силікагелі (хлороформ-метанол від 98:2 до 95:5) до отримання цільової сполуки (102 мг, 55%) у вигляді кристалів світло-жовтого кольору. Точка плавлення 180-186ºС. 1 ЯМР H (400 МГц, CDCl3): 6,77 (д, 1H, J 8,0 Гц, H-1), 6,59 (д, 1H, J 8,0 Гц, H-2), 5,71 (м, 1H, H-8), 5,37 (м, 2H, H-4’ і H-3’), 5,27 (м, 1H, H-7), 5,18 (м, 1H, H-2’), 4,99 (д, 1H, J 7,5 Гц, H-1’), 4,95 (д, 1H, J 5,5 Гц, H-5), 4,87 (м, 1H, H-5’), 4,31 (м, 1H, H-6), 3,71 (м, 1H, H-9), 3,07 (м, 1H, H-10a), 2,97-2,89 (м, 2H, H-16a, H-14), 2,62-2,52 (м, 8H, H-10b, CH3оксадіазол, NCH3, H-16b), 2,33 (с, 9 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 60 CH3CO), 2,28 (м, 1H, H-15a), 2,14 (с, 3H, CH3CO), 2,04 (с, 3H, CH3CO), 1,98 (м, 1H, H-15b), 1,93 (с, 3H, CH3CO). 13 ЯМР C (100 МГц, CDCl3): 175,9, 170,0, 169,4, 169,3, 165,3, 161,2 (C=O, C=N), 150,3, 132,0 (C-ipso), 130,9 (C-8), 130,6, 130,4 (C-ipso), 127,5 (C-7), 122,6 (C-1), 119,5 (C-2), 100,0 (C-V), 89,1 (C-5), 73,6 (C-6), 71,8 (C-3’ або C-4’), 71,0 (C-2’), 69,6 (C-3’ або C-4’), 67,9 (C-5’), 58,5 (C-9), 46,0 (C-16), 42,7 (C-13), 41,7 (NCH3), 38,9 (C-14), 33,8 (C-15), 21,5 (C-10), 20,7, 20,6, 20,4 (CH3CO), 11,0 (CH3оксадіазол). + Розрахункова C33H38N3O12[M+Н] 668,2455, отримана 668,2560. 2.2. Трифторацетат морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)-β- D-ксилопіранозиду (сполука 5) У розчин 3-О-ацетилморфін-6-іл 2,3,4-три-О-ацетил-5-С-(2-метил-1,3,4-оксадіазол-5-іл)--Dксилопіранозиду, отриманого на попередній стадії (100 мг, 0,15 ммоль), в метанолі (2 мл) при кімнатній температурі вводять метилат натрію (32 мг, 0,59 ммоль). Реакційне середовище перемішують протягом 3 годин при кімнатній температурі, потім нейтралізують шляхом + додавання смоли, що випускається під найменуванням Amberlyte Н ® (Rohm and Haas). Розчин фільтрують і фільтрат концентрують при зниженому тиску. Залишок очищають препаративною хроматографією в зворотній фазі (градієнт (Н2О+0,1% трифтороцтової кислоти)-ацетонітрил від 95:5 до 20:80) до отримання цільової сполуки в формі білих кристалів (34 мг, 46%). Точка плавлення 215-218ºС. 1 ЯМР H (300 МГц, D2O): 6,83 (д, 1H, J 8,0 Гц, H-1), 6,74 (д, 1H, J 8,0 Гц, H-2), 5,84 (м, 1H, H8), 5,46 (м, 1H, H-7), 5,32 (д, 1H, J 6,5 Гц, H-5), 5,00 (д, 1H, J 8,0 Гц, H-1’), 4,90 (м, 1H, H-5’), 4,59 (м, 1H, H-6), 4,26 (м, 1H, H-9), 3,92 (т, 1H, J 9,5 Гц, H-4’), 3,74 (т, 1H, J 9,5 Гц, H-3’), 3,59 (м, 1H, H-2’), 3,45-3,38 (м, 1H, H-16a), 3,29 (д, 1H, H-10a), 3,17 (м, 1H, H-16b), 3,03-2,92 (м, 5H, NCH3, H10b, H-14), 2,63 (с, 3H, CH3оксадіазол), 2,40-2,11 (м, 2H, H-15). 13 ЯМР C (75 МГц, D2O): 131,2 (C-8), 126,3 (C-7), 120,6 (C-2), 118,2 (C-1), 102,5 (C-1’), 88,2 (C-5), 75,0 (C-3’), 73,5 (C-6), 73,0 (C-2’ або C-4’), 71,4 (C-2’ або C-4’), 69,3 (C-5’), 60,7 (C-9), 47,4 (C-6), 41,1 (NCH3), 38,7 (C-14), 32,6 (C-15), 21,1 (C-10), 10,2 (CH3оксадіазол). + Розрахункова C25H30N3O8[M+Н] 500,2033, отримана 500,2021. Приклад 3: Трифторацетат морфін-6-іл 5-С-[5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-4Н1,2,4-триазол-3-іл]--D-ксилопіранозиду (сполука 6) 3.1. 1,2,3,4-тетра-О-бензоїл-5-С-[5-(4-метоксифеніл)-4-(2,2,2трифторетил)-4Н-1,2,4триазол-3-іл]-/-D-ксилопіранозу У розчин 1,2,3,4-тетра-O-бензоїл-5-С-(тетразол-5-іл)-/-D-ксилопіранози (10,0 г, 15,77 ммоль), отриманої на стадії 1.2 з прикладу 1, в толуолі (119 мл) вводятьтриетиламін (4,3 мл, 30,85 ммоль) і хлорид 2,2,2-трифтор-N-(4-метоксибензил)ацетимідоїлу (7,9 г, 31,47 ммоль). Реакційне середовище перемішують протягом однієї ночі із зворотним холодильником. Розчинник видаляють при зниженому тиску, і залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 1:1) до отримання цільового продукту (7,3 г, 56%) у вигляді кристалів світло-жовтого кольору. Спектр протонного ЯМР в CDCl3 показує відношення : 5:2. 1 ЯМР H (400 МГц, CDCl3): 8,28-7,29 (м, 22Hα+22Hβ, H-aro), 7,00 (д, 2Hα, J 8,5 Гц, HaroPMPa), 6,94 (д, 2Hβ, J 8,5 Гц, H-aroPMPβ), 6,84 (д, 1Hα, J 3,5 Гц, H-1α), 6,54 (т, 1Hβ, J 8,5 Гц, H-4β), 6,45 (м, 2Hα, H-3α, H-4α), 6,38 (д, 1Hβ, J 7,0 Гц, H-1β), 6,18 (т, 1Hβ, J 8,5 Гц, H-3β), 5,94 (дд, 1Hβ, J 7,0 Гц, J 8,5 Гц, H-2β), 5,76-5,69 (м, 2Hα, H-2α, H-5α), 5,61 (д, 1Hβ, J 8,5 Гц, H-5β), 5,13 (м, 1Hβ, CH2CF3β), 4,99 (м, 1Hα, CH2CF3α), 4,65-4,51 (м, 1Hα+1Hβ, CH2CF3α, CH2CF3β), 3,84 (с, 3Hα, 0CH3α), 3,83 (с, 3Hβ, OCH3β). 13 ЯМР C: (100 МГц, CDCl3) 166,0, 165,4, 165,2, 164,7 (C=O), 161,5, 156,8, 149,5 (C=N, CipsoPMP), 134,4-128,2 (C-aro), 117,5 {C-ipsoPMP), 114,6 (C-aroPMPα), 114,5 (C-aroPMPβ), 93,2 (C-1β), 90,1 (C-1α), 71,9 (C-2β або C-3β або C-4β), 70,3 (C-2α або C-2α або C-4α), 70,2 (C-2α або C-2α або C-4α), 70,0 (C-2β або C-3β або C-4β), 69,2 (C-2α або C-2α або C-4α), 69,1 (C-2β або C3β або C-4β), 66,1 (C-5α, C-5β), 55,4 (OCH3α, OCH3β), 45,4 (CH2CF3β), 45,0 (CH2CF3α). + Розрахункова маса C44H35F3N3O10 [M+Н] 822,2275, отримана 822,2291. 3.2. 2,3,4-три-О-бензоїл-5-С-[5-(4-метоксифеніл)-4-(2,2,2- трифторетил)-4Н-1,2,4-триазол-3іл]-/-D-ксилопіранозу У розчин сполуки, отриманої на стадії 3.1 (7,2 г, 8,77 моль), в N,N-диметилформаміді (50 мл) при 0ºС вводять маленькими порціями протягом 15 хвилин гідразинацетат (1,2 г, 13,0 ммоль). Реакційне середовище перемішують протягом 1 години при 0ºС, потім протягом 2,5 годин при кімнатній температурі. Вводять етилацетат (100 мл) і воду (50 мл). Фази розділяють. Водну фазу повторно екстрагують етилацетатом (1×50 мл). Об'єднані органічні фази сушать над сульфатом натрію. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 2:3) до отримання цільового продукту 10 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 60 (3,1 г, 49%) у вигляді білих кристалів. Спектр протонного ЯМР в CDCl3 показує відношення : 9:1. 1 ЯМР H (400 МГц, CDCl3) для аномеру α: 7,99-7,26 (м, 17H, H-aro), 6,76 (д, 2H, J 9,0 Гц, HaroPMP), 6,24 (т, 1H, J 10,0 Гц, H-3), 6,14 (т, 1H, J 10,0 Гц, H-4), 5,80 (д, 1H, J 10,0 Гц, H-5), 5,45 (д, 1H, J 3,0 Гц, H-1), 5,31 (м, 1H, CH2CF3), 5,07 (дд, 1H, J 3,0 Гц, J 10,0 Гц, H-2), 4,92 (м, 1H, CH2CF3), 3,72 (с, 3H, OCH3). 13 ЯМР C (100 МГц, CDCl3) для аномеру α: 165,8, 165,5, 165,1 (C=O) 161,3, 156,5, 151,3 (C=N, C-ipsoPMP), 133,2-128,2 (C-aro), 122,9 (C-ipso) 117,6 (C-ipsoPMP), 114,4 {C-aroPMP), 90,2 (C-1), 72,1 (C-2), 70,8 (C-3), 69,6 (C-4), 62,1 (C-5), 55,2 (OCH3), 45,3 (м, CH2CF3). + Розрахункова маса C37H31F3N3O9 [M+Н] 718,2012, отримана 718,2034. 3.3. Трихлорацетамід 2,3,4-три-О-бензоїл-5-С-[5-(4-метоксифеніл)-4-(2,2,2-трифторетил)4Н-1,2,4-триазол-3-іл]-/-D-ксилопіранозилу У розчин продукту, отриманого на стадії 3.2 (2,8 г, 3,91 ммоль), в дихлорметані (65 мл) при кімнатній температурі вводять 1,8-диазобицикло[5.4.0]ундек-7-ен (115 мкл, 0,770 ммоль), потім трихлорацетонітрил (7,8 мл, 77,8 ммоль). Реакційне середовище перемішують протягом 1 години при кімнатній температурі. Вводять розчин оцтової кислоти (45 мкл, 0,786 ммоль) у воді (25 мл). Фази розділяють, органічну фазу промивають водою (25 мл), потім сушать над сульфатом натрію. Розчинник видаляють при зниженому тиску і залишок очищають хроматографією на силікагелі (кремнезем, попередньо нейтралізований промиваннями розчином триетиламіну, 5% в етилацетаті) (циклогексан-етилацетат 7:3) до отримання цільового продукту (2,1 г, 63%) у вигляді білих кристалів. Спектр протонного ЯМР в CDCl3 показує відношення : 5:4. 1 ЯМР H (400 МГц, CDCl3): 8,78 (с, 1Hβ, NHβ), 8,77 (с, 1Hα, NHα), 8,00-7,31 (м, 17Hα+17Hβ, H-aro), 7,00 (м, 2Hα+2Hβ, H-aroPMPα, H-aroPMPβ), 6,78 (д, 1Hα, J 3,5 Гц, H-1α), 6,51 (т, 1Hα, J 10,0 Гц, H-4α), 6,44-6,34 (м, 1Hα+1Hβ, H-3α, H-4β), 6,21 (д, 1Hβ, J 8,0 Гц, H-1β), 6,13 (т, 1Hβ, J 9,5 Гц, H-3β), 5,92 (дд, 1Hβ, J 8,0 Гц, J 9,5 Гц, H-2β), 5,69 (д, 1Hα, J 10,0 Гц, H-5α), 5,62 (дд, 1Hα, J 3,5 Гц, J 10,0 Гц, H-2α), 5,52 (д, 1Hβ, J 9,5 Гц, H-5β), 5,27 (м, 1Hβ, CH2CF3β), 5,00 (м, 1Hα, CH2CF3α), 4,58 (м, 1Hα+1Hβ, CH2CF3α, CH2CF3β), 3,87 (с, 3Hα+3Hβ, ОCH3α, OCH3β). 13 ЯМР C (100 МГц, CDCl3) 165,7, 165,4, 164,7, 164,4, (C=O) 161,4, 149,2 (C=N, C-ipsoPMP), 133,7-128,2 (C-aro), 117,7 (C-ipsoPMP), 114,5 (C-aroPMP), 96,6 (C-1β), 93,5 (C-1α), 72,5, 70,5, 70,2, 70,0, 69,3, 68,9 (C-2α, C-3β, C-3α, C-3β, C-4α, C-4β), 66,2 (C-5α, C-5β), 55,4 (ОCH3α, OCH3β), 45,1 (м, CH2CF3α, CH2CF3β). 3.4. 3-О-півалоїл-N-етоксикарбонілнорморфін-6-іл 2,3,4-три-О-бензоїл-5-С-[5-(4метоксифеніл)-4-(2,2,2-трифторетил)-4Н-1,2,4-триазол-3-іл]--D-ксилопіранозид У розчин продукту, отриманого на стадії 3.3 (1,20 г, 1,40 ммоль), і 3-О-півалоїл-Nетоксикарбонілнорморфіну (410 мг, 0,96 ммоль) в дихлорметані (50 мл) при 0ºС в атмосфері аргону вводять трифторметансульфоніл триметилсилану (696 мкл, 3,84 ммоль). Реакційне середовище перемішують протягом 30 хвилин при 0ºС, потім протягом 30 хвилин при кімнатній температурі. Вводять N-діізопропілетиламін (0,5 мл), суміш перемішують 15 хвилин, потім концентрують досуха при зниженому тиску. Залишок очищають хроматографією на силікагелі (циклогексан-етилацетат 3:7) до отримання цільового продукту (680 мг, 63%) у вигляді оранжевих кристалів. Точка плавлення 194ºС. 1 ЯМР H (400 МГц, CDCl3) 7,98-7,29 (м, 17H, H-aro), 7,03 (д, 2H, J 9,0 Гц, H-aroPMP), 6,71 (д, 1H, J 8,0 Гц, H-1), 6,54 (д, 1H, J 8,0 Гц, H-2), 6,00 (м, 2H, H-3’, H-4’), 5,73 (м, 1H, H-8), 5,66 (м, 1H, H-2’), 5,41 (м, 2H, H-1’, H-5’), 5,30 (м, 1H, H-7), 4,98 (м, 2H, H-9, CH2CF3), 4,86-4,76 (м, 2H, H-5, CH2CF3), 4,30 (м, 1H, H-6), 4,17 (м, 2H, OCH2CH3), 4,01 (м, 1H, H-16a), 3,89 (с, 3H, OCH3), 3,072,84 (м, 2H, H-16b, H-10a), 2,75 (м, 1H, H-10b), 2,47 (м, 1H, H-14), 1,88 (м, 2H, H-15), 1,27 (м, 12H, C(CH3)3, OCH2CH3). 13 ЯМР C (100 МГц, CDCl3) 165,6, 165,1, 165,0, (C=O) 161,4, 156,9, 149,6 (C=N, C-ipsoPMP), 133,4 (C-aro), 130,7 (C-8), 129,9-127,8 (C-aro, C-7), 122,5 (C-1), 118,0 (C-ipsoPMP), 119,4 (C-2), 114,6 {C-aroPMP), 100,6 (C-1’), 90,2 (C-5), 74,0 (C-6), 72,3 (C-2’ або C-3’ або C-4’), 71,8 (C-2’ або C-3’ або C-4’), 70,3 (C-2’, C-3’ або C-4’), 69,9 (C-5’), 61,7 (OCH2CH3), 55,4 (OCH3), 48,1 (C-9), 44,5 (CH2CF3 або C-13), 39,8 (C-14), 37,2 (C-16), 35,3 (C-15), 35,0 (C(CH3)3), 30,0 (C-10), 27,1 (C(CH3)3), 14,7 (OCH2CH3). + Розрахункова маса C61H58F3N4O14[M+Н] 1127,3902, отримана 1127,3889. 3.5. Трифторацетат морфін-6-іл 5-С-[5-(4-метоксифеніл)-4-(2,2,2- трифторетил)-4Н-1,2,4триазол-3-іл]--D-ксилопіранозиду (сполука 6) У суспензію гідриду літію і алюмінію (311 мг, 8,19 ммоль) в тетрагідрофурані (13 мл) вводять розчин сполуки, отриманої на стадії 3.4 (622 мг, 0,55 ммоль) в тетрагідрофурані (13 11 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 мл). Реакційне середовище перемішують протягом 1 години із зворотним холодильником. Для усунення надлишку LiAlH4 вводять етилацетат і рН середовища доводять до 1 шляхом додавання розчину соляної кислоти 1N. Реакційне середовище концентрують досуха. Залишок очищають двома послідовними проходами через хроматографічну колонку в зворотній фазі (чиста Н2О, потім (Н2О+0,1% трифтороцтова кислота)-CH3CN 80:20) для видалення солей. Останнє очищення препаративною хроматографією в зворотній фазі (градієнт (Н2О+0,1% трифтороцтова кислота)-ацетонітрил від 95:5 до 20:80) дозволяє отримати цільову сполуку у вигляді білих кристалів (35 мг, 10%). Точка плавлення 274-276ºС. 1 ЯМР H (400 МГц, D2O): 7,51 (д, 2H, J 8,5 Гц, H-aroPMP), 7,15 (д, 2H, J 8,5 Гц, H-aroPMP), 6,72 (д, 1H, J 8,0 Гц, H-1), 6,64 (д, 1H, J 8,0 Гц, H-2), 5,67 (м, 1H, H-8), 5,29 (м, 1H, H-7), 5,22 (д, 1H, J 6,0 Гц, H-5), 5,09-4,90 (м, 3H, CH2CF3, H-1’), 4,82 (д, 1H, J 9,5 Гц, H-5’), 4,41 (м, 1H, H-6), 4,18 (м, 1H, H-9), 4,12 (т, 1H, J 9,5 Гц, H-4’), 3,88 (с, 3H, OCH3), 3,71 (т, 1H, J 9,5 Гц, H-3’), 3,57 (дд, 1H, J 8,0 Гц, J 9,5 Гц, H-2’), 3,36 (м, 1H, H-16a) 3,26 (м, 1H, H-10a), 3,12-3,03 (м, 1H, H-16b), 2,96 (с, 3H, N-CH3), 2,93-2,84 (м, 2H, H-10b, H-14), 2,31-2,22 (м, 2H, H-15). 13 ЯМР C (100 МГц, D2O): 130,9 (C-aroPMP), 126,0 (C-7), 120,4 (C-2), 117,7 (C-1), 116,8 (CipsoPMP), 114,7 (C-aroPMP), 102,6 (C-1’), 88,1 (C-5), 75,0 (C-3’), 73,6 (C-6), 72,8 (C-2’), 72,0 (C-4’), 67,9 (C-5’), 60,5 (C-9), 55,4 (OCH3), 47,2 (C-16), 46,6 (CH2CF3), 40,9 (NCH3), 38,4 (C-14), 32,4 (C15), 20,8 (C-10). + Розрахункова C33H36F3N4O8[M+Н] 673,2485, отримана 673,2482. Приклад 4: Трифторацетат морфін-6-іл 5-С-(тетразол-5-іл)-/-D-ксилопіранозиду (сполука 1) 4.1. 3-О-півалоїл-N-етоксикарбонілнорморфін-6-іл 2,3,4-три-О-бензоїл-5-С-(тетразол-5-іл)/-D-ксилопіранозиду Розчин 3-О-півалоїл-N-етоксикарбонілнорморфін-6-іл 2,3,4-три-О-бензоїл-5-С-[2-(4метоксибензил)-2Н-тетразол-5-іл]--D-ксилопіранозиду (1,6 г, 1,51 ммоль), отриманий на стадії 1.6 з прикладу 1, в трифтороцтової кислоті (4,5 мл, 60,6 ммоль) нагрівають із зворотним холодильником протягом 45 хвилин. Реакційне середовище концентрують досуха, залишок обробляють толуолом (2×10 мл) і знову концентрують. Фільтрування на силікагелі (етилацетат) дозволяє видалити аполярні домішки. Залишок (1,3 г) використовують на стадії відновлення без додаткового очищення. 4.2. трифторацетат морфін-6-іл 5-С-(тетразол-5-іл)-/-D-ксилопіранозиду (сполука 1) Трифторацетат морфін-6-іл 5-С-(тетразол-5-іл)-/-D-ксилопіранозиду синтезують з 3-Опівалоїл-N-етоксикарбонілнорморфін-6-ілу 2,3,4-три-О-бензоїл-5-С-(тетразол-5-іл)-/-Dксилопіранозиду, отриманого на попередній стадії (1,30 г, 1,38 ммоль), способом, описаним на стадії 1.8 з прикладу 1. Отримують цільову суміш аномерів у вигляді світло-жовтих кристалів (215 мг, 32%). Спектр протонного ЯМР в D2O показує відношення : 1:1. 1 ЯМР H (400 МГц, D2O): 6,83-6,79 (м, 1Hα+1Hβ, H-1α, H-1β), 6,70 (м, 1Hα+1Hβ, H-2α, H-2β), 5,91 (м, 1Hα, H-8α), 5,82 (м, 1Hβ, H-8β), 5,60 (д, 1Hα, J 10,0 Гц, H-5’α), 5,48 (м, 1Hα, H-7α), 5,39 (м, 1Hβ, H-7β), 5,31 (д, 1Hα, J 4,0 Гц, H-1’α), 5,28 (д, 1Hβ, J6,0 Гц, H-5β), 5,13 (д, 1Hα, J 6,0 Гц, H5α), 5,01-4,96 (м, 2Hβ, H-5’β, H-1’β), 4,55 (м, 1Hβ, H-6β), 4,43 (м, 1Hα, H-6α), 4,26-4,17 (м, 1Ha+1Hβ, H-9α, H-9β), 3,99 (т, 1Hα, J 9,5 Гц, H-3’α), 3,82 (дд, 1Hα, J 4,0 Гц, J 9,5 Гц, H-2’α), 3,783,74 (м, 1Hα+2Hβ, H-4’α, H-3’β, H-4’β), 3,59 (м, 1Hβ, H-2’β), 3,41-3,38 (м, 1Hα+1Hβ, H-16aα, H16aβ), 3,33-3,27 (м, 1Hα+1Hβ, H-10aα, H-10aβ), 3,17-3,08 (м, 1Hα+1Hβ, H-16bα, H-16bβ), 3,00 (с, 3Hα+3Hβ, NCH3α, NCH3β), 3,00-2,88 (м, 2Hα+2Hβ, H-10bα, H-10bβ, H-14α, H-14β), 2,37-2,07 (м, 2Hα+2Hβ, H-15α, H-15β). 13 ЯМР C (100 МГц, D2O): 136,5 (C-ipso), 131,2 (C-8α), 130,4 (C-8β), 129,0 (C-ipso), 126,5 (C7α), 126,1 (C-7β), 123,3 (C-ipso), 120,5 (C-2α, C-2β), 117,8 (C-1α, C-1β), 102,5 (C-1’β), 100,0 (C1’α), 90,1 (C-5α), 88,2 (C-5β), 74,9, 74,7, 73,6, 72,9, 72,5, 72,4, 72,3, 71,1 (C-2’α, C-2’β, C-3’α, C-3’β, C-4’α, C-4’β, C-6α, C-6β), 68,9 (C-5’β), 65,6 (C-5’α), 60,5 (C-9α, C-9β), 47,2 (C-16α, C-16β), 41,5 (C13α, C-13β), 40,9 (NCH3Oα, NCH3β), 38,7 (C-14α), 38,4 (C-14β), 32,4 (C-15α, C-15β), 20,9 (C-10α, C-10β). + Розрахункова маса C23H28N5O7[M+Н] 486,1989, отримана 486,1979. Приклад 5: Трифторацетат морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)--Dксилопіранозиду (сполука 4) 5.1. Трифторацетат 3-О-ацетил-морфін-6-іл 2,3,4-три-О-ацетил-5-С-(2-метил-1,3,4оксадіазол-5-іл)--D-ксилопіранозиду і трифторацетат 3-О-ацетил-морфін-6-іл 2,3,4-три-Оацетил-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-/-D-ксилопіранозиду 12 UA 104302 C2 5 10 15 20 25 30 35 40 45 50 55 Розчин трифторацетату морфін-6-іл 5-С-(тетразол-5-іл)-/-D-ксилопіранозиду (300 мг, 0,62 ммоль), отриманого на стадії 4.2 з прикладу 4, в оцтовому ангідриді (7 мл) нагрівають із зворотним холодильником протягом ночі. Реакційне середовище концентрують досуха, залишок обробляють толуолом (2×10 мл) і знову концентрують. Продукт очищають на колонці з кремнеземом (CHCl3-CH3OH від 98:2 до 95:5) до отримання двох фракцій: - однієї, що містить чистий аномер (45 мг) - іншої, що містить суміш аномерів і (92 мг). Спектр протонного ЯМР в CDCl3 показує відношення ::2:3, що визначається ЯМР і ВЕРХ. Загальний вихід реакції становить 33%. 1 ЯМР H (400 МГц, CDCl3) для аномерів α: 6,82 (д, 1H, J 8,0 Гц, H-1), 6,61 (д, 1H, J 8,0 Гц, H2), 5,74 (м, 1H, H-8), 5,69 (т, 1H, J 10,0 Гц, H-3’), 5,63 (д, 1H, J 10,0 Гц, H-5’), 5,40 (д, 1H, J 4,0 Гц, H-1’), 5,37-5,30 (м, 2H, H-4’, H-7), 5,01-4,96 (м, 2H, H-2’, H-5), 4,14 (м, 1H, H-6), 3,60 (м, 1H, H-9), 3,10 (м, 1H, H-10a), 2,80 (м, 1H, H-16a), 2,70-2,50 (м, 9H, CH3оксадіазол, NCH3, H-10b, H-14, H16b), 2,34 (с, 3H, CH3CO), 2,31-2,25 (м, 1H, H-15a), 2,08 (с, 3H, CH3CO), 2,05 (с, 3H, CH3CO), 2,00 (м, 1H, H-15b), 1,95 (с, 3H, CH3CO). 13 ЯМР C (100 МГц, CDCl3) для аномерів α: 170,2, 169,2, 168,6, 164,9, 162,2 (C=O, C=N), ’ 122,7 (C-1), 119,4 (C-2), 97,6 (C-1’), 91,4 (C-5), 76,7 (C-6), 70,6 (C-2 ), 70,0 (C-4’), 69,2 (C-3’), 64,2 (C-5’), 59,2 (C-9), 46,4 (C-16), 42,5 (NCH3), 33,5 (C-15), 21,3 (C-10), 20,7, 20,6, 20,5 (CH3CO), 11,0 (CH3-оксадіазол). + Розрахункова маса C33H38N3O12[M+Н] 668,2455, отримана 668,2560. 5.2. Трифторацетат морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)-- D-ксилопіранозиду (сполука 4) У розчин трифторацетату 3-О-ацетил-морфін-6-іл 2,3,4-три-О-ацетил-5-С-(2-метил-1,3,4оксадіазол-5-іл)--D-ксилопіранозиду (45 мг, 0,07 ммоль) в метанолі (0,5 мл) при кімнатній температурі вводять метилат натрію (14 мг, 0,26 ммоль). Реакційне середовище перемішують протягом 3 годин при кімнатній температурі, потім нейтралізують шляхом введення смоли + Amberlyte Н ® (Rohm and Haas). Розчин фільтрують і фільтрат концентрують при зниженому тиску до отримання трифторацетату морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)-α-Dксилопіранозиду (31 мг, 92%) у вигляді світло-жовтих кристалів. 1 ЯМР H (400 МГц, CD3OD) для аномеру α: 8,54 (с, 1H, PhOH), 6,57 (д, 1H, J 8,0 Гц, H-1), 6,46 (д, 1H, J 8,0 Гц, H-2), 5,86 (м, 1H, H-8), 5,49 (д, 1H, J 10,0 Гц, H-5’), 5,39 (м, 1H, H-7), 5,13 (д, 1H, J4,0 Гц, H-1’), 4,95 (д, 1H, J 6,0 Гц, H-5), 4,24 (м, 1H, H-6), 3,84 (т, 1H, J 9,5 Гц, H-3’), 3,75 (дд, 1H, J 9,5 Гц, J 10,0 Гц, H-4’), 3,60-3,55 (м, 2H, H-9, H-2’), 3,08 (м, 1H, H-10a), 2,76-2,70 (м, 2H, H14, H-16a), 2,59 (с, 3H, NCH3), 2,56 (с, 3H, CH3оксадіазол), 2,55-2,45 (м, 2H, H-10b, H-16b), 2,12 (м, 1H, H-15a), 1,84 (м, 1H, H-15b). 13 ЯМР C (100 МГц, CD3OD) для аномеру α: 166,4, 166,3 (C=N), 147,6, 140,0 (C-ipso), 131,6 (C-8), 130,9 (C-ipso), 129,1 (C-7), 125,5 (C-ipso), 120,6 (C-2), 118,2 (C-1), 102,1 (C-1’), 92,1 (C-5), 78,0 (C-6), 74,7 (C-3’), 73,4 (C-2’), 73,3 (C-4’), 67,6 (C-5’), 60,9 (C-9), 47,7 (C-13), 44,6 (C-16), 42,5 (NCH3), 40,7 (C-14), 35,4 (C-10), 22,3 (C-15), 10,8 (CH3оксадіазол). + Розрахункова маса C25H30N3O8[M+Н] 500,2033, отримана 500,2029 ((). Приклад 6: Трифторацетат морфін-6-іл 5-С-(2-метил-1,3,4-оксадіазол-5-іл)-/-Dксилопіранозиду (сполуки 3) Той же протокол, що описаний на стадії 5.2 з прикладу 5, використовують виходячи з суміші 3-О-ацетил-морфін-6-іл 2,3,4-три-О-ацетил-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-/β-Dксилопіранозиду (: 2:3)(92 мг, 0,14 ммоль), отриманої на стадії 5.1 з прикладу 5. Цільову суміш аномерів отримують у вигляді світло-жовтих кристалів (62 мг, 90%). Спектр протонного ЯМР в CDCl3 показує відношення : 2:3, що визначається ЯМР і ВЕРХ. + Розрахункова маса C25H30N3O8[M+Н] 500,2033, отримана 500,2585 (: 2:3). Нижченаведена таблиця ілюструє хімічні структури і фізичні властивості декількох прикладів сполук за винаходом. На цій таблиці: - в колонці «аномер» «» і «» означають відповідно чисті аномери і «/» означає суміш останніх, причому відношення в дужках є відношенням (:); - в колонці «маса» приведена кінцева маса сполуки, отриманої способом хімічної іонізації; - в колонці «точка плавлення» вказана величина точки плавлення сполуки в градусах Цельсія; - в колонці «D» вказана ротаційна здатність сполуки в градусах; в дужках вказані розчинник і виміряна концентрація і - в колонці «сіль», «CF3COO» вказана сполука в формі трифторацетату. 13 UA 104302 C2 Таблиця 1 1 тетразол /(1/1) 486,1979 PF(C) точка плавлення 2 тетразол β 486,1982 204-207 2-метил-1,3,4оксадіазол 2-метил-1,3,4оксадіазол 2-метил-1,3,4оксадіазол 5(4-метоксифеніл)-4(2,2,2трифторетил)1,2,4триазол /(2/3) 500,2585 CF3COOH 500,2029 CF3COOH β 500,2021 215-218 CF3COOH β 673,2482 274-276 -72 (с=0,5, СН3ОН) CF3COOH N 3 4 5 6 5 10 15 20 25 30 35 аномер R1 маса D сіль -116 (с=0,5, СН3ОН) CF3COOH CF3COOH Біологічна активність Сполуки за винаходом були піддані фармакологічним дослідним випробуванням, що дозволяють визначити їх аналгезуючу дію. Проводилися випробування, що полягають у вимірюванні активності in vivo сполук за винаходом по захисній рефлекторній відповіді. При такому підході латентний період захисної рефлекторної відповіді тварини вимірювався як контроль болю. Тест “Tail-Flick" Проведення досліду Аналгетичну активність визначали в тесті “Tail-Flick", який проводився на самцях миші Swiss (Iffa Credo). Цей тест оснований на спонтанному захисному рефлексі відсмикування хвоста тварини, викликаного тепловим больовим подразненням (з інфрачервоного джерела). Тест “Tail-Flick" (тест Amour et SmitH, 1941, Pharmacol Exp Ther; 72: 74-79) полягає в тому, що після введення продукту хвіст миші вміщували в сфокусовану точку інфрачервоного джерела так, щоб проводити больове теплове подразнення (температура поверхні приблизно 55-60°С). Вимірювання часу реакції (TR) миші (латентний період між моментом появи світлового променя і моментом, коли миша відсмикувала хвіст) дублювали з різними періодами від 20 хвилин до 120 хвилин після введення продукту. Теплову інтенсивність регулювали так, щоб це рефлекторне відсмикування складало від 0,5 до 3,5 секунд у контрольних тварин і було довільним критерієм для мінімальної аналгезії (0%). Два вимірювання часу реакції проводили до введення продукту кожній миші для встановлення базового часу вимірювання. Максимальний час, що дорівнює 8 секундам, був вибраний як максимальний час реакції, щоб не викликати опікового пошкодження тканин у тварин і бути довільно вибраним критерієм для максимальної аналгезії (100%). Час реакції збільшився за допомогою анальгетиків в порівнянні з контрольною твариною, що не отримувала лікування. Продукти вводили підшкірно і перорально в дозах, що складали від 1,25 до 30 мг/кг (вираженим в солі). Результати Результати, отримані відносно сполук за винаходом, представлені в Таблиці 2, в якій приведені наступні дані: - максимальна аналгетична активність в процентах (індекс % МРЕ max), отримана по кожній сполуці (в тестованій дозі), - DE50 (виражена в мг/кг), що відповідає ефективній дозі кожної сполуки, для якої була отримана 50%-на аналгезія; останню обчислюють за часом, що пройшов після введення сполук; і - тривалість аналгезуючої дії для даної дози. Процент аналгетичної активності (% МРЕ) розраховували за наступною формулою: % МРЕ=(TR після введення - TR до введення)*100/(TRmax - TR до введення) 14 UA 104302 C2 Таблиця 2 № 1 2 3 4 5 6 5 10 15 20 25 30 35 40 Сполуки (R1 і тип аномеру, про який йде мова) (тетразол /) (тетразол ) (2-метил-1,3,4оксадіазол /) (2-метил-1,3,4оксадіазол ) (2-метил-1,3,4оксадіазол ) (5-(4-метоксифеніл)-4(2,2,2трифторетил)1,2,4триазол ) тривалість дії, хвилини (доза, мг/кг, сек) 50(10) 100(1,25) DE50 60 мін після введення, мг/кг 10 120(5) 65(10) 8 90(10) 100(1,25) 120(1,25) % МРЕ max (доза, мг/кг, сек.) >120(10) >120(1,25) Результати показують, що сполуки за винаходом мають потужну аналгетичну активність (>50%) в дозах від 1,25 мг/кг до 10 мг/кг при підшкірному введенні (вимірювання через 60 хвилин після введення) і в дозах від 2,5 до 30 мг/кг при пероральному введенні (вимірювання через 60 хвилин після введення). Ця аналгетична активність є стійкою і тривалою, більше 120 хвилин після введення в стандартній дозі. З найбільш активних сполук, активність яких оцінювалася при пероральному введенні, як приклад можна привести сполуку n5, що має максимальний процент аналгетичної активності (індекс % МРЕ max) 78 в дозі 10 мг/кг і DE50 через 60 хвилин менше 2,5 мг/кг. Таким чином, сполуки за винаходом мають аналгетичну активність. Сполуки за винаходом можна використовувати, таким чином, для отримання лікарських засобів, зокрема, лікарських засобів, призначених для лікування або попередження болю. Таким чином, відповідно до іншого аспекту винаходу його об'єктом є лікарські засоби, що містять сполуку формули (I), або сіль приєднання останньої з фармацевтично прийнятною кислотою, або гідрат або сольват. Ці лікарські засоби знаходять своє застосування в терапії, зокрема, в лікуванні і попередженні гострого або хронічного болю, зокрема, периферичного або пов'язаного із запальними захворюваннями, такими як артрит, ревматоїдний артрит, остеоартрит, спондиліт, подагра, васкуліт, хвороба Крона і синдром подразненої товстої кишки, невропатичні, м’язові, кісткові, післяопераційні болі, мігрень, ломбальгія, болі, пов'язані з раком, діабетом або СНІДом. Сполуки за винаходом знаходять також застосування в лікуванні сексуальних дисфункцій і, зокрема, в лікуванні передчасної еякуляції у чоловіків, для яких була продемонстрована активність сполуки аналгетичного типу. Відповідно до іншого аспекту даний винахід належить до фармацевтичних композицій, що містять як активну речовину сполуку за винаходом. Ці фармацевтичні композиції містять ефективну дозу щонайменше однієї сполуки за винаходом або фармацевтично прийнятну сіль, гідрат або сольват вказаної сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. Вказані ексципієнти вибирають відповідно до лікарської форми і необхідного способу введення із звичайних ексципієнтів, відомих фахівцеві. У фармацевтичних композиціях по даному винаходу для перорального, сублінгвального, підшкірного, внутрішньом'язового, внутрішньовенного, топічного, місцевого, інтратрахеального, інтраназального, черезшкірного або ректального, очного введення, активну речовину вказаної вище формули (I) або її можливу сіль, сольват або гідрат можна вводити в стандартній формі в суміші з традиційними фармацевтичними ексципієнтами тваринам і людині для лікування вказаних вище порушень або захворювань. До відповідних стандартних лікарських форм належать форми для перорального введення, такі як таблетки, м'які або тверді желатинові капсули, порошки, гранули і питні розчини або суспензії, форми для під’язикового, щічного, інтратрахеального, інтраокулярного, інтраназального введення, шляхом інгаляції, форми для топічного, черезшкірного, підшкірного, 15 UA 104302 C2 5 10 внутрішньом'язового або внутрішньовенного введення і форми для ректального введення і імплантати. Для топічного нанесення можна використати сполуки за винаходом в складі кремів, мазей або лосьйонів. Як приклад стандартна лікарська форма сполуки за винаходом в формі таблетки може містити наступні компоненти: Сполука за винаходом 50,0 мг Маніт 223,75 мг Кроскармелоза натрієва 6,0 мг кукурудзяний крохмаль 15,0 мг Гідроксипропілметилцелюлоза 2,25 мг Стеарат магнію 3,0 мг Відповідно до іншого з своїх аспектів винахід також належить до способу лікування вказаних вище патологій, який включає введення пацієнту ефективної дози сполуки за винаходом, або однієї з її фармацевтично прийнятних солей, або гідратів або сольватів. 15 ФОРМУЛА ВИНАХОДУ 1. Сполука загальної формули (І) HO 2 3 1 11 4 R1 HO 25 30 35 40 45 O 1' HO 20 5' 4' 2' 3' OH O 16 13 5 10 15 12 O 14 9 N 8 6 7 , (I) в якій: R1 означає 5-членну гетероциклічну ароматичну групу, можливо заміщену одним або декількома замісниками, вибраними з атомів галогену і (С 1-С4)алкілу, галогену, гідроксилу, оксо, гало(С1-С4)алкілу, гало(С1-С4)алкілокси, С1-С4)алкілокси, арил(С1-С4)алкілу і арилу, причому вказана арильна група можливо заміщена однією або декількома групами, вибраними з груп: (С1-С4)алкілу, гало(С1-С4)алкілу, гідроксилу і (С1-С4)алкілокси, у формі основи або солі приєднання з кислотою, а також у формі гідрату або сольвату. 2. Сполука загальної формули (І) за п. 1, де вказана сполука має одну або декілька наступних характеристик: - гетероциклічну ароматичну групу вибирають з піролу, фурану, тіофену, імідазолу, триазолу, тетразолу, оксазолу, ізоксазолу, оксадіазолу, тіазолу, ізотіазолу і тіадіазолу, і - якщо гетероциклічна ароматична група заміщена однією або декількома групами, вказану групу вибирають з метилу, етилу, пропілу, ізопропілу, бутилу, ізобутилу, трет-бутилу, фторметилу, дифторметилу, трифторметилу, хлорметилу, дихлорметилу, трихлорметилу, фторетилу, дифторетилу, трифторетилу, хлоретилу, дихлоретилу, трихлоретилу, метоксифенілу, етоксифенілу, пропоксифенілу і бутилоксифенілу. 3. Сполука загальної формули (І) за п. 1, де: - вказану гетероциклічну ароматичну групу вибирають з тетразолу, триазолу і оксазолу, і - якщо вказана гетероциклічна ароматична група заміщена однією або декількома групами, вказану групу вибирають з метилу, трифторетилу і п-метоксифенілу. 4. Сполука загальної формули (І) за будь-яким з пп. 1-3, вибрана з: - морфін-6-іл-5-С-(тетразол-5-іл)-/-D-ксилопіранозиду (1/1), - морфін-6-іл-5-С-(тетразол-5-іл)--D-ксилопіранозиду, - морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)-/-D-ксилопіранозиду (2/3), - морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозиду, - морфін-6-іл-5-С-(2-метил-1,3,4-оксадіазол-5-іл)--D-ксилопіранозиду і морфін-6-іл-5-С-[5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-4Н-1,2,4-триазол-3-іл]--Dксилопіранозиду. 16 UA 104302 C2 5 5. Лікарський засіб, який відрізняється тим, що він містить сполуку загальної формули (І) за будь-яким з пп. 1-4 або сіль приєднання цієї сполуки з фармацевтично прийнятною кислотою, або гідрат або сольват сполуки формули (І). 6. Фармацевтична композиція, яка відрізняється тим, що вона містить сполуку загальної формули (І) за будь-яким з пп. 1-4 або фармацевтично прийнятну сіль, гідрат або сольват цієї сполуки, а також щонайменше один фармацевтично прийнятний ексципієнт. 7. Застосування сполуки загальної формули (І) за будь-яким з пп. 1-4 для отримання лікарського засобу, призначеного для лікування або попередження болю. 8. Сполука загальної формули (III) 10 R1 PG2O PG2O O OPG2 PG2O 15 , (III) в якій: R1 такий, як визначений в п. 1, і PG2 означає бензоїльну групу. 9. Сполука загальної формули (III) за п. 8, де R1 вибирають з тетразолу, 1,2,3,4-тетра-Обензоїл-5-С-2-(4-метоксибензил)-2Н-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4метоксибензил)-1Н-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу. 10. Сполука загальної формули (IV) 20 R1 PG2O PG2O 25 O PG2O OH , (IV) в якій: R1 такий, як визначений в п. 1, і PG2 означає бензоїльну групу. 11. Сполука загальної формули (IV) за п. 10, де R1 вибирають з 1,2,3,4-тетра-О-бензоїл-5-С-2(4-метоксибензил)-2Н-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4-метоксибензил)-1H-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу. 12. Сполука загальної формули (V) 30 R1 PG2O PG2O 35 O PG2O OLG , (V) в якій: R1 такий, як визначений в п. 1, РG2 означає бензоїльну групу, і LG означає трихлорацетамідатну групу. 13. Сполука загальної формули (V) за п. 12, де R1 вибирають з 1,2,3,4-тетра-О-бензоїл-5-С-2-(4метоксибензил)-2H-тетразолу, 1,2,3,4-тетра-О-бензоїл-5-С-1-(4-метоксибензил)-1Н-тетразолу і 5-(4-метоксифеніл)-4-(2,2,2-трифторетил)-1,2,4-триазолу. 40 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 17
ДивитисяДодаткова інформація
Автори російськоюDlubala, Alain, Ripoche, Isabelle, Trecant, Claire
МПК / Мітки
МПК: A61P 29/00, C07H 15/24, C07H 7/00, A61P 25/04, A61K 31/70, A61K 31/485, C07H 17/00, C07H 17/04
Мітки: похідні, отримання, терапії, застосування, морфін-6-глюкуроніду
Код посилання
<a href="https://ua.patents.su/19-104302-pokhidni-morfin-6-glyukuronidu-kh-otrimannya-i-kh-zastosuvannya-v-terapi.html" target="_blank" rel="follow" title="База патентів України">Похідні морфін-6-глюкуроніду, їх отримання і їх застосування в терапії</a>
Попередній патент: Скляний шприц з голкою, яка відводиться
Наступний патент: Причіпний технологічний модуль
Випадковий патент: Система вивчення іноземної мови