Алкілпіримідинові похідні для лікування вірусних інфекцій та подальших захворювань
Номер патенту: 115558
Опубліковано: 27.11.2017
Автори: Рабуассон П'єр Жан-Марі Бернар, Йонкерс Тім Хьюго Марія, МакГован Девід Крейг
Формула / Реферат
1. Сполука формули (І)
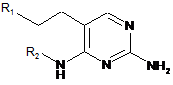
або її фармацевтично прийнятна сіль, де
R1 являє собою водень, піридиніл, тіофеніл, хінолініл або феніл, необов'язково заміщені однією або двома С1-6алкоксигрупами;
R2 являє собою С1-6алкіл;
за умови, що N-(2-аміно-5-фенетилпіримідин-4-іл)-N-пентиламін виключений.
2. Сполука за п. 1, де R1 являє собою водень, і де R2 являє собою С1-6алкіл.
3. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 1 або 2 разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями.
4. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 або 2 як лікарського засобу.
5. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 або 2 для лікування порушення, до якого залучена модуляція TLR7 та/або модуляція TLR8.
6. Застосування фармацевтичної композиції за п. 3 як лікарського засобу.
7. Застосування фармацевтичної композиції за п. 3 для лікування порушення, до якого залучена модуляція TLR7 та/або модуляція TLR8.
Текст
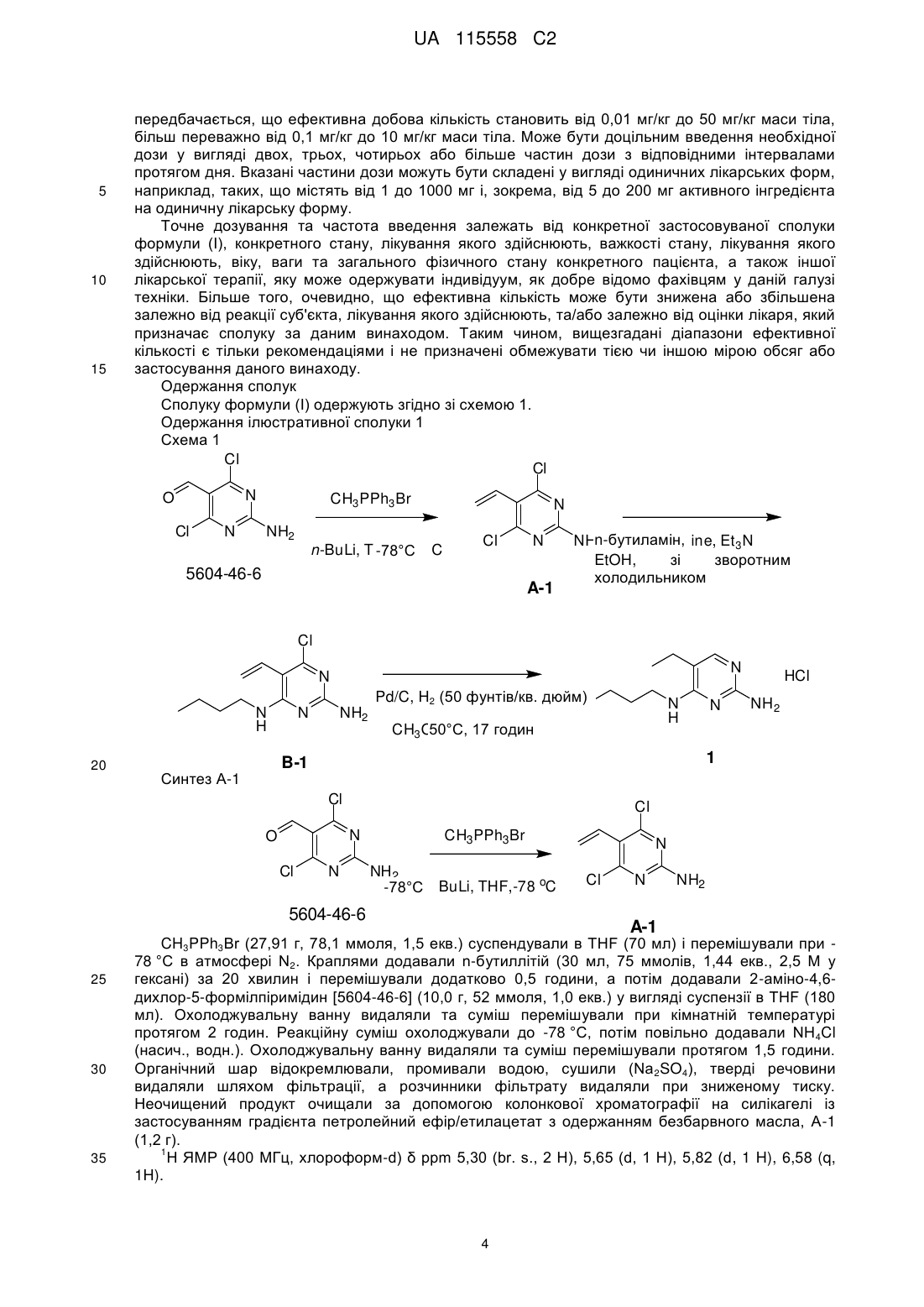
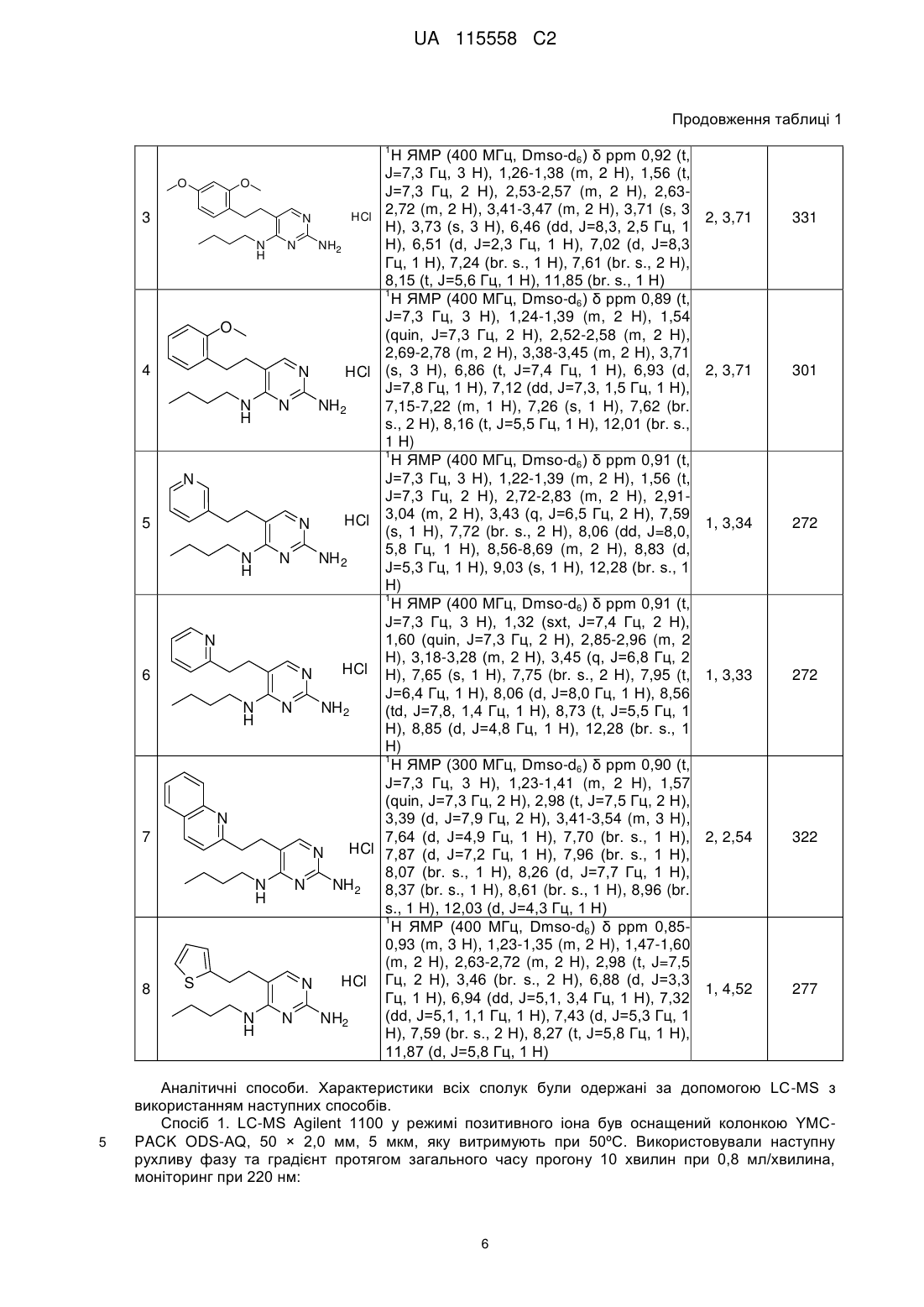
Реферат: Даний винахід стосується алкілпіримідинових похідних формули (І), способів їх одержання, фармацевтичних композицій і їхнього застосування в терапії для лікування вірусних інфекцій. R1 N R2 N H N NH2 UA 115558 C2 (12) UA 115558 C2 UA 115558 C2 5 10 15 20 25 30 35 40 45 50 55 Даний винахід відноситься до алкілпіримідинових похідних, способів їх одержання, фармацевтичних композицій та їх застосування при лікуванні та/або терапії захворювань. Даний винахід відноситься до застосування алкілпіримідинових похідних при лікуванні вірусних інфекцій, імунних або запальних порушень, до якого залучені модуляція або агонізм толл-подібних рецепторів (TLR). Толл-подібні рецептори являють собою первинні трансмембранні білки, що характеризуються позаклітинним лейцин-багатим доменом і цитоплазматичним розширенням, яке містить консервативну область. Природжена імунна система може розпізнавати патоген-асоційовані молекулярні патерни за допомогою даних TLR, що експресуються на клітинній поверхні певних типів імунних клітин. При розпізнаванні чужорідних патогенів активується утворення цитокінів та підвищення рівня регуляції костимулюючих молекул на фагоцитах. Це приводить до модуляції поведінки Т-клітин. Більшість видів ссавців мають від десяти до п'ятнадцяти типів толл-подібних рецепторів. У цілому в людей і мишей було ідентифіковано тринадцять TLR (просто названих TLR1-TLR13), а еквівалентні форми багатьох з них були виявлені в інших видів ссавців. Проте, еквіваленти певних TLR, виявлених у людини, не присутні у всіх ссавців. Наприклад, ген, що кодує білок, аналогічний TLR10 у людей, присутній у мишей, але, виявляється, у певний момент у минулому був ушкоджений ретровірусом. З іншого боку, у мишей експресуються TLR 11, 12 і 13, жоден з яких не представлений у людини. У інших ссавців можуть експресуватися TLR, які не виявлені в людини. Інші види, що не є ссавцями, можуть мати TLR, відмінні від таких у ссавців, доказом цьому служить TLR14, виявлений у риби фугу. Це може ускладнити спосіб застосування експериментальних тварин як моделей природженого імунітету людини. Для огляду толл-подібних рецепторів див. наступні журнальні статті: Hoffmann, J.A., Nature, 426, p33-38, 2003; Akira, S., Takeda, K., and Kaisho, T., Annual Rev. Immunology, 21, p335-376, 2003; Ulevitch, R. J., Nature Reviews: Immunology, 4, p512-520, 2004. Раніше були описані сполуки, що проявляють активність щодо толл-подібних рецепторів, такі як гетероциклічні похідні в WO2000006577, похідні аденіну в WO 98/01448 і WO 99/28321 та піримідини в WO 2009/067081. При лікуванні деяких вірусних інфекцій можуть застосовуватися постійні ін'єкції інтерферону (IFN-альфа), як у випадку з вірусом гепатиту C (HCV), (Fried et. al. Peginterferon-alfa plus ribavirin for chronic hepatitis C virus infection, N Engl J Med 2002; 347: 975-82). Доступні для перорального приймання низькомолекулярні індуктори IFN представляють можливі переваги - знижену імуногенність і зручність введення. Таким чином, нові індуктори IFN є потенційно ефективним новим класом лікарських засобів для лікування вірусних інфекцій. У якості літературного прикладу низькомолекулярного індуктора IFN, що має противірусний ефект, див. De Clercq, E.; Descamps, J.; De Somer, P. Science 1978, 200, 563-565. Інтерферон-α також вводять у комбінації з іншими лікарськими засобами при лікуванні деяких типів рака (Eur. J. Cancer 46, 2849–57, і Cancer Res. 1992, 52, 1056). Агоністи TLR7/8 також становлять інтерес як вакцинні ад'юванти завдяки своїй здатності індукувати чітко виражену Th1 відповідь (Hum. Vaccines 2010, 6, 322-335, і Hum. Vaccines 2009, 5, 381-394). Проте, існує гостра потреба в нових модуляторах толл-подібних рецепторів, що характеризуються переважною селективністю, а також поліпшеним профілем безпеки в порівнянні із сполуками з відомого рівня техніки. Відповідно до даного винаходу представлена сполука формули (I), R1 N R2 N N NH2 H (I), або її фармацевтично прийнятна сіль, сольват або поліморф, де R1 являє собою водень, фтор, гідроксил, амін, C1-6алкіл, C1-6алкіламіно, C1-6алкоксі, C3C4-7гетероцикл, арил, біциклічний гетероцикл, арилалкіл, гетероарил, 7циклоалкіл, гетероарилалкіл, арилоксі, гетероарилоксі, карбонову кислоту, естер карбонової кислоти, амід карбонової кислоти, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно вибраними з галогену, гідроксилу, аміно, C1-6алкілу, ди-(C1-6)алкіламіно, (C1C1-6алкіламіно, C1-6алкілу, C1-6алкоксі, C3-6циклоалкілу, карбонової 4)алкокси-(C1-4)алкілу, кислоти, естеру карбонової кислоти, аміду карбонової кислоти, гетероциклу, арилу, алкенілу, алкінілу, арилалкілу, гетероарилу, гетероарилалкілу або нітрилу, R2 являє собою C1-6алкіл, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно вибраними з галогену, гідроксилу, аміно, нітрилу, карбонової кислоти, естеру карбонової кислоти, аміду карбонової кислоти, C1-3алкілу, C1-3алкоксі або C36циклоалкілу, сульфону, сульфоксиду або нітрилу, 1 UA 115558 C2 5 10 15 20 25 30 35 40 45 50 55 60 за умови, що N-(2-аміно-5-фенетилпіримідин-4-іл)-N-пентиламін виключений. У першому варіанті здійснення даний винахід відноситься до сполук формули (I), де R 1 являє собою гетероцикл, а R2 являє собою C1-6алкіл, заміщений, наприклад, гідроксильною групою. У другому варіанті здійснення даний винахід забезпечує сполуки формули (I), де R 1 являє собою водень, і де R2 являє собою C1-6алкіл, кожний з яких необов'язково заміщений одним або декількома замісниками, незалежно вибраними з галогену, гідроксилу, аміно, нітрилу, карбонової кислоти, естеру карбонової кислоти, аміду карбонової кислоти, C 1-3алкілу, C1-3алкоксі або C3-6циклоалкілу, сульфону, сульфоксиду або нітрилу. Сполуки формули (I) та їхня фармацевтично прийнятна сіль, сольват або поліморф мають активність як фармацевтичні препарати, зокрема, як модулятори активності толл-подібного рецептора (особливо TLR7 та/або TLR8). У додатковому аспекті даний винахід забезпечує фармацевтичну композицію, яка містить сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями. Крім того, сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф відповідно до даного винаходу, або фармацевтичну композицію, яка містить вказану сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф, можна застосовувати як лікарський препарат. Іншим аспектом даного винаходу є те, що сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф або вказану фармацевтичну композицію, яка містить вказану сполуку формули (I) або її фармацевтично прийнятну сіль, сольват або поліморф, можна, відповідно, застосовувати при лікуванні будь-якого порушення, до якого залучена модуляція TLR7 та/або TLR8. Термін "алкіл" відноситься до насиченого аліфатичного вуглеводню з нерозгалуженим ланцюгом або розгалуженим ланцюгом, що містить певну кількість атомів вуглецю. Термін "галоген" відноситься до фтору, хлору, брому або йоду. Термін "алкеніл" відноситься до алкілу, визначеного вище, який включає щонайменше два атоми вуглецю та щонайменше один вуглець-вуглецевий подвійний зв'язок. Термін "алкініл" відноситься до алкілу, визначеного вище, який включає щонайменше два атоми вуглецю та щонайменше один вуглець-вуглецевий потрійний зв'язок. Термін "циклоалкіл" відноситься до карбоциклічного кільця, що містить певну кількість атомів вуглецю. Термін "алкоксі" відноситься до алкільної групи (ланцюгу з атомів вуглецю та водню), зв'язаної одинарним зв'язком з киснем, як наприклад, метоксигрупа або етоксигрупа. Термін "арил" означає ароматичну кільцеву структуру, що необов'язково включає один або два гетероатоми, вибрані з N, O та S, зокрема, з N та O. Вказана ароматична кільцева структура може містити 5, 6 або 7 кільцевих атомів. Зокрема, вказана ароматична кільцева структура може містити 5 або 6 кільцевих атомів. Термін "арилоксі" відноситься до ароматичної кільцевої структури. Вказана ароматична група окремо зв'язана з киснем, як, наприклад, фенол. Термін "гетероарилоксі" відноситься до ароматичної кільцевої структури, що необов'язково включає один або два гетероатоми, вибрані з N, O і S. Вказана ароматична група містить 5-7 кільцевих атомів, один з яких окремо зв'язаний з киснем, як наприклад, гідроксипіридин. Термін "біциклічний гетероцикл" означає ароматичну кільцеву структуру, визначену для терміна "арил", що включає два конденсовані ароматичні кільця. Кожне кільце необов'язково включає гетероатоми, вибрані з N, O та S, зокрема, з N та O. Термін "арилалкіл" означає ароматичну кільцеву структуру, визначену для терміна "арил" і необов'язково заміщену алкільною групою. Термін "гетероарилалкіл" означає ароматичну кільцеву структуру, визначену для терміна "гетероарил", необов'язково заміщену алкільною групою. "Гетероцикл" відноситься до молекул, які є насиченими або частково насиченими та включають без обмеження тетрагідрофуран, діоксан або інші циклічні ефіри. Гетероцикли, що містять азот, включають, наприклад, азетидин, морфолін, піперидин, піперазин, піролідин тощо. Інші гетероцикли включають, наприклад, тіоморфолін, морфолін і циклічні сульфони. "Гетероарильні" групи являють собою гетероциклічні групи, які за своєю природою є ароматичними. Вони бувають моноциклічними, біциклічними або поліциклічними та містять один або декілька гетероатомів, вибраних з N, O або S. Гетероарильні групи можуть являти собою, наприклад, імідазоліл, ізоксазоліл, фурил, оксазоліл, піроліл, піридоніл, піридил, 2 UA 115558 C2 5 10 15 20 25 30 35 40 45 50 55 60 піридазиніл, піразиніл, тіофен або хінолін. Фармацевтично прийнятні солі сполук формули (I) включають їхні солі приєднання кислоти та основні солі. Придатні солі приєднання кислоти утворюються з кислот, які утворюють нетоксичні солі. Придатні основні солі утворюються з основ, які утворюють нетоксичні солі. Сполуки за даним винаходом також можуть існувати у несольватованій і сольватованій формах. Термін "сольват" застосовується у даному документі для опису молекулярного комплексу, що включає сполуку за даним винаходом та одну або декілька молекул фармацевтично прийнятного розчинника, наприклад, етанолу. Термін "поліморф" відноситься до здатності сполуки за даним винаходом існувати в більш ніж одній формі або кристалічній структурі. Сполуки за даним винаходом можна вводити у вигляді кристалічних або аморфних продуктів. Вони можуть бути одержані, наприклад, у вигляді твердої пресованої маси, порошків або плівок за допомогою таких способів, як осадження, кристалізація, ліофілізація, розпилювальне сушіння або сушіння випарюванням. Їх можна вводити окремо або у комбінації з одним або декількома іншими сполуками за даним винаходом або в комбінації з одним або декількома іншими лікарськими засобами. В основному, вони будуть вводитися у вигляді складу разом з одним або декількома фармацевтично прийнятними наповнювачами. Термін "наповнювач" застосовується у даному документі для опису будь-якого інгредієнта, відмінного від сполуки (сполук) за даним винаходом. Вибір наповнювача більшою мірою залежить від таких факторів, як конкретний спосіб введення, вплив наповнювача на розчинність і стабільність та природа лікарської форми. Сполуки за даним винаходом або будь-яка їхня підгрупа для цілей введення можуть бути складені в різні фармацевтичні форми. У якості придатних композицій можуть бути згадані всі композиції, які звичайно використовуються для системного введення лікарських засобів. Для одержання фармацевтичних композицій за даним винаходом ефективну кількість конкретної сполуки, необов'язково у формі солі приєднання, у якості активного інгредієнта поєднують в однорідну суміш із фармацевтично прийнятним носієм, при цьому носій може приймати широку різноманітність форм залежно від форми препарату, необхідного для введення. Дані фармацевтичні композиції бажано перебувають в одиничній лікарській формі, що підходить, наприклад, для перорального, ректального або черезшкірного введення. Наприклад, при одержанні композицій у вигляді пероральної лікарської форми можна використовувати будь-яке загальноприйняте фармацевтичне середовище, таке як, наприклад, вода, гліколі, масла, спирти тощо, у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії та розчини; або тверді носії, такі як крохмалі, цукри, каолін, розріджувачі, змащувальні речовини, зв'язувальні речовини, розпушувачі тощо, у випадку порошків, пігулок, капсул і таблеток. Завдяки своїй простоті введення таблетки та капсули являють собою найбільш зручні пероральні форми одиниці дозування, у випадку яких, вочевидь, застосовують тверді фармацевтичні носії. Також включені препарати у твердій формі, які незадовго до застосування можуть бути перетворені на препарати в рідкій формі. У композиціях, що підходять для черезшкірного введення, носій необов'язково включає речовину, що сприяє проникненню, та/або підходящий змочувальний засіб, необов'язково в комбінації з підходящими добавками будь-якої природи в мінімальних пропорціях, при цьому добавки не здійснюють значного шкідливого впливу на шкіру. Вказані добавки можуть полегшувати введення в шкіру та/або можуть бути корисними при одержанні необхідних композицій. Дані композиції можна вводити різними шляхами, наприклад, у формі трансдермального пластиру, у формі крапкового нанесення, у формі мазі. Сполуку за даним винаходом можна також вводити шляхом інгаляції або інсуфляції за допомогою способів і складів, застосовуваних у рівні техніки для введення таким шляхом. Таким чином, в основному сполуку за даним винаходом можна вводити в легені у формі розчину, суспензії або сухого порошку. Особливо зручним є складання вищевказаних фармацевтичних композицій в одиничній лікарській формі для простоти введення та рівномірності дозування. Одинична лікарська форма, застосовувана в даному документі, відноситься до фізично окремих одиниць, що підходять як одиничні дози, при цьому кожна одиниця містить попередньо встановлену кількість активного інгредієнта, розраховану для одержання необхідного терапевтичного ефекту, у комбінації з необхідним фармацевтичним носієм. Прикладами таких одиничних лікарських форм є таблетки (включаючи таблетки, які можна ділити, або таблетки, покриті оболонкою), капсули, пігулки, пакетики з порошком, пластинки, супозиторії, ін'єкційні розчини або суспензії тощо, а також їхні окремі сукупності. Фахівці в галузі лікування інфекційних захворювань зможуть визначити ефективну кількість, виходячи з результатів тестів, представлених далі в даному документі. Загалом 3 UA 115558 C2 5 10 15 передбачається, що ефективна добова кількість становить від 0,01 мг/кг до 50 мг/кг маси тіла, більш переважно від 0,1 мг/кг до 10 мг/кг маси тіла. Може бути доцільним введення необхідної дози у вигляді двох, трьох, чотирьох або більше частин дози з відповідними інтервалами протягом дня. Вказані частини дози можуть бути складені у вигляді одиничних лікарських форм, наприклад, таких, що містять від 1 до 1000 мг і, зокрема, від 5 до 200 мг активного інгредієнта на одиничну лікарську форму. Точне дозування та частота введення залежать від конкретної застосовуваної сполуки формули (I), конкретного стану, лікування якого здійснюють, важкості стану, лікування якого здійснюють, віку, ваги та загального фізичного стану конкретного пацієнта, а також іншої лікарської терапії, яку може одержувати індивідуум, як добре відомо фахівцям у даній галузі техніки. Більше того, очевидно, що ефективна кількість може бути знижена або збільшена залежно від реакції суб'єкта, лікування якого здійснюють, та/або залежно від оцінки лікаря, який призначає сполуку за даним винаходом. Таким чином, вищезгадані діапазони ефективної кількості є тільки рекомендаціями і не призначені обмежувати тією чи іншою мірою обсяг або застосування даного винаходу. Одержання сполук Сполуку формули (I) одержують згідно зі схемою 1. Одержання ілюстративної сполуки 1 Схема 1 Cl Cl N O Cl N CH3 PPh3 Br NH2 N n-BuLi, THF,-78 oC -78°С Cl 5604-46-6 N A-1 NHn-бутиламін, n-butylamine, Et 3 N 2 EtOH, reflux зворотним EtOH, зі холодильником Cl N N N H 20 N NH2 Pd/C, H2 (50(50 Psi) Pd/C, H 2 фунтів/кв. дюйм) CH3 N CH3 PPh3 Br NH 2 -78°С n-BuLi, THF,-78 oC 5604-46-6 30 35 NH 2 Cl N O Cl N 1 B-1 Синтез A-1 Cl 25 N H 50°С, oC, 17 h OH, 50 17 годин HCl N Cl N A-1 NH2 CH3PPh3Br (27,91 г, 78,1 ммоля, 1,5 екв.) суспендували в THF (70 мл) і перемішували при 78 °C в атмосфері N2. Краплями додавали n-бутиллітій (30 мл, 75 ммолів, 1,44 екв., 2,5 M у гексані) за 20 хвилин і перемішували додатково 0,5 години, а потім додавали 2-аміно-4,6дихлор-5-формілпіримідин [5604-46-6] (10,0 г, 52 ммоля, 1,0 екв.) у вигляді суспензії в THF (180 мл). Охолоджувальну ванну видаляли та суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш охолоджували до -78 °C, потім повільно додавали NH4Cl (насич., водн.). Охолоджувальну ванну видаляли та суміш перемішували протягом 1,5 години. Органічний шар відокремлювали, промивали водою, сушили (Na 2SO4), тверді речовини видаляли шляхом фільтрації, а розчинники фільтрату видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі із застосуванням градієнта петролейний ефір/етилацетат з одержанням безбарвного масла, A-1 (1,2 г). 1 H ЯМР (400 МГц, хлороформ-d) δ ppm 5,30 (br. s., 2 H), 5,65 (d, 1 H), 5,82 (d, 1 H), 6,58 (q, 1H). 4 UA 115558 C2 Одержання B-1 Cl Cl N Cl N n-бутиламін, N NH 2 n-butylamine, Et3N EtOH, зіEtOH, reflux зворотним холодильником N H A-1 5 10 N NH2 B-1 A-1 (1,0 г, 5,26 ммоля), n-бутиламін (0,39 г, 5,26 ммоля) і Et3N (0,53 г, 5,26 ммоля, 1,0 екв.) в етанолі (10 мл) нагрівали зі зворотним холодильником протягом 12 годин. Розчинник видаляли при зниженому тиску. Неочищений продукт очищали за допомогою колонкової хроматографії на силікагелі з використанням градієнта петролейний ефір/етилацетат. Найкращі фракції поєднували та концентрували при зниженому тиску з одержанням B-1 (300 мг). LC-MS маса/заряд = 227 (M+H). 1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,95 (t, J=7,3 Гц, 3 H), 1,38 (dq, J=14,9, 7,4 Гц, 2 H), 1,55 (quin, J=7,4 Гц, 2 H), 3,38 (q, J=7,3 Гц, 2 H), 4,75 (br. s., 2 H), 5,39 (br. s., 1 H), 5,5 (m, 2H), 6,55 (m, 1H). Одержання ілюстративної сполуки 1 Cl N N H N N NH2 Pd/C, H2 (502фунтів/кв. дюйм) Pd/C, H (50 Psi) 50°С, CH3 OH, 50 oC, 17 h 17 годин N H N B-1 15 20 HCl NH 2 1 До розчину B-1 (200 мг, 0,88 ммоля, 1,0 екв.) у метанолі (5 мл) додавали 10 % Pd/C (20 мг) і змішували з газоподібним H2 (50 фунтів/кв. дюйм) при 50 °C протягом 17 годин. Неочищений продукт очищали за допомогою препаративної високоефективної рідинної хроматографії (колонка C18, елюент: CH3CN/H2O від 10/90 до 95/5, 0,05 % HCl). Бажані фракції поєднували та концентрували при зниженому тиску з одержанням 1 (74 мг). LC-MS маса/заряд = 195 (M+H). 1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,95 (t, J=7,3 Гц, 3 H), 1,20 (t, J=7,3 Гц, 3 H), 1,38 (dq, J=14,9, 7,4 Гц, 2 H), 1,62 (quin, J=7,4 Гц, 2 H), 1,93 (br. s., 1 H), 2,37 (q, J=7,3 Гц, 2 H), 3,403,63 (m, 2 H), 6,18 (br. s., 1 H), 7,24 (br. s., 1 H), 13,43 (br. s., 1 H). Таблиця 1 Сполуки формули (I). Усі сполуки були синтезовані згідно зі способом одержання ілюстративної сполуки 1 № СТРУКТУРА H ЯМР Спосіб Одержана LC, Rt маса (хвилини) (M+H) 1 N HCl 1 N H N NH2 N 2 N H N HCl NH 2 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,95 (t, J=7,3 Гц, 3 H), 1,20 (t, J=7,3 Гц, 3 H), 1,38 (dq, J=14,9, 7,4 Гц, 2 H), 1,62 (quin, J=7,4 Гц, 2 H), 1,93 (br. s., 1 H), 2,37 1, 3,86 (q, J=7,3 Гц, 2 H), 3,40-3,63 (m, 2 H), 6,18 (br. s., 2 H), 7,24 (br. s., 1 H), 13,43 (br. s., 1 H) 1 H ЯМР (400 МГц, ХЛОРОФОРМ-d) δ ppm 0,95 (t, J=7,3 Гц, 3 H), 1,20 (t, J=7,3 Гц, 3 H), 1,38 (dq, J=14,9, 7,4 Гц, 2 H), 1,62 (quin, J=7,4 Гц, 2 H), 1,93 (br. s., 1 H), 2,37 2, 3,6 (q, J=7,3 Гц, 2 H), 3,40-3,63 (m, 2 H), 6,18 (br. s., 2 H), 7,24 (br. s., 1 H), 13,43 (br. s., 1 H) 5 195 271 UA 115558 C2 Продовження таблиці 1 1 3 4 5 6 7 8 5 H ЯМР (400 МГц, Dmso-d6) δ ppm 0,92 (t, J=7,3 Гц, 3 H), 1,26-1,38 (m, 2 H), 1,56 (t, O O J=7,3 Гц, 2 H), 2,53-2,57 (m, 2 H), 2,632,72 (m, 2 H), 3,41-3,47 (m, 2 H), 3,71 (s, 3 HCl N H), 3,73 (s, 3 H), 6,46 (dd, J=8,3, 2,5 Гц, 1 N N NH2 H), 6,51 (d, J=2,3 Гц, 1 H), 7,02 (d, J=8,3 H Гц, 1 H), 7,24 (br. s., 1 H), 7,61 (br. s., 2 H), 8,15 (t, J=5,6 Гц, 1 H), 11,85 (br. s., 1 H) 1 H ЯМР (400 МГц, Dmso-d6) δ ppm 0,89 (t, J=7,3 Гц, 3 H), 1,24-1,39 (m, 2 H), 1,54 O (quin, J=7,3 Гц, 2 H), 2,52-2,58 (m, 2 H), 2,69-2,78 (m, 2 H), 3,38-3,45 (m, 2 H), 3,71 N HCl (s, 3 H), 6,86 (t, J=7,4 Гц, 1 H), 6,93 (d, J=7,8 Гц, 1 H), 7,12 (dd, J=7,3, 1,5 Гц, 1 H), N N NH 2 7,15-7,22 (m, 1 H), 7,26 (s, 1 H), 7,62 (br. H s., 2 H), 8,16 (t, J=5,5 Гц, 1 H), 12,01 (br. s., 1 H) 1 H ЯМР (400 МГц, Dmso-d6) δ ppm 0,91 (t, J=7,3 Гц, 3 H), 1,22-1,39 (m, 2 H), 1,56 (t, N J=7,3 Гц, 2 H), 2,72-2,83 (m, 2 H), 2,91HCl 3,04 (m, 2 H), 3,43 (q, J=6,5 Гц, 2 H), 7,59 N (s, 1 H), 7,72 (br. s., 2 H), 8,06 (dd, J=8,0, 5,8 Гц, 1 H), 8,56-8,69 (m, 2 H), 8,83 (d, N N NH 2 J=5,3 Гц, 1 H), 9,03 (s, 1 H), 12,28 (br. s., 1 H H) 1 H ЯМР (400 МГц, Dmso-d6) δ ppm 0,91 (t, J=7,3 Гц, 3 H), 1,32 (sxt, J=7,4 Гц, 2 H), 1,60 (quin, J=7,3 Гц, 2 H), 2,85-2,96 (m, 2 N H), 3,18-3,28 (m, 2 H), 3,45 (q, J=6,8 Гц, 2 HCl H), 7,65 (s, 1 H), 7,75 (br. s., 2 H), 7,95 (t, N J=6,4 Гц, 1 H), 8,06 (d, J=8,0 Гц, 1 H), 8,56 N N NH 2 (td, J=7,8, 1,4 Гц, 1 H), 8,73 (t, J=5,5 Гц, 1 H H), 8,85 (d, J=4,8 Гц, 1 H), 12,28 (br. s., 1 H) 1 H ЯМР (300 МГц, Dmso-d6) δ ppm 0,90 (t, J=7,3 Гц, 3 H), 1,23-1,41 (m, 2 H), 1,57 (quin, J=7,3 Гц, 2 H), 2,98 (t, J=7,5 Гц, 2 H), 3,39 (d, J=7,9 Гц, 2 H), 3,41-3,54 (m, 3 H), N 7,64 (d, J=4,9 Гц, 1 H), 7,70 (br. s., 1 H), HCl 7,87 (d, J=7,2 Гц, 1 H), 7,96 (br. s., 1 H), N 8,07 (br. s., 1 H), 8,26 (d, J=7,7 Гц, 1 H), N N NH 2 8,37 (br. s., 1 H), 8,61 (br. s., 1 H), 8,96 (br. H s., 1 H), 12,03 (d, J=4,3 Гц, 1 H) 1 H ЯМР (400 МГц, Dmso-d6) δ ppm 0,850,93 (m, 3 H), 1,23-1,35 (m, 2 H), 1,47-1,60 (m, 2 H), 2,63-2,72 (m, 2 H), 2,98 (t, J=7,5 HCl Гц, 2 H), 3,46 (br. s., 2 H), 6,88 (d, J=3,3 S N Гц, 1 H), 6,94 (dd, J=5,1, 3,4 Гц, 1 H), 7,32 (dd, J=5,1, 1,1 Гц, 1 H), 7,43 (d, J=5,3 Гц, 1 N N NH2 H H), 7,59 (br. s., 2 H), 8,27 (t, J=5,8 Гц, 1 H), 11,87 (d, J=5,8 Гц, 1 H) 2, 3,71 331 2, 3,71 301 1, 3,34 272 1, 3,33 272 2, 2,54 322 1, 4,52 277 Аналітичні способи. Характеристики всіх сполук були одержані за допомогою LC-MS з використанням наступних способів. Спосіб 1. LC-MS Agilent 1100 у режимі позитивного іона був оснащений колонкою YMCPACK ODS-AQ, 50 × 2,0 мм, 5 мкм, яку витримують при 50ºC. Використовували наступну рухливу фазу та градієнт протягом загального часу прогону 10 хвилин при 0,8 мл/хвилина, моніторинг при 220 нм: 6 UA 115558 C2 Рухома фаза Градієнт 5 15 20 25 30 35 %A 100 100 40 40 100 %B 0 0 60 60 0 Спосіб 2. LC-MS Agilent 1100 у режимі позитивного іона був оснащений колонкою YMC-PACK ODS-AQ, 50 × 2,0 мм, 5 мкм, яку витримують при 50ºC. Використовували наступну рухливу фазу та градієнт протягом загального часу прогону 10 хвилин при 0,8 мл/хвилина, моніторинг при 220 нм: Рухома фаза 10 A: H2O(0,1 % TFA) B: CH3CN(0,05 % TFA) Час (хв.) 0 1 5 7,5 8 A: H2O(0,1 % TFA) B: CH3CN(0,05 % TFA) Час (хв.) 0 0,8 4,5 7,5 8 %A 90 90 20 20 90 %B 10 10 80 80 10 Біологічна активність сполук формули (I) Опис біологічних аналізів Оцінка активності TLR7 і TLR8 Здатність сполук активувати TLR7 (hTLR7) та/або TLR8 (hTLR8) людини оцінювали в клітинному аналізі репортерного гена з використанням клітин HEK293, тимчасово трансфікованих вектором експресії TLR7 або TLR8 і репортерною конструкцією NFκB-luc. В одному прикладі з конструкції експресії TLR експресується відповідна послідовність дикого типу або мутантна послідовність, що містить делецію в другому лейцин-багатому повторі TLR. Як вказувалося раніше, такі мутантні білки TLR більшою мірою піддаються активації агоністом (документ US 7498409). Коротко, клітини HEK293 вирощували у культуральному середовищі (DMEM, доповненому 10 % FCS та 2 мМ глутаміну). Для трансфекції клітин в 10-см чашках клітини відшаровували трипсином-EDTA, трансфікували сумішшю CMV-TLR7 або плазміди TLR8 (750 нг), плазміди NFκB-luc (375 нг) і трансфекційного реагенту та інкубували протягом ночі при 37 °C у зволоженій атмосфері 5 % CO2. Далі трансфіковані клітини відшаровували трипсином-EDTA, промивали в 5 PBS і ресуспендували в середовищі до щільності 1,67 × 10 клітин/мл. Тридцять мікролітрів клітин потім розподіляли в кожну лунку в 384-лункових планшетах, де вже містилося 10 мкл сполуки в 4 % DMSO. Після 48 годин інкубації при 37 °C, 5 % CO2, визначали люциферазну активність шляхом додавання 15 мкл субстрату Steady Lite Plus (Perkin Elmer) у кожну лунку та зчитували показання, одержані на пристрої для зчитування мікропланшетів ViewLux ultraHTS (Perkin Elmer). Криві залежності доза-ефект були побудовані, виходячи з вимірів, виконаних у чотирьох повторах. Для кожної сполуки визначали значення найбільш низьких ефективних концентрацій (LEC), що визначаються як концентрація, яка викликає ефект, який щонайменше у два рази перевищує припустиме відхилення аналізу. Паралельно використовували подібні серії розведень сполуки (10 мкл сполуки в 4 % DMSO) 5 з 30 мкл клітин на лунку, трансфікованих тільки репортерною конструкцією NFκB-luc (1,67 × 10 клітин/мл). Через шість годин після інкубації при 37 °C, 5 % CO2, визначали люциферазну активність шляхом додавання 15 мкл субстрату Steady Lite Plus (Perkin Elmer) у кожну лунку та зчитували показання, одержані на пристрої для зчитування мікропланшетів ViewLux ultraHTS (Perkin Elmer). Дані зворотного скринінгу реєстрували як LEC. Усі сполуки продемонстрували CC50 > 24 мкМ в TOX-аналізі на HEK293, описаному вище. 40 7 UA 115558 C2 № СТРУКТУРА hTLR7 wt (LEC) hTLR8 wt (LEC) 2,4 1,3 6,7 6,5 2,4 12 5 13 1,2 1,4 0,6 1,6 0,5 1,2 8,1 3,6 N 1 N H N NH2 N 2 N H O N NH2 O 3 N N H N NH 2 O 4 N N H N NH 2 N 5 N N H N NH 2 N N 6 N H N NH 2 N 7 N N H N S 8 NH 2 N N H N NH 2 ФОРМУЛА ВИНАХОДУ 5 1. Сполука формули (І) R1 N R2 10 N H N NH2 або її фармацевтично прийнятна сіль, де R1 являє собою водень, піридиніл, тіофеніл, хінолініл або феніл, необов'язково заміщені однією або двома С1-6алкоксигрупами; R2 являє собою С1-6алкіл; за умови, що N-(2-аміно-5-фенетилпіримідин-4-іл)-N-пентиламін виключений. 2. Сполука за п. 1, де R1 являє собою водень, і де R2 являє собою С1-6алкіл. 8 UA 115558 C2 5 10 3. Фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль за п. 1 або 2 разом з одним або декількома фармацевтично прийнятними наповнювачами, розріджувачами або носіями. 4. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 або 2 як лікарського засобу. 5. Застосування сполуки формули (І) або її фармацевтично прийнятної солі за п. 1 або 2 для лікування порушення, до якого залучена модуляція TLR7 та/або модуляція TLR8. 6. Застосування фармацевтичної композиції за п. 3 як лікарського засобу. 7. Застосування фармацевтичної композиції за п. 3 для лікування порушення, до якого залучена модуляція TLR7 та/або модуляція TLR8. Комп’ютерна верстка Г. Паяльніков Міністерство економічного розвитку і торгівлі України, вул. М. Грушевського, 12/2, м. Київ, 01008, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 9
ДивитисяДодаткова інформація
Назва патенту англійськоюAlkylpyrimidine derivatives for the treatment of viral infections and further diseases
Автори англійськоюMc Gowan, David, Craig, Jonckers, Tim, Hugo, Maria, Raboisson, Pierre, Jean-Marie, Bernard
Автори російськоюМакГован Дэвид Крейг, Йонкерс Тим Хьюго Мария, Рабуассон Пьер Жан-Мари Бернар
МПК / Мітки
МПК: C07D 239/48, A61K 31/506, C07D 409/06, A61K 31/505, C07D 401/06
Мітки: вірусних, подальших, захворювань, похідні, лікування, інфекцій, алкілпіримідинові
Код посилання
<a href="https://ua.patents.su/11-115558-alkilpirimidinovi-pokhidni-dlya-likuvannya-virusnikh-infekcijj-ta-podalshikh-zakhvoryuvan.html" target="_blank" rel="follow" title="База патентів України">Алкілпіримідинові похідні для лікування вірусних інфекцій та подальших захворювань</a>